Cancer et grossesse : stratégie de thromboprophylaxie et prise en
charge anesthésique pour l’accouchement
T H È S E
Présentée et publiquement soutenue devant LA FACULTÉ DE MÉDECINE DE MARSEILLE
Le 15 Mars 2018
Par Madame Marie COURTY Née le : 25/09/1987 à Avignon (84)
Pour obtenir le grade de Docteur en Médecine D.E.S d’ANESTHÉSIE-RÉANIMATION
Membres du Jury de la Thèse :
Monsieur le Professeur Marc LEONE Président
Monsieur le Professeur Jacques ALBANESE Assesseur
Monsieur le Professeur Xavier CARCOPINO Assesseur
Monsieur le Professeur Pierre MORANGE Assesseur
Remerciements
Aux membres du jury,
Monsieur le Professeur Marc Leone, vous me faites l’honneur de présider ce jury. Un grand merci pour votre disponibilité et votre aide dans l’organisation de cette soutenance. C’est une fierté d’intégrer le service très prochainement et soyez certain que je rejoins l’équipe avec ambition et bonne humeur.
Monsieur le Professeur Jacques Albanèse, je vous remercie d’être présent à cette soutenance et de juger mon travail. Je garde une belle et douce nostalgie de mon passage dans votre service auprès de vos alliés, Valéry, Cyril, Karim, Laurent, Romain, Elisa… J’ai adoré apprendre mon métier avec vous et même si pour divers raisons je poursuis mon chemin plus au Nord, je garde un souvenir ému de la RPPF. Monsieur le Professeur Xavier Carcopino, je vous remercie d’avoir accepté de porter votre jugement d’expert sur ce travail. Je crois beaucoup en la collaboration interdisciplinaire et je reste persuadée qu’elle reste la clé d’une prise en charge optimale des patients.
Monsieur le Professeur Pierre Morange, je vous remercie d’être présent ce soir pour juger ce travail. Votre présence illustre l’indispensable coopération entre professionnel de santé lors de situations complexes comme celles présentées dans ce travail.
Au Docteur Marie-Pierre Bonnet, ma directrice de thèse,
Merci pour tes conseils si précieux dans l’élaboration de ce travail. Merci d’avoir accepter d’encadrer ce projet de thèse et d’avoir été présente à chaque étape même à distance. Tu as tout mon respect et ma reconnaissance. En espérant poursuivre nos échanges à l’avenir et élaborer de nouveaux projets multicentriques…
Voilà, les révérences académiques sont terminées.
La tradition le veut ainsi, il est coutume à présent de remercier les personnes qui me sont chères, qui me soutiennent, qui m’encourage dans tous mes projets...Toutes ces personnes qui font de ma vie, une si belle vie.
Alors sans pudeur, je remercie… Les essentiels, ma famille.
Je n’ai manqué de rien grâce à vous et surtout pas d’amour.
A toi papounet, tu es un papa formidable toujours présent pour tes filles. N’oublie pas que je t’aime fort même si je ne te le dis pas assez souvent.
A toi mamounette et à cette énergie folle que tu déploies pour ne jamais subir ta vie. Je m’en inspire.
A toi ma petite mamie adorée, tu t’es faite belle et élégante comme toujours et peut être encore d’avantage ce soir car tu sais que papi nous regarde de là haut. Merci d’être toujours là pour nous.
A ma juju, ma petite sœur, ton parcours m’a tellement fait rêver pendant toutes ces années où j’étais bien sagement sur les rails. Saches que je serais toujours là pour toi, même si je sais que tu es déçue qu’après tant d’années d’études je nte suggère que du Doliprane quand tu n’es pas bien…
A Antoine, futur beau-frère puisque le meilleur des remèdes c’est encore l’amour…Je pense qu’avec toi elle ne sera plus jamais malade !!
Aux comédiens, chanteurs, musiciens, scénaristes, à ceux qui sauvent des enfants et ceux qui sauvent la planète, à tous mes cousins, cousines, oncles et tantes passionnés et talentueux… Ouais on fait bien partie de la même famille ; )
A mes beaux parents, Jean-Marc et Nathalie, merci de m’avoir accueilli si chaleureusement dans votre famille. C’est toujours une joie de passer du temps avec vous dans la maison du bonheur !
A lolotte et notre douce complicité.
Les indipensables, mes amis. « Les canulars
Les pétards Les folies Les orgies Les jours du bac Le cognac Les refrains Tout ce qui fait Je le sais
Que je n’oublierai jamais
Mes amis, mes amours, mes emmerdes »
C. Aznavour
Florence, Manu et Anna-Clara. Depuis le lycée Périer, on a fait du chemin mais sans jamais s’oublier…Vous êtes comme ma famille et de voir la votre s’agrandir je suis hyper heureuse !! Je nous souhaite encore plein de beaux évènements à vivre ensemble mes chéries.
Alice, Fanny et Aurélia, mes 3 fantastiques. A nos soirées du mercredi, nos confidences, les potins…C’est apaisant, on se comprend sans se parler, les mêmes choses nous saoulent et je ne compte plus nos fous rires. On se tire vers le haut toujours. On s’encourage, on se soutient (merci pour cette hotline 4F sur whatsApp !!).
Sophie et Julien, merci pour m’avoir honorer de ce rôle de marraine. J’adore ma filleule et j’adore nos réunions de famille arrosées qui finissent on ne sait jamais trop quand ni comment…
Vanina, à l’origine du scandale « comment l’AP-HP finance le groupe LVMH ». J’espère que tu sais que tu peux compter sur moi tout le temps (même si je sais toujours pas « déliker » une photo facebook).
Cecilia, à nos soirées inoubliables à Shanghai, ferme les yeux et souviens toi bordel! Et dire qu’un jour on aura peut être plus le rythme dans la peau!
C’est dommage y’a que ton mec que je peux pas trop blairer…
Caroline A., à nos belles années « Hartley cœur à vif », à Annie, à chipie (RIP), au forfait local (RIP), au 3310 (indétrônable au snake, respect), au TN caméléon de Godrie, au Cadillac, à Ryan Phillippe, à tes portes de placards et à Mr Naon…
Céline, muevelo muevelo muevelo…voilà ça résume bien ma P2-D1 avec toi !! De nos belles années au Hush Hush, en passant par les soirées fluo, les soirées berbères dans ton jardin, le bar de la marine…c’est quand même un comble que tu digères plus l’alcool!
A Caroline B., ma g’nevoise !! Tellement élégante, rafinée, classe qu’on a du mal à imaginer que t’as les mains dans le caca toute la journée…Dernière ligne droite pour toi ! Je pense fort à toi !!
Pierre, avoue tu mattes encore les annonces sur le bon coin ?! En attendant le prochain coup, on compte bien profiter de la piscine cet été…une belle maison pour une belle famille !
Dodo, ouais je sais t’aimes pas que je t’appelle comme ça. Avec toi aussi je me suis bien marrée, sur les bancs de la fac, au Maroc encore plus et à chaque fois que je te vois en fait !! Tellement agréable de rire comme ça, et puis rire c’est gratuit ; )
A tous les marseillais, notre petit monde, Alan et Marilou, Steph et Eric, les Mondolacce, Antoine le parrain, Ben (merci pour tes précieux conseils), François… Chloé, Pierre et Céc. A nos sous-colles, au ccm…boulversants souvenirs.
A la team biterroise, Fanchon, Henri, Marine, PAD, Nico, Justine, Florine, VV, Léa, Francois, Lucie, David, Pauline, Roland, Julie, Tonio, Charlot des îles, Justin, Ines, Jivus, Clément, Fanny, Tom, Marie, Tara, la houle, Sarah, Pierre, Arnaud, Camille, Yoni, Thibaut…
Les belles rencontres. Mes co-internes,
Mon laulau, mon fraté, quand on fait le point, il y a eu pas mal de disputes en 5 ans!!! C’est même étonnant qu’on se parle encore…Et pourtant on s’aime toujours…Enfin jcrois ; )
Michou, avoue c’est moi ta préférée! Jean-Loup, rentable ce stage en réa ped ou bien ?! Victor ton air circonspect me manque, David T., président !! Laura K., ASA combien??!! Lucas qui t’endors aux gaz, et je parle pas du sevo, Sam, tu viens plus aux soirées?! Michael P. faut qu’on test ALR corps entier vs AG, bouillant ? David F. y a vraiment pas un moyen de racheter en viager les baraques des patients ASA 4 ? Jérémy, Romain R, Dan, Aurélien, Pierre S., Mathieu, Orni, Julie, Delphine, Annabelle, Momo, Sarah, Axel, Kéké, JB, Medhi, Alex, Mathieu, Tim, Thibaut, Bruno, Salma, …
Les patrons et leurs disciples,
A Nicolas Bruder, Lionel Velly, Sophie Cataldi, JC Dumont, Camille, Salah, Thibaut (t’es peut être plus vraiment dans la bonne catégorie mais c’est là que je t’ai rencontré !! Et avant d’être un copain t’as été un bon prof et tu m’as beaucoup apporté. J’ai beaucoup de respect et de reconnaissance envers toi !! Merci). Vous m’avez accompagné lors de mes premiers pas. Merci pour vos enseignements. Mention spéciale à Michèle Loubat pour sa douceur, son énergie, son élégance, sa gentillesse…un modèle !!
A Catherine Guidon, Gabrielle, Nicolas, David, Benoit, Romain, Raphaelle, Françoise, Judith, Maurice, Salem, Adrien, Florent, Cyndji, Anissa… Quel bonheur de travailler avec vous l’été dernier. Vous êtes gentils, drôles, intelligents…Un microcosme de gens biens. Merci pour tout.
A toutes les infirmières de réa, de blocs, les iades, les aides soignants, les ash… c’est avec vous que je me suis construit et que j’ai appris mon métier! Merci pour votre patience surtout, votre confiance, vos compétences. A Karen, Popoff, Sophie, Audrey, Claire, Véro, Elodie, Julien, Santosh, Lynda, Marlene, Mélanie, Djamila, Brigitte, Elodie, Malik, Nathalie, Anne Claire…
La team du Nord.
Malik, plus qu’un collègue t’es devenu un pote depuis ce « doux » week-end de garde de décembre 2015 avec Catherine…Ah l’esprit de Noël! Tu as largement participé à mon envie de venir travailler à Nord, du coup c’est cool que tu partes juste quand j’arrive !!!!
Laurent Z, merci pour ta bonne humeur et ta bienveillance. Tu as un vrai bon fond et ta gentillesse me touche. Et depuis que je connais ta femme, je la trouve presque aussi cool que toi…
Julie, on va le trouver ce meuble TV, promis!!
A Lauren, Béa, Agnès, Carole, Zoé, Calypso, Jeanne, Aude, Raph, Emma, Caro, Sophie, Emmanuelle, Coralie, Sarah, Marion…Et aux quelques males survivants parmi les Femen, Gary, Alex, Vincent qui rend les armes (sniff), Thierry, François… Je nous souhaite une belle et paisible collaboration car chers collègues, en effet c’est quelque peu troublant mais dans peu de temps je ne serais plus votre interne mais votre collègue de travail (oui Marion je sais ça va pas être simple de devoir me respecter du jour au lendemain! ; ))
Pour finir, venons en à l’Essentiel, l’Indispensable, La belle rencontre, mon binôme…qui donne un sens à tout le reste. A toi Illan, mon amour. Tu es une merveilleuse personne, gentil, généreux, passionné, curieux, drôle…J’admire et m’inspire de ta joie de vivre et ton optimisme. Tu me rends meilleure.
Merci.
A nous deux et à tous nos projets. Passionnément, amoureusement. Docteur COURTY M.
Table des matières
Abréviations ... 2
I. Introduction ... 3
I. 1. Prévention de la pathologie thromboembolique ... 3
I. 1. a. Grossesse et risque thromboembolique ... 3
I. 1. b. Cancer et risque thromboembolique ... 6
I. 2. Anesthésie de la femme enceinte atteinte d’une néoplasie ... 8
II. Matériel et méthodes ... 10
II. 1. Design de l’étude, population source et population d’étude ... 10
II. 2. Variables explorées ... 11
II. 2. a. Caractéristiques maternelles, de la grossesse et de l’accouchement ... 11
II. 2. b. Caractéristiques de la prise en charge anesthésique ... 12
II. 2. c. Caractéristiques relatives à la prévention thromboembolique ... 12
II. 3. Analyses statistiques ... 13
II. 4. Considération éthique ... 13
III. Résultats ... 14
III. 1. Incidence des pathologies néoplasiques parmi les femmes enceintes et issues de grossesse (Figure 1) ... 14
III. 2. Caractéristiques maternelles, de la grossesse et issue néonatale ... 15
III. 3. Caractéristiques oncologiques (Tableau 3) ... 17
III. 4. Prise en charge anesthésique ... 19
III. 5. Evaluation du risque, thromboprophylaxie et complications thromboemboliques ... 21 V. Discussion ... 24 VI. Conclusion ... 29 Annexe ... 30 Références bibliographiques ... 32
Abréviations
ACCP = American College of Chest Physicians
ACOG = American Congress of Obstetricians and Gynecologists APM = Anesthésie péri-médullaire
AVB = Accouchement voie basse
CNGOF = Collège National des Gynécologues et Obstétriciens Français ENCMM : Enquête Nationale Confidentielle sur les Morts Maternelles EP = Embolie pulmonaire
FT = Facteur tissulaire
HAS = Haute Autorité de Santé
HBPM = Héparine de bas poids moléculaire IMG= Interruption médicale de grossesse
ITAC-CME = International Initiative on Thrombosis and Cancer-Continous Medical
Education
MTEV = Maladie thromboembolique veineuse
RCOG = Royal College of Obstetricians and Gynaecologists SA= Semaine d’aménorrhée
SFAR = Société Française d’Anesthésie Réanimation
SOGC = Société des Obstétriciens et Gynécologues du Canada TVP = Thrombose veineuse profonde
I. Introduction
Dans des pays à niveau de ressources élevées, une femme enceinte sur 1000 est atteinte d’une pathologie néoplasique (1–5). Le cancer du sein est le cancer le plus courant chez les femmes enceintes et dans le post-partum, et survient chez environ 1 femme enceinte sur 3000 (6). La prise en charge du cancer, de la grossesse et de l’accouchement de ces femmes est modifiée par le contexte et nécessite une collaboration multidisciplinaire efficace face à cette situation complexe. Au delà des atteintes d’organes spécifiques à chaque type de cancer, deux problématiques principales se posent aux médecins anesthésiste-réanimateurs en charge de ces femmes:
1) la gestion du risque thromboembolique pendant la grossesse et dans le post-partum,
2) la prise en charge anesthésique et analgésique de l’accouchement en cas de risques ou présence de métastases vertébrales.
En effet, du fait de la rareté de la situation, peu de données sont disponibles dans la littérature, et aucune recommandation n’existe actuellement concernant ces deux aspects de la prise en charge de ces femmes.
I. 1. Prévention de la pathologie thromboembolique I. 1. a. Grossesse et risque thromboembolique
La maladie thromboembolique veineuse (MTEV) regroupe la thrombose veineuse profonde (TVP) et sa complication immédiate, l’embolie pulmonaire (EP).
L’incidence de la MTEV en France est estimée entre 1 et 2 pour 1000 habitants (7,8).
La MTEV constitue une cause majeure de morbi-mortalité maternelle dans le monde et en particulier dans les pays à niveau de ressources élevé. Au Royaume-Uni, la première cause directe de décès maternel est la pathologie thromboembolique, avec un ratio de mortalité maternel de 1,1/100 000 naissances vivantes (9). En France, dans le dernier rapport de l’ Enquête Nationale Confidentielle sur la Mortalité Maternelle (ENCMM) regroupant les décès maternels survenus entre 2010 et 2012 (10), la MTEV se situe au 2ème rang des causes de mortalité maternelle avec
un ratio de 1,1/100 000 naissances vivantes (10,2% de l’ensemble des décès
maternels en France).
Concernant la morbidité maternelle, la fréquence de la MTEV en obstétrique est difficile à évaluer, de nombreux cas de femmes présentant cette pathologie n’étant pas recensés. Ainsi, nous ne disposons pas de données fiables et récentes concernant l’incidence de la MTEV pendant la grossesse et dans le post-partum en France. Plusieurs travaux aux Royaume-Uni et aux Etats-Unis rapportent une incidence moyenne de 2 cas pour 1000 grossesses (11–14).
Les femmes ont un risque accru d’accidents thromboemboliques pendant leur grossesse et dans la période du post-partum de 4 à 5 fois supérieur par rapport à une population appariée non enceinte (14). En effet, plusieurs éléments de la classique triade de Virchow sont présents pendant la grossesse et après l’accouchement et participent à l’augmentation du risque thromboembolique veineux
dans ce contexte (15) :
- Tout d’abord dès le premier trimestre, une stase veineuse est observée. Elle est due initialement à une vasodilatation veineuse induite par la progestérone. Des 20 SA, la compression de la veine cave inférieure par l'utérus gravide s’ajoute ainsi qu’une compression pulsatile de la veine iliaque gauche par l'artère iliaque droite. La baisse de l’activité physique induite par la grossesse favorise également cette stase veineuse.
- tout au long de la grossesse, le système hémostatique est progressivement activé pour préparer la parturiente au risque hémorragique lié à l'accouchement. L'activité intrinsèque des molécules anticoagulantes endogènes est réduite (diminution du taux de protéine S de près de 50%, résistance de la protéine C activée augmenté). L'activité procoagulante augmente également suite à une élévation des concentrations des facteurs de coagulation circulants (fibrinogène, prothrombine, facteurs V, VII, VIII, IX, X). La dissolution du thrombus est réduite par une diminution de la fibrinolyse, résultant de l'activité accrue des inhibiteurs de l'activateur du plasminogène (PAI-1, Plasminogen activator inhibitor 1). Cet état d’hypercoagulabilité physiologique pendant la grossesse diminue progressivement après l’accouchement, jusqu’à la normalisation des sécrétions hormonales à 6 semaines voire même au delà. Ce phénomène explique pourquoi la période de surisque thrombotique se poursuit dans les semaines qui suivent l’accouchement.
- la fonction endothéliale est altérée par les traumatismes liés à l’accouchement, aux manœuvres obstétricales (césarienne, manœuvres instrumentales, épisiotomies, déchirures périnéales) mais également en cas de prééclampsie.
A ces modifications s’ajoutent fréquemment des facteurs de risques contextuels (césarienne en urgence, hémorragie du post partum, multiparité…) ou liés au terrain (obésité, âge maternel, thrombophilie) qui seuls ou en association peuvent majorer le risque thromboembolique.
Une thromboprophylaxie médicamenteuse en cours de grossesse et dans le postpartum est donc parfois nécessaire, en fonction de la stratification du risque thromboembolique de la patiente.
Concernant les stratégies de prévention thromboembolique pour la femme enceinte, de nombreuses sociétés savantes internationales et françaises ont élaboré des lignes directrices depuis le début des années 2000: l’American College of Chest
Physicians (ACCP) (16), l’American Congress of Obstetricians and Gynecologists
(ACOG) (17), la Société des Obstétriciens et Gynécologues du Canada (SOGC) (18), le Royal College of Obstetricians and Gynaecologists (RCOG) (19), la Haute Autorité de Santé (HAS) (20), la Société Française d’Anesthésie Réanimation (SFAR) (21), le Collège National des Gynécologues et Obstétriciens Français (CNGOF) (22). Elles fournissent des algorithmes permettant d’identifier les patientes enceintes à haut risque qui doivent bénéficier d’une anticoagulation préventive. Ces recommandations diffèrent entre elles (23), mais s’accordent cependant sur l’importance de réaliser une évaluation des facteurs de risque thromboemboliques chez la femme dès le début de sa grossesse et ce de manière répétée à chaque hospitalisation ou évènement nouveau.
En France, les médecins anesthésiste-réanimateurs s’appuient notamment sur les recommandations de la SFAR publiées en 2005 pour identifier les femmes enceintes à risque thromboembolique élevé et qui nécessitent une anticoagulation préventive. (Annexe 1)
I. 1. b. Cancer et risque thromboembolique
Les pathologies néoplasiques majorent également le risque de développer une MTEV et constitue la seconde cause de mortalité chez les patients atteints de néoplasie (24).
L’incidence rapportée dans la littérature de la MTEV chez le patient cancéreux est considérablement variable en fonction de la population étudiée, du site de la tumeur, de la durée de suivie, de la période à laquelle a été menée l’étude et des techniques pour diagnostiquer les accidents thromboemboliques veineux. Les risques les plus élevés ont été décrits pour une population de patients nécessitant une hospitalisation et traité par chimiothérapie (6% à 8%). (25)
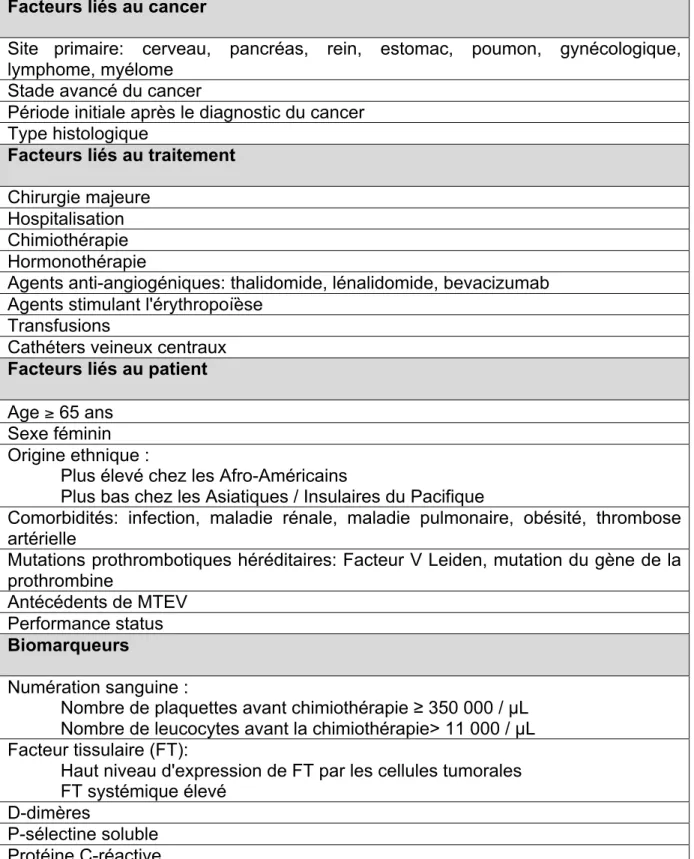
La littérature s’accorde généralement sur la plupart des facteurs de risque de MTEV associée au cancer. Une liste complète est présentée dans le tableau 1. (25)
Tableau 1. Facteurs de risque cliniques et biomarqueurs associés à la MTEV chez le patient atteint d’un cancer mis en évidence dans l’ensemble de la littérature (25) Facteurs liés au cancer
Site primaire: cerveau, pancréas, rein, estomac, poumon, gynécologique, lymphome, myélome
Stade avancé du cancer
Période initiale après le diagnostic du cancer Type histologique
Facteurs liés au traitement Chirurgie majeure
Hospitalisation Chimiothérapie Hormonothérapie
Agents anti-angiogéniques: thalidomide, lénalidomide, bevacizumab Agents stimulant l'érythropoïèse
Transfusions
Cathéters veineux centraux Facteurs liés au patient Age ≥ 65 ans
Sexe féminin Origine ethnique :
Plus élevé chez les Afro-Américains
Plus bas chez les Asiatiques / Insulaires du Pacifique
Comorbidités: infection, maladie rénale, maladie pulmonaire, obésité, thrombose artérielle
Mutations prothrombotiques héréditaires: Facteur V Leiden, mutation du gène de la prothrombine
Antécédents de MTEV Performance status Biomarqueurs
Numération sanguine :
Nombre de plaquettes avant chimiothérapie ≥ 350 000 / µL Nombre de leucocytes avant la chimiothérapie> 11 000 / µL Facteur tissulaire (FT):
Haut niveau d'expression de FT par les cellules tumorales FT systémique élevé
D-dimères
P-sélectine soluble Protéine C-réactive
Il existe de nombreuses recommandations internationales et nationales pour guider la prévention du risque thromboembolique chez les patients cancéreux.
Les plus récentes sont issues de l’International Initiative on Thrombosis and
Cancer-Continous Medical Education (ITAC-CME) qui ont élaboré de nouvelles
recommandations internationales concernant les bonnes pratiques cliniques pour le traitement prophylactique et curatif de la maladie thromboembolique veineuse en hospitalisation et en ambulatoire (26) . Par ailleurs ces recommandations distinguent le contexte de néoplasies traitées chirurgicalement, celles traitées médicalement et la prévention de thrombose sur cathéter central dans ce contexte. (Annexe 2)
Ainsi, une femme enceinte porteuse d’un cancer présente un double risque thromboembolique. Or parmi les nombreuses recommandations de bonnes pratiques concernant la thromboprophylaxie chez la femme enceinte seul le RCOG (19) considère la présence d’un cancer évolutif pendant la grossesse dans la stratification du risque thromboembolique.
I. 2. Anesthésie de la femme enceinte atteinte d’une néoplasie
La prise en charge anesthésique de la femme enceinte atteinte d’un cancer présente également des particularités.
Une anesthésie peut être nécessaire dans deux contextes différents au cours de sa grossesse : pour une prise en charge chirurgicale de la tumeur au cours de la grossesse, et pour son accouchement.
Pour l’accouchement, l’anesthésiste-réanimateur doit principalement évaluer l’indication d’une anesthésie péri-médullaire (APM), classiquement réalisée en obstétrique. Dans ce contexte il doit prendre en considération le risque de lésions secondaires rachidiennes de type métastases osseuses et/ou épidurite métastatique.
Aucune recommandation n’existe à l’heure actuelle pour guider le praticien ; or, la réalisation d’une APM chez un patient présentant des métastases vertébrales pourrait entraîner des complications neurologiques graves.
Dès 1946, Nicholson et Everson suggèrent qu’une lésion secondaire rachidienne, en comprimant l’espace péridural, limiterait la diffusion de l’anesthésique local et entrainerait une stagnation avec accumulation du produit qui pourrait être responsable d’une neurotoxicité (27).
Une autre hypothèse soutient que la compliance de l’espace péridural est réduite par la tumeur compressive, et l’administration de l’anesthésique local au sein de cet espace entraînerait une élévation du volume et donc de la pression, pouvant conduire à l’apparition des signes de compression médullaire. La perfusion continue d’anesthésique local au sein de l’espace péridural pourrait ainsi favoriser l’apparition d’un déficit neurologique plusieurs heures après la mise en place du cathéter (28). En pratique, la majorité des cas cliniques d’APM chez des patients atteints de lésions rachidiennes métastatiques ont été rapportés en dehors du contexte obstétrical, pour des gestes chirurgicaux réalisés sous rachianesthésie ou des poses de cathéter de péridurale thoracique à visée analgésique en présence d’une lésion tumorale souvent méconnue avant le geste (29–31)(32).
Par ailleurs, l’anesthésie générale a ses propres complications chez ces patients atteints de néoplasie. L’état général du patient porteur d’un cancer métastatique doit être évalué, et en particulier sa fonction respiratoire (métastases pleuro-pulmonaires pouvant être associées) pour pouvoir mettre en balance les risques d’un sevrage ventilatoire difficile en cas d’anesthésie générale (32).
Ainsi, le choix d’une technique d’anesthésie dans ce contexte de cancer métastatique avec localisation rachidienne n’est pas codifié et chaque technique présente en elle-même des risques et des bénéfices.
La tumeur la plus fréquemment observée pendant la grossesse est le cancer du sein, touchant 1 femme enceinte sur 3000 (33). Le cancer du sein est l’un des cancers solides les plus ostéophiles, avec le cancer du poumon, du rein, de la prostate et de la thyroïde. En pratique, la réalisation d’un bilan d’extension est recommandée chez les femmes non enceinte porteuses d’une néoplasie mammaire à un stade avancé (cT3-T4), et/ou avec une atteinte ganglionnaire et ce même en l’absence de signes cliniques au moment du diagnostic suggérant la présence de métastases (34,35).
Le bilan d’imagerie repose classiquement sur trois options en fonction du plateau technique disponible:
-‐ radiographie de thorax, échographie abdominale et scintigraphie osseuse -‐ ou, TDM thoraco-abdominale et scintigraphie osseuse
-‐ ou dans l’idéal, TEP-TDM au 18FDG.
Chez la femme enceinte atteinte d’un cancer du sein, le bilan d’extension s’adapte au statut gestationnel des patientes et la recherche de métastases osseuses chez les patientes à risque n’est pas réalisée de manière systématique.
La femme enceinte peut également être touchée par d’autres types de tumeurs au cours de sa grossesse. Pour la plupart des cancers solides non ostéophiles, un bilan d’extension à la recherche de métastases à distance est indiqué uniquement en présence de points d’appel clinique.
Du point de vue du médecin anesthésiste-réanimateur, ces situations à risque de métastases rachidiennes soulèvent deux problématiques ; premièrement de poser l’indication d’une imagerie osseuse avant de réaliser une APM et deuxièmement de réaliser une APM en présence de métastases rachidiennes.
Dans ce contexte, les objectifs de notre étude étaient de décrire chez les femmes enceintes atteintes de cancer :
1) les stratégies de prévention de la maladie thromboembolique au cours de la grossesse et dans le postpartum,
2) la prise en charge analgésique et/ou anesthésique pour l’accouchement.
II. Matériel et méthodes
II. 1. Design de l’étude, population source et population d’étude Il s’agit d’une étude descriptive, rétrospective et monocentrique.
La population source est constituée de toutes les femmes qui ont accouché à la maternité Port Royal du groupe hospitalier Paris Centre de l’Assistance Publique-Hôpitaux de Paris, entre le 1 janvier 2009 et le 31 juillet 2016. Cette maternité de type 3 est une des plus importantes de France métropolitaine en terme d’activité,
avec 5600 accouchements par an. Par ailleurs, l’activité de cette maternité se caractérise par un recrutement important de femmes enceintes présentant des pathologies maternelles (30% des femmes qui accouchent à la maternité Port Royal).
Notre population d’étude est constituée de toutes les femmes atteintes de pathologie néoplasique, tout type de cancer confondu, diagnostiquée avant ou pendant la grossesse. Ces femmes ont été identifiées dans la base de données de la maternité Port Royal DIAMMATER.
Les femmes qui présentaient un antécédent de néoplasie en rémission complète au moment de la grossesse n’ont pas été incluses dans ce travail, ainsi que les femmes pour lesquelles une néoplasie à été diagnostiquée en postpartum.
II. 2. Variables explorées
Les données des femmes enceintes incluses dans notre étude ont été extraites à partir des données informatisées dans le logiciel DIAMMATER ainsi que des dossiers médicaux.
II. 2. a. Caractéristiques maternelles, de la grossesse et de l’accouchement Les caractéristiques maternelles recueillies étaient : l’âge, l’indice de masse corporelle calculé à partir du poids avant la grossesse, l’origine ethnique. Les caractéristiques de la grossesse recueillies étaient les suivantes : gestité, parité, le recours à la procréation médicalement assistée, la gémellité, la nécessité d’une hospitalisation pendant la grossesse, l’existence d’une complication obstétricale en cours de grossesse (menace d’accouchement prématuré, diabète gestationnel et prééclampsie) le recours à une interruption médicale de grossesse. Les caractéristiques de l’accouchement recueilli étaient : le terme de l’accouchement, la voie d’accouchement (voie basse, césarienne programmée ou en urgence pendant le travail ou en dehors travail), la mise en travail spontanée ou déclenchée.
Les caractéristiques néonatales explorées étaient les suivantes : âge gestationnel à la naissance, mort fœtale in utero, poids de naissance, pH artériel ombilical, hospitalisation en réanimation néonatale.
Les caractéristiques oncologiques suivantes ont été explorées : le type de tumeur, le moment du diagnostic de la tumeur par rapport à la grossesse (avant ou pendant), le bilan d’extension réalisé, les traitements en cours de grossesse (chimiothérapie, chirurgie, autres traitements spécifiques), risque de localisation osseuse secondaire.
II. 2. b. Caractéristiques de la prise en charge anesthésique
Les données anesthésiques recueillies étaient : la technique d’anesthésie ou d’analgésie mise en place au moment de l’accouchement, les motifs contre indiquant une technique d’APM, les indications d’anesthésie générale pour l’accouchement, et la recherche de complications liées à l’anesthésie.
II. 2. c. Caractéristiques relatives à la prévention thromboembolique
Le risque thromboembolique a été stratifié à partir des recommandations nationales de la SFAR sur la prévention de la maladie thromboembolique veineuse péri-opératoire et obstétricale publiées en 2005 (Annexe1). La présence d’un cancer évolutif pendant la grossesse était considérée comme une maladie thrombogène sous jacente soit un facteur de risque faible selon ces recommandations de la SFAR.
Le risque a été également stratifié à partir des recommandations internationales issues de l’International Initiative on Thrombosis and Cancer-Continous Medical
Education (ITAC-CME) concernant les bonnes pratiques cliniques pour le traitement
prophylactique et curatif de la maladie thromboembolique veineuse chez les patients atteints de cancer. (Annexe 2)
Nous avons identifié les femmes qui ont été traitées par une anticoagulation préventive pendant leur grossesse et dans le post-partum.
Les évènements thromboemboliques veineux pendant la grossesse et dans le post-partum ont été recherchés et analysés, ainsi que le décès maternel.
II. 3. Analyses statistiques
La proportion de femmes atteintes de cancer en cours de grossesse a été calculée parmi toutes les femmes ayant accouché au cours de la même période d’étude à Port Royal, ainsi que le taux de létalité.
Les caractéristiques maternelles et de la grossesse ont été décrites parmi les femmes enceintes atteintes de cancer, les caractéristiques de l’accouchement et les issues néonatales uniquement parmi les femmes qui ont poursuivi leur grossesse. Les caractéristiques néoplasiques, les traitements reçus et la recherche d’une localisation osseuse secondaire par un examen d’imagerie pendant la grossesse ont également été décrites parmi toutes les femmes atteintes de cancer.
Les techniques d’anesthésie en fonction des voies d’accouchement ont été analysées pour l’ensemble de la population d’étude et plus particulièrement dans le sous-groupe des femmes enceintes porteuses d’un cancer à risque de métastases rachidiennes.
Le niveau de risque thromboembolique lié à la grossesse selon la SFAR et lié au cancer selon l’ITAC-CME a été décrit dans toute la population d’étude et chez chaque femme ayant présenté une complication thromboembolique.
Les données quantitatives ont été présentées par moyenne avec leur écart type ou en médiane [25%-75% interquartile]. Les données qualitatives ont été présentées en valeur absolue avec leur pourcentage.
II. 4. Considération éthique
Ce travail a été mené avec l’autorisation du Commission Nationale de l’Informatique et des libertés CNIL N°1755849 à exploiter les données collectées dans la base de données DIAMMATER et dans les dossiers médicaux.
Toutes les femmes prises en charge à la maternité sont informées par écrit que les informations les concernant peuvent être utilisées à des fins de recherche.
III. Résultats
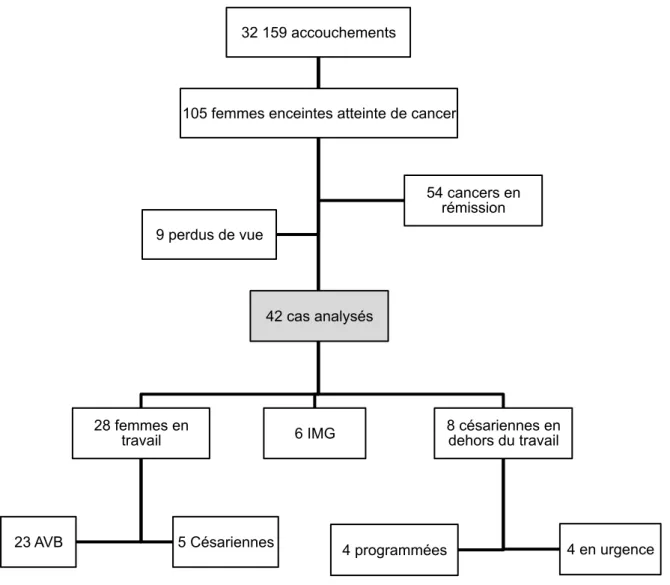
III. 1. Incidence des pathologies néoplasiques parmi les femmes enceintes et issues de grossesse (Figure 1)
Au total, 42 femmes enceintes atteintes d’un cancer entre janvier 2009 et juillet 2016 ont été analysées, soit 0,13 % des femmes enceintes prises en charge à la maternité Port Royal.
Concernant l’issue de ces grossesses, 6 femmes (14% des femmes enceintes avec néoplasie) ont eu une interruption médicale de grossesse d’indication maternelle, dont un tiers des cas au premier et deux tiers au 2ème trimestre.
Parmi les 36 femmes qui ont poursuivi leur grossesse, 23 (64%) femmes ont accouché par voie basse et 13 (36%) femmes ont accouché par césarienne, dont 4 par césarienne programmée et 9 par césarienne en urgence.
Figure 1. Population d’étude et voie d’accouchement des femmes enceintes atteintes de cancer à la maternité Port Royal (janvier 2009-juillet 2016)
Abréviations : IMG=Interruption médicale de grossesse ; AVB=Accouchement voie basse
III. 2. Caractéristiques maternelles, de la grossesse et issue néonatale
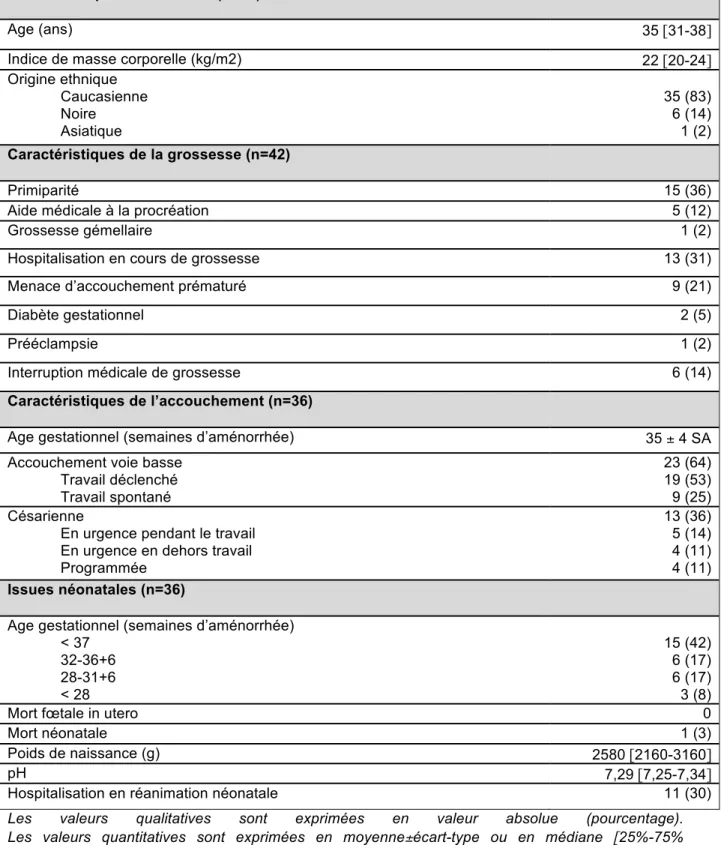
La moitié des femmes de notre série étaient âgées de plus de 35 ans et la majorité d’entre elles était d’origine caucasienne. Quarante deux pourcent des patientes ont accouché prématurément. Un décès néonatal a été observé secondairement à une procidence du cordon ombilical. Quatre femmes ont séjourné en réanimation. Aucun décès maternel n’a été observé au cours de la période d’étude parmi les femmes incluses. (Tableau 2)
105 femmes enceintes atteinte de cancer 32 159 accouchements
28 femmes en travail
23 AVB 5 Césariennes
6 IMG 8 césariennes en dehors du travail
4 programmées 4 en urgence 9 perdus de vue
54 cancers en rémission
Tableau 2. Caractéristiques maternelles et de la grossesse des 42 femmes enceintes porteuses d’un cancer dans notre étude. Caractéristiques de l’accouchement et issues néonatales des 36 femmes qui ont poursuivi leur grossesse.
Caractéristiques maternelles (n=42)
Age (ans) 35 [31-38]
Indice de masse corporelle (kg/m2) 22 [20-24]
Origine ethnique Caucasienne Noire Asiatique 35 (83) 6 (14) 1 (2) Caractéristiques de la grossesse (n=42) Primiparité 15 (36)
Aide médicale à la procréation 5 (12)
Grossesse gémellaire 1 (2)
Hospitalisation en cours de grossesse 13 (31)
Menace d’accouchement prématuré 9 (21)
Diabète gestationnel 2 (5)
Prééclampsie 1 (2)
Interruption médicale de grossesse 6 (14)
Caractéristiques de l’accouchement (n=36)
Age gestationnel (semaines d’aménorrhée) 35 ± 4 SA
Accouchement voie basse Travail déclenché Travail spontané 23 (64) 19 (53) 9 (25) Césarienne
En urgence pendant le travail En urgence en dehors travail Programmée 13 (36) 5 (14) 4 (11) 4 (11) Issues néonatales (n=36)
Age gestationnel (semaines d’aménorrhée) < 37 32-36+6 28-31+6 < 28 15 (42) 6 (17) 6 (17) 3 (8)
Mort fœtale in utero 0
Mort néonatale 1 (3)
Poids de naissance (g) 2580 [2160-3160]
pH 7,29 [7,25-7,34]
Hospitalisation en réanimation néonatale 11 (30)
Les valeurs qualitatives sont exprimées en valeur absolue (pourcentage).
Les valeurs quantitatives sont exprimées en moyenne±écart-type ou en médiane [25%-75% interquartiles] en fonction de la distribution.
III. 3. Caractéristiques oncologiques (Tableau 3)
Dans notre population d’étude, cinq femmes (12%) avaient une néoplasie connue avant d’être enceinte :
-‐ trois femmes étaient porteuses d’un cancer évolutif avant leur projet de grossesse,
-‐ deux grossesses ont été découvertes de manière fortuite lors du bilan d’extension de cancer au premier trimestre.
Chez les 37 autres femmes (88% de la population d’étude), le cancer était découvert pendant la grossesse et dans plus de la moitié des cas au cours du 2ème trimestre (n=26, 62 %).
Le cancer du sein était le cancer le plus fréquent et concernait deux tiers de notre population (67%), suivi des hémopathies malignes (12%) puis des adénocarcinomes digestifs (7%).
Trente deux patientes (89%) ont reçu une chimiothérapie pendant leur grossesse dont la dernière séance s’est déroulée au moins 3 semaines avant l’accouchement dans 84% des cas.
Tableau 3. Type de cancers diagnostiqués dans la population d’étude et traitement introduit pendant la grossesse.
Type de cancer Total (n=42) Traitement Sein 28 (68%) Chimiothérapie (n=26) Chirurgie carcinologique (n=10) IMG (n=1) Hémopathies malignes Lymphomes LAM LMC 5 (12%) 2 2 1 Chimiothérapie (n=2) IMG (n=1) Surveillance (n=1) Traitement spécifique (n=4) Adénocarcinome digestif Gastrique Rectal Colique 3 (7)% 1 1 1 Chimiothérapie (n=3)
Phéochromocytome malin 2 (5%) IMG (n=1)
Surveillance (n=1)
Tumeur ovaire 1 (2%) Chimiothérapie
Tumeur cérébrale 1 (2%) IMG
Corticosurrénalome 1 (2%) IMG
Tumeur ORL 1 (2%) IMG
Abréviations : LAM = Leucémie aiguë myéloïde; LMC = Leucémie myéloïde chronique
Au total, 10 patientes (24%) étaient considérées à risque de localisations osseuses secondaires : 5 femmes porteuses d’une forme inflammatoire de cancer du sein, 1 femme porteuse d’un cancer du sein bilatéral, 4 femmes porteuses d’un cancer et qui manifestaient des symptômes cliniques évocateurs de métastases rachidiennes. Parmi ces femmes, une imagerie osseuse à la recherche de métastases vertébrales a été réalisée chez 4 d’entre elles. Les résultats de l’imagerie ont mis en évidence des métastases osseuses vertébrales chez 3 de ces 4 femmes.
III. 4. Prise en charge anesthésique
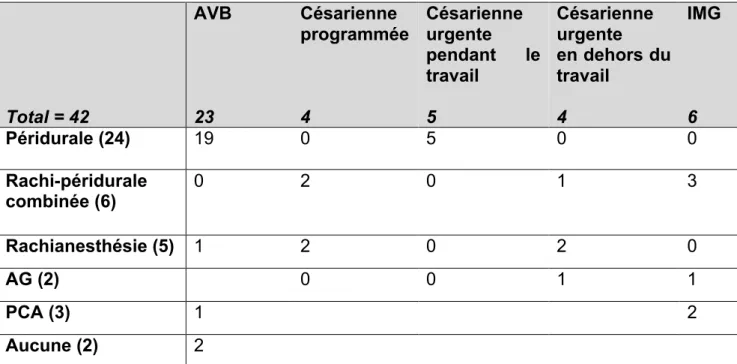
Sept patientes (17%) n’ont pas eut d’APM pour leur accouchement ou l’expulsion de leur fœtus au motif de troubles de la coagulation (n=3), d’HTIC (n=1), du refus de la patiente (n=1), d’un accouchement imminent (n=1) et de la nécessité d’une exploration chirurgicale sous anesthésie générale dans le même temps dans le même temps (n=1).
Les techniques d’anesthésie ou d’analgésie réalisées en fonction de la modalité d’accouchement sont présentées dans le tableau 4.
Tableau 4. Technique d’analgésie ou d’anesthésie pour les 36 femmes enceintes porteuses d’un cancer en fonction de la voie d’accouchement et pour les 6 femmes qui ont eu une IMG.
Total = 42 AVB 23 Césarienne programmée 4 Césarienne urgente pendant le travail 5 Césarienne urgente en dehors du travail 4 IMG 6 Péridurale (24) 19 0 5 0 0 Rachi-péridurale combinée (6) 0 2 0 1 3 Rachianesthésie (5) 1 2 0 2 0 AG (2) 0 0 1 1 PCA (3) 1 2 Aucune (2) 2
Abréviations : AG = Anesthésie générale, PCA =Patient Controlled Analgesia, AVB=Accouchement voie basse, IMG=Interruption médicale de grossesse
Les trois patientes porteuses de métastases vertébrales ont toutes bénéficié d’une anesthésie par rachi-péridurale combinée pour leur accouchement par césarienne. Il n’y a eu aucune complication sur le plan anesthésique pendant ou au décours de l’accouchement. (Tableau 5)
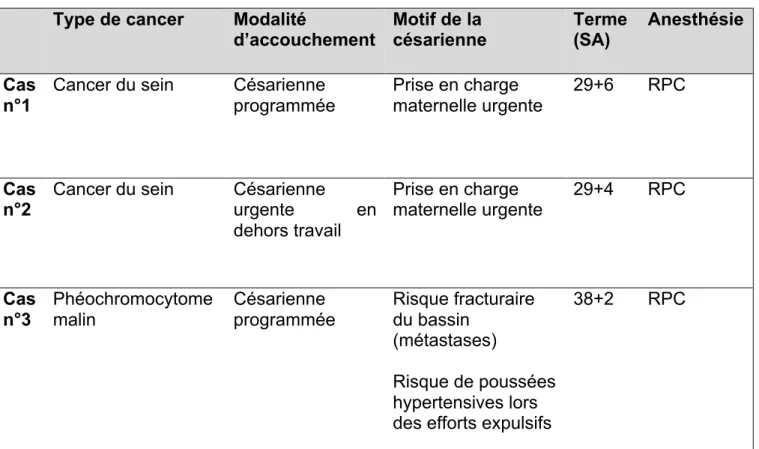
Tableau 5. Prise en charge anesthésique et analgésique chez les 3 femmes enceintes porteuses d’un cancer avec métastases rachidiennes (n=3)
Type de cancer Modalité
d’accouchement Motif de la césarienne Terme (SA) Anesthésie Cas
n°1
Cancer du sein Césarienne programmée
Prise en charge maternelle urgente
29+6 RPC
Cas
n°2 Cancer du sein Césarienne urgente en dehors travail Prise en charge maternelle urgente 29+4 RPC Cas n°3 Phéochromocytome malin Césarienne programmée Risque fracturaire du bassin (métastases) Risque de poussées hypertensives lors des efforts expulsifs
38+2 RPC
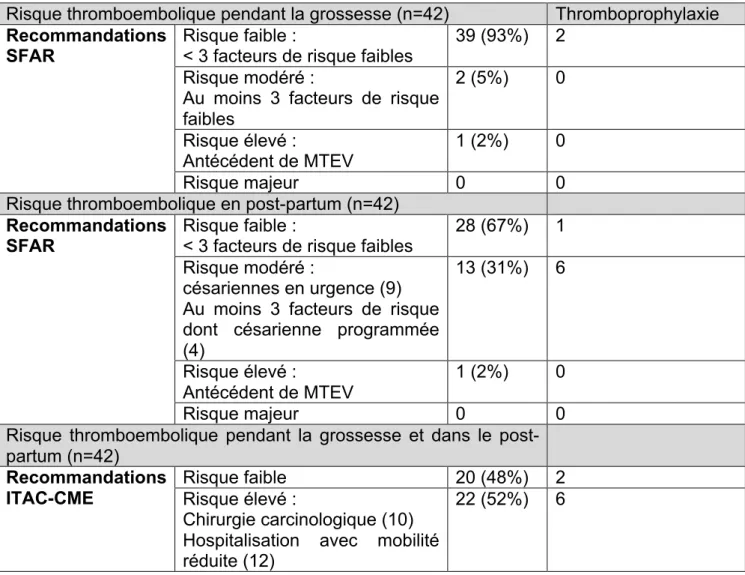
III. 5. Evaluation du risque, thromboprophylaxie et complications thromboemboliques
Concernant l’évaluation du risque thromboembolique selon les recommandations de la SFAR, les femmes étaient considérées à risque faible pendant leur grossesse dans 93% des cas et dans 67% des cas en post-partum. Une seule femme était identifiée comme à risque élevé pendant sa grossesse et le post-partum devant un antécédent de MTEV. Tableau 6
Selon l’ITAC-CME, une femme sur 2 était considérée à risque élevé tout au long de sa grossesse et dans le post-partum.
Les 2 femmes ayant reçu une anticoagulation préventive pendant leur grossesse étaient identifiés à risque thromboembolique faible suivant la SFAR et à risque élevé suivant les recommandations de l’ITAC-CME.
Après un accouchement par césarienne, 46% des femmes ont reçu une anticoagulation préventive.
L’anticoagulation préventive était assurée par une héparine de bas poids moléculaire (HBPM) type Enoxaparine à dose préventive de 4000 UI/ 24 heures en une injection par voie sous cutanée.
Tableau 6. Stratification du risque thromboembolique selon les recommandations de la SFAR pendant la grossesse et dans le post-partum (Annexe 1) et selon les recommandations de l’ITAC-CME (Annexe 2) chez les 42 femmes enceintes porteuses d’un cancer.
Risque thromboembolique pendant la grossesse (n=42) Thromboprophylaxie Recommandations
SFAR Risque faible : < 3 facteurs de risque faibles 39 (93%) 2 Risque modéré :
Au moins 3 facteurs de risque faibles
2 (5%) 0
Risque élevé :
Antécédent de MTEV 1 (2%) 0
Risque majeur 0 0
Risque thromboembolique en post-partum (n=42) Recommandations
SFAR Risque faible : < 3 facteurs de risque faibles 28 (67%) 1 Risque modéré :
césariennes en urgence (9) Au moins 3 facteurs de risque dont césarienne programmée (4) 13 (31%) 6 Risque élevé : Antécédent de MTEV 1 (2%) 0 Risque majeur 0 0
Risque thromboembolique pendant la grossesse et dans le post-partum (n=42) Recommandations ITAC-CME Risque faible 20 (48%) 2 Risque élevé : Chirurgie carcinologique (10) Hospitalisation avec mobilité réduite (12)
22 (52%) 6
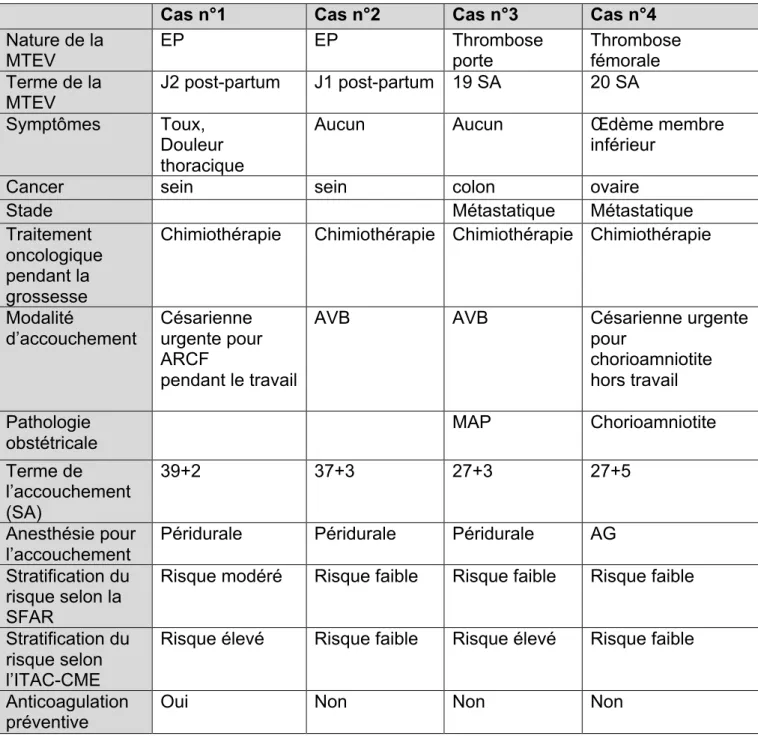
Au total, 4 (9,5%) patientes ont présenté un accident thrombo-embolique veineux pendant leur grossesse ou dans le post partum. Deux patientes ont eu une TVP pendant leur grossesse et deux cas d’EP ont été diagnostiqués dans les 48 heures du post-partum (1 après césarienne et l’autre après un accouchement voie basse). Une seule des 4 femmes avait reçu une anticoagulation préventive.
Les données oncologiques, la stratification du risque thromboembolique et les modalités d’accouchement de ces 4 femmes sont présentés dans le tableau 7.
Tableau 7. Analyse des 4 cas d’accidents thromboemboliques parmi les 42 femmes enceintes porteuses de cancer.
Abréviations : ARCF = Anomalies du rythme cardiaque fœtal, SA = semaine d’aménorrhée, MAP= Menace d’accouchement prématurée. EP= Embolie pulmonaire
Cas n°1 Cas n°2 Cas n°3 Cas n°4
Nature de la MTEV EP EP Thrombose porte Thrombose fémorale Terme de la MTEV J2 post-partum J1 post-partum 19 SA 20 SA Symptômes Toux, Douleur thoracique
Aucun Aucun Œdème membre
inférieur
Cancer sein sein colon ovaire
Stade Métastatique Métastatique
Traitement oncologique pendant la grossesse
Chimiothérapie Chimiothérapie Chimiothérapie Chimiothérapie
Modalité d’accouchement Césarienne urgente pour ARCF pendant le travail
AVB AVB Césarienne urgente
pour
chorioamniotite hors travail Pathologie
obstétricale MAP Chorioamniotite
Terme de l’accouchement (SA) 39+2 37+3 27+3 27+5 Anesthésie pour l’accouchement
Péridurale Péridurale Péridurale AG Stratification du
risque selon la SFAR
Risque modéré Risque faible Risque faible Risque faible
Stratification du risque selon l’ITAC-CME
Risque élevé Risque faible Risque élevé Risque faible
Anticoagulation préventive
V. Discussion
Dans cette étude rétrospective monocentrique, nous avons observé que la technique d’APM pour l’accouchement, reste préférentiellement utilisée chez les femmes enceintes atteintes d’un cancer.
Pour les femmes enceintes identifiées comme à risque de métastases osseuses, une imagerie vertébrale est rarement réalisée avant une APM. Cependant aucune complication secondaire n’a été observée après réalisation d’une APM en présence de métastases vertébrales.
L’incidence des évènements thromboemboliques, pendant la grossesse et dans le post-partum, chez les femmes atteintes de cancer semble supérieure à celle rapportée chez la femme enceinte en bonne santé.
Notre étude a permis l’analyse de la prise en charge anesthésique pour l’accouchement et la gestion du risque thromboembolique chez 42 femmes enceintes porteuses d’un cancer sur une période de 7 ans. Il s’agit d’une étude rétrospective monocentrique avec un effectif réduit qui s’explique par la rareté de l’association entre cancer et grossesse.
C’est un des rares travaux disponibles dans la littérature qui s’intéresse spécifiquement à ces 2 stratégies. A notre connaissance, il n’existe qu’une seule étude décrivant également la stratégie anesthésique dans ce contexte. (36)
De même, la littérature sur la réalisation d’une APM dans le contexte de métastases rachidiennes est constituée uniquement de cas cliniques rapportés (29–31)(32). Une des forces de notre étude est le recueil détaillé des données à partir des dossiers médicaux, permettant une exhaustivité notamment concernant les stratégies anesthésiques et de prévention thromboembolique. Cependant les patientes étaient également suivit dans d’autres établissements parisiens spécialisés dans la prise en charge du cancer, et certaines données ne figuraient pas dans le dossier de la maternité. La classification cTNM du cancer du sein étaient l’une des données manquantes, il existait probablement d’avantage de femmes à considérer comme à risque de métastases osseuses dans notre population car le cancer du sein pendant la grossesse est diagnostiqué le plus souvent à des stades avancés. (6)
Dans notre étude nous avons retrouvé une incidence de femmes enceintes atteintes de cancer de 0,13% des femmes enceintes. Cette incidence est tout à fait comparable à celle rapportée dans la littérature récente (1–5). Cet élément renforce la représentativité de notre étude, même si celle-ci est monocentrique.
Dans ce travail, nous avons observé que la prise en charge anesthésique et analgésique pour l’accouchement des femmes porteuses d’un cancer diffère peu de celle réalisée chez des femmes enceintes non atteintes de cancer quelles que soient les modalités d’accouchements. En pratique, le choix d’une technique d’APM reste privilégiée comme dans la population générale des femmes enceintes en France. Ainsi dans notre étude, parmi les femmes enceintes porteuses d’un cancer en travail spontané ou déclenché, 87% ont pu bénéficier d’une analgésie péri-médullaire pour la prise la charge de la douleur au cours du travail obstétrical. Ce taux est comparable à celui de 83% rapporté dans l’Enquête Nationale Périnatale de 2016 (37). De même, en cas de césarienne, une anesthésie péri-médullaire était réalisée dans 92% des cas. Ces données sont semblables aux données de l’ENP de 2016 (94%).
En revanche, nos résultats ne sont pas comparables à ceux de l’étude homologue rétrospective canadienne parue en 2012. Dans cette étude monocentrique qui décrivait également la gestion anesthésique de femmes enceintes porteuses de cancer (36), les auteurs constataient que dans leur institution une proportion plus importante de femmes (22%) atteintes de cancer avaient une anesthésie générale pour leur accouchement par césarienne en comparaison à la population générale (1%-3%). L’absence de recommandations sur le sujet peut expliquer ces différences de pratiques d’un centre à l’autre.
Sur le plan obstétrical, la proportion de femmes qui ont eu un déclenchement du travail était plus de deux fois supérieure (53%) à celle rapportée dans l’ENP (22% des femmes qui accouchent en France). En effet, un nombre important de femmes est traité par chimiothérapie pendant la grossesse (89%), et par prudence il est recommandé de respecter un délai de 3 semaines entre la dernière séance et l’accouchement pour diminuer le risque infectieux lié à une neutropénie, le risque hémorragique et l’impossibilité de réaliser une analgésie péridurale lié à une thrombopénie (38). Cette recommandation peut expliquer pourquoi souvent l’accouchement voie basse de ces femmes sera « programmé » et donc déclenché.
Nous avons observé que la proportion d’accouchements par césarienne est également supérieure à celle retrouvée dans la population générale (36% vs 20% dans l’ENP 2016), le plus souvent réalisés en urgence en dehors du travail pour sauvetage maternel ou pour des anomalies du rythme cardiaque fœtal. Cette tendance est également retrouvée dans l’étude canadienne de Tharmartnam et al. avec un taux de césarienne presque double par rapport aux autres femmes qui accouchent dans cette maternité (54% versus 25-30%), et de même dans une autre étude explorant les issues obstétricales des femmes enceintes atteintes de cancer (39).
Parmi les femmes considérées comme à risque de métastases osseuses, seule une minorité a bénéficié d’une imagerie rachidienne avant la réalisation d’une APM. Ces images révélaient une localisation secondaire chez 3 femmes parmi les 4. Cette faible proportion d’exploration par imagerie s‘explique principalement par l’absence de recommandations concernant l’attitude à préconiser dans ce contexte. En effet, la prise en charge anesthésique pour l’accouchement de ces femmes enceintes porteuses d’un cancer avec métastase rachidienne n’est pas codifiée.
Dans la littérature, il existe quelques cas de déficit neurologique à la suite d’APM chez des patients porteurs de métastases rachidiennes, le plus souvent méconnues au moment du geste. Un cas de paraplégie a été rapporté chez un homme de 47 ans atteint d’un carcinome rénal avec métastases vertébrales thoraciques et lombaires après la réalisation d’une péridurale thoracique pour néphrectomie (40). De même, le même déficit a été observé chez un homme de 75 ans, porteur de métastases vertébrales thoraciques et lombaires, au décours d’une rachianesthésie pour urétéroscopie rétrograde (30). Kararmaz et al. ont également rapporté le cas d’une paraplégie après la réalisation d’une rachianesthésie péridurale combinée pour arthroplastie du genou chez une femme de 75 ans atteinte d’un cancer de l’endomètre avec des métastases vertébrales thoraciques (31). Graham et al. ont décrit un cas de paraplégie après rachianesthésie pour orchidectomie bilatérale chez un patient atteint d’un cancer de la prostate avec métastases vertébrales (29).
La principale hypothèse qui expliquerait l’apparition d’un déficit neurologique suite à la réalisation d’une APM est fondée sur une diminution de la compliance de l’espace péridural par la présence de métastases rachidiennes (28). La neurotoxicité décrite par Nicholson et Everson (27) apparaît comme une théorie moins valable car les concentrations des anesthésiques locaux utilisés sont plus faibles à l’heure actuelle.
On ne peut cependant pas écarter un phénomène de coïncidence : les tumeurs vertébrales métastatiques peuvent également s’aggraver qu’il y ait ou non la réalisation d’une APM. Le lien de causalité entre le geste et la complication semble extrêmement difficile à mettre en évidence.
Pour autant, en cas d’accouchement par césarienne, l’anesthésie générale n’est pas toujours une alternative dénuée de risques dans ce contexte. En effet, l’intubation orotrachéale peut être déconseillée en présence de métastases osseuses étagées au niveau du rachis cervical comme chez l’une des 3 patientes de notre série. Le sevrage ventilatoire peut également être à risque, comme chez cette femme de 32 ans atteinte d’un sarcome multi métastatique avec lésions vertébrales étagées qui présentait un état général très altéré avec une détresse respiratoire en lien avec des métastases pleuro pulmonaires bilatérales (32).
Ainsi, aux vues de la littérature dont on dispose et des résultats de notre étude, le choix de la technique anesthésique pour l’accouchement doit être décidé de façon collégiale, au cas par cas, en mettant en balance les bénéfices et les risques.
L’incidence de la pathologie thromboembolique dans notre population de femmes enceintes atteintes de cancer est quasiment 50 fois supérieure à celle observée dans la population générale de femmes enceintes (respectivement 9,5% versus 0,2%). (11–14). Cette incidence semble d’avantage se rapprocher de celle décrite pour des populations de patients porteurs d’un cancer à haut risque thromboembolique, se situant entre 6% et 8% (25).
Dans ce travail, en se basant sur les recommandations de la SFAR, la grande majorité des femmes (93%) étaient considérées comme à faible risque thromboembolique malgré l’association cancer et grossesse, par contre plus de la moitié des femmes étaient considérées comme à risque élevé avec la classification de l’ITAC-CME. Dans ce cas, l’ITAC-CME conseillent la mise en place d’une anticoagulation préventive chez la femme enceinte mais soulignent l’absence de données pour cette situation (26).
A l’heure actuelle, seule la troisième édition du RCOG publiée en 2015 (19) tient compte de la présence d’un cancer comme comorbidité à considérer comme un facteur de risque élevé chez la femme enceinte. Dans leur algorithme de prise en charge, il est recommandé d’introduire une prophylaxie thromboembolique à partir
de 28 SA pour les femmes enceintes porteuses d’un cancer quelque soit la nature du cancer.
En effet, au vue de nos résultats, il faut probablement considérer l’association cancer et grossesse comme une situation à risque thromboembolique élevé car la moitié des femmes qui ont présenté un événement thromboembolique étaient considérées à faible risque suivant les recommandations de la SFAR et de l’ITAC-CME.
Dans notre étude, une anticoagulation préventive était trop rarement administrée et en particulier chez seulement 1 femme sur 2 après un accouchement par césarienne. Or toutes ces femmes étaient identifiées comme à risque thromboembolique modéré et auraient du recevoir une anticoagulation préventive au décours de leur accouchement par une HBPM à dose préventive pendant six à huit semaines selon les recommandations pour la pratique clinique de la SFAR concernant la prévention de la maladie thromboembolique veineuse.
D’une manière générale, la gestion optimale n’est toujours pas claire concernant la place de l’anticoagulation préventive après un accouchement par césarienne car toutes les sociétés savantes ne considèrent pas toutes les mêmes facteurs de risque pour identifier les femmes à haut risque thromboembolique. Une étude nord-américaine a comparé les taux d’anticoagulation préventive chez 293 patientes ayant accouché par césarienne en se basant sur 3 principales lignes directrices à savoir celles de l’ACOG, du RCOG et de l’ACCP. Une grande majorité des patientes (85%) avait reçu une prophylaxie médicamenteuse post césarienne en suivant les lignes directrices du RCOG contre 1% en suivant celles de l’ACOG et 35% en suivant celles de l’ACCP (23).
Bien que nos résultats concernent uniquement les pratiques observées dans une seule maternité, et probablement non représentatifs des pratiques de tous les anesthésistes français travaillant en maternité, Il semble important de communiquer sur le risque thromboembolique chez les femmes enceintes atteintes de cancer et sur la nécessité d’administrer un traitement anticoagulant prophylactique après une césarienne dans ce contexte.
VI. Conclusion
La grossesse chez une femme atteinte de cancer est une situation rare dont la prise en charge est complexe. Pour l’anesthésiste-réanimateur, le choix du type d’anesthésie ou d’analgésie pour l’accouchement doit faire l’objet d’une discussion collégiale mettant en balance les bénéfices et les risques de chaque technique dans ce contexte. Il convient d’évoquer la nécessité ou non de programmer une imagerie rachidienne avant une APM bien que la présence d’une métastase vertébrale ne semble pas contre-indiquer sa réalisation. La prescription d’une thromboprophylaxie en cours de grossesse et dans le postpartum, en particulier après césarienne, devrait être plus souvent envisagée compte tenu de la fréquence élevée des évènements thromboemboliques chez les femmes enceintes porteuses d’une néoplasie. Les résultats de ce travail mériteraient d’être confirmés par une étude de plus grande taille multicentrique.
Annexe
Annexe 1. Prévention de la maladie thromboembolique veineuse péri-opératoire et obstétrical, recommandations pour la pratique clinique, SFAR 2005.
Annexe 2. Recommandation pour une anticoagulation préventive chez le patient porteur d’un cancer d’après les recommandations de l’ITAC-CME. 2016.
Références bibliographiques
1. Salani R, Billingsley CC, Crafton SM. Cancer and pregnancy: an overview for obstetricians and gynecologists. Am J Obstet Gynecol. 2014 Jul;211(1):7–14.
2. Pentheroudakis G, Pavlidis N. Cancer and pregnancy: poena magna, not anymore. Eur J Cancer Oxf Engl 1990. 2006 Jan;42(2):126–40.
3. Pavlidis NA. Coexistence of pregnancy and malignancy. The Oncologist. 2002;7(4):279–87.
4. Eibye S, Kjær SK, Mellemkjær L. Incidence of Pregnancy-associated Cancer in Denmark, 1977–2006. Obstet Gynecol. 2013 Sep 1;122(3):608–17.
5. Binder-Foucard F, Bossard N, Delafosse P, Belot A, Woronoff A-S, Remontet L. Cancer incidence and mortality in France over the 1980–2012 period: Solid tumors. Rev DÉpidémiologie Santé Publique. 2014 Apr 1;62(2):95–108.
6. Amant F, Deckers S, Van Calsteren K, Loibl S, Halaska M, Brepoels L, et al. Breast cancer in pregnancy: Recommendations of an international consensus meeting. Eur J Cancer. 2010 Dec 1;46(18):3158–68.
7. Article - Bulletin épidémiologique hebdomadaire [Internet]. [cited 2018 Jan 28]. Available from: http://invs.santepubliquefrance.fr/beh/2013/33-34/2013_33-34_2.html
8. Oger E. Incidence of venous thromboembolism: a community-based study in Western France. EPI-GETBP Study Group. Groupe d’Etude de la Thrombose de Bretagne Occidentale. Thromb Haemost. 2000 May;83(5):657–60.
9. MBRRACE-UK Maternal Report 2017 - Web.pdf [Internet]. [cited 2018 Feb 13]. Available from: https://www.npeu.ox.ac.uk/downloads/files/mbrrace-uk/reports/MBRRACE-UK%20Maternal%20Report%202017%20-%20Web.pdf 10.
5e_rapport_morts_maternelles_france_mieux_comprendre_mieux_prevenir_2010-2012.pdf [Internet]. [cited 2018 Jan 28]. Available from: http://www.xn--epop-inserm-
ebb.fr/wp-content/uploads/2017/11/5e_rapport_morts_maternelles_france_mieux_comprendre _mieux_prevenir_2010-2012.pdf
11. James AH. Venous thromboembolism in pregnancy. Arterioscler Thromb Vasc Biol. 2009 Mar;29(3):326–31.
12. Sultan AA, Tata LJ, West J, Fiaschi L, Fleming KM, Nelson-Piercy C, et al. Risk factors for first venous thromboembolism around pregnancy: a population-based cohort study from the United Kingdom. Blood. 2013 May 9;121(19):3953–61.
13. James AH, Jamison MG, Brancazio LR, Myers ER. Venous thromboembolism during pregnancy and the postpartum period: incidence, risk factors, and mortality. Am J Obstet Gynecol. 2006 May;194(5):1311–5.
14. Heit JA, Kobbervig CE, James AH, Petterson TM, Bailey KR, Melton LJ. Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study. Ann Intern Med. 2005 Nov 15;143(10):697–706.
15. Bourjeily G, Paidas M, Khalil H, Rosene-Montella K, Rodger M. Pulmonary embolism in pregnancy. Lancet Lond Engl. 2010 Feb 6;375(9713):500–12.
16. Bates SM, Greer IA, Middeldorp S, Veenstra DL, Prabulos A-M, Vandvik PO. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012 Feb;141(2 Suppl):e691S– e736S.
17. James A, Committee on Practice Bulletins—Obstetrics. Practice bulletin no. 123: thromboembolism in pregnancy. Obstet Gynecol. 2011 Sep;118(3):718–29. 18. gui308CPG1406F.pdf [Internet]. [cited 2017 Feb 6]. Available from: https://sogc.org/wp-content/uploads/2014/06/gui308CPG1406F.pdf
19. gtg-37a.pdf [Internet]. [cited 2017 Feb 6]. Available from: https://www.rcog.org.uk/globalassets/documents/guidelines/gtg-37a.pdf
20. Thrombophilie_grossesse_court.pdf [Internet]. [cited 2018 Jan 28]. Available
from:
https://www.has-sante.fr/portail/upload/docs/application/pdf/Thrombophilie_grossesse_court.pdf 21.
2_AFAR_Prevention-de-la-maladie-thromboembolique-veineuse-perioperatoire-et-obstetricale.pdf [Internet]. [cited 2017 Aug 18]. Available from:
http://sfar.org/wp-content/uploads/2015/09/2_AFAR_Prevention-de-la-maladie-thromboembolique-veineuse-perioperatoire-et-obstetricale.pdf
22. 2010_GO_169_benhamou.pdf [Internet]. [cited 2017 Feb 6]. Available from: http://www.cngof.asso.fr/d_livres/2010_GO_169_benhamou.pdf
23. Palmerola KL, D’Alton ME, Brock CO, Friedman AM. A comparison of recommendations for pharmacologic thromboembolism prophylaxis after caesarean delivery from three major guidelines. BJOG Int J Obstet Gynaecol. 2016 Dec;123(13):2157–62.
24. Chew HK, Wun T, Harvey D, Zhou H, White RH. Incidence of venous thromboembolism and its effect on survival among patients with common cancers. Arch Intern Med. 2006 Feb 27;166(4):458–64.
25. Khorana AA, Connolly GC. Assessing Risk of Venous Thromboembolism in the Patient With Cancer. J Clin Oncol. 2009 Oct 10;27(29):4839.