Effet du colmatage bactérien sur la performance de
l'ultrafiltration du lactosérum
Mémoire
William Villeneuve
Maîtrise en sciences des aliments - avec mémoire
Maître ès sciences (M. Sc.)
Effet du colmatage bactérien sur la performance de
l’ultrafiltration du lactosérum
Mémoire
William Villeneuve
Sous la direction de :
Alain Doyen, directeur de recherche
Steve Labrie, codirecteur de recherche
Résumé
Le lactosérum, co-produit de la transformation fromagère, peut être valorisé en concentrant ses protéines par ultrafiltration (UF). Le principal inconvénient de l’UF est le colmatage des membranes, notamment par les protéines et le phosphate de calcium, qui entraîne une réduction des performances du procédé. Depuis quelques années, il est reconnu que les membranes peuvent être colmatées par des cellules bactériennes et des biofilms lors de l’UF du lactosérum. De nombreux auteurs ont souligné la présence de biofilms sur les membranes et investigué différents paramètres régissant la diversité bactérienne de ces biofilms. Toutefois, aucune étude n’a encore démontré l’impact concret du colmatage bactérien sur les performances de l’UF du lactosérum. L’objectif général de cette étude était donc de quantifier les baisses de performance causées par le dépôt de cellules bactériennes et la formation de biofilms lors du l’UF du lactosérum. Le premier objectif a démontré que le dépôt de cellules bactériennes pouvait exacerber les baisses de flux causées par le colmatage des protéines sériques en UF frontale, alors qu’il avait peu d’effet sur le colmatage minéral. Une neutralisation partielle des charges électrostatiques entre les bactéries et les protéines réduirait les répulsions et entraînerait la formation d’un gâteau de particules plus compact sur la membrane. Les résultats du deuxième objectif ont permis de confirmer, en UF tangentielle de lactosérum doux, que le colmatage bactérien provenant de la microflore intrinsèque du système de filtration pouvait diminuer les flux de perméation après 18 h de filtration. Le colmatage bactérien a augmenté la résistance hydraulique des membranes, permettant le calcul de résistances spécifiques au colmatage bactérien (Rbio) qui représentaient de 31 à 44% de la
résistance totale de la couche de colmatage. Ces résultats démontrent que le colmatage bactérien peut influencer négativement les performances de l’UF du lactosérum et soulignent l’importance de développer des solutions pour mitiger ce colmatage.
Abstract
Whey, the main co-product of cheese manufacturing, can be valorized through protein concentration by ultrafiltration (UF). The main drawback of UF is fouling, mainly by protein and calcium phosphate, which lowers the process performance. It has recently been acknowledged that membranes can also be fouled by bacterial cells and biofilms during whey UF. Numerous authors have demonstrated the presence of biofilms on membranes and investigated many parameters that can modulate the bacterial diversity of these biofilms. However, the impact of biofouling on the performance of whey UF is still unknown. The general objective of this study was therefore to quantify the loss of performance caused by bacterial cell deposition and biofilm formation during whey UF. The first objective demonstrated that bacterial cell deposition could increase the flux drop caused by whey protein fouling during dead-end UF, while it had minor effects on mineral fouling. Partial neutralization of bacterial cells and protein electrostatic charges may have reduced repulsions led to the formation of a more compact cake. The results of the second objective confirmed, during crossflow UF of sweet whey, that biofouling from the intrinsic microflora of the filtration system could lower permeation fluxes after 18 h of filtration. Biofouling also increased membrane hydraulic resistances, allowing the calculation of biofouling-specific resistances (Rbio), which accounted for 31 to 44% of the total fouling layer resistances.
These results demonstrate that biofouling can negatively affect the performance of whey processing by UF and highlight the need for solutions to mitigate biofouling.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des figures ... ix
Liste des tableaux ... x
Liste des abréviations ... xi
Remerciements ... xii
Avant-propos ... xiv
Introduction ... 1
Chapitre 1 : Revue de littérature ... 3
1.1. Généralités sur le lactosérum ... 3
1.1.1. Sources et composition du lactosérum ... 3
1.1.2. La valorisation du lactosérum... 4
1.2. Les procédés baromembranaires ... 7
1.2.1. Généralités ... 7
1.2.2. L’utilisation des procédés baromembranaires en industrie laitière ... 8
1.2.3. L’ultrafiltration pour la valorisation du lactosérum ... 9
1.3. Le colmatage ... 10
1.3.1. La polarisation de concentration ... 11
1.3.2. Le colmatage irréversible ... 12
1.3.2.1. Les mécanismes de colmatage ... 13
1.3.2.2. Le modèle des résistances en série ... 14
1.3.3. Effets du colmatage sur la performance de l’ultrafiltration... 15
1.3.4. Colmatage lors de l’ultrafiltration du lactosérum ... 16
1.4. Le colmatage bactérien ... 18
1.4.1. Définition ... 18
1.4.2. Colmatage par le dépôt de cellules bactériennes ... 18
1.4.3. Colmatage par la formation de biofilms ... 20
1.4.3.1. Définitions ... 20
1.4.3.2. Formation et structure des biofilms ... 20
1.4.3.3. Biofilms dans les installations membranaires en industrie laitière ... 22
1.4.4. Impact du colmatage bactérien sur les procédés baromembranaires ... 25
1.4.4.1. Qualité des produits ... 25
1.4.4.2. Performance du procédé ... 25
Chapitre 2 : Hypothèse et objectifs ... 28
2.1. Les procédés baromembranaires ... 28
2.2. Hypothèse ... 28
2.3. Objectifs ... 29
Chapitre 3 : Effect of Streptococcus thermophilus cell deposition on flux reduction during ultrafiltration of whey constituents ... 30
3.1. Avant-propos ... 30
3.2. Résumé ... 30
3.3. Abstract ... 32
3.4. Introduction ... 33
3.5. Materials and Methods ... 34
3.5.1. Feed solutions ... 34
3.5.2. Model bacterial strain and feed solution inoculation ... 35
3.5.3. Dead-end ultrafiltration experiments ... 35
3.5.4. Scanning electron microscopy ... 36
3.5.5. Proximate composition of feed solutions, permeate solutions and membrane fouling layer ... 36
3.5.6. Statistical analysis ... 37
3.6. Results ... 37
3.6.1. Permeate flux decline of feed solutions ... 37
3.6.2. Composition of feed solutions, UF-permeates and membrane fouling layer ... 40
3.6.3. Microstructure of the fouling layers ... 42
3.7. Discussion ... 44
3.7.1. Effect of cell deposition on flux decline ... 44
3.7.2. Visual aspects of the fouling layer ... 44
3.7.3. Interactions between bacteria and whey protein ... 45
3.7.4. Effect of bacterial cells on feed, permeate and fouling layer composition ... 46
3.8. Conclusions ... 47
3.9. Acknowledgments ... 47
Chapitre 4 : Contribution of biofouling to permeation flux decline and membrane resistance changes during whey ultrafiltration ... 48
4.2. Résumé ... 48
4.3. Abstract ... 50
4.4. Introduction ... 51
4.5. Materials and Methods ... 52
4.5.1. Feed solutions ... 52
4.5.2. Model starter culture ... 53
4.5.3. Model crossflow UF system and filtration membranes ... 53
4.5.4. Biofouling protocol ... 54
4.5.5. Membrane resistance ... 55
4.5.6. Characterization of the fouling layer ... 56
4.5.6.1. Culturable bacterial counts ... 56
4.5.6.2. Identification of the isolated bacteria ... 56
4.5.7. Determination of protein and carbohydrate content ... 57
4.5.8. Mineral analyses ... 57
4.5.9. Microscopy ... 58
4.5.9.1. Scanning electron microscopy ... 58
4.5.9.2. Confocal laser scanning microscopy ... 58
4.5.10. Statistical Analysis ... 58
4.6. Results and Discussion ... 59
4.6.1. Influence of biofouling on permeate flux ... 59
4.6.2. Influence of biofouling on membrane resistances ... 62
4.6.3. Influence of biofouling on fouling layer composition ... 63
4.6.3.1. Culturable bacteria ... 63
4.6.3.2. Protein, carbohydrate and mineral contents ... 66
4.6.3.3. Microstructure of the fouling layer ... 68
4.7. Conclusion ... 71
4.8. Acknowledgments ... 71
Chapitre 5 : Discussion générale ... 72
5.1. Retour sur les résultats ... 72
5.2. Retour sur l’hypothèse ... 73
5.3. Retour sur la méthodologie ... 73
5.3.1. Retour sur la méthodologie de l’objectif 1 ... 74
Conclusion et perspectives ... 80 Bibliographie ... 81
Liste des figures
Figure 1.1. Domaines de fractionnement, tailles de pores et pressions transmembranaires utilisées pour les
différents procédés baromembranaires ... 7
Figure 1.2. Évolution du flux de perméation selon la pression transmembranaire ... 12
Figure 1.3. Conséquences du colmatage des membranes d'ultrafiltration ... 15
Figure 1.4. Étapes de formation d’un biofilm ... 22
Figure 1.5. Facteurs qui modulent ou qui sont suspectés de moduler l'influence du colmatage bactérien sur les performances membranaires ... 27
Figure 3.1. Absolute (a) and normalized (b) flux during unstirred dead-end UF of 50 mL of sterile or inoculated NaCl, WPI and WP feed solutions ... 38
Figure 3.2. Absolute (a) and normalized (b) flux during unstirred dead-end UF of 50 mL of sterile or inoculated β-LG and α-LA feed solutions. ... 40
Figure 3.3. SEM images of membrane surfaces after unstirred dead-end UF of sterile (left) or inoculated (right) NaCl (A), WPI (B), WP (C), β-LG (D) and α-LA (E) solutions. ... 43
Figure 4.1. Absolute (a) and normalized (b) flux during 24-h crossflow ultrafiltration of whey solutions with and without sodium azide. ... 60
Figure 4.2. Culturable bacterial counts (CFU/mL) in whey solutions at the beginning (0 h) and end (24 h) of crossflow ultrafiltration ... 61
Figure 4.3. Total aerobic plate count (CFU/cm2) on the membrane surface after 24-h crossflow ultrafiltration of whey solutions ... 64
Figure 4.4. SEM images of the membrane surface after 24 h crossflow UF of whey solutions ... 69
Liste des tableaux
Tableau 1.1. Composition approximative du lactosérum doux et du lactosérum acide. ... 4
Tableau 1.2. Voies de valorisation du lactosérum ... 6
Tableau 1.3. Principales applications des procédés baromembranaires dans l'industrie laitière ... 9
Tableau 1.4. Principaux facteurs influençant le colmatage et moyens envisagés pour le réduire... 13
Table 3.1. Proximate composition of NaCl, WPI and WP feed solutions and permeate solutions after dead-end UF of sterile or inoculated solutions. ... 41
Table 3.2. Ash and mineral content of membranes after unstirred dead-end UF of NaCl, WPI and WP sterile or inoculated feed solutions. ... 42
Table 4.1. Proximate composition of model sweet whey solutions on a wet basis ... 53
Table 4.2. Membrane irreversible (Rirr) and reversible resistances (Rrev) with corresponding biofouling resistance (Rbio(irr), Rbio(rev)) of whey and deproteinized whey solutions, with and without sodium azide ... 62
Table 4.3. Identification of bacterial strains obtained from whey or the membrane surface ... 66
Liste des abréviations
ADNe ADN extracellulaireANOVA Analysis of variance
BCA Bicinchoninic acid
CLSM Confocal laser scanning microscopy
ConA Concanavalin A
DF Diafiltration
dNTP Deoxynucleotide
DW 0%-protein whey
EDTA Éthylènediaminetétraacétique
EPS Exopolymères (Exopolymeric substances) FITC Fluorescein isothiocyanate
GLM General linear models
HPLC High performance liquid chromatography
ICP-OES Inductively coupled plasma optical emission spectrometry
MF Microfiltration
MWCO Seuil de coupure (Molecular weight cut-off) N-DW 0%-protein whey without sodium azide
NEP Nettoyage-en-place
NF Nanofiltration
NPN Non-protein nitrogen
N-PW 0.8%-protein whey without sodium azide
OI Osmose inverse
PAN Polyacrylonitrile
PBM Procédé(s) baromembranaire(s)
PBS Phosphate-buffered saline
PC Polarisation de concentration
PCA Plate count agar
PCR Polymerase chain reaction
PES Polyéthersulfone (polyethersulfone)
PI Propidium iodide
PTM Pression transmembranaire
PVDF Polyfluorure de vinylidène (Polyvinylidene fluoride)
PW 0.8%-protein whey
RO Reverse osmosis
SA-DW 0%-protein whey supplemented with sodium azide
SA-PW 0.8%-protein whey supplemented with sodium azide
SDS Laurylsulfate de sodium
SEM Scanning electron microscopy
TMP Transmembrane pressure
TSB Bouillon tryptone-soja
UF Ultrafiltration
UHT Ultra-high temperature
WP Whey permeate
WPC Concentré de protéines de lactosérum (Whey protein concentrate) WPI Isolat de protéines de lactosérum (Whey protein isolate)
α-LA α-lactalbumin
Remerciements
Je tiens tout d’abord à remercier Alain Doyen, mon directeur de recherche, pour m’avoir accueilli dans son équipe de recherche et pour m’avoir si bien soutenu tout au long de ma maîtrise. Je suis très heureux de la confiance qu’il m’a accordée en me proposant ce projet qui paraissait si complexe à première vue. Alain a été un réel mentor tout au long de mon parcours. Il m’a toujours guidé vers la bonne voie tout en laissant libre cours à mes idées. Sans sa compréhension, sa grande disponibilité et son dynamisme, ma maîtrise n’aurait pas été aussi agréable. Je veux aussi remercier Steve Labrie, mon co-directeur de recherche, pour son point de vue de microbiologiste qui était essentiel à mon projet. Mes rencontres avec lui et les étudiants de son équipe ont toujours été une grande source d’inspiration pour mon projet et ont apporté beaucoup de solutions à mes problèmes. Un grand merci à Julien Chamberland et à Yves Pouliot pour leurs précieux conseils ainsi que pour avoir accepté de participer à l’élaboration de ce projet.
Je voudrais remercier tous les professionnels de recherche et tous ceux m’ayant offert un soutien technique, notamment Amélie Bérubé, sans qui mes expériences de filtration sur 24 heures n’auraient pas été possibles. Sa flexibilité, sa rigueur et sa bonne humeur m’ont grandement aidé à passer à travers ces longues journées (et nuits) de travail. Un grand merci à Véronique Perreault, Marie-Hélène Lessard et Diane Gagnon pour m’avoir aidé dans le développement des protocoles d’analyses et pour avoir répondu à mes si nombreuses questions. Je me dois aussi de souligner l’aide indispensable de Dany Boisvert et de Pascal Lavoie pour l’élaboration des systèmes de filtration. Je veux aussi remercier Alexandre Bastien, professionnel de recherche au département des Sciences animales, qui a pris de son temps pour ma formation au microscope confocal.
J’ai eu la chance de côtoyer deux équipes de recherche formidables. Un grand merci aux étudiants de l’équipe d’Alain et de Steve, qui ont apporté beaucoup de bonheur et de rires pendant mes journées au laboratoire. Leurs conseils et leur aide ont aussi été grandement appréciés.
Je voudrais remercier le Conseil de Recherches en Sciences Naturelles et en Génie du Canada (CRNSG) et le Fonds Québécois de la Recherche sur la Nature et les Technologies (FRQNT) pour mes bourses de recherche, la Fondation François-Bourgeois pour ma bourse d’admission à la maîtrise ainsi que la fondation Initia pour ma bourse d’excellence. Le projet n’aurait pas été possible sans le soutien financier du CRSNG, du Consortium de recherche et innovations en bioprocédés industriels au Québec (CRIBIQ), Saputo et Lactalis Canada.
Merci à mes parents et à ma soeur, qui ont toujours cru en moi et qui m’ont poussé à poursuivre mes rêves. Finalement, je remercie mon copain Thomas, qui a toujours été là pour me soutenir au quotidien.
Avant-propos
Ce projet de recherche a été réalisé au département des Sciences des aliments de la Faculté de l’Agriculture et de l’Alimentation à l’Université Laval, sous la direction du Dr. Alain Doyen et la co-direction du Dr. Steve Labrie. L’objectif du projet était de quantifier les baisses de performance causées par le colmatage bactérien lors de l’UF du lactosérum.
Dans le premier chapitre, l’état des connaissances en lien avec le sujet de l’étude est présenté sous la forme d’une revue de littérature. Des généralités sur le lactosérum et sur les procédés baromembranaires sont d’abord présentées, puis les principales utilisations de l’ultrafiltration pour la valorisation du lactosérum sont expliquées. Dans la section suivante, les principaux types de colmatage sont énumérés et leurs effets sur la performance du procédé sont explorés. Une attention plus particulière est accordée sur le colmatage bactérien dans la dernière section. L’hypothèse et les objectifs sont par la suite énoncés dans le deuxième chapitre. Le chapitre 3 présente les résultats du premier objectif du projet sous la forme d’un article scientifique intitulé «
Effect of Streptococcus thermophilus cell deposition on flux reduction during ultrafiltration of whey constituents
» et qui a été soumis pour publication dans l’International Dairy Journal le 23 septembre 2020. L’auteur de ce mémoire est responsable de la planification et de la réalisation des expérimentations ainsi que de la rédaction de l’article. Les co-auteurs de cet article sont Julien Chamberland, Yves Pouliot, Steve Labrie et Alain Doyen. Les résultats du deuxième objectif sont présentés au chapitre 4 sous la forme d’un article scientifique intitulé «
Contribution of biofouling to permeation flux decline and membrane resistance changes during whey ultrafiltration ». Cet article sera soumis pour publication dans l’International Dairy Journal. La contribution de
l’auteur du mémoire à la réalisation de cet article est identique à celle de l’article du chapitre 3. Les co-auteurs sont Amélie Bérubé, Julien Chamberland, Yves Pouliot, Steve Labrie et Alain Doyen.
Au chapitre 5, une discussion générale est présentée afin de mettre en synthèse les principaux résultats et répondre à l’hypothèse de recherche. Un retour sur la méthodologie est présenté afin d’offrir un regard critique sur les résultats et conclusions obtenus. Finalement, quelques perspectives de recherche sont proposées afin d’approfondir les connaissances acquises durant ce projet.
Introduction
En 2019, 92 millions d’hectolitres de lait ont été produits au Canada [1]. Les produits laitiers représentaient alors 12,6% de la valeur totale de tous les produits alimentaires manufacturés expédiés au pays, ce qui fait de la transformation laitière la deuxième industrie alimentaire canadienne en importance après celle de la viande rouge [2]. Pour cette même année, 510 300 tonnes de fromage ont été fabriquées [1], ce qui a engendré la production de près de 46 millions d’hectolitres de lactosérum, considérant que la production d’un kilogramme de fromage génère environ 9 L de lactosérum [3]. L’impact environnemental relié au rejet du lactosérum est tel que celui-ci doit être traité en usine d’épuration, ce qui entraîne des coûts élevés pour l’industriel [4]. Cette avenue n’est plus priorisée aujourd’hui puisque les protéines du lactosérum sont d’un grand intérêt nutritionnel et fonctionnel [5]. Par contre, il est difficile de valoriser le lactosérum sans le transformer, à cause de sa faible concentration en solides totaux et de son faible ratio protéines/lactose [4]. C’est pourquoi les procédés baromembranaires (PBM) sont maintenant couramment utilisés pour concentrer et séparer les solides du lactosérum, assurant ainsi un revenu supplémentaire aux transformateurs fromagers. L’avènement des PBM a permis au lactosérum, autrefois considéré comme un déchet, de devenir un co-produit à haute valeur ajoutée. L’ultrafiltration (UF) est le PBM le plus utilisé pour le traitement du lactosérum puisque ce procédé permet de concentrer les protéines sériques en éliminant l’eau, le lactose et les minéraux [4]. De nombreuses voies de valorisation du lactosérum ont ainsi émergé depuis l’installation de systèmes d’UF en industries laitières, comme la production de concentrés et d’isolats de protéines de lactosérum, de protéines sériques purifiées, de lactosérum en poudre, ou encore de lactose pur [6]. Les poudres de lactosérum et de protéines sériques ont une grande solubilité et possèdent de bonnes capacités moussantes, gélifiantes et émulsifiantes en plus d’être une source de protéines contenant tous les acides aminés essentiels et possédant une grande valeur biologique [5]. De ce fait, ces ingrédients ont été intégrés à une multitude d’aliments et de suppléments, comme les produits de boulangerie et de pâtisserie, les sauces, les boissons pour sportifs, les formules pour nourrisson, etc. [5].
Malgré les nombreuses opportunités qu’offrent l’UF pour la valorisation du lactosérum, son efficacité est limitée par les phénomènes de colmatage des membranes, causés notamment par les protéines sériques et le phosphate de calcium [7]. Les membranes colmatées ont une perméabilité plus faible, ce qui entraîne une baisse des flux de perméation, une augmentation de la consommation énergétique, du temps d’opération et des coûts, ainsi qu’une diminution du rendement [4,7]. Le colmatage chimique par les protéines et les minéraux a fait l’objet d’un nombre conséquent de recherches. Les mécanismes de colmatage sont ainsi bien connus, et de nombreuses stratégies ont été investiguées et appliquées pour atténuer ses effets [7]. Toutefois, le colmatage bactérien reste un problème majeur pour les industriels laitiers. Ce type de colmatage inclut à la
fois le dépôt de cellules microbiennes sur la membrane et la formation subséquente de biofilms [8]. Des études ont démontré la présence de biofilms sur des membranes industrielles laitières utilisées pendant plusieurs mois [9,10]. La résistance de ces biofilms aux procédures de lavage standards est très élevée [11] et dans certains cas, ceux-ci peuvent entraîner des problèmes de qualité et de salubrité majeurs dans les produits traités [12]. Dans les dernières années, la démocratisation de la métagénomique a permis d’obtenir un portrait global des écosystèmes bactériens sur les membranes, et d’étudier les facteurs ayant une influence sur la diversité de ces écosystèmes. Par exemple, Chamberland et al. [10,13–15] ont déterminé que la nature du fluide, le pré-traitement appliqué au fluide (pasteurisation, blanchiment), l’environnement, le matériau membranaire et la température de filtration pouvaient tous affecter la composition de l’écosystème bactérien sur les membranes. Ces auteurs ont par le fait même identifié certaines bactéries « pionnières », c’est-à-dire les premières bactéries à coloniser des membranes vierges en l’espace de quelques heures. Ils ont notamment souligné une problématique en lien avec les bactéries sporulantes du genre Bacillus, qui avaient tendance à rapidement dominer la surface des membranes à haute température de filtration (50 °C).
Bien que les recherches concernant les biofilms sur les membranes laitières soient en croissance, très peu d’information est disponible concernant les effets concrets du colmatage bactérien sur la performance, à court terme (24 h), du procédé d’UF utilisé pour la concentration des protéines du lactosérum. Il est pourtant reconnu que les cellules bactériennes déposées sur une membrane, ainsi que les biofilms générés, influencent négativement la performance des PBM en seulement quelques heures [16–21]. Notamment, Herbzerg et Elimelech [18] ont filtré des eaux usées synthétiques par osmose inverse (OI) pendant 24 h et ont observé une baisse de 80 % du flux de perméation lorsque le fluide était inoculé avec une culture viable de
Pseudomonas aeruginosa, contre 40 % lorsque les cellules de P. aeruginosa étaient non viables. Ces mêmes
auteurs ont également démontré que les cellules bactériennes non viables pouvaient tout de même diminuer les flux de perméation en augmentant le différentiel de pression osmotique à la surface de la membrane. Bien que les mécanismes de colmatage diffèrent entre l’OI et l’UF, il est tout à fait possible que le colmatage bactérien affecte aussi les performances de l’UF du lactosérum.
Par conséquent, ce projet de recherche vise à étudier l’effet du dépôt de cellules bactériennes et de la formation de biofilms sur la performance à court terme de l’UF du lactosérum. Ces résultats mettront en lumière l’importance relative du colmatage bactérien par rapport aux autres formes de colmatage du lactosérum et aideront ainsi les industriels à trouver des leviers de contrôle pour minimiser l’influence du colmatage bactérien sur la performance du procédé.
Chapitre 1 : Revue de littérature
1.1. Généralités sur le lactosérum
1.1.1. Sources et composition du lactosérum
Le lactosérum est un effluent laitier généré à la suite de la séparation de la phase colloïdale, c’est-à-dire des micelles de caséines, du lait. Les caséines peuvent être fractionnées du lait par acidification à leur point isoélectrique (pH de 4,6) à l’aide de ferments ou par ajout d’acides, par l’utilisation d’enzymes protéolytiques comme la présure, ou encore par microfiltration (MF) [5]. Les deux principales activités de transformation du lait générant du lactosérum sont la production fromagère et la production de caséines et caséinates [5]. Il est considéré que pour un kilogramme de fromage produit, environ 9 L de lactosérum sont générés [3] même si, dans le cas de la production fromagère, les rendements fromagers ont été améliorés au cours des années. Selon le procédé utilisé, deux principaux types de lactosérum sont générés, soient le lactosérum doux et le lactosérum acide.
Le lactosérum doux est le plus communément produit. Il est issu d’une coagulation enzymatique, comme lors de la fabrication de fromages fermes et semi-fermes (ex : cheddar), ou encore par MF du lait lors de la production de caséine micellaire [5,22]. Le pH du lactosérum est alors proche de la neutralité (6,0 à 6,5) [5]. Le lactosérum acide est quant à lui généré à la suite d’un processus de fermentation, par exemple lors de la fabrication de yogourt grec ou de fromage frais comme le cottage, ou par ajout direct d’acide lors de la production de caséines ou de caséinates. Son pH acide, en lien avec la production d’acide lactique par les bactéries lactiques, varie généralement entre 4,6 et 5,0 [5].
La composition du lactosérum est relativement semblable, qu’il soit doux ou acide [5]. Toutefois, le lactosérum acide contient généralement plus de calcium et de phosphate à cause de la plus grande solubilité des phosphates de calcium à faible pH. De plus, s’il provient d’un processus de fermentation, sa teneur en lactose est plus faible au détriment d’une concentration plus importante en acide lactique [5].
Tableau 1.1. Composition approximative du lactosérum doux et du lactosérum acide. Tiré et adapté de Bansal et Bhandari [5].
Lactosérum doux Lactosérum acide
Solides totaux (g/L) 63,0-70,0 63,0-70,0 Protéines (g/L) 6,50-6,60 6,10-6,20 Azote non-protéique (g/L) 0,27-0,37 0,30-0,40 Lactose (g/L) 46,0-52,0 44,0-47,0 Lipides (g/L) 0,20-0,50 0,30 Minéraux (g/L) 5,00-5,20 7,50-7,90 Calcium (g/L) 0,40-0,60 1,20-1,60 Phosphate (g/L) 0,50-1,00 2,00 Sodium (g/L) 0,50-0,53 0,50-0,51 Chlore (g/L) 1,10 1,10 Lactate (g/L) 2,00 6,40 pH 5,90-6,40 4,60-4,70 1.1.2. La valorisation du lactosérum
Le lactosérum a longtemps été considéré comme un sous-produit de la production fromagère ayant une valeur commerciale très faible. Au début du XXe siècle, les utilisations humaines étaient limitées, surtout à cause de
sa faible concentration en solides totaux et du manque de technologie pour concentrer ceux-ci [4]. S’il n’était pas jeté au drain, le lactosérum était le plus souvent utilisé en tant que supplément aux rations alimentaires des porcs et d’autres animaux d’élevage. Il pouvait aussi être épandu dans les champs en tant que fertilisant, occasionnant en parallèle une forte contamination des sols [5]. En effet, le lactosérum génère une demande biologique en oxygène variant entre 32 000 et 60 000 ppm [4], ce qui en fait un effluent excessivement polluant.
Dès les années 1930, les utilisations du lactosérum se sont raffinées. La première grande étape vers la concentration du lactosérum a été initiée lorsque des évaporateurs à flot grimpant à effet multiple ont été utilisés pour produire des concentrés de lactosérum contenant jusqu’à 45 % de solides totaux [3]. Dès 1937, le séchage par atomisation de concentrés de lactosérum permettait d’obtenir une poudre humide contenant de 10 à 14 % d’humidité, teneur qui était ensuite réduite de 3 à 5 % en séchant la poudre sur un lit fluidisé [3]. Toutefois, les poudres de lactosérum obtenues trouvaient peu d’utilisations spécialisées en lien avec le fort taux de dénaturation des protéines engendré par la chaleur des évaporateurs et leur faible solubilité dans l’eau [3]. Ce n’est véritablement qu’avec l’avènement des technologies de séparation membranaire dans le milieu
laitier, dans les années 1970, que les poudres de lactosérum atteindront des propriétés nutritionnelles et fonctionnelles intéressantes.
Le passage du lactosérum de « sous-produit » à « co-produit » de la fabrication fromagère s’explique par plusieurs facteurs. Parmi eux, citons l’augmentation massive de la production fromagère, l’avènement de règlements environnementaux plus stricts, l’avancée de la science et des technologies, ainsi que l’augmentation de la demande pour des produits d’intérêt nutritionnel pour les consommateurs [5]. Aujourd’hui, dans plusieurs pays, si le lactosérum n’est pas valorisé, il doit être traité en usine d’épuration, ce qui entraîne un coût élevé de manutention et de transport pour les industries laitières [23]. Malheureusement, à l’échelle mondiale, on estime qu’environ 50 % du lactosérum n’est toujours pas revalorisé [6,23].
Plusieurs voies de valorisation du lactosérum ont été développées au cours des années, les plus courantes ayant été listées au Tableau 1.2. Parmi ces voies, la séparation et la concentration des solides totaux sont les plus utilisées par l’industrie laitière [6,23], ce qui implique l’utilisation de PBM comme l’UF ou l’OI. Dans la majorité des cas, les PBM sont donc essentiels à la valorisation du lactosérum. Cependant, la concentration des lactosérums par les PBM, en particulier par UF, a généré un nouveau coproduit, le perméat de lactosérum, dont les voies de valorisation sont plus restreintes du fait notamment de sa haute teneur en lactose et de l’absence de protéines. Néanmoins, ce coproduit riche en minéraux est considéré comme une source intéressante d’électrolytes [6]. De plus, la bioconversion et la production de lactose et ses dérivés sont souvent utilisées pour valoriser le perméat de lactosérum suite à la production de concentrés protéiques [23].
Tableau 1.2. Voies de valorisation du lactosérum
Voie de valorisation Produits générés Principaux procédés impliqués Réf.
Séparation des solides totaux
WPC et WPI Ultrafiltration, diafiltration, évaporation et atomisation [6] Poudre de perméat d’UF Ultrafiltration, évaporation et atomisation [6] Poudre de lactosérum
déminéralisée
Nanofiltration, chromatographie à échange d’ions, électrodialyse,
évaporation et atomisation [6] Protéines pures (β-lactoglobuline,
α-lactalbumine, sérumalbumine
bovine, etc.) Ultrafiltration et chromatographie [6] Concentration des solides
totaux Lactosérum en poudre Osmose inverse, évaporation et atomisation [6]
Bioconversion
Éthanol Fermentation alcoolique du lactose [23,24]
Méthane (biogaz) Biométhanisation [25,26]
Acides organiques Fermentation du perméat d’UF [27–29]
Lactose et dérivés
Lactose pur
Ultrafiltration, chromatographie à échange d’ions, osmose inverse et
atomisation [6]
Lactitol Hydrogénation catalytique du lactose [30] Lactulose Isomérisation du lactose en milieu alcalin [31] Galacto-oligosaccharides Galactosylation du lactose à l’aide de β-galactosidase microbienne [32,33]
Les applications alimentaires des divers produits issus de la valorisation du lactosérum sont nombreuses. Les poudres de WPC et WPI possèdent plusieurs propriétés fonctionnelles intéressantes, notamment une grande moussabilité, une solubilité importante sur une large gamme de pH ainsi que de bonnes capacités émulsifiantes, de gélation et de modulation de la texture [3,5]. Ces poudres peuvent être ajoutées notamment dans les produits de boulangerie et de pâtisserie, les sauces, les suppléments alimentaires, les mayonnaises, les crèmes glacées, les produits de fromage fondu, les formulations pour nourrissons, les aliments et boissons pour sportifs [3,5]. Le lactosérum est également reconnu pour la grande qualité nutritionnelle de ses protéines, qui contiennent tous les acides aminés essentiels et qui possèdent une valeur biologique très élevée, comparable à celles de l’œuf [5,6]. Plusieurs propriétés nutraceutiques ont également été attribuées au lactosérum, comme la réduction du risque d’obésité, de diabète et même de cancer (études réalisées sur des modèles murins), la régulation du microbiote intestinal, ainsi que la stimulation du système immunitaire [5,6].
Le lactose peut être utilisé comme ingrédient alimentaire ou comme agent de remplissage dans les médicaments [6]. Parmi les dérivés du lactose, le lactitol agit à titre d’édulcorant alors que le lactulose et les galacto-oligosaccharides sont des prébiotiques bifidogéniques [30,31,33]. Finalement, actuellement, la production de biogaz par méthanisation semble une voie intéressante de valorisation des perméats de lactosérum.
1.2. Les procédés baromembranaires
1.2.1. Généralités
Les PBM, qui permettent de séparer des molécules en utilisant des membranes semi-perméables sous l’effet d’une pression transmembranaire (PTM), sont séparés en quatre catégories selon la taille des pores membranaires. Le procédé permettant le rejet des molécules les plus volumineuses est la microfiltration (MF), suivi de l’ultrafiltration (UF), la nanofiltration (NF) et l’osmose inverse (OI), ce dernier procédé ne laissant passer que les molécules d’eau ou de solvant à travers la membrane [34].
Figure 1.1. Domaines de fractionnement, tailles de pores et pressions transmembranaires utilisées pour les différents procédés baromembranaires. Tiré de Hausmann et al. [35]
Le fonctionnement des PBM peut être effectué en régime d’écoulement frontal ou tangentiel. Dans un régime d’écoulement frontal, le fluide filtré entre en contact avec la membrane de façon perpendiculaire et ne peut passer ailleurs qu’au travers de celle-ci [36]. Un désavantage majeur de ce type de régime d’écoulement est qu’il doit être effectué en mode discontinu [35]. Dans la très grande majorité des applications industrielles, les PBM sont effectués en régime d’écoulement tangentiel. Le fluide filtré circule alors de manière parallèle à la membrane. En plus de permettre une opération continue, ce régime limite le colmatage à la surface de la membrane [35].
La force motrice des PBM est la différence de pression entre les deux parois de la membrane (PTM) [35]. Pour les PBM en mode tangentiel, elle peut être calculée selon l’équation suivante [35] :
𝑃𝑇𝑀 =𝑃𝑓+𝑃𝑟
2 − 𝑃𝑝 (1)
où Pf, Pr et Pp représentent la pression du côté du fluide à filtrer (feed), du rétentat et du perméat,
respectivement. L’application de cette force motrice entraîne la perméation d’une partie du fluide à travers la membrane : ce phénomène est mesuré par le flux de perméation (J), qui est défini comme étant la quantité de perméat récoltée (V) par unité de temps (t) et de surface membranaire (A) [35], selon l’équation 2.
𝐽 = 𝑉
𝐴∙𝑡 (2)
Le flux peut être exprimé sous forme massique (kg∙m-2∙h-1
)
ou volumétrique (L∙m-2∙h-1). Pour un fluide purcomme l’eau, une augmentation de la PTM entraîne une augmentation proportionnelle du flux de perméation. Cependant, lors de la filtration de fluides complexes, l’augmentation de la PTM induit une augmentation du flux jusqu’à une valeur de flux limite visualisée par l’atteinte d’un plateau [37]. Ce phénomène, appelé polarisation de concentration, sera détaillé plus loin.
1.2.2. L’utilisation des procédés baromembranaires en industrie laitière
L’utilisation des PBM dans le domaine laitier s’est développée dans les années 1960 et leur popularité s’explique par les nombreux avantages qu’ils procurent comparativement aux procédés traditionnels de séparation, comme la distillation, l’évaporation ou la cryoconcentration. Notamment, les PBM sont reconnus comme étant plus abordables, moins énergivores et nécessitant moins d’espace [38]. Le Tableau 1.3 présente leurs principales applications.
Tableau 1.3. Principales applications des procédés baromembranaires dans l'industrie laitière
Procédé baromembranaire Applications Réf.
Microfiltration
Débactérisation du lait [39]
Standardisation du lait en caséines [40]
Récupération du gras et des saumures [40]
Délipidation du lactosérum [41]
Ultrafiltration
Pré-concentration du lait à la ferme [39]
Standardisation du lait en protéines pour la production fromagère [40] Concentration du lait pour la production de yogourt et de yogourt grec [42] Concentration du lait pour la fabrication fromagère [40]
Production de pré-fromages [40]
Production de concentrés protéiques de lait (MPC) [43]
Fractionnement des protéines sériques [41]
Concentration des protéines sériques [41]
Nanofiltration
Pré-concentration du lait à lait ferme [39]
Déminéralisation partielle du lactosérum ou du perméat d'UF de lactosérum [41] Concentration du lactosérum et du perméat d'UF de lactosérum [41]
Osmose inverse
Pré-concentration du lait à lait ferme [39]
Récupération des eaux de lavage et des eaux blanches [44] Récupération de l'eau des filtrats et des condensats de fluides laitiers [44] Concentration du lactosérum et du perméat d'UF de lactosérum [41]
1.2.3. L’ultrafiltration pour la valorisation du lactosérum
L’UF utilise des membranes ayant un seuil de coupure (molecular weight cut-off, MWCO) compris entre 1 et 300 kDa et qui opère à des pressions allant jusqu’à 1000 kPa [38]. Les protéines, les lipides et les microorganismes sont pour la plupart retenus par la membrane, alors que les sucres et les minéraux peuvent la traverser [34]. La concentration des protéines du lactosérum s’effectue à l’aide de membranes ayant un MWCO d’environ 10 kDa [45] et la température optimale de filtration est autour de 50 °C [46].
L’UF est le PBM le plus utilisé dans l’industrie laitière [22]. Les premières utilisations de l’UF dans ce domaine remontent au début des années 1970 avec la concentration du lactosérum issu de la transformation fromagère et la pré-concentration du lait de fromagerie [4,38]. D’autres applications actuelles de l’UF incluent la concentration du lait de consommation, la fabrication de yogourt riche en protéines de type yogourts grecs, la
pré-concentration du lait à la ferme pour faciliter son transport et la fabrication d’isolats de protéines du lait [4]. Aujourd’hui, la valorisation des protéines de lactosérum issues de la transformation fromagère, par concentration ou fractionnement, est l’utilisation la plus importante de l’UF dans l’industrie laitière [4,38]. La concentration des protéines sériques par UF combinée à la diafiltration (DF) et au séchage par atomisation permet la production de concentrés et d’isolats de protéines du lactosérum (whey protein concentrate, WPC;
whey protein isolate, WPI) [5]. Les WPC contiennent entre 35 et 80 % de protéines sériques alors que les WPI
en contiennent plus de 90 % [41]. L’UF peut aussi être appliquée pour la déminéralisation du lactosérum avant la fabrication de WPC ou de WPI, ainsi que pour le fractionnement des protéines sériques (α-lactalbumine, β-lactoglobuline, immunoglobulines, etc.) [41].
Le matériau membranaire le plus utilisé pour l’UF de fluides laitiers est le polysulfone, un polymère de faible coût, résistant à des températures allant jusqu’à 120 °C et à des valeurs de pH entre 1 et 14, et possédant de bonnes propriétés mécaniques [38,47]. La plupart de ces membranes sont utilisées sous une configuration spiralée ou à fibres creuses. Les membranes spiralées sont avantageuses lors de la filtration de fluides peu concentrés comme le lactosérum, car elles ont une résistance supérieure aux hautes pressions (environ 10-13 bar) [4,38]. D’un autre côté, les membranes à fibres creuses permettent un flux plus important et sont donc pratiques pour la filtration de fluides concentrés [38].
L’UF seule ne permet pas de concentrer le lactosérum à plus de 24 % de solides totaux à cause des phénomènes de polarisation de concentration et de colmatage, qui entraînent une réduction réversible ou même permanente des flux de perméation [38]. La combinaison de l’UF et de la DF permet d’augmenter légèrement la concentration en solides totaux, à environ 28 % [38]. Le lactosérum est responsable de problématiques de colmatage encore plus importantes que le lait écrémé, ce qui peut s’expliquer par deux principaux facteurs [4,38] : premièrement, les caséines du lait, sous forme de micelles sphériques volumineuses (10-100 nm), sont plus facilement détachées de la surface de la membrane que les protéines sériques. De plus, ces caséines lient une partie du calcium, ce qui diminue la formation de ponts calciques entre les protéines sériques et la membrane. La sévérité du colmatage causé par le lactosérum explique qu’un nombre conséquent de recherches ont été effectuées dans les dernières décennies pour comprendre les causes et les mécanismes du colmatage et pour développer des moyens de le contrôler.
1.3. Le colmatage
Les membranes d’UF sont très susceptibles au colmatage lors de la filtration de fluides alimentaires. Plus spécifiquement, le colmatage peut être divisé en deux catégories, soit le colmatage réversible et irréversible. Le colmatage réversible est causé par le phénomène de polarisation de concentration alors que le colmatage
irréversible est engendré par l’adsorption ou la précipitation de particules, par un blocage des pores membranaires et/ou par la formation de couches de particules (gâteau) en surface de la membrane [37].
1.3.1. La polarisation de concentration
Lors de la filtration de l’eau pure, le flux de perméation est directement proportionnel à la PTM. Par contre, lors de la filtration de fluides complexes, l’augmentation de la PTM induit une augmentation linéaire du flux de perméation jusqu’à l’atteinte d’un plateau, visualisé par l’atteinte d’un « flux limite » [37]. À faible PTM, le flux est contrôlé par la vitesse de perméation du fluide à travers la membrane. Lorsque la PTM est augmentée, les solutés présents dans le fluide sont en partie rejetés par la membrane et s’accumulent à sa surface, créant ainsi une couche concentrée en solutés (couche limite). Ce phénomène, appelé polarisation de concentration (PC), induit une diffusion des solutés de la surface membranaire vers le fluide à filtrer (rétrodiffusion) et une résistance au transfert de masse des solutés à travers la membrane. À forte PTM, le flux est alors contrôlé uniquement par des phénomènes de transfert de masse [37] (Figure 1.2). L’atteinte du flux limite peut être retardée en augmentant la température d’opération et la vélocité du fluide ou en diminuant sa concentration en solutés [37]. Le phénomène de PC intervient dès les premières minutes de filtration, occasionnant une baisse immédiate du flux de perméation [37,38]. En filtration tangentielle, la PC n’augmente généralement pas avec le temps, ce qui signifie que les flux de perméation restent stables (en absence de tout autre phénomène de colmatage), alors qu’en filtration frontale, la PC augmente continuellement, causant une baisse continue des flux de perméation [37]. Après la filtration, un simple rinçage à l’eau suffit pour rétablir la performance de la membrane. De ce fait, la PC est considérée comme une forme de colmatage réversible. La couche de polarisation peut être visqueuse voire gélatineuse selon le type de solutés, ce qui lui confère parfois le nom de couche de gel ou de gâteau, qu’il ne faut pas confondre avec le gâteau formé en cours de filtration et causant un colmatage irréversible [4]. Ce concept sera d’ailleurs détaillé dans la section 1.3.2. En filtration tangentielle, la PC peut être quantifiée par le modèle du film (film model), qui décrit le transfert de masse comme étant la différence entre la vitesse de rétrodiffusion des solutés et la vitesse de perméation de ces solutés à travers la membrane [37].
Outre le modèle du film, différents modèles ont été développés pour quantifier plus précisément la PC selon les solutions filtrées. En présence de colloïdes, comme les micelles de caséines, ou de macromolécules, comme les protéines sériques, il est possible que la concentration de ces solutés à la surface de la membrane dépasse leur solubilité et qu’il se forme un gel. Le transfert de masse est alors décrit selon le modèle de polarisation par gel (gel polarisation model) [37]. D’un autre côté, en présence de solutés de faible poids moléculaire, comme les sucres ou les minéraux, le transfert de masse est plutôt contrôlé par la différence entre la PTM et le différentiel de pression osmotique des solutés de part et d’autre de la membrane (osmotic
Figure 1.2. Évolution du flux de perméation selon la pression transmembranaire. Tiré de Cui et al. [48]
La polarisation de concentration a notamment été observée lors de la filtration de lait écrémé [4,7,49], de lactosérum acide [50] et de lactosérum doux [51,52]. Par exemple, Cheryan et Kuo [50] ont étudié la relation PTM-flux lors de l’UF de lactosérum de fromage cottage avec des membranes à fibres creuses et spiralées. En dessous de 150 kPa, le flux augmentait proportionnellement à la PTM et était indépendant du débit. À des PTM plus élevées, le flux atteignait un plateau, surtout à faible débit.
1.3.2. Le colmatage irréversible
Le colmatage irréversible est un phénomène d’encrassement de la membrane dû à un dépôt de particules solubles ou en suspension à sa surface occasionnant des baisses de performance du procédé, comme une diminution des flux de perméation, ainsi que des altérations de la membrane, comme une baisse de sa sélectivité [37,48]. Seul un nettoyage ou un remplacement de la membrane permet de rétablir sa performance initiale. La formation d’une couche de colmatage sur la membrane peut être visualisée via l’atteinte du flux critique, soit la valeur de flux au-dessus de laquelle le flux diminue au cours du temps à PTM constante [53]. Il est aussi possible d’évaluer le flux critique en augmentant graduellement la PTM. Le flux critique correspond alors à la valeur de flux pour laquelle la perte de linéarité entre la PTM et le flux de perméation est observée, valeur généralement atteinte avant le flux limite [37] (Figure 1.2). Lorsque la section linéaire de la relation PTM-flux suit celle de l’eau pure, le flux critique est alors dit « fort ». Lorsque la PTM augmente plus rapidement que lors de la filtration de l’eau pure, on parle plutôt de flux critique « faible » [54].
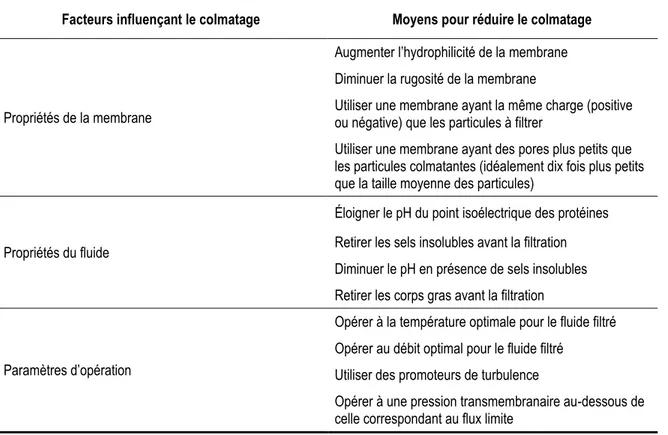
Le colmatage peut être plus ou moins sévère selon les propriétés de la membrane et du fluide ainsi que selon les paramètres d’opération. Les principaux facteurs influençant le colmatage, ainsi que les moyens utilisés pour le réduire, sont énumérés au Tableau 1.4 [4].
Tableau 1.4. Principaux facteurs influençant le colmatage et moyens envisagés pour le réduire
Facteurs influençant le colmatage Moyens pour réduire le colmatage
Propriétés de la membrane
Augmenter l’hydrophilicité de la membrane Diminuer la rugosité de la membrane
Utiliser une membrane ayant la même charge (positive ou négative) que les particules à filtrer
Utiliser une membrane ayant des pores plus petits que les particules colmatantes (idéalement dix fois plus petits que la taille moyenne des particules)
Propriétés du fluide
Éloigner le pH du point isoélectrique des protéines Retirer les sels insolubles avant la filtration Diminuer le pH en présence de sels insolubles Retirer les corps gras avant la filtration
Paramètres d’opération
Opérer à la température optimale pour le fluide filtré Opérer au débit optimal pour le fluide filtré
Utiliser des promoteurs de turbulence
Opérer à une pression transmembranaire au-dessous de celle correspondant au flux limite
1.3.2.1. Les mécanismes de colmatage
Le phénomène de colmatage irréversible est induit via divers mécanismes, soit l’adsorption de particules sur la membrane, le blocage des pores, la précipitation et la formation d’un gâteau de particules [37]. Le mécanisme de colmatage dépend de la nature des substances colmatantes et de la taille des pores de la membrane. Quatre grands types de particules colmatantes sont dénombrés : les colloïdes (particules en suspension), les molécules organiques (protéines, acides humiques, polysaccharides), les minéraux insolubles (calcium, silice, phosphore, sulfate, fer) et les microorganismes (cellules bactériennes et formation de biofilms) [55].
Le mécanisme d’adsorption est surtout induit en présence de molécules organiques, comme les protéines, et est causé par des interactions électrostatiques et hydrophobes avec la membrane [37]. Les protéines colmatent les membranes d’abord en s’adsorbant à leur surface (interactions membrane-protéine), puis les protéines s’accumulent en plusieurs couches dues à des interactions hydrophobes et des ponts disulfure (interactions protéine-protéine) [7]. Le calcium peut aussi s’adsorber à la surface de la membrane en créant des ponts entre la membrane et les protéines [37].
Le blocage des pores est courant en UF et en MF, à cause de la grande taille de ceux-ci (>2 nm). La plupart des substances colmatantes, selon leur taille et leur affinité pour la membrane, peuvent bloquer les pores, soit
en pénétrant à l’intérieur des pores ou en bouchant partiellement ou complètement leur ouverture [48,55]. Différents modèles mathématiques ont été développés pour prédire les flux de perméation en présence de blocage interne, partiel ou complet des pores [4,48].
La précipitation de minéraux est causée par leur accumulation dans la couche de polarisation à la surface de la membrane, à des concentrations qui dépassent leur seuil de solubilité [55]. La précipitation du calcium est aussi favorisée par des valeurs de pH et de température élevées [7]. Les minéraux peuvent précipiter autant à la surface de la membrane qu’à l’intérieur des pores [55,56].
La formation d’un gâteau de particules (cake layer) est causée par le dépôt d’une ou plusieurs couches de substances colmatantes sur la membrane, comme des colloïdes, des molécules organiques ou des bactéries. Le modèle de filtration du gâteau (cake filtration model) assume que les particules couvrent la totalité de la surface de la membrane et que le gâteau continue de croître en fonction du volume de perméat récolté [4]. La résistance spécifique du gâteau peut augmenter à cause d’interactions entre les composés colmatés ou avec la membrane, ou encore à cause de la compression du gâteau au cours du temps, réduisant sa porosité [37]. Lors de la filtration d’un fluide complexe, la baisse lente du flux de perméation après l’atteinte d’un plateau (steady-state) est souvent expliquée par une compression du gâteau [37].
1.3.2.2. Le modèle des résistances en série
Le modèle des résistances en série est une autre méthode permettant de quantifier les effets du colmatage membranaire réversible et irréversible. Ces phénomènes peuvent être représentés par des résistances additionnelles au passage du fluide à travers la membrane. Dans un cas idéal comme la filtration de l’eau pure, le flux de perméation peut être représenté par l’équation suivante, dérivée de la loi de Darcy [4] :
𝐽 = 𝛥𝑃
𝜇𝑅𝑀 (1)
où ΔP est la PTM, RM est la résistance intrinsèque de la membrane au transfert de masse et µ est la viscosité
du perméat. Lors de la filtration de fluides complexes, les phénomènes de PC et de colmatage irréversible entraînent une augmentation de la résistance membranaire, qui est alors représentée par l’équation suivante :
𝑅′𝑀= 𝑅𝑀+ 𝑅𝑃𝐶+ 𝑅𝐹 (2)
Où R’M est la résistance totale de la membrane, RPC est la résistance causée par la PC et RF est la résistance
causée par le colmatage irréversible. À pression, température, débit et concentration constants, RPC est
constante, ce qui permet de corréler la baisse du flux de perméation avec une augmentation de RF [4]. Cette
de colmatage (adsorption, blocage des pores, etc.) [37]. Il est également possible d’attribuer une valeur de résistance pour chaque type de particule colmatante. Par exemple, lors de la filtration de boues activées, des auteurs ont attribué des résistances individuelles aux solides en suspension, aux colloïdes, et aux particules en solution. La somme de ces résistances est égale à la résistance totale de la couche de colmatage (RF) [57].
Le fractionnement des résistances permet d’évaluer de façon simple la contribution de chaque type de colmatant, mais un désavantage de ce modèle est qu’il néglige les effets d’interactions entre ces colmatants [57].
Chiang et Cheryan [49] ont mesuré des valeurs de RPC et de RF respectivement 4 et 23 fois supérieures à la
valeur de RM lors de l’UF de lait écrémé. Lors de l’UF de lactosérum avec membranes à fibres creuses,
Cheryan et Kuo [50] ont mesuré une valeur de RF plus de cinq fois supérieure à la valeur de RM, alors que la
résistance associée à la PC était nulle puisque le flux était dépendant de la PTM.
1.3.3. Effets du colmatage sur la performance de l’ultrafiltration
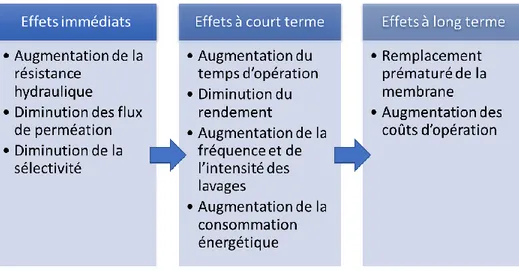
Le colmatage des membranes entraîne une baisse presqu’immédiate de la performance de l’UF, ce qui engendre de nombreuses conséquences à moyen et long terme sur les opérations industrielles, telles qu’énumérées à la Figure 1.3 [4,7].
Figure 1.3. Conséquences du colmatage des membranes d'ultrafiltration
L’accumulation de solides à la surface de la membrane augmente la résistance de celle-ci, entraînant une baisse des flux de perméation. Cette baisse de flux entraîne à son tour plusieurs problématiques opérationnelles puisque le système de filtration doit être opéré plus longtemps ou à des pressions plus élevées pour compenser le faible flux de perméation. Les nettoyages sont aussi plus fréquents ou plus agressifs, ce qui contribue d’autant plus à diminuer la durée de vie des membranes, notamment celles en
acétate de cellulose à cause de leur faible tolérance aux valeurs de pH extrêmes, au chlore et aux températures élevées [4]. Lorsque les nettoyages ne sont plus suffisants pour rétablir le flux initial, la membrane doit être remplacée. Ultimement, toutes ces conséquences ont un coût élevé pour l’industriel. Au niveau de la performance du procédé, le colmatage affecte non seulement la résistance de la membrane et les flux de perméation, mais aussi sa sélectivité. Le facteur de rétention (Rf) est défini selon l’équation suivante
[48] :
𝑅𝑓 = 1 − 𝐶𝑃
𝐶𝑅 (3)
Où CP et CR représentent la concentration d’un composé donné dans le perméat et dans le rétentat,
respectivement. La couche de colmatage peut agir comme une seconde membrane (souvent appelée membrane « dynamique »), ce qui peut rétrécir les pores et ainsi augmenter le facteur de rétention de différents composés qui devraient normalement traverser la membrane. Si le perméat est d’intérêt commercial, le rendement est alors affecté [4].
1.3.4. Colmatage lors de l’ultrafiltration du lactosérum
Trois grands types de colmatage influencent négativement les performances membranaires lors de l’UF du lactosérum : le colmatage organique, minéral et microbiologique [58]. Dans l’industrie laitière, ce sont les dépôts organiques et minéraux qui sont les plus problématiques [7,59]. Le colmatage organique par le lactosérum est majoritairement causé par le dépôt et l’adsorption de protéines à la surface de la membrane [7]. La matière grasse et le lactose causeraient peu de colmatage lors de l’UF, puisque ces molécules sont non chargées [37]. Toutefois, le dégraissage du lactosérum par MF permettrait d’augmenter légèrement le flux [7].
Le colmatage par les protéines sériques a notamment été observé sur des membranes d’OI [60,61] et d’UF [45,52,56], causant des baisses du flux de perméation. Lors de l’UF d’un lactosérum acide, Merin et Cheryan [56] ont déterminé que l’α-lactalbumine serait responsable de la perte de flux dans les premières minutes d’opération à cause de son faible poids moléculaire lui permettant de boucher l’intérieur des pores. La
β-lactoglobuline, sous forme d’octamères volumineux capables de « rouler » à la surface de la membrane,
serait plutôt responsable du colmatage à long terme. Au début de la filtration, les interactions hydrophobes et électrostatiques entre les protéines et la membrane favorisent l’adsorption des protéines sous forme de monocouche [7]. Des interactions protéines-protéines (ponts disulfures et interactions hydrophobes) peuvent ensuite entraîner la formation d’un gâteau composé de multiples couches de protéines [7,37]. Fane et al. [62] ont mesuré l’équivalent de 100 à 400 monocouches de sérumalbumine bovine sur des membranes d’UF.
L’utilisation de membranes chargées négativement s’est avérée efficace pour diminuer le colmatage protéique lors de l’UF de lactosérum doux du fait de phénomènes de répulsions électrostatiques entre la surface membranaire et les protéines [63]. Des résultats similaires ont été obtenus avec des membranes en polyéthersulfone (PES) et en polyfluorure de vinylidène (PVDF) contenant des nanoparticules métalliques hydrophiles [64,65].
Le colmatage minéral est principalement causé par la précipitation de phosphates de calcium et par les interactions membrane-protéines-phosphates [7,66]. Merin et Cheryan [56] ont mesuré le dépôt de minéraux sur des membranes d’UF suite à leur trempage dans un ultrafiltrat de lait simulé. Le dépôt était environ deux fois plus important à pH 7,0 qu’à pH 3,0 à cause de la diminution de la solubilité des sels à pH élevé. Taddei et
al. [67] ont observé la précipitation de phosphate de calcium lors de l’UF de lactosérum doux, ce qui a causé
une baisse importante du flux. Un phénomène similaire a été observé notamment par Kuo et Cheryan [68] et Daufin et al. [51]. Lors de la filtration du lactosérum, le flux est minimal à environ 30 °C [4]. En dessous de cette température, le colmatage minéral est limité par l’augmentation de la solubilité du phosphate de calcium. Au-dessus de 30 °C, la baisse de viscosité et l’augmentation de la diffusivité ont un effet plus important que la faible solubilité du phosphate de calcium, ce qui entraîne une augmentation nette du flux [4]. L’augmentation de la solubilité du phosphate de calcium par diminution du pH, ainsi que la séquestration du calcium à l’aide d’EDTA ou d’acide citrique, sont des moyens efficaces pour augmenter le flux lors de l’UF du lactosérum doux ou acide [66,68–70]. Ces traitements pourraient agir à la fois sur la réduction de la précipitation du phosphate de calcium, sur le changement de configuration des protéines (en modifiant l’équilibre protéines-phosphate de calcium) et sur la capacité du phosphate de calcium à agir comme ligand entre la membrane et les protéines [56,69]. Un traitement du lactosérum doux ou acide à la chaleur peut également diminuer le colmatage en stabilisant les complexes calcium-protéine. Dans cette optique, divers barèmes temps-températures (30-90 min à 50-60 °C ou 15 s à 72-85 °C) ont été proposés [4].
Les pré-traitements appliqués aux fluides laitiers avant leur filtration (chauffage, ajout d’agents séquestrants, microfiltration) sont surtout destinés à réduire le colmatage protéique et minéral [71], alors que leur charge bactérienne peut être considérable. Par exemple, du lactosérum de cheddar peut contenir 105 – 106 UFC/mL
avant pasteurisation et 102 UFC/mL après pasteurisation [13]. Pourtant, peu d’études ont étudié l’effet de cette
1.4. Le colmatage bactérien
1.4.1. Définition
Le terme « biofouling » est largement utilisé pour décrire le phénomène d’encrassement des membranes par les microorganismes et leurs exopolymères (exopolymeric substances, EPS) [58,72,73]. De nombreux auteurs se sont penchés sur l’étude de la production d’EPS et la formation subséquente de biofilms sur les membranes de filtration. Pourtant, la seule présence d’une charge microbienne dans le fluide à filtrer peut être la cause d’une baisse de flux [18,20]. Le colmatage bactérien est donc un processus graduel, qui débute avec le dépôt de cellules bactériennes suivi de la formation de biofilms [8,72].
1.4.2. Colmatage par le dépôt de cellules bactériennes
Le dépôt et le transport de bactéries ou de levures à la surface des membranes s’effectuent par les mêmes mécanismes que le dépôt de molécules organiques, soit par des facteurs hydrodynamiques (convection, diffusion brownienne, force de cisaillement, portance) et par des interactions hydrophobes et électrostatiques avec la membrane [74]. Les bactéries peuvent être considérées comme des particules colloïdales en suspension et le colmatage par le dépôt de bactéries est alors dominé par le blocage des pores et la formation d’un gâteau [54,75].
Plusieurs études ont démontré que le dépôt de levures ou de bactéries peut diminuer la performance de différents procédés membranaires comme la MF en mode frontal [21,75–80], la MF en mode tangentiel [20,81–84], l’UF [54,74] et l’OI [18,19]. Ces cellules microbiennes peuvent engendrer à la fois un colmatage réversible et irréversible [54].
La MF de suspensions bactériennes en mode frontal a notamment permis de déterminer que la concentration, la taille, la forme et la composition de la paroi des cellules influencent la résistance spécifique du gâteau de cellules et que celui-ci est compressible, c’est-à-dire que sa résistance spécifique augmente avec la pression [21,57]. La compressibilité des gâteaux de cellules a aussi été validée en MF tangentielle [81,84]. Tanaka et
al. [20] ont observé une diminution du flux de perméation lors de MF en mode frontal et tangentiel de
suspensions de Corynebacterium glutamicum et de différentes espèces de Bacillus. Le dépôt de C.
glutamicum, une bactérie ellipsoïdale, avait la même résistance spécifique en filtration frontale qu’en filtration
tangentielle. D’un autre côté, la forme en bâtonnets des Bacillus a eu pour effet d’aligner les cellules dans le sens de la circulation du fluide, ce qui a augmenté la résistance de la couche bactérienne et aggravé la baisse de flux. De plus, l’augmentation de la concentration bactérienne a diminué le flux, alors que la variation du débit et de la PTM n’a pas eu d’effet.
Les gâteaux de cellules peuvent être considérés comme des couches de cellules se superposant à la surface de la membrane. Avant l’obtention d’une monocouche de cellules couvrant la quasi-totalité de la membrane, les cellules n’ont que très peu d’influence sur les flux de perméation [84]. Riesmeier et Kroner [81] ont qualifié de « couches secondaires » le dépôt de cellules d’Escherichia coli sur des membranes de MF en mode tangentiel. Ces couches mesuraient entre 0,4 et 40 µm selon la PTM, la concentration en cellules, le débit et la géométrie du module. Les flux de perméation diminuaient lorsque la concentration en cellules, la PTM et la longueur du canal d’écoulement étaient élevées et lorsque le débit était faible. Wang et al. [74] ont quant à eux obtenu l’équivalent de quatre couches de cellules de Saccharomyces cerevisiae sur des membranes d’UF en mode frontal en l’espace de quelques heures.
Comme pour tout composé colmatant, les cellules microbiennes entraînent une perte de linéarité dans la relation flux-TMP. Wang et al. [74] ont déterminé une valeur de flux critique au-dessus duquel l’attachement de cellules de S. cerevisiae était majoritairement irréversible en UF frontale. Dans une étude similaire [54], il a été démontré que le flux critique lors de l’UF en mode tangentiel de suspensions de S. cerevisiae diminuait en fonction du logarithme de la concentration en cellules. De plus, les cellules n’avaient aucun impact sur les performances du procédé dans la zone sous-critique.
En OI, les cellules bactériennes diminueraient le flux en empêchant partiellement la rétrodiffusion des sels de la surface de la membrane vers la solution, augmentant ainsi la pression osmotique à la surface de la membrane [18]. Li et al. [17] ont aussi observé que la PC augmentait avec la concentration en cellules de
Pseudomonas aeruginosa sur des membranes d’OI.
Le dépôt de cellules n’a pas toujours un effet négatif sur la performance du procédé. Au contraire, certaines études ont démontré que des cellules de levures déposées sur des membranes de MF pouvaient agir comme « pré-filtres » lors de la filtration frontale ou tangentielle de solutions protéiques, empêchant l’encrassement des membranes par les protéines agrégées tout en maintenant la transmission des protéines à des niveaux satisfaisants [80,83,85]. Par contre, cet effet positif était valide seulement à de faibles concentrations de cellules, de plus hautes concentrations occasionnant une baisse des performances.
Ces études démontrent ainsi la capacité des cellules microbiennes à bloquer les pores des membranes et à former une couche de particules compacte. À plus long terme, ces cellules peuvent adhérer aux membranes et initier la formation de biofilms, qui deviennent alors un facteur encore plus important de colmatage bactérien.
![Tableau 1.1. Composition approximative du lactosérum doux et du lactosérum acide. Tiré et adapté de Bansal et Bhandari [5]](https://thumb-eu.123doks.com/thumbv2/123doknet/2886575.73580/18.918.123.783.157.500/tableau-composition-approximative-lactosérum-lactosérum-adapté-bansal-bhandari.webp)