Présentée à
L’UNIVERSITE DE POITIERS
ECOLE SUPERIEURE D’INGENIEURS DE POITIERSECOLE DOCTORALE : INGENIERIE, CHIMIQUE, BIOLOGIQUE ET GEOLOGIQUE Pour l’obtention du grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(Diplôme National – Arrêté du 7 Août 2006)
Spécialité : CHIMIE ET MICROBIOLOGIE DE L’EAU Par
Emmanuelle BARRON
Docteur en PharmacieMesure de l’exposition au sélénium :
évaluations chimique et épidémiologique
auprès de sujets alimentés par une eau potable
à teneur élevée, dans la Vienne.
Soutenue le 18 décembre 2007, devant la commission d’examen :
Rapporteurs : M. Yves LEVIM. Philippe HARTEMANN
Examinateurs : Mme Martine POTIN-GAUTIER M. Bernard LEGUBE
Directeur de thèse : Mme Sylvie RABOUAN
Co-directeur de thèse : Mme Virginie MIGEOT
Membres invités Mme Fabienne SEBY
l’Eau et de l’Environnement (LCEE, UMR CNRS 6008) de l’Université de Poitiers avec le soutien financier de la DRASS Poitou-Charentes (Direction Régionale des Affaires Sanitaires et Sociales), du Conseil Général de la Vienne et des collectivités concernées par la problématique « Sélénium dans les eaux de consommation ».
Je remercie sincèrement Monsieur le Professeur Bernard LEGUBE, Directeur du LCEE pour m’avoir accueillie au sein du laboratoire, pour avoir soutenu le thème de recherche « eau-santé » et pour avoir suivi ce travail avec intérêt. Merci également pour l’honneur que vous me faites en présidant ce jury.
Je remercie Madame Sylvie RABOUAN, Professeur d’Université à la faculté de Médecine-Pharmacie de Poitiers, pour sa disponibilité et pour sa rigueur notamment lors de la rédaction. Je tiens à lui exprimer toute ma reconnaissance pour ses précieux conseils et pour son soutien durant ces plusieurs années.
Je remercie Madame Virginie MIGEOT, Maître de Conférences Universitaire - Praticien Hospitalier à la faculté de Médecine-Pharmacie de Poitiers, pour avoir co-encadré cette thèse avec enthousiasme et pour avoir su me conseiller efficacement.
Je n’oublierai pas l’engagement que vous avez personnellement pris toutes les deux dans la réalisation et surtout dans l’achèvement de cette thèse.
Je suis très reconnaissante envers Monsieur Philippe HARTEMANN, Professeur d’Université – Praticien Hospitalier à la faculté de Médecine de Nancy, pour avoir accepté de juger ce travail et d’en être rapporteur.
Je suis également très honorée de la présence de Monsieur Yves LEVI, Professeur d’Université à la faculté de Pharmacie de Paris XI, parmi les membres du jury en qualité de rapporteur.
J’adresse mes remerciements à Madame Martine POTIN-GAUTIER, Professeur d’Université à la faculté de Pau et de l’Adour, pour avoir accepté d’être examinatrice de ce travail mais aussi pour l’intérêt qu’elle a accordé à notre projet de recherche, pour sa coopération, et pour son bon accueil lors de mes séjours à Pau, au LCABIE (Laboratoire de Chimie Analytique Bio-Inorganique et Environnement).
Je remercie Madame Fabienne SEBY, Ingénieur d’Applications à UT2A (Ultra-Traces Analyses Aquitaine), pour l’accueil chaleureux que j’ai reçu lors de mes séjours à Pau, pour ses compétences, pour sa disponibilité, pour son aide précieuse et pour sa grande sympathie.
Mes remerciements vont aussi à Monsieur Jean-Claude PARNAUDEAU, Ingénieur d’Etudes Sanitaires à la DDASS de la Vienne, pour avoir initié cette étude et pour nous avoir fait confiance.
- Isabelle Ingrand (Ingénieur en Biostatistiques à la faculté de Médecine-Pharmacie de Poitiers) pour son implication dans le projet et pour sa relecture,
- Nathalie Ranger (Secrétaire du LCEE) pour son aide administrative (pas toujours évidente !),
- Les participants à l’étude, exposés et non exposés, pour leur dévouement,
- Les participants à l’étude pilote,
- Les élus et personnels administratifs,
- Les personnes ayant aidé à la collecte des aliments produits localement,
- Les personnes ayant aidé au recrutement des participants.
Je souhaite remercier l’ensemble des permanents du laboratoire en particulier Patrick Mazellier et Nathalie Karpel Vel Leitner. Merci également aux membres de l’APTEN en particulier Bertrand, Cristina et Béatrice.
Je souhaite également remercier Pascale pour son aide technique pour le meilleur (merci pour les macarons !) et pour le pire (broyage des aliments au petit matin !)…et François Baty-Sorel pour m’avoir patiemment guidée pour la réalisation du Nouveau Chapitre de Thèse.
Je tiens également à remercier tous les étudiants que j’ai pu côtoyer au cours des quatre années passées au laboratoire. Merci à toi Marie, Cécile, Marie-Cécile, Sophie, Claude, Hugues, David, Tony… pour tous les bons moments partagés ensemble, en espérant que ce n’est que le début d’une longue série !
Merci également à Johan, Pierre, Ladji, Quynh, Babak, Audrey, Rita, Manal, Leslie, Justine, Sahidou, Seb, Fabien, Nico, Aurélien, Bouchra, Fadi, Vinh, Laetitia, Nico, Stéphane… excusez moi de ne pas avoir pu tous vous citer ici !
Je voudrais souligner l’importance de mon entourage amical : Merci à Mumu, Fred, Jeanphi, Daminuche, Loïc, Yoyo, Damien, Jéjé, Caro, Tâafit, Lulu, JB, mes jumelles (Lili et Lolo), Bibine, Michel et Christophe…
Enfin, je ne saurais terminer sans dire un grand merci à Nylou pour sa bonne humeur du soir et pour avoir assuré l’intendance de l’appartement (et du réfrigérateur !) dans les moments « speed », et à ma « belle » famille pour son soutien.
A mes parents, A Nathalie, Philippe, Clément et Julie, A ma famille, A Thibaud
INTRODUCTION
CHAPITRE I : CONTEXTE DE L’ETUDE, LE SELENIUM DANS LES EAUX DE CONSOMMATION
1 Limite de qualité des eaux destinees à la consommation humaine ... 11
2 Traitements possibles des eaux destinees a la consommation ... 12
3 Demande de dérogations ... 12
4 Concentrations en sélénium des eaux... 13
4.1 Hors de France... 13
4.2 En France... 14
4.3 Cas de la Vienne ... 14
4.3.1 Historique ... 14
4.3.2 Situation géographique ... 15
4.3.3 Concentration séléniée des eaux destinées à la consommation ... 16
4.3.4 Origine ... 16
4.3.5 Solutions envisagées ... 17
CHAPITRE II : SYNTHESE BIBLIOGRAPHIQUE 1 Le sélénium dans l’environnement et chez les animaux ... 21
1.1 Chimie du sélénium ... 21
1.2 Usages industriels du sélénium... 23
1.3 Le sélénium dans la croûte terrestre et les sols ... 24
1.4 Le sélénium dans l’atmosphère ... 25
1.5 Le sélénium dans les eaux de surface ... 26
1.6 Le sélénium dans les organismes aquatiques... 26
1.7 Le sélénium dans les végétaux ... 27
1.7.1 Métabolisme du sélénium chez les végétaux ... 27
1.7.2 Facteurs influençant la teneur séléniée des végétaux ... 28
1.8 Le sélénium chez les animaux ... 30
1.8.1 Chez les animaux d’élevage... 30
1.8.2 Chez les animaux de laboratoire : tests de toxicité... 31
2 Cinétique et métabolisme du sélénium chez l’homme... 32
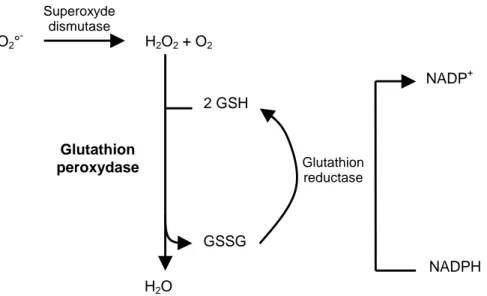
2.1 Voies d’absorption... 32 2.1.1 Absorption pulmonaire ... 32 2.1.2 Absorption cutanée ... 33 2.1.3 Absorption digestive... 33 2.2 Distribution... 34 2.3 Métabolisme ... 34 2.3.1 Exemples de sélénoprotéines ... 36 2.4 Elimination ... 38
3 Mesure de l’exposition séléniée chez l’homme ... 39
3.1 Détermination des apports alimentaires séléniés ... 39
3.1.1 Facteurs influençant les apports séléniés alimentaires ... 39
3.1.2 Méthodes d’estimation des apports alimentaires et nutritionnels... 43
3.1.3 Résultats de détermination des apports séléniés... 44
3.1.4 Limites de la méthode ... 46
3.2 Biométrologie ... 48
3.2.1 Le dosage d’éléments séléniés sanguins ... 49
3.2.2 Le dosage dans les urines ... 51
3.2.3 Le dosage dans les phanères... 51
4 Réponse biologique en fonction de la concentration en sélénium ... 52
4.1 Signes sévères de carence... 54
4.2 Signes de carence modérée... 55
4.2.1 Déficits immunitaires ... 55
4.2.2 Cancers ... 55
4.2.3 Maladies cardiovasculaires ... 56
4.2.4 Déclin des fonctions cognitives... 56
4.2.5 Troubles de reproduction... 56
4.2.6 Troubles de la thyroïde ... 57
4.2.7 Augmentation de la toxicité des xénobiotiques et de certains métaux lourds ... 57
4.3 Etat physiologique ... 57
4.4 Effets pharmacologiques ... 58
4.5 Toxicité... 60
4.5.1 Toxicité aiguë... 60
4.5.2 Toxicité chronique ... 61
CHAPITRE III : MATERIEL, METHODES ET VALIDATION 1 Type d’étude... 67
2 Population cible et population d’étude... 67
2.1 Définition de l’exposition ... 67
2.2 Critères d’inclusion et d’exclusion ... 68
2.3 Nombre de sujets nécessaires ... 68
2.4 Modalités de recrutement des participants... 69
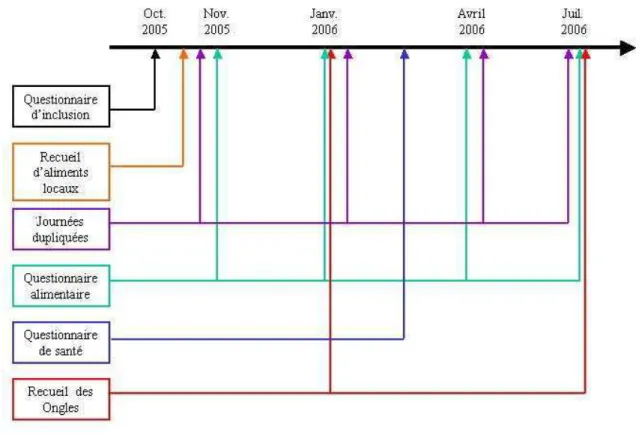
3 Recueil des données ... 70
3.1 Modalités de recueil des données ... 70
3.1.1 Prélèvements alimentaires ... 70
3.1.2 Questionnaires auto-administrés ... 73
3.1.3 Prélèvement biologique... 75
3.2 Fréquence de recueil des données auprès de la population d’étude... 75
3.3 Récapitulatif : définition des variables ... 77
4 Modalités de mise en place de l’étude ... 78
4.1 Etude pilote... 78
4.2 Autorisations réglementaires ... 78
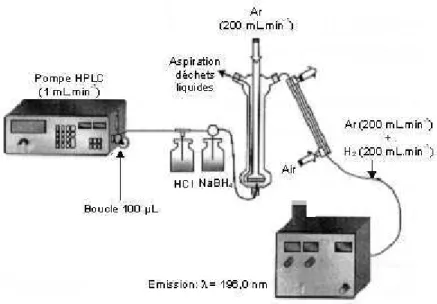
5 Méthodes de quantification du selenium... 79
5.1 Dans les aliments et les ongles ... 79
5.1.1 Choix de la méthode de dosage des échantillons de cette étude ... 79
5.1.2 Préparation des échantillons collectés au cours de l’étude... 81
5.1.3 Dosage du sélénium total par HG-AFS ... 88
5.1.4 Dosage du sélénium total par ICP-MS ... 90
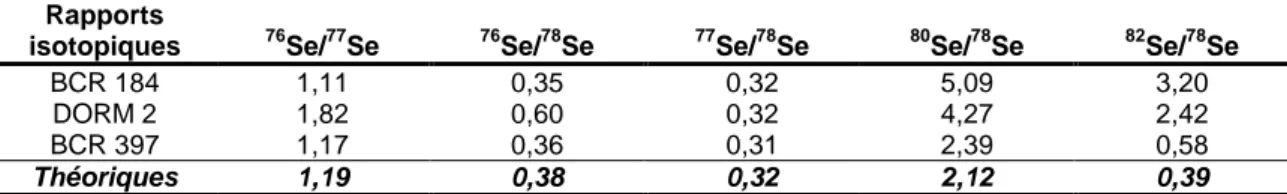
5.1.5 Validation... 93
5.2 Dans l’eau de consommation... 102
5.3 Expression des résultats... 103
5.3.1 Cas des aliments produits localement... 103
5.3.2 Méthode d’estimation des apports séléniés... 103
5.3.3 Méthode d’estimation de l’imprégnation séléniée (cas des ongles)... 108
6 Stratégie d’analyse des données ... 108
6.1.1 Description des deux groupes de la population d’étude ... 109
6.1.2 Etude de l’exposition a posteriori de la population d’étude ... 109
6.1.3 Etude de l’état de santé général et la morbidité déclarée... 109
6.1.4 Quantification du niveau d’exposition individuelle au sélénium ... 109
6.1.5 Etude de l’imprégnation corporelle séléniée ... 110
6.1.6 Comparaison des trois méthodes d’estimation des mesures d’exposition séléniée (par questionnaire, par la méthode des journées dupliquées, par le dosage du sélénium dans les ongles)... 110
1.1 Représentativité de la population d’étude... 115
1.2 Taux de participation ... 115
1.3 Caractéristiques sociodémographiques et habitudes de vie ... 116
1.3.1 Caractéristiques sociodémographiques ... 116
1.3.2 Caractéristiques anthropométriques... 118
1.3.3 Habitudes de vie... 119
2 Mesure d’exposition ... 119
2.1 Contrôle de qualité des analyses... 119
2.1.1 Critères de contrôle de la qualité... 120
2.1.2 Les cartes de contrôles... 122
2.2 Exposition a posteriori de la population d’étude... 124
2.2.1 Concentrations en sélénium dans les eaux de consommation... 124
2.2.2 Consommation de boissons ... 125
2.2.3 Autoconsommation... 127
2.3 Estimation des apports alimentaires séléniés... 131
2.3.1 A partir du questionnaire alimentaire... 131
2.3.2 A partir des journées dupliquées... 134
2.3.3 Corrélation entre les deux méthodes d’estimation des apports séléniés... 139
2.4 Imprégnation corporelle séléniée... 142
2.5 Comparaison des trois méthodes de mesures d’exposition... 147
3 Etat de santé perçu et morbidité déclarée... 148
3.1 Etat de santé perçu et qualité de vie... 148
3.2 Symptomatologie en relation avec le sélénium ... 148
CHAPITRE V : DISCUSSION 1 Méthodes de mesure d’exposition... 154
1.1 Validité des méthodes... 154
1.1.1 Méthode d’échantillonnage... 154
1.1.2 Validité épidémiologique du marqueur d’exposition ... 154
1.1.3 Quantification des apports quotidiens séléniés... 158
1.1.4 Recueil des données par questionnaires ... 159
1.2 Intérêts et limites des méthodes... 159
1.2.1 Méthode d’estimation des apports séléniés... 159
1.2.2 Méthodes d’estimation des concentrations des coupures d’ongles... 162
1.2.3 Méthodes de mesures d’exposition (apports et ongle) ... 163
2 Situation des sujets exposés : mesure d’exposition... 165
2.1 Niveau d’apports ... 165
2.1.1 Eau du robinet... 165
2.1.2 Aliments locaux... 167
2.1.3 Situation des apports séléniés quotidiens... 169
2.2 Niveau d’imprégnation corporelle... 171
2.2.1 Facteurs associés à l’imprégnation corporelle... 171
2.2.2 Situation de l’imprégnation corporelle séléniée ... 171
2.3 Etat de santé... 171
3 Bilan : évaluation du risque... 172
3.1 Pour la population générale adulte ... 172
3.2 Pour les sujets a priori plus à risque... 173
CONCLUSION
Annexe 1 : Spécialités et compléments alimentaires renfermant du sélénium ...2
Annexe 2 : Note d’information remise aux sujets exposés intéressés pour participer à l’étude...3
Annexe 3 : Questionnaire d’inclusion ...7
Annexe 4 : Consentement de participation ...8
Annexe 5 : Note d’information remise aux sujets non exposés intéressés pour participer à l’étude...9
Annexe 6 : Exemple de formulaire à remplir par les sujets exposés pour indiquer la consommation d’aliments ou de boissons lors des journées dupliquées ...12
Annexe 7 : Instructions remises aux sujets exposés pour effectuer les journées dupliquées ...13
Annexe 8 : Questionnaire alimentaire remis aux participants à l’étude à chaque saison ...15
Annexe 9 : Questionnaire de santé remis aux participants à l’étude ...33
Annexe 10 : Instructions remises aux participants pour le recueil des ongles ...52
Annexe 11 : Exemple de calendrier fourni aux participants à l’étude...53
Annexe 12 : Valeurs des apports séléniés quotidiens des sujets exposés estimés via la méthode des journées dupliquées...54
Annexe 13 : Valeurs des concentrations séléniées des coupures d’ongles des sujets participants à l’étude ...60
Annexe 14 : Valeurs des concentrations séléniées des coupures d’ongles des femmes non exposées...63
Dans ses écrits datant du XIIIème siècle, Marco Polo raconte que lors d’un voyage en Chine, ses chevaux perdaient progressivement leurs sabots et devenaient incapables de se déplacer, y compris pour se nourrir. Les chevaux locaux, quant à eux, se portaient bien. En observant le régime alimentaire, il remarqua que ses chevaux s’alimentaient avec une plante nommée l’Astragale, que les chevaux locaux évitaient. A l’époque, l’élément chimique responsable de cette toxicité n’était bien sûr pas caractérisé.
Ce n’est qu’en 1817 que Jöns Jakob Berzélius découvrit le « sélénium » dans les sous-produits de fabrication de l’acide sulfurique. Le lien entre la mort des chevaux et l’Astragale, plante accumulatrice de sélénium, pu alors être expliqué par la toxicité du sélénium.
De toxique il passa à maléfique lorsqu’il fut suspecté d’être cancérigène en 1943. En effet, certains auteurs ont mis en évidence une induction de tumeurs de foie chez les rats. Dès lors, le sentiment général était de le proscrire.
Sa réhabilitation n’est que récente et progressive.
En 1957, Schwarz et Foltz découvrent que le sélénium apporté dans l’alimentation prévient la dégénérescence nécrotique du foie, prouvant son essentialité chez le rat. Chez l’homme, on comprit que le sélénium était indispensable à la vie dans les années 70-80, lors de l’observation de cardiomyopathie pouvant être fatale dans des zones chinoises très pauvres en sélénium (comté de Keshan, Nord-Est de la Chine).
Depuis, le sélénium voit sa réputation s’améliorer de façon exponentielle : de plus en plus de travaux lui sont consacrés et son intérêt semble s’élargir de jour en jour, grâce notamment au développement des méthodes analytiques qui permettent une quantification de cet oligo-élément (ultra-traces).
Ses propriétés antioxydantes sont aujourd’hui reconnues et les recherches concernant son champ d’application en santé publique ne cessent de croître, que ce soit d’un point de vue préventif (en cancérologie notamment) ou curatif (par exemple pour les maladies neurodégénératives). Il paraît aujourd’hui réhabilité dans l’esprit des médecins et des nutritionnistes.
Cependant un décalage demeure avec la législation : augmenter ou diminuer le statut sélénié de la population constitue aujourd’hui une préoccupation de santé publique dans beaucoup de parties du monde, et notamment en Europe.
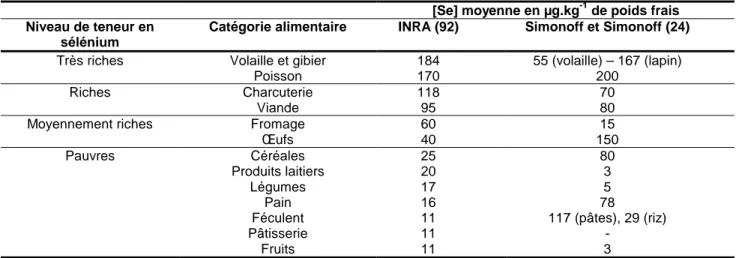
De façon générale, en dehors de la supplémentation, les aliments constituent la principale voie d’apport sélénié chez l’homme. Il est considéré que l’apport hydrique de sélénium est négligeable, en raison de la faible concentration habituellement contenue dans les eaux de boisson. Il est néanmoins soumis au calcul de la concentration maximale autorisée dans les eaux de consommation. Ainsi, le Code de la Santé Publique (CSP) définit la norme séléniée de qualité des eaux à 10 µg.L-1. En France, la majorité des eaux de consommation est conforme à cette réglementation. Pourtant, plusieurs collectivités du département de la Vienne sont actuellement desservies par une eau contenant entre 10 et 20 µg.L-1 de sélénium, nécessitant le recours à des dérogations.
Le travail présenté ici, fait suite à la demande de la Direction Départementale des Affaires Sanitaires et Sociales de la Vienne, pour apporter des éléments de réponse sur l’exposition séléniée de la population générale adulte résidant dans ces communes.
Dans le contexte de cette demande, l’origine d’une surexposition en sélénium a été identifiée par deux risques principaux. Le premier est représenté par la consommation d’eau du robinet comme boisson principale, qui pourrait constituer un apport sélénié supplémentaire non négligeable. Le deuxième est représenté par la consommation de produits d’origine locale (autoconsommation). Les concentrations en sélénium du sol et des eaux d’irrigation pourraient engendrer une fixation par les plantes et une ingestion par les animaux d’élevage plus importantes dans cette zone. Dans de telles conditions, la consommation de produits locaux (potagers, élevage) conduirait à une exposition significativement supérieure à celle présentée dans d’autres zones géographiques en France.
L’objectif principal de ce travail était de quantifier le niveau d’exposition individuelle au sélénium de la population générale adulte, résidant dans ces différentes communes de la Vienne. Pour cela, les apports en sélénium ont été estimés par deux méthodes à savoir la reconstitution à partir d’un questionnaire alimentaire et la collecte de repas par la méthode des journées dupliquées. De plus, l’analyse de quelques aliments produits localement a été réalisée. Ces approches ont été complétées en comparant le statut sélénié évalué par la mesure d’un biomarqueur (la concentration en sélénium des coupures d’ongles), entre la population de l’étude et une non exposée.
Les objectifs secondaires étaient :
- d’étudier l’état de santé général et la morbidité déclarée de la population résidant dans ces différentes communes de la Vienne par rapport à la population française,
- d’étudier la relation entre les apports en sélénium provenant des aliments et des boissons et l’imprégnation corporelle séléniée en tenant compte des éventuels facteurs de confusion.
Après avoir décrit le contexte de cette étude, nous présenterons une synthèse bibliographique sur le sélénium dans la nature, et chez l’Homme. Nous ferons le point notamment sur les connaissances concernant la réponse biologique du sélénium en fonction de la dose.
Le travail de cette thèse sera ensuite présenté, en décrivant d’abord le matériel et les méthodes employées pour effectuer les mesures d’exposition, ainsi que les validations qui les accompagnent. Puis, nous détaillerons les résultats obtenus dans cette étude, pour enfin les discuter et effectuer un bilan concernant le risque potentiel encouru par cette population.
Chapitre I :
1 L
IMITE DE QUALITE DES EAUX DESTINEES A LA CONSOMMATION HUMAINEEn 2003, le Code de la Santé Publique (1) intègre le décret n°2001-1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine, à l’exclusion des eaux minérales. Ce décret provient de la transposition de la directive européenne 98/83/CE du 3 novembre 1998. Cette directive définit une limite de qualité pour le sélénium dans les eaux destinées à la consommation humaine à 10 µg.L-1. Cette concentration est reprise dans l’arrêté du 11 janvier 2007 relatif aux limites et références de qualité des eaux brutes et des eaux destinées à la consommation humaine, en France (2).
Cette limite de qualité européenne est issue de la valeur guide proposée par l’Organisation Mondiale de la Santé (OMS) (3). Cet organisme se doit de proposer des valeurs et d’effectuer des recommandations en prenant en compte des problématiques de santé internationale.
La limite proposée a été fixée de la façon suivante (4) : à partir des données de la bibliographie, la Dose Sans Effet Indésirable Observé (DSEIO) a été estimée à 4 µg.kg-1 de poids corporel par jour, soit un apport maximal de 240 µg.j-1 pour un homme de 60 kg. Considérant que la boisson représente 2 L par personne et par jour et contribue pour 10% des apports totaux journaliers, la quantité maximale de sélénium absorbée lors des breuvages doit être de 24 µg de sélénium par jour. Ainsi, l’eau de boisson doit contenir au maximum 12 µg de sélénium par litre pour ne pas dépasser la dose limite de sélénium quotidienne. Cette valeur a ensuite été arrondie à 10 µg.L-1.
Dans le contexte international, il est à noter que :
(i) cette limite a fait l’objet de révision par l’OMS suite à l’évolution de la littérature à propos du sélénium ; une nouvelle limite devrait être proposée dans la quatrième édition du guide des recommandations pour les eaux de consommation (5).
(ii) Aux Etats Unis, en 1979, Lafond et Calabrese considéraient que la norme séléniée de 10 µg.L-1 alors en vigueur leur apparaissait inappropriée et trop basse (6). Depuis, l’Agence de Protection de l’Environnement américaine (EPA) propose aujourd’hui une concentration maximale de 50 µg.L-1 (7).
2 T
RAITEMENTS POSSIBLES DES EAUX DESTINEES A LA CONSOMMATIONSelon l’Afssa (Agence française de sécurité sanitaire des aliments) (4), les possibilités de traitement permettant une diminution des teneurs en sélénium dans l’eau destinée à la consommation sont les suivantes :
- la coagulation – floculation – décantation : le Se(IV) réagit avec le chlorure ferrique (coagulant) et co-précipite (l’utilisation plus courante de sels d’aluminium pré-polymérisés comme coagulant est inefficace). Le pH doit être inférieur à 7,5. Pour le Se(VI) (généralement majoritaire dans les eaux naturelles), ce procédé nécessite une étape de réduction préalable.
- la décarbonatation : à pH supérieur à 9 (soude ou chaux), le Se(IV) est bien éliminé (environ 90%) alors que le Se(VI) présente un rendement d’élimination d’environ 20%.
- l’adsorption sélective : sur alumine activée, charbon actif, dioxyde de manganèse, geothite (FeO(OH)), anatase (TiO2)... Le pH doit être inférieur à 7,5. Comme pour les
autres techniques, le sélénium IV est mieux éliminé que le Se(VI) qui est dix fois moins retenu.
- les résines échangeuses d’ions (résines anioniques).
- les traitements membranaires : filtration par nanofiltration ou par osmose inverse.
3 D
EMANDE DE DEROGATIONSLes personnes publiques ou privées responsables de la distribution d’eau ont la possibilité de demander une dérogation aux limites de qualité de l’eau auprès du préfet (article R. 1321-31 du CSP), « si son utilisation ne constitue pas un danger potentiel pour la santé des personnes et s’il n’existe pas d’autres moyens raisonnables pour maintenir la distribution de l’eau destinée à la consommation humaine dans le secteur concerné ». Cette dérogation, qui doit être d’une durée aussi limitée que possible dans le temps, ne peut excéder trois ans et peut éventuellement être renouvelée deux fois.
La circulaire DGS 2004/602 du 15 décembre 2004 relative à la gestion du risque sanitaire en cas de dépassement des limites de qualité des eaux destinées à la consommation humaine précise les conditions pour le paramètre sélénium : « en cas de dépassement de la limite de qualité (10 µg.L-1), une dérogation peut être octroyée sous conditions. Pendant la période dérogatoire, une teneur maximale en sélénium dans l’eau comprise entre 10 et
40 µg.L-1 peut être admise. Toutefois, l’octroi d’une dérogation doit impérativement être accompagnée :
- d’une restriction de l’eau pour les usages alimentaires pour les enfants (moins de 4 ans) lorsque les teneurs en sélénium sont supérieures à 20 µg.L-1,
- d’une recommandation à la population, de reconsidérer la consommation de compléments alimentaires à base de sélénium lorsque l’eau de distribution publique est utilisée pour des usages alimentaires… ».
Pour des teneurs en sélénium dans l’eau d’alimentation comprises entre 40 et 70 µg.L-1, la demande de dérogation est soumise aux instances nationales d’expertise.
En cas de présence de sélénium à des teneurs supérieures à 70 µg.L-1, aucune dérogation ne peut être accordée.
4 C
ONCENTRATIONS EN SELENIUM DES EAUXEn dehors de quelques zones géographiques, la concentration séléniée des eaux de consommation est, en général, de quelques microgrammes par litre, voire beaucoup moins (8).
4.1 Hors de France
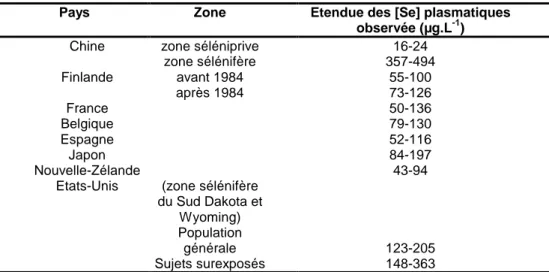
Deux zones géographiques situées hors de France, alimentées en eau de consommation contenant entre 50 et 125 µg.L-1 de sélénium pour la première (Etats-Unis) et entre 4 et 9 µg.L-1 pour la deuxième (Italie), ont fait l’objet d’études épidémiologiques décrites ci-dessous.
Aux Etats Unis (Colorado), une population recevant une eau contenant entre 50 et 125 µg.L-1 de sélénium, a été étudiée par Tsongas et Ferguson (9). Ces auteurs ont mis en évidence une plus forte concentration séléniée contenue dans les urines des sujets recevant une eau riche en sélénium par rapport à celle des sujets recevant une eau moins riche en sélénium ([Se]eau de consommation entre 1 et 16 µg.L-1) (86 sujets). Cependant aucune différence
d’incidence ou de prévalence de maladies n’a pu être mise en évidence (85 paramètres étudiés).
En Italie, une partie de la population de Reggio Emilia a reçu une eau contenant une concentration séléniée entre 4 et 9 µg.L-1 jusqu’en 1988. Les études effectuées ont porté sur :
- la recherche de la mortalité par cancer sur 4419 sujets pendant une période de 7 ans (10),
- la recherche d’apparition de malformations : prévalence de malformations congénitales et d’avortements spontanés entre 1980 et 1988 (353 naissances) (11), - la mortalité par cancer, maladie cardio-vasculaire et neurologique sur 12 ans (2065
sujets) (12),
- le risque de sclérose latérale amyotrophique (maladie neurodégénérative d’origine inconnue) (13).
Les auteurs n’ont pu mettre en évidence de relation entre l’exposition au sélénium et le caractère recherché, excepté dans le cas de la sclérose latérale amyotrophique, laissant supposer que la progression de cette maladie influence le métabolisme du sélénium (diminution des apports séléniés, augmentation de l’utilisation dans certains tissus…).
Cependant, les auteurs dénoncent plusieurs limites méthodologiques : un manque d’information concernant les facteurs de confusion (style de vie), un manque de précision dans la caractérisation de l’exposition de la population (simple dichotomie), un nombre de sujets trop faible engendrant une imprécision des estimations (11).
Les auteurs suggèrent que les apports de la population ne doivent pas être significativement différents des apports moyens nationaux. Mais aucune évaluation des apports ou du statut sélénié n’a été effectuée pour confirmer cette hypothèse (10).
4.2 En France
A notre connaissance, seules les eaux de consommation de deux zones présentent des teneurs séléniées supérieures à la limite de qualité : l’Essonne (14) et la Vienne. Dans ces deux zones, les teneurs en sélénium sont aujourd’hui comprises entre 10 et 20 µg.L-1 et d’origine naturelle.
4.3 Cas de la Vienne
4.3.1 Historique
L’observation répétée de teneurs séléniées supérieures à 10 µg.L-1 au départ de certaines stations de production d’eau de la Vienne a conduit à la mise en place en 1997, d’une campagne de prélèvements intensive (Figure 2 page 16). Celle-ci avait révélé des dépassements des exigences de qualité vis-à-vis du sélénium sur douze captages alimentant huit unités de distribution (zone géographique desservie par une qualité d’eau sensiblement identique tout au long de l’année). Ces unités approvisionnaient 40 000 à 55 000 habitants et contenaient entre 11 et 40 µg.L-1 de sélénium. Afin de remédier à cette situation, les premières opérations entreprises ont porté sur la recherche d’autres ressources et sur les possibilités d’interconnexions entre réseaux pour permettre de diluer. Finalement, ces opérations ont
entraîné la fermeture de quatre captages mais quatre collectivités de la Vienne (15) restent actuellement approvisionnées avec une eau riche en sélénium, sous couvert d’un accord dérogatoire temporaire (16). Ces quatre collectivités sont présentées ci-dessous.
4.3.2 Situation géographique
Les quatre collectivités concernées par une concentration en sélénium dans les eaux de consommation supérieure à 10 µg.L-1 sont situées dans deux zones géographiques, à l’Est du département de la Vienne (Figure 1).
Les communes desservies sont (regroupement par Syndicat Intercommunal d’Alimentation en Eau Potable SIAEP) :
- Coussay-les-Bois, Lésigny et Mairé : SIAEP de Coussay-les-Bois (zone 2 sur la Figure 1),
- Leigné-les-Bois : SIAEP de Vicq-sur-Gartempe (unité de distribution B : les Vignaux) (zone 2 sur la Figure 1),
- Fontaine, La Chapelle-Viviers et Pindray : SIAEP de Leignes-sur-Fontaine (zone 1 sur la Figure 1),
- Montmorillon et Jouhet (zone 1 sur la Figure 1).
Figure 1 : Zones de la Vienne ayant une concentration séléniée des eaux de consommation
supérieure à la norme de 10 µg.L-1 ((la station thermale de la Roche-Posay est représentée par la fontaine
4.3.3 Concentration séléniée des eaux destinées à la consommation
Les concentrations séléniées des eaux de consommation des communes concernées sont présentées sur la Figure 2.
Les collectivités du SIAEP de Leignes-sur-Fontaine reçoivent des eaux d’origine différente : La Chapelle-Viviers reçoit majoritairement l’eau du forage de Servon, Pindray celle du forage de Tussac et Leignes-sur-Fontaine reçoit un mélange des deux forages.
Figure 2 : Concentrations séléniées déterminées dans les eaux de consommation des collectivités depuis 1997 (DDASS).
L’ensemble de ces données est commenté au paragraphe 2.1.1.1 page 165.
4.3.4 Origine
Le sélénium présent dans les eaux a une origine géologique naturelle par lessivage des roches du Jurassique et du Turonien.
L’eau distribuée a pour origine :
- la nappe aquifère semi-captive du Jurassique moyen pour les eaux de :
o Montmorillon et Jouhet (deux captages : Roche (source) et Chambon (forage)),
o Leignes-sur-Fontaine (deux forages : Tussac (profondeur de 121 m) et Servon (profondeur de 128 m)) ;
- la nappe aquifère libre du Turonien (Crétacé secondaire) pour les eaux de :
o Coussay-les-Bois (forage de Fontaine Rateau (profondeur de 60 m)),
o Leigné-les-Bois (forage des Vignaux (profondeur de 55 m)).
Les roches de cette même période du Turonien, à quelques kilomètres au nord de cette zone (Figure 1), ont généré une eau très riche en sélénium ([Se] ≈ 50-60 µg.L-1
) localisée et alimentant exclusivement la station thermale de la Roche-Posay. La forte concentration séléniée de cette eau serait due à la recharge des aquifères à travers les couches tertiaires de l’éocène (17). Ses propriétés, en partie dues à la présence de sélénium, permettent le traitement des pathologies dermatologiques (18). Par un suivi clinique de sujets atteints de
0 5 10 15 20 25 30 35 40 45 11/3/97 24/7/98 6/12/99 19/4/01 1/9/02 14/1/04 28/5/05 10/10/0 6 22/2/08 Dates de prélèv ement [S e ] µ g .L -1 Montmorillon-Jouhet Coussay-les-Bois Leigné-les-Bois La Chapelle Viviers Leignes-sur-Fontaine Pindray 10/10/06
psoriasis traités à la Roche-Posay, Pinton et al. ont montré que la moyenne des taux plasmatiques de sélénium augmente de façon concomitante à l’amélioration clinique des patients (19, 20).
4.3.5 Solutions envisagées
Les solutions pour maintenir une teneur en sélénium respectant la norme peuvent être la recherche de nouvelles sources ou l’élimination du sélénium de l’eau par un traitement appliqué dans les usines.
Concernant l’élimination du sélénium, des essais effectués en laboratoire, portant sur l’eau de Chambon ont été réalisés en 1999 (21). Les résultats ont montré que, parmi les procédés testés (coagulation-floculation, nanofiltration, adsorption, résine échangeuses d’ions), seule la nanofiltration et l’échange d’ions pouvaient être des procédés efficaces pour éliminer le sélénium. En raison des coûts d’investissement et de fonctionnement très supérieurs de la nanofiltration, seul le traitement sur résine échangeuses d’ions a été ensuite étudié. L’inconvénient de cette méthode est la production d’éluats chargés en sélénium et en sulfate ou en chlorure (selon le type de régénération) qu’il est nécessaire de traiter. Le coût d’investissement était estimé (en 1999) à 380 000 € (traitement des éluats non compris). Le coût de fonctionnement (réactif uniquement) était estimé entre 0,8 à 2,6 cts d’€.m-3 selon le type de réactifs.
Actuellement, hors la teneur en sélénium, ces eaux ne nécessitent aucun traitement et subissent uniquement une désinfection par le chlore gazeux.
L’installation et la mise en œuvre de traitements pour éliminer le sélénium sont lourdes et onéreuses. Avant toute décision, il convient d’évaluer précisément les risques encourus par la population et ce pour trois raisons :
- La norme de 10 µg.L-1 de sélénium dans l’eau est issue d’un calcul théorique (Cf. paragraphe 1 page 11).
- Les valeurs maximales des eaux incriminées restent inférieures à 40 µg.L-1 depuis 1997 (Figure 2 page 16).
- Enfin, les Etats-Unis affichent une norme à 50 µg.L-1.
Dans ce contexte, il est apparu nécessaire de déterminer précisément le niveau d’exposition des sujets résidant dans ces communes, en comparant les apports séléniés quotidiens de cette population par rapport à la DSEIO de 240 µg.j-1 fournie par l’OMS (3).
Chapitre II :
1 L
E SELENIUM DANS L’
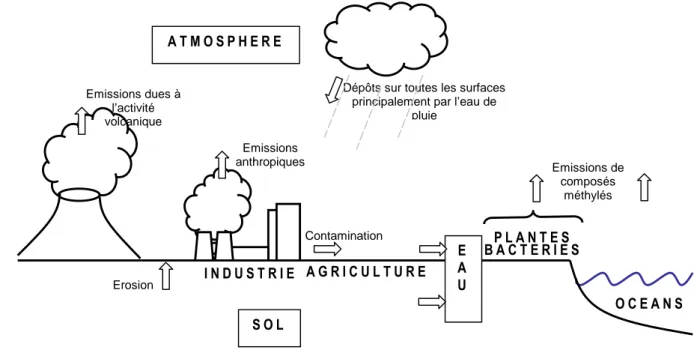
ENVIRONNEMENT ET CHEZ LES ANIMAUXLe sélénium est un élément peu abondant (élément-trace), mais il est ubiquitaire. Il se retrouve dans tous les principaux compartiments environnementaux via des transferts résumés sur la Figure 3. Cette partie présente les caractéristiques physico-chimiques du sélénium puis détaille sa présence dans les différents compartiments de l’écosystème.
Figure 3 : Cycle environnemental du sélénium adapté de Haygarth et al. (22).
1.1 Chimie du sélénium
Le sélénium appartient à la famille des métalloïdes. De numéro atomique 34, il se situe dans la même colonne que le soufre avec lequel il présente des analogies. Ainsi, quel que soit le compartiment de l’écosystème, sa présence est étroitement liée à celle du soufre.
La masse molaire du sélénium élémentaire est de 78,96 g.mol-1. Ses températures de fusion et d’ébullition sont respectivement de 217 ± 1°C et 684,9 ± 1°C (23).
A température ambiante, il se présente sous forme solide, stable, insoluble dans l’eau et les solvants organiques usuels. Il existe sous différentes formes physiques : une forme amorphe rouge ou noire et une forme cristalline rouge ou grise. Le sélénium gris ou
Emissions de composés méthylés P L A N T E S S O L I N D U S T R I E Emissions anthropiques Erosion B A C T E R I E S E A U A T M O S P H E R E A G R I C U L T U R E
Dépôts sur toutes les surfaces principalement par l’eau de
pluie Contamination Emissions dues à l’activité volcanique O C E A N S
« métallique » (improprement appelée ainsi en raison de son aspect), de structure hexagonale et photoconducteur, apparaît lorsqu’on chauffe les autres variétés de sélénium vers 200°C.
Il possède six isotopes naturels (abondance naturelle) : 74Se (0,9%), 76Se (9,0%),
77
Se (7,5%), 78Se (23,5%), 80Se (50%) et 82Se (9,0%) (24).
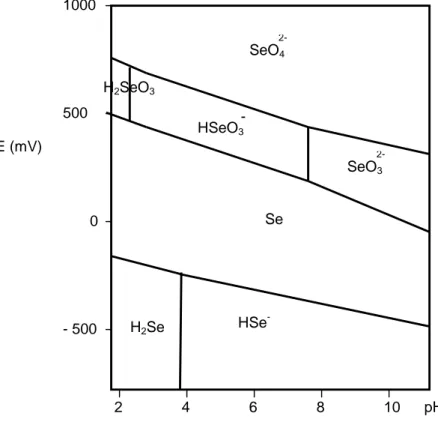
Il peut exister sous plusieurs états d’oxydation : -II (séléniure), 0 (sélénium élémentaire), + IV (sélénite) et + VI (séléniate). La répartition et les diverses associations du sélénium dépendent essentiellement du pH, des conditions d’oxydo-réduction et des cinétiques de réaction. Les effets du pH et du potentiel d’oxydo-réduction sur les différents états d’oxydation du sélénium sont présentés sur la Figure 4.
Figure 4 : Diagramme potentiel-pH du sélénium établi pour une concentration en sélénium
de 10-6 mol.L-1 (25).
D’une façon générale, les composés chimiques peuvent différer dans la composition isotopique, le degré d’oxydation ou état électronique (comme décrit précédemment), ou dans la nature de leurs liaisons aux substituants, qui peuvent être complexés ou liés par covalence. Ainsi, chaque composé peut être considéré comme une espèce chimique différente, ce qui conduit l’IUPAC à distinguer clairement les définitions suivantes (26) :
- analyse de spéciation : activité analytique qui permet d’identifier et/ou de déterminer
la quantité d’une ou plusieurs espèces chimiques dans un échantillon ;
- spéciation d’un élément ou spéciation : distribution d’un élément parmi les différentes
espèces chimiques existantes dans un système.
2 4 6 8 10 pH - 500 0 500 1000 H2SeO3 Se H2Se SeO4 2- HSeO3 - SeO3 2- HSe -E (mV)
Les formes les plus couramment rencontrées sont présentées dans le Tableau 1 (27) et possèdent des propriétés différentes.
Tableau 1 : Exemples de composés séléniés inorganiques et organiques.
Dénomination Formule chimique Etat d’oxydation Abréviation
Composés inorganiques
Sélénite H2SeO3, HSeO3
-, SeO3
2-+IV
Séléniate H2SeO4, HSeO4-, SeO42- +VI
Dioxyde de sélénium = anhydride sélénieux SeO2 + IV Séléniure d’hydrogène = hydrure de sélénium H2Se, HSe -, Se2- -II Séléniure de métaux = séléniure inorganique MSe Composés organiques Sélénométhionine Homologue de la méthionine
(acide aminé soufré)
CH3-Se-(CH2)2-CH-NH2 -II Se-Met
Sélénocystéine Homologue de la cystéine
(acide aminé soufré)
H-Se-CH-NH2 -II Se-Cys
Diméthylséléniure CH3-Se-CH3 -II DMSe
Diméthyldiséléniure CH3-Se-Se-CH3 -II DMDSe
Ion triméthysélénonium (CH3)3Se+ -II TMSe
1.2 Usages industriels du sélénium
Le sélénium possède un large spectre d’utilisation : de l’agriculture aux procédés industriels high-tech (24, 27, 28). Ainsi, il est employé dans :
- l’industrie électrique et électronique pour la fabrication de redresseurs de courants, de cellules photoélectriques, de tambours de photocopieurs (grâce aux propriétés photosensibles et semiconductrices du « sélénium métallique »),
- l’industrie métallurgique pour la préparation d’alliages facilement usinables et résistant à la corrosion et le traitement de surface des métaux,
- l’industrie des lubrifiants comme additifs pour la fabrication d’huiles lubrifiantes, - l’industrie du verre et de la céramique pour la décoloration (neutralisation de la
coloration due aux oxydes de fer) et la pigmentation (variétés de verre rouge employées pour la signalisation lumineuse, comme filtres de lumière ou dans l’équipement infrarouge, et verre noir utilisé comme revêtement des édifices modernes),
- l’industrie chimique comme catalyseurs,
- l’industrie des peintures et vernis comme pigments inorganiques,
- l’industrie du caoutchouc pour la vulcanisation du caoutchouc en présence de soufre, - l’industrie alimentaire et pharmaceutique comme suppléments alimentaires pour
l’homme (Cf. paragraphe 3.1.1.4 page 42),
- l’agriculture comme fertilisants et suppléments alimentaires pour l’animal (Cf. paragraphe 1.8 page 30).
COOH
1.3 Le sélénium dans la croûte terrestre et les sols
La croûte terrestre, composée de 95% de roches magmatiques et 5% de roches sédimentaires (29), renferme une concentration moyenne de sélénium de 0,09 µg.g-1 (69ème position par ordre d’abondance) (24). Le sélénium est surtout concentré dans les sulfures minéraux (galène PbS, chalcopyrite CuFeS2, pyrite FeS2), et de façon générale, les
éléments-traces sont hautement dispersés dans une large variété de minéraux. Comme le montre le Tableau 2, cette concentration est variable selon le type de roche.
Tableau 2 : Concentrations moyennes en sélénium dans différents types de roches (24, 29).
Types de roches [Se total] (µg.g-1) Roches magmatiques
Basalte (en surface) Granit (profonde) 0,05-0,11 0,05-0,06 Roches sédimentaires Schiste (80%) Argile Grès (15%) Carbonate (5%) 0,6 0,4-0,6 0,05 0,08
Les roches sédimentaires sont les plus riches en sélénium et les plus fréquemment retrouvées à la surface de la terre. Ainsi, dans les sols, la concentration moyenne en sélénium est estimée à 0,2 µg.g-1 (29).
Il existe une variation de cette concentration à travers le monde. Les zones rocheuses, peu recouvertes de sédiments ou résistantes à l’érosion sont déficientes en sélénium (30), tandis que la plupart des sols sélénifères et potentiellement toxiques est formée à partir des schistes provenant de la période du Crétacé.
Par conséquent, il existe des zones dites séléniprives (exemple : une partie de la Chine, la Nouvelle Zélande ([Se total]=0,1 µg.g-1)) et des zones dites sélénifères (exemple : certains états des USA, Irlande ([Se total]=1200 µg.g-1)).
La présence de sélénium dans le sol peut également être due à des apports anthropiques provenant (28) :
- de l’exploitation et de la combustion des énergies fossiles (charbon, huile de graissage) puisque la plupart des déchets solides et des effluents liquides issus de la production d’énergie électrique est enrichie en sélénium,
- de l’exploitation minière,
- des industries de raffinage des métaux (que ce soit par traitement physico-chimique ou thermique),
- des décharges publiques qui peuvent contenir du matériel riche en sélénium comme des composants photoélectroniques provenant d’ordinateurs ou d’équipements industriels électroniques,
- de l’utilisation d’engrais sélénié, de lisier de porc ou de bétail. Selon certains auteurs, il n’est pas rare que ces fumiers renferment 50-150 µg.L-1 de sélénium (31),
- de la production électrolytique de manganèse métallique où le sélénium est utilisé comme additif (environ 75% de la production de manganèse).
1.4 Le sélénium dans l’atmosphère
En dehors des zones volcaniques, la concentration moyenne de sélénium atmosphérique est évaluée à 0,04 ng.m-3 avec des variations entre 0,1 et 10 ng.m-3 dans la plupart des zones urbaines (3). Par exemple, en Espagne, cette concentration varie entre 0,2 et 0,5 ng.m-3 et en Inde, entre 0,02 et 2 ng.m-3 (32).
Le sélénium atmosphérique peut être d’origine : - naturelle (60% environ) :
o issu de l’activité volcanique (24),
o issu de l’émission de dérivés séléniés méthylés volatils (biométhylation) notamment par les micro-organismes des océans. En effet, les océans sont présumés être une source majeure de sélénium pour l’atmosphère (entre 45 et 77% de l’émission globale). Amouroux et al. ont déterminé qu’en moyenne 0,51 µg.m-2.j-1 de sélénium est émis de l’océan Atlantique nord . Ainsi ils estiment qu’environ 35 000 tonnes de sélénium sont émises par an à partir des océans. Les espèces majoritaires seraient le diméthylsélénosulfure (DMSeS) et le diméthylséléniure (DMSe). Ce dernier semble produit par des coccolithophores similairement à la formation de diméthylsulfure (DMS). Comme pour le cycle marin des sulfures, les espèces séléniées volatiles semblent émises de la surface marine et piégées par des particules atmosphériques (33).
La biométhylation est également un phénomène observé chez les bactéries des eaux douces et des sols, les plantes, les animaux et les hommes, en particulier lors d’intoxication (29, 34, 35, 36). Ce processus de détoxication intensif pour certaines plantes (Cf. page 28), peut être mis à profit pour éliminer le sélénium contaminant des sols. Il s’agit d’une technologie récente appelée phytoremédiation (37, 38).
- anthropique (environ 40%) :
Les industries de raffinage des métaux qui utilisent le traitement thermique sont responsables de la volatilisation de sélénium sous forme de vapeur. Lors du refroidissement, ce sélénium peut adhérer aux fines particules atmosphériques.
1.5 Le sélénium dans les eaux de surface
Dans l’écosystème aquatique, le sélénium est issu du lessivage des sols. Les teneurs sont variables en fonction de la richesse des sols traversés et du pH de l’eau.
Le sélénium est essentiellement sous forme inorganique et plus particulièrement à l’état d’oxydation IV et VI dans les eaux aérées. La répartition de ces deux espèces est fonction du type d’eau, de la profondeur, de l’aération et du pH. Dans les eaux naturelles, les formes majoritaires du Se IV sont les espèces HSeO3- et SeO32-, la prépondérance de l’une sur
l’autre dépend du pH (pKa H2SeO3/HSeO3-=2,35 ; pKa HSeO3-/SeO32-=8). Le Se VI existe
essentiellement sous forme SeO42- (pKa H2SeO4/HSeO4-=0 et pKa HSeO4-/SeO42-=1,7).
Le sélénium dissous peut demeurer libre en solution, être absorbé par un organisme ou être retenu par la matière colloïdale organique et/ou inorganique. Cette dernière possibilité est la voie majoritaire. Ainsi 70 à 85% du sélénium organique et inorganique peut être lié aux particules colloïdales et de ce fait être éliminé dans les sédiments (39).
Les eaux de surface (rivière et lac) présentent, en général, des concentrations en sélénium total dissous de l’ordre de 0,1 à 0,3 µg.L-1 (8, 40) sauf si l’eau est alcaline et draine des régions volcaniques (30), comme c’est le cas par exemple en Argentine ([Se]=48 µg.L-1) (24). Les concentrations séléniées de l’eau de mer ainsi que celles des précipitations sont généralement inférieures à 1 µg.L-1 (8).
1.6 Le sélénium dans les organismes aquatiques
L’apport en sélénium chez les organismes aquatiques peut être schématisé par la Figure 5 (41).
Figure 5 : Sources en sélénium chez les organismes aquatiques (41).
EAU Se (IV) Se(VI) Se organique PLANCTON Phytoplancton Zooplancton Mollusques Crustacés Poissons Particules sédimentaires
Se(0), Se(-II) organique Déchets enrichis 5 1 3 2 4
Les apports séléniés des mollusques, crustacés et poissons sont principalement issus du plancton (voie 3). Le facteur de bioaccumulation des poissons, défini comme le ratio entre la concentration d’un composé chimique d’un organisme résultant de toutes les voies d’exposition possibles et la concentration du milieu aquatique, est en moyenne de 22 000 (42). Ainsi, le poisson, contenant 0,2 µg.g-1 de sélénium en moyenne, est classé comme une source séléniée alimentaire privilégiée.
Par ailleurs, en cas de contaminations séléniées, l’apport direct par l’eau peut être responsable de toxicité. Plusieurs cas ont été rapportés par Lemly (28) mais un seul cas majeur de toxicité environnementale du sélénium a été décrit en 1985 dans le refuge national de Kesterson (Vallée San Joaquim, Californie). La mort et la déformation de poissons et d’oiseaux aquatiques ont été observées dans cette zone où plusieurs conditions étaient réunies pour que la concentration en sélénium dans l’eau atteigne en moyenne 300 µg.L-1 (43). L’examen des populations et des animaux domestiques vivant à proximité n’a pas mis en évidence d’effets néfastes (44).
1.7 Le sélénium dans les végétaux
1.7.1 Métabolisme du sélénium chez les végétaux
Le sélénium n’est pas indispensable à la vie du règne végétal mais il entre tout de même dans le métabolisme des plantes. Ceci permet de le rendre disponible pour les organismes animaux et humains (45).
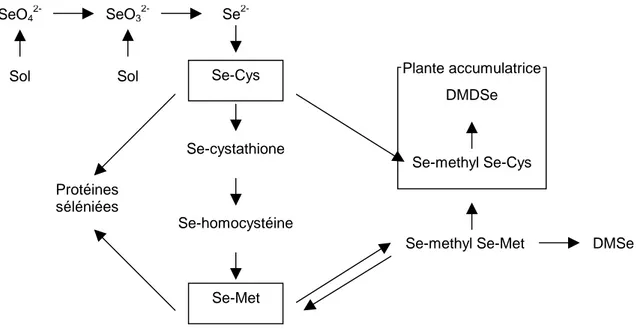
Le sélénium est absorbé par les plantes sous forme de séléniate ou sélénite. Son métabolisme est intimement lié à celui du soufre (46). Les séléniates sont absorbés par le transporteur des sulfates. Il existe donc une compétition d’absorption entre les sulfates et les séléniates. Après absorption, les séléniates sont transportés aux chloroplastes via la voie des sulfures. Ils sont transformés en adénosine 5’-phosphoséléniate par l’Adénosine Tri Phosphate sulfurylase (ATP sulfurylase). Cette étape serait une des étapes limitant l’assimilation du séléniate (37). Puis, l’adénosine 5’-phosphoséléniate est réduit en sélénite puis en sélénide en présence de glutathion (GSH).
La résultante de ce métabolisme est la production d’acides aminés séléniés comme la sélénométhionine et la sélénocystéine qui sont ensuite incorporés dans les protéines (Figure 6). Cette incorporation ne se fait pas de manière spécifique : les acides aminés séléniés sont incorporés en compétition avec leurs homologues soufrés (par exemple pour les céréales, la sélénométhionine est incorporée en compétition avec la méthionine (47)).
Figure 6 : Mécanisme d'assimilation du sélénium chez les végétaux adapté de Dumont et al. (48).
Certains auteurs ont montré qu’à dose convenable, le sélénium serait capable d’augmenter le taux de croissance des plantes en renforçant l’activité antioxydante, en retardant les effets de sénescence et en améliorant l’utilisation des courtes longueurs d’onde pour la photosynthèse (47).
A haute dose, il semble que les plantes réduisent leur croissance et synthétisent des composés volatils, en particulier le DMSe, pour détoxifier (49, 50). Cependant, certaines plantes dites accumulatrices peuvent supporter des concentrations en sélénium plus élevées. Celles-ci sont décrites au paragraphe suivant.
1.7.2 Facteurs influençant la teneur séléniée des végétaux
La teneur séléniée des plantes dépend :
- du type de végétal et de son âge (51) : en général, la teneur séléniée des plantes est
faible sauf pour les plantes dites accumulatrices de sélénium. En effet, il existe les plantes accumulatrices primaires, ou hyperaccumulatrices (Astragalus) qui ont une concentration de l’ordre de 1000 µg.g-1 et les plantes accumulatrices secondaires contenant une concentration de l’ordre de 100 µg.g-1 (Brassica) (52). Ce sont ces variétés, en particulier Brassica juncea qui sont utilisées dans le procédé de phytoremédiation (29, 52). Chez ces plantes, la méthylsélénocystéine peut devenir le composé majoritaire (jusqu’à 80% du sélénium total). La synthèse de cette molécule permet d’éviter la toxicité du sélénium car celle-ci ne peut être incluse dans les protéines (51) (Cf. Figure 6 page 28).
- de la concentration séléniée du sol : l’utilisation de fertilisant sélénié, notamment
sous la forme de séléniate, permet d’augmenter la concentration de la plante (53). Ce phénomène a été mis à profit à partir de 1984, en Finlande, où un risque de carence en SeO4 2-SeO3 2-Se 2-Se-Cys Se-Met Se-cystathione Se-homocystéine Protéines séléniées Sol Sol
Se-methyl Se-Met DMSe
DMDSe
Se-methyl Se-Cys Plante accumulatrice
sélénium de la population avait été dénoncé. De nombreux travaux ont été publiés concernant l’impact de cette application sur les concentrations séléniées des aliments (47, 54, 55, 56). Les répercussions semblent variables selon les catégories alimentaires : augmentation de la concentration en sélénium de 10 à 13 fois pour les céréales, la viande et le lait, 6 fois pour le fromage et 3 fois pour les œufs (47). Grâce à cette mesure, le problème de déficience séléniée de la population semble avoir été résolu. En effet, les apports séléniés des finlandais atteignent aujourd’hui 100-200 µg.j-1 (56) alors qu’ils étaient de 30 à 40 µg.j-1 avant la mise en place de cette politique (en 1978, 57).
Cependant, la concentration séléniée du sol ne suffit pas pour prédire la richesse des végétaux. Par exemple, les sols finlandais ne sont pas exceptionnellement pauvres en sélénium (47). Les sols d’Hawaï riches en sélénium (6 à 15 µg.g-1) ne produisent pas de végétation sélénifère et à l’inverse, les sols du sud Dakota et du Kansas contenant moins de 1 µg.g-1 produisent une végétation riche en sélénium (24).
En général, seulement une petite portion des éléments-traces du sol est biodisponible (29) (la biodisponibilité est définie comme la part du nutriment ingéré utilisée pour les fonctions physiologiques ou le stockage (58)). La biogéochimie du sélénium est complexe. La mobilité et la disponibilité de cet élément dans les sols sont contrôlées par des procédés chimiques tels que la précipitation-dissolution, l’adsorption-désorption, la complexation-dissociation et l’oxydo-réduction.
Ainsi, la part de sélénium disponible à la plante dépend de l’importance relative de chaque procédé, fonction des propriétés du sol :
- le pH et le potentiel redox du sol vont influer sur la stabilité des formes
physico-chimiques du sélénium (Cf. Figure 4 page 22). Ces formes présentent des mobilités différentes (par mobilité croissante) : séléniure < sélénium élémentaire < sélénite < séléniate (34). Ainsi, plus le milieu est réducteur, plus les espèces séléniées deviennent immobiles : les séléniures de métaux et le sélénium élémentaire sont insolubles, les sélénites sont peu disponibles car ils se fixent très fortement aux hydroxydes ferriques formant une entité insoluble, tandis que les ions séléniates sont solubles et assimilables. Cette différence d’adsorption sur les hydroxydes ferriques est expliquée par une différence de complexation : l’ion séléniate serait faiblement lié à la goethite par une complexation de surface alors que l’ion sélénite serait fortement lié par formation d’un complexe interne excluant les molécules d’eau et générant une proximité plus importante sélénium-fer au sein du complexe (59).
Dans les sols acides et faiblement aérés, le sélénium est principalement sous forme de séléniure et de sélénium métallique insoluble. Dans les sols alcalins, bien aérés, le sélénium est oxydé sous forme d’ions séléniates facilement assimilables par les plantes (34, 47, 60, 61).
- la teneur en sels minéraux du sol (60) (naturelle ou modifiée suite à l’addition de
fertilisants) : par exemple, l’utilisation de fertilisants contenant du sulfate, du phosphore, ou de l’azote peut diminuer l’absorption du sélénium (24).
- la teneur en matières organiques du sol : certains auteurs ont observé une
corrélation inverse entre la teneur en matières organiques du sol et la teneur en sélénium soluble dans l’eau (biodisponible) (62, 63).
Le climat (la température, l’humidité et l’irrigation) semble également un facteur déterminant (30, 60). En effet, la biodisponibilité du sélénium dans les zones tropicales semble supérieure à celle observée dans les régions froides et tempérées parce que la roche mère est plus vite érodée, que les sols sont généralement plus alcalins et contiennent moins de matières organiques. Le sélénium est également plus disponible à la plante lors de conditions de faibles précipitations. En effet, certains auteurs ont noté que l’irrigation engendre une diminution significative de la concentration séléniée des céréales (30-75%) et proposent trois hypothèses pour expliquer ce phénomène : un effet de dilution, une compétition de l’absorption du sélénium avec le soufre contenu dans l’eau d’irrigation et une augmentation des pertes par lixiviation (64).
Enfin, le mode d’agriculture peut également jouer un rôle. Certains auteurs pensent que la concentration de sélénium dans les plantes cultivées est plus faible qu’il y a 50 ans suite à l’avènement des méthodes d’agriculture et de production modernes (agriculture intensive). En effet, la même quantité de sélénium doit être partagée par des plantes bien plus nombreuses (65). Cette hypothèse a été confirmée par Ekholm et al. (55) qui ont observé une diminution significative de la concentration des éléments-traces des végétaux depuis 30 ans.
1.8 Le sélénium chez les animaux
1.8.1 Chez les animaux d’élevage
La source de sélénium des animaux provient de leur alimentation. Comme celle-ci peut être très variable en fonction des zones géographiques, les animaux peuvent souffrir de symptômes de carence ou de toxicité :
- les symptômes de carence en sélénium sont appelés la « maladie du muscle blanc » : il s’agit d’une dystrophie musculaire affectant particulièrement les animaux en période de croissance. Ces animaux deviennent faibles et ne peuvent plus se nourrir. La mort subite peut survenir si une complication cardiaque se produit (66).
- les signes de toxicité varient selon les espèces mais deux tableaux cliniques principaux sont décrits :
o la maladie alcaline : elle fait suite à un empoisonnement chronique par l’ingestion de plantes riches en sélénium (plantes accumulatrices secondaires). Elle est caractérisée par des atteintes de la peau et des sabots (24, 66).
o le syndrome des « blind staggers » ou « animaux titubants » : il serait causé par l’ingestion de plantes accumulatrices primaires qui entraînerait des atteintes musculaires (y compris respiratoire) ainsi qu’une cécité.
A dose satisfaisante (environ 100 à 300 µg de sélénium par kg de poids frais de nourriture), il a été noté que le sélénium pouvait avoir des effets bénéfiques sur la croissance, la santé et la production des animaux (66, 67). Ces observations sont à l’origine de l’utilisation du sélénium de plus en plus répandue dans le domaine agricole. Par exemple, en Finlande, les animaux commerciaux (porcs) sont supplémentés en sélénite depuis 1969 (47), comme en Australie, bien qu’il n’y ait pas de cas majeur de déficience en sélénium observé chez les animaux dans ce pays (66). Cette supplémentation est introduite soit directement à l’animal par voie injectable ou orale (incorporation de sélénite ou séléniate dans l’eau ou au bloc de sel, utilisation de comprimés à relargage lent dans l’intestin de l’animal…), soit indirectement par application de sélénium sur les pâtures (pour augmenter la teneur des plantes ingérées par les animaux) (66, 67). Ainsi, l’apport sélénié de l’animal va dépendre de la pratique de supplémentation en sélénium. En France, le porc industriel serait plus concentré que le porc fermier de par la supplémentation effectuée dans l’élevage industriel (24).
1.8.2 Chez les animaux de laboratoire : tests de toxicité
1.8.2.1 Toxicité aiguë
Le Tableau 3 présente les résultats de toxicité aiguë exprimés en dose létale 50 (DL50) c’est à dire la dose entraînant la mort de 50% des animaux.
Tableau 3 : Doses létales 50 déterminées pour différentes espèces animales et différentes espèces séléniées (27).
Composé sélénié Espèce animale DL50 orale mg.kg-1
Sélénium élémentaire Rat/cobaye 6700
Sélénite de sodium Rat/souris
Lapin Cobaye
7 2,25 5,06
Séléniate de sodium Rat
Lapin
1,6 2,25
Sulfure de sélénium Souris
Rat Lapin
370 38 55
Les valeurs de doses létales diffèrent selon les espèces animales et la spéciation du sélénium.
Ainsi, chez l’animal, les espèces les plus solubles (sélénite et séléniate) seraient les plus toxiques (27). D’autres auteurs considèrent que la toxicité des sels inorganiques est peu différente de celle des acides aminés séléniés, la DL50 restant inférieure à 10 mg.kg-1 de poids corporel en moyenne (par ingestion) (68).
Les modifications observées après une exposition orale sont localisées au niveau (27) : - du système nerveux central : faiblesse musculaire, perte de vigilance, irritabilité, - du tractus respiratoire : congestion, hémorragies et oedèmes pulmonaires, provoquant
des difficultés respiratoires jusqu’à des spasmes d’asphyxie et la mort par arrêt respiratoire,
- du foie et des reins : modification du fonctionnement (à l’autopsie : congestion et nécrose hépatique et une congestion rénale accompagnée d’hémorragies),
- de la peau et des poils : dermatite et perte de poils,
- des paramètres sériques : augmentation du taux d’hémoglobine et de l’hématocrite (chez le chien).
1.8.2.2 Toxicités subchronique et chronique
Les études de toxicités subchronique et chronique ont permis d’estimer des valeurs de Dose Sans Effet Indésirable Observé (DSEIO) récapitulées dans le Tableau 4 (27).
Tableau 4 : Dose Sans Effet Indésirable Observé (DSEIO) déterminées pour les espèces inorganiques de sélénium (27).
Composé sélénié Mode d’ingestion orale Espèce animale DSEIO mg.kg-1.j-1 Durée
Sélénite de sodium
Dans la nourriture Dans l’eau de boisson
Rat Hamster Rat Souris 0,2 0,61 0,4 0,9 42j 42j 90j 90j Séléniate de sodium
Dans l’eau de boisson Rat
Souris
0,4 0,8
90j 90j
Une diminution de croissance, une baisse de la prise de poids, des lésions hépatiques (cirrhose, nécrose…), pancréatiques (hypertrophie) et spléniques sont observées. La baisse de consommation hydrique provoquerait une modification des paramètres biologiques sériques et urinaires.
2 C
INETIQUE ET METABOLISME DU SELENIUM CHEZ L’
HOMME2.1 Voies d’absorption
2.1.1 Absorption pulmonaire
Par cette voie, l’apport est estimé à 4,2 ng.j-1 ce qui est négligeable (32). Cependant, en cas d’exposition professionnelle, cette voie peut devenir importante (23).