Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées
Laboratoire Signalisation et transports ioniques membranaires - STIM (Poitiers) (Diplôme National - Arrêté du 25 mai 2016)
École doctorale : Biologie-santé - Bio-santé (Limoges) Secteur de recherche : Biomolécules, pharmacologie, thérapeutique
Présentée par : Élodie Péraudeau
Évaluation et optimisation de l'efficacité de conjugués anticancéreux ciblant les récepteurs de l'acide folique
Directeur(s) de Thèse : Laurent Cronier, Jonathan Clarhaut Soutenue le 07 décembre 2016 devant le jury
Jury :
Président Sebastien Papot Professeur, Université de Poitiers
Rapporteur Frederic Blanchard Directeur de recherche, INSERM, Université de Nantes Rapporteur Fabrice Soncin Directeur de recherche, INSERM, Université de Lille Membre Laurent Cronier Maître de conférences, Université de Poitiers
Membre Jonathan Clarhaut Ingénieur de recherche, CHU, Université de Poitiers Membre Francois Guilhot-Gaudeffroy Professeur et praticien hospitalier, Université de Poitiers Membre Frédéric Schmidt Directeur de recherche CNRS, Institut Curie, Paris
Membre Nicolas Guilbaud Directeur de recherche, P. Fabre pharmaceutics, Toulouse
Pour citer cette thèse :
Élodie Péraudeau. Évaluation et optimisation de l'efficacité de conjugués anticancéreux ciblant les récepteurs de
l'acide folique [En ligne]. Thèse Biomolécules, pharmacologie, thérapeutique. Poitiers : Université de Poitiers, 2016.
T
HESE DE DOCTORAT
Pour l’obtention du grade deD
OCTEUR DE L
’U
NIVERSITE DE
P
OITIERS
Faculté des Sciences Fondamentales et Appliquées Diplôme national – Arrêté du 25 Avril 2012
Ecole doctorale Biosanté n°524 Discipline Biologie, Médecine, santé
Secteur Biomolécules, pharmacologie, thérapeutique
Présentée par
Elodie P
ERAUDEAU
Evaluation et optimisation de l’efficacité de conjugués
anticancéreux ciblant les récepteurs de l’acide folique
Sous la direction des Dr Laurent Cronier et Jonathan Clarhaut et du Pr François Guilhot
Soutenue publiquement le 07 Décembre 2016 devant la commission d’examen
J
URY
Dr Frédéric BLANCHARD Directeur de Recherche INSERM, Université de Nantes
Rapporteur
Dr Fabrice SONCIN Directeur de Recherche INSERM, Université de Lille
Rapporteur
Dr Nicolas GUILBAUD Directeur de l’innovation externe en oncologie, Pierre Fabre Pharmaceutics, Toulouse
Examinateur
Dr Frédéric SCHMIDT Directeur de Recherche CNRS Institut Curie, Paris
Examinateur
Pr Sébastien PAPOT Professeur Universitaire Université de Poitiers
Examinateur
Pr François GUILHOT Professeur Universitaire-Praticien Hospitalier CHU et Université de Poitiers
Examinateur
Dr Laurent CRONIER Maitre de Conférences Universitaire Université de Poitiers
Examinateur
Dr Jonathan CLARHAUT Ingénieur de Recherche
CHU et Université de Poitiers
R
EMERCIEMENTS
C’est en toute logique que mes premiers remerciements s’adressent à mes directeurs de thèse et tout particulièrement au Dr Jonathan Clarhaut, pour la confiance qu’il m’a accordée en me recrutant d’abord en master puis en re-signant pour trois années supplémentaires ! Et dire que tout est parti d’un coup du sort… Bien sûr, je te remercie pour la formation scientifique et technique que tu m’as apportée. Mais aussi pour des qualités plus subtiles à insuffler à un étudiant comme l’autonomie et la confiance en ses capacités. Merci d’avoir imaginé tous les projets qui nous attendent, qui nous poussent vers de nouvelles techniques et qui font que j’ai hâte de retourner à la paillasse (et en réunion dès le lendemain de la soutenance…)!
Je tiens à exprimer toute ma gratitude au Dr Laurent Cronier qui n’a pas hésité à prendre la direction de cette thèse et qui a souvent représenté la voix de la raison dans nos discussions et réunions. Merci pour votre présence et votre implication ainsi que pour la patience dont vous avez fait preuve concernant l’apprentissage de la manipulation sur animaux qui fut long et pas évident…
Ma reconnaissance s’adresse aussi au Pr François Guilhot qui, malgré son emploi du temps chargé, a apporté son regard de clinicien expérimenté sur mes résultats au cours de nos réunions.
Je souhaiterais remercier les membres extérieurs de mon jury de thèse, le Dr Frédéric Blanchard, le Dr Fabrice Soncin, le Dr Nicolas Guilbaud et le Dr Frédéric Schmidt, qui ont accepté d’accorder de leur temps pour faire le déplacement et évaluer mon travail de thèse.
Toute ma gratitude s’adresse à l’ensemble du personnel du laboratoire de Signalisation et Transports Ioniques Membranaires, en particulier aux membres de l’équipe Implications Physiologiques et Physiopathologiques des Connexines qui m’ont accueillie et avec qui j’ai pu collaborer. Je n’oublie pas non plus les donateurs et les associations qui ont soutenu et permis la réalisation de cette thèse : Sport et Collection, La Ligure Contre le Cancer, le Centre Hospitalier Universitaire de Poitiers et France
pour votre soutien et votre bonne humeur de (presque) tous les jours.
Merci également aux chimistes de L’institut de Chimie des Milieux et des Matériaux de Poitiers avec qui j’ai eu la chance de collaborer toute ces années et en particulier au Pr Sébastien Papot, même si je le l’entends déjà me chambrer en relisant ce passage avec une voix beaucoup trop aiguë pour lui… Merci pour ta présence, ton optimisme et ta créativité. J’ai tout de même le regret d’émettre quelques réserves sur tes talents de graphiste…
Enfin, et de manière plus personnelle ma profonde gratitude s’adresse à mes parents, qui m’ont toujours soutenue et cru en moi et qui ont sacrifié beaucoup pour m’emmener jusque-là. Merci à toi, Quentin, pour ta patience, ton soutien et ta compréhension indéfectibles. Merci à tous mes amis et notamment à Elodie avec qui j’ai vécu cette aventure en parallèle, mais aussi à Jacques, Valentine et Clément avec qui j’ai fait mes premiers pas à Poitiers il y a presque 10 ans maintenant !
A
VANT
-
PROPOS
L’ère de la chimiothérapie pour le traitement du cancer a débuté dans les années 1940. En dépit des nombreux progrès réalisé depuis, l’efficacité de cette stratégie de soin est toujours limitée par les nombreux et sévères effets secondaires qu’elle entraine. Mon travail de thèse entre dans le cadre du développement de nouveaux médicaments conçus pour cibler et détruire sélectivement les tumeurs. L’introduction présentée dans ce document abordera succinctement les différentes stratégies de ciblage thérapeutique des cancers avant de se focaliser sur les récepteurs à l’acide folique dont le ciblage a constitué la majeure partie de mon travail. J’ai abordé cette thématique selon deux approches :
une approche chimique au cours de laquelle de nouvelles molécules plus performantes ciblant les récepteurs à l’acide folique ont été développées et testées en collaboration avec les chimistes du groupe ;
une approche biologique qui a consisté à modifier les cellules tumorales pour augmenter la quantité de récepteurs à l’acide folique afin de faciliter leur reconnaissance et leur élimination par nos agents anticancéreux.
Ces travaux ont donné lieu à la publication de trois articles alors qu’un quatrième est en cours de rédaction. De plus, au cours de ces trois années, j’ai eu l’opportunité de participer à des études exploitant d’autres stratégies de ciblage thérapeutique donnant lieu à trois autres publications et qui seront présentées de manière concise à la fin de ce document.
S
OMMAIRE
1
erePartie : Etat de l'art ... 1
1
erChapitre
– Généralités sur le cancer ... 1
I. Le cancer en quelques chiffres ... 1
II. Cancer : définition ... 2
2
eChapitre
– De la chimiothérapie à la nanomédecine ... 5
I. Des chimiothérapies classiques au ciblage des tumeurs ... 6
A. Les chimiothérapies classiques ... 6
B. Notion de ciblage tumoral ... 7
II. Les thérapies ciblées ... 8
III.Les chimiothérapies vectorisées ... 10
A. Définition ... 10
B. Comment cibler les tumeurs? ... 10
1.Ciblage passif des tumeurs solides, exemple de l’« effet EPR » ... 11
2.Ciblage actif des tumeurs ... 12
C. Différents types de vecteurs ... 13
1.Les nanotransporteurs ... 13
2.Les conjugués d’agents anticancéreux ... 14
3
eChapitre
– Les folates et leurs transporteurs ... 16
I. Les folates ... 16
II. Le transport des folates ... 17
A. Le transporteur de folates réduits (RFC) ... 17
1.Structure du gène et de la protéine RFC ... 17
2.Transport des folates par le RFC ... 18
3.Expression et physiopathologies liées aux RFC ... 18
B. Le transporteur de folates couplés aux protons (PCFT) ... 19
1.Structure du gène et de la protéine PCFT ... 19
1.Généralités sur les FR ... 21
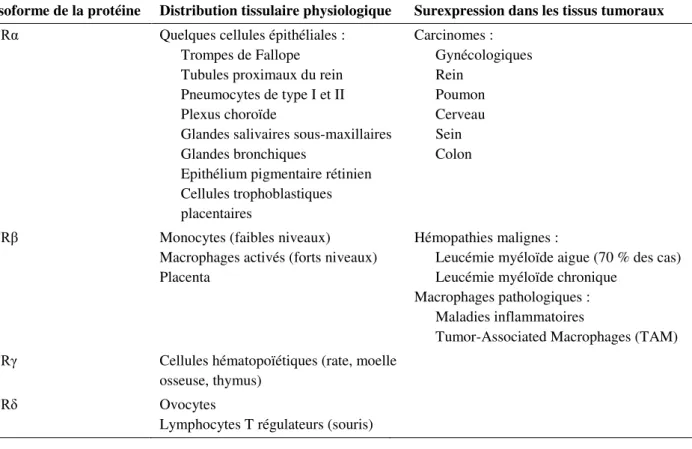
2.Différentes isoformes de FR ... 22
3.Transport des folates et recyclage de FRα et FRβ ... 25
4.Physiopathologies liées au récepteur FRα ... 25
5.Physiopathologies liées au récepteur FRβ ... 28
4
eChapitre
– Vectorisation et ciblage par l’acide folique ... 31
I. Les vecteurs de l’acide folique pour l’imagerie médicale ... 31
A. Généralités ... 31
B. Exemple de l’Etarfolatide ... 32
II. Des vecteurs de l’acide folique à visée thérapeutique ... 33
A. Généralités ... 33
B. Exemple du Vintafolide ... 34
2
ePartie : Objectifs de la thèse ... 36
5
eChapitre
– Contexte scientifique & travaux antérieurs ... 36
I. Synthèse et validation d’un vecteur dérivé de la doxorubicine ... 37
II. Synthèse du vecteur dérivé de la MMAE ... 38
III.Transfert du concept sur cellules de patients ... 40
→ Clarhaut J. et al., 2013, Leukemia Research...43
6
eChapitre
– Objectifs de la thèse ... 42
3
ePartie : Matériels & Méthodes ... 44
I. Culture cellulaire ... 44
A. Modèles cellulaires ... 44
B. Décongélation, entretien, congélation ... 44
2.Entretien des cellules ... 44
3.Congélation des cellules ... 45
II. Etude de cytotoxicité ... 46
A. Mesure de la viabilité cellulaire ... 46
1.Principe ... 46
2.Protocole ... 46
B. Mesure de la prolifération cellulaire ... 47
1.Principe ... 47
2.Protocole ... 47
C. Mesure de l’apoptose ... 48
1.Principe ... 48
2.Protocole ... 48
D. Test de morphogenèse sur Matrigel® ... 49
III.Mesure de l’expression d’un gène par réaction en chaine par polymérase ... 50
A. Extraction des ARN totaux ... 50
1.A l’aide du kit Promega ... 50
2.A l’aide du kit Macherey-Nagel ... 51
3.Extraction d’ARN sur de petites quantités de cellules ... 51
B. Qualité et dosage des ARN totaux ... 52
C. Transcription inverse des ARN ... 52
1.A l’aide du kit Invitrogen ... 52
2.A l’aide du kit Quanta ... 52
D. PCR quantitative en temps réel ... 53
1.Principe ... 53
2.Protocole ... 53
3.Analyse des résultats ... 54
IV.Etude de l’expression et de la localisation d’une protéine ... 54
A. Etude de l’expression par Western blot ... 54
B. Etude de la localisation par immunofluorescence ... 55
V. Etude de la résistance à l’anoïkis ... 56
VII. Etudes in vivo ... 58
A. Etude de l’efficacité antitumorale du vecteur MGAF ... 58
B. Analyse histopathologique des organes ... 59
4
ePartie : Résultats ... 60
7
eChapitre
– Optimisation chimique ... 60
I. Synthèse et évaluation du vecteur diDGAF ... 60
A. Introduction et principe de l’étude ... 60
B. Résultats biologiques principaux ... 61
→ Grinda M. et al., 2013, Organic & Biomolecular Chemistry...64
II. Synthèse et évaluation du vecteur diMGAF ... 63
A. Introduction et principe de l’étude ... 63
B. Résultats biologiques principaux ... 64
→ Alsarraf J. et al., 2015, Chemical Communication...64
8
eChapitre
– Optimisation biologique ... 65
I. Comment modifier l’expression du gène FOLR1 ? ... 65
II. Evaluation in vitro du mélange DV ... 67
A. Caractérisation des lignées KB et A549 ... 67
B. Effet du mélange DV sur les cellules KB et A549 ... 68
1.Toxicité du mélange adjuvant ... 68
2.Effet sur l’expression des récepteurs FR ... 68
C. Effet du mélange DV sur d’autres lignées tumorales ... 69
1.Caractérisation des lignées cellulaires ... 69
2.Toxicité et stimulation de FOLR1 induite par le mélange DV ... 70
D. Spécificité de la stimulation de FOLR1 ... 71
E. Réversibilité de l’effet du traitement adjuvant ... 71
F. Effet du traitement adjuvant sur les cellules saines ... 72
A. Le mélange DV augmente-t-il in vivo l’expression tumorale des FR ? ... 73
1.Expression de FOLR1 et FOLR2 dans les tumeurs ... 73
2.Expression de FOLR1 et FOLR2 dans les cellules saines ... 74
B. Modulation de l’activité antitumorale d’un vecteur ... 75
1.Effet sur la croissance tumorale ... 75
2.Mesure de la quantité d’agent anticancéreux libéré ... 76
C. Toxicité du cotraitement – effets indésirables ... 77
1.Comportement et poids des souris ... 77
2.Etude histopathologique des organes sains ... 77
IV. Mécanismes impliqués dans la modulation de l’activité du vecteur MGAF ... 79
A. Internalisation du vecteur MGAF ... 79
B. Effet du cotraitement sur la viabilité des cellules KB ... 79
C. Toxicité du cotraitement sur les cellules cultivées en condition sans ancrage ... 80
1.Effet sur la croissance des cellules dans une matrice semi-solide ... 80
2.Effet sur l’apoptose dans les cellules KB cultivées en suspension... 81
3.Effet sur les cellules HeLa, A2780 et A549 ... 82
5
ePartie : Discussion & Perspectives ... 84
I. Optimisation chimique des vecteurs dérivés de l’acide folique ... 84
II. Optimisation biologique du ciblage des récepteurs à l’acide folique ... 86
A. Stimulation du gène FOLR1 ... 86
B. effets du mélange DV in vivo ... 89
C. Stimulation de l’activité d’un vecteur anticancéreux... 92
9
eChapitre
– Développement d’un vecteur ciblant le
microenvironnement tumoral ... 98
→ Renoux B.. et al., 2016, Angewandte Chemie (soumis)...102
10
eChapitre
– Autres stratégies de ciblage thérapeutique ... 103
→ Rubio S. et al., 2016, Peptide Science...104
→ Barat R. et al., 2013, Chemical Science...104
I
NDEX DES
F
IGURES
&
Figure Sujet Page
1 Incidence et mortalité associées au cancer 2
2 Incidence et mortalité par cancer 2-3
3 Représentation de la carcinogenèse 2-3
4 Critères d’agressivité des cellules tumorales 3
5 Principe des chimiothérapies conventionnelles et des « Magic bullets » 7 6 Mécanismes des thérapies ciblées, des chimiothérapies classique et vectorisée 8
7 Structure de vaisseaux sanguins normaux et tumoraux 11
8 Principe des ciblages passif et acif 12
9 Représentation des différentes stratégies de vectorisation 13
10 Transport des folates 17
11 Conjugué d’acide folique et de fluorescéine isothiocyanate 31
12 Structure et activité de l’Etarfolatide (99mTc-EC20) 32
13 Structure et mécanisme d’action du Vintafolide (EC145) 34
14 Représentation et mode d’action des vecteurs dérivés de l’acide folique 37
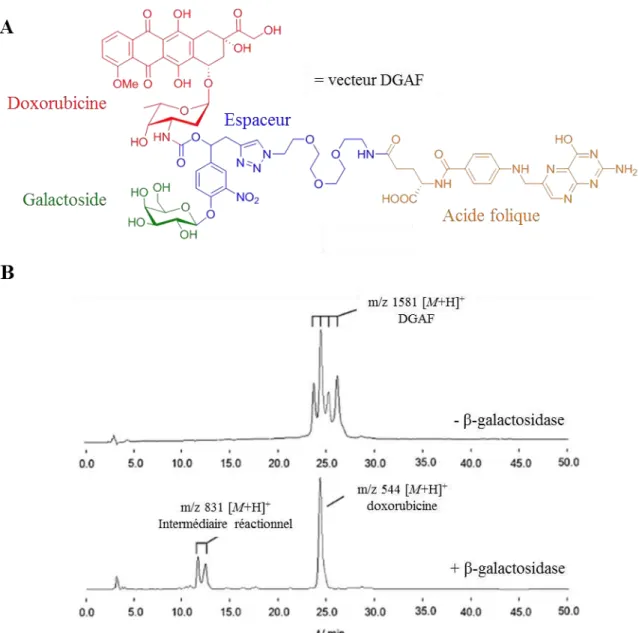
15 Structure et hydrolyse du vecteur DGAF 37-38
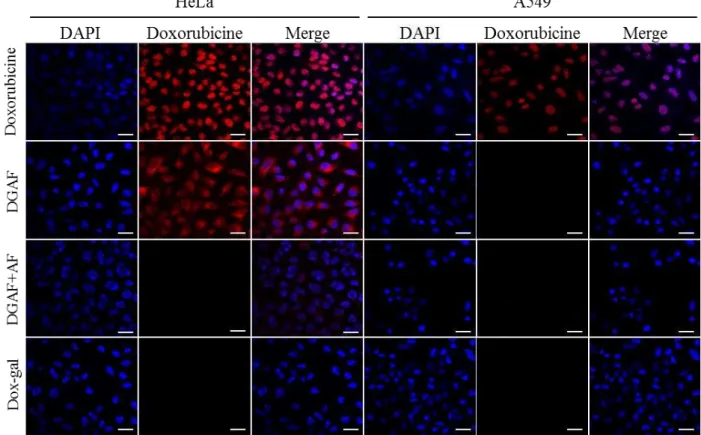
16 Internalisation du vecteur DGAF dans les cellules HeLa et A549 37-38
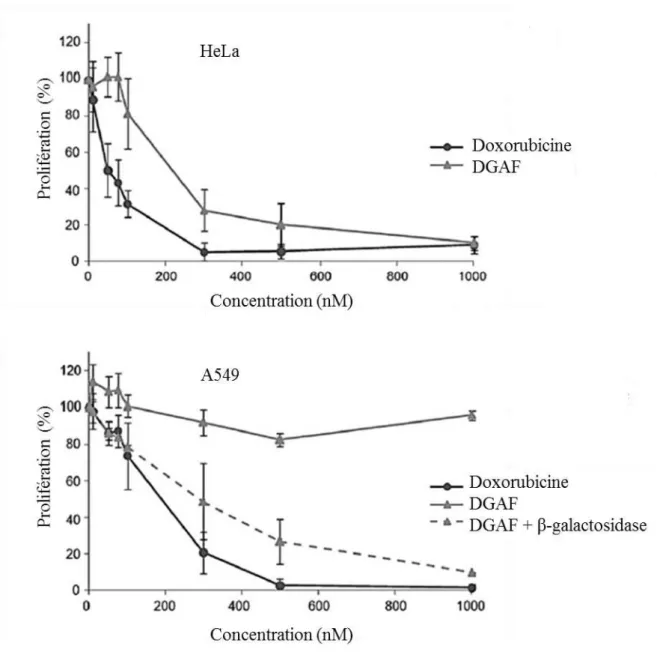
17 Cytotoxicité du vecteur DGAF sur les cellules HeLa et A549 37-38
18 Structure du vecteur MGAF 38-39
19 Toxicité du vecteur MGAF en chambre de Boyden 38-39
20 Efficacité antitumorale du vecteur MGAF in vivo 39
21 Expression de FOLR2 et toxicité du DGAF sur des cellules leucémiques 40 22 Expression de FOLR2 et internalisation du DGAF dans des cellules de patient 41
23 Représentation des deux approches abordées au cours de ma thèse 42
24 Exemple de courbe obtenue en RT-qPCR 54
25 Structure et hydrolyse du vecteur diDGAF 61
26 Etude en microscopie confocale de l’internalisation du vecteur diDGAF 62
27 Toxicité du vecteur diDGAF sur les cellules A2780 et A549 62-63
28 Etude par cytométrie en flus de l’internalisation du diDGAF 62-63
30 Caractérisation de l’expression des FR dans les cellules KB et A549 67
31 Toxicité du mélange DV sur les cellules KB et A549 68
32 Effet du mélange DV sur l’expression des FR dans les cellules KB et A549 69
33 Expression de FOLR1 et FOLR2 des cellules KB, HeLa, A2780 et A549 70
34 Effet du mélange DV sur l’expression des FR dans les cellules HeLa et A2780 71
35 Effet du mélange DV sur l’expression des gènes RFC et PCFT 71-72
36 Réversibilité de l’effet du DV sur l’expression de FOLR1 71-72
37 Effet du mélange DV sur les cellules saines HUVEC 72
38 Effet in vivo du mélange DV sur l’expression des FR tumoraux 73
39 Effet in vivo du mélange DV sur FOLR1 dans les cellules saines 74
40 Effet du mélange DV sur l’activité du vecteur MGAF in vivo 75
41 Effet du mélange DV sur le poids des souris et étude histopathologique 77
42 Quantité de MMAE dans les cellules KB et A549 et cytotoxité 79
43 Croissance des cellules KB en matrice semi-solide d’agarose 80
44 Croissance des cellules KB sur poly-HEMA 81
45 Croissance des cellules HeLa, A2780 et A549 en matrice semi-solide 82 46 Modes d’action hypothétique du mélange DV sur la régulation des FR 86 47 Alternative au VPA et vecteur hétérodimérique dexaméthasone/MS-275 91
48 Mécanismes de déclenchement de l’anoïkis 92
49 Structure du vecteur MMAE-Alb 99
50 Efficacité du vecteur MMAE-Alb in vivo sur des xénogreffes tumorales KB 100 51 Efficacité du vecteur MMAE-Alb in vivo sur des tumeurs orthotopiques du
sein et du pancréas
101 52 Efficacité du vecteur MMAE-Alb in vivo sur la régression des tumeurs
orthotopiques du pancréas de volume important
Tableau Sujet Page
1 Distribution tissulaire des récepteurs à l’acide folique 22
2 Niveau d’expression des récepteurs à l’acide folique dans les cancers 27
3 Toxicité du MGAF en fonction du niveau de FOLR1 38-39
4 Caractéristiques des lignées cellulaires utilisées 45
5 Marquage des cellules par le Apoptotic/Necrotic/Healthy Cell Detection Kit 48
6 Séquences des couples d’amorces utilisés en RT-qPCR 53
7 Anticorps primaires et secondaires utilisés en Western blot 55
8 Anticorps primaires et secondaires utilisés en Immunofluorescence 56
9 Toxicité du vecteur diMGAF sur les cellules HeLa, SKOV-3 et A2780 64
10 Quantification de la MMAE présente dans les cellules A2780 64
11 Facteurs de transcription potentiellement impliqués dans la régulation de FOLR1 87
5’UTR : 5’ Untranslated Region, région non transcrite en 5’ A
ABC : ATP-Binding Cassette ADN : acide désoxyribonucléique ARN : acide riboNucléique ATP : adénosine triphosphate B
Bim : Bcl-2 interacting mediator of cell death BrdU : 5-bromo-2’-déoxyuridine
BSA : Bovin Serum Albumin C
CIPA : Centre d’Imagerie du Petit Animal Ct : Cycle treshold, cycle seuil
D
Dexa : dexamethasone
DGAF : Doxorubicine-Galactoside-Acide Folique diDGAF : diDoxorubicine-Galactoside-Acide Folique diMGAF : diMMAE-Galactoside-Acide Folique dNTP : désoxyribonucléotides
DO : densité optique
DV : mélange adjuvant composé de dexaméthasone et de VPA E
EBM-2 : Endothelial cell Basal Medium-2 EGM-2 : Endothelial cell Growth Medium-2 EMEM : Eagle’s Minimum Essential Medium EPR : Enhanced Permeability and Retention ER : Estrogen Receptor
EthD-III : Ethidium Homodinère III F
FAK : Focal Adhesion Kinase
FDA : Food and Drug Administration FITC : Isothiocyanate de fluorescéine
FR : Folate Receptor, récepteur à l’acide folique G
GPI : Glycosyl PhosphatidylInositol
GRE : Glucocorticoid receptor Response Element H
HDAC : Histone Déacétylase
HER2 : Human Epidermal Growth Factor-2
HPLC : chromatographie en phase liquide à haute performance HRMS : spectrométrie de masse à haute résolution
HRP : Péroxydase de Raifort
HUVEC : Human Umbilical Vein Endothelial Cells I
IRM : Imagerie à Résonance Magnétique K
kDa : kilo Dalton L
LAM : Leucémie Aigue Myéloblastique LMC : Leucémie Myéloïde Chronique -luc : luciférase
M
MAPK : Mitogen-Activated Protein Kinases MDR : Multi-Drug Resistance Proteins MGAF : MMAE-Galactoside-Acide Folique
MHAF : Malabsorption Héréditaire de l’acide folique MMAE : MonoMéthyl Auristatine E
N
NEAA : Non-Essential Amino Acids NRF-1 : Nuclear Respiratory Factor 1 P
PBS : Phosphate Buffered Saline
PCFT : Proton Coupled Folate Transporter, transporteur de folates couplé aux protons PCR : Polymerase Chain Reaction, réaction en chaine par polymérisation
PEG : Poly-Ethylène Glycol PI3K : PhosphoInositol-3-Kinase
R
RFC : Reduced Folate Carrier, transporteur de folates réduits rpm : rotations par minute
RPMI : Roswell Park Memorial Institute RT-qPCR : PCR quantitative en temps réel S
SAHA : acide subéroylanilide hydroxamique siRNA : short interfering RNA
SVF : Sérum de Veau Fœtal T
TEMP : Tomographie par Emission MonoPhotonique TEP : Tomographie par Emission de Positons
THF : Tetrahydrofolate TSA : Trichostatine A V
VEGF : Vascular Endothelial Growth Factor
VEGFR : Vascular Endothelium Growth Factor Receptor VPA : acide valproïque
1
ERE
P
ARTIE
1
1
ER
C
HAPITRE
Généralités sur le cancer
I.
L
E CANCER EN QUELQUES CHIFFRES
Selon le rapport « Les Cancers en France » publié en 2014 par l’Institut National du Cancer, le nombre de nouveaux cas de cancers (toutes origines confondues) diagnostiqués en France a augmenté d’environ 109 % chez l’homme comme chez la femme entre 1980 et 2012 (Figure 1). Ainsi, un homme sur deux et une femme sur trois de moins de 85 ans se voient diagnostiquer un cancer. Ces chiffres sont liés à l’accroissement et au vieillissement de la population française mais également à l’amélioration des techniques de dépistage de cette maladie. Le cancer le plus fréquent chez l’homme est de loin le cancer de la prostate (56 800 cas par an), suivi du cancer du poumon (28 200 cas par an) et du cancer colorectal (23 200 cas par an ; Binder-Foucard et al., 2014). Avec 48 800 nouveaux cas diagnostiqués en 2012, le cancer du sein est le plus fréquent chez la femme, suivis par les cancers colorectaux (18 900 cas) et pulmonaires (11 300 cas ; Figure 2A). Selon cette étude, sur la période comprise entre 1980 et 2012, certains cancers moins fréquents ont vu leur incidence augmenter fortement. C’est le cas des mélanomes de la peau (+ 590,7 %), des cancers de la thyroïde (+ 577,6 %), du foie (+ 350,9 %), du pancréas (+ 247,7 %) et du rein (+ 206,9 %).
Sur la même période, l’amélioration des traitements mais également les diagnostics à des stades précoces de la maladie se sont traduits par une diminution du risque de décès à cause du cancer. Malgré cela, l’accroissement et le vieillissement de la population aboutissent tout de même à une augmentation de plus de 10 % chez l’homme et d’environ 17 % chez la femme du nombre de décès liés à cette maladie (Figure 1). Chez l’homme, le cancer du poumon reste le plus meurtrier avec plus de 21 000 décès estimés, loin devant les cancers colorectaux (9 300 décès) et prostatiques (8 900 décès). Chez la femme, les trois cancers entrainant le plus de
Figure 1. Incidence (A) et mortalité (B) des cancers de toutes origines confondues en France métropolitaine sur la période 1980 - 2012. D’après Binder-Foucard F., 2014 et Les Cancers en France, Les Données, INCa, 2014.
2 mortalité sont les cancers du sein (11 900 décès), du poumon (8 600 décès) et les cancers colorectaux (8 400 décès ; Figure 2B).
Globalement, l’analyse de l’évolution de l’incidence et de la mortalité liée au cancer sur la période 1980 – 2012 montre que pour de nombreux cancers (estomac, col de l’utérus, sein, prostate…) l’incidence et/ou la mortalité ont diminué. En revanche, d’autres cancers présentent des évolutions plus préoccupantes avec une augmentation à la fois de l’incidence et de la mortalité. C’est notamment le cas du cancer du poumon chez la femme, du mélanome cutané et du cancer du système nerveux central (Binder-Foucard et al., 2014).
II.
C
ANCER
:
DEFINITION
Le terme « cancer » regroupe un ensemble de maladies caractérisées par la prolifération et la propagation incontrôlées de cellules anormales. On distingue deux grandes catégories de cancers : les cancers dits « solides » qui regroupent les carcinomes d’origine épithéliale et les sarcomes qui apparaissent dans le tissu conjonctif, ainsi que les cancers hématopoïétiques qui affectent des cellules sanguines situées dans la moelle osseuse dans le cadre des leucémies, ou bien dans les organes lymphoïdes (ex : les ganglions lymphatiques) pour les lymphomes.
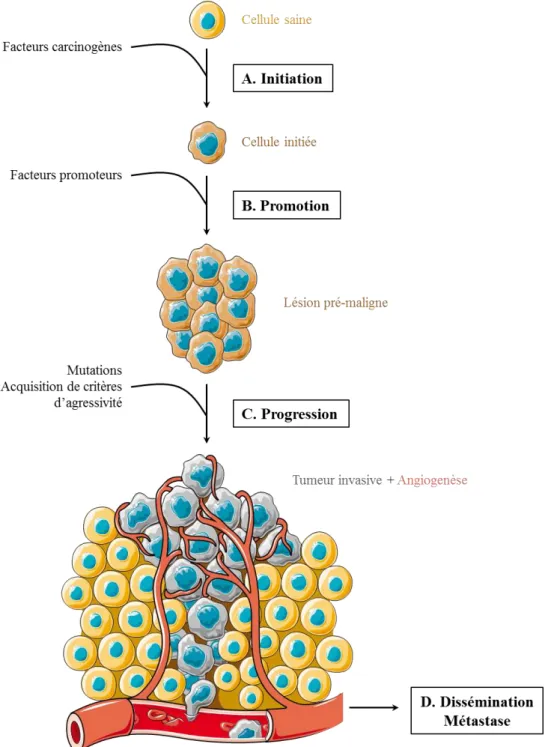
La carcinogenèse est un processus multifactoriel et complexe qui se développe autour de trois étapes principales : l’initiation, la promotion et la progression. De manière simplifiée, au cours de l’initiation, une cellule normale acquiert des anomalies génétiques irréversibles conduisant à sa transformation (Figure 3A). Ces mutations peuvent se produire de manière spontanée, par exemple suite à une erreur lors de la réplication de la cellule, mais dans la plupart des cas, il s’agit d’une conséquence d’une exposition à des agents carcinogènes (polluants, produits chimiques, rayons ultraviolets, virus, etc.) et/ou à l’influence de facteurs intrinsèques (dérèglement hormonal ou immunitaire, mutation héréditaire, etc.). Lorsque ces altérations se produisent au niveau de proto-oncogènes ou de gènes suppresseurs de tumeurs, cela peut conduire à la dérégulation de processus essentiels à l’homéostasie cellulaire tels que la croissance, la prolifération et la survie cellulaires. Ces mutations peuvent également altérer la fonction de gènes impliqués dans la surveillance et la réparation du génome. On parle alors de cellule initiée (pour revue : Oliveira et al., 2007).
Figure 2. Incidence (A) et mortalité (B) estimées par cancer chez les hommes et chez les femmes en France métropolitaine en 2012. Les données concernant la mortalité pour le cancer du foie et du pancréas ne sont pas disponibles compte tenu de leur faible qualité. D’après Binder-Foucard F., 2014.
Figure 3. Représentation de la carcinogenèse. (A) Suite à une mutation spontanée ou à l’exposition à des facteurs carcinogènes, une cellule normale acquière des altérations génétiques irréversibles. C’est l’étape d’initiation. (B) Pendant l’étape de promotion, et en présence de facteurs promoteurs, la cellule initiée prolifère pour former une lésion précancéreuse. (C) La phase de progression correspond à la transformation de la lésion pré-maligne en cancer invasif. Les cellules tumorales sont soumises à une forte instabilité génétique et acquièrent des caractéristiques d’agressivité comme la capacité à envahir les tissus adjacents. (D) La mise en place d’une angiogenèse soutient la croissance tumorale et favorise la dissémination des cellules cancéreuses et la formation de métastases.
Figure 4. Au cours des différentes étapes de la carcinogenèse, une cellule cancéreuse acquiert différents critères d’agressivité. Elle développe une auto-suffisance en facteurs de croissance, une insensibilité aux facteurs anti-prolifératifs et apoptotiques et échappe à la sénescence cellulaire ce qui lui confère un potentiel réplicatif illimité. Elle peut induire une angiogenèse tumorale et développer des capacités d’invasion et un potentiel métastatique.
3 La promotion (Figure 3B) correspond à l’amplification clonale, autrement dit à la prolifération, de la cellule initiée en réponse à des facteurs dits promoteurs tels que peuvent l’être certaines hormones (Mehta, 1995). Contrairement à l’étape d’initiation, la promotion peut être réversible. Après disparition de l’agent promoteur, il peut y avoir régression tumorale, probablement par un processus d’apoptose (Oliveira et al., 2007).
Au cours de ces deux étapes, les cellules transformées subissent des mutations additionnelles ainsi que des réarrangements génétiques qui leur permettent d’acquérir différentes caractéristiques (Figure 4). Elles deviennent notamment indépendantes vis-à-vis des signaux extérieurs de croissance : les cellules mutées sécrètent leurs propres facteurs de croissance et stimulent leur prolifération de manière autocrine (Pedraza-Fariña, 2006). Elles développent également une résistance aux facteurs inhibant la prolifération et déclenchant l’apoptose, ainsi qu’un échappement à la senescence cellulaire (Hanahan and Weinberg, 2011).
L’étape de progression (Figure 3C) correspond à la transition entre une lésion pré-maligne, telle qu’elle peut l’être au cours des étapes d’initiation et de promotion, et le développement d’un cancer invasif. Au cours de cette phase, les cellules mutées acquièrent une capacité invasive et un potentiel métastatique (Figure 4). Elles sont alors caractérisées par une forte instabilité génétique, une croissance rapide et présentent des changements morphologiques, biochimiques et métaboliques (Oliveira et al., 2007). L’angiogenèse, ou la formation de vaisseaux sanguins à partir de vaisseaux préexistants, est également un processus important dans cette étape. En effet, en absence d’angiogenèse, la croissance tumorale est limitée à 1 ou 2 mm3
(Folkman, 1995). Au-delà, les cellules se trouvant au centre souffrent d’hypoxie et de carence en nutriments. Pour y remédier, les cellules sécrètent des facteurs dits pro-angiogéniques dont le Vascular Endothélium Growth Factor ou VEGF est un des plus emblématiques. En se liant à son récepteur (le VEGFR ou Vascular Endothélium Growth Factor Receptor) situé à la membrane des cellules endothéliales, le VEGF stimule la prolifération et la migration de ces dernières, qui vont alors irriguer la tumeur (Figure 3D). Associée au potentiel invasif des cellules tumorales, l’angiogenèse est ainsi un processus clé de la dissémination des cellules malignes et favorise la formation de métastases dans les tissus situés à distance de la tumeur primaire (Hanahan and Folkman, 1996 ; Hanahan and Weinberg, 2000). La lymphangiogenèse qui correspond à la formation de capillaires lymphatiques au niveau de la tumeur participe également à ce phénomène et est impliquée dans la colonisation des ganglions lymphatiques par les cellules cancéreuses (Christiansen and Detmar, 2011).
1ere Partie – Etat de l’art
1er Chapitre – Généralités sur le cancer
4 En conclusion, avec plus de 384 000 nouveaux cas diagnostiqués en 2015 et plus de 149 000 décès liés à cette pathologie, le cancer demeure aujourd’hui encore un problème majeur de santé publique. Cette maladie est également un enjeu socio-économique puisque les dépenses liées à la prise en charge des cancers en 2014 ont représenté plus de 5 milliards d’euros. En France, depuis 2003, la lutte contre le cancer s’est structurée autour de plans nationaux appelés « Plan Cancer » qui définissent des objectifs pour guider la prévention, le dépistage, les soins, la recherche et l'accompagnement des patients. Ainsi, l’objectif 5 du troisième plan cancer s’étalant de 2014 à 2019 souligne l’importance de l’innovation thérapeutique et du développement de la médecine personnalisée notamment avec l’utilisation de nouveaux biomarqueurs pour le choix des traitements. Il oriente ainsi la recherche vers l’optimisation des traitements et l’amélioration de la qualité de vie des patients.
5
2
E
C
HAPITRE
De la chimiothérapie à la
nanomédecine
Les protocoles de traitement mis en place pour lutter contre les cancers sont choisis en fonction de différents facteurs prenant en compte l’âge et l’état général de la personne, le type et le degré d’extension du cancer dont elle est atteinte ainsi que la présence d’éventuelles autres maladies. La chirurgie, utilisée depuis de nombreux siècles pour l’ablation des tumeurs solides fut longtemps la seule ligne d’attaque contre cette maladie. Aujourd’hui, elle est souvent utilisée avec la radiothérapie pour lutter contre les tumeurs solides. Cependant, ces deux stratégies de soin s’avèrent inefficaces lorsque le cancer est caractérisé par un fort potentiel métastatique, qu’il est disséminé au sein de l’organisme ou que le patient présente un haut risque de rechute. En agissant de manière systémique, les chimiothérapies cytotoxiques permettent de pallier à ce manque car elles peuvent agir sur les cellules malignes disséminées dans l’ensemble du corps.
Bien qu’essentiels encore aujourd’hui dans les protocoles de traitement, le manque de sélectivité des médicaments utilisés en chimiothérapie est souvent responsable de sévères effets secondaires. Un des objectifs présents de la recherche en oncologie médicale est donc de développer des molécules ou des stratégies innovantes capables de rendre l’action de l’agent anticancéreux spécifique des cellules pathologiques à éliminer et, par conséquent, de limiter les effets secondaires vis-à-vis du reste de l’organisme.
1ere Partie – Etat de l’art
2e Chapitre – De la chimiothérapie à la nanomédecine
6
I.
D
ES CHIMIOTHERAPIES CLASSIQUES AU CIBLAGE DES
TUMEURS
A.
L
ES CHIMIOTHERAPIES CLASSIQUESL’aire de la chimiothérapie cytotoxique pour le traitement du cancer a débuté dans les années 1940, lorsque Goodman et Gilman découvrent que les moutardes azotées, des dérivés du gaz moutarde, sont capables d’entrainer une régression tumorale chez des patients atteints de lymphome non-Hodgkinien (Gilman, 1963). Depuis, plusieurs dizaines de molécules cytotoxiques ont été identifiées et sont utilisées pour le traitement des cancers. Il en existe plusieurs catégories, classées par la société Vidal selon leur mode d’action. Les agents alkylants forment des liaisons covalentes avec l’ADN pour en inhiber la réplication. On retrouve dans cette catégorie les moutardes azotées citées ci-dessus, ainsi que la cisplatine qui est fréquemment utilisée contre le cancer ovarien (Dasari and Tchounwou, 2014). Les anti-métabolites comprennent des antifolates tels que le methotrexate et le pemetrexed ainsi que des antipuriques et des antipyrimidiques (fluorouracil). Ces molécules qui inhibent la synthèse des acides nucléiques et bloquent ainsi la réplication sont utilisées pour lutter notamment contre les cancers mammaires, ovariens et colo-rectaux mais également pour le traitement des ostéosarcomes et des choriocarcinomes (tumeurs du trophoblaste ; Gonen and Assaraf, 2012). Les taxanes et les vinca-alcaloïdes tels que la vinblastine appartiennent au groupe des poisons du fuseau mitotique. Ils perturbent la polymérisation des microtubules et empêchent ainsi la division cellulaire. A titre d’exemple, la vinblastine est utilisée dans une variété de cancers incluant les cancers de l’ovaire, de la vessie, du rein (Yue et al., 2010). Enfin, on trouve les inhibiteurs de topoisomérases, des enzymes impliquées dans la réplication de l’ADN. Cette catégorie regroupe les anthracyclines telles que la doxorubicine, une molécule fréquemment utilisée pour le traitement des leucémies et des lymphomes (Rivankar, 2014).
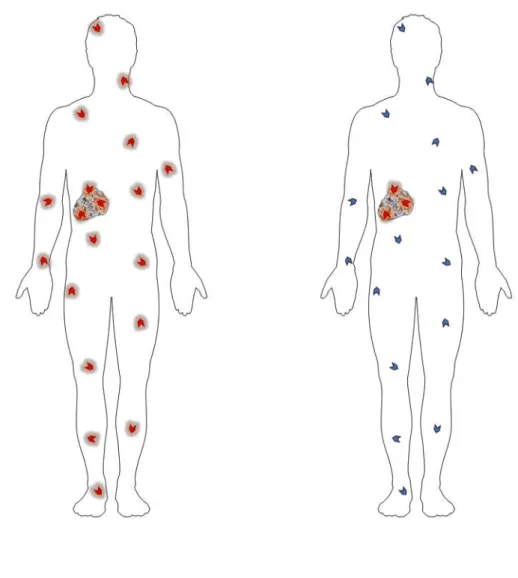
Malgré leur diversité, l’efficacité des chimiothérapies conventionnelles est limitée par les nombreuses contraintes qu’elles entrainent. En effet, les agents utilisés en chimiothérapie traditionnelle exploitent les propriétés cytotoxiques d’agents non spécifiques, qui circulent dans l’ensemble de l’organisme et qui affectent les cellules à division rapide, qu’elles soient cancéreuses ou non (Figures 3). Ce manque de sélectivité vis-à-vis des cellules malignes induit une toxicité importante envers certaines cellules saines telles que les cellules du système
Figure 5. Les chimiothérapies classiques affectent sans discrimination les cellules cancéreuses et les cellules saines (à gauche). Cela se traduit par la manifestation de nombreux effets secondaires chez les patients. Paul Ehrlish proposa la création de « magic bullets », des médicaments qui seraient conçus pour reconnaitre une structure moléculaire pathologique et ainsi épargner les tissus sains (à droite, Strebhardt et Ullrich, 2008).
1ere Partie – Etat de l’art
2e Chapitre – De la chimiothérapie à la nanomédecine
7 immunitaire, les cellules épithéliales gastro-intestinales, les follicules pileux, etc. De nombreux effets secondaires dont la gravité peut varier sont alors observés suite à une chimiothérapie. Par exemple, elles peuvent entrainer une aplasie médullaire (diminution de la proportion d’un ou plusieurs types de cellules sanguines), une inflammation des muqueuses notamment de l’œsophage et du colon pouvant aboutir à la formation d’ulcères, des diarrhées, constipations, nausées et vomissements. Dans les cas les plus graves, les chimiothérapies peuvent être responsables de lésions au niveau des organes, comme la doxorubicine pour laquelle une forte toxicité au niveau du cœur a été rapportée (Rivankar, 2014).
A cause de ces lourds effets secondaires, la quantité d’agent anticancéreux administrée au patient est souvent limitée voir insuffisante pour éradiquer le cancer et l’arrêt prématuré du traitement est parfois recommandé. Par ailleurs, les cellules cancéreuses en présence de ces agents de chimiothérapie traditionnelle développent régulièrement des mécanismes de résistances dits multidrogues. Ces résistances peuvent résulter de plusieurs mécanismes tels que des modifications lipidiques qui entrainent une internalisation moins efficace de l’agent anticancéreux ou à la surexpression d’une famille de transporteurs ABC ou ATP-Binding Cassette (Núñez et al., 2016). Ces protéines, appelées MDR pour Multidrug Resistance Proteins, utilisent l’énergie de l’hydrolyse de l’ATP (adénosine triphosphate) pour prendre en charge l’agent chimiothérapeutique et l’expulser hors de la cellule cancéreuse (Zhang et al., 2015). Elles sont notamment responsables d’une diminution de la sensibilité des cellules cancéreuses pulmonaires à la vincristine, la cisplatine et à la doxorubicine (Young et al., 2001).
B.
N
OTION DE CIBLAGE TUMORALConsidéré comme le père de la chimiothérapie, le célèbre immunologiste Paul Ehrlich avait déjà conscience au début du XXe siècle de la « puissance aveugle » de ces molécules de
chimiothérapie et émit l’idée de la création de « magic bullets », des médicaments attaquant efficacement une structure biologique pathogène tout en demeurant inoffensifs pour le reste de l’organisme (Strebhardt et Ullrich, 2008 ; Figure 5). Dans le cadre du traitement du cancer, cela signifie développer des agents thérapeutiques, utilisés seuls ou en combinaison avec des chimiothérapies traditionnelles et dont l’activité est spécifique des cellules cancéreuses. Cet objectif peut être atteint par deux approches différentes : les thérapies ciblées et les chimiothérapies vectorisées dont les principes sont décrits ci-dessous.
Figure 6. (A) Les thérapies ciblées sont conçues pour altérer des acteurs majeurs de voies de signalisation cruciales au développement du cancer. (B) Les agents anticancéreux utilisés en chimiothérapie classique peuvent souvent pénétrer par diffusion passive dans les cellules cancéreuses mais également dans les cellules saines, causant de nombreux effets secondaires. (C) Enfin, la plupart des vecteurs anticancéreux ciblent des marqueurs moléculaires surexprimés ou exprimés spécifiquement à la surface des cellules malignes. Le vecteur est ensuite internalisé dans la cellule par endocytose et l’agent cytotoxique libéré pour tuer la cellule de l’intérieur.
1ere Partie – Etat de l’art
2e Chapitre – De la chimiothérapie à la nanomédecine
8
II.
L
ES THERAPIES CIBLEES
La première approche pour le ciblage des cellules tumorales est une approche directe : les molécules altèrent directement des voies de signalisation essentielles à la survie ou à la progression tumorale (Figure 6A). La protéine ciblée par le médicament doit être drastiquement surexprimée dans les cellules cancéreuses ou présenter une activité fortement augmentée comparée aux cellules saines. Il peut également s’agir d’une forme mutée de la protéine ou d’une protéine chimérique résultant de la fusion de deux gènes. Dans cette catégorie de médicaments, on trouve généralement des anticorps monoclonaux dont un des plus emblématiques est le Bevacizumab (Avastin®, Genentech). Le Bevacizumab, un anticorps humanisé dirigé contre le VEGF-A (vascular endothelial growth factor A), est utilisé en complément de chimiothérapies classiques pour bloquer l’angiogenèse tumorale (Kim et al., 1993). Il est utilisé pour le traitement de plusieurs cancers tels que les cancers colorectaux, pulmonaires et mammaires mais également pour la prise en charge de certaines formes de dégénérescence maculaire liée à l’âge (Falk et al., 2015).
En plus des anticorps monoclonaux, on trouve également dans cette catégorie de thérapie à ciblage direct de petites molécules inhibitrices comme l’Alpelisib (BYL917, Novartis) ou l’Imatinib mesylate (Glivec®, Novartis). Le BYL917 est un inhibiteur spécifique de la phosphoinositol-3-kinase (PI3K), une protéine à la base de nombreuses voies de signalisation (apoptose, prolifération, différenciation, migration cellulaire, etc.) est fréquemment dérégulée dans de nombreux cancers (Katso et al., 2001 ; Engelman, 2009). Le BYL917 est actuellement testé dans différents essais cliniques de phase 1 pour le traitement de patients souffrant de différents cancers solides (cancers mammaires, colorectaux, ovariens, etc. ; De Buck et al., 2014). De plus, compte tenu des données précliniques et cliniques obtenues pour le BYL917, Gobin et al., ont proposé en 2015 d’utiliser le BYL917 pour le traitement de l’ostéosarcome. Au cours de cette étude préclinique, le BYL917 a montré qu’il était capable d’entrainer une diminution de la croissance tumorale d’une part en inhibant la croissance des cellules tumorales, mais également en influant sur le microenvironnement de la tumeur notamment pour inhiber l’angiogenèse (Gobin et al., 2015).
Un autre exemple de thérapie ciblée est l’Imatinib mesylate. Ce médicament cible différentes protéines ou récepteurs à activité tyrosine-kinase et notamment une protéine particulière présente uniquement dans les cellules malignes de patients souffrant de leucémies
9 myéloïdes chroniques (LMC) : la protéine de fusion BCR-ABL (Rea et al., 2012). Cette protéine est le produit du gène de Philadelphie, un gène de fusion issu d’une altération chromosomique au niveau des gènes BCR et ABL. La protéine BCR-ABL est constitutivement activée et stimule la prolifération des cellules leucémiques (Røsland et Engelsen, 2015). L’Imatinib mesylate est apparu comme une révolution dans le traitement des LMC entrainant des résultats supérieurs au traitement utilisé jusqu’alors (une combinaison d’interféron α et de cytarabine ; O’Brien et al., 2003) et une survie globale à 5 ans de 89 % des patients (Druker et al., 2006). Par ailleurs, l’Imatinib mesylate est également utilisé pour le traitement des tumeurs stromales gastro-intestinales et des dermatofibrosarcomes protuberans dans lesquels il inhibe d’autres protéines tyrosine-kinases telles que le récepteur Kit (Waller, 2014 ; Rutkowski and Debiec-Rychter, 2015).
La seconde approche permettant le ciblage des tumeurs est une approche indirecte qui repose sur la reconnaissance et l’utilisation de caractéristiques spécifiques des cellules tumorales ou de leur microenvironnement pour réaliser l’adressage d’agents chimiothérapeutiques uniquement à ces cellules (Figure 6C). Pour cela, on utilise des vecteurs ou des conjugués, c’est-à-dire des molécules permettant le transport et la protection du principe actif jusqu’au site pathologique à traiter. On parle alors de chimiothérapie vectorisée, une stratégie qui fait l’objet de mes travaux de thèse et qui est décrite plus particulièrement dans le chapitre suivant.
1ere Partie – Etat de l’art
2e Chapitre – De la chimiothérapie à la nanomédecine
10
III.
L
ES CHIMIOTHERAPIES VECTORISEES
A.
D
EFINITIONLa vectorisation consiste à associer un principe actif à une structure ou un édifice moléculaire permettant son transport jusqu’au site d’action où il est libéré de manière contrôlée (Pérez-Herrero and Fernández-Medarde, 2015). La vectorisation d’agents anticancéreux présente de nombreux avantages puisqu’en plus de protéger les tissus sains des agents transportés, les molécules vectorisées permettent d’éviter ou de ralentir la dégradation ou l’élimination du principe actif par l’organisme. Certains composés permettent également de s’affranchir des problèmes de solubilité et de stabilité du principe actif et d’en maitriser les propriétés de pharmacodynamique et de pharmacocinétique (Duncan et Gaspar, 2011). De nombreuses stratégies de vectorisation ont donc été imaginées pour transporter des médicaments ou des agents permettant le diagnostic des tumeurs (agents de contraste pour l’imagerie médicale par exemple). L’objectif de ce chapitre n’est pas d’en dresser une liste exhaustive mais, après une présentation générale de l’adressage de ces molécules vectorisées aux cellules cancéreuses suite à la reconnaissance de marqueurs tumoraux, de décrire les deux grandes familles de vecteurs : les transporteurs et les conjugués.
B.
C
OMMENT CIBLER LES TUMEURS?
A cause de l’instabilité génétique qui caractérise les cellules tumorales, chaque cancer peut être considéré comme unique dans son répertoire de mutations et d’anomalies génétiques. Cependant, les études dites « OMICS » (génomique, protéomique, métabolomique…) menées à grande échelle font ressortir un certain nombre de particularités phénotypiques communes à certaines cellules cancéreuses et permettant leur distinction des cellules saines (Alexandrov et
al., 2013). Ces signatures tumorales, ou marqueurs, sont exprimées par la cellule cancéreuse
elle-même, mais peuvent également être des spécificités du microenvironnement tumoral.
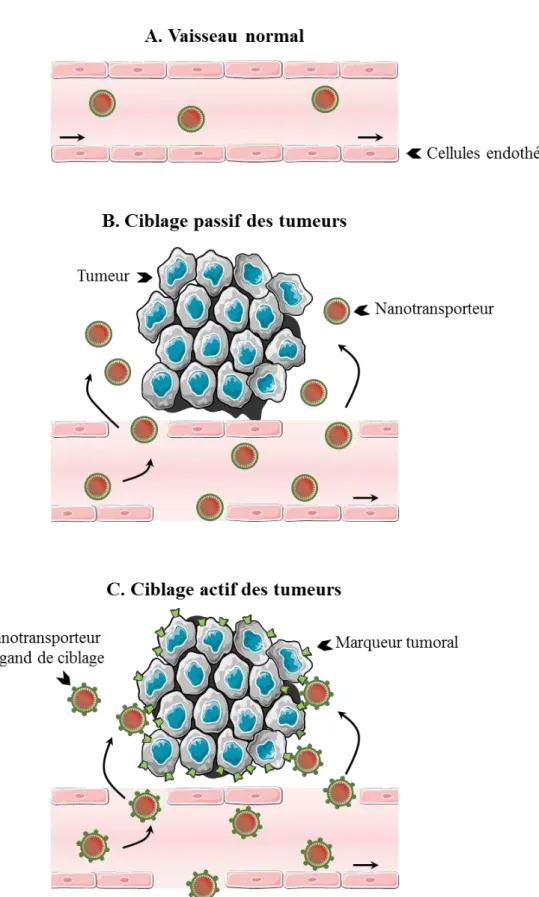
Pour reconnaitre les tumeurs, les molécules vectorisées exploitent deux types de ciblage. Le ciblage passif tire profit des différences physiques entre les cellules saines et les cellules cancéreuses ou leur microenvironnement. Il est principalement utilisé pour le ciblage des
Figure 7. Structure de vaisseaux sanguins normaux (à gauche) et tumoraux (à droite) en microscopie électronique. (A) Les tissus sains murins ont une vascularisation simple et organisée en artérioles, capillaires et veinules. Au contraire, la vascularisation tumorale ne suit pas cette hiérarchie et présente une structure désorganisée et hautement ramifiée (d’après McDonald and Baluk, 2005). (B) Les cellules endothéliales formant la paroi luminale des vaisseaux sanguins sains sont lisses et présentent une structure resserrée, ce qui n’est pas le cas des cellules endothéliales des vaisseaux tumoraux qui forment des pores dans lesquelles les macromolécules peuvent s’accumuler et diffuser vers la tumeur (d’après Baluk et al., 2005).
1ere Partie – Etat de l’art
2e Chapitre – De la chimiothérapie à la nanomédecine
11 tumeurs solides. Le ciblage actif des tumeurs repose sur la reconnaissance de marqueurs moléculaires présents ou surexprimés de manière spécifique sur les cellules cancéreuses, tels que peuvent l’être certains récepteurs membranaires.
1. Ciblage passif des tumeurs solides, exemple de l’« effet EPR »
Le ciblage passif des tumeurs solides exploite les différences physiques entre les tissus tumoraux et les tissus sains pour déposer ou activer plus efficacement la molécule vectorisée là où elle doit agir. Une des caractéristiques les plus exploitées pour ce type de ciblage est la vascularisation anormale des tumeurs. En effet, comme les tissus normaux, les cellules tumorales nécessitent un apport suffisant en nutriments et en oxygène pour survivre et se développer. Pour cela, elles stimulent la formation de vaisseaux sanguins à partir de vaisseaux préexistants par un processus appelé angiogenèse. Chez l’adulte, les cellules endothéliales sont quiescentes en conditions physiologiques et l’angiogenèse, est quasiment inexistante due à la balance entre la production de facteurs pro- et anti-angiogéniques. Les cellules cancéreuses, en sécrétant des facteurs pro-angiogéniques, activent les cellules endothéliales avoisinantes qui prolifèrent alors pour former des vaisseaux et irriguer la tumeur (Folkman, 1995). La production non contrôlée de ces facteurs pro-angiogéniques aboutit à la formation rapide d’un réseau vasculaire dont l’architecture est fragile et aberrante. En effet, outre l’absence de hiérarchisation des vaisseaux sanguins tumoraux, ceux-ci présentent une porosité plus importante que les vaisseaux normaux et sont donc plus perméables aux macromolécules (Figure 7 ; Baluk et al., 2005 ; McDonald et Baluk, 2005 ; Smith et al., 2012). De plus, l’absence ou le faible drainage lymphatique au sein des tumeurs y entraine une rétention des macromolécules. Ce phénomène, appelé effet « EPR » pour « Enhanced Permeabily and Retention », confère un avantage à certains vecteurs comme les liposomes et les nanoparticules qui circulent à travers les pores des vaisseaux sanguins tumoraux et s’accumulent dans les tissus malades (Figure 8 ; Zwicke et al., 2012). Ce ciblage passif est donc conditionné préférentiellement par la taille du vecteur, sans véritable reconnaissance d’une cible moléculaire.
Figure 8. (A) La structure des vaisseaux sanguins normaux empêche l’extravasation des nanotransporteurs. (B) Le ciblage passif des tumeurs tire profit de la fenestration importante des vaisseaux tumoraux. Les nanotransporteurs peuvent alors s’accumuler dans les pores des vaisseaux et rejoindre le microenvironnement de la tumeur. (C) Le ciblage actif des tumeurs est basé sur la reconnaissance de marqueurs moléculaires spécifiques aux cellules tumorales.
1ere Partie – Etat de l’art
2e Chapitre – De la chimiothérapie à la nanomédecine
12 2. Ciblage actif des tumeurs
L’effet « EPR » facilite la localisation efficace de certains vecteurs anticancéreux mais ne promeut pas l’internalisation spécifique du principe actif qu’ils transportent dans la tumeur. Cette seconde étape peut être assurée en intégrant à la structure du vecteur un ou plusieurs éléments de ciblage des cellules tumorales tels que des petites molécules (par exemple de l’acide folique ou des carbohydrates), des peptides, des protéines ou des anticorps. Souvent, ces éléments de ciblage reconnaissent des récepteurs membranaires surexprimés ou exprimés spécifiquement à la surface des cellules cancéreuses et déclenchent l’internalisation du composé au sein de la cellule tumorale par un processus d’endocytose (Figure 6 ; Bazak et al., 2015). En plus de permettre la libération du principe actif directement dans les cellules à éliminer, l’internalisation sélective par endocytose du médicament (comparée à la diffusion passive d’une molécule de chimiothérapie à travers la membrane plasmique) semblerait supprimer le phénomène de résistance multidrogue observé dans certains cancers (Huwyler et al., 2002).
Compte tenu de ces avantages, de nombreux ligands de ciblage sont proposés pour cibler activement les cellules cancéreuses, notamment des anticorps ou des fragments d’anticorps qui sont une des approches les plus avancées, des aptamères, des peptides ou des protéines entières comme la transferrine (une glycoprotéine sérique), différents ligands, etc. A titre d’exemple, la sous-unité B non toxique de la toxine Shiga, produite par une bactérie intestinale pathogène, a été conjuguée à différents agents anticancéreux. Le composé est internalisé via l’interaction de la sous-unité B de la toxine et son récepteur Gb3 surexprimé notamment dans les cancers colorectaux. In vitro, ces composés montrent des résultats prometteurs sur des cellules de cancer du côlon (HT29) avec des concentrations inhibitrices médianes (IC50) de l’ordre du nanomolaire
Figure 9. Représentation schématique de différentes stratégies de vectorisation anticancéreuse. Il existe deux grandes familles de vecteurs : les conjugués en rouge et les transporteurs en bleu, dont la liste n’est pas exhaustive et qui sont classés selon la nature de leurs composants (d’après Wicki et al., 2015).
1ere Partie – Etat de l’art
2e Chapitre – De la chimiothérapie à la nanomédecine
13
C.
D
IFFERENTS TYPES DE VECTEURSIl existe toute une variété de vecteurs même si beaucoup sont encore à des stades précoces de développement. Ils diffèrent par leur taille, leur structure, la nature de leurs composants, etc., ce qui rend leur classification assez difficile. Cependant, il est possible d’en faire ressortir deux grandes catégories : les nanotransporteurs qui « encapsulent » le principe actif, et les conjugués qui sont des structures liant de manière covalente un élément de ciblage des cellules tumorales et le principe actif (Figure 9).
1. Les nanotransporteurs
Les nanotransporteurs représentent la plus grande catégorie de vecteurs. Ce sont des assemblages moléculaires de taille nanométrique dans lesquels plusieurs molécules de principe actif (petites molécules de faible poids moléculaire ou macromolécules telles que des gènes ou des protéines) sont piégées pour permettre leur transport jusqu’au site d’action. Ils ont généralement un diamètre compris entre 10 et 200 nm, leur conférant une taille suffisante pour éviter leur élimination par le rein (Venturoli et Rippe, 2005) et une taille optimale à leur extravasation entre les cellules endothéliales des vaisseaux sanguins tumoraux (Dreher et al., 2006). La libération des molécules de principe actif est réalisée dans le microenvironnement de la tumeur (ciblage passif) ou directement dans la cellule à éliminer (ciblage actif) suite à la décomposition du vecteur. Les propriétés de cette décomposition peuvent être modulées en modifiant les composants du transporteur.
Il existe une très grande variété de ce type de vecteurs répartis selon Wicki et al. en quatre classes en fonction de la nature des composants utilisés (Wicki et al., 2015 ; Pérez-Herrero et Fernández-Medarde, 2015 ; Figure 9). Ainsi, il existe des nanoparticules virales conçues pour se répliquer préférentiellement dans les cellules cancéreuses et qui entrainent leur destruction en détournant les voies de signalisation de la cellule hôte et/ou en recrutant le système immunitaire. On peut également citer les nanoparticules inorganiques qui peuvent être utilisées comme sensibilisateurs à la radiothérapie ou pour l’ablation thermique des tumeurs (NanoTherm® développé par MagForce AG pour l’ablation des glioblastomes, Rivera Gil et al., 2010). On retrouve également les nanoparticules polymériques qui sont composées d’un enchevêtrement de biopolymères piégeant les molécules de principe actif à transporter.
14 Enfin, il est possible de trouver dans cette catégorie des liposomes, des structures composées d’une bicouche phospholipidique formant un compartiment dans lequel se trouve le principe actif (qui peut également être piégé dans la bicouche phospholipidique selon sa nature). D’ailleurs, un des premiers nanotransporteurs lipidiques mis sur le marché est le Doxil®, ou Caelyx® en Europe. Il s’agit d’un liposome contenant de la doxorubicine et recouvert de polyéthylène glycol pour augmenter la durée de circulation systémique du composé. Il est aujourd’hui utilisé pour le traitement du cancer du sein métastatique, des cancers ovariens avancés, des sarcomes de Kaposi et des myélomes multiples (Barenholz, 2012).
2. Les conjugués d’agents anticancéreux
Une autre approche permet de délivrer des molécules cytotoxiques ou des agents d’imagerie médicale en les liant de manière covalente à un anticorps ou à un ligand reconnaissant une cible moléculaire présente à la surface des cellules cancéreuses. On parle alors de conjugué ou de prodrogue. La liaison entre le principe actif et l’élément de ciblage doit être stable au sein de la circulation sanguine pour permettre le maintien de l’inactivité du médicament. En revanche, cette liaison covalente doit pouvoir être dégradée en intra- ou en extracellulaire au niveau des cellules cancéreuses et libérer le médicament pour qu’il puisse exercer son activité.
A titre d’exemple, le F14512 est un conjugué composé d’un ligand de ciblage, la spermine et d’un agent anticancéreux dérivé de la podophyllotoxine (un inhibiteur de la topoisomérase II). Le ligand de ciblage permet l’internalisation du composé au sein de certaines cellules cancéreuses qui surexpriment le système de transport de polyamines. Le F14512 exerce de fortes propriétés antitumorales in vitro sur différentes lignées cancéreuses (leucémie, cancers du sein et du poumon, mélanomes et sarcomes) et in vivo, sur des modèles de leucémies, de cancers du sein et du côlon (Barret et al., 2008 ; Kruczynski et al., 2009). Le F14512 a également montré une forte efficacité au cours de différents essais cliniques de phase 1 menés sur un modèle canin de lymphome ou chez l’homme pour le traitement de leucémies myéloïdes aigues (LAM ; Tierny et al., 2015). Il est actuellement en cours d’évaluation chez l’homme, dans une phase 2 pour le traitement des LAM.
1ere Partie – Etat de l’art
2e Chapitre – De la chimiothérapie à la nanomédecine
15 Aujourd’hui, beaucoup de molécules de ce type sont testées en essais cliniques. Parmi celles approuvées par la Food et Drug Administration, on trouve le brentuximab vendotin (Adcetris®, Takeda Pharma) et le trastuzumab emtansine (Kadcyla®, Roche). Le brentuximab vendotin consiste en un anticorps chimérique dirigé contre l’antigène CD30 et relié à un puissant agent anticancéreux, la monométhyl Auristatine E (MMAE). Il est approuvé depuis 2011 pour le traitement des lymphomes Hodgkiniens et des lymphomes anaplasiques à grandes cellules (Foyil et Bartlett, 2011). Le trastuzumab emtansine, lui, cible le récepteur HER2 (Human Epidermal growth factor Receptor-2) et est associé à un agent cytotoxique dérivé de la maitansine. Il est autorisé depuis 2013 pour le traitement des cancers du sein métastatique exprimant le récepteur HER2 (Verma et al., 2012).
Ainsi, il existe plusieurs stratégies de ciblage des cellules tumorales ou de leur microenvironnement. A travers mes travaux de thèse, j’ai eu l’occasion de travailler sur plusieurs types de ciblage mais c’est celui concernant les récepteurs à l’acide folique qui a représenté la plus grande partie de mon travail. De ce fait, le prochain chapitre est consacré à la présentation de ce récepteur particulier.
16
3
E
C
HAPITRE
Les folates et leurs transporteurs
I.
L
ES FOLATES
Le terme générique « folate » regroupe tous les composés, naturels et synthétiques (comme l’acide folique), appartenant à la famille des vitamines B9. Ils interviennent comme cofacteurs enzymatiques dans les réactions de transfert de carbone unique et sont de fait impliqués dans de nombreuses fonctions essentielles du métabolisme cellulaire telles que la biosynthèse des purines et des pyrimidines, la méthylation de l’ADN, la synthèse d’acides aminés et de quelques vitamines (Iyer et Tomar, 2009).
Avec un apport quotidien recommandé de 400 µg pour un adulte, la vitamine B9 fait obligatoirement l’objet d’apports exogènes, les cellules de mammifères ne possédant pas les enzymes nécessaires à sa biosynthèse. Ainsi, les carences en folates sont courantes. Elles sont à l’origine de nombreux symptômes et favorisent de nombreuses pathologies. A titre d’exemple, une carence en vitamine B9 au cours du développement embryonnaire entraine des défauts de formation du tube neural (Daly et al., 1995). Chez l’adulte, les déficiences en folate sont associées à des anémies et différents problèmes neurologiques tels que des dépressions et des accidents vasculaires cérébraux. Elles peuvent également favoriser l’apparition de maladies cardio-vasculaires (Morrison et al., 1996) et de la maladie d’Alzheimer (Hinterberger et Fischer, 2013). Dans le cadre du cancer, les folates jouent un rôle ambivalent. En effet, alors qu’une carence en folate peut augmenter le risque de cancers notamment mammaires et colorectaux (Choi et Mason, 2002), ils sont également décrits comme un soutien majeur de la prolifération des cellules malignes (Gonen and Assaraf, 2012). A ce titre, de nombreuses molécules ont été utilisées en chimiothérapie comme antifolates. C’est par exemple le cas du méthotrexate et du pemetrexed qui inhibent des enzymes clés du métabolisme des folates (la dihydrofolate reductase et la thymidylate synthase, respectivement ; Gonen and Assaraf, 2012).
Figure 10. Transport des folates dans les cellules saines ou cancéreuses via le transporteur de folates réduits (Reduced Folate Carrier), le transporteur de folates couplé aux protons (Proton Coupled Receptor) ou le récepteur de l’acide folique (Folate Receptor).