Dépistage et suivi des pucerons et aleurodes vecteurs
de virus et identification des diverses sources de
contamination virale dans les fraisières du Québec
Mémoire
Phanie Bonneau
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
Dépistage et suivi des pucerons et aleurodes vecteurs
de virus et identification des diverses sources de
contamination virale dans les fraisières du Québec
Mémoire
PHANIE BONNEAU
Sous la direction de :
Valérie Fournier, directrice de recherche
Stéphanie Tellier, co-directrice de recherche
Résumé
Au Québec, le dépérissement des fraisières cultivées (Fragaria x ananassa Duchesne) observé dernièrement a principalement été causé par les virus SMYEV, SCV, SMoV, SVBV et SPaV. Les vecteurs sont le puceron du fraisier, Chaetosiphon fragaefolii (Cockerell), et l’aleurode des serres, Trialeurodes vaporariorum (Westwood). Cette étude de deux ans comportait six objectifs. Premièrement, nous avons comparé l’efficacité de deux outils de dépistage des vecteurs, soit les pièges-collants jaunes et les pièges-bols jaunes. Les résultats démontrent que les pièges-collants sont plus efficaces pour la capture de pucerons et d’aleurodes, toutes espèces confondues. Deuxièmement, nous avons déterminé les périodes de vol des deux insectes vecteurs à l’échelle provinciale. Les résultats indiquent que le puceron du fraisier est principalement présent dans les champs du début juillet jusqu’au début septembre. Quant à l’aleurode des serres, il est présent de début juin jusqu’à la fin octobre. Troisièmement, nous avons évalué la prévalence des virus SMYEV et SCV dans les spécimens de pucerons du fraisier ailés capturés. Des analyses RT-PCR ont démontré que 38% des pucerons (N=205) étaient infectés. Le quatrième objectif consistait à évaluer la capacité des fraisiers sauvages (Fragaria virginiana Miller) à constituer un réservoir naturel de virus. Les analyses RT-PCR ont indiquées que 67% des talles de fraisiers sauvages (N=12) étaient infectées et qu’elles représentent donc des réservoirs de virus. Le cinquième objectif était de suivre l’accumulation des virus dans 14 fraisières à l’aide de plants sentinelles protégés et exposés. Les résultats confirment que les plants de fraisier exposés en plein champ ont accumulé des virus suite aux envolées des vecteurs. Enfin, nous avons réalisé un inventaire considérable des différentes espèces de pucerons et d’aleurodes retrouvées en fraisières. Cette étude a apporté d’importantes contributions dans la gestion des insectes vecteurs de virus dans le cadre de la problématique du dépérissement des fraisières au Québec.
Abstract
In Quebec, strawberry decline disease outbreak occurring in strawberry fields (Fragaria x ananassa Duchesne) has been predominantly caused by viruses (SMoV, SVBV, SPaV, SMYEV and SCV). The vectors are the strawberry aphid, Chaetosiphon fragaefolii (Cockerell) (Hemiptera : Aphididae) and the greenhouse whitefly, Trialeurodes vaporariorum (Westwood) (Hemiptera : Aleyrodidae). This 2-year study had six objectives. First, we compared the effectiveness of two screening techniques, yellow sticky traps and yellow pan-traps. The results demonstrated that the yellow sticky traps are more effective for capturing aphids and whiteflies, all species combined. The second objective was to determine the flight periods of the main vectors across the province. The results indicated that the winged strawberry aphids are mainly present in strawberry fields from early July until early September. As for the greenhouse whitefly, it is mainly present from early June and extends through October. The third objective was to measure the prevalence of SMYEV and SCV in winged strawberry aphid specimens captured in 2014 and 2015. The RT-PCR results indicated that 38% of the aphids (N=205) captured were infected. The fourth objective was to examine the ability of wild strawberries (Fragaria virginiana Miller) to be a long-term host for strawberry viruses. The RT-PCR results demonstrated that 67% of the wild strawberry patches tested (N=12) were infected and therefore, represent a natural reservoir. The fifth objective was to monitor the viruses’ accumulation in 14 strawberry fields throughout the province, using protected and exposed control plants. The results confirmed that the exposed control strawberry plants accumulated viruses following the vectors’ flights over the season. Finally, we carried out a considerable inventory of the different species of aphids and whiteflies found in strawberries. This study has provided important contributions to the management of virus-carrying insects as part of the problem of the strawberry decline in Quebec.
Table des matières
Résumé ... III
Abstract ... IV
Table des matières ... V
Liste des tableaux ... VIII
Liste des figures ... IX
Liste des abréviations et des sigles ... X
Remerciements ... XII
Avant-propos ... XIV
Introduction générale ... 1
Chapitre 1 : État des connaissances ... 2
1.1. La fraise au Québec ... 3
1.2. Dépérissement des fraisières... 8
1.3. Les virus ... 10
1.3.1. Phytovirus ... 10
1.3.2. Phytovirus du fraisier ... 11
1.3.3. Détection des virus dans les plantes ... 13
1.4. Les vecteurs de virus ... 14
1.4.1. Pucerons ... 14
1.4.1.1. Puceron du fraisier ... 16
1.4.2. Aleurodes ... 19
1.4.2.1. Aleurode des serres ... 19
1.4.3. Mode de transmission par les vecteurs ... 20
1.4.4. Détection des phytovirus dans les vecteurs ... 21
1.4.5. Méthodes de dépistage des vecteurs ... 22
1.5. Problématique ... 25
1.6. Objectifs de recherche ... 27
1.7. Approche méthodologique ... 28
Chapitre 2 : Monitoring Chaetosiphon fragaefolii (Hemiptera: Aphididae) and
Trialeurodes vaporariorum (Hemiptera: Aleyrodidae) as vectors of strawberry viruses in
Quebec, Canada ... 29
Résumé ... 30
Abstract ... 31
Introduction ... 32
Materials and Methods ... 35
Experimental Setting ... 35
Statistical Analysis ... 36
Vectors’ Flight Activity Across the Province ... 36
Experimental Setting ... 36
Abundance and Diversity of Aphids and Whiteflies in Selected Strawberry Fields ... 37
Experimental Setting for whitefly diversity ... 37
Experimental Setting for aphid diversity ... 37
Results... 38
Trapping Technique Comparison ... 38
Vectors’ Flight Activity Across the Province ... 38
Abundance and Diversity of Aphids and Whiteflies in Selected Strawberry Fields ... 39
Discussion... 39
Trapping Technique Comparison ... 40
Vectors’ Flight Activity Across the Province ... 41
Abundance and Diversity of Aphids and Whiteflies in Selected Strawberry Fields ... 42
Conclusion ... 43
Acknowledgments ... 43
References ... 44
Appendices ... 49
Chapitre 3 : Evaluation of Various Sources of Viral Contamination in Strawberry Fields of
Quebec, Canada ... 54
Résumé ... 55
Abstract ... 56
Introduction ... 57
Materials and Methods ... 59
Prevalence of SMYEV and SCV in the Strawberry Aphid C. fragaefolii ... 59
RT-PCR detection of SMYEV and SCV ... 61
Prevalence of five Viruses in Wild Strawberry Plants F. virginiana... 61
RT-PCR detection of five strawberry viruses ... 61
Monitoring the Accumulation of Viruses in Strawberry Fields ... 62
Experimental Setting ... 62
Statistical Analysis ... 63
Results... 63
Prevalence of SMYEV and SCV in the Strawberry Aphid C. fragaefolii ... 63
Prevalence of Viruses in Wild Strawberry Plants F. virginiana ... 63
Monitoring the Accumulation of Viruses in Strawberry Fields ... 64
Discussion... 65
Prevalence of SMYEV and SCV in the Strawberry Aphid C. fragaefolii ... 65
Prevalence of Viruses in Wild Strawberry Plants F. virginiana ... 67
Monitoring the Accumulation of Viruses in Strawberry Fields ... 68
Conclusion ... 69
References ... 70
Appendices ... 75
Chapitre 4 : Conclusion générale ... 79
Liste des tableaux
Tableau 1 : Présence des maladies dans les cultures de fraises au Canada ... 6 Tableau 2 : Présence des insectes nuisibles dans les cultures de fraises au Canada ... 7 Tableau 3 : Résultats de l’analyse par l’entremise de l’enquête du MAPAQ sur les causes du
dépérissement des fraisières ... 10 Tableau 4 : Les virus qui s’attaquent au fraisier et leurs modes naturels de transmission ... 13 Tableau 5 : Récapitulatif des caractéristiques de transmission des virus par les insectes vecteurs 21 Tableau 6 : Insecticides homologués au Canada dans la culture de la fraise. ... 26 Table 7 : Total seasonal counts of whitefly species in strawberry fields. ... 52 Table 8 : Abundance and diversity of aphids in strawberry fields. ... 53
Liste des figures
Figure 1 : Période de vol du puceron du fraisier ailé dans la région Ouest et Vallée de la Nouvelle-Écosse en 2013. ... 18 Figure 2 : Période de vol du puceron du fraisier ailé dans la région Centrale et Est de la
Nouvelle-Écosse en 2013. ... 18 Figure 3 : Yellow Sticky Trap. ... 49 Figure 4 : Yellow Pan Trap. ... 49 Figure 5 : The mean total captures in pan traps and sticky traps, for both years and for all 6 sites
combined. ... 50 Figure 6 : Vectors’ Flight Activity ... 51 Figure 7 : Prevalence of persistent viruses detected in all winged strawberry aphids (N=205)
captured in yellow pan-traps, in six fields, or found on strawberry leaves from May 26 to October 27, 2014 (N=74) and from May 25 to October 26, 2015 (N=131), in 17 strawberry fields. ... 75 Figure 8 : Prevalence of viruses detected in leaves collected from wild strawberry patches (N=12)
found nearby 12 commercial strawberry fields from May 28 to June 15, 2015. ... 75 Figure 9 : Strawberry viruses’ Infection rate of sentinel plants, at the end of growing season,
October 2015, on 14 sites across the province of Quebec. ... 76 Figure 10 : Prevalence of strawberry viruses in infected sentinel plants, at the end of growing
season, October 2015, in new plantings and established fields on 14 sites across the province of Quebec. ... 77 Figure 11 : Prediction of viral infection rate of sentinel strawberry plants at the end of the growing
season, in 2015, in response to the total number of winged strawberry aphids found on sticky traps during the season on 14 sites across the province of Quebec. ... 77 Figure 12 : Viral Contamination Sources at the beginning and the end of growing season 2015, on
Liste des abréviations et des sigles
ADN : Acide désoxyribonucléiqueARN : Acide ribonucléique
Ha : Hectare
RT-PCR : Rétrotranscription – Réaction en chaîne par polymérase SCV : Strawberry crinkle virus (virus de la frisolée du fraisier) SMoV : Strawberry mottle virus (virus de la marbrure du fraisier)
SMYEV : Strawberry mild yellow edge virus (virus de la jaunisse du fraisier) SPaV : Strawberry pallidosis virus (pallidose du fraisier)
SPV1 : Strawberry polerovirus 1 (polérovirus 1 de la fraise)
Remerciements
En premier lieu, je remercie sincèrement ma directrice de recherche Valérie Fournier pour m’avoir donné l’opportunité et ta confiance dès le départ afin de mener à terme ce beau projet innovateur. Merci aussi pour ton soutien et ta disponibilité. Je remercie également ma co-directrice de recherche Stéphanie Tellier, pour tes conseils et tes encouragements qui m’ont guidé pendant ces deux années.
Merci aux nombreux aides de terrain que j’ai eu la chance d’avoir et sans qui toute cette étude n’aurait pu être possible : Étienne Nadeau, Vivien Michel, Frédéric McCune, Sophie LeBoulanger, Stéphane Thibault, Noémie Brisson, Manon Bellanger et Sandra Savard.
Merci à mes collègues de laboratoire de l’Envirotron : Olivier, Marianne, Ségolène, et Amélie, ainsi que Stéphanie et Béatrice, pour votre support et vos conseils tout au long de cette aventure, sans oublier nos fameux 5 à 7 !
Merci à Liette Lambert ainsi qu’à tous les intervenants et agronomes du MAPAQ et des Clubs Conseils pour leur précieuse collaboration à l’échantillonnage partout en province. Un énorme merci également aux 17 producteurs de fraises qui nous ont ‘’prêté’’ leurs champs pour fin de recherche.
Merci à tous les chercheurs qui ont collaboré de proche ou de loin au projet, soit Dr Debra Moreau et John Lewis de la Nouvelle-Écosse, Pam Fisher de l’Ontario, Dr Robert R. Martin des États-Unis et Dr Sébastien Boquel du Nouveau-Brunswick. Merci également à Dr Robert Foottit et Eric Maw d’Agriculture et Agro-alimentaire Canada pour m’avoir accueillie dans votre laboratoire d’entomologie à Ottawa pour l’identification de spécimens de pucerons. Merci à Jean Denis Brisson pour tous les renseignements pertinents au sujet des aleurodes et des fraisiers sauvages ainsi qu’aux nombreuses corrections du présent mémoire.
Un grand merci à Dr Richard Hogue, Nathalie Daigle et Édith Plante de l’IRDA pour votre implication dans les travaux de détection moléculaire de virus dans les feuillages et les pucerons. Merci également aux gens du Laboratoire de Diagnostic du MAPAQ, Mario Fréchette et Joseph Moisan-De Serres pour l’aide dans l’identification de pucerons et les nombreuses photos.
Merci à Josée Doyon de l’Université de Montréal pour nous avoir donné des pucerons du soya. Merci à Phytoclone pour nous avoir fourni les plants de fraisier.
Merci beaucoup à Conrad Cloutier et Debra Moreau qui ont bien voulu évaluer mon mémoire. Merci également à Gaétan Daigle pour son aide lors des analyses statistiques.
En dernier lieu, je tiens à remercier sincèrement ma famille et plus spécialement ma mère Gaétane et mon père Guy. Merci pour tout. C’est grâce à vous si je suis passionnée par la nature, les plantes, l’écologie, l’agriculture et la science, et que ma soif de connaissance est insatiable. Merci aussi à mes précieux amis, et surtout France et Robert pour les belles fins de semaine dans Charlevoix, qui m’ont permis de décrocher. And of course, thanks to Stephen, the most important person in my life, who has always been there for me. Et enfin, merci à mes chats pour votre écoute et votre approbation à ce que je continue mes études graduées. Je vous aime
Avant-propos
Les chapitres II et III de ce mémoire sont présentés sous la forme d’articles scientifiques rédigés en anglais. Le chapitre II sera soumis pour publication dans le journal scientifique The Canadian Entomologist. Le chapitre III sera soumis pour publication dans le Journal of Economic Entomology.
L’échantillonnage, l’identification des spécimens récoltés, l’analyse des résultats, ainsi que la rédaction du texte sont issus de la candidate à la maîtrise, qui est l’auteure principale des deux articles.
Les co-auteures sont Valérie Fournier Ph.D (directrice), professeure au département de phytologie de l’Université Laval, Stéphanie Tellier agr., M.Sc. (codirectrice), conseillère régionale en horticulture et en agriculture biologique au Ministère de l’Agriculture, des Pêcheries et de l’Alimentation (MAPAQ) de la Direction régionale de la Capitale-Nationale; Dr Richard Hogue, phytopathologiste et chercheur à l’IRDA, et Jean Denis Brisson, entomologiste et chercheur retraité.
Ce projet de recherche a été rendu possible grâce aux subventions du Programme Innov’Action Volet 2, du Programme d’Appui au Développement de l’Agriculture et de l’Agroalimentaire en Région (PADAAR) du Ministère de l’Agriculture, des Pêcheries et de l’Alimentation, du Programme Cultivons l’Avenir Volet 2, ainsi que de l’Association des Producteurs de Fraises et Framboises du Québec (APFFQ).
Introduction générale
Avec plus de 500 exploitations agricoles qui cultivent la fraise (Fragaria x ananassa Duchesne), le Québec représente 52% de la production canadienne de ce petit fruit rouge. La régie de culture majoritairement adoptée est le système conventionnel en rangs nattés qui permet une production soutenue de fraises de deux à trois ans. Depuis quelques années, les fraisières en rangs nattés de l’Est du Canada sont aux prises avec des symptômes de dépérissement : elles ont de la difficulté à s’établir au moment de l’implantation, leur système racinaire est affaibli et il y a une importante réduction de stolons, occasionnant d’énormes pertes pour les producteurs québécois. Le dépérissement des fraisières est bien connu chez nos voisins du Sud et des chercheurs américains ont déterminé que ce phénomène était principalement causé par des complexes viraux transmis par des insectes. Au Québec, six virus ont été détectés dans les fraises cultivées : les virus persistants tels que le Strawberry mild yellow edge virus (SMYEV), le Strawberry crinkle virus (SCV), et les virus semi-persistants tels que le Strawberry mottle virus (SMoV), le Strawberry vein banding virus (SVBV) et le Strawberry pallidosis virus (SPaV). Un sixième virus nommé Strawberry polerovirus 1 (SPV1), nouvellement détecté, n’a pas été inclus dans la présente étude. Le principal vecteur connu des virus SMYEV, SCV, SMoV et SVBV est le puceron du fraisier Chaetosiphon fragaefolii (Cockerell) (Hemiptera : Aphididae) alors que le SPaV est transmis par l’aleurode des serres, Trialeurodes vaporariorum (Westwood) (Hemiptera : Aleyrodidae).
Cette étude comportait plusieurs objectifs : 1) comparer deux techniques d’inventaire pour dépister les insectes vecteurs, soit les bols jaunes et les pièges-collants jaunes; 2) déterminer les périodes de vol de ces insectes vecteurs à l’échelle de la province; 3) déterminer la prévalence des virus persistants dans les spécimens de pucerons du fraisier capturés; 4) évaluer la capacité des fraisiers sauvages (Fragaria virginiana Miller), situés près des fraisières commerciales, à former des réservoirs naturels de virus; 5) suivre au cours d’une saison de croissance, l’accumulation des virus dans les fraisières en relation avec les insectes vecteurs présents; et 6) observer l’abondance et la diversité des pucerons et aleurodes présents dans les champs de fraise. Le présent mémoire se veut un portrait de la situation sur les insectes vecteurs de virus dans les fraisières du Québec. Les connaissances générées aideront les intervenants à mieux cibler les actions concrètes à prendre afin de lutter contre le dépérissement des fraisières.
1.1. La fraise au Québec
La fraise cultivée (Fragaria x ananassa Duchesne) telle que nous la connaissons aujourd’hui est une espèce hybride provenant d’un croisement entre Fragaria virginiana Miller de l’Amérique du Nord et Fragaria chiloensis L. de l’Amérique du Sud (Agriculture et Agroalimentaire Canada, 2015). L’origine du croisement demeure inconnue, cependant le botaniste français Antoine Nicholas Duchesne a nommé cette variété hybride en 1766 en raison de l’odeur du fruit qui lui rappelle celui de l’ananas (Hancock, 1999). La fraise cultivée est très bien adaptée pour croître dans toutes les régions tempérées du monde et sa production en Amérique du Nord existe depuis près de deux siècles.
Il existe trois espèces de fraisiers sauvages indigènes au continent américain : Fragaria vesca L., Fragaria chiloensis L. et Fragaria virginiana Miller (Hancock et al. 2004). Tout comme la fraise cultivée, ces fraisiers sauvages font partie de la famille des Rosaceae. Le fraisier de Virginie (Fragaria virginiana Miller), ou fraisier des champs, représente l’espèce de fraisier la plus commune au Québec car il envahit facilement les champs cultivés (Marie-Victorin, F., 1997).
La culture de la fraise occupe une place de choix au Québec. Notre Belle Province est le plus grand producteur de fraises au Canada, avec 52% de la production canadienne, et se situe au troisième rang en Amérique du Nord, suivant de près la Californie et la Floride. Selon le Profil sectoriel de l’industrie bioalimentaire au Québec (2016), plus de 500 producteurs cultivent ce petit fruit rouge sur une superficie d’environ de 1600 hectares, en produisant ainsi près de 10 000 tonnes par année. En 2014, les recettes en provenance du marché atteignaient jusqu’à 33 millions de dollars pour une année-récolte.
Au Québec, deux types de fraisiers sont cultivés, soit la fraise d’été (fraise à jour court), et la fraise à jour neutre (fraise d’automne). La différence entre ces deux types de fraisiers repose sur la photopériode. Le fraisier à jour court est influencé par la photopériode pour l’initiation des boutons floraux, alors que le fraisier à jour neutre fleurit de façon continue pendant toute la saison de végétation (Dale & Pritts, 2002). Ces fraisiers peuvent être cultivés selon différents systèmes de production, soit en rangs nattés avec ou sans bâches, sur butte de plastique, hors sol, en grands tunnels ainsi qu’en serre. Il est aussi possible de varier le type de plants utilisés (plants mottes, plants frais, plants frigos, trayplants, etc.), et de varier les dates de plantation (automne, tôt printemps, début juin, etc.) et les cultivars (hâtifs, mi-saison, tardifs), afin de viser une fenêtre de production
spécifique. La combinaison de différents paramètres permet maintenant de fournir le marché sur une période beaucoup plus longue comparativement à ce qui se faisait traditionnellement au Québec (Novafruit, 2016).
Toutefois, plus de 81% des producteurs d’ici ont des champs cultivés selon la régie conventionnelle en rangs nattés (Novafruit, 2016; Yourianne Plante, dir. gén. APFFQ, comm. pers.). Ce modèle de production peut être réalisé avec deux types de plants à racines nues, soit des «plants frais» qui sont arrachés au printemps à la pépinière et doivent être plantés immédiatement chez le producteur, ou des «plants frigos» qui sont arrachés à l’automne à la pépinière, conservés au réfrigérateur durant l’hiver et plantés au printemps chez le producteur (Thireau & Lefebvre, 2014). Ces plants sont implantés au printemps à une densité à la plantation d’environ 10 000 plants/ha. Dans les deux cas, une année d’implantation sans récolte est nécessaire à la formation d’une plate-bande fournie par l’enracinement des plants-filles. Ces champs pourront par la suite produire pour les 2 ou 3 années suivantes. La récolte des fruits dure de 2 à 3 semaines, entre la mi-juin et la mi-juillet, selon la région et les cultivars. Dès que la production est terminée, une rénovation doit être effectuée afin d’éliminer le vieux feuillage porteur de maladies et insectes, de stimuler la production de stolons et de bourgeons à fruits et ainsi assurer une bonne production l’année suivante. La rénovation consiste à faucher les plants à environ 25 cm du sol ainsi qu’à rétrécir les rangs de 30 à 50 cm (Urbain et Bernier, 2013). La technique du rang natté donne un rendement d’environ 10-15 tonnes à l’hectare la première année, rendement qui diminuera avec les années (Parent, 2004). Le paillage de la plate-bande à l’automne confère une protection hivernale contre le gel et les écarts de température aux plants de fraisiers en dormance et permettra une protection des allées au printemps suivant.
Plusieurs cultivars sont recommandés pour ce type de régie, entre autres : ‘Jewel’, ‘Mira’, ‘Wendy’, ‘Valley Sunset’, ‘Bounty’, ‘Veestar’, ‘Annapolis’ et ‘Yamaska’ (Novafruit, 2016). Le cultivar ‘Jewel’ est de loin celui le plus utilisé par les producteurs québécois. La provenance des plants diffère selon les producteurs. Dans la grande majorité des cas, les plants de fraises cultivés au Québec sont produits dans les différentes pépinières de la province, mais certains producteurs peuvent aussi se les procurer aux États-Unis, en Ontario ou en Nouvelle-Écosse (Hogue, 2015, conférence journée agricole février 2015).
Les avantages du système conventionnel en rangs nattés sont nombreux (Novafruit, 2016) : faible coût d’implantation, risques peu élevés, facilité d’adaptation aux différents types de terrain et très grande expérience au Québec avec ce type de culture. Par contre, lorsque la culture de fraise demeure en place pendant plusieurs années consécutives, un risque croissant d’accumulation de maladies et de ravageurs fait sans contredit partie des inconvénients.
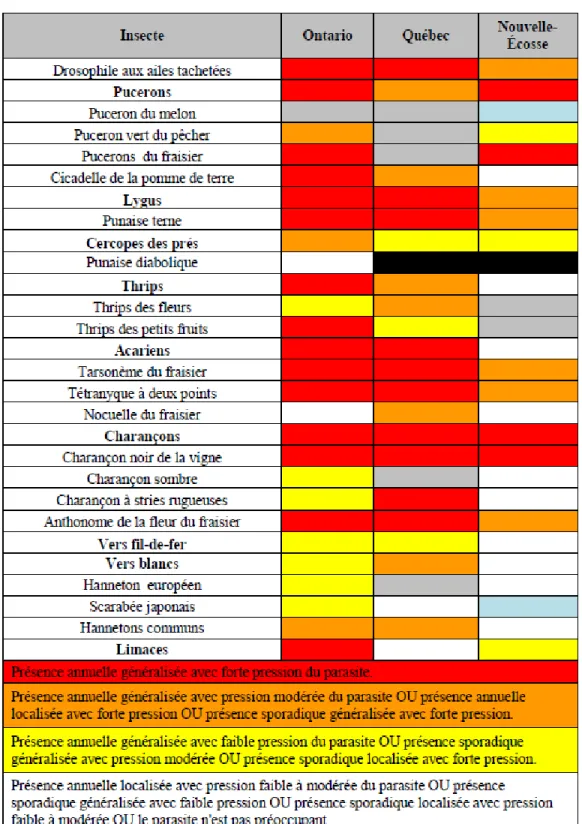
Il existe dix stades phénologiques chez le fraisier : dormant, début végétation, début bouton vert, bouton vert avancé, début floraison, pleine floraison, début fruit vert, fruit vert, fruit mûr et post-récolte (Lambert et al. 2007). C’est principalement au cours de la floraison, de la fructification et de la période post-récolte que les nombreux ravageurs et maladies s’attaquent au fraisier ou à la fraise (Tableaux 1 et 2).
Tableau 1 : Présence des maladies dans les cultures de fraises au Canada. Tiré d’Agriculture et Agroalimentaire Canada (2015).
Tableau 2 : Présence des insectes nuisibles dans les cultures de fraises au Canada. Tiré d’Agriculture et Agroalimentaire Canada (2015).
1.2. Dépérissement des fraisières
Le dépérissement des fraisières est une problématique grave qui sévit actuellement à l’échelle mondiale (Tzanetakis & Martin, 2012). Il cause d’importants dommages aux récoltes et par conséquent, de grandes pertes économiques. Cette problématique est connue depuis plus d’une dizaine d’années aux États-Unis (Martin & Tzanetakis, 2006). De nombreuses études ont été réalisées sur le sujet au cours des dernières années par des pathologistes tels que le Dr Robert R. Martin de l’USDA en Orégon et le Dr Ioannis E. Tzanetakis de l’Université de l’Arkansas. Les recherches ont démontré la présence de maladies virales dans les champs de fraises en dépérissement aux États-Unis (Martin & Tzanetakis, 2013).
Au début des années 2000, le phénomène a touché la côte Ouest, du Sud de la Californie jusqu’à la Colombie-Britannique (Martin et al. 2004). En Californie, suite au plus fort de la crise de 2003, le dépérissement a commencé à s’estomper, mais les plants de fraisier ont continué de dépérir au nord de l’état de Washington ainsi que dans la vallée de la Rivière Fraser en Colombie-Britannique (Martin & Tzanetakis 2013).
En 2012, la maladie a pris de l’ampleur et s’est propagée à la côte Est de l’Amérique du Nord, de la Nouvelle-Écosse jusqu’à la Floride (Martin & Tzanetakis, 2013). La région de Great Village en Nouvelle-Écosse a été durement touchée. À chaque année, des millions de plants provenant des pépiniéristes canadiens de cette région sont achetés par des producteurs américains pour être cultivés aux États-Unis, afin de satisfaire les besoins en refroidissement des fraisiers (Martin et al. 2013). Cette pratique pourrait avoir contribué à l’expansion du dépérissement des fraisières en Amérique du Nord au cours des dernières années (Martin & Tzanetakis, 2013). Il a été spéculé que la contamination proviendrait principalement du marcottage en pépinière de plants virosés qui ont ensuite été transplantés chez les producteurs. Pour cette raison, des régions de la Floride, de la Caroline du Sud, de la Caroline du Nord, de la Virginie, de la Géorgie ainsi que du Maryland aux États-Unis ont été grandement affectées par le dépérissement des fraisières parce que les producteurs de ces régions s’approvisionnaient chez les mêmes pépiniéristes (Martin & Tzanetakis, 2013; Poling, 2013; Johnson & Burrack, 2013).
Durant la même période (2012-2014), le dépérissement s’est propagé aux fraisières de l’Île du Prince Edouard et de l’Ontario alors que les fraisières de la Californie subissaient une deuxième résurgence, démontrant l’ampleur de la problématique à travers toute
l’Amérique du Nord (Dara, 2015; Xiang et al. 2015; Lambert et al. 2014). Ainsi, plusieurs producteurs canadiens ont été dans l’obligation de détruire leurs champs en 2013 et 2014 suite au dépérissement généralisé de leurs fraisiers (Lambert et al., 2014).
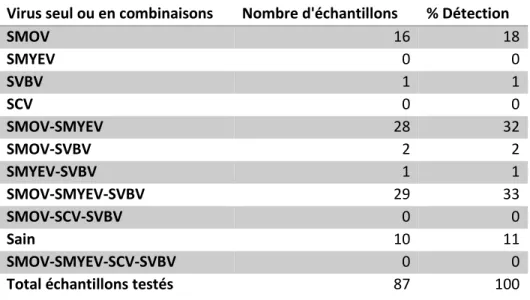
Au Québec, le phénomène a été mis à jour plus récemment. Toutefois, certains signes de dépérissement étaient présents en fraisières depuis plusieurs années déjà, sans qu’on puisse, à cette époque, nommer la cause de ces symptômes (L. Lambert, comm. pers). En 2012, des observations provenant d’agronomes et de producteurs notent un dépérissement des fraisières accentué (Tellier, 2015, conférence journée horticole Janvier 2015). Une enquête réalisée à l’automne 2013 par le Ministère de l’Agriculture, des Pêcheries et de l’Alimentation (MAPAQ) dans les différentes régions productrices de fraises du Québec démontre que le dépérissement est présent principalement dans les cultures de fraise en rangs nattés en implantation et en première année de production (Lambert et al., 2013). Lors de cette enquête, 87 échantillons de plants provenant de toutes les régions présentant des symptômes de perte de vigueur, notamment, ont été analysés pour la détection de virus. Les résultats indiquent que jusqu’à 68% des plants sont infectés par une combinaison de deux ou trois virus (Tableau 3). En janvier 2014, la venue de chercheurs de l’extérieur, tels que Dr Martin des États-Unis et M. John Lewis de la Nouvelle-Écosse, ont grandement aidé à résoudre l’énigme et il a été établi que c’était bel et bien les virus qui étaient à l’origine du dépérissement observé au Québec (Tellier, 2015, conférence journée horticole Janvier 2015).
Les symptômes liés au dépérissement des fraisières apparaissent lorsque deux ou plusieurs virus sont présents (Agriculture et Agroalimentaire Canada, 2015; Martin & Tzanetakis, 2013). En général, on observe notamment une réduction des stolons produits par la plante, un système racinaire affaibli ainsi qu’une difficulté à s’établir suite à l’implantation.
Par ailleurs, il a été démontré que plusieurs causes sont associées au dépérissement des fraisières, en complément aux maladies virales. Entre autres, les pourritures racinaires, dont la pourriture noire, le gel hivernal, le choc salin et le stress de transplantation peuvent également altérer la vigueur des fraisiers. Les études récentes ont cependant démontré que les complexes viraux sont pour ainsi dire toujours présents lorsqu’il y a des symptômes de dépérissement dans une fraisière (Dara, 2015).
Tableau 3 : Résultats de l’analyse par l’entremise de l’enquête du MAPAQ sur les causes du dépérissement des fraisières. Adapté de Gilbert (2013) par l’auteure.
Virus seul ou en combinaisons Nombre d'échantillons % Détection
SMOV 16 18 SMYEV 0 0 SVBV 1 1 SCV 0 0 SMOV-SMYEV 28 32 SMOV-SVBV 2 2 SMYEV-SVBV 1 1 SMOV-SMYEV-SVBV 29 33 SMOV-SCV-SVBV 0 0 Sain 10 11 SMOV-SMYEV-SCV-SVBV 0 0
Total échantillons testés 87 100
1.3. Les virus
1.3.1.
Phytovirus
Les virus sont des parasites intracellulaires obligatoires qui se multiplient uniquement dans les cellules vivantes qu’ils infectent. Ils sont transmissibles et ont la capacité de causer une maladie, qu’on appelle virose, à au moins un hôte (Hull, 2014). Ces viroses sont généralisées et incurables. Les phytovirus s’attaquent plus particulièrement aux organismes végétaux. La particule infectieuse du virus, le virion, est composé soit d’acide déoxyribonucléique (ADN) ou bien d’acide ribonucléique (ARN) et possède une capside protectrice (Lwoff & Tournier, 1966). Il existe six grands groupes de virus des plantes, classifiés sur la base de leur acide nucléique : dsDNA (RT), ssDNA, dsRNA, ssRNA (-), ssRNA (+) et ssRNA (RT) (Decker & Fauquet, 2006). Les lettres ‘ss’ et ‘ds’ font référence à la nature simple (s) ou double des brins (strands) d’ADN ou d’ARN.
Longtemps confondus avec des bactéries, ce n’est qu’à la fin du 19ième siècle que les virus phytopathogènes sont ‘’découverts’’, suite à l’étude de la mosaïque du tabac (Mayer, 1886). Contrairement aux génomes des autres organismes vivants tels que les plantes ou les animaux qui possèdent un génome ADN, les génomes des phytovirus sont soit ADN ou ARN (Mukhopadhyay, 2011).
Les phytovirus ont cinq types de structures différentes: isométrique (icosaédrique), bâtonnet rigide, filamenteux, bacilliforme et jumelé (Mukhopadhyay, 2011). La majorité des virus possède des particules isométriques. Parmi les genres prépondérants, on retrouve les Potyvirus avec 74 espèces, puis les Rhabdovirus avec 32 espèces, les Carlavirus avec 32 espèces également ainsi que les Potexvirus qui incluent 22 virus (Albouy & Duvergne, 1998). Cependant, il importe de souligner que la classification des virus est instable (Conrad Cloutier, comm. pers.).
Comme les plantes sont immobiles, les phytovirus utilisent plusieurs moyens afin d’assurer leur dissémination. Plusieurs modes de propagation naturelle des virus sont possibles, soit la transmission végétative ou verticale et la transmission par vecteurs ou horizontale (Albouy & Devergne, 1998). La transmission végétative peut se faire de différentes manières, soit par contact direct d’une plante saine avec une plante infectée, par le greffage, par les semences ou par le pollen (Agrios, 2005). La transmission des virus par vecteurs s’effectue par plusieurs groupes de vecteurs, tels que les insectes, les acariens, les nématodes, les champignons et les protistes (Mukhopadhyay, 2011). Parmi les insectes, ceux que l’on retrouve le plus souvent sont les pucerons (Hemiptera : Aphididae), les aleurodes (Hemiptera : Aleyrodoidea), les cicadelles (Hemiptera : Cicadellidae) et les thrips (Thysanoptera : Thripidae), qui sont tous des arthropodes suçeurs ainsi que des vecteurs de virus extrêmement efficaces (Albouy & Devergne, 1998).
1.3.2.
Phytovirus du fraisier
Plus d’une vingtaine de virus s’attaquant au fraisier cultivé existent au niveau mondial (Martin & Tzanetakis, 2006). Parmi tous ces virus, cinq sont en partie responsables du phénomène de dépérissement des fraisières : le virus de la marbrure du fraisier (Strawberry mottle virus SMoV), le virus de la jaunisse du fraisier (Strawberry mild yellow edge virus SMYEV), le virus des nervures lisérées du fraisier (Strawberry vein banding virus SVBV), le virus de la frisolée du fraisier (Strawberry crinkle virus SCV) et la pallidose du fraisier (Strawberry pallidosis virus SPaV), les acronymes provenant de Brisson et coll. 2003. Un sixième virus a été découvert en 2014, soit le polérovirus 1 de la fraise (Strawberry polerovirus 1 SPV1) (Moreau, 2015, conférence journée horticole Décembre 2015; Xiang et al. 2015). Par ailleurs, l’enquête du MAPAQ de 2013 a démontré que le SMYEV et le SMoV avaient une plus
grande prévalence dans les fraisières du Québec. Le tableau 4 indique les genres des cinq virus considérés dans notre étude : le SCV est un Cytorhabdovirus, de la famille des Rhabdoviridae; le SPaV est un Crinivirus de la famille des Closteroviridae; le SMYEV est un Potexvirus de la famille des Flexiviridae; le SVBV est un Caulimovirus de la famille des Caulimoviridae, et le SMoV est un Sadwavirus de la famille des Sequiviridae (Tzanetakis & Martin, 2013; Belshaw et al. 2011).
Outre les fraisiers cultivés, les espèces sauvages apparentées à ceux-ci telles que le fraisier des champs Fragaria virginiana Miller et la potentille ansérine Potentilla anserina L. sont de possibles hôtes de SMYEV, SMoV, SCV, SVBV ainsi que SPaV (Moreau, 2015, conférence journée horticole Décembre 2015; Thompson et al. 2003; Tzanetakis & Martin, 2013; Martin & Tzanetakis, 2006). Par ailleurs, le SPaV possède une plus grande gamme d’hôtes tels que Sibbaldia procumbens L. (Rosaceae), Nicotiana benthamiana Domin (Solanaceae), Nicotiana clevelandii A. Gray (Solanaceae), Physalis wrightii A. Gray (Solanaceae) et Malva parviflora L. (Malvaceae) (Tzanetakis et al. 2006).
Tableau 4 : Les virus qui s’attaquent au fraisier et leurs modes naturels de transmission. Adapté de Tzanetakis & Martin (2013) par l’auteure.
Virus name Acronym Mode of transmission Genus Laboratory detection Apple mosaic ApMV Pollen, seed Ilarvirus ELISA, RT-PCR
Arabis mosaic ArMV Nematode, seed Nepovirus ELISA, RT-PCR
Beet pseudo-yellows BPYV Whitefly Crinivirus RT-PCR
Fragaria chiloensis cyptic
FClCV Pollen, seed Unknown RT-PCR
Fragaria chiloensis latent
FClLV Pollen, seed Ilarvirus ELISA, RT-PCR
Raspberry ringspot RpRSV Nematode, seed Nepovirus ELISA, RT-PCR
Strawberry chlorotic fleck
SCFV Aphid Closterovirus RT-PCR
Strawberry crini-3 SCrV-3 Whitefly Crinivirus RT-PCR
Strawberry crini-4 SCrV-4 Whitefly Crinivirus RT-PCR
Strawberry crinkle SCV Aphid Cytorhabdovirus RT-PCR
Strawberry latent StLV Unknown Cripavirus RT-PCR
Strawberry latent C SLCV Aphid Nucleorhabdovirus NA
Strawberry latent ringspot
SLRSV Nematode, seed Sadwavirus ELISA, RT-PCR
Strawberry leaf curl StLCV Whitefly Begomovirus RT-PCR
Strawberry mild yellow edge
SMYEV Aphid Potexvirus ELISA, RT-PCR
Strawberry mottle SMoV Aphid Sadwavirus RT-PCR
Strawberry necrotic shock
SNSV Thrips, pollen, seed Ilarvirus ELISA, RT-PCR
Strawberry pallidosis SPaV Whitefly Crinivirus RT-PCR
Strawberry pseudo mild yellow edge
SPMYEV Aphid Carlavirus ELISA
Strawberry vein banding
SVBV Aphid Caulimovirus PCR
Tobacco necrosis D TNV-D Oomycete Necrovirus ELISA, RT-PCR
Tobaco streak TSV Pollen, seed Ilarvirus ELISA, RT-PCR
Tomato black ring TBRV Nematode, seed Nepovirus ELISA, RT-PCR
Tomato ringspot ToRSV Nematode, seed Nepovirus ELISA, RT-PCR
1.3.3.
Détection des virus dans les plantes
Les premières détections de virus dans les plantes remontent à 1976, alors qu’un test ELISA a été appliqué afin de détecter le virus de la mosaïque de l’arabette (Voller et al. 1976). Le test ELISA (Enzyme-Linked Immunosorbent Assay), longtemps le seul outil pour détecter les virus, consiste à détecter la présence d’un anticorps ou d’un antigène dans un tissu végétal (Hull, 2014). Comme ce test ne détecte pas l’ARN viral
à proprement parlé, il peut être considéré comme moins précis. Depuis les années 1990, la recherche concernant les outils de biologie moléculaire s’est accrue. Il est maintenant possible d’analyser tous les principaux virus du fraisier et ainsi de les détecter dans les feuillages et les insectes à l’aide de test RT-PCR tel que mentionné dans la dernière colonne du tableau 4 (Tzanetakis & Martin, 2013). Le test de RT-PCR consiste en une transcription inverse suivie d’une RT-PCR (amplification en chaîne par polymérase). Ce test peut détecter de manière très précise la présence d’ARN virale soit dans un insecte, soit dans une plante (Singh et al. 2004). Maintenant, il existe de nouveaux tests encore plus puissants, tels que le séquençage de nouvelle génération (NGS) qui permet le séquençage de millions, voire milliards de brins d’ARN en parallèle. Cette technique a permis d’identifier de nouveaux virus tels que le crinivirus 4 du fraisier (Ding et al. 2016). De plus, les séquençages de génomes complets d’isolat des virus du fraisier, dont le SMYEV, ont été effectués récemment, ce qui accroît la banque de gènes (GenBank) de façon régulière (Bhagwat et al. 2015).
1.4. Les vecteurs de virus
Le tableau 4 de la section précédente fait mention des virus les plus connus s’attaquant aux fraisiers. Parmi les vecteurs biologiques de virus de fraisier de la colonne 3, on recense les vecteurs aériens comme les pucerons, les aleurodes et les thrips, ainsi que les vecteurs souterrains, tels que les nématodes et les oomycètes (Tzanetakis & Martin, 2013). Dans la même colonne, il est également indiqué que les cinq virus considérés dans l’étude sont transmis par des insectes vecteurs, soit les pucerons et les aleurodes. En ce qui concerne la transmission par vecteur, il existe deux types de propagations : la propagation primaire, les virus sont alors propagés par des insectes vecteurs infectieux qui proviennent d’un autre champ, et la propagation secondaire, dans ce cas les virus sont propagés par des insectes vecteurs infectieux de plants infectés vers des plants sains dans un même champ, un type de propagation n’empêchant pas l’autre (Perring et al. 1999).
1.4.1.
Pucerons
Les pucerons (Hemiptera : Aphididae) sont parmi les plus importants ravageurs de cultures au monde (Blackman & Eastop, 2000). Ils sont connus entre autres pour l’alimentation de masse du phloème des plantes, la production de miellat sur les
feuillages qui engendre les fumagines ainsi que la formation de galles. Cependant, les dégâts les plus graves proviennent de la propagation de nombreuses maladies virales (Blackman & Eastop, 2000).
Il existe différents types de cycle de vie chez les pucerons : anholocyclique, dans lequel les pucerons ne se reproduisent que par parthénogénèse, sans reproduction sexuée, et holocyclique, au cours duquel il y a reproduction sexuée et parthénogénèse (Emden & Harrington, 2007). Chez les pucerons holocycliques, on retrouve deux autres types de cycle de vie : hétéroécique, les pucerons alternent leurs hôtes afin de compléter leur cycle, et monoécique, les pucerons accomplissent la totalité de leur cycle sur un seul hôte (Williams & Dixon, 2007). Pour ces derniers, en général sauf exceptions, les pucerons se reproduisent sexuellement à l’automne, pondent des œufs hibernant tout l’hiver, et des fondatrices émergent au printemps. Ces fondatrices produisent des générations de pucerons femelles vivipares par parthénogénèse, aptères à l’origine (Bernardi et al. 2012). Au cours de la saison, la forme ailée émerge, dépendamment de la quantité de pucerons présents (surpeuplement) ainsi que de la qualité nutritionnelle de la plante hôte (Wadley, 1923) mais peut aussi être induite par la présence d’ennemis naturels et de pathogènes (Irwin et al. 2007) ainsi que la température et la photopériode (Kawada, 1987). Puis à l’automne, la formation des pucerons mâles débute, ceux-ci se reproduisent avec les femelles ovipares et ainsi, le cycle reprend son cours.
L’alimentation des pucerons est de type piqueur-suceur. Par conséquent, leurs pièces buccales consistent en plusieurs stylets flexibles enveloppés par un rostre, ou proboscis, leur permettant ainsi de percer les tissus végétaux afin d’en extraire la sève (Pettersson et al. 2007). Les stylets maxillaires forment un canal salivaire ainsi qu’un canal alimentaire. C’est donc lors de la piqûre pour se nourrir que le puceron régurgite les virus dans la plante à partir d’un réservoir, les glandes salivaires (Minks & Harrewijn, 1987).
Environ une douzaine d’espèces de pucerons sont présentes dans les fraises cultivées en Amérique du Nord, soit en tant que colonisateurs, soit en tant qu’errants (Minks & Harrewijn, 1989). Les colonisateurs étant les pucerons adaptés au fraisier alors que les errants sont des pucerons ailés qui atterrissent sur le feuillage de manière aléatoire. Parmi ceux-ci, le puceron jaune du rosier Rhodobuim porosum
Sanderson, le puceron vert du pêcher Myzus persicae Sulzer, le puceron de la digitale Aulacorthum solani Kaltenbach, le puceron de la mûre Amphorophora rubi Kaltenbach, le puceron du melon Aphis gossypii Glover ainsi que les espèces du genre Chaetosiphon spp. pourraient possiblement transmettre des virus de fraisier (Craig & Stultz, 1964; Tzanetakis & Martin, 2013). Le puceron du fraisier Chaetosiphon fragaefolii demeure tout de même l’espèce la plus importante dans les fraisières au Québec, étant monoécique et inféodé à cette plante (Rondon & Cantliffe, 2004; Lavandero et al. 2012).
1.4.1.1. Puceron du fraisier
Originaire de l’Amérique du Nord, le cycle vital du puceron du fraisier débute au stade d’œuf noir hibernant sous les feuilles de fraisier. Tout comme les pucerons monoéciques, lorsque les œufs des pucerons du fraisier éclosent au printemps, une fondatrice aptère émerge. Quatre stades larvaires se suivent : le premier stade dure de 1 à 2 journées, le deuxième stade larvaire dure de 2 à 3 journées, le troisième stade larvaire dure également de 2 à 3 journées alors que le dernier stade larvaire est plus long, soit de 3 à 4 journées (Bernardi et al. 2012). Le développement complet de la nymphe a donc une durée moyenne de 8 à 10 jours. Une fois adultes, les femelles aptères vivipares se multiplient par parthénogénèse, produisant ainsi plusieurs générations par année (Lambert et al. 2007). Cette période de reproduction asexuée chez le puceron du fraisier est d’une période d’environ 16 à 18 jours (Bernardi et al. 2012). Ce qui fait en sorte que le cycle complet du puceron du fraisier est d’environ 3 à 4 semaines, dépendamment des conditions environnementales. Par ailleurs, des pucerons ailés sont éventuellement formés. Dans ce cas particulier, la nymphe du dernier stade larvaire (L4) possèdera des bourgeons allaires, et ce quatrième stade en question durera de 4 à 7 jours (Dicker, 1952). La forme ailée permettra aux pucerons du fraisier de se disperser et coloniser d’autres champs de fraise lorsque les conditions de croissances sont optimales (Minks & Harrewijn, 1987). Le stimulus du surpeuplement n’est donc pas ici le facteur déclenchant le stade ailé. Par la suite, les mâles sont présents à l’automne pour la reproduction sexuée avec les femelles ovipares, et ainsi le cycle de vie recommencera l’année suivante, à partir de l’œuf hiverné.
Le puceron du fraisier aptère est un puceron de taille moyenne (0,9 à 1,8 mm), translucide de couleur vert pâle tirant sur le jaune, couvert de soies capitées. Ailé, sa tête et son thorax sont noirs et il possède une tache noire à l’abdomen (Blackman & Eastop, 2006).
Les principaux hôtes du puceron du fraisier sont toutes les variétés de fraises cultivées Fragaria x ananassa, Potentilla spp. ainsi que les fraisiers sauvages Fragaria spp. et même possiblement Rosa spp., faisant tous partie de la famille des rosacées (Rosacea) (Moreau, 2015, conférence journée horticole Décembre 2015; Blackman & Eastop, 2006; Blackman et al. 1987; Martin & Tzanetakis, 2015; Dicker, 1952).
Sous sa forme ailée, le puceron du fraisier est le plus important vecteur de virus du fraisier, dont le SMYEV, SMoV, SVBV et SCV (Lavandero et al. 2012). Par ailleurs, les pucerons peuvent transmettre les virus à tous les stades de développement, soit larve, adulte aptère et adulte ailé (Krczal, 1980). Cependant, lorsque les pucerons ailés sont en vol pendant de longues périodes de temps, ils deviennent affamés et leurs comportements de sélection d’hôte font en sorte qu’ils piquent plusieurs plantes à la fois (Minks & Harrewijn, 1987). De plus, le fait d’être transporté par le vent vers d’autres champs joue un rôle essentiel dans la propagation des virus sur de très grandes distances. C’est donc toutes ces caractéristiques qui font en sorte que les pucerons du fraisier ailés sont des vecteurs de virus efficaces.
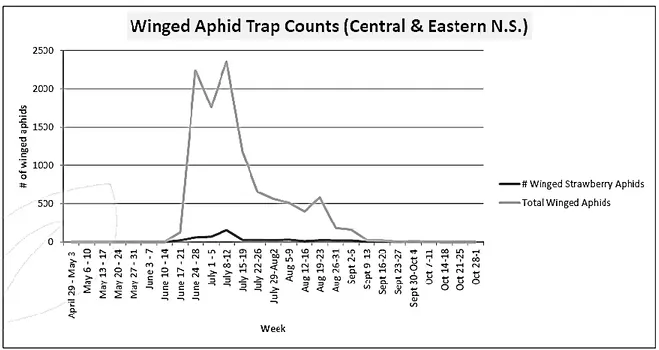
Le puceron du fraisier semble avoir toujours été présent dans les fraisières de la Nouvelle-Écosse, au Canada (Stultz, 1968). Un rapport publié par Perennia (Lewis, 2013) indique que la période de vol du puceron du fraisier de la région Ouest et Vallée de la Nouvelle-Écosse se situe du début du mois de juin jusqu’à la fin du mois de juillet, tel qu’indiqué dans la figure 1. Par contre, dans la région Centrale et Est de la Nouvelle-Écosse, les pucerons du fraisier ailés sont présents de fin juin à la mi-juillet et brièvement à la mi-octobre, tel de présenté dans la figure 2.
Figure 1 : Période de vol du puceron du fraisier ailé dans la région Ouest et Vallée de la Nouvelle-Écosse en 2013. Adapté de Lewis (2013) par l’auteure.
Figure 2 : Période de vol du puceron du fraisier ailé dans la région Centrale et Est de la Nouvelle-Écosse en 2013. Adapté de Lewis (2013) par l’auteure.
1.4.2.
Aleurodes
Les aleurodes (Hemiptera : Aleyrodidae), communément appelés ‘’mouches blanches’’ sont d’importants ravageurs de cultures connus pour extraire de grande quantité de sève du phloème des plantes, produire du miellat qui peut occasionner l’apparition de champignons pathogènes mais également en tant que vecteurs de maladies virales économiquement graves (Byrne & Bellows, 1991). Ce n’est seulement que tout récemment qu’ils sont identifiés comme des vecteurs de virus dans les cultures de fraises et de mûres (Martin & Tzanetakis, 2015). Officiellement, seulement quelques aleurodes colonisent les fraisiers cultivés en Amérique du Nord : l’aleurode de l’iris Aleyrodes spiraeoides Quaintance, l’aleurode du fraisier Trialeurodes packardi Morrill, Trialeurodes ruborum Cockerell et Trialeurodes fernaldi Morrill, (Evans, 2007). D’autres sources rapportent que l’aleurode à ailes striées Trialeurodes abutiloneus Haldeman et l’aleurode du tabac Bemisia tabaci Gennadius s’attaqueraient également aux fraisiers cultivés (Tzanetakis et al. 2006) ainsi que l’aleurode du chou Aleyrodes proletella Linné (Brisson, 2015). Curieusement, les listes officielles de ravageurs du fraisier au Canada et au Québec n’indiquent pas l’aleurode des serres Trialeurodes vaporarorium Westwood comme peste nuisible dans cette culture (Agriculture et Agroalimentaire Canada, 2015; Lambert et al. 2007). Pourtant, nombre d’articles publiés démontrent le contraire (e.g., Martin & Tzanetakis, 2013; Tzanetakis & Martin, 2013; Martin & Tzanetakis, 2006; Tzanetakis et al. 2006). Il semble exister peu d’informations officielles au sujet des aleurodes au Québec puisque la seule compilation complète connue qui regroupe plus de 3900 hémiptères (et homoptères) au Canada (Maw et al. 2000) inclut seulement l’aleurode des serres comme le seul aleurode présent dans notre province (Brisson, 2015).
1.4.2.1. Aleurode des serres
Comme son nom l’indique, l’aleurode des serres, ou aleurode commun T. vaporarorium, est un ravageur des cultures de serre, dont les tomates, les concombres et un grand nombre de plantes ornementales (McClanahan, 1979). Il possède donc d’innombrables hôtes, dont le fraisier des champs Fragaria virginiana (Tzanetakis et al. 2006) et il se retrouve également dans les champs de fraises de la province du Québec (Lambert et al. 2014).
Les adultes sont de couleur blanche, d’une longueur d’environ 1,5 mm et leurs ailes sont recouvertes d’une pruinosité blanche. Les femelles pondent de 150 à 300 œufs au cours de leur vie, d’une durée d’environ 42 jours (Brisson, 2015). Lorsque l’œuf éclot, une larve mobile se déplace de un à deux jours, puis se transforme en nymphe fixe. Ensuite, la nymphe se transforme en pupe d’où l’adulte émerge une dizaine de jours plus tard (McClanahan, 1979). Il a été mentionné que l’aleurode des serres hiverne dans les serres au stade pupal (Lambert et al. 2014) mais également au stade adulte en présence de nourriture (McClanahan, 1979).
L’aleurode des serres est le seul vecteur connu du virus SPaV (Tzanetakis et al. 2014). Le SPaV seul n’a aucun impact sur le dépérissement des fraisiers, mais tel que mentionné précédemment, la combinaison avec un ou des virus transmis par le puceron cause des symptômes néfastes aux plants (Tzanetakis & Martin, 2013). Tout comme pour le puceron du fraisier, c’est évidemment au stade ailé que l’introduction des virus par l’aleurode des serres dans d’autres champs se produit. Nous n’avons aucune information concernant la période de vol de l’aleurode des serres au Québec. Par ailleurs, il est mentionné que ce vecteur sort des serres à la fin de la saison (Lambert et al. 2014).
1.4.3.
Mode de transmission par les vecteurs
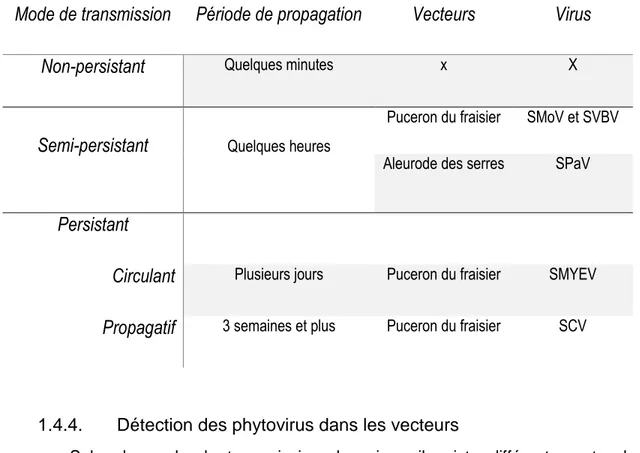
Il existe trois modes de transmission des virus par les vecteurs, soit non-persistant, semi-persistant et persistant (circulant et propagatif), présentés dans le tableau 5, adapté de Minks & Harrewijn (1989) par l’auteure. Les virus non-persistants sont des virus acquis rapidement et demeurant dans les stylets de l’insecte pour quelques minutes seulement (Fereres & Collar 2001). Toutefois, il n’y a pas de virus non-persistant parmi ceux responsables du dépérissement des fraisières. Les virus semi-persistants tels que SMoV, SVBV et SPaV sont des virus acquis rapidement et demeurant dans les stylets de l’insecte pour quelques heures (Watson & Plumb, 1972). Puisque le virus semi-persistant se situe uniquement dans les stylets du vecteur, la spécificité vecteur-virus s’en trouve modérée, ce qui signale que d’autres espèces de pucerons pourraient transmettre ces virus (Pelletier et al. 2012; Andret-Link & Fuchs, 2005).
Par ailleurs, les virus persistants circulants tel que SMYEV sont des virus acquis lors de l’alimentation, circulant dans le corps de l’insecte sans s’y répliquer, pour plusieurs jours. Les virus persistants propagatifs tel que SCV sont également des virus acquis lors de l’alimentation, circulant dans le corps de l’insecte et s’y répliquant, pour quelques semaines, soit la durée de vie du puceron (Gray & Banerjee 1999). Étant donné que l’alimentation est nécessaire à l’acquisition du virus persistant, le nombre d’espèces vectrices est très limité. La spécificité vecteur-virus est élevée de sorte que le puceron du fraisier est le seul vecteur connu des virus SMYEV et SCV (Andret-Link & Fuchs, 2005; Sylvester, 1980).
Tableau 5 : Récapitulatif des caractéristiques de transmission des virus par les insectes vecteurs. Adapté de Minks & Harrewijn (1989) par l’auteure.
Mode de transmission Période de propagation
Vecteurs
Virus
Non-persistant
Quelques minutes x XSemi-persistant
Quelques heuresPuceron du fraisier SMoV et SVBV Aleurode des serres SPaV
Persistant
Circulant
Plusieurs jours Puceron du fraisier SMYEVPropagatif
3 semaines et plus Puceron du fraisier SCV1.4.4.
Détection des phytovirus dans les vecteurs
Selon le mode de transmission des virus, il existe différents protocoles de détection des virus dans les insectes vecteurs à l’aide d’analyses moléculaires. C’est en 1992 que la première détection d’un phytovirus dans un puceron vert du pêcher, Myzus persicae Sulz, individuel par PCR a été réalisée (Lopez-Moya et al. 1992).
L’utilisation d’une amplification en chaîne par polymérase (PCR) de haute sensibilité pour détecter le virus de la mosaïque du chou-fleur dans le corps entier du puceron a été un succès, bien que ce virus soit non-persistant. Tel que mentionné précédemment, les virus non-persistants et semi-persistants sont confinés dans le stylet de l’insecte, ce qui peut rendre la détection des virus plus ardue et donc, moins précise (Singh et al. 1996). En 2012, Pelletier et collaborateurs améliorent la méthode de détection des virus non-persistants et semi-persistants situés dans les stylets des pucerons et réussissent à détecter le virus Y de la pomme de terre en détachant les pièces buccales (ou parfois une partie de la tête) de plus de 2500 spécimens (Pelletier et al. 2012). Les analyses s’en trouvent beaucoup plus précises mais le coût de la main-d’œuvre est considérable compte-tenu des dissections de pucerons requises (Y. Pelletier, chercheur retraité AAC, comm. pers).
Par ailleurs, l’acide nucléique constituant le génome du virus influence également la méthode de détection des virus, soit par PCR pour l’ADN viral et par RT-PCR pour l’ARN viral. Comme la grande majorité des virus ont un génome d’ARN, une transcription inverse est (RT pour «reverse transcription» en anglais) de mise, afin d’obtenir l’ADN complémentaire, avant d’effectuer une PCR. Les caractérisations moléculaires des virus ARN sont cependant plus laborieuses car l’ARN des phytovirus est difficile à cloner (Tzanetakis et al. 2005).
En ce qui concerne les autres insectes vecteurs, tels que les aleurodes et les thrips, les méthodes de dépistage sont sensiblement les mêmes. La RT-PCR est très efficace pour détecter le virus de la jaunisse du concombre dans l’aleurode du tabac, Bemisia tabaci (Gennadius), en utilisant le corps entier de l’insecte (Gil-Salas et al. 2007). Cette méthode est également efficace dans le cas des thrips pour détecter le virus de la maladie bronzée de la tomate, toujours en utilisant le corps entier de l’insecte, et le broyant avant d’en faire l’extraction d’ARN virale (Boonham et al. 2002).
1.4.5.
Méthodes de dépistage des vecteurs
Parmi les programmes de gestion des maladies virales transmises par des vecteurs, une des approches considérées est la réduction du nombre de vecteurs actifs (Martin & Tzanetakis, 2015). Le dépistage par piégeage, utilisé pour surveiller
l’activité de vol des vecteurs ailés, apporte donc des connaissances essentielles sur la gestion des maladies virales et sur les modèles de propagation des virus (Minks & Harrewijn, 1989). Le puceron du fraisier et l’aleurode des serres étant au cœur de la problématique de dépérissement des fraisières, il importe donc de les dépister au stade ailé.
En fraisières, la méthode de dépistage la plus utilisée par les agronomes au Québec est l’échantillonnage de feuille du cœur de plant de fraisier, afin de noter la présence des insectes vecteurs (Légaré et al. 2015). Cette méthode est rapide car la détection peut être effectuée directement au champ, à l’aide d’une loupe 20x. Il est également possible de faire une estimation du nombre de pucerons dans un champ en faisant un échantillonnage de 80 feuilles (Frazer & McGregor, 1990). Cependant, cette méthode n’est pas pertinente pour dépister les vecteurs au stade ailé, car les pucerons dérangés ont tendance à s’envoler.
Plusieurs méthodes de piégeages ont évolué au cours des 70 dernières années afin de capturer ces deux vecteurs au stade ailé. Il existe différentes catégories de pièges : attractifs ou non attractifs, capturant les insectes soit par interception, soit par aspiration (Mukhopadhyay, 2011).
Le piège non attractif pour capturer les pucerons ailés par aspiration le plus connu est le piège à succion. Ce type de piège est utile pour capturer un très grand nombre d’insectes de manière constante et faire un suivi rigoureux de toutes les espèces présentes dans une aire déterminée, car étant non-sélectif et non biaisé, il collecte tous les insectes volant au-dessus de la bouche d’aspiration (O’Loughlin, 1963). De 1978 à 1984, ce type de piège a été utilisé par Dr Conrad Cloutier (Université Laval) pour faire un inventaire des pucerons ailés à quatre différents emplacements dans la province de Québec. Grâce à ce système, 65 nouvelles mentions au Québec, dont 14 nouvelles au Canada et même 5 nouvelles pour l’Amérique du Nord ont pu être dénombrées (Cloutier et al. 1986). Plusieurs spécimens de Chaetosiphon fragaefolii ailés, incluant mâles et femelles, ont été capturés lors de cette étude (Conrad Cloutier comm. pers.). Par ailleurs, le principal désavantage de ce type de piège est qu’il nécessite l’accès à une prise de courant électrique à proximité. De plus, les coûts de fabrication d’un tel piège s’élèvent facilement à près d’un millier de dollars (Pascal et al. 2013).
Le piège non attractif pour capturer des insectes par interception le plus utilisé est le piège à fil englué. Il est utilisé pour dépister des pucerons ailés en Europe (Avinent et al. 1991). Il est utilisé en général pour étudier le plancton aérien, lorsqu’il est impossible d’utiliser le piège à succion. Cependant, ces pièges ont une efficacité de capture plutôt faible. De plus, un solvant est nécessaire afin de récupérer les pucerons (Pascal et al. 2013).
Les pièges attractifs capturant les insectes par interception les plus communs sont les pièges-bols et les pièges-collants. L’attraction se fait notamment par l’utilisation de couleur soit bleu, vert, blanc, noir ou jaune, dépendamment de l’insecte que l’on veut capturer (Mukhopadhyay, 2011). En 1948, Broadbent invente un type de piège-collant cylindrique jaune afin de capturer des pucerons ailés en pleine migration, toujours très utilisé aujourd’hui avec quelques modifications (Broadbent, 1948). Le piège-collant consiste en une feuille enroulée en forme de cylindre, enduite d’un adhésif collant. Il peut être modifié en utilisant soit une feuille en forme de rectangle, un pot en plastique ou une plaque, tous enduits d’adhésif collant, soit suspendu ou bien attaché à un support (A’Brook, 1973). Dans le cadre du phénomène de dépérissement des fraisières, des pièges-collants jaunes ont été utilisés en Nouvelle-Écosse afin de connaître les périodes de vols des pucerons du fraisier ailés (Lewis, 2013). Deux des avantages de cette méthode sont qu’elle est très facile d’utilisation et requiert peu de matériel afin d’identifier les vecteurs de virus ailés.
En 1951, Moericke invente un type de piège-bol afin de capturer des insectes ailés qui s’avère également très efficace pour les pucerons (Moericke, 1951; O’Loughlin, 1963). Plusieurs produits liquides peuvent être utilisés dans ces pièges-bols, majoritairement de l’eau, ou un mélange d’eau et de savon, d’éthanol ou de propylène glycol (Mukhopadhyay, 2011). Différents équipements et plusieurs manipulations sont donc nécessaires au succès de cette méthode (Hodgson et al. 2005; Labonne et al. 1989). Plus récemment, Pelletier et al. (2012) utilisait des pièges-bols jaunes remplis de propylène glycol (40 à 60%) afin de conserver l’ARN du virus Y de la pomme de terre PVY provenant des stylets des pucerons capturés. Cette méthode est très utile pour pouvoir mesurer la prévalence des virus dans les spécimens de pucerons ailés capturés, car le propylène glycol a la propriété de conserver les acides nucléiques (Nie et al. 2011). Elle a d’ailleurs été utilisée par des chercheurs d’Agriculture et agroalimentaire Canada tels que Dr Debra Moreau de la
Nouvelle-Écosse et Madame Pam Fisher de l’Ontario (OMAFRA) afin de capturer des vecteurs de virus ailés dans l’actuelle problématique du dépérissement des fraisières (Debra Moreau et Pam Fisher, comm. pers.). Les insectes issus de ces pièges sont facilement identifiables car non seulement ils ont gardés toutes leurs caractéristiques morphologiques intactes, mais il est possible de les monter sur lames et de les identifier au microscope à l’aide de clés d’identification (Maw, 1999; Foottit & Richards, 1993).
Le succès de ces deux pièges provient de la couleur jaune, qui est très attirante pour nombre d’insectes, dont les pucerons et les aleurodes (Eastop, 1955; Berlinger, 1980). Afin de mesurer la variation saisonnière de l’abondance des vecteurs de virus ailés, les pièges-bols jaunes et les pièges-collants jaunes semblent donc être des solutions adéquates.
1.5. Problématique
La principale préoccupation des intervenants et des producteurs en lien au phénomène du dépérissement des fraisières est le peu d’informations disponibles sur les insectes vecteurs au Québec ainsi que sur les virus du fraisier, tel que le démontre très bien les tableaux 1 et 2. Il n’existe en effet aucune étude publiée sur les pucerons du fraisier et les aleurodes vecteurs de virus de fraisier dans la province de Québec. Toutes les informations réunies proviennent de l’extérieur, soit des États-Unis, de l’Ontario et de la Nouvelle-Écosse. Développer une technique de dépistage en champ facile d’utilisation afin qu’elle soit transférable aux intervenants et aux producteurs demeure la solution essentielle à cette préoccupation.
Outre le développement d’un outil de dépistage efficace des vecteurs, le projet avait pour fin d’apporter de nouvelles connaissances sur la phénologie ainsi que sur le suivi des populations spécifiques au Québec de ces insectes et ce, pour chacune des 13 régions productrices de fraise de la province. Selon Dr Jean Denis Brisson (2015) les connaissances concernant les aleurodes sont toujours très limitées au Canada et au Québec.
De plus, des questionnements subsistent : quelles sont les principales sources de contamination virale des champs de fraises au Québec ? Les pépiniéristes