Bacillus pumilus et Bacillus subtilis pour lutter contre la
pourriture grise chez la tomate et le concombre de serre
Mémoire
Mathieu Bouchard-Rochette
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
Bacillus pumilus et Bacillus subtilis pour lutter contre la
pourriture grise chez la tomate et le concombre de serre
Mémoire
Mathieu Bouchard-Rochette
Sous la direction de :
Russell J. Tweddell, directeur de recherche
Hani Antoun, codirecteur de recherche
Résumé
Cette étude s’inscrit dans le cadre d’un programme de recherche destiné à évaluer le potentiel d’utilisation en horticulture des bactéries Bacillus pumilus souche PTB180 et Bacillus
subtilis souche PTB185. Elle avait pour objectifs (1) d’évaluer in vitro l’activité antagoniste
contre Botrytis cinerea des souches PTB180 et PTB185, (2) d’estimer leur capacité à survivre sur la phyllosphère de la tomate et du concombre et 3) d’évaluer leur effet sur le développement de la pourriture grise (B. cinerea) sur des plants de tomate et de concombre cultivés en serre. L'activité antagoniste de PTB180 et PTB185 a été évaluée en boîtes de Pétri sur géloses, sur tissus foliaires de tomate et de concombre et sur fruits de tomate. Les deux souches ont inhibé très fortement la croissance mycélienne et la germination des spores de
B. cinerea sur géloses. Sur feuilles de tomate et sur disques foliaires de concombre, PTB185
et le mélange (1:1) des deux souches ont réduit significativement (p ≤ 0,01) la croissance mycélienne de B. cinerea comparativement aux témoins. PTB180 a réprimé significativement la croissance mycélienne de B. cinerea sur les fruits de tomate. Afin d'estimer la survie de PTB180 et PTB185 sur la phyllosphère, des plants de tomate et de concombre ont été pulvérisés jusqu'à ruissellement avec une suspension (1×107 unités formatrices de colonies [UFC]/mL) de PTB180, PTB185 ou d'un mélange (1:1) des deux souches. Les populations de chaque souche ont ensuite été suivies au cours du temps sur les feuilles.Les résultats obtenus montrent que les souches survivent au moins 21 jours sur les plants de tomate et de concombre avec un taux de survie variant de 43% à 100%. De plus, pratiquement aucune variation dans les proportions de chaque souche n'a été observée au fil du temps lorsque PTB180 et PTB185 étaient appliquées en mélange. Enfin, l’application foliaire de PTB180, PTB185 et du mélange (1:1) des deux souches a permis une réduction significative de l’incidence et de la sévérité de la pourriture grise chez des plants de tomate et de concombre inoculés avec B. cinerea et cultivés en serre. Les souches PTB180 et PTB185 ont montré au cours de cette étude une forte activité antagoniste envers B. cinerea, la capacité de survivre sur la phyllosphère de plants de tomate et de concombre et de réprimer le développement de la pourriture grise chez ces derniers. Ces souches pourraient éventuellement être utilisées comme agents de lutte biologique contre la pourriture grise du concombre et de la tomate de serre.
Table des matières
Résumé ... ii
Table des matières... iii
Liste des tableaux ... v
Liste des figures ... vi
Remerciements ... vii
Avant-propos ... viii
Introduction ... 1
Chapitre 1: Revue de Littérature ... 3
1.1 Situation de la production de légumes de serre au Québec et au Canada ... 3
1.2 Tomate de serre ... 4 1.3 Concombre de serre ... 4 1.4 La pourriture grise ... 5 1.5 Méthodes de lutte ... 7 1.5.1 Pratiques culturales ... 7 1.5.2 Lutte génétique ... 8 1.5.3 Lutte chimique ... 8 1.5.4 Lutte biologique ... 11 1.6 Les Bacillus ... 14 1.6.1 Leur utilisation ... 14
1.6.2 Les Bacillus et la lutte biologique ... 15
1.7 Hypothèse et objectifs ... 18
Chapitre 2: Manuscrit Biofungicide potential of Bacillus pumilus and Bacillus subtilis against Botrytis cinerea on tomato and cucumber plants………19
Résumé ... 20
Abstract ... 21
Introduction ... 22
Materials and methods ... 23
Bacteria ... 23
Botrytis cinerea ... 23
Effect of PTB180 and PTB185 on B. cinerea mycelial growth and conidial germination on agar (double agar layer technique) ... 24
Effect of PTB180 and PTB185 on the development of B. cinerea on postharvest tomato fruits ... 25
Survival of PTB180 and PTB185 on the phyllosphere ... 26
Effect of PTB180 and PTB185 on gray mold incidence and severity on tomato and cucumber plants grown in greenhouse ... 26
Analysis of variance ... 28
Results ... 28
Mycelial growth and conidial germination of B. cinerea on agar ... 28
Mycelial growth of B. cinerea on leaf tissues ... 28
Mycelial growth of B. cinerea on postharvest tomato fruits ... 29
Survival of PTB180 and PTB185 on the phyllosphere ... 29
Gray mold incidence and severity on tomato and cucumber plants grown in greenhouse... 29
Discussion ... 30
Acknowledgements ... 33
References ... 34
Conclusion ... 46
Liste complète des références ... 47
Liste des tableaux
Tableau 1. Liste de quelques fongicides de synthèse homologués au Canada contre la pourriture
grise (Botrytis cinerea). ... 10
Tableau 2. Liste de quelques fongicides biologiques homologués au Canada contre la pourriture
grise (Botrytis cinerea). ... 13
Tableau 3. Bactéries du genre Bacillus ayant démontré des effets prometteurs contre diverses
Liste des figures
Figure 1. Effect of PTB180 and PTB185 inoculated at different concentrations on Botrytis cinerea
mycelial growth. ... 37
Figure 2. Effect of PTB180 and PTB185 inoculated at different concentrations on Botrytis cinerea
conidial germination. ... 37
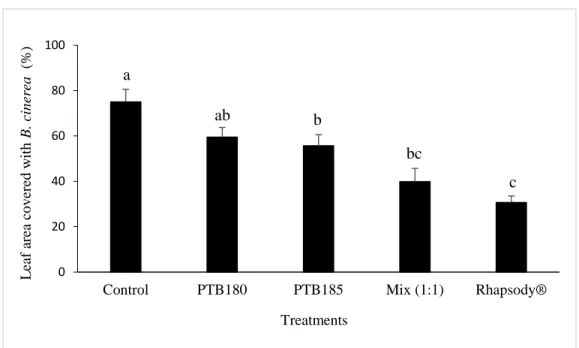
Figure 3. Effect of PTB180, PTB185, and mix (1:1) of both strains on tomato leaf area covered
with Botrytis cinerea. ... 38
Figure 4. Effect of PTB180, PTB185, and mix (1:1) of both strains on cucumber leaf disc area
covered with Botrytis cinerea. ... 38
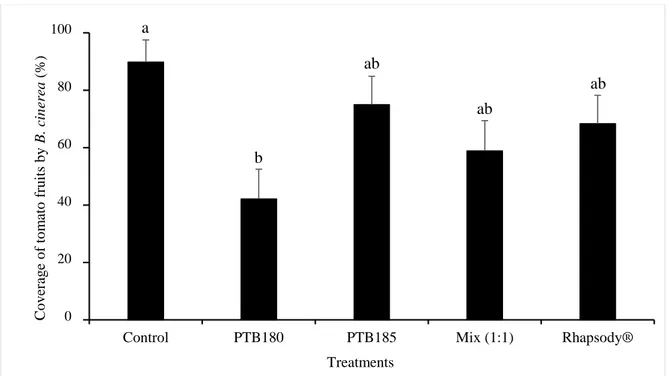
Figure 5. Effect of PTB180, PTB185, and mix (1:1) of both strains on Botrytis cinerea coverage of
postharvest tomato fruits. ... 39
Figure 6. Time course of PTB180 and PTB185 populations on tomato leaf when applied as a single
suspension or as a mix (1:1). ... 39
Figure 7. Proportion of PTB180 and PTB185 populations [when applied as a mix (1:1)] on tomato
leaves as a function of time. ... 40
Figure 8. Root and shoot dry weight of tomato plants 21 days after inoculation with PTB180,
PTB185, and mix (1:1) of both strains. ... 40
Figure 9.Time course of PTB180 and PTB185 populations on cucumber leaf when applied as a
single suspension or as a mix (1:1). ... 41
Figure 10. Proportion of PTB180 and PTB185 populations [when applied as a mix (1:1)] on
cucumber leaves as a function of time. ... 41
Figure 11. Root and shoot dry weight of cucumber plants 21 days after inoculation with PTB 180,
PTB 185, and a mix (1:1) of both strains. ... 42
Figure 12. Effect of preventive application of PTB180, PTB185, and mix (1:1) of both strains on
incidence and severity index of gray mold evaluated on tomato plants 7 days following Botrytis
cinerea inoculation.. ... 42 Figure 13. Effect of preventive application of PTB180, PTB185, and mix (1:1) of both strains on
incidence and severity index of gray mold evaluated on tomato plants 10 days following Botrytis
cinerea inoculation. ... 43 Figure 14. Effect of preventive application of PTB180, PTB185, and mix (1:1) of both strains on
incidence and severity index of gray mold evaluated on tomato plants 14 days following Botrytis
cinerea inoculation. ... 43 Figure 15. Effect of PTB180, PTB185, and mix (1:1) of both strains on shoot dry weight of tomato
plants inoculated with Botrytis cinerea. ... 44
Figure 16. Effect of preventive application of PTB180, PTB185, and mix (1:1) of both strains on
incidence and severity index of gray mold evaluated on cucumber plants 7 days following Botrytis
cinerea inoculation. ... 44 Figure 17. Effect of PTB180, PTB185, and mix (1:1) of both strains on shoot dry weight of
Remerciements
Tout d’abord, j’aimerais remercier mon directeur de recherche, M. Russell J. Tweddell, ainsi que mon codirecteur, M. Hani Antoun, pour leur aide et leurs conseils qui ont permis de développer mon approche expérimentale, mon raisonnement scientifique ainsi que ma capacité d’écriture dans le domaine des sciences. Je les remercie aussi pour l’immense patience qu’ils ont su démontrer quant à mes questions et auxerreurs que j’ai pu commettre. Merci à notre professionnelle de recherche, Mme Thi Thuy An Ngyuen, pour sa patience, sa générosité et pour ses nombreux enseignements précieux. Merci surtout de m’avoir poussé à réaliser mes essais jusqu’au bout, me permettant ainsi de développer mon expertise en microbiologie.
Je tiens aussi à remercier toute l’équipe du laboratoire, Maxime Delisle-Houde, Élizabeth Demeule, Mouna Kahia et Louis Cossus pour leur aide et leurs conseils.
Finalement, merci à nos partenaires de recherche, Premier Tech, le Consortium de recherche et innovations en bioprocédés industriels au Québec (CRIBIQ) et le Conseil de recherches en sciences naturelles et génie du Canada (CRSNG), sans qui ce projet n’aurait pu être réalisé.
Avant-propos
Le premier chapitre de ce mémoire présente une revue de littérature traitant des connaissances actuelles sur la culture de la tomate et du concombre de serre au Canada et sur l’agent phytopathogène à l’étude dans le cadre de ce projet, soit le Botrytis cinerea. Une description du cycle épidémiologique de B. cinerea est présentée, en plus des différentes méthodes pour lutter contre cet organisme; une attention particulière est portée sur la lutte biologique. La revue de littérature traite également des bactéries du genre Bacillus, organismes testés lors de ce projet comme agents de lutte contre B. cinerea, et de leur utilisation en lutte biologique. Finalement, l’hypothèse et les objectifs de l’étude sont présentés en toute fin de section.
Le deuxième chapitre présente un article scientifique intitulé « Biofungicide potential of
Bacillus pumilus and Bacillus subtilis against Botrytis cinerea on tomato and cucumber
plants » La soumission de cet article à la Revue canadienne de phytopathologie est prévue
pour l’automne 2019. Voici la liste des auteurset leur contribution respective:
• Mathieu Bouchard-Rochette (auteur principal; réalisation des expériences, rédaction de l’article et mise en forme)
• Russell J. Tweddell (supervision, corrections, conseils et mise en forme) • Hani Antoun (supervision, corrections, conseils et mise en forme) Finalement, une brève conclusion vient terminer le mémoire.
Ce projet, réalisé dans le cadre du projet Horizon, a été possible grâce au soutien de plusieurs partenaires soit: Premier Tech, le Consortium de Recherche et Innovations en Bioprocédés Industriels au Québec (CRIBIQ), et le Conseil de Recherches en Sciences Naturelles et en Génie du Canada (CRSNG).
Introduction
L’industrie canadienne de la serriculture maraîchère gagne en importance d’année en année, se démarquant comme la production horticole qui connaît la plus forte progression avec une croissance constante depuis les cinq dernières années (Statistique Canada, 2017). Au Québec, la tomate (Solanum lycopersicum L.) et le concombre (Cucumis sativus L.) constituent les principales productions maraîchères sous serre (MAPAQ, 2018). La forte production de ces cultures les expose à plusieurs maladies, comme la pourriture grise, causée par le champignon Botrytis cinerea Pers. À l’échelle mondiale, la pourriture grise est reconnue comme la deuxième maladie fongique en importance (Dean et al., 2012). En raison de l’inquiétude grandissante quant à l’innocuité des fongicides de synthèse et au développement de cas de résistance, l’utilisation d’agents de lutte biologique est de plus en plus prisée pour lutter contre cet agent pathogène, et ce bien que la lutte biologique essuie de nombreuses critiques relatives, entre autres, à une efficacité variable et au faible taux de survie in situ des agents de lutte biologique (Elad et al., 2016). Les bactéries du genre
Bacillus figurent parmi les microorganismes les plus étudiés pour lutter contre les
champignons phytopathogènes (Kefi et al., 2015). Ces bactéries Gram positif ubiquistes constituent en effet d’excellents candidats en vue d’une utilisation comme agents de lutte biologique. De nombreuses bactéries du genre Bacillus sont reconnues pour leur effet antagoniste contre plusieurs agents phytopathogènes via différents modes d’action (compétition pour les nutriments, antibiose ou induction de la défense systémique de la plante), leur effet stimulant sur la croissance des plantes et leur capacité de survivre à diverses conditions extrêmes par la production d’endospores (Hinarejos et al., 2016; Kilani-Feki et al., 2016).
Les souches PTB180 de Bacillus pumilus Meyer et Gottheil et PTB185 de Bacillus subtilis (Ehrenberg) Cohn, isolées de la rhizosphère, ont récemment montré une activité antifongique contre plusieurs agents phytopathogènes du sol. Cette étude, réalisée en collaboration avec Premier Tech, avait pour objectifs (1) d’évaluer in vitro l’activité antagoniste contre B.
cinerea des souches PTB180, PTB185 et d’un mélange (1:1) des deux souches, (2) de
déterminer la capacité des souches à survivre sur la phyllosphère de plants de tomate et de concombre, et (3) de tester la capacité des souches, seules ou en mélange (1:1), à réduire
l’incidence et la sévérité de la pourriture grise sur des plants de tomate et de concombre cultivés en serre.
Chapitre 1: Revue de Littérature
1.1 Situation de la production de légumes de serre au Québec et au Canada
L’industrie canadienne de la serriculture maraîchère gagne en importance d’année en année, se démarquant comme la production horticole qui connaît la plus forte progression, avec une croissance constante depuis les cinq dernières années et une valeur à la ferme allant jusqu’à 1,4 milliard de dollars (Statistique Canada, 2017). Cette croissance est attribuable, entre autres, à une augmentation de la consommation de légumes de serre chez les Canadiens passant de 6,2 kg par habitant en 2007 à 9,9 kg par habitant en 2015; 41% des légumes consommés en 2015 par les Canadiens étaient produits en serre. Toujours en 2015, la production de légumes de serre a dépassé la consommation domestique, atteignant un taux d’autosuffisance de 165%, indiquant de bonnes tendances pour le marché d’exportation (MAPAQ, 2018). L’exportation des légumes de serre était en 2017 nettement supérieure à leur importation (principalement du Mexique) avec des recettes monétaires de 964 M$ contre 384 M$, engendrant un profit de plus de 580 M$. Le Québec se classe au troisième rang des provinces productrices de légumes de serre (6% de la production canadienne), derrière l’Ontario (70%) et la Colombie-Britannique (20%) (MAPAQ, 2018). Comparativement à la production en champ, la production des légumes en serre présente de nombreux avantages dont les suivants: 1) meilleure durée de vie sur les comptoirs, 2) meilleure esthétique, 3) production plus stable et moins sujette aux aléas environnementaux et aux maladies, 4) adaptée à la production locale sur toute l’année (AGÉCO, 2011) et 5) davantage adaptée à la production biologique, qui devient de plus en plus populaire et rentable sur le marché. Sur la base des superficies en culture, les trois légumes de serre les plus cultivés au Canada et au Québec sont la tomate (38% des superficies en culture), le poivron (33%) et le concombre (26%) (Statistique Canada, 2017).
1.2 Tomate de serre
La tomate, Solanum lycopersicum L., appartient à la famille des Solanacées. Originaires d’Amérique du Sud, les fruits ont été importés pour la première fois en 1524 par les Européens pour ensuite connaître une production fulgurante dans le reste du monde. Au Canada, la tomate de serre est produite selon différents cycles de production établis en fonction des objectifs de production de l’année et du climat. Généralement, une ou deux productions sont possibles durant l’année, le temps de production variant de 6 à 7 mois (Agriculture et Agroalimentaire Canada, 2016a). Au Québec et au Canada, la tomate est le légume le plus produit en serre et l’un des principaux exportés. En 2015, plus de 391 M$ de tomates fraîches produites au Canada ont été exportés (38% des produits de serre exportés), majoritairement vers les États-Unis. Au Québec, 64% des tomates exportées sont produites en serre. En 2014, avec 18 000 tonnes de tomates de serre produites, le Québec figurait au troisième rang des provinces productrices de ce légume derrière l’Ontario et la Colombie-Britannique (Agriculture et Agroalimentaire Canada, 2016a).
1.3 Concombre de serre
Cultivé depuis 3000 ans, le concombre, Cucumis sativus L., serait originaire de l’Inde. Depuis les dernières années, le concombre gagne en popularité. Il est de plus en plus cultivé en serre, particulièrement le mini-concombre et le concombre à marinade. Le concombre anglais reste le plus cultivé en serre au Canada, avec une douzaine de variétés produites (Agriculture et Agroalimentaire Canada, 2016b). Grâce au caractère parthénocarpique du concombre, les producteurs peuvent faire deux ou trois cultures par année, parfois quatre cultures. En 2017, le concombre était le troisième légume de serre produit au Canada et le deuxième au Québec, avec 190 000 tonnes produites au pays (Statistique Canada, 2017). Toujours en 2017, 331 M$ de concombres de serre produits au Canada ont été exportés et 45 M$ ont été importés, permettant un profit d’environ 306 M$ (MAPAQ, 2018). Près de 300 entreprises québécoises étaient dédiées à la production de concombre de serre en 2016.
1.4 La pourriture grise
Parmi les différentes maladies affectant les cultures maraîchères en serre, la pourriture grise, malgré tous les efforts déployés pour la prévenir ou l’éradiquer, demeure endémique au Québec, au Canada et à travers le monde (Romanazzi et Feliziani, 2014). La pourriture grise, ou moisissure grise, est causée par Botrytis cinerea Pers., un champignon saprophyte naturellement présent dans le sol. Parasite opportuniste nécrotrophe, B. cinerea profite de certaines conditions de faiblesse de la plante (carence en nutriments, lésion, autres maladies, etc.) pour l’infecter (Biddle, 2001). À l’échelle mondiale, la pourriture grise est considérée comme la maladie fongique la plus préjudiciable en serre, et la deuxième plus importante, en agriculture, juste après la pyriculariose du riz, causée par Magnaporthe grisea (Dean et al., 2012). Les coûts totaux associés à la lutte à la pourriture grise (mesures préventives culturales, fongicides, etc.) sont estimés à 1,5 milliard de dollars américains chaque année. Si l'on ajoute les pertes de rendement attribuables à la maladie, les coûts inhérents seraient de 10 à 100 milliards de dollars américains chaque année. Le champignon, en plus de causer d’importants dommages lors de la culture, peut également sévir en post-récolte; il est l’agent pathogène causant le plus de dommages post-récolte aux fruits. Botrytis cinerea est considéré comme un agent pathogène polyphage pouvant infecter une large gamme d’hôtes, soit près de 230 espèces de plante, alors qu’en moyenne les agents pathogènes n’infectent qu’une trentaine d’espèces différentes (Elad et al., 2016). En serre, il exerce une forte pression de maladie en plus d’avoir une présence continue durant toute l’année. En raison de sa capacité de vivre en saprophyte ou en parasite, il peut être difficile de se débarrasser de B. cinerea.
Le champignon responsable de la pourriture grise est nommé B. cinerea sous sa forme asexuée (anamorphe) et Botryotinia fuckeliana sous sa forme sexuée (téléomorphe). Sous sa forme sexuée (rarement observée en nature), ce champignon de l’embranchement des Ascomycota produit des apothécies portant les asques contenant les ascospores (Romanazzi et Feliziani, 2014). On retrouve une grande diversité de souches de B. cinerea présentant plusieurs phénotypes différents tel que: mycélium court ou long pouvant être aérien, sporulation abondante ou non, production ou non des sclérotes, production de métabolites secondaires et résistance aux fongicides de synthèse. Malgré les différences observées au
sein des souches, le champignon se distingue clairement par son apparence grise. Botrytis
cinerea infecte seulement les parties aériennes des plants, soit la tige, la feuille, la fleur et le
fruit. Les symptômes de la maladie se manifestent sous forme de chloroses et nécroses. Les premiers symptômes peuvent être observés sur le limbe et à la marge des feuilles sous forme de taches nécrotiques annelées (Davidson et al., 2007). On peut aussi observer sur les fruits de petites taches en forme de halo blanc, connues sous le nom de taches fantômes (Elad et al., 2016). Les signes de la maladie sont clairement observables sur les tissus infectés sous forme de mycélium gris. Lorsque les conditions sont favorables, les conidies (spores asexuées) présentes sur un hôte sensible germent et produisent des appressoria destinés à pénétrer les tissus végétaux (Agrios, 2005). Après avoir pénétré les tissus de l’hôte, B.
cinerea tue les cellules par la production de métabolites secondaires et colonise l’hôte. Les
conidies germent à une température comprise entre 18oC et 24oC et sous haute humidité relative, soit plus de 90%. L’humidité est un facteur clé qui régit l’infection, puisqu’il doit y avoir présence d’eau stagnante durant au moins 24 heures pour que les conidies germent. Outre les conidies, le mycélium de B. cinerea constitue un inoculum capable de causer l’infection. L’infection peut être aussi favorisée par une courte photopériode, soit moins de 12 heures, et par la présence de blessures sur les plants. Lorsque les conditions deviennent moins favorables, le champignon peut amorcer la production de conidiophores qui portent en leur extrémité une grappe de conidies grises (reproduction asexuée) qui donnent l’aspect gris duveteux au champignon. Les conidies sont par la suite dispersées par le vent ou d’autres modes de dispersion comme les vêtements des travailleurs, l’équipement (arrosoir, sécateur, etc.) ou les insectes comme les thrips, pour éventuellement coloniser d’autres hôtes et recommencer le cycle d’infection (Elad et al., 2016).
Agent pathogène polycyclique, B. cinerea peut réaliser plusieurs cycles d’infection au cours de la même saison. Sous des conditions très défavorables, par exemple une sécheresse, le champignon peut survivre (jusqu’à 9 mois) dans les débris végétaux sous forme mycélium ou de sclérotes; ces derniers pourront germer lorsque les conditions deviendront favorables. Parasite nécrotrophe, B. cinerea cause la mort des tissus de l’hôte pour ensuite les coloniser et s’en nourrir. Pour pénétrer la plante, B. cinerea peut sécréter près de 30 composés différents. Il sécrète, entre autres, plusieurs enzymes, comme des cutinases, pectinases,
protéases, hydrolases, lipases, hémicellulases et cellulases (Elad et al., 2016). Il sécrète également le botrydial et l’acide botcinique qui sont des phytotoxines propres à B. cinerea de même que l’acide oxalique pour abaisser le pH de la plante, et ainsi favoriser l’activité des hydrolases et la mort cellulaire.
1.5 Méthodes de lutte
1.5.1 Pratiques culturales
Les pratiques culturales sont les principales méthodes de lutte contre la pourriture grise; elles demeurent parmi les plus efficaces à ce jour. En serre, on veille à réduire l’humidité et l’eau stagnante qui peut s’accumuler dans les sous-pots ou se former à la surface des feuilles. Une pratique commune est de chauffer les serres à 37oC et ventiler les plants. Cependant, bien que ces méthodes soient efficaces, elles restent très coûteuses pour les producteurs. La taille et l’espacement des plants sont d’autres méthodes permettant de réduire la formation d’eau stagnante et le développement de la maladie. On recommande d’enlever au fur et à mesure les fruits mûrs ou montrant des signes de moisissure, et d’éliminer les débris végétaux au sol et les plants moribonds (Biddle, 2001). Il faut s’assurer de ne pas laisser ces débris près de la zone de culture, car ils pourraient constituer une source d’inoculum de B. cinerea. D’autres pratiques culturales de base sont recommandées pour réduire la maladie comme désinfecter l’équipement avant chaque utilisation et éviter les blessures lors de la taille et à la récolte des fruits. Ces méthodes, bien que laborieuses, sont peu coûteuses. En post-récolte, la température, l’humidité, les niveaux d’oxygène, de gaz carbonique et d’éthylène doivent être contrôlés rigoureusement. Ainsi des températures froides sont conseillées, mais un refroidissement trop rapide des fruits peut causer une condensation et des fissures chez les fruits, favorisant l’infection (Romanazzi et al., 2012).
1.5.2 Lutte génétique
Chez les populations de B. cinerea, en raison de la grande plasticité, de la diversité génétique et d’une évolution rapide des gènes grandement due aux mutations et aux fusions anastomosiques, il est difficile de développer des plantes résistantes à long terme et ce, bien que plusieurs gènes de résistance soient présents naturellement. Par exemple, certaines variétés de tomate expriment des gènes favorisant des dépôts de cutine et de cire plus élevés que la moyenne (Finkers et al., 2008). Des efforts sont par ailleurs déployés pour découvrir et développer des mycovirus capables d’induire une hypovirulence chez des isolats de B.
cinerea exerçant une forte pression de maladie. Cette approche semble prometteuse mais la
transmission des mycovirus d’un isolat à l’autre est souvent limitée par plusieurs facteurs incluant les incompatibilités de groupe anastomosique (Rodríguez‐García et al., 2014).
1.5.3 Lutte chimique
En général, les fongicides de synthèse utilisés contre B. cinerea sont unisites systémiques, c’est-à-dire qu’ils n’ont qu’un site d’action comme la mitochondrie, le cytosquelette, la paroi cellulaire, le site de synthèse de l’ATP, la synthèse des protéines, etc. Les botrycides multisites, comme les sels de cuivre, sont efficaces, mais demandent plusieurs applications préventives et sont interdits dans certains pays, particulièrement en Europe (Rodríguez et al., 2014). Une multitude de produits de synthèse contenant différentes matières actives sont homologués au Canada pour lutter contre B. cinerea (Tableau 1). Aucun de ces fongicides n’est recommandé pour une utilisation post-récolte. Parmi les matières actives les plus efficaces, on retrouve le pyriméthanil qui affecte la synthèse de la méthionine, acide aminé essentiel au processus d’infection, et la sécrétion des enzymes hydrolytiques (Romanazzi et Feliziani, 2014). En général, les botrycides sont appliqués de manière préventive, sur les fleurs et les feuilles avant l’apparition des fruits, à raison de plusieurs applications par plant. Dans certains cas, les fongicides sont appliqués plusieurs fois sur les fruits après la récolte. L’application répétée de ces fongicides favorise le développement de résistance chez l’agent pathogène. Botrytis cinerea est reconnu comme l’un des agents phytopathogènes subissant
le plus de mutations spontanées, et qui par le fait même développe le plus rapidement la résistance aux fongicides de synthèse (Elad et al., 2016). La perte d’efficacité des fongicides de synthèse attribuable à l’apparition de souches résistantes des agents pathogènes jumelée à l’inquiétude grandissante du public face aux possibles effets néfastes de ces derniers sur la santé humaine et l’environnement encouragent le développement d’alternatives efficaces aux fongicides de synthèse pour lutter contre B. cinerea.
On s’intéresse de plus en plus à la possibilité d’utiliser des produits naturels pour lutter contre les agents phytopathogènes. Ces produits peuvent être des dérivés d’extraits de plante comme des huiles essentielles; ils sont généralement considérés comme peu néfastes pour l’environnement et sans danger pour l’humain. Ils peuvent agir directement contre l’agent pathogène ou indirectement en induisant les défenses naturelles de la plante. Ils sont aussi très appréciés pour leur faible coût d’utilisation (Feliziani et al., 2013). La chitine, l’acide salicylique et l’acide jasmonique qui agiraient comme éliciteurs des défenses naturelles de la plante, ont montré de l’efficacité contre la pourriture grise. Le biochar, produit de la pyrolyse de biomasse en condition anaérobie, aurait aussi montré de l’efficacité contre la pourriture grise (Elad et al., 2010). L’acide lactique et différents sels, comme le bicarbonate de sodium, le carbonate de potassium et le sorbate de sodium, se sont avérés efficaces contre la pourriture grise; ils ont toutefois causé des signes de phytotoxicité chez les plants, en plus de retarder le mûrissement des fruits (Palou et al., 2009).
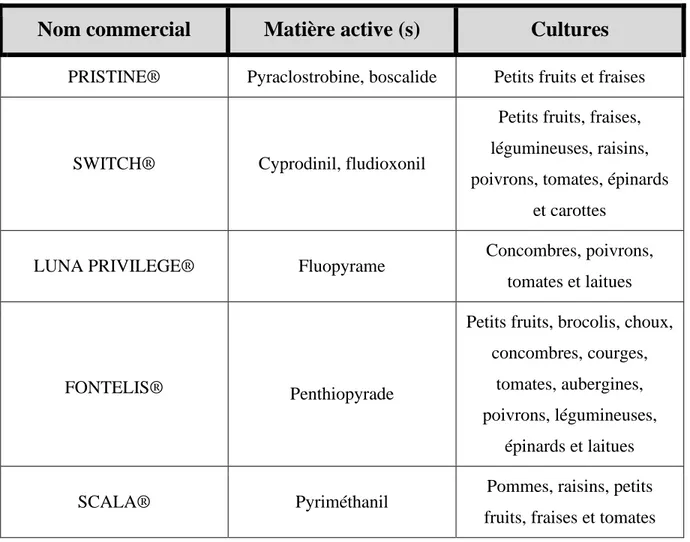
Tableau 1. Liste de quelques fongicides de synthèse homologués au Canada contre la
pourriture grise (Botrytis cinerea).
Nom commercial
Matière active (s)
Cultures
PRISTINE® Pyraclostrobine, boscalide Petits fruits et fraises
SWITCH® Cyprodinil, fludioxonil
Petits fruits, fraises, légumineuses, raisins, poivrons, tomates, épinards
et carottes
LUNA PRIVILEGE® Fluopyrame Concombres, poivrons,
tomates et laitues
FONTELIS® Penthiopyrade
Petits fruits, brocolis, choux, concombres, courges,
tomates, aubergines, poivrons, légumineuses,
épinards et laitues
SCALA® Pyriméthanil Pommes, raisins, petits
fruits, fraises et tomates (Santé Canada, 2019b)
1.5.4 Lutte biologique
La lutte biologique se définit comme l’utilisation de microorganismes (principalement des bactéries et des mycètes), d’insectes ou de composés dérivés de ceux-ci pour contrer un ou plusieurs agents pathogènes ou ravageurs des plantes (Xu et al., 2016). Les agents de lutte biologique affectent l’organisme nuisible selon différents modes d’action. Certains organismes, comme la levure Aureobasidium pullulans, agissent contre B. cinerea par compétition pour l’espace et les nutriments, empêchant ainsi sa prolifération sur la plante (Elad et al., 2016). D’autres organismes parasitent l’agent pathogène et affectent ainsi son développement; ce mécanisme est connu sous le nom d’hyperparasitisme. Plusieurs champignons des genres Gliocladium et Trichoderma ainsi que plusieurs bactéries du genre
Streptomyces sont connus pour produire des enzymes dénaturant les parois de B. cinerea,
qu’ils utilisent pour se nourrir (Elad et al., 2016; Ingram et Meister, 2006). L’antibiose (production de métabolites secondaires toxiques) est un autre mode d’action par lequel les agents de lutte biologique limitent le développement des agents pathogènes. Par exemple, plusieurs bactéries du genre Pseudomonas produiraient la pyrrolnitrine, un composé antifongique qui préviendrait la croissance mycélienne de B. cinerea (Haggag et El Soud, 2012). Finalement, les agents de lutte biologique peuvent stimuler les défenses naturelles de la plante, préparant ainsi la plante en cas d’attaque des agents pathogènes. Plusieurs espèces de Trichoderma ont montré la capacité de stimuler les défenses naturelles de la plante, en agissant comme éliciteurs des gènes reliés aux voies de signalement de l’acide salicylique et de l’acide jasmonique impliqués dans la production de phytoalexines (Elad et al., 2016). En général, les agents de lutte biologique contre la pourriture grise sont utilisés en traitement préventif plutôt qu’en traitement curatif; l’efficacité des agents de lutte biologique en traitement curatif est peu concluante. Plusieurs agents de lutte biologique sont actuellement homologués au Canada pour lutter contre B. cinerea (Tableau 2). La principale critique formulée à l’égard de ces derniers concerne leur efficacité variable. L’utilisation d’agents biologiques génère aussi des inquiétudes, particulièrement chez les producteurs, qui doutent de leur efficacité croyant qu’ils ne peuvent pas survivre sur les plants traités (Wei et al., 2016). La variabilité de l’efficacité des agents de lutte biologique contre B. cinerea est attribuable, entre autres, aux variations de température et d’humidité, à la difficulté de survie
sur le plant et d’adaptation avec la microflore naturelle, au moment et au mode d’application du produit, à la variété de plante utilisée et à la souche de B. cinerea utilisée (Elad et al., 2016). L’efficacité des produits de lutte biologique peut être améliorée en les combinant à des fongicides de synthèse ou en faisant des applications répétées (Islam et al., 2017). En serre où les conditions sont davantage contrôlées, une application répétée des agents de lutte biologique, avant et après la récolte des fruits, est préférable pour augmenter leur efficacité (Wei et al., 2016). Les bactéries du genre Bacillus sont parmi les agents de lutte biologique les plus étudiés et les plus utilisés contre les maladies et les ravageurs en serre.
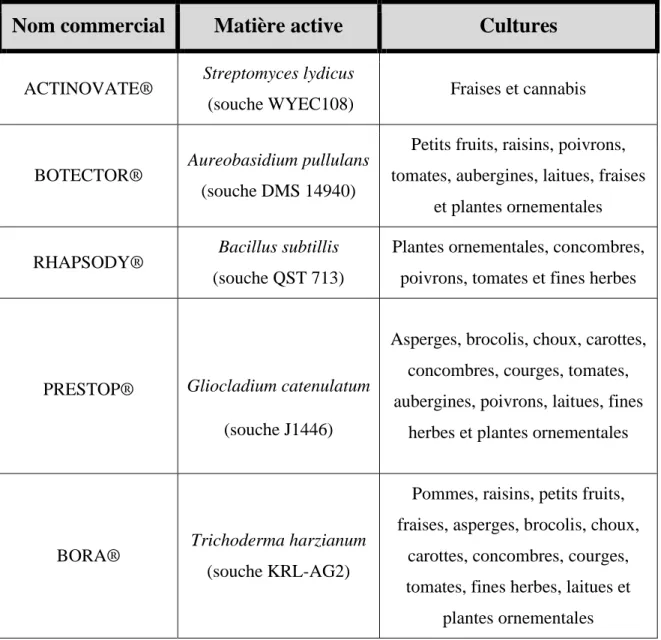
Tableau 2. Liste de quelques fongicides biologiques homologués au Canada contre la
pourriture grise (Botrytis cinerea).
Nom commercial
Matière active
Cultures
ACTINOVATE® Streptomyces lydicus
(souche WYEC108) Fraises et cannabis
BOTECTOR® Aureobasidium pullulans
(souche DMS 14940)
Petits fruits, raisins, poivrons, tomates, aubergines, laitues, fraises
et plantes ornementales
RHAPSODY® Bacillus subtillis
(souche QST 713)
Plantes ornementales, concombres, poivrons, tomates et fines herbes
PRESTOP® Gliocladium catenulatum
(souche J1446)
Asperges, brocolis, choux, carottes, concombres, courges, tomates, aubergines, poivrons, laitues, fines
herbes et plantes ornementales
BORA® Trichoderma harzianum
(souche KRL-AG2)
Pommes, raisins, petits fruits, fraises, asperges, brocolis, choux,
carottes, concombres, courges, tomates, fines herbes, laitues et
plantes ornementales
1.6 Les Bacillus
1.6.1 Leur utilisation
Les bactéries du genre Bacillus sont hétérotrophes et en forme de bâtonnets. Ces bactéries à Gram positif ubiquistes sont naturellement présentes dans la rhizosphère (Nakano et Zuber, 1998). Reconnues comme généralement inoffensives pour l’être humain, elles sont grandement utilisées en agriculture, en médecine et en industrie. En raison de leur capacité à produire des endospores, elles peuvent coloniser différentes niches écologiques et survivent dans plusieurs milieux différents. Les endospores peuvent survivre à des températures, pH et pressions osmotiques extrêmes, en plus de résister à la radiation, aux rayons UV et à la dessiccation. Ces bactéries représentent donc d’excellents candidats pour la formulation, l’entreposage et la commercialisation d’agents de lutte biologique (Shafi et al., 2017). En industrie, les Bacillus sont exploités pour la production d’importants antibiotiques, probiotiques et enzymes. On attribue près de 60% de la production commerciale d’enzymes aux Bacillus spp. avec des revenus annuels de plus de 3 milliards de dollars américains répartis dans la production, entre autres, de textiles, breuvages et détergents (Islam et al., 2017). Par exemple, on utilise l’alpha-amylase produite par ces bactéries pour convertir l’amidon en fructose dans la préparation de boissons sucrées. Ces bactéries sont aussi utilisées en biorestauration des sols contaminés par des résidus de pesticides, de colorants et d’hydrocarbures polycycliques, en raison de leur production de biosurfactants et d’enzymes qui accélèrent la solubilisation de ces composés (Cubitto et al., 2004). Par exemple, B.
pumilus a la capacité de dégrader le chlorpyrifos, substance active de certains insecticides
(Lorsban® et Dursban®), pouvant avoir des effets neurotoxiques sur l’homme (Islam et al., 2017). En agriculture, les Bacillus sont appréciés pour leur capacité à fixer l’azote atmosphérique, à solubiliser le phosphore, le potassium et le zinc inorganiques dans le sol, à produire des phytohormones et des composés antibiotiques, et à stimuler la croissance des plantes, particulièrement la croissance des racines en favorisant l’absorption des nutriments et l’induction des défenses naturelles. Certains Bacillus produisent de l’acide indole 3-acétique (AIA), une phytohormone favorisant la formation des racines latérales et des poils absorbants chez la plante, et ainsi l’absorption des nutriments et de l’eau (Mia et al., 2010).
Certains Bacillus hydrolysent l’acide 1-aminocyloproprane-1-carboxylique (ACC), précurseur de l’éthylène, par la production d’une ACC désaminase (Islam et al., 2017). Ceci réduit donc la production d’éthylène, surtout chez les plantes exposées au stress, ce qui favorise la croissance et l’élongation des racines. Certains Bacillus peuvent mobiliser le phosphore organique par la production d’enzymes comme la phosphatase et solubiliser le phosphore inorganique par la production d’acides organiques comme l’acide oxalique. On considère que seulement 15% du phosphore provenant des fertilisants est utilisé par la plante (Panhwar et al., 2012). Les Bacillus permettent donc une meilleure disponibilité du phosphore pour la plante. Tous ces avantages aident la plante à survivre dans des milieux défavorables, comme les sols alcalins ou riches en métaux lourds, ou en période de sécheresse. Chez le riz, l’inoculation de B. pumilus aurait favorisé la production d’enzymes antioxydantes pour réduire l’accumulation de Na+ dans les feuilles (Bharti et al., 2013). La capacité de survie des plants serait améliorée lorsque les Bacillus sont combinés avec d’autres microorganismes comme les champignons mycorhiziens. Chez la laitue, la combinaison
Bacillus thuringiensis et mycorhizes a accru la résistance à la sécheresse, en réduisant les
dommages oxydatifs causés par les lipides et en améliorant le développement mycélien des champignons mycorhizateurs (Armada et al., 2015). En raison de leurs effets bénéfiques sur la croissance des plantes, les Bacillus sont reconnus comme des PGPR (Plant Growth
Promoting Rhizobacteria) rhizosphériques et endophytes (Kloepper et al., 1980). Au-delà de
leur effet PGPR, les Bacillus exercent un effet antagoniste sur plusieurs microorganismes phytopathogènes par action directe, compétition pour la niche écologique et production de métabolites secondaires toxiques, ou par action indirecte en stimulant les défenses naturelles de la plante. C’est pourquoi ils constituent d’excellents candidats comme agents de lutte biologique.
1.6.2 Les Bacillus et la lutte biologique
Plusieurs bactéries du genre Bacillus ont démontré leur efficacité à réprimer plusieurs agents phytopathogènes de la rhizosphère et de la phyllosphère. Parmi ces Bacillus, certaines souches sont homologuées au Canada comme biofongicides (Tableau 3). Les Bacillus exercent leur activité antagoniste envers les agents phytopathogènes par différents modes
d’action incluant la compétition, l’antibiose et la stimulation des défenses naturelles de la plante. Les Bacillus sont d’excellents compétiteurs en raison de leur capacité à coloniser rapidement la niche écologique. Par exemple, dans la rhizosphère, B. subtilis colonise rapidement les racines grâce à ses flagelles et à sa capacité de détoxifier les exsudats toxiques produits par les racines. De plus, B. subtilis produit des sidérophores qui lui confèrent un avantage compétitif pour sa nutrition en oligonutriments comme le fer. Les Bacillus produisent une variété de composés antibiotiques participant à leur activité antagoniste. Parmi ces composés, on retrouve des enzymes dégradant la paroi cellulaire (chitinase, cellulase, etc.), de l’acide cyanhydrique et principalement des peptides polycycliques, les lipopeptides. Parmi les lipopeptides connus, la mycosubtiline, la fengicyne et la polymyxine ont montré les effets fongistatiques et fongicides les plus forts contre B. cinerea en réduisant la germination des conidies et l’élongation des tubes germinatifs (Farace et al., 2015). Les
Bacillus peuvent aussi stimuler les défenses naturelles de la plante se traduisant par la
production de phytoalexines, de protéines PR comme les chitinases, ou de lignine venant renforcir la paroi végétale. Les bactéries produisent à cet effet des composés volatils ou des lipopeptides qui serviront d’éliciteurs. Plusieurs souches de Bacillus commercialisées, comme la souche B. subtilis QST 713 présente dans le Serenade®, ont démontré la capacité de réduire de 50% la sévérité de plusieurs maladies racinaires et des parties aériennes, comme la fonte des semis causée par Rhizoctonia solani, la moucheture bactérienne causée par
Pseudomonas syringae et le blanc poudreux causé par divers champignons de l’ordre des Erysiphales chez plusieurs plantes incluant la tomate et le concombre (Islam et al., 2017).
Une autre souche de B. subtilis, GA1, a démontré la capacité de protéger des pommes endommagées après leur récolte contre B. cinerea (Toure et al., 2004). Récemment, Salvatierra-Martinez et collaborateurs (2018) ont démontré l’efficacité de Bacillus
amyloliquefaciens à réduire la sévérité de la pourriture grise chez la tomate. En général, les Bacillus sont plus efficaces contre les agents pathogènes affectant les racines qu’envers ceux
affectant la partie aérienne des plants, et leur efficacité serait améliorée par l’application répétée préventive, particulièrement en serre, où les modes (vent, insecte, pluie) de dispersion des endospores des bactéries sont plus limités (Islam et al., 2017; Wei et al., 2016).
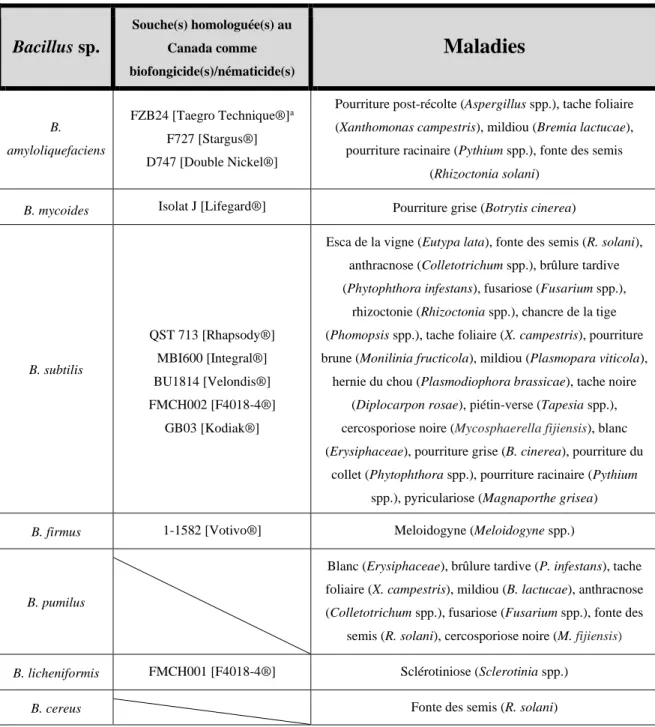
Tableau 3. Bactéries du genre Bacillus ayant démontré des effets prometteurs contre diverses
maladies des plantes.
Bacillus sp. Souche(s) homologuée(s) au Canada comme biofongicide(s)/nématicide(s)
Maladies
B. amyloliquefaciens FZB24 [Taegro Technique®]a F727 [Stargus®] D747 [Double Nickel®]Pourriture post-récolte (Aspergillus spp.), tache foliaire (Xanthomonas campestris), mildiou (Bremia lactucae), pourriture racinaire (Pythium spp.), fonte des semis
(Rhizoctonia solani)
B. mycoides Isolat J [Lifegard®] Pourriture grise (Botrytis cinerea)
B. subtilis QST 713 [Rhapsody®] MBI600 [Integral®] BU1814 [Velondis®] FMCH002 [F4018-4®] GB03 [Kodiak®]
Esca de la vigne (Eutypa lata), fonte des semis (R. solani), anthracnose (Colletotrichum spp.), brûlure tardive (Phytophthora infestans), fusariose (Fusarium spp.),
rhizoctonie (Rhizoctonia spp.), chancre de la tige (Phomopsis spp.), tache foliaire (X. campestris), pourriture brune (Monilinia fructicola), mildiou (Plasmopara viticola),
hernie du chou (Plasmodiophora brassicae), tache noire (Diplocarpon rosae), piétin-verse (Tapesia spp.), cercosporiose noire (Mycosphaerella fijiensis), blanc (Erysiphaceae), pourriture grise (B. cinerea), pourriture du
collet (Phytophthora spp.), pourriture racinaire (Pythium spp.), pyriculariose (Magnaporthe grisea)
B. firmus 1-1582 [Votivo®] Meloidogyne (Meloidogyne spp.)
B. pumilus
Blanc (Erysiphaceae), brûlure tardive (P. infestans), tache foliaire (X. campestris), mildiou (B. lactucae), anthracnose (Colletotrichum spp.), fusariose (Fusarium spp.), fonte des
semis (R. solani), cercosporiose noire (M. fijiensis) B. licheniformis FMCH001 [F4018-4®] Sclérotiniose (Sclerotinia spp.)
B. cereus Fonte des semis (R. solani)
1.7 Hypothèse et objectifs
Cette étude s’inscrit dans le cadre d’un programme de recherche destiné à évaluer le potentiel d’utilisation en horticulture, soit comme biostimulant ou agent de lutte biologique, des bactéries Bacillus pumilus souche PTB180 et Bacillus subtilis souche PTB185. Cette étude avait pour but de vérifier l’effet antagoniste in vitro et in planta (tomate et concombre) des souches PTB180 et PTB185, seules ou en combinaison, contre l’agent pathogène responsable de la pourriture grise, B. cinerea.
Dans le cadre de cette étude, l’hypothèse suivante a été vérifiée:
Les souches PTB180 et PT185, appliquées seules ou en mélange (1:1), inhibent la croissance de B. cinerea et réduisent le développement de la pourriture grise chez la tomate et le concombre de serre.
Les objectifs spécifiques de recherche étaient les suivants:
1) Évaluer in vitro l’activité antagoniste des souches PTB180 et PTB185, seules ou en mélange (1:1), sur la croissance mycélienne et la germination des conidies de B.
cinerea en milieux gélosés, sur tissus foliaires (tomate et concombre) et sur fruits de
tomate,
2) Évaluer la capacité des souches PTB180 et PTB185, seules ou en mélange (1:1), à survivre sur la phyllosphère de plants de tomate et de concombre cultivés en serre,
3) Évaluer l’efficacité des souches PTB180 et PTB185, seules ou en mélange (1:1), à réprimer le développement (incidence et sévérité) de la pourriture grise chez la
Chapitre 2: Manuscrit
Biofungicide potential of Bacillus pumilus and Bacillus subtilis against Botrytis cinerea on tomato and cucumber plants
M. Bouchard-Rochette1, H. Antoun2 and R.J. Tweddell1
1 Département de phytologie, Université Laval, Québec, QC G1V 0A6, Canada.
2 Département des sols et de génie agroalimentaire, Université Laval, Québec, QC G1V 0A6, Canada.
Corresponding author: Russell J. Tweddell, (email: russell.tweddell@fsaa.ulaval.ca).
Running title
Biofungicide potential of Bacillus pumilus and Bacillus subtilis
La soumission de cet article à la Revue canadienne de phytopathologie est prévue pour l’automne 2019
Résumé
La pourriture grise, causée par le champignon Botrytis cinerea Pers., est l’une des maladies les plus dommageables affectant les cultures horticoles. Les souches PTB180 de Bacillus
pumilus Meyer et Gottheil et PTB185 de Bacillus subtilis (Ehrenberg) Cohn ont démontré un
potentiel antifongique contre plusieurs champignons phytopathogènes du sol. Cette étude avaitpour objectifs (1) d’évaluer in vitro l’activité antagoniste contre B. cinerea des souches PTB180, PTB185 et d’un mélange (1:1) des deux souches¸ (2) d’évaluer la capacité des souches à survivre sur la phyllosphère de la tomate (Solanum lycopersicum L.) et du concombre (Cucumis sativus L.) et (3) d’évaluer leur efficacité à réprimer le développement de la pourriture grise sur des plants de tomate et concombre cultivés en serre. L'activité antagoniste de PTB180 et PTB185 a été évaluée en boîtes de Pétri sur géloses, sur tissus foliaires de tomate/concombre et sur fruits de tomate. Les deux souches ont inhibé fortement la croissance mycélienne et la germination des spores de B. cinerea sur géloses. Sur feuilles de tomate et sur disques foliaires de concombre, PTB185 et le mélange (1:1) des deux souches ont réduit significativement (p ≤ 0,01) la croissance mycélienne de B. cinerea par rapport au témoin. Sur fruits de tomate, le recouvrement mycélien de B. cinerea a été réduit significativement par la souche PTB180 seulement. Afin d'évaluer la survie de PTB180 et PTB185 sur la phyllosphère, des plants de tomate et de concombre ont été pulvérisés jusqu'à ruissellement avec une suspension (1 × 107 unités formatrices de colonies [UFC]/mL) de PTB180, PTB185 ou d'un mélange (1:1) des deux souches. Les populations de chaque souche ont été suivies au cours du temps sur les tissus foliaires. Les résultats obtenus montrent que les souches PTB survivent au moins 21 jours sur les plants de tomate et de concombre, avec un taux de survie variant de 43% à 100%. De plus, pratiquement aucune variation dans les proportions de chaque souche n'a été observée au fil du temps lorsque PTB180 et PTB185 étaient appliquées en mélange. L’application foliaire de PTB180, PTB185, et du le mélange (1:1) des deux souches a réduit significativement l’incidence et la sévérité de la pourriture grise sur les plants de tomate et de concombre, comparativement aux traitements témoins. PTB180 et PTB185 ont montré au cours de cette étude une forte activité antagoniste contre
B. cinerea, la capacité de survivre sur la phyllosphère de la tomate et du concombre et de
réprimer le développement de la pourriture grise, suggérant qu'elles pourraient éventuellement être utilisées comme agents de lutte biologique contre la pourriture grise.
Mots-clés: Activité antifongique; Bacillus pumilus; Bacillus subtilis; Botrytis cinerea; lutte biologique; pourriture grise.
Abstract
Gray mold, caused by the fungus Botrytis cinerea Pers., is one of the most damaging diseases affecting horticultural crops. Bacillus pumilus Meyer and Gottheil strain PTB180 and
Bacillus subtilis (Ehrenberg) Cohn strain PTB185 have shown antifungal activity against
several soilborne fungal pathogens. This study aims (1) to investigate in vitro the antagonistic activity of PTB180, PTB185, and a mix (1:1) of both strains against B. cinerea, (2) to evaluate the capacity of PTB180 and PTB185 to survive on tomato (Solanum lycopersicum L.) and cucumber (Cucumis sativus L.) phyllosphere, and (3) to evaluate their efficacy to control gray mold on tomato and cucumber plants grown in greenhouse. The antagonistic activity of PTB180 and PTB185 was evaluated in petri plates on agar, tomato/cucumber leaf tissues, and tomato fruits. Both strains were shown on agar to strongly inhibit B. cinerea mycelial growth and spore germination. On tomato leaves and cucumber leaf discs, PTB185 and mix (1:1) of both strains significantly (p ≤ 0.01) reduced B. cinerea mycelial growth as compared to the control while only PTB180 significantly reduced B. cinerea coverage of tomato fruits. In order to evaluate the survival of PTB strains on tomato and cucumber phyllosphere, tomato and cucumber plants were sprayed until runoff with a suspension (1×107 colony forming units [CFU]/mL) of either PTB180, PTB185 or a mix (1:1) of both strains and populations of each strain were monitored over time. PTB strains were shown to survive for at least 21 days on both tomato and cucumber leaves with a survival rate varying from 43% to 100%. Moreover, almost no variation in the proportions of each strain was observed over time when PTB180 and PTB185 were applied as a mix. Foliar application of PTB180, PTB185, and mix (1:1) of both strains significantly reduced gray mold incidence and severity on tomato and cucumber plants as compared to the control.PTB180 and PTB185 showed in this study strong antagonistic activity against B. cinerea, the capacity to survive on tomato and cucumber phyllosphere, and to repress gray mold development, suggesting that they could eventually find applications as biocontrol agents against gray mold.
Keywords: antifungal activity; Bacillus pumilus; Bacillus subtilis; biocontrol; Botrytis
Introduction
In 2017, greenhouse production in Canada has generated up to 1.4 billion dollars (farm gate value) through the production of nearly 600,340 metric tons of greenhouse vegetables (Statistique Canada, 2017). Tomato (Solanum lycopersicum L.) and cucumber (Cucumis
sativus L.) represent the first (38%) and the third (26%) most widely grown greenhouse
vegetables in Canada, respectively.
Greenhouse tomato and cucumber productions are affected by several diseases including gray mold (Botrytis cinerea Pers.). Gray mold is considered the world's second most important disease in agriculture, with losses of more than 10 billion dollars (Dean et al., 2012). On tomato and cucumber, the fungus infects leaves, stems, and fruits. Disease symptoms appear as a fuzzy gray mycelium and chlorosis resulting in the death of the infected tissues (Elad et al., 2016). In organic greenhouse production, several practices are used to control the disease including the elimination of dead and moribund plants, the reduction of relative humidity under 80%, and the sterilization of maintenance equipment along with the use of biofungicides. Several biofungicides, that can be used in organic greenhouse tomato and/or cucumber productions, are registered in Canada to control gray mold: Prestop (Gliocladium catenulatum), Rootshield (Trichoderma harzianum), Double Nickel (Bacillus amyloliquefaciens), Rhapsody/Cease (Bacillus subtilis QST 713), Serifel (B. amyloliquefaciens MBI600), Regalia Maxx (Reynoutria sachalinensis), and Timorex Gold (Melaleuca oil) (Santé Canada, 2019). Biological control products are gaining popularity because of their environmental friendliness and ease of use, but are strongly criticized for their inconsistency in effectiveness and lack of survival on the applied organs (Wei et al., 2016).
Species of the genus Bacillus are ubiquitous Gram-positive bacteria mostly found in the rhizosphere (Xu et al., 2016). They are recognized as excellent biocontrol agents because of their capacity to compete for nutrients and space, to produce toxic secondary metabolites, to stimulate plant natural defences, and to produce endospores enabling to survive adverse conditions (Islam et al., 2017). Recently, Bacillus pumilus Meyer and Gottheil strain PTB180 and B. subtilis (Ehrenberg) Cohn strain PTB185, both isolated from rhizosphere, have shown
in vitro strong antagonistic activity against several soilborne pathogens. As part of ongoing
(i) the in vitro antagonistic activity of PTB180 and PTB185 against B. cinerea on agar, cucumber and tomato leaf tissues, and tomato fruits, (ii) the survival of the strains on the phyllosphere of tomato and cucumber plants, and (iii) the effect of the strains on the development of gray mold when applied on tomato and cucumber plants grown in greenhouse.
Materials and methods
Bacteria
Bacillus pumilus strain PTB180 and B. subtilis strain PTB185 were provided by Premier
Tech (Rivière-du-Loup, Quebec, Quebec, Canada) as spore suspensions [1×109 colony forming units (CFU)/mL] stored at 4°C. Before each test, the concentrations of the suspensions were verified by plate counting on nutrient agar (NA; Oxoid, Hampshire, United Kingdom).
Botrytis cinerea
One isolate (B. cinerea MAPAQ) was kindly provided by the Laboratoire d’expertise et de diagnostic en phytoprotection (MAPAQ, Quebec, Canada). The other isolate, B. cinerea 6.9, was kindly provided by Premier Tech. The fungus was cultivated at 21oC on either potato dextrose agar (PDA; Becton, Dickinson and Company, Franklin Lakes, New Jersey, United States) or V8 agar [200 mL, non clarified V8 (Campbell Soup Company, Camden, New Jersey, United States); 800 mL, distilled water; 15 g, agar (Becton, Dickinson and Company); 2g, CaCO3(Ward’s Science, St. Catharines, Ontario, Canada)].
For the preparation of conidial suspension, five PDA discs (8-mm diameter) of actively growing mycelium of B. cinerea were cut with a cork borer from the edge of a one-week-old culture. The discs were transferred to a 250 mL Erlenmeyer flask containing 100 mL of potato dextrose broth (PDB; Becton, Dickinson and Company). The flask was incubated at room temperature on a rotary shaker (160 rpm) for one week. The culture was then homogenized with a sterile food processor and filtered with a sterile Buchner funnel (1.3 mm). Suspension was then adjusted to a concentration of 1×103 or 1×106 conidia/mL with sterile distilled water, using a hemocytometer.
Effect of PTB180 and PTB185 on B. cinerea mycelial growth and conidial germination on agar (double agar layer technique)
A first layer (20 mL) of tryptic soy agar 10% (TSA; Becton, Dickinson and Company) containing 1×102 to 1×106 CFU/mL of either PTB180, PTB185 or no bacteria added (control) was poured in Petri dishes. Bacteria were added once agar was cooled down at 48oC. Petri dishes were then incubated at room temperature in obscurity for 48 hours. A second layer (10 mL) of either TSA 10% (for mycelial growth) or Rose Bengal Agar (Becton, Dickinson and Company) (for conidial germination) was poured in the Petri dishes. After 24 hours at 4oC, Petri dishes were inoculated with either an 8 mm-diameter PDA disc covered with actively growing mycelium or a conidial suspension (1×103 conidia/mL; 100 μl) of B. cinerea 6.9. After an incubation period (4-7 days) in the dark at 24oC, B. cinerea radial growth or conidial germination were evaluated and expressed as mycelial growth/conidial germination inhibition using the equation: {[mycelial growth or number of germinated conidia (control) - mycelial growth or number of germinated conidia (bacteria treatment)]/ mycelial growth or number of germinated conidia (control)}×100. A completely randomized experimental design with six (mycelial growth) or seven (conidial germination) replicates was used; a Petri dish being the experimental unit. The experiment for conidia germination was repeated twice; data of both experiments were combined by adding a blocking factor to account for inter-experimental variations.
Effect of PTB180 and PTB185 on the development of B. cinerea on leaf tissues
Tomato (cv. Microtom) and cucumber (cv. Marketmore 70) plants were grown in 2 L pots filled with Pro-Mix (Premier Tech) as a substrate in a greenhouse at 22oC (60% relative humidity; photoperiod of 16 hours). Plants were fertilized weekly with 150 mL of 20-20-20 (N-P-K). Tomato leaves sampled from 4-week-old plants were placed in Petri dishes containing a moistened filter paper (Whatman grade 2). Cucumber leaf discs (5-cm diameter) were cut from leaves of 2-week-old plants with a laboratory punch and placed in Petri dishes containing sterile 10% water agar. Tomato leaves and cucumber leaf discs were then sprayed (1 mL on each leaf and disc) with sterile water (control), Rhapsody® (B. subtilis strain QST 713; 1×107 CFU/mL was applied as recommended by the manufacturer; Bayer, Leverkusen, Germany), or a suspension (1×107 CFU/mL) of either PTB180, PTB185 or a mix (1:1, v:v)
of both strains. One hour following the application of the treatments, tomato leaves or cucumber leaf discs were sprayed (100 µL on each leaf and disc) with a conidial suspension (1×106 conidia/mL) of B. cinerea MAPAQ and Petri dishes were incubated in the dark at room temperature. After an incubation period of 5-7 days, the percentage of leaf/leaf disc area covered by B. cinerea was evaluated using the equation: (leaf area covered with B.
cinerea/leaf area)×100. Experiments were conducted according to a completely randomized
design with six (tomato) and eight (cucumber) replicates; tomato leaf/cucumber leaf disc being the experimental unit. Experiments with tomato leaves and cucumber leaf discs were carried out separately. Each experiment was repeated three times. For both tomato and cucumber, data of the three experiments were combined by adding a blocking factor to account for inter-experimental variations.
Effect of PTB180 and PTB185 on the development of B. cinerea on postharvest tomato fruits
Tomato plants (cv. Microtom) were grown as previously described. Eight weeks after seeding, tomato fruits were harvested at their unripe stage in order to delay B. cinerea infection and facilitate measurement of fungal growth (Mari et al., 1996). Fruits were soaked in 70% ethanol (2 minutes), rinsed with sterile distilled water twice, and kept to dry in a laminar flow hood. Fruits were then soaked (2 minutes) in either sterile distilled water (control), a suspension (1×107 CFU/mL) of PTB180, PTB185, a mix (1:1 v:v) of both strains, or Rhapsody®. Fruits were kept in a laminar flow hood to dry for 1 hour. A 2-mm depth lesion was then made near the peduncle with a sterile paperclip (1-mm diameter) and inoculated with 20 µl of B. cinerea suspension (1×106 conidia/mL).Fruits were placed in 15-cm diameter Petri dishes (five fruits per Petri dish) containing a cotton moistened with 10 mL sterile distilled water. Dishes were then closed with a transparent plastic bag and incubated for 7 days at 21oC (photoperiod of 16 hours). Following incubation, mean radial growth of B. cinerea at the surface of the fruits from the lesion point was measured and expressed as percentage of coverage of tomato fruits as per the following equation: (mean radial growth of B. cinerea/mean diameter of the tomato fruit)×100. A completely randomized experimental design with 15 replicates was used, where a tomato fruit was the experimental unit.
Survival of PTB180 and PTB185 on the phyllosphere
Tomato (cv. Microtom) and cucumber (cv. Marketmore 70) plants were grown as previously described in greenhouse. After 4 weeks (tomato) and 3 weeks (cucumber), plants were sprayed (15 mL) on both sides of the leaves with water (control) or a suspension (1×107 CFU/mL) of either PTB180, PTB185, or a mixture (1:1, v:v) of both strains. They were then grown in greenhouse for an additional 28 days (24°C day/20°C night for tomato and 22°C day/18°C night for cucumber; 60% relative humidity; photoperiod of 16 hours). The first three leaves from the base of each tomato or cucumber plant were collected 1 hour, 7, 14, and 21 days following application of PTB strains. Five discs (1.8-cm diameter) were randomly cut from the leaves with a sterile cork borer and homogenized in sterile distilled water (10 mL) using a sterile food processor mixer. The suspensions were submitted to serial dilutions, heated (55ºC, 15 minutes) to isolate the Bacillus populations of the phyllosphere, and then plated on NA. After an incubation period of 24 hours at 37°C, the number of CFU was determined. The populations of PTB180 and PTB185 were expressed as CFU/g of fresh leaf. After 21 days, shoot of each plant was then cut at the pot surface. Aerial parts and roots (previously washed with water) were dried at 50°C for 4 days and dry weights of aerial parts and roots were measured. The experimental design used was a randomized complete block with four replicates. Experiments were repeated twice. Data of both experiments were combined.
Effect of PTB180 and PTB185 on gray mold incidence and severity on tomato and cucumber plants grown in greenhouse
Tomato (cv. Microtom) seeds were sown in 250 mL well-planting trays and transplanted after emergence into 1 L pots filled with Pro-Mix. Plants were grown in greenhouse at 22oC and weekly fertilized with 100 mL of 20-20-20. Except stated otherwise, plants were submitted to 60% relative humidity and to a photoperiod of 16 hours. After 4 weeks, plants were grown at diurnal temperature of 24°C and nocturnal temperature of 20°C. Each 4-week-old plant was sprayed with 15 mL of either water (control), a suspension (1×107 CFU/mL) of strain PTB180, PTB185, a mix (1:1, v:v) of both strains or Rhapsody® (applied as recommended by the manufacturer). After 2 days, the treatments were reapplied. Three days following the
second application of the treatments, each plant was sprayed with 5 mL of a suspension (1×106 conidia/mL) of B. cinerea three times (4-hour interval during the same day) to avoid dripping and kept under plastic dome for 3 days (95% relative humidity in the greenhouse) to favor establishment of the pathogen. Plastic domes were then removed; relative humidity in the greenhouse was maintained to 95% for an additional 4 days. After 7, 10, and 14 days post-inoculation (dpi) of the pathogen, incidence and severity of the disease were measured. The incidence was determined on each plant as follows: [number of leaves showing symptoms of gray mold/total number of leaves]×100. Severity was measured on each leaf according to a rating scale ranging from 0 to 4, where 0 = no symptom, 1 = minor necrotic lesions (1 to 25% of leaf area), 2 = important necrotic lesions (26 to 50% of leaf area), 3 = important necrotic lesions with some mycelium (51 to 75% of leaf area), and 4 = dead leaf covered with mycelium clearly visible (76 to 100% of leaf area). For each plant, all leaves were scored (0, 1, 2, 3, 4) and then disease severity index was determined using the following formula: {∑ni=0 (Ln × n)/4 × ∑ni=0(Ln)} × 100, where n corresponds to the rating scale (0, 1, 2, 3, 4) and Ln is the number of leaf corresponding to the rating scale n (You et al., 2016). At the end of the trial (14 dpi of the pathogen), each plant was cut at the pot surface, dried at 50°C for 2-3 days, and dry weight of aerial parts was measured. The experimental design was a completely randomized block with eight replicates; tomato plant being the experimental unit. The experiment was repeated three times. Data of the three experiments were combined by adding a blocking factor to account for inter-experimental variations.
Cucumber (cv. Marketmore 70) seeds were sown in 250 mL well-planting trays and transplanted after emergence into 1 L pots filled with either Pro-Mix or Pro-Mix amended with PTB185 (1×105 UFC/g of substrate). Plants were grown in greenhouse as previously described for tomato. Each 2-week-old plant grown in Pro-Mix was sprayed with 15 mL of either water (control), a suspension (1×107 CFU/mL) of PTB180, PTB185, a mix (1:1, v:v) of both strains or Rhapsody® (applied as recommended by the manufacturer). Plants grown in Pro-Mix amended with PTB185 were sprayed with water. After 2 days, the treatments were reapplied. Three days following the second application of the treatments, each plant was sprayed with 15 mL of a suspension (1×106 conidia/mL) of B. cinerea three times (4-hour interval during the same day).After 7 dpi of the pathogen, disease incidence and severity and dry weight of aerial parts were measured as previously described for tomato. The
![Figure 7. Proportion of PTB180 (■) and PTB185 (□) populations [when applied as a mix (1:1)] on tomato leaves as a function of time](https://thumb-eu.123doks.com/thumbv2/123doknet/3146100.89580/49.918.161.758.100.428/figure-proportion-ptb-populations-applied-tomato-leaves-function.webp)
![Figure 10. Proportion of PTB180 (■) and PTB185 (□) populations [when applied as a mix (1:1)] on cucumber leaves as a function of time](https://thumb-eu.123doks.com/thumbv2/123doknet/3146100.89580/50.918.187.730.654.976/figure-proportion-ptb-populations-applied-cucumber-leaves-function.webp)

