Niveaux d'activité et de participation des patients
post-AVC à Kinshasa
Mémoire
Claudel Rutare Mwaka
Maîtrise en sciences cliniques et biomédicales - avec mémoire
Maître ès sciences (M. Sc.)
Niveaux d’activité et de participation des patients
post-AVC à Kinshasa
Mémoire
Claudel Rutare Mwaka
Sous la direction de :
Charles Sèbiyo Batcho, directeur de recherche
Kadija Perreault, codirectrice de recherche
Résumé
L’accident vasculaire cérébral (AVC) est la cause majeure de la dépendance de l’adulte dans les pays à faible et moyens revenus, y compris la République Démocratique du Congo (DRC). Il y entraine des dépenses majeures pour sa prise en charge en réadaptation alors que les personnes qui en sont victimes manquent souvent des moyens pour supporter les soins de réadaptation. Cette situation peut contribuer à limiter l’accès aux soins de réadaptation à moyen et long termes, avec des répercussions sur la récupération fonctionnelle en termes d’activités de la vie quotidienne (AVQ), de capacité de marcher chez soi ou en communauté, et de participation.
De nombreuses études réalisées dans des contextes divers ont fourni des portraits sur les niveaux de réalisation des AVQ et/ou de la marche chez les patients post-AVC. D’autres études se sont focalisées sur la participation de ces patients. Mais à ce jour, à notre connaissance, rien de pareil n’a été conduit dans le contexte de la RDC et de Kinshasa en particulier. C’est ainsi que l’étude que nous avons menée à Kinshasa, capitale de la RDC avait comme buts de (1) décrire les niveaux d’activité et de participation des patients post-AVC vivant à Kinshasa et (2) comparer ces niveaux par rapport aux catégories de vitesse de marche de ces patients.
Les résultats ont montré que ces patients, malgré le revenu mensuel insuffisant, voire même inexistant, et le manque d’assurance maladie pour nombreux d’entre eux, avaient généralement un bon niveau d’activité. Cependant, pris individuellement, la plupart de ces patients présentaient encore des limitations à accomplir des activités en communauté. Ils nécessitent donc le soutien de leurs familles respectives et une attention particulière de la part des soignants pour qu’ils progressent, dans la mesure du possible, en termes d’activité et de participation.
Abstract
Stroke is the major cause of adult dependence in low-and middle-income countries (LMICs), including the Democratic Republic of Congo (DRC). It leads to enormous expenditure for rehabilitation care, while stroke survivors in this country often experience financial difficulties for supporting rehabilitation care. This situation may contribute to limiting access to mild-and long-term rehabilitation care, with repercussions on functional recovery in terms of activities of daily life (ADLs), walking ability at home or in the community, and participation. Many studies carried out in various contexts have provided portraits on the levels of ADLs and/or walking ability after stroke. Other studies have focused on poststroke participation. Given that, to our knowledge, there is no available study in DRC and Kinshasa particularly, neither on activity and participation nor on walking ability after stroke, our study aimed ) to (1) describe the levels of activity and participation of post-stroke patients living in Kinshasa and (2) compare these levels across subgroup-based walking speed.
The results showed that these patients, despite insufficient or non-existent monthly income, and the lack of health insurance for many of them, generally had a good level of activity. However, taken individually, most of these patients still had limitations in performing community activities. They therefore require the support of their respective families and special attention on the part of caregivers to progress, as far as possible, in terms of activity and participation.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vii
Liste des tableaux ... viii
Liste des acronymes ... ix
Remerciements ... x
Avant-propos ... xi
Introduction ... 1
Chapitre 1 Généralités sur l’accident vasculaire cérébral ... 3
1.1 Accident vasculaire cérébral ... 3
1.1.1 Définition de l’AVC ... 3
1.1.2 Types d’AVC ... 3
1.1.3 Facteurs de risque de l’AVC... 4
Facteurs de risque modifiables et leur association avec les types d’AVC ... 4
Hypertension artérielle ... 4
Consommation du tabac ... 4
Diabète sucré ... 5
Taux de cholestérol élevé ... 5
Inactivité physique et obésité ... 5
Fibrillation auriculaire ou autre maladie cardiaque ... 5
Consommation excessive d'alcool ... 6
Consommation de drogues illégales ... 6
1.1.4 Épidémiologie de l’AVC ... 6
Prévalence, incidence, mortalité et morbidité de l’AVC ... 7
1.2 Modèle conceptuel de la classification du fonctionnement, du handicap et de la santé (CIF) ... 8
1.2.1 Déficiences liées à l’AVC ... 10
1.2.2 Niveaux d’activité et de participation après un AVC... 10
1.3.1 Mécanismes neurophysiologiques de la récupération après un AVC ... 11
1.3.2 Réadaptation après un AVC ... 12
1.3.2.1 Évaluations et phases de réadaptation post-AVC... 13
Évaluations post-AVC ... 13
Phases de réadaptation post-AVC ... 15
Phase hyperaiguë ... 15
Phase aiguë ... 15
Phase subaiguë ... 16
Phase post subaiguë ... 16
1.3.2.2 Réadaptation après un AVC dans les pays à faibles et moyens revenus (PFMR) ... 16
1.4 Objectifs ... 17
1.5 Hypothèses ... 17
Chapitre 2 Méthodologie générale ...19
2.1 Devis et participants ... 19
2.2 Critères d’inclusion et d’exclusion ... 19
2.2.1 Critères d’inclusion ... 19
2.2.2 Critères d’exclusion ... 19
2.3 Outils de mesure utilisés ... 20
2.3.1 SIAS ... 20
2.3.2 ACTIVLIM-Stroke ... 20
2.3.3 10MWT ... 21
2.3.4 6MWT ... 21
2.3.5 RNLI ... 22
2.4 Procédures de recrutement et de collecte des données ... 22
2.5 Analyses statistiques ... 23
Chapitre 3 Activity and participation, and walking performance in
stroke survivors: a cross sectional study ...24
Résumé ... 24 Contexte ... 24 Méthodes ... 24 Résultats ... 25 Conclusion ... 25 Abstract ... 25 Background ... 25
Methods ... 25
Results ... 26
Conclusion ... 26
3.1 Introduction... 26
3.2 Methods ... 27
3.2.1 Design and subjects ... 27
3.2.2 Study variables and measurement instruments... 28
3.2.3 Data collection procedures ... 29
3.2.4 Statistical analysis ... 29
3.3 Results ... 29
3.4 Discussion ... 32
Strengths and limitations ... 34
3.5 Conclusion ... 34
3.6 Acknowledgements ... 34
3.7 Declaration of conflicting interests... 34
Chapitre 4 Discussion générale ...35
4.1 Discussion sur les principaux résultats ... 35
4.2 Autres résultats ... 37 4.3 Retombées de l’étude ... 37 4.4 Limites de l’étude ... 38 4.5 Perspectives ... 38
Conclusion ...39
Bibliographie ...40
Annexe A Fiche de collecte des données sociodémographiques et
cliniques ...48
Liste des figures
Chapitre 1
Figure 1.1 : Classification internationale du fonctionnement, du handicap et de la santé………9 Figure 1.2 : Phases de réadaptation post-AVC………..15
Chapitre 3
Liste des tableaux
Chapitre 1
Tableau 1.1 : Quelques outils de mesure de déficiences, d’activité et de participation………14
Chapitre 3
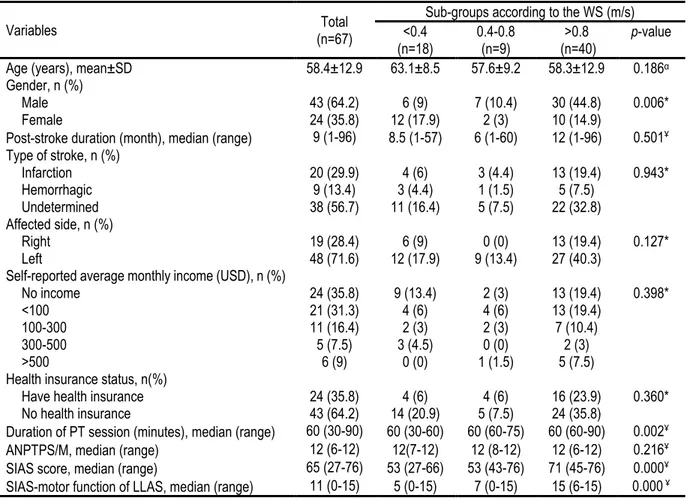
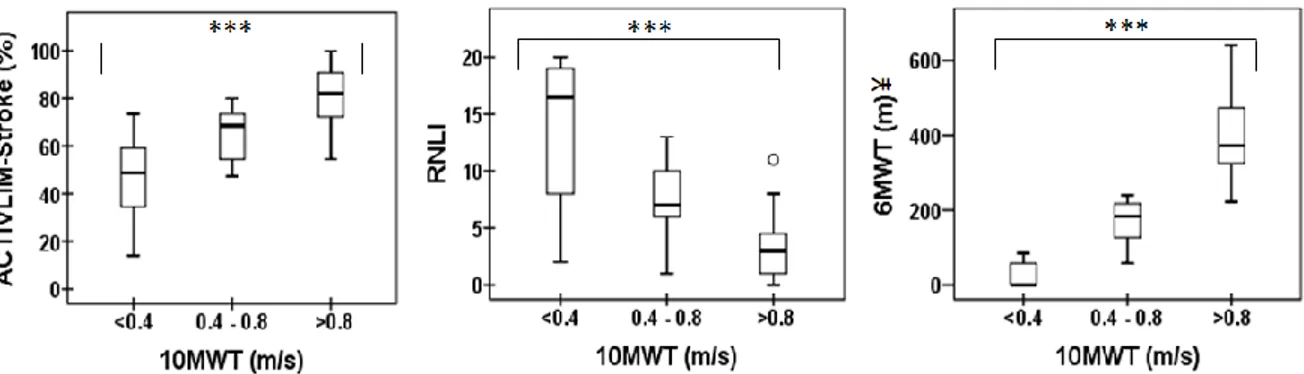
Tableau 3.1: Sociodemographic and clinical characteristic of participants stratified by walking speed………...30 Tableau 3.2: Activity and participation outcomes of all participants………31 Tableau 3.3: Correlation between 10MWT and ACTIVLIM-Stroke, RNLI and………32
Liste des acronymes
2MWT 2-minute Walking Test 6MWT 6-minute Walking Test 10MWT 10-meter Walking Test 12MWT 12-minute Walking Test ASS Afrique subsaharienne AVC Accident vasculaire cérébral AVQ Activités de la vie quotidienne BI Barthel Index
CIDIH Classification internationale des déficiences, incapacités et handicap CIF Classification internationale du fonctionnement, du handicap et de la santé CRHP Centre de rééducation pour handicapés physiques
ESP-KIN École de santé publique de Kinshasa
HMRCK Hôpital militaire de référence de camp Kokolo IADL Instrumented Activities of Daily Life
MoCa Montreal cognitive assessment OMS Organisation mondiale de la santé PFMR Pays à faibles et moyens revenus PT Physiotherapy
RDC République Démocratique du Congo RNLI Reintegration to Normal Living Index SIAS Stroke Impairment Assessment Set SIDA Syndrome d’immunodéficience acquise TENS Transcutaneous Electrical Nerve Stimulation VIH Virus d’immunodéficience humaine
Remerciements
La rédaction de ce mémoire est le couronnement de ma formation de maitrise avec recherche en sciences cliniques et biomédicales à l’Université Laval. Il a été rendu possible grâce aux efforts de :
Charles Batcho, mon directeur de recherche que je remercie pour avoir accepté de superviser mes travaux de recherche tout au long de mon cheminement académique. Tes interventions et conseils dans le cadre de la recherche m’ont été d’une importance incommensurable. Ce fut à la fois un plaisir et un honneur de réaliser mes travaux de recherche sous ta supervision.
Kadija Perreault, ma co-directrice de recherche que j’aimerais aussi remercier pour la supervision de mes travaux de recherche. Tes questions et commentaires m’ont permis de renforcer mes compétences dans le domaine de la recherche et surtout d’aiguiser mon sens d’analyse critique.
Pamphyle Abedi. Permets que je te remercie pour avoir accepté de collaborer à la recherche menée à Kinshasa. Ton apport sur le terrain de la recherche a été inestimable. Daigne accepter aussi mes remerciements pour ton soutien moral.
J’aimerais remercier aussi le Programme Canadien des Bourses de la Francophonie pour avoir financé ma formation et mes travaux de recherche.
Le Centre Interdisciplinaire de Recherche en Réadaptation et Intégration Sociale m’a aussi soutenu significativement dans mes travaux de recherche en m’offrant un bon cadre de travail et en facilitant mon intégration dans la communauté estudiantine. Je l’en remercie de tout cœur.
Enfin, je voudrais adresser également mes remerciements à Armelle Ngueleu et Aristide Honado, mes camarades avec qui j’ai passé de très bons moments de joie, de bonheur et de partage scientifique au Centre interdisciplinaire de recherche en réadaptation et intégration sociale.
A vous tous, je vous demande de trouver, ici, à travers ces quelques lignes, l’expression de ma plus profonde gratitude.
Avant-propos
Ce mémoire comporte en son sein un manuscrit rédigé en anglais qui reprend les résultats de mes travaux de recherche réalisés sous la direction de Charles Batcho et la codirection de Kadija Perreault, avec la collaboration de Pamphyle Abedi et de Willy Masuga. Ce manuscrit est présenté au chapitre 3.
Titre: Activity and participation and waking performance in stroke survivors: a cross sectional study. Auteurs: Mwaka C.R, MSc 1, 2,3, Perreault K, PhD1,2, Abedi P.M, PhD3, Masuga W.M4, Batcho C.S, PhD1,2
Affiliations: 1Faculté de médecine, Université Laval, Québec, Canada ; 2Centre interdisciplinaire de recherche
en réadaptation et intégration sociale (CIRRIS), Québec, Canada, Institut de réadaptation en déficience physique de Québec (IRDPQ), Centre intégré universitaire de santé et de services sociaux de la Capitale Nationale (CIUSSS-CN), Québec, Canada; 3Institut Supérieur des Techniques Médicales de Kinshasa
(ISTM-KIN), Kinshasa, Democratic Republic of Congo; 4Programme de réadaptation à base communautaire, Kinshasa,
Democratic Republic of Congo.
Contribution de l’étudiant : élaboration du projet de recherche, réalisation de la collecte et des analyses de
données, interprétation des résultats et rédaction du manuscrit sous la supervision du directeur et de la codirectrice de recherche.
Introduction
L’accident vasculaire cérébral (AVC) est un problème de santé publique majeur pouvant entrainer une mortalité précoce et une dépendance chez l’adulte surtout dans les pays à faible et moyen revenus (PFMR)1. Il a été
identifié comme étant souvent responsable des pertes d'emploi2. Il entraine aussi d’énormes dépenses pour les
soins, particulièrement dans les PFMR alors que la majorité des personnes n’y sont pas couvertes par une assurance maladie3,4.
L’AVC n’est pas seulement une affection du cerveau, mais il est aussi une entité pathologique qui affecte l’individu en tant que personne et être social. Son impact est dévastateur sur l’état de santé de la personne qui en est victime, sa famille et la société dans laquelle elle mène sa vie5. En effet, comme la plupart des maladies
non transmissibles, l’AVC entraine des conséquences énormes au niveau de ménages et au niveau national6.
Au niveau du ménage, il conduit à des dépenses importantes pour sa prise en charge, pouvant avoir un impact négatif sur le quotidien de celui-ci, particulièrement en Afrique subsaharienne (ASS)7. A l’échelle nationale, il
peut entrainer la perte de productivité résultant de l’absentéisme et de l’incapacité des patients à travailler avec un effet direct sur le niveau de revenu national6.
Sa prise en charge en réadaptation dans une équipe multidisciplinaire vise une récupération fonctionnelle en termes de participation dans les activités communautaires8. Or, à Kinshasa, capitale de la République
Démocratique du Congo (RDC), cette prise en charge ne se limite qu’à des programmes de traitement médical et à quelques séances de physiothérapie comme dans les pays voisins9. Les soins de réadaptation étant
couteux en RDC comme dans la région de l’ASS7, la plupart des patients post-AVC vivant à Kinshasa ont un
accès limité aux soins de réadaptation de qualité à moyen et long termes. Toutes ces difficultés peuvent affecter leur récupération en termes d’accomplissement des activités de la vie quotidienne (AVQ), de leur capacité à marcher en communauté et de leur participation.
Plusieurs études réalisées dans des contextes variés ont essayé de décrire les niveaux d’activité dans ses composantes des AVQ et de mobilité chez les patients post-AVC10-14 . D’autres études se sont focalisées sur la
participation post-AVC15-17. D’autres encore18,19 ont élaboré des catégories de marche en communauté basée
sur la vitesse de marche de ces patients afin de les décrire. Une autre étude20 a cherché à vérifier si la
progression vers une autre catégorie de marche en communauté basée sur la vitesse de marche était associée à l’amélioration des AVQ, de la mobilité et de la participation. Pourtant, à notre connaissance, à ce jour, aucune
patients post-AVC ni sur leur capacité de marcher en communauté. Dans le cadre de ce travail, nous avons voulu investiguer ces domaines définis dans le cadre de la classification internationale du fonctionnement, du handicap et de la santé (CIF) dans le contexte de la RDC, afin de fournir des données sur les patients post-AVC vivant à Kinshasa. Dans un contexte où les évaluations ne sont pas réalisées systématiquement, les résultats de cette étude contribueront à l’amélioration du suivi de ces patients.
Ce travail comprend quatre chapitres dont le premier présente des informations générales sur l’AVC et sa prise en charge en réadaptation. Le deuxième chapitre porte sur l’aspect méthodologique de la recherche alors que le troisième présente les résultats de la recherche. Enfin, le quatrième chapitre boucle ce mémoire par une discussion générale des résultats.
Chapitre 1
Généralités sur l’accident vasculaire cérébral
1.1 Accident vasculaire cérébral
1.1.1 Définition de l’AVC
Selon l’organisation mondiale de la santé (OMS), l’AVC est un déficit brusque d’une fonction cérébrale focale, parfois même globale sans cause apparente autre qu'une origine vasculaire, entrainant des symptômes qui persistent au-delà de 24 heures ou la mort21. Au cours d'un AVC, les cellules nerveuses qui sont privées
d’oxygène et des nutriments notamment le glucide, le protide et le lipide, cessent de fonctionner en quelques secondes et subissent une nécrose après seulement 2 minutes22. Cela conduit à une altération de la fonction
sensorielle et motrice dans une moitié du corps 23,24, et souvent aussi de la fonction cognitive25.
1.1.2 Types d’AVC
Deux types d’AVC peuvent être identifiés26: (1) AVC ischémique, par processus d’infarctus d’une artère
cérébrale ou (2) AVC hémorragique, par rupture d’une artère à la suite d’une hypertension spontanée, d’une pathologie artérielle ou d’un anévrisme cérébral27.
Les proportions de survenue de ces deux types d’AVC varient selon les études et les registres hospitaliers. Globalement, les proportions d’AVC ischémique varient de 80 à 87% des cas25,27,28. Dans ce type d’AVC , le
processus athérothromboembolique est en cause dans 50% des cas, les maladies de petits vaisseaux intracrâniens dans 25 %, les embolies d’origine cardiaque dans 20% des cas et les causes rares dans 5% des cas 27. Aarli et coll.27 rapportent que 80% des AVC qui se produisent dans les pays à revenu élevé sont
imputables à une ischémie cérébrale, tandis que les 20% restants sont attribués à une hémorragie intracérébrale ou sous-arachnoïdienne. Par contre, Owolabi et coll.29 rapportent, dans leur étude sur la charge globale de
l’AVC en Afrique, des proportions d’accidents hémorragiques relativement élevées, variant de 29 à 57%. Toutefois, avec le changement de style vie, l’adoption des habitudes alimentaires occidentales surtout dans les grandes villes africaines, une inversion des tendances est en train de se produire en Afrique, en termes des proportions des AVC ischémiques par rapport aux AVC hémorragiques. Selon Boehme et coll.30, les proportions
1.1.3 Facteurs de risque de l’AVC
Les facteurs de risque se catégorisent (i) en facteurs modifiables comprenant l’hypertension artérielle, la fibrillation auriculaire, le tabagisme, le diabète sucré, la consommation excessive d’alcool, la sédentarité, l’hypercholestérolémie et l’excès pondéral, et (ii) en facteurs non modifiables regroupant l’âge, le sexe, la race-ethnie et la génétique26,30. De ces deux catégories de facteurs d’AVC, ce sont les facteurs modifiables qui
intéressent le plus les professionnels de la santé, les chercheurs et les décideurs politiques puisqu’ils offrent la possibilité de prendre des mesures de santé publique appropriées pour prévenir l’AVC et limiter ainsi sa charge en termes de mortalité et de morbidité, particulièrement dans les PFMR.
Facteurs de risque modifiables et leur association avec les types d’AVC
Hypertension artérielle
Plusieurs études sur la charge globale de l’AVC dans le monde rapportent que l’hypertension est le facteur de risque le plus important d’AVC et constitue donc sa principale cause26,27,31,32. L’hypertension intervient à hauteur
de 38,8 à 59,6% dans tous les types d’AVC (ischémique et hémorragique)26,30. Cependant, bien que
l’hypertension intervienne dans les deux types d’AVC, elle contribue de manière plus significative dans la survenue des AVC hémorragiques29. En Afrique, presque 98% de patients post-AVC présentent de
l’hypertension artérielle29. Ceci laisse croire que peu d’efforts sont fournis dans cette région du monde pour
sensibiliser les populations sur les effets de l’hypertension artérielle et pour la traiter afin de prévenir la survenue et la récidive des AVC.
Consommation du tabac
La consommation du tabac endommage les vaisseaux sanguins. Elle peut conduire à des blocages dans ces vaisseaux sanguins, provoquant un AVC26,27,30. D’après O’Donnell et coll.26, la consommation du tabac contribue
à hauteur de 4,5 à 18% dans la survenue des AVC ischémiques et hémorragiques, mais avec une prédominance pour les AVC ischémiques26.
Diabète sucré
Le diabète sucré fait plus que doubler le risque d'AVC chez les personnes diabétiques, et l’AVC représente 20% de décès chez cette catégorie de patients30,33. Le diabète sucré intervient dans les deux types d’AVC, mais
surtout dans les AVC ischémiques, et ce, à hauteur de 3,9% 26. Le changement de style de vie combiné au
traitement contre l’hyperglycémie permettent de réduire le risque d’AVC34.
Taux de cholestérol élevé
La dysrégulation des apolipoprotéines entrainant une augmentation des apolipoprotéines B aux dépens de A1 conduit à une hypercholestérolémie35. Cette dernière augmente le risque d’obstruction des artères. Si une artère
menant au cerveau devient bloquée, un AVC peut en résulter. La contribution de la dysrégulation des apolipoprotéines dans la survenue des AVC ischémiques varie de 24,8 à 67,6%26. Un ratio élevé des
apolipoprotéines B/A1 est positivement associé à la survenue d’un AVC ischémique36.
Inactivité physique et obésité
Être inactif et/ou obèse peut augmenter le risque de maladie cardiaque et d'AVC26,27,29. Les évidences
scientifique démontrent qu’il existe une relation linéaire négative entre la pratique des activités physiques et la survenue des AVC37-39. La réduction de ce risque passe donc par la pratique régulière des activités physiques.
La littérature rapporte qu’une personne dépensant plus de 8000 MET minutes/semaine, correspondant à environ 2 heures d’activité physique vigoureuse par jour, réduit de 25 à 30% le risque de subir un AVC en la comparant avec une personne inactive, ne dépensant pas plus 600 MET minutes/semaine37-41.
Fibrillation auriculaire ou autre maladie cardiaque
Dans la fibrillation auriculaire, les oreillettes du cœur, surtout l’oreillette gauche vibre plutôt que de battre d'une manière rythmée et organisée42. Cela peut entraîner la coagulation du sang et augmenter le risque d'AVC
ischémique d’origine cardioembolique30. La fibrillation auriculaire serait responsable de 3,1% des AVC
Consommation excessive d'alcool
La consommation en moyenne de plus d'un verre par jour pour les femmes ou plus de deux verres par jour pour les hommes peut augmenter la pression artérielle43,44. Les personnes alcooliques s’exposent à développer des
hypertensions artérielles et par conséquent, ils peuvent subir soit des AVC ischémiques soit des AVC hémorragiques30. La consommation excessive d’alcool contribue à 5,9% dans la survenue des deux types
d’AVC26.
Consommation de drogues illégales
L’abus de drogues illégales telles que la cocaïne, l'héroïne, les amphétamines, des ecstasy, augmente le risque d’AVC ischémique ou hémorragique45,46.
Il ressort de cette brève description des facteurs de risque d’AVC que l’hypertension artérielle est plus associée à une hémorragie intracérébrale qu’à un AVC ischémique. Par contre, la consommation du tabac, les diabètes, les apolipoprotéines (augmentation des apolipoprotéines B aux dépens de A1) et les maladies cardiaque comme les fibrillations auriculaires, sont plus liés à l’AVC d’origine ischémique.
L'importance de tout facteur de risque sur une population dépendra à la fois de son risque relatif et de la prévalence de ce facteur de risque dans la population47. En ce qui concerne les AVC, cinq facteurs de risque
classiques présentent un intérêt majeur du point de vue de la population : l'hypertension, le tabagisme, l'inactivité physique, le diabète et la fibrillation auriculaire. Pris ensemble, ces cinq facteurs de risque sont responsables de la survenue de plus des deux tiers de tous les AVC27.
1.1.4 Épidémiologie de l’AVC
L’épidémiologie de l’AVC a bien été documentée dans les pays à revenu élevé48 ; ce qui n’est pas le cas dans
les PFMR où les données épidémiologiques sont parcellaires et généralement basées sur des registres des hôpitaux29,31,49. Les responsables politiques des PFMR, particulièrement ceux de l’ASS accordent beaucoup
plus de priorité aux maladies infectieuses telles que le VIH/SIDA et le paludisme au détriment des maladies non transmissibles telles que des AVC, par manquent des ressources financières7. Or, les informations sur la
prévalence, l’incidence, la mortalité, les facteurs de risque, le nombre d’années de vie perdues et le nombre d’années vécues avec incapacité à la suite d’un AVC, sont d’une importance capitale; elles permettent une évaluation des priorités afin de faire face à cette affection neurologique et donc, de concevoir efficacement des
mesures de contrôle des facteurs de risque modifiables et de prévention de l’AVC, et de lutte contre les séquelles générées48. Ces mesures comprennent la lutte contre l’hypertension artérielle et l’hypercholestérolémie, la
cessation du tabagisme et de l’alcoolisme, la réduction de la consommation de sel, les campagnes de sensibilisation sur les facteurs de risques de l’AVC et le traitement des maladies cardiaques, du diabète et des AVC à des coûts abordables, surtout dans les PFMR où la plupart des patients ne sont pas couverts par une assurance maladie32,50. Toutefois, il est important de noter que depuis 1990, la charge globale de l’AVC dans le
monde augmente de manière considérable et plus particulièrement dans les PFMR 29,31,32,50,51. Cette tendance
pourrait se poursuivre jusqu’en 2030 si les efforts ne sont pas déployés pour appliquer ces mesures3.
Prévalence, incidence, mortalité et morbidité de l’AVC
Les indicateurs épidémiologiques montrent que la charge globale de l’AVC a évolué avec le temps. À l’échelle mondiale, la prévalence de l’AVC est passée de 33 millions (2010) à 25,7 millions (2013) des cas31,32,50.
Toutefois, cette prévalence se répartit aussi diversement selon le niveau de revenu des pays. Par exemple, en 2006 la prévalence de l’AVC variait de 76 cas sur 100 000 habitants en Tanzanie à 1 445 cas sur 100 000 habitants en France 27. En 2010, elle variait de 82 cas sur 100 000 habitants au Burundi à 1 187 cas sur 100 000
habitants au Canada31. Dans The Global Burden of Disease (GBD) 2013 Study, Feigin et coll.50 ont indiqué que
les prévalences des AVC ischémiques les plus élevées avaient été enregistrées dans les pays à revenu élevé, et plus particulièrement aux Etats-Unis (1015 à 1 184 cas sur 100 000 habitants)50, alors que les taux les plus
bas avaient été enregistrés dans les PFMR et atteignaient 339 cas sur 100 000 habitants50. Pour ce qui est des
AVC hémorragiques, les auteurs ont rapporté des taux de prévalence très élevés aux Etats-Unis (232 - 270 cas sur 100 000 hab.). La prévalence la plus basse (jusqu’à 78 cas sur 100 000 hab.) des AVC hémorragiques a été enregistrée en Amérique latine, en Afrique, au Moyen-Orient, en France, en Europe de l'est, dans la partie nord de l'Asie et en Russie50. Quant à la RDC, les données disponibles sur la charge globale des AVC
ischémiques et hémorragiques ont été publiées en 2013 et ne concernent que l’incidence, la mortalité et les années de vie de qualité perdues à cause de l’incapacité liée l’AVC, sur la période de 1990 à 201032.
Pour ce qui est de l’incidence, globalement, elle a été estimée à 16,9 millions de nouveaux cas en 2010 et à 10,3 millions de nouveaux cas en 201331,32,50. En RDC, l’incidence des AVC ischémiques variait de 127,96
nouveaux cas sur 100 000 habitants en 1990 à 163,54 nouveaux cas sur 100 000 habitants en 201032 et celle
des AVC hémorragiques est passée de 53,34 nouveaux cas sur 100 000 habitants en 1990 à 74,31 nouveaux cas sur 100 000 en 201032.
Sur le plan de mortalité, l’AVC a entrainé 5,9 millions de décès (dont 71% dans les PFMR) en 2010 et de 6,5 millions de décès en 2013, au niveau mondial31,50. Des données très récentes indiquent 6,24 millions de décès
dont plus de 450 000 en ASS sont imputables à l’AVC52. Pour ce qui est de la RDC, en 1990, les AVC
ischémiques ont entrainé 49,09 cas de décès sur 100 000 habitants alors qu’en 2010, 54,36 cas de décès sur 100 000 habitants leur ont été attribués32. Les AVC hémorragiques ont été responsables de 66,79 cas de décès
sur 100 000 en 1990 et de 76,71 sur 100 000 habitants en 201032.
Sur le plan de la morbidité, l’AVC entraine des incapacités résultant de déficiences. En 2013, il a été identifié comme étant la troisième cause de handicap dans le monde53. De 1990 à 2013, beaucoup d’années de vie de
qualité ont été perdues à cause de l’incapacité liée à l’AVC31,32,50 et la charge globale de l'AVC en termes de
nombre absolu de personnes touchées par un AVC ou qui sont restées avec des incapacités n’a fait qu’augmenter significativement à travers le monde. Cette augmentation s’explique, d’une part, par les efforts déployés particulièrement par les pays à revenu élevé pour réduire la mortalité due à l’AVC, avec un effet direct sur l’augmentation de la prévalence54 et, d’autre part, par l’augmentation exponentielle de l’incidence dans les
PFMR suite à des mesures de contrôle insuffisantes de facteurs de risque et prévention de l’AVC dans les PFMR50.
Il se dégage de l’analyse de ces données épidémiologiques que, de manière générale, la prévalence et l’incidence de l’AVC ont régressé à l’échelle mondiale de 2010 à 2013. Cette réduction est la conséquence de la prise de conscience de ce problème de santé publique par les institutions de santé et les populations, et des mesures adéquates en termes de prévention par le dépistage précoce et le traitement de l’hypertension artérielle et la sensibilisation pour le changement des comportements/styles de vie, surtout dans les pays à revenu élevé. En présence de faibles niveaux de sensibilisation aux facteurs de risque, de soins de santé et de suivi, et de la rareté des médicaments et d’équipement de base pour la prévention et le traitement des AVC, les PFMR et surtout l’ASS ne devraient toutefois pas s’attendre à cette diminution de la charge globale de l’AVC31,32,55.
1.2 Modèle conceptuel de la classification du fonctionnement, du
handicap et de la santé (CIF)
La CIF de l'OMS56 constitue un modèle utile pour la compréhension et la description des états de la santé56. Il a
été conçu en 200156 et mis à la disposition des professionnels de la santé et des chercheurs, en tant que
révision de la classification internationale des déficiences, incapacités et handicaps (CIDIH) publiée en 198057,
Ce plus récent modèle intègre les dimensions biologiques, personnelles et sociales d’un individu et s’éloigne de la CIDIH qui mettait l’accent sur les conséquences linéaires des maladies, pour embrasser une approche plus positive de la santé. Ainsi, deux composantes ont été décrites dans le modèle de la CIF : les composantes du fonctionnement et du handicap regroupant les structures anatomiques et les fonctions physiologiques, l’activité et la participation, d’une part, et les facteurs contextuels comprenant les facteurs personnels et environnementaux, d’autre part56. Contrairement à la CIDIH, la CIF considère que les états du fonctionnement
et du handicap d’une personne résultent de l’interaction dynamique et bidirectionnelle entre son problème de santé (déficience, limitations d’activité et restrictions de participation) et les facteurs contextuels, dans laquelle les facteurs environnementaux jouent un grand rôle.
Figure1. Classification internationale du fonctionnement, du handicap et de la santé (CIF) (OMS, 2001)56.
La figure 1 est une représentation schématisée des interactions entre les composantes de la santé de la CIF. Selon la CIF, les domaines du fonctionnements et du handicap et les facteurs contextuels sont définis de la manière suivante56 :
• Les fonctions organiques désignent les fonctions physiologiques des systèmes organiques (y compris les fonctions psychologiques).
• Les structures anatomiques désignent les parties anatomiques du corps, telle que les organes, les membres et leurs composantes.
• Les déficiences désignent des problèmes au niveau de la fonction organique ou de la structure anatomique, tels qu'un écart ou une perte importante.
Problèmes de santé (troubles ou maladies) Facteurs personnels Facteurs environnementaux Fonctions organiques et structures anatomiques Déficiences Activité Limitations Participation Restrictions
• L’activité désigne l'exécution d'une tâche ou d'une action par une personne.
• La participation désigne l'implication d'une personne dans une situation de vie réelle.
• Les limitations d'activité désignent les difficultés que rencontre une personne dans l'exécution d'activités.
• Les restrictions de participation désignent les problèmes qu'une personne peut rencontrer dans son implication dans une situation de vie réelle.
• Les facteurs environnementaux désignent l'environnement physique, social et attitudinal dans lequel les gens vivent et mènent leur vie.
Toutes les dimensions de la CIF sont pertinentes à étudier pour tout problème de santé. Mais, étant donné qu’elles sont vastes et qu’il n’est donc pas évident de les étudier toutes au même moment, dans le cadre de notre étude, nous abordons seulement les domaines du fonctionnement et du handicap avec un accent particulier sur les domaines d’activité et de participation. Ces derniers correspondent aux attentes des patients post-AVC et aux objectifs fonctionnels primordiaux de la réadaptation post-AVC à court, moyen et long termes8.
1.2.1 Déficiences liées à l’AVC
L'AVC peut affecter de nombreux aspects de la fonction et de la structure des cellules nerveuses8. Toutefois,
sur le plan clinique, les déficiences se manifestent le plus souvent par les déficits moteurs58,59, déficits liées à la
mobilité8, la spasticité60-62, les déficits sensoriels58,60,63, la dysphagie (trouble de la déglutition)8,64, les troubles
de l’équilibre64, la négligence spatiale8, les troubles de communication8,65,66, la douleur67,68, l’ataxie69,70, les
contractures47,62,71, les escarres64, les troubles cognitifs et de l’humeur8, etc. Ces déficiences peuvent, en
interaction avec les facteurs contextuels, surtout les facteurs environnementaux, conduire à des limitations d’activité et des restrictions de participation.
1.2.2 Niveaux d’activité et de participation après un AVC
Tel que nous l’avons évoqué précédemment, l’AVC peut entrainer des déficiences. Celles-ci sont susceptibles d’affecter les AVQ telles que la marche en communauté, les soins personnels, les montées et descentes des escaliers et la communication ; ce qui peut compromettre la capacité d’accomplir des tâches en lien avec son emploi, le loisir et le sport72. D’après American Heart Association73 sur plus de 5,7 millions de personnes ayant
il est notable que le niveau d’activité après un AVC est influencé par les déficiences74, l’âge, le sexe, la sévérité
de l’AVC à l’admission, le type d’AVC et l’humeur14.
Par ailleurs, l’AVC peut être associé aussi à des restrictions de participation pour les personnes qui en sont victimes16,75. Considérant la nature chronique de l’AVC, les restrictions de participation peuvent persister même
sur le long terme. C’est ainsi que Gadidi et coll.76 notent dans leur étude que plus de 30% des patients ont
rapporté des restrictions dans l’accomplissement des rôles sociaux quatre ans après leur premier AVC. Considérée comme l’aboutissement d’un processus de réadaptation post-AVC réussi77, la participation est
fondamentalement influencée par les facteurs environnementaux78. Mais, elle peut être affectée par la sévérité
de l’AVC, l’âge, l’acceptation de l’AVC79, les déficiences incluant les déficits de la fonction du membre supérieur,
la dépression et d’autres comorbidités16,78, et les déficits cognitifs80 et les déficits de la marche79.
1.2.2.1 Capacité à marcher après un AVC
Plus de 80% des patients post-AVC présentent des troubles de la marche qui limitent leur capacité d’accomplir des AVQ et de participer à des activités en communauté64. Ceci montre que la marche est une des plus
importantes composantes des domaines d’activité et de participation affectées suite à un AVC81 et constitue, de
ce fait, une des priorités du processus de réadaptation post-AVC. Plusieurs paramètres permettent d’estimer la
capacité à marcher après un AVC. Deux d’entre eux sont la vitesse de marche et la distance de marche.
1.3 Mécanismes neurophysiologiques de la récupération après un
AVC et réadaptation
1.3.1 Mécanismes neurophysiologiques de la récupération après un AVC
Des études expérimentales sur les animaux et des études neurophysiologiques et en neuro-imagerie chez les sujets humains ont démontré que le cerveau de l’adulte garde sa capacité de se réorganiser tout au long de sa vie82,83. C’est cette capacité intrinsèque de réorganisations anatomiques accompagnées de modifications
synaptiques que l’on appelle plasticité cérébrale ou neuronale ou encore neuroplasticité84-86. Les réorganisations
des circuits neuronaux après une lésion cérébrale, en l’occurrence un AVC, calque le paradigme de la plasticité du cerveau normal d’un adulte en cas de mort cellulaire programmée85,87. En effet, après un AVC, le plus grand
défi à relever pour le cerveau lésé est d’élaborer des nouvelles stratégies de réponse compensant les fonctions des tissus nerveux endommagés. Ce sont ces nouvelles stratégies (mécanismes de réorganisations et de modifications synaptiques) qui conditionnent une certaine récupération fonctionnelle spontanée85. Malgré le
récupération spontanée. Cette récupération spontanée peut être guidée par des interventions thérapeutiques, en l’occurrence la réadaptation vers un niveau plus évolué. En 2016, Li et ses collègues88 ont d’ailleurs rapporté
que la récupération de la fonction motrice augmente de manière significative après une intervention thérapeutique88. La récupération après un AVC est donc sous-tendue par deux mécanismes: 1) les modifications
structurelles et fonctionnelles dans les réseaux neuronaux conduisant à la suppléance fonctionnelle des tissus nerveux perdus à la suite d’un AVC par des cellules nerveuses contiguës, indemnes de la lésion et 2) l’expérience/apprentissage87 (par exemple, par la réadaptation). Toutefois, il importe de noter qu’en raison de la
perte des neurones ayants des fonctions hautement spécifiques, il est peu probable que la récupération fonctionnelle et particulièrement, la récupération motrice qui survient après un AVC soit identique que les schémas moteurs ayant prévalu avant ce processus pathologique87. Mais, il se peut que dans certaines
situations, ces neurones soient épargnés par la lésion nerveuse. En conséquence, l’exécution de l’acte moteur s‘accompagne d’une compensation négligeable87.
1.3.2 Réadaptation après un AVC
La réadaptation des patients post-AVC est un processus global et pluridisciplinaire visant le rétablissement des capacités physiques, mentales et sociales27,48. Elle constitue la pierre angulaire de la prise en charge des
patients pos-AVC89.
Des évidences scientifiques soutiennent que les soins de réadaptation des patients post-AVC, bien organisés, dans une équipe multidisciplinaire, réduisent significativement non seulement les taux de mortalité et d’hospitalisation, les déficiences et les incapacités, mais améliorent aussi le niveau d'indépendance dans les AVQ89,90 nécessaire pour la réintégration communautaire. Toutefois, l’efficacité de ces soins est difficile à
mesurer en raison de la multiplicité des facteurs (par exemple, la motivation du sujet, la plasticité cérébrale, environnement social, …) qui ont une grande influence sur le niveau de déficiences, les limitations d’activité et les restrictions de la participation et voire même sur la qualité de vie91. Malgré cela, l’objectif principal de la
réadaptation est de prévenir les complications, de minimiser les déficiences et de maximiser la récupération fonctionnelle64,92, de faciliter la réintégration en communauté et d’améliorer la participation dans
l’accomplissement des rôles sociaux92.
Plusieurs techniques de réadaptation telles que les techniques traditionnelles de facilitation neuromusculaire (de Bobath, Kabat, Brunnstrum), la stimulation nerveuse électrique transcutanée (SNET ou TENS en anglais), le biofeedback électromyographique, l’acupuncture, la robotique, la rééducation par la tâche spécifique / rééducation orientée sur la tâche (task – specific / task - oriented training, en anglais), etc. ont été développées
pour permettre aux patients post-AVC de recouvrer, autant que faire se peut, l’autonomie dans l’accomplissement des AVQ, entre autres. Ces techniques sont à la fois communes et très variées8. Toutefois,
en ce qui concerne les techniques traditionnelles, dans une revue systématique consistant à évaluer l'efficacité des techniques physiothérapiques traditionnelles à partir des résultats d’essais cliniques, Langhammer et Stanghelle93 ont affirmé qu’aucun essai n'avait montré que ces techniques étaient supérieures aux thérapies de
comparaison respectives bien que des améliorations dans la fonction motrice aient été démontrées. Dans une étude similaire publiée en 200794, les auteurs avaient conclu que ces techniques étaient tantôt efficaces tantôt
moins efficace que d’autres approches thérapeutiques en termes d’amélioration de la capacité à marcher.
La réadaptation des patients post-AVC débute pendant l'hospitalisation aiguë, dès que le diagnostic d'AVC est établi et que la stabilité médicale est assurée8,64,95. Les priorités les plus élevées au cours de cette première
phase sont la prévention de la récidive et des complications, la bonne gestion des fonctions générales de santé, la mobilisation du patient, son encouragement pour la reprise des activités par l’implication personnelle et le soutien moral en faveur du patient et de sa famille64. Après cette phase, la réadaptation pourra se focaliser sur
les évaluations et l’amélioration des niveaux d’activité et de participation.
1.3.2.1 Évaluations et phases de réadaptation post-AVC
Évaluations post-AVC
Les évaluations d’un patient post-AVC et l’organisation des soins qui en découle doivent toucher à l’ensemble des domaines du cadre conceptuel de la CIF. Après une hospitalisation aiguë pour un AVC, le patient doit donc subir une évaluation complète des structures anatomiques et des fonctions organiques, des limitations d'activité et des restrictions de participation, conformément à la CIF96 et ce, dans une équipe multidisciplinaire pouvant
comprendre le patient, sa famille, des médecins, physiothérapeutes, infirmières, ergothérapeutes, orthophonistes , thérapeutes en loisirs, psychologues, nutritionnistes, travailleurs sociaux et autres8.
Dans un premier temps, ces évaluations peuvent déjà être effectuées en même temps que les tests diagnostiques, 24 heures après l'admission, selon la stabilité médicale du patient8. Elles peuvent se poursuivre
après quelques jours ou mois pour s’assurer du progrès du patient en termes de la reprises de ses AVQ et rôles sociaux.
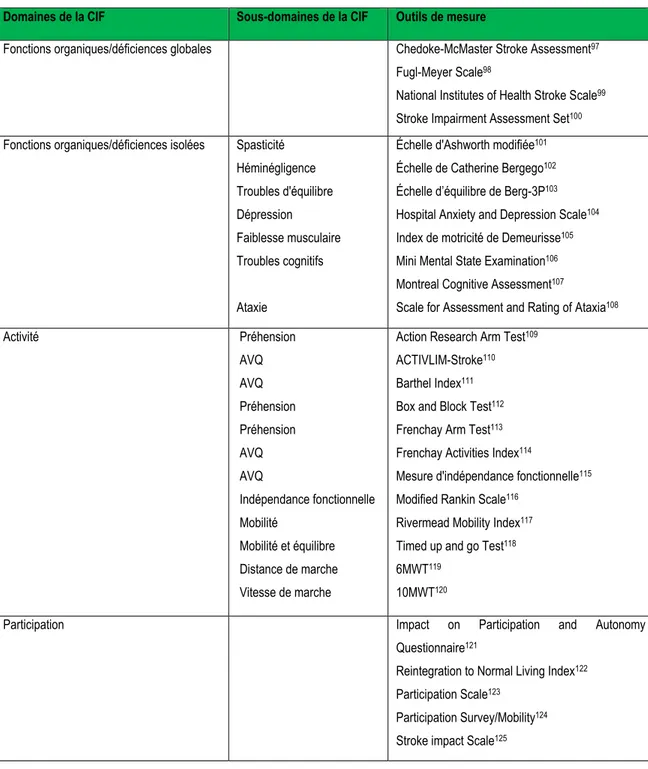
Il existe de nombreux d’outils de mesure des déficiences, des limitations d’activité et des restrictions de participation. La liste ci-dessous présente certains outils pouvant être utilisés pour évaluer les principaux domaines de la CIF chez les personnes ayant subi un AVC
Tableau 1. Quelques outils de mesure de déficiences, d’activité et de participation
Malgré le caractère non exhaustif de cette liste, il nous semble important de préciser que le choix d’un outil de mesure dépendra notamment de la force de ses qualités métrologiques, de la simplicité de son usage, de son applicabilité dans le milieu visé et du domaine de la CIF à évaluer. C’est ainsi que dans le cadre de notre étude, nous avons porté notre choix sur cinq (5) outils de mesure évaluant les conséquences de l’AVC. Ces outils de mesure sont décrits dans le chapitre 2.
Domaines de la CIF Sous-domaines de la CIF Outils de mesure
Fonctions organiques/déficiences globales
Chedoke-McMaster Stroke Assessment97
Fugl-Meyer Scale98
National Institutes of Health Stroke Scale99
Stroke Impairment Assessment Set100
Fonctions organiques/déficiences isolées Spasticité Héminégligence Troubles d'équilibre Dépression Faiblesse musculaire Troubles cognitifs Ataxie
Échelle d'Ashworth modifiée101
Échelle de Catherine Bergego102
Échelle d’équilibre de Berg-3P103
Hospital Anxiety and Depression Scale104
Index de motricité de Demeurisse105
Mini Mental State Examination106
Montreal Cognitive Assessment107
Scale for Assessment and Rating of Ataxia108
Activité Préhension AVQ AVQ Préhension Préhension AVQ AVQ Indépendance fonctionnelle Mobilité Mobilité et équilibre Distance de marche Vitesse de marche
Action Research Arm Test109
ACTIVLIM-Stroke110
Barthel Index111
Box and Block Test112
Frenchay Arm Test113
Frenchay Activities Index114
Mesure d'indépendance fonctionnelle115
Modified Rankin Scale116
Rivermead Mobility Index117
Timed up and go Test118
6MWT119 10MWT120 Participation
Impact on Participation and Autonomy Questionnaire121
Reintegration to Normal Living Index122
Participation Scale123
Participation Survey/Mobility124
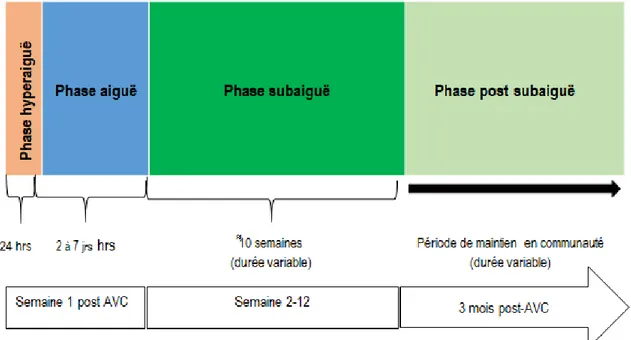
Phases de réadaptation post-AVC
D’après le comité d’experts du Québec sur l’offre de services de réadaptation post-AVC95, la réadaptation post-AVC comporte quatre phases qui s’inscrivent dans un continuum des soins administrés à l’urgence, puis en unité de l’AVC ou autre unité des soins, les soins en ambulatoire et les soins en communauté.
Figure 2. Phases de réadaptation post-AVC (page 109)95
Phase hyperaiguë
Cette phase couvre les 24 premières heures post-AVC et comprend les premières 4,5 heures où le patient est en route vers l’hôpital et à l’urgence. Au cours de cette phase, le patient reçoit d’abord les premiers soins. Ensuite, il subit une évaluation de la sévérité de l’AVC et des examens neurologiques systématisés comme par exemple, la tomographie par émission de positron, l’imagerie par résonnance magnétique fonctionnelle, et l’échographie doppler carotidien pour décider de la pertinence d’une thrombolyse. À ce stade, le patient peut être transféré dans une unité de l’AVC.
Phase aiguë
Commençant 24 heures après la phase hyperaiguë, la phase aiguë est celle au cours de laquelle on procède à l’évaluation systématique des besoins globaux de la réadaptation dans une équipe multidisciplinaire, une fois la
sur l’altération des fonctions physiologiques et structures anatomiques, les limitations d’activité et les restrictions de participation afin d’établir la meilleure trajectoire de réadaptation pour le patient.
C’est la phase du début de la réadaptation proprement dite au cours de laquelle il faut veiller à la bonne installation du patient au lit et dans un fauteuil roulant pour éviter de susciter ou réveiller une douleur à l’épaule (si atteinte du membre supérieur présente) et à initier la mobilisation passive et/ou active selon la condition du patient.
Phase subaiguë
Elle intervient entre la 2ème et la 12ème semaine post-AVC. À ce stade, le patient est transféré dans un
établissement de réadaptation où il reçoit des soins en interne ou en ambulatoire. Au cours de cette phase, les évaluations se poursuivent pour vérifier l’efficacité des soins de réadaptation et suivre sa progression en termes d’accomplissement des AVQ et des rôles sociaux. Plusieurs techniques de réadaptation ont été développées pour permettre aux patients post-AVC de recouvrer leur indépendance fonctionnelle.
Phase post subaiguë
C’est la phase au cours de laquelle la réadaptation doit être beaucoup plus axée sur la progression du patient en termes de sa participation sociale et sa qualité de vie.
Il est notable de préciser que l’organisation des soins de réadaptation post-AVC à travers ces quatre phases constitue la norme. Mais elle dépend aussi des réalités d’un pays à l’autre. Par exemple, en RDC, le constat est tel que les évaluations post-AVC n’y pas sont réalisées systématiquement, et face au problème d’accès aux soins de réadaptation, les patients ne sont pas toujours suivis à travers toutes ces phases.
1.3.2.2 Réadaptation après un AVC dans les pays à faibles et moyens
revenus (PFMR)
D’énormes progrès ont été réalisés dans le domaine des soins et en particulier, de la réadaptation des patients post-AVC dans les pays à revenus élevés. Toutefois, ces progrès n'ont pas bénéficié aux PFMR et surtout pas à l'ASS126. De plus, le coût des services de réadaptation y est souvent élevé27,48 alors que les populations sont
généralement pauvres. En y ajoutant d’autres facteurs tels que les croyances culturelles, le manque de personnel qualifié et d'équipement, et l’insuffisance d’infrastructures adéquates, la plupart des patients post-AVC vivants dans les PFMR ont un accès limité aux soins de réadaptation7,27,48,127. Par ailleurs, tel que
mentionné précédemment, les programmes de réadaptation qui sont organisés dans les PFMR, et particulièrement dans la région de l’ASS, se résument généralement aux soins médicaux et à quelques séances de physiothérapie9. Plus encore, étant donné que peu de gens sont couverts par l’assurance maladie3,128,
beaucoup de patients post-AVC sont obligés de financer eux-mêmes les soins de réadaptation et/ou de recourir à des proches. C’est le cas de la RDC où, selon une enquête non publiée, à petite échelle, menée en 2017 dans cinq formations médicales de Kinshasa, les patients post-AVC devaient débourser en moyenne 12.5 USD$ par séance de physiothérapie, sans tenir compte de dépenses liées leur à déplacement, alors que le revenu annuel brut estimé par la banque mondiale dans la même année était de 450 USD par habitant129. Le coût d’une séance
de physiothérapie représentait donc 33,3% du revenu mensuel moyen. Le coût des soins de réadaptation paraissait plus élevé que le revenu mensuel moyen de ces patients, ce qui les exposait au risque d’interruption de leurs programmes de réadaptation, avec des conséquences néfastes sur leurs niveaux d’activité et de participation.
Il ressort de ce premier chapitre que l’AVC est l’une des principales causes de décès et de handicap dans le monde et surtout dans les PFMR. Il entraine des dépenses énormes au niveau des ménages dans les PFMR, d’autant plus que beaucoup de patients vivant dans cette région ne sont pas couverts par une assurance maladie. Cette difficulté peut contribuer à limiter l’accès aux soins dans cette région.
Vu ces conséquences
socio-économiques et la charge en termes de mortalité, de morbidité et de dépendance qu’entrainent
les AVC, il est donc crucial de prévenir leur survenue par le contrôle des facteurs modifiables, et de
prendre en charge les personnes qui en sont victimes. Bien que les stratégies de prévention primaire
puissent réduire la charge de cette affection neurologique, des traitements efficaces, abordables et
basés sur des évaluations régulières dans une équipe de réadaptation multidisciplinaire, sont
essentiels pour réduire la mortalité, les limitations d’activités et les restrictions de participation chez les
personnes qui l’ont déjà subie.
1.4 Objectifs
L’étude qui a été menée à Kinshasa avait comme objectifs de (1) décrire les niveaux d’activité et de participation des patients post-AVC et (2) comparer ces niveaux à travers les catégories de vitesse de marche de ces patients.
1.5 Hypothèses
émis l’hypothèse selon laquelle les patients post-AVC vivant à Kinshasa présenteraient presque les mêmes niveaux d’activité et de participation que ceux évalués, avec les mêmes outils de mesure et tests, dans le contexte similaire. Mais ces niveaux seraient inférieurs aux patients évalués dans les pays à revenu élevé. Par ailleurs, nous avons postulé que ces niveaux d’activité et de participation varieraient significativement en fonction des vitesses de marche des patients.
Chapitre 2
Méthodologie générale
2.1 Devis et participants
Il s’agissait d’un devis prospectif transversal, avec un seul temps de mesure par participant. Avant le recrutement réalisé grâce à la technique d’échantillonnage de convenance, les participants devaient consentir volontairement à participer à l’étude en signant le formulaire de consentement volontaire. Pour sa réalisation, l’étude avait été approuvée par le comité d’éthique du centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale (CIUSSS-CN), au Canada et celui de l’école de santé publique de Kinshasa (ESP-KIN), en RDC.
2.2 Critères d’inclusion et d’exclusion
Pour participer à notre étude, les participants devaient répondre aux critères ci-dessous.
2.2.1 Critères d’inclusion
1. Être âgé de 18 ans ou plus ;
2. Avoir subi un AVC tel que défini par Hatano (1976)21
3. Ne pas présenter une altération des fonctions cognitives : Montreal Cognitive Assessment (Moca) ≥ 19130 au moment de l’évaluation (pour comprendre les consignes simples liées aux évaluations) ;
4. Ne pas présenter une héminégligence ni majeure ni modérée : échelle de Bergego ≤ 10102 (pour passer
le test de 10 mètres de marche (10MWT) et le test de 6 minutes de marche (6MWT) ; 5. Habiter dans la ville de Kinshasa.
2.2.2 Critères d’exclusion
• Tout patient aphasique était exclu de notre étude puisque les évaluations nécessitaient la collaboration aisée des participants, incluant la capacité à communiquer verbalement.
2.3 Outils de mesure utilisés
Les participants ont été évalués avec le Stroke Impairment Assessment Set (SIAS)131, le ACTIVLIM-Stroke110,
le test de 10 mètres de marche132, le test de 6 minutes de marche133 et le Reintegration to Normal Living Index
(RNLI)122,134. En plus de ces outils, une fiche de collecte de données sociodémographiques et cliniques
comprenant des questions sur l'âge, le sexe, le revenu mensuel moyen auto-rapporté, l'assurance maladie, et l’hémicorps atteint, le délai d’AVC, le type d'AVC, la durée de séance de la physiothérapie (PT) et le nombre moyen de séances de physiothérapie planifiées/mois, a été utilisée.
2.3.1 SIAS
Le SIAS est une échelle spécifique permettant d’évaluer les divers aspects de déficiences des patients post-AVC100, pour un total de 22 items, dont 9 items évaluant la fonction motrice et la communication, et 6 évaluant
les réflexes ostéotendineux et la fonction visuo-spaciale . Son système de cotation comporte 3 ou 5 niveaux, selon les items. Le score total varie de 0 (déficiences sévères) à 76 (normal). Son administration dure 10 minutes.
Des études sur sa fiabilité interjuge et sa validité ont été effectuées sur différents domaines de l’échelle pris séparément. Par exemple, dans une étude portant sur sa fiabilité interjuge, des degrés d’accord de 0,83 et 1,00 ont été trouvés respectivement pour les domaines de fonction motrice et de communication135, et de 0,61 et
0,77 pour les domaines de réflexes ostéotendineux et de fonction visuo-spaciale135. En 1995, Domen K. et ses
collègues136 ont étudié la validité concomitante du SIAS-Motor en le comparant au Motricty Index basé sur le
testing musculaire manuel et au Brunnstrom Stage. Les coefficients de corrélations étaient respectivement de 0,87 et 0,95136. Par ailleurs, le SIAS serait plus sensible au changement que le Motricity Index, le Brunnstrom
Stage, et le NIHSS100.
2.3.2 ACTIVLIM-Stroke
L’ACTIVLIM-Stroke est un questionnaire spécifique d’autoévaluation des limitations d’activité des patients post-AVC110. Il comporte 20 items avec un système de cotation qui comprend 3 niveaux (impossible, difficile, facile).
L’administration du questionnaire dure entre 4 et 7 minutes. Le score total brut de chaque patient est convertible en mesure linéaire exprimée soit en pourcentage soit en logit110. Mais nous avons converti les scores bruts en
L’ACTIVLIM-Stroke a une excellente fiabilité test-retest (Coefficient de corrélation intraclasse [CCI] = 0,92 – 0,99; P<0,001)110 et une très bonne validité convergente avec les scores de l’index de Barthel (IB) (r = 0,83,
P<0,001)110 et la dimension motrice de la mesure d’indépendance fonctionnelle (r = 0,82, P<0,001)110. Il est
aussi sensible au changement que le IB, mais plus sensible que l’échelle de Rankin modifiée et le test de 6 minutes de marche chez les patients post-AVC considérés comme stables 10 mois après leur AVC137.
2.3.3 10MWT
Le 10MWT est un test d’évaluation de la performance de la marche. Il évalue la vitesse (confortable ou maximale) de la marche sur 10 mètres120. Deux mètres non comptabilisés sont ajoutés avant la ligne de départ
et après celle d’arrivée pour réduire respectivement les effets d’accélération et de décélération. Lors de la réalisation du test, le participant peut s’arrêter à tout moment en cas de sensations de fatigue. Le temps d’administration du test est de 4 à 5 minutes. Sa fiabilité test-retest varie selon les études. Green et coll.138
rapportent des CCI variant de 0,87 à 0,88 alors que Flansbjer et coll.139 notent des CCI variant de 0,94 à 0,99.
Il a une bonne validité convergente par rapport au IB (r = – 0,78) et au Instrumented Activities of Daily Life (IADL) (r = – 0,76)140. Le test de 10 mètres de marche est aussi sensible au changement que les sous-score du BI se
rapportant à la mobilité 141.
Dans le cadre de cette étude, c’est la composante vitesse maximale qui nous a intéressés. Elle serait fortement associée à la force musculaire des membres inférieurs 132,142. Cette dernière aurait une grande influence sur la
capacité de la marche143. Suivant les recommandations de Dalgas et coll.142, nous avons déterminé la vitesse
maximale comme étant le meilleur score de trois essais pour éviter les essais de vitesse non maximales ou l’influence de la fatigue chez les patients post-AVC.
2.3.4 6MWT
Le 6MWT est un test de la marche fonctionnelle permettant d’évaluer la distance parcourue à la marche en 6 minutes133. Le 6MWT est un test simple à administrer qui requiert un parcours droit de 30m119. Il est aussi
possible d’utiliser des parcours de 20m144 ou 50m145. Dans le cadre de cette étude, le parcours de 30 mètres a
été retenu tel que recommandé par le American Thoracic Society119. Le parcours doit être marqué à tous les 3
mètres. Un cône doit être placé au bout du parcours pour maquer le retour vers la ligne de départ 119. Lors de
Le 6MWT a une excellente fidélité test-retest (ICC = 0,99)139,146. Sa validité convergente a été étudiée par Kosak
and Smith en 2005 en le comparant au test de 2 minutes de marche (2MWT) et au test de 12 minutes de marche (12MWT) chez les patients post-AVC hémiparésiques147. Ils ont rapporté d’excellentes corrélations entre le
6MWT et le 2MWT (r=0,997), et entre le 6MWT et le 12MWT (r=0,99)147. Plusieurs études ont par ailleurs montré
que le 6MWT est sensible au changement147-149.
2.3.5 RNLI
Le RNLI est aussi un outil de mesure d’autoévaluation comportant onze (11) items ou affirmations. Il évalue le fonctionnement global de la personne en réadaptation en mesurant l’autoperception de ses capacités122,134. Son
système de cotation comprend trois niveaux. Le répondant indique si l'affirmation s'applique:0 = tout à fait; 1 = partiellement ou 2 = pas du tout à sa situation. Le score total varie de 0 (excellente réintégration) à 22 (aucune réintégration). Son interprétation est telle que plus le score total est élevé, moindre est le niveau de réintégration à la vie sociale.
En 1988, Wood-Dauphinee et ses collègues122 avaient trouvé une très bonne cohérence interne du RNLI après
l’avoir administré auprès de trois échantillons différents. L’Alpha de Cronbach variait de 0,90 à 0,95. Ils avaient aussi rapporté que l’échelle est sensible au changement mais que l’usage des sous-échelles donne un résultat plus précis que l’échelle complète puisque les changements (améliorations ou détériorations) dans les domaines spécifiques peuvent être perdus dans le score total.
2.4 Procédures de recrutement et de collecte des données
Le recrutement des patients post-AVC a été effectué au centre de rééducation pour handicapés physiques (CRHP) et à l’hôpital militaire de référence du Camp Kokolo (HMRCK) à partir des registres d’admission des services de réadaptation de ces deux établissements. Un mois avant le recrutement, des annonces de recrutement y ont été affichées pour permettre aux patients qui y poursuivaient encore leurs programmes de réadaptation de prendre connaissance de l’étude faisant l’objet de recrutement. En même temps, des physiothérapeutes de ces établissements chargés d’identification et d’enregistrement des potentiels participants ont contacté par téléphone des patients poursuivant leurs séances à domicile, et ceux ayant été contraints d’abandonner la réadaptation pour les informer du recrutement. Ce n’est qu’après cette étape que l’investigateur a pris contact avec des potentiels participants pour leur faire part du projet avant de les inviter à passer les évaluations s’ils consentaient à y participer.
Les données ont été collectées dans les services de réadaptation des établissements cités ci-haut, en une ou deux rencontres, selon l’état de fatigue perçu et rapporté par le participant. Pour les participants ayant présenté de la fatigue lors de la première rencontre, seuls le SIAS, ACTIVLIM-Stroke et RNLI étaient administrés lors de la première rencontre par entrevues, en vue de limiter des données manquantes et des biais associés à l’utilisation des questionnaires d’autoévaluation. Le 10MWT et 6MWT ont été administrés lors d’une seconde rencontre. En ce qui concerne le 10MWT, les participants ont été invités à marcher aussi vite que possible sur un couloir balisé de 14 mètres, mais chronométré sur la distance de 10 mètres. Debout derrière la ligne de départ, les participants devaient marcher jusqu'à la ligne d’arrivée. Ils devaient aussi effectuer 3 essais du 10MWT à la vitesse maximale avec 30 secondes entre chaque essai, conformément à la procédure décrite par Flansbjer et coll.139. La vitesse maximale a été représentée par le meilleur score des trois essais afin d'éviter les
essais non maximaux influencés par la fatigue142. Les participants devaient compléter les 14 mètres complets,
mais ils pouvaient s'arrêter à n'importe quel moment s'ils ressentaient de la fatigue. Le 6MWT a été réalisée avec ou sans assistance dans un couloir de 30 mètres. Les participants ont également été invités à marcher aussi vite que possible en 6 minutes, mais ils pouvaient s'arrêter à tout moment s'ils ressentaient de la fatigue. Ils pouvaient se reposer et ensuite continuer de marcher. Toutes les évaluations ont été effectuées par le même enquêteur qui était un physiothérapeute ayant de l’expérience en réadaptation neurologique à Kinshasa.
2.5 Analyses statistiques
Des statistiques descriptives ont été utilisées pour décrire le fonctionnement des patients post-AVC en termes d’activité et de participation (Objectif 1). Pour ce faire, les variables quantitatives continues normalement distribuées et les variables ordinales ont été respectivement exprimées en moyenne et écart-type (SD), et en médiane et étendue. Pour les groupes de comparaisons (Objectif 2), l'échantillon a été divisé en trois sous-groupes basés sur la classification de la marche en communauté proposée par Perry et coll.18 : < 0,4 m/s
(marcheurs au domicile), entre 0,4 et 0,8 m/s (marcheurs limités en communauté) et > 0,8 m/s (marcheurs sans limite). Les coefficients de corrélation de Pearson et de Spearman ont été utilisés pour des analyses supplémentaires en vue de confirmer l’objectif 2, en analysant l’association entre l’ACTIVLIM-Stroke, le 6MWT, le RNLI and le 10MWT. Ensuite, le One-way ANOVA et les tests de Kruskal-Wallis ont été effectués respectivement pour les variables quantitatives continues normalement distribuées et les variables ordinales. Une valeur de p<0,05 a été jugée comme étant statistiquement significative. Les analyses ont été réalisées au moyen du logiciel SPSS, version 21.