© Marie-Pier Desjardins, 2018
Impact de l'inflammation sur la rigidité aortique en
insuffisance rénale chronique
Mémoire
Marie-Pier Desjardins
Maîtrise en médecine expérimentale - avec mémoire
Maître ès sciences (M. Sc.)
Impact de l’inflammation sur la rigidité aortique en
insuffisance rénale chronique
Mémoire
Marie-Pier Desjardins
Sous la direction de :
iii
RÉSUMÉ
Les maladies cardiovasculaires (MCV) sont la principale cause de mortalité en insuffisance rénale chronique (IRC). De nombreuses études ont démontré des associations entre la rigidité aortique, un facteur de risque cardiovasculaire non traditionnel, et un risque élevé de mortalité en IRC. Traditionnellement, la rigidité aortique a toujours été considérée comme une maladie vasculaire d’origine non inflammatoire. Cependant, récemment, dans un modèle animal en IRC avec des calcifications vasculaires, nous avons observé une augmentation de l’expression de l’interleukine-1β (IL-1β), de l’interleukine-6 (IL-6) et du facteur de nécrose tumoral (TNF) dans les calcifications vasculaires de l’aorte. Or, nous proposons que l’inflammation joue un rôle clé dans la physiopathologie de la rigidité aortique en IRC.
Les objectifs de ce mémoire sont 1) d’examiner l’impact de l’IL-1β, de l’IL-6 et du TNF sur la rigidité aortique chez des patients en IRC en dialyse, 2) d’évaluer l’effet de l’activation du système immunitaire sur l’évolution de la rigidité aortique après une greffe rénale (KTx) et 3) d’examiner l’impact de l’angiopoïétine-like-2 (ANGPTL2), un nouveau marqueur biologique de vieillissement vasculaire, sur la rigidité aortique après une greffe rénale.
D’après nos travaux, l’activation du système immunitaire semble jouer un rôle clé dans la physiologie de la rigidité aortique. Plus spécifiquement, l’IL-6, une cytokine pro-inflammatoire, est associée à la rigidité aortique chez des patients en dialyse. Par ailleurs, des taux élevés d’IL-6 trois mois après la greffe rénale prédisent une évolution défavorable de la rigidité aortique, suggérant que l’IL-6 est possiblement impliqué dans le remodelage vasculaire des patients greffés. Finalement, l’ANGPTL2 est associé à la rigidité aortique et à la mortalité chez des patients greffés, suggérant que l’ANGPTL2 est impliqué dans le développement des maladies cardiovasculaires en IRC.
Ces travaux suggèrent que l’inflammation est potentiellement une cible thérapeutique pour réduire la rigidité aortique menant à la mortalité cardiovasculaire en IRC.
iv
ABSTRACT
Cardiovascular disease (CVD) is the leading cause of mortality in patients with chronic kidney disease (CKD). Studies have shown an association between aortic stiffness, a nontraditional risk factor, and high mortality rate in CKD patients. Aortic stiffness has always been considered as a non-inflammatory vascular disease. However, recently, using a CKD animal model with pure medial vascular calcification, we have shown an increase expression of interleukin-1β (IL-1β), interleukin-6 (IL-6) and tumour necrosis factor (TNF) in calcified aortic wall. Therefore, we hypothesized that inflammation might be involved in the physiopathology of aortic stiffness in CKD patients.
The aims of this master are 1) to study the impact of IL-1β, IL-6 and TNF on aortic stiffness in CKD patients undergoing dialysis, 2) to examine the effect of the activation of the immune system on the evolution of aortic stiffness after a kidney transplantation (KTx) and 3) to evaluate the impact of angiopoietin-like-2 (ANGPTL2), a novel inflammatory biomarker of vascular aging, on aortic stiffness after KTx.
According to our results, the activation of the immune system seems to play a key role in the physiopathology of aortic stiffness. Indeed, IL-6, a pro-inflammatory cytokine, is associated with aortic stiffness in CKD patients undergoing dialysis. Also, increase levels of IL-6 three months after KTx is associated with an unfavourable evolution of aortic stiffness after KTx, suggesting that IL-6 is involved in arterial walls remodeling in kidney transplant recipients. In addition, ANGPTL2 is associated with aortic stiffness and mortality in kidney transplant recipients, suggesting that ANGPTL2 may play a biological role in CKD-related-CVD.
Our results suggest that inflammation may represent a novel therapeutic target of CKD-related-CVD.
v
TABLE DES MATIÈRES
RÉSUMÉ ... III
ABSTRACT ... IV
LISTE DES TABLEAUX ... VII
LISTE DES FIGURES ... VIII
LISTE DES ABRÉVIATIONS ... IX
REMERCIEMENTS ... XII
AVANT-PROPOS ... XIII
CHAPITRE 1. INTRODUCTION ... 1
CHAPITRE 2. LE REIN ET SES FONCTIONS BIOLOGIQUES ... 2
2.1L’INSUFFISANCE RÉNALE CHRONIQUE (IRC) ... 3
2.2ÉPIDÉMIOLOGIE DE L’IRC ... 4
2.3TRAITEMENT DE L’IRC ... 5
2.3.1 Dialyse ... 5
2.3.2 Greffe rénale ... 6
2.4COMPLICATIONS CARDIOVASCULAIRES ... 8
2.4.1 Chez les patients dialysés ... 8
2.4.2 Chez les patients greffés ... 9
CHAPITRE 3. RIGIDITÉ AORTIQUE ... 10
3.1STRUCTURE ET COMPOSITION DE L’ARBRE ARTÉRIEL ... 10
3.1.1 Les artères musculaires ... 11
3.1.2 Les artères élastiques ... 11
3.2LA RIGIDITÉ AORTIQUE: UN FACTEUR DE RISQUE DE MALADIES CARDIOVASCULAIRES ... 12
3.3MODÈLES THÉORIQUES DE L’ARBRE ARTÉRIEL ... 13
3.3.1 Modèle de Windkessel ... 13
3.3.2 Modèle de propagation de l’onde de pouls ... 14
3.4LA VÉLOCITÉ DE L’ONDE DE POULS ... 15
3.5INDEX DE RIGIDITÉ AORTIQUE Β0 ... 17
3.6CONSÉQUENCES HÉMODYNAMIQUES LIÉES À LA RIGIDITÉ AORTIQUE ÉLEVÉE ... 17
3.6.1 Réflexion d’onde ... 17
3.6.2 Le phénomène d’amplification ... 19
3.7CONSÉQUENCES HÉMODYNAMIQUES DE LA RIGIDITÉ AORTIQUE SUR LA MICROCIRCULATION ... 20
3.8MÉTHODES D’ÉVALUATION DE LA RIGIDITÉ ARTÉRIELLE ET DE SES COMPLICATIONS HÉMODYNAMIQUES ... 23
3.8.1 Évaluation de la vélocité de l’onde de pouls ... 23
3.8.2 Évaluation des ondes de réflexion ... 25
CHAPITRE 4. LA RIGIDITÉ AORTIQUE EN IRC ... 28
4.1LA RIGIDITÉ ARTÉRIELLE : UN FACTEUR PRONOSTIC EN IRC ... 28
4.2MÉCANISMES IMPLIQUÉS DANS LA PROGRESSION DE LA RIGIDITÉ AORTIQUE EN IRC ... 29
vi
4.2.2 L’accumulation de produits de glycation avancée ... 30
4.2.3 Les désordres de l’axe phosphocalcique et la calcification vasculaire ... 30
4.2.4 Le stress oxydant ... 31
4.2.5 L’inflammation ... 31
CHAPITRE 5. L’IMPACT DE L’INFLAMMATION SUR LA
RIGIDITÉ AORTIQUE EN IRC ... 40
5.1L’INFLAMMATION : UNE CIBLE THÉRAPEUTIQUE POTENTIELLE POUR RÉDUIRE LA RIGIDITÉ AORTIQUE ... 40
5.1.1 En IRC ... 40
5.1.2 Après la greffe rénale ... 41
CHAPITRE 6. HYPOTHÈSES ET OBJECTIFS DE RECHERCHE ... 43
6.1HYPOTHÈSE ... 43
6.2OBJECTIFS GÉNÉRAUX ET SPÉCIFIQUES DE RECHERCHE ... 43
CHAPITRE 7. MÉTHODOLOGIE DE RECHERCHE ... 44
7.1DEVIS ET POPULATION DES PROJETS DE RECHERCHE ... 44
7.1.1 Chez les patients dialysés ... 44
7.1.2 Chez les patients greffés ... 44
7.2COLLECTE DE DONNÉES... 44
7.2.1 Données cliniques, démographiques et pharmacologiques ... 44
7.2.2 Données biochimiques ... 45
7.2.3 Données hémodynamiques ... 45
7.3ANALYSES STATISTIQUES ... 46
CHAPITRE 8. IMPACT DE L’INTERLEUKINE-6 SUR LA RIGIDITÉ
AORTIQUE EN INSUFFISANCE RÉNALE CHRONIQUE
TERMINALE ... 47
CHAPITRE 9. IMPACT DE LA TRANSPLANTATION RÉNALE SUR
L’INDEX DE RIGIDITÉ AORTIQUE Β0 ... 67
CHAPITRE 10. LES TAUX D’ANGIOPOÏÉTINE-LIKE-2 SONT
POSITIVEMENT ASSOCIÉS À LA RIGIDITÉ AORTIQUE ET À LA
MORTALITÉ APRÈS UNE GREFFE RÉNALE ... 92
CHAPITRE 11. COMPLÉMENT DE DISCUSSION ... 112
CHAPITRE 12. CONCLUSION... 126
BIBLIOGRAPHIE ... 127
ANNEXE I... 144
vii
LISTE DES TABLEAUX
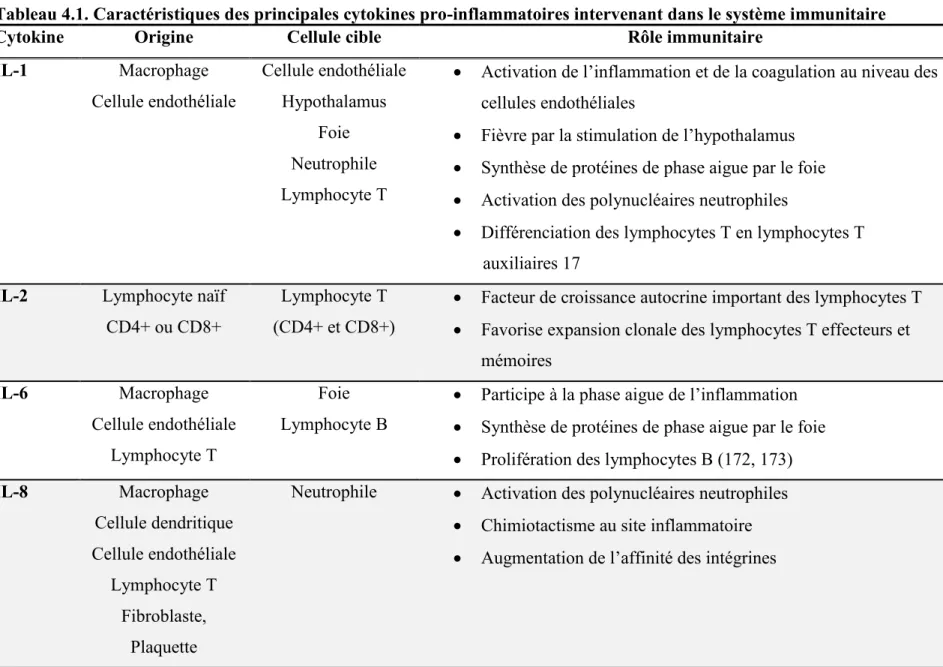
Tableau 2.1 Stades de l'insuffisance rénale chronique ... 4 Tableau 4.1. Caractéristiques des principales cytokines pro-inflammatoires intervenant
dans le système immunitaire ... 33 Table 8.1 Baseline clinical, hemodynamic, biochemical and pharmacological parameters
according to median levels of IL-6 ... 55 Table 8.2 Relationship between IL-6, cf-PWV, central PP and AIx@75 in univariate and
multivariate analysis ... 58 Table 8.3 Determinants of cf-PWV ... 57 Table 9.1 Baseline characteristics at the time of transplantation ... 76 Table 9.2 Clinical, hemodynamic and biochemical parameters of patients 3 months after a
kidney transplantation according to a favourable and an unfavourable late
progression of aortic stiffness index β0 after kidney transplantation ... 79 Table 9.3 Interleukin-6 (IL-6) and late progression of aortic stiffness index β0 ... 84 Table 10.1 Baseline characteristics at the time of transplantation ... 99 Table 10.2 Clinical, hemodynamic and biochemical parameters 3 months
post-transplantation ... 101 Table 10.3 Determinants of ANGPTL2 after KTx ... 103 Table 10.4 Comparative impact of age, CVD, diabetes, levels of ANGPTL2, aortic stiffness
viii
LISTE DES FIGURES
Figure 2.1 Anatomie du rein et du néphron ... 2 Figure 2.2 Nombre de transplantations rénales par année au Canada entre 2005 et 2014 ... 7 Figure 2.3 Mortalité cardiovasculaire stratifiée selon l’âge, l’ethnie et le genre chez les
patients dialysés et la population générale ... 8 Figure 3.1 Structure et composition de la paroi artérielle... 10 Figure 3.2 Les fonctions d’amortissement et de conductance de l’arbre artériel
représentées par le modèle de Windkessel (A) et le modèle de propagation de l’onde de pouls (B) ... 14 Figure 3.3 Relation exponentielle entre la pression artérielle et le diamètre artériel au
niveau de l’aorte ... 16 Figure 3.4 Conséquences hémodynamiques des ondes réfléchies chez des sujets jeunes et
âgés ... 18 Figure 3.5 Changement du profil de l’onde de pouls le long de l’arbre artériel chez des
sujets de 24, 54 et 68 ans ... 20 Figure 3.6 Conséquences hémodynamiques du gradient de rigidité artérielle sur la
microcirculation ... 22 Figure 3.7 Évaluation de la vélocité de l’onde de pouls carotide-fémorale à partir de la
méthode «pied à pied» ... 25 Figure 3.8 Profil central de l’onde de pouls obtenu à partir de la tonométrie d’applanation .. 26 Figure 4.1 Risque de mortalité cardiovasculaire selon les tertiles de la vélocité de l’onde
de pouls carotide-fémorale (VOP-cf) chez des patients en IRC ... 28 Figure 4.2 Mécanismes physiopathologiques proposés expliquant les changements
structurels de la paroi artérielle menant à la progression de la rigidité artérielle
induits par l’inflammation chronique. ... 39 Figure 8.1 Associations between IL-6, TNF, IL-1β and aortic stiffness in end-stage renal
disease ... 54 Figure 8.2 Exploration of the underlying process by which age, diabetes and
atherosclerotic CVD influence aortic stiffness through IL-6 using a series of
mediation analysis ... 59 Figure 9.1 Study Flowchart ... 73 Figure 9.2 Progression of carotid-femoral pulse wave velocity, mean arterial pressure,
cf-PWV adjusted for MAP and aortic stiffness index β0 after kidney transplantation ... 77 Figure 9.3 Progression of carotid-femoral pulse wave velocity, mean arterial pressure,
cf-PWV adjusted for MAP and aortic stiffness index β0 according to a favourable and unfavourable late progression of aortic stiffness index β0 after kidney transplantation . 78 Figure 9.4 Levels of interleukin-6, tumour necrosis factor and interleukin-1β between
groups with favourable and unfavourable trajectories of aortic stiffness index β0 ... 83 Figure 10.1 Flowchart of the study ... 97 Figure 10.2 Levels of ANGPTL2 before and 3 months after kidney transplantation ... 100 Figure 10.3 Association between ANGPTL2 and aortic stiffness after kidney
transplantation ... 103 Figure 10.4 Mortality and levels of angiopoietin-like-2 ... 104 Figure 11.1 Méta-analyse de l’impact de la greffe rénale sur la VOP-cf ... 116
ix
LISTE DES ABRÉVIATIONS
ACEi angiotensin-converting-enzyme inhibitor
ADMA diméthylarginine asymétrique/ asymmetric dimethyl arginine AGE advanced glycation end products
AIx index d’augmentation/ augmentation index
AIx@75 heart-rate (75 b.p.m.) adjusted augmentation index Akt/PKB protéine kinase B
ANGPTL2 angiopoïétine-like-2/ angiopoietin-like-2
AP@75 heart rate (75 b.p.m) adjusted augmentation pressure ARB angiotensin receptor blockers
ARNm acide ribonucléique messager
BM membrane basale
BP blood pressure
Ca/P/VitD diète riche en calcium, phosphate et vitamine D
CI confidence interval
cIMT épaisseur carotidienne entre l’intima et la média cf-PWV carotid-femoral pulse wave velocity
CRP C-reactive protein
cr-PWV carotid-radial pulse wave velocity CKD chronic kidney disease
CKD-EPI Chronic Kidney Disease-Epidemiology Collaboration CMH complexe majeur d’histocompatibilité
CVD cardiovascular disease DBP diastolic blood pressure Dd/Δd distance parcourue
DFGe débit de filtration glomérulaire estimé
DP dialyse péritonéale
Dt/Δt temps de transit ECM matrice extracellulaire ESRD end stage renal disease
ET-1 endothéline-1
FMD vasodilatation dépendante du flux sanguin
GAG glycosaminoglycane
GEEs generalized estimating equations H2O2 peroxide d’hydrogène
HbA1c hémoglobine glyquée
HD hémodialyse
HDL lipoprotéine à haute densité
HPLC chromatographie en phase liquide à haute performance
HR heart rate
ICIS registre canadien des insuffisances et des transplantations d’organes IFNγ interféron γ/ interferon γ
x
IgG immunoglobuline G
IL- interleukine-/ interleukin- IRC insuffisance rénale chronique
KTx transplantation rénale/ kidney transplantation
LDL lipoprotéine à basse densité/ low-density lipoprotein
MBP mean blood pressure
MCV maladies cardiovasculaires MMP métalloprotéases matricielles
mRNA messenger RNA
MΦ macrophage
NFκB nuclear factor kappa B
NK natural killer
NO monoxyde d’azote
O2− superoxyde
OR odds ratio
P pression
PAM pression artérielle moyenne PAR polyarthrite rhumatoïde PCR protéine C réactive
PGA produits de glycation avancée
PO43− phosphate
PP pression pulsée/ pulse pressure
PTH parathyroid hormone
qPCR PCR quantitatif
RA rigidité aortique
ROS espèces réactives oxygénées SBP systolic blood pressure
VSMC cellule musculaire lisse vasculaire/ vascular smooth muscle cell
TG triglyceride
TIMP tissue inhibitor of matrix metalloproteinases TNF facteur de nécrose tumoral/ tumor necrosis factor
V volume
VOP vélocité de l’onde de pouls
VOP-cf vélocité de l’onde de pouls carotide-fémorale VOP-cr vélocité de l’onde de pouls carotide-radiale VOP-fd vélocité de l’onde de pouls fémorale-distale
xi
«Le succès n’est pas une destination, mais un voyage.» -Arthur Ashe
xii
REMERCIEMENTS
Lorsque j’ai commencé mes études en médecine, je n’aurais jamais imaginé accomplir une maitrise de recherche entre mon pré-clinique et mon externat. Cependant, lors de mon premier stage de recherche, j’ai rencontré une équipe exceptionnelle qui m’a donné la piqure pour la recherche.
Je veux d’abord remercier Dr Mohsen Agharazii, mon directeur de recherche, qui m’a soutenu et encouragé tout au long de ma maitrise. J’ai appris beaucoup à vos cotés tant sur le plan professionnel en recherche que sur le plan personnel. J’ai apprécié vos précieux conseils, vos anecdotes et vos fameuses «leçons de vie». Je suis très reconnaissante de votre dévouement pour l’accomplissement de ma maitrise.
L’accomplissement de cette belle aventure n’aurait pas été possible sans l’aide de mon équipe de recherche. Je remercie d’abord Karine Marquis pour sa disponibilité, son aide et ses conseils judicieux dans mes projets de recherche. Je remercie également Visal Roth Ung pour son aide et son implication dans les manipulations en laboratoire. Je remercie Dr Richard Larivière, Dr Sacha A. DeSerres et Dr Fabrice Mac-Way pour leurs conseils et leur aide lors de la rédaction des manuscrits et de mes demandes de bourses.
Mon expérience de recherche n’aurait jamais été aussi agréable sans avoir été entourée d’une belle gang d’étudiants (Catherine, Aboubacar, Stéphanie, Sarah-Kim, Jane et Louis-Charles). J’aimerais remercier Catherine Fortier pour son aide, ses conseils et son écoute. Mes journées n’auraient pas été aussi agréables sans sa présence. Je veux aussi remercier Aboubacar Sidibé pour son aide en statistiques et pour sa bonne humeur contagieuse.
Je veux aussi remercier mes parents et ma famille qui m’ont soutenu et encouragé afin d’accomplir ce défi. Finalement, je remercie mon copain, Simon, pour son soutien et son aide durant la réalisation de ma maitrise.
Je tiens à souligner la contribution de l’Institut de recherche en santé du Canada (IRSC), la société québécoise d’hypertension artérielle (SQHA), Servier Canada et la fondation de l’Université Laval pour les bourses octroyées dans le cadre de ma maitrise.
xiii
AVANT-PROPOS
Ce mémoire de recherche a comme principal objectif d’approfondir le rôle de l’inflammation dans la physiopathologie de la rigidité aortique en insuffisance rénale chronique (IRC). Ce mémoire est composé de trois volets principaux.
D’abord, le premier objectif était d’étudier l’impact des cytokines inflammatoires sur la rigidité aortique chez des patients dialysés dans une étude transversale. Les résultats de ce projet sont présentés sous forme d’un article scientifique publié dans le Journal of the American Society of Hypertension en 2017 (Chapitre 8).
Ensuite, le second objectif était d’évaluer l’impact de l’inflammation sur la progression de la rigidité aortique dans une étude longitudinale chez des patients ayant reçu une greffe rénale. Plus précisément, cet objectif tentait d’examiner si l’activation du système immunitaire, évaluée par les taux plasmatiques des cytokines inflammatoires mesurées trois mois après une greffe rénale, pouvait entrainer une évolution défavorable de la rigidité aortique après une greffe rénale. Les résultats de ce projet sont présentés sous forme d’un article scientifique soumis dans une revue révisée par les pairs (Chapitre 9).
Finalement, le troisième objectif était d’examiner l’implication de l’angiopoïétine-like-2, un nouveau marqueur biologique de vieillissement vasculaire, dans le remodelage vasculaire et la rigidité aortique après une greffe rénale. Les résultats de ce projet sont présentés sous forme d’un article scientifique publié dans le American Journal of Hypertension en 2017 (Chapitre 10).
Les articles qui sont présentés dans ce mémoire sont le fruit de mes travaux de maitrise réalisés au cours des deux dernières années dans l’équipe du Dr Mohsen Agharazii. Ayant participé à toutes les étapes de ces projets, je suis la première auteure des trois manuscrits insérés dans ce mémoire. La contribution des coauteurs est décrite avant chaque article inséré.
Durant ma maitrise, j’ai eu la chance de collaborer sur d’autres projets de recherche. Les résultats de ces collaborations ont conduit à la publication de plusieurs manuscrits. La liste comprend tous les articles découlant de ces travaux de collaboration.
xiv
I. Aortic-brachial pulse wave velocity ratio: a measure of arterial stiffness gradient
not affected by mean arterial pressure (mini-revue invitée) (ANNEXE I) Auteurs: Catherine Fortier, Marie-Pier Desjardins et Mohsen Agharazii Journal: Pulse
Statut de l’article: Publié en octobre 2017
II. Reduction of arterial stiffness after kidney transplantation: a systematic review and
meta-analysis (ANNEXE II)
Auteurs: Aboubacar Sidibé, Catherine Fortier, Marie-Pier Desjardins, Hervé Tchala Vinon Zomahoun, Amélie Boutin, Fabrice Mac-Way, Sacha De Serres et Mohsen Agharazii
Journal: Journal of the American Heart Association (JAHA) Statut de l’article: Publié en décembre 2017
III. Aortic-brachial pulse wave velocity ratio: a blood pressure independent index of vascular aging.
Auteurs: Catherine Fortier, Aboubacar J. Sidibé, Marie-Pier Desjardins, Karine Marquis, Sacha A. De Serres MD, Fabrice Mac-Way et Mohsen Agharazii
Journal: Hypertension
1
CHAPITRE 1. INTRODUCTION
Actuellement, l’insuffisance rénale chronique (IRC) est une maladie très prévalente au Canada touchant près de 3 millions de Canadiens(1). D’après le registre canadien des insuffisances et des transplantations d’organes (ICIS)(2), plus de 40 000 patients étaient en IRC au stade terminal en 2014. Le nombre de patients en IRC terminale a augmenté de 38% au cours des 10 dernières années, une hausse explicable par le vieillissement de la population et par la prévalence élevée de diabète et d’hypertension(2).
Le risque de morbidité et de mortalité cardiovasculaires est accru chez les insuffisants rénaux. En effet, le risque de mortalité cardiovasculaire est 10 à 20 fois plus élevé chez les patients en IRC par rapport à la population générale(3). Même si la transplantation rénale améliore la survie, les patients greffés demeurent avec un risque de mortalité supérieur par rapport à la population générale(4). Étonnamment, la surmortalité cardiovasculaire n’est pas explicable par les facteurs de risque cardiovasculaires traditionnels.
Au cours des dernières décennies, plusieurs études ont démontré l’importance de la rigidité aortique comme facteur de risque cardiovasculaire non traditionnel en IRC(5-8). La rigidité aortique, un phénomène de vieillissement vasculaire accéléré, est associée à la mortalité cardiovasculaire en IRC(6). Malheureusement, les mécanismes accélérant la progression de la rigidité artérielle en IRC restent à élucider. Récemment, de plus en plus d’études ont souligné l’importance de l’inflammation dans la physiopathologie de la rigidité aortique. Parallèlement, nous avons précédemment démontré, à partir d’un modèle animal en IRC avec des désordres du métabolisme minéral osseux, une augmentation de l’expression des cytokines inflammatoires dans les calcifications vasculaires de l’aorte(9).
Alors que la rigidité aortique était autrefois considérée comme un phénomène non inflammatoire, ces récentes études révèlent la potentielle importance de l’inflammation sur la rigidité aortique. Une connaissance plus approfondie des mécanismes inflammatoires impliqués dans la progression de la rigidité aortique chez les patients en IRC est nécessaire pour trouver de nouvelles approches thérapeutiques afin de réduire la morbidité et la mortalité cardiovasculaires.
2
CHAPITRE 2. LE REIN ET SES FONCTIONS BIOLOGIQUES
Les reins, des organes hautement irrigués, reçoivent près de 20% de la circulation sanguine, soit l’équivalent d’un litre de sang par minute(10). Ce haut débit sanguin rénal est nécessaire pour maintenir une filtration rénale optimale afin d’assurer des fonctions biologiques essentielles dont le maintien de la composition liquidienne corporelle, l’excrétion de déchets métaboliques et la sécrétion d’hormones(11).
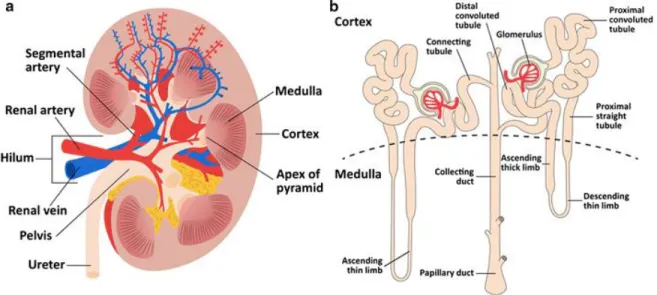
Pour accomplir ces rôles biologiques, l’unité fonctionnelle des reins est le néphron. Chaque rein comprend plus d’un million de néphrons. Le néphron est formé d’un glomérule et d’un tubule qui est segmenté en 4 parties (le tubule proximal, l’anse de Henle, le tubule distal et le tubule collecteur) ayant chacune des caractéristiques anatomiques et fonctionnelles distinctes(10) (Figure 2.1, tirée de De Boer et al., 2016(12)).
Figure 2.1 Anatomie du rein (a) et du néphron (b) Figure tirée avec permission de DeBoer et al.(12)
Brièvement, le néphron assure l’épuration du sang par trois mécanismes, soit par la filtration glomérulaire où le sang de l’organisme est filtré par le glomérule, soit par la réabsorption tubulaire où le tubule réabsorbe les molécules nécessaires à l’organisme ou soit par la sécrétion tubulaire où le tubule épure le sang de molécules n’ayant pu être filtrées par le glomérule en raison de leur charge électrique ou de leur poids moléculaire élevé(10). Le filtre glomérulaire, composé d’un endothélium fenestré, de la membrane basale et du podocyte, exerce un rôle de barrière physicochimique. Or, la perméabilité de ce
3
filtre glomérulaire est principalement basée sur la taille des molécules et la charge électriques des éléments.
Une barrière physique est créée par l’endothélium, une membrane poreuse, qui est perméable à l’eau et aux petites particules solubles, mais qui est imperméable aux grosses molécules, aux cellules sanguines et à la majorité des protéines. Ainsi, des éléments de faible poids moléculaire (5kDa) comme l’urée, le glucose et l’insuline circulent librement à travers la barrière tandis que des molécules de haut poids moléculaire comme l’albumine (65kDa) ne traversent pas le filtre glomérulaire aussi librement(13).
Une barrière chimique est formée par la membrane basale, constituée par les podocytes, qui possède une charge électrique négative repoussant par électro-répulsion les anions (c.-à-d. la majorité des protéines). Par conséquent, les anions ne traversent pas le filtre glomérulaire aussi librement que les cations(14).
La fonction rénale est évaluée à partir du débit de filtration glomérulaire. Le débit de filtration glomérulaire (DFGe) est généralement estimé à partir de la formule épidémiologique CKD-EPI (Chronic Kidney Disease-Epidemiology Collaboration)(15) où les valeurs normales sont estimées à partir d’une population de 20 ans (c.-à.-d. un DFGe=120 mL/min/1,73m2). Le vieillissement entraine une perte annuelle de 1 mL/min atteignant 70 mL/min/1,73m2 à l’âge de 70 ans(16). La perte de fonction rénale évaluée à partir du DFGe mène ultérieurement à l’insuffisance rénale.
2.1 L’insuffisance rénale chronique (IRC)
L’insuffisance rénale chronique est définie par un débit de filtration glomérulaire (DFG) inférieur à 60 mL/min/1,73m2, par la présence d’anomalies rénales urinaires et sanguines ou par des signes de lésions rénales à l’imagerie pendant plus de 3 mois(17). Les stades d’IRC se classifient selon le degré d’atteinte de la fonction rénale estimé à partir du DFG (Tableau 2.1).
4
Tableau 2.1 Stades de l'insuffisance rénale chronique Stade DFGe (mL/min/1,73 m2) Description
1 ≥ 90 Atteinte rénale* avec DFGe normale ou DFGe
2 60-89 Atteinte rénale* avec légère du DFGe
3a 45-59 légère à modérée du DFGe
3b 30-44 modérée à sévère du DFGe
4 15-29 sévère du DFGe
5 <15 (ou dialyse) Insuffisance rénale terminale
DFGe signifie débit de filtration glomérulaire estimé à partir de la formule épidémiologique CKD-EPI (Chronic Kidney Disease-Epidemiology Collaboration)
*L’atteinte rénale est définie par la présence d’anomalies rénales urinaires et sanguines ou des signes de lésions rénales à l’imagerie.
Généralement, les patients aux stades 1 et 2 ne manifestent pas de signes ni de symptômes liés à la diminution de la fonction rénale(16). Cependant, l’évolution de la maladie rénale entraine plusieurs désordres tels que de la dénutrition, de l’anémie, des désordres de l’axe phosphocalcique, des débalancements ioniques, de l’inflammation chronique, du stress oxydant, des dysfonctions endothéliales et l’accumulation de produits de glycation avancée (PGA)(16, 18, 19). Ultérieurement, un traitement de suppléance rénale doit être envisagé chez les patients ayant des symptômes liés à l’IRC(20).
2.2 Épidémiologie de l’IRC
Actuellement, plus de 3 millions de patients souffrent d’insuffisance rénale chronique au Canada(1). Or, parmi ces patients, 0,73 million ont un débit de filtration rénale inférieur à 60 mL/min/1,73m2 (stade IRC 3 à 5)(1). Selon le registre canadien des insuffisances et des transplantations d’organes (ICIS), il y avait 40 385 patients en IRC au stade terminal au Canada en 2011. D’après ICIS, le nombre de patients en insuffisance rénale chronique au stade terminal a augmenté de 38% entre 2005 et 2014(2). L’augmentation de la prévalence de patients en IRC au stade terminal est, en partie, expliquée par le vieillissement de la population et par la hausse de patients diabétiques et hypertendus au Canada(20, 21). En effet, plus de la moitié (53%) des nouveaux cas d’insuffisance rénale chronique terminale sont âgés de plus de 65 ans, une conséquence du vieillissement de la population
5
canadienne(2). Le principal facteur de risque de l’IRC est le diabète, une maladie chronique responsable de 36% des nouveaux cas d’insuffisance rénale en 2014(2).
2.3 Traitement de l’IRC
La dialyse, une technique d’épuration extra-rénale, et la greffe rénale sont les pierres angulaires dans le traitement actuel de l’insuffisance rénale chronique terminale.
2.3.1 Dialyse
D’après le registre canadien des insuffisances et des transplantations d’organes, près de 59% des patients en IRC terminale ont opté pour la dialyse comme traitement de suppléance rénale. Il existe deux techniques d’épuration extra-rénale soit l’hémodialyse (HD) et la dialyse péritonéale (DP).
2.3.1.1 Hémodialyse
Inventé en par Willem J Koff en 1945(22), l’hémodialyse a grandement évolué aux cours des décennies. Or, de nos jours, l’hémodialyse est l’option thérapeutique choisie par plus de 75% des patients en IRC terminale(2). Ce traitement est basé sur la création d’un circuit extra-corporel permettant le passage du sang dans un rein artificiel, soit le dialyseur. Le dialyseur est segmenté par une membrane semi-perméable en deux compartiments, l’un réservé à la circulation sanguine et l’autre réservé au dialysat(23). Le dialysat joue un rôle clé en hémodialyse puisqu’il permet d’épurer le sang des déchets urémiques par diffusion, de corriger l’excès liquidien par ultrafiltration et de rétablir les débalancements ioniques par osmolarité(11). Ce traitement doit être répété plusieurs fois par semaine afin de corriger les désordres métaboliques de l’IRC.
2.3.1.2 Dialyse péritonéale
La dialyse péritonéale est une technique de suppléance rénale où le péritoine, une membrane séreuse naturelle, assure l’épuration du sang. Le péritoine viscéral, recouvrant l’intestin et le mésentère, ainsi que le péritoine pariétal, recouvrant la cavité abdominale, forment un compartiment appelé la cavité péritonéale. Pendant le traitement de dialyse, le péritoine assure des échanges entre le sang et un fluide circulant à l’intérieur de la cavité
6
péritonéale via un cathéter préalablement installé. La dialyse péritonéale est une technique de suppléance rénale réalisable à domicile(11, 23).
2.3.1.3 Efficacité des traitements de dialyse
L’hémodialyse et la dialyse péritonéale possèdent la même efficacité dans le traitement des symptômes de l’IRC terminale(23). En fait, plusieurs études ont comparé l’impact des différents types de suppléance extra-rénale à court et à long terme. Cependant, aucune de ces études n’a soulevé des différences significatives entre l’hémodialyse et la dialyse péritonéale. Récemment, Mehrotra et al. a démontré qu’il n’y avait pas de différence significative entre le risque de mortalité chez des patients traités en HD et ceux en DP après un suivi de 5 ans(24). Tse et al. a appuyé ses résultats dans une étude de suivi d’une durée de 12 ans(25). Par ailleurs, la survie en bonne santé est similaire chez les patients traités en HD et en DP(26).
2.3.2 Greffe rénale
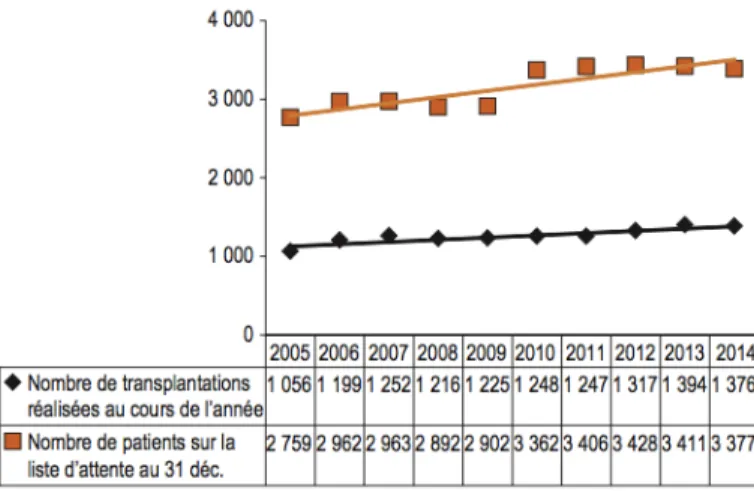
La greffe rénale est un traitement visant à transplanter le rein d’un donneur vivant ou décédé sur l’artère iliaque du receveur. En 1902, Dr Ullman fut le premier à tenter, sans succès, la greffe d’un rein de porc dans le coude d’une jeune femme souffrant d’IRC(27). Au fil du temps, plusieurs ont tenté diverses techniques de greffe rénale sans toutefois y parvenir. Or, en 1954, Dr Murray a réussi cet exploit, un succès récompensé par le prix Nobel de médecine en 1990. Il a réussi la première greffe rénale entre deux frères jumeaux identiques(28). Aujourd’hui, la greffe rénale est assurément le traitement de choix pour la majorité des patients en IRC terminale. Malheureusement, le faible nombre de donneurs limite l’accessibilité aux greffes rénales annuellement au Canada (Figure 2.2, tirée de ICIS, 2016(2)).
La transplantation rénale prolonge la survie des patients, améliore la qualité de vie et assure la reprise des fonctions biologiques essentielles du rein telles que le maintien de la composition liquidienne corporelle, l’excrétion de déchets métaboliques et la sécrétion d’hormones(29-31). Plus précisément, la greffe rénale diminue significativement le taux de mortalité annuel passant de 16,1 décès par 100 patients-années chez des patients dialysés à 3,8 décès par 100 patients-années chez les patients greffés(31). Parmi les facteurs de bon
7
pronostic, la greffe rénale d’un donneur vivant améliore la survie en réduisant le risque de complications post-transplantation et en diminuant le risque de rejet de greffon(32). En fait, le taux de survie à 5 ans d’un greffon provenant d’un donneur vivant est de 90,8% tandis que celui provenant d’un donneur décédé est estimé à 81,4%, une réduction significative de la survie de 9% sur 5 ans(2).
Figure 2.2 Nombre de transplantations rénales par année au Canada entre 2005 et 2014. Figure tirée avec permission de ICIS(2)
La perte de greffon est une complication redoutée qui peut être prévenue par le typage des antigènes d’histocompatibilité et par la prise de médication immunosuppressive(33). Un typage des antigènes est nécessaire pour s’assurer de la compatibilité du système ABO et des antigènes des leucocytes humains (HLA) entre le donneur et le receveur(34). Une incompatibilité provoque des interactions immunologiques entre les anticorps du receveur et les antigènes du donneur menant potentiellement à la perte du greffon. Cette réaction immune entraine des lésions sur le tissu rénal se manifestant par des atteintes de la fonction rénale et ultérieurement par la perte du greffon. Classiquement, ce processus immun est classifié en trois types de réactions soit le rejet hyperaigu, le rejet aigu ou encore le rejet chronique(35). L’arsenal thérapeutique aide aussi à prévenir cette réaction immunologique. Ce traitement comprend entre autres des corticostéroïdes, des inhibiteurs de la calcineurine (tacrolimus, cyclosporine), des agents cytostatiques antimétabolites (azathioprine, mofetilmycophénolate, méthotrexate) et des anticorps monoclonaux inhibiteurs de l’interleukine-2 (basiliximab, daclizumab,
8
rapamycine)(36). La greffe rénale est assurément une option thérapeutique très avantageuse en IRC terminale malgré le risque de complications immunologiques post-transplantation.
2.4 Complications cardiovasculaires
2.4.1 Chez les patients dialysés
Les maladies cardiovasculaires sont la principale cause de morbidité et de mortalité chez les patients en insuffisance rénale chronique. Plus la fonction rénale d’un patient se détériore, plus le risque de mortalité et de morbidité cardiovasculaire augmente(37). En effet, la prévalence de maladies coronariennes et d’hypertrophie ventriculaire gauche chez les patients en IRC terminale atteint 40% et 75%, respectivement(3). Les patients dialysés possèdent une prévalence d’insuffisance cardiaque touchant les 40%. Les maladies cardiovasculaires représentent 40% des hospitalisations(37) et près de 50% des décès des patients en IRC(38). La mortalité cardiovasculaire en insuffisance rénale chronique terminale est de 9% par année(3). La surmortalité cardiovasculaire est 10 à 20 fois plus élevée chez les patients dialysés comparativement à la population générale après les ajustements pour les facteurs potentiellement confondants tels que l’âge, l’ethnie, le genre et la présence de comorbidités(3) (Figure 2.3, tirée de Parfrey et al., 1999 (39)).
Figure 2.3 Mortalité cardiovasculaire stratifiée selon l’âge, l’ethnie et le genre chez les patients dialysés et la population générale. La surmortalité cardiovasculaire est 10 à 20 fois plus élevée chez les patients dialysés comparativement à la population générale après les ajustements pour les facteurs potentiellement confondants tels que l’âge, l’ethnie, le genre et la présence de comorbidités. Figure tirée avec permission de Parfrey et al.(39)
9 2.4.2 Chez les patients greffés
Heureusement, la greffe rénale diminue significativement le risque de maladies cardiovasculaires comparativement aux patients dialysés sans toutefois le normaliser à celui rapporté dans la population générale(4). Les maladies cardiovasculaires sont la principale cause de perte de greffon et de décès prématurés chez les patients greffés(40). Les maladies cardiovasculaires sont responsables de plus de 30% des décès chez les patients greffés(37, 41). Or, la proportion de décès cardiovasculaires augmente durant le suivi post-transplantation, passant de 21,6% des décès un an après une greffe à plus de 31% dix ans plus tard(42).
2.4.3 L’IRC : un facteur de risque cardiovasculaire
Récemment, l’insuffisance rénale chronique a été décrite comme un facteur de risque indépendant de maladies cardiovasculaires(43). L’IRC favorise le développement de l’athérosclérose et de l’artériosclérose, des phénomènes vasculaires prédisposant à l’apparition de MCV. En effet, l’athérosclérose, une maladie vasculaire d’origine inflammatoire, progresse de manière accélérée en IRC. L’athérosclérose, une réponse immunitaire contre les dépôts de cholestérol-lipoprotéine à basse densité (LDL) oxydé menant à la formation focale de plaques instables d’athérome, s’accélère dans un milieu urémique(44). Cependant, la surmortalité cardiovasculaire en IRC n’est pas seulement explicable par l’athérosclérose. En effet, au cours des dernières décennies, plusieurs études ont démontré l’importance de l’artériosclérose, un processus de rigidification de l’arbre artériel, comme un facteur de risque de mortalité cardiovasculaire en IRC(5-8). La rigidité artérielle est reconnue comme un marqueur de vieillissement vasculaire dans la population générale. Or, la rigidité artérielle est accélérée en IRC. Étonnement, ce phénomène de vieillissement vasculaire accéléré, manifesté par une rigidité aortique élevée, a été observé chez les enfants et les jeunes adultes en IRC(45, 46). En effet, plusieurs études ont démontré une progression accélérée de la rigidité artérielle liée à la perte de la fonction rénale(47-49). Malheureusement, les mécanismes accélérant la rigidité aortique en IRC restent à élucider.
10
CHAPITRE 3. RIGIDITÉ AORTIQUE
Le phénomène de rigidité aortique est reconnu comme un facteur de risque indépendant de maladies cardiovasculaires dans plusieurs populations. Ce phénomène de vieillissement vasculaire accéléré entraine des modifications à la structure et à la composition de l’arbre artériel et provoque des répercussions hémodynamiques sur les organes cibles. L’étude de l’onde de pouls permet d’évaluer la rigidité aortique et ses conséquences hémodynamiques.
3.1 Structure et composition de l’arbre artériel
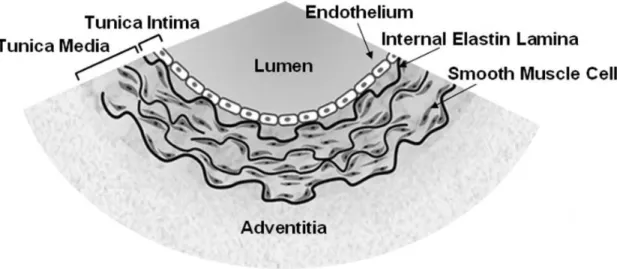
La paroi artérielle est principalement composée de 3 couches tissulaires concentriques, soit l’intima, la tunique médiale et l’adventice(50) (Figure 3.1, tirée de Wang et al., 2008(51)). L’intima, la couche tissulaire interne, est composée d’une monocouche de cellules endothéliales. La lame élastique interne, une structure complexe formée d’une membrane de fibres d’élastine, dissocie l’intima de la tunique médiale. La tunique médiale, la couche intermédiaire, est composée d’un assemblage concentrique de cellules musculaires lisses vasculaires, de fibres de collagène et de fibres d’élastine. La proportion des composantes formant la tunique médiale détermine les propriétés mécaniques du segment artériel(52). La lame élastique interne sépare la tunique médiale de l’adventice, une couche tissulaire formée d’une matrice extracellulaire lâche contenant des fibroblastes, des mastocytes et des terminaisons nerveuses(50).
Figure 3.1Structure et composition de la paroi artérielle. Figure tirée avec permission de Wang et al.(51)
11
Afin d’assurer diverses fonctions, la composition de la tunique médiale varie d’un segment artériel à l’autre. En effet, la proportion de cellules musculaires lisses, de fibres de collagène et de fibres d’élastine composant la tunique médiale fluctue. Ce sont ces composantes qui déterminent les propriétés mécaniques propres aux artères musculaires et élastiques.
3.1.1 Les artères musculaires
La tunique médiale est composée de beaucoup de cellules musculaires lisses vasculaires et de très peu de fibres élastiques. Les artères musculaires, des artères de conductance dont la principale fonction est de transporter le sang aux artérioles et aux organes cibles, possèdent une paroi relativement épaisse par rapport à leur diamètre de petit calibre. La haute concentration en cellules musculaires lisses vasculaires permet aux artères musculaires de moduler leur diamètre pour ajuster le débit sanguin selon les besoins des organes cibles(53). Les principales artères musculaires de l’arbre artériel sont, entre autres, l’artère brachiale, l’artère radiale, l’artère fémorale et les artères tibiales (antérieure et postérieure).
3.1.2 Les artères élastiques
L’aorte, le tronc brachiocéphalique, les artères carotides communes et les artères iliaques communes sont les principales artères élastiques de l’arbre artériel. Les artères élastiques, des artères de capacitance, possèdent une paroi vasculaire très mince malgré un diamètre de grand calibre et une tunique médiale composée majoritairement de fibres élastiques. Ces propriétés mécaniques permettent aux artères élastiques d’amortir la pulsatilité de la pression artérielle créée par la contraction du ventricule gauche. L’aorte permet de transformer le débit pulsatile généré par le ventricule gauche lors du cycle cardiaque en un débit continu permettant de perfuser adéquatement les organes cibles. La compliance vasculaire de l’aorte, soit sa capacité à se distendre et à reprendre sa forme initiale, assure une perfusion continue des organes cibles lors de la diastole. En effet, la compliance des artères élastiques assure un flot continu dépourvu de pulsation cardiaque au niveau des artérioles.
En vieillissant, les composantes du mur artériel s’altèrent favorisant ainsi la progression de la rigidité artérielle. En effet, les cellules endothéliales deviennent
12
irrégulières et dysfonctionnelles, les fibres d’élastine se fragmentent et sont remplacées par des fibres de collagènes et les cellules musculaires lisses vasculaires se calcifient et nécrosent(54). Ces changements histologiques et morphologiques sont responsables de l’apparition de la rigidité aortique, un facteur de risque non traditionnel dans le développement de morbidité et de mortalité cardiovasculaire.
3.2 La rigidité aortique: un facteur de risque de maladies
cardiovasculaires
Au cours des dernières décennies, de plus en plus d’études ont démontré l’importance de la rigidité aortique dans le développement des maladies cardiovasculaires. Aujourd’hui, la rigidité aortique est reconnue comme un prédicteur indépendant de maladies cardiovasculaires, de mortalité cardiovasculaire et de mortalité globale. En effet, une rigidité aortique élevée est associée à l’apparition d’évènements cardiovasculaires dans la population générale(55, 56), hypertendue(57, 58), coronarienne(59), diabétique(60, 61), âgée de plus de 70 ans(62) et en insuffisance rénale chronique terminale(63). Par ailleurs, la rigidité aortique élevée prédit également le risque de mortalité cardiovasculaire et globale dans une population générale en santé(56, 64, 65), hypertendue(66), diabétique(61, 67), âgée de plus de 70 ans(62, 68) et en insuffisance rénale chronique terminale(6, 7, 63). Dans une récente revue systématique avec méta-analyse, Vlachooulos et al., a comparé le risque d’évènements cardiovasculaires, de mortalité cardiovasculaire et de mortalité globale associée à une rigidité aortique élevée chez diverses populations. Ces résultats ont démontré que certains groupes de patients comme ceux hypertendus, âgés, coronariens et insuffisants rénaux sont plus à risque que la population générale(69). Ces récentes études ont contribué à reconnaitre l’importance clinique de la rigidité aortique dans le développement de maladies cardiovasculaires.
Malgré le récent engouement pour le phénomène de rigidité artérielle de la communauté scientifique, la rigidité artérielle est un concept connu jadis. Or, la notion de rigidité artérielle, basée principalement sur l’étude de l’onde de pouls, a intrigué de nombreux scientifiques par le passé. L’avancement des connaissances et des technologies a permis de faire évoluer la notion de rigidité artérielle au cours des siècles. Or, Hales fut l’un des premiers à s’intéresser à l’onde de pouls en 1733. Il a comparé l’onde de pression
13
artérielle parcourant l’arbre artériel à une lance à incendie, un modèle aujourd’hui reconnu comme le modèle de Windkessel. Plus tard, plusieurs autres physiciens tels que Poiseuille, Young, les frères Weber, Moens, Korteweg et Bright ont élaboré le modèle de propagation de l’onde de pouls en se basant sur de nouvelles connaissances sur les propriétés hydrauliques et élastiques de l’arbre artériel(52). D’autres scientifiques tels que Marey, Mahomed et Mackenzie ont développé plusieurs modèles de sphygmographes, des outils innovateurs permettant d’évaluer et d’analyser l’onde de pouls. Toutefois, l’étude des ondes de pouls s’est avérée beaucoup plus complexe sur le plan théorique et technique. Les segments artériels se distinguent par leurs mécanismes d’adaptation et leurs propriétés anisotropes et viscoélastiques(52, 70). Par exemple, aucun segment de l’arbre artériel ne possède les mêmes propriétés viscoélastiques empêchant toute extrapolation des propriétés d’un segment à un autre. Heureusement, des scientifiques comme Safar et O’Rourke se sont penchés sur ces obstacles afin de développer des paramètres simplifiant l’application clinique de ces concepts complexes. Ces paramètres sont basés, entre autres, sur les théories du modèle de Windkessel et de la propagation de l’onde de pouls(52, 70).
3.3 Modèles théoriques de l’arbre artériel
3.3.1 Modèle de WindkesselAu cours du XVIIIe siècle, Hales développa l’un des premiers modèles théoriques sur le comportement de l’arbre artériel. Ce modèle, le modèle de Windkessel, compare le système artériel à une lance à incendie où la cloche à air amortit les pulsations produites par la pompe manuelle assurant un débit continu de l’eau à travers les tuyaux. D’après son modèle, les artères élastiques de grand calibre agissent comme la cloche à air, les artères musculaires jouent le rôle des tuyaux tandis que les artérioles représentent la buse d’incendie(52, 71), séparant ainsi les fonctions d’amortissement et de conductance de l’arbre artériel (Figure 3.2.A, tirée de O’Rourke et al., 2002(72)). Cependant, le modèle de Windkessel comporte des limitations majeures. D’abord, l’arbre artériel ne possède pas des fonctions d’amortissement et de conductance distinctes. En effet, il y a une perte progressive de la fonction d’amortissement caractérisée par la réduction des fibres élastique dans la tunique médiale tandis qu’il y a une augmentation graduelle de la fonction de conductance en s’éloignant du cœur. Ensuite, le modèle de Windkessel ignore
14
l’hétérogénéité de la rigidité artérielle liée à la hausse des fibres musculaires des segments de l’arbre artériel. En fait, les artères musculaires périphériques sont plus rigides que les artères élastiques centrales dans une population saine. La rigidité des artères musculaires est influencée par le tonus vasomoteur qui dépend du système rénine-angiotensine, du système nerveux sympathique et de la fonction endothéliale(73, 74). Due aux limitations du modèle de Windkessel élaboré par Hales, la communauté scientifique a préféré adopter le modèle de propagation de l’onde de pouls pour représenter l’arbre artériel.
3.3.2 Modèle de propagation de l’onde de pouls
Le modèle de propagation de l’onde est une représentation plus juste et réaliste du comportement de l’onde de pression parcourant l’arbre artériel. D’après ce modèle, l’arbre artériel s’apparente à un simple tube gonflable ayant des propriétés élastiques homogènes dont l’une des extrémités représente les résistances périphériques et l’autre reçoit les pulsations de sang éjecté par le ventricule gauche (Figure 3.2.B, tirée de O’Rourke et al., 2002(72))(52, 70).
Figure 3.2 Les fonctions d’amortissement et de conductance de l’arbre artériel représentées par le modèle de Windkessel (A) et le modèle de propagation de l’onde
de pouls (B). Les fonctions d’amortissement et de conductance sont séparées selon les segments de l’arbre artériel dans le modèle de Windkessel alors que dans le modèle de propagation de l’onde de pouls chaque segment artériel assure ces deux fonctions. Figure
tirée avec permission de O’Rourke et al.(72)
Le modèle de propagation de l’onde de pouls, conceptualisé par Bramwell et Hill en 1922, considère que la vélocité à laquelle l’onde de pouls se propage est variable le long de l’arbre artériel. Bramwell et Hill ont élaboré une équation mathématique utilisée largement
15
de nos jours en recherche clinique permettant d’estimer la vélocité de l’onde de pouls (VOP)(75) :
𝑉𝑂𝑃 = √𝑉 𝑑𝑃 𝜌 𝑑𝑉
où ρ correspond à la densité du sang, dP est la pression, dV correspond au volume sanguin et V dP/ dV est l’inverse de la compliance de l’artère. L’équation illustre que la vélocité de l’onde de pouls varie inversement à la compliance des segments artériels. En d’autres mots, plus le segment artériel est rigide, plus l’onde de pouls se propage rapidement. Le modèle de propagation de l’onde schématisé par O’Rourke et d’autres à partir de l’équation de Bramwell et Hill permet d’expliquer la physiopathologie de la rigidité artérielle.
3.4 La vélocité de l’onde de pouls
Lors de la contraction cardiaque, le ventricule gauche éjecte une onde de pression incidente pulsatile dans l’aorte ascendante se propageant le long de l’arbre artériel. La vitesse de propagation de l’onde de pression, aussi appelée la vélocité de l’onde de pouls, est dépendante de la rigidité des segments artériels. La rigidité de la paroi artérielle varie d’un segment artériel à l’autre: les segments artériels centraux sont plus élastiques tandis que les artères périphériques sont plus rigides(76). Plus les segments artériels sont rigides, plus la vélocité de l’onde de pouls est élevée. Par exemple, l’onde de pouls se propage plus lentement au niveau des artères centrales (4-5 m/sec au niveau de l’aorte ascendante) et accélère progressivement au niveau des artères périphériques (8-9 m/sec au niveau des artères iliaques et fémorales et 15-35 m/sec au niveau des artères de petit calibre)(53, 71, 76).
La vélocité de l’onde de pouls est dépendante de l’élasticité des segments artériels, une propriété qui varie principalement selon la densité de la tunique médiale en fibres d’élastine et de collagène. La relation entre la rigidité artérielle et l’élasticité est complexe, suivant une courbe exponentielle avec l’augmentation de la pression artérielle. À basse pression, les fibres d’élastines sont mises en tension tandis que les fibres de collagène sont encore pliées. L’augmentation de la pression recrute graduellement l’implication des fibres de collagène ayant une forte résistance à la traction (Figure 3.3, tirée de McEniery et al.,
16
2007 (77)). Bref, à mesure que l’artère se distend (c.-à-d. secondairement à l’augmentation de la pression), plus celle-ci devient rigide. La dépendance intrinsèque de la VOP à la pression artérielle explique les changements de VOP observé lors du cycle cardiaque. En effet, les changements de pression lors de la systole et de la diastole font varier la VOP entre 0.7 et 4 m/sec, une variation qui n’est assurément pas induite par un remodelage des composantes du mur artériel(78, 79). La courbe exponentielle entre la pression et le diamètre possède une grande variabilité interindividus, variant selon l’âge, la génétique, les antécédents cardiovasculaires et le tonus des cellules musculaires lisses vasculaires(79).
Figure 3.3 Relation exponentielle entre la pression artérielle et le diamètre artériel au niveau de l’aorte. À basse pression, les fibres d’élastines sont mises en tension tandis que
les fibres de collagène sont encore pliées. L’augmentation de la pression recrute graduellement l’implication des fibres de collagène ayant une forte résistance à la traction(77). Le vieillissement vasculaire ou la perte de fibres d’élastine favorise la mise en
tension des fibres de collagène à des pressions plus basses et, par conséquent, augmente la pression pulsée. Figure tirée avec permission de McEniery et al.(77)
Par conséquent, afin de prendre en compte la dépendance intrinsèque de la VOP à la pression artérielle, des ajustements statistiques sont nécessaires. Dans la majorité des études transversales, l’ajustement la VOP pour la pression artérielle est généralement effectué à l’aide d’une régression linéaire en utilisant la pression artérielle moyenne (c-à.-d. la
17
composante non pulsatile de la pression artérielle) de la cohorte. Cependant, cette méthode statistique a des limitations puisqu’elle ne considère pas les changements interindividuels de la courbe pression-diamètre ni la nature non linéaire de cette relation. Ainsi, la dépendance intrinsèque de la VOP avec la pression artérielle a mené à la quête d’un nouveau paramètre de rigidité artérielle indépendant à la pression artérielle.
3.5 Index de rigidité aortique β0
Hayashi et al.(80) a été le premier à proposer l’index de rigidité aortique β0, un paramètre de rigidité artérielle local indépendant de la pression artérielle. Dérivé à partir de l’index de rigidité aortique β0, la rigidité artérielle β est communément utilisée comme un paramètre de rigidité artérielle indépendant de la pression artérielle. Par contre, la rigidité artérielle β est obtenue en substituant la pression et le diamètre de référence (de la formule originale proposée par Hayashi et al.(80)) par la pression et le diamètre diastoliques. D’après Spronck et ses collègues(81), cette substitution induit une dépendance à la pression artérielle. Spronck et al.(81) a surmonté cette limitation en proposant d’appliquer une pression de référence au paramètre de la rigidité artérielle β afin d’obtenir l’index de rigidité artérielle β0, un paramètre de rigidité artérielle théoriquement indépendant à la pression artérielle. Ainsi, cette approche peut être appliquée à la VOP basée sur l’équation de Bramwell-Hill afin d’obtenir un paramètre de rigidité artérielle régionale théoriquement indépendant à la pression artérielle.
3.6 Conséquences hémodynamiques liées à la rigidité aortique élevée
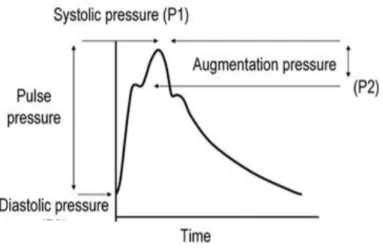
L’augmentation de la rigidité aortique provoque des changements hémodynamiques ayant des répercussions sur les organes cibles. Plus précisément, une rigidité aortique élevée entraine des changements hémodynamiques sur la réflexion d’onde et l’amplification de l’onde de pression.3.6.1 Réflexion d’onde
En systole, la contraction du ventricule gauche génère une onde de pression incidente s’éloignant du cœur. Cependant, une partie de chaque onde de pouls incidente est réfléchie à différents sites de réflexions et retourne au cœur à sens contraire. Les ondes réfléchies sont des ondes rétrogrades générées par la réflexion des ondes incidentes sur des sites de
18
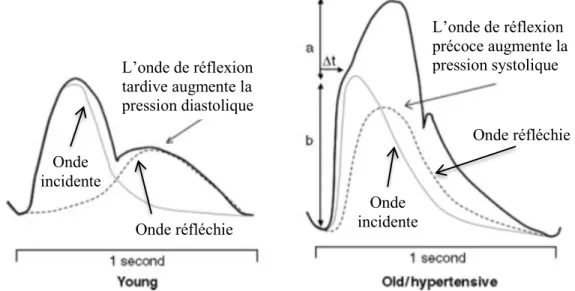
réflexion. Généralement, les multiples sites de réflexion sont situés au niveau des artères périphériques, des segments artériels à haute résistance. Par exemple, les sites de bifurcations, de changements de calibre et de changements d’élasticité le long de l’arbre artériel sont des sites de réflexion de l’onde incidente. D’ailleurs, les sites de réflexion peuvent être modulés par le tonus vasomoteur. Chez des patients sains, l’onde est réfléchie durant la diastole assurant un flot de pression continu permettant ainsi une meilleure perfusion myocardique. À l’inverse, le retour précoce de l’onde réfléchie en systole augmente la post-charge du cœur et diminue la perfusion myocardique des artères coronaires en diastole. Le moment de retour de l’onde de pression réfléchie dépend de la vélocité de l’onde de pouls et de la localisation des sites de réflexion (Figure 3.4, tirée de Greenwald et al., 2007(82)).
Figure 3.4 Conséquences hémodynamiques des ondes réfléchies chez des sujets jeunes et âgés. Figure tirée avec permission de Greenwald et al.(82)
Une vélocité de l’onde de pouls élevée, une conséquence hémodynamique observable chez des patients âgés, hypertendus ou insuffisants rénaux, est responsable d’une onde de réflexion précoce en systole. En effet, plus l’onde incidente et l’onde réfléchie se propagent rapidement, plus le temps nécessaire pour que l’onde de pouls incidente frappe un site de réflexion et retourne au cœur est court. Inversement, le temps nécessaire pour parcourir la même distance est plus grand lorsque les ondes de pouls voyagent plus lentement.
Onde incidente Onde incidente Onde réfléchie L’onde de réflexion tardive augmente la pression diastolique Onde réfléchie L’onde de réflexion précoce augmente la pression systolique
19
D’ailleurs, la localisation des sites de réflexion est impliquée dans le moment de retour de l’onde de pouls. Chez des patients sains, les sites de réflexion se situent à une distance théorique d’environs 40-55 cm du cœur(52). Cependant, si les sites de réflexion se rapprochent du cœur, les ondes de réflexion vont se mêler aux ondes incidentes plus précocement durant le cycle cardiaque. L’altération de l’élasticité de segments artériels et la vasoconstriction sont des changements hémodynamiques rapprochant les sites de réflexion du cœur. En effet, la vasoconstriction des artères et des artérioles rapproche les sites de réflexion du coeur entrainant des ondes de réflexion précoces(83-85).
Ainsi, autant les artères de petits et de grands calibres sont responsables de la réflexion précoce de l’onde ayant comme conséquences une surcharge de pression au ventricule gauche en systole et une baisse marquée de pression en diastole nuisible à la perfusion myocardique.
3.6.2 Le phénomène d’amplification
Les ondes réfléchies contribuent aussi à l’amplification de l’onde de pression, un phénomène d’augmentation progressive de l’amplitude de l’onde de pression en s’éloignant du coeur. En s’éloignant du cœur, l’amplitude de l’onde de pouls augmente tandis que la pression moyenne diminue progressivement. Ce phénomène d’amplification est causé par le gradient de rigidité, soit l’augmentation graduelle de la rigidité des artères distales. Par conséquent, l’amplitude de l’onde de pression est plus élevée au niveau des artères périphériques par rapport aux artères centrales. Chez les jeunes, l’amplitude de l’onde de pression augmente d’environ 60% durant la transmission. Toutefois, le phénomène d’amplification de l’onde de pression a tendance à s’atténuer en vieillissant, voire même à s’estomper vers l’âge de 70 ans(52) (Figure 3.5, tirée de Safar et al., 2003(86)). L’atténuation de l’onde de pression a également été rapportée dans des conditions pathologiques comme chez des patients hypertendus et en IRC, où la disparition du phénomène d’amplification est un prédicteur indépendant de mortalité(87). Les mécanismes atténuant l’effet d’amplification en vieillissant demeurent encore à élucider, mais pourraient inclure la dégénérescence artérielle, la diminution de la compliance et l’augmentation de la vélocité de l’onde de pouls(52).
20
Figure 3.5 Changement du profil de l’onde de pouls le long de l’arbre artériel chez des sujets de 24, 54 et 68 ans. L’amplitude de l’onde pouls s’estompe en vieillissant. Figure
tirée avec permission de Safar et al.(86)
Le phénomène d’amplification de l’onde de pression est responsable des différences de pression mesurées entre les segments centraux et périphériques. En effet, la pression systolique et la pression pulsée augmentent entre les segments centraux et périphériques. Par exemple, chez des jeunes sujets, la pression systolique et la pression pulsée centrale sont significativement inférieures à la pression systolique et à la pression pulsée périphérique, atteignant généralement une différence de 14 mm de Hg(72). Au contraire, aucune différence n’a été remarquée entre la pression diastolique et moyenne d’origine centrale et périphérique. Par conséquent, la pression artérielle brachiale est une mesure inexacte de la pression artérielle centrale, surtout chez des jeunes sujets.
3.7 Conséquences hémodynamiques de la rigidité aortique sur la
microcirculation
Dans des conditions physiologiques, les artères élastiques de grand calibre participent à l’amortissement des pulsations générées par le ventricule gauche tandis que les artères musculaires de petits et de moyens calibres participent davantage à acheminer un flot
21
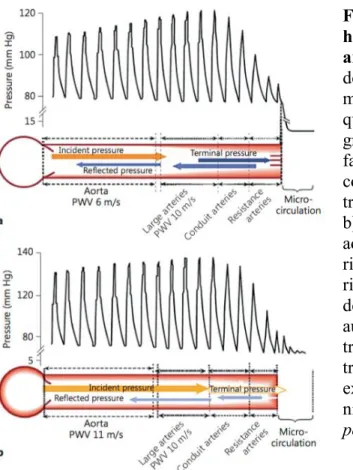
adéquat pour la perfusion des organes périphériques(88). L’hétérogénéité des fonctions, la géométrie et la composition histologique de la paroi artérielle des segments de l’arbre artériel est bénéfique pour la microcirculation des organes cibles. En effet, la perte de fibres élastiques et la réduction du diamètre des vaisseaux artériels en s’éloignant du cœur créent un gradient de rigidité, observable par une augmentation graduelle de la rigidité des artères de l’aorte en périphérie. À mesure que l’onde incidente voyage le long de l’arbre artériel, une partie de l’onde est réfléchie vers le cœur aux sites de réflexion créée par les changements de rigidité et de diamètre des segments artériels(89). Par conséquent, les ondes réfléchies et l’élasticité de l’aorte contribuent à une meilleure perfusion coronaire sans toutefois augmenter la post-charge du ventricule gauche. D’ailleurs, la réduction progressive de l’onde incidente en s’éloignant du cœur assure une perfusion périphérique adéquate, où la pulsatilité doit être minimale. Le gradient de rigidité a des effets bénéfiques sur les organes cibles en créant des ondes de réflexion qui atténue la pression pulsée transmise à la microcirculation et perfuse les artères coronaires en diastole (Figure 3.6a, tirée de Briet et al., 2012(90)).
À l’inverse, la perte ou même le renversement du gradient de rigidité artérielle secondaire à l’augmentation de la rigidité aortique a des répercussions néfastes au niveau des organes cibles. La perte du gradient de rigidité favorise la transmission d’une pression pulsée au niveau de la microcirculation puisqu’il y a moins de sites de réflexion et d’ondes réfléchies (Figure 3.6b, tirée de Briet et al., 2012(90)). La transmission d’une pulsatilité accrue dans la microcirculation entraine un remodelage des cellules musculaires lisses, des dysfonctions endothéliales, une hypoperfusion et, voire même, une dysfonction des organes cibles(91).
L’augmentation de la rigidité aortique contribuant à l’atténuation du gradient de rigidité artérielle a des répercussions sur les reins, le cerveau et le cœur. La hausse de la rigidité aortique, de la pression pulsée centrale et de la pulsatilité de l’onde de pression incidente au niveau de la microcirculation est associée à l’augmentation de la pulsatilité du flot sanguin de l’artère rénale entrainant des lésions microvasculaires aux reins(92). Ces changements hémodynamiques expliquent les nombreuses associations positives entre la pression pulsée, la protéinurie et les dysfonctions rénales(93-95).