HAL Id: dumas-01620342
https://dumas.ccsd.cnrs.fr/dumas-01620342
Submitted on 20 Oct 2017
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
radio-induites
Céline Salomon
To cite this version:
Céline Salomon. La Pilocarpine dans le cadre des xérostomies radio-induites. Chirurgie. 2017. �dumas-01620342�
Collège des Sciences de la Santé UFR des Sciences Odontologiques
Année 2017 N°64
Thèse pour l’obtention du :
DIPLOME D’ETAT DE DOCTEUR EN CHIRURGIE DENTAIRE
Présentée et soutenue publiquement par : Céline, Annaëlle SALOMON Née le 05 Octobre 1991 à Courcouronnes
Le 11 Septembre 2017
La Pilocarpine dans le cadre des
xérostomies radio-induites
Directeur de thèse : Pr Jean-Christophe FRICAIN
Membres du jury :
Président : M. J-C FRICAIN Professeur des Universités
Rapporteur : M. S. CATROS Maître de Conférences des Universités Assesseur : Mme M-C BADET Maître de Conférences des Universités Assesseur : Mme M. FENELON Assistante Hospitalo-universitaire
UNIVERSITE DE BORDEAUX
Président M. TUNON DE LARA Manuel
Directeur de Collège des Sciences de la Santé M. PELLEGRIN Jean-Luc
COLLEGE DES SCIENCES DE LA SANTE UNITE DE FORMATION ET DE
RECHERCHE DES SCIENCES ODONTOLOGIQUES
Directrice Mme BERTRAND Caroline 58-02 Directeur Adjointe - Chargée de la Formation initiale Mme ORIEZ-PONS Dominique 58-01 Directeur Adjoint – Chargé de la Recherche M. FRICAIN Jean-Christophe 57-02 Directeur Adjoint – Chargé de la Recherche Directeur Adjoint – Chargé des Relations Internationales
M.LASSERREJean-François 58-02
ENSEIGNANTS DE L'UR
PROFESSEURS DES UNIVERSITES
Mme Caroline BERTRAND Prothèse dentaire 58-02
Mme Marie-José BOILEAU Orthopédie dento-faciale 56-02
Mme Véronique DUPUIS Prothèse dentaire 58-02
M. Bruno ELLA NGUEMA Sciences anatomiques et physiologiques - Biomatériaux 58-03 M. Jean-Christophe FRICAIN Chirurgie buccale – Pathologie et thérapeutique 57-02
MAITRES DE CONFERENCES DES UNIVERSITES
Mme Elise ARRIVÉ Prévention épidémiologie – Economie de la santé – Odontologie 56-03 légale
Mme Cécile BADET Sciences biologiques 57-03
M. Etienne BARDINET Orthopédie dento-faciale 56-02
M. Michel BARTALA Prothèse dentaire 58-02
M. Cédric BAZERT Orthopédie dento-faciale 56-02
M. Christophe BOU Prévention épidémiologie – Economie de la santé – Odontologie 56-03 légale
Mme Sylvie BRUNET Chirurgie buccale – Pathologie et thérapeutique 57-02 M. Sylvain CATROS Chirurgie buccale – Pathologie et thérapeutique 57-02 M. Stéphane CHAPENOIRE Sciences anatomiques et physiologiques 58-03 M. Jacques
COLAT
PARROS Sciences anatomiques et physiologiques 58-03 M, Jean-Christophe COUTANT Sciences anatomiques et physiologiques 58-03
M. François DARQUE Orthopédie dento-faciale 56-02
M. François DE BRONDEAU Orthopédie dento-faciale 56-02
M. Yves DELBOS Odontologie pédiatrique 56-01
M. Raphael DEVILLARD Odontologie conservatrice- Endodontie 58-01
M. Emmanuel D'INCAU Prothèse dentaire 58-02
M. Dominique GILLET Odontologie conservatrice – Endodontie 58-01
M. Jean-François LASSERRE Prothèse dentaire 58-02
M. Yves LAUVERJAT Parodontologie 57-01
M. Jean-Marie MARTEAU Chirurgie buccale – Pathologie et thérapeutique 57-02
Mme Javotte NANCY Odontologie pédiatrique 56-01
M. Adrien NAVEAU Prothèse dentaire 58-02
Mme Dominique ORIEZ Odontologie conservatrice – Endodontie 58-01 M. Jean-François PELI Odontologie conservatrice – Endodontie 58-01
M. Philippe POISSON
Prévention épidémiologie – Economie de la santé – Odontologie
56-03 légale
M. Patrick ROUAS Odontologie pédiatrique 56-01
M. Johan SAMOT Sciences biologiques 57-03
Mme Maud SAMPEUR Orthopédie dento-faciale 56-02
M. Cyril SEDARAT Parodontologie 57-01
Mme Noélie THEBAUD Sciences biologiques 57-03
M. Eric VACHEY Odontologie conservatrice – Endodontie 58-01
ASSISTANTS
Mme Audrey AUSSEL Sciences anatomiques et physiologiques 58-03 M. Wallid BOUJEMAA AZZI Odontologie conservatrice – Endodontie 58-01 Melle Camille BOULÉ-MONTPEZAT Odontologie pédiatrique 56-01
Melle Anaïs CAVARÉ Orthopédie dento-faciale 56-02
M. Hubert CHAUVEAU Odontologie conservatrice – Endodontie 58-01
M. Mathieu CONTREPOIS Prothèse dentaire 58-02
M. Jean-Baptiste CULOT Sciences anatomiques et physiologiques 58-03 Mme Clarisse DE OLIVEIRA Orthopédie dento-faciale 56-02 M. Cédric FALLA Prévention épidémiologie – Economie de la santé – Odontologie 56-03
légale
Mme Mathilde FENELON Chirurgie buccale – Pathologie et thérapeutique 57-02
Mme Elsa GAROT Odontologie pédiatrique 56-01
Mme Agathe GREMARE Sciences biologiques 57-03
Mme Olivia KEROUREDAN Odontologie conservatrice – Endodontie 58-01
M. Adrien LASTRADE Prothèse dentaire 58-02
M. Alexandre MARILLAS Odontologie conservatrice – Endodontie 58-01 M. Emmanuel
MASSON-REGNAULT Chirurgie buccale – Pathologie et thérapeutique 57-02
Mme Marie MÉDIO Orthopédie dento-faciale 56-02
Mme Meriem MESFIOUI Parodontologie 57-01
Mme Darrène NGUYEN Sciences biologiques 57-03
M. Ali NOUREDDINE Prothèse dentaire 58-02
Mme Chloé PELOURDE Orthopédie dento-faciale 56-02
M. Antoine POPELUT Parodontologie 57-01
Mme Charlotte RAGUENEAU Prothèse dentaire 58-02
Mme Noëlla RAJONSON Prévention épidémiologie – Economie de la santé – Odontologie 56-03 légale
M. Clément RIVES Odontologie conservatrice – Endodontie 58-01
M. Thibaut ROULLAND Prothèse dentaire 58-02
M. François ROUZÉ L'ALZIT Prothèse dentaire 58-02
Mme Audrey SAY LIANG FAT
Prévention épidémiologie – Economie de la santé – Odontologie
56-03 Légale
À notre Président et Directeur de thèse, Monsieur le Professeur Jean-Christophe FRICAIN Professeur des Universités – Praticien Hospitalier
Sous-section Chirurgie-buccale pathologies thérapeutiques 57-02
Je vous remercie de m’avoir fait l’honneur de diriger et présider ma thèse, de votre implication et de votre réactivité lors de mes sollicitations. Veuillez trouver ici l’expression de ma profonde reconnaissance.
À notre Rapporteur de thèse, Monsieur le Docteur Sylvain CATROS
Maître de Conférences des Universités – Praticien Hospitalier Sous-section Chirurgie-buccale pathologies thérapeutiques 57-02
Je vous remercie pour votre participation à l’évaluation de ce travail et votre rapidité. Veuillez trouver ici l’expression de ma reconnaissance.
À notre Assesseur,
Madame le Docteur Marie-Cécile BADET
Maître de Conférences des Universités – Praticien Hospitalier Sous-section Sciences Biologiques 57-03
Je vous remercie chaleureusement de me faire l’honneur de siéger dans ce jury de thèse. Je vous remercie pour votre enseignement de qualité et votre implication clinique.
Veuillez trouver ici l’expression de ma reconnaissance.
À notre Assesseur,
Madame le Docteur Mathilde FENELON Assistante Hospitalo-Universitaire
Sous-section Chirurgie-buccale pathologies thérapeutiques 57-02
Je vous remercie d’avoir accepté de siéger dans mon jury de thèse Veuillez trouver ici l’expression de ma reconnaissance.
Remerciements personnels :
À mes parents, les mots ne suffiront pas pour exprimer ma profonde reconnaissance envers
vous. Merci pour l’éducation que vous m’avez instaurée, le goût du travail, et de l’effort que vous m’avez enseigné. Vous n’avez jamais cessé d’être là pour moi et de m’accompagner tout au long de mes études malgré les hauts et les bas. Je ne vous remercierais jamais assez pour tous les sacrifices que vous avez fait pour moi. Je vous aime !
À Binou, Merci de m’avoir supportée et rassurée lors de mes périodes de stress. Merci de ta
patience et d’être là au quotidien à mes côtés !
À ma famille : Frères, oncles, tantes, grand-mère et grand-père, cousins et cousines. Merci
pour vos encouragements. C’est toujours un réel plaisir de revenir me ressourcer au soleil auprès de vous.
À Annaïc et Sophie, mes amies d’enfance, séparées aux quatre coins de la France et de la
Martinique mais toujours aussi liées et pour encore longtemps je l’espère. C’est vous les seules vraies.
À Vince, petit homme unique dans son genre, je suis vraiment fière de toi et de ton parcours
et heureuse de savoir que tu n’es jamais très loin au quotidien !
À mes copines de promo et futures consœurs :
Isabelle, c’est grâce à toi que j’ai autant apprécié ces années d’étude. Ce n’aurait pas été pareil si tu n’avais pas été là. Fière de toi et de ton parcours !
Sophia, merci pour ton aide durant cette période thèse, de ta bonne humeur et tes éternels potins !
Myriam et Penelope, mes futures orthodontistes.
Sans oublier cette superbe et inoubliable mission humanitaire thaïlandaise avec vous, Marielle et Liza.
Table des matières
I. Introduction ... - 8 - II. Méthode ... - 10 - II.1. Critères d’inclusion ... - 10 - II.2. Stratégie de recherche ... - 11 - II.3. Stratégie de sélection des articles ... - 11 - II.4. Stratégie de collecte des données ... - 12 - III. Résultats ... - 13 - III.1. Choix des articles inclus dans la revue systématique ... - 13 - III.2. Caractéristiques des articles sélectionnés ... - 15 - III.3. Objectif 1: Efficacité de la Pilocarpine dans le cadre des xérostomie radio-induite ... - 16 - III.3.1. Caractéristique des études ... - 16 - III.3.2. Principaux résultats ... - 21 - III.3.3 Analyse ... - 24 - III.4. Objectif 2: Effet radioprotecteur de la Pilocarpine dans le cadre des xérostomie radio induite - 27 - III.4.1. Caractéristiques des études ... - 27 - III.4.2. Principaux résultats ... - 34 - III.4.3. Analyse ... - 40 - IV. Discussion ... - 42 - IV.1. Efficacité de la Pilocarpine administrée après la radiothérapie ... - 42 - IV.2. Efficacité de la Pilocarpine administrée pendant la radiothérapie ... - 43 - V. Conclusion ... - 46 - VI. Bibliographie ... - 47 -
I. Introduction
En 2015, le nombre de nouveaux cas de cancers des voies aérodigestives supérieures était estimé à 11610 en France, soit 3% de l’incidence des cancers. Il s’agit de la 8e localisation cancéreuse et de la 9e cause de décès (1).La radiothérapie (RT) joue un rôle prédominant dans la thérapeutique multidisciplinaire des cancers des voies aérodigestives supérieures. Associée à la chirurgie, elle peut être exclusive, concomitante à de la chimiothérapie ou associée à des biothérapies. La radiothérapie conformationnelle avec modulation d’intensité (RCMI) utilisée de nos jours a recours à multiples faisceaux d’intensité variable permettant d’utiliser une dose de radiation élevée sur les cibles tumorales tout en épargnant les tissus sains à proximité de la tumeur (2).
Cependant, au-delà d’une dosimétrie de 30 Gray, la radiothérapie est responsable d’effets secondaires pouvant s’avérer irréversibles (2). Dans le cas des cancers des voies aérodigestives supérieures, la xérostomie fait partie de ces effets. Les glandes salivaires mineures et majeures étant incluses dans la zone de radiation. Même si la xérostomie est considérée comme étant un effet secondaire mineur, elle a un impact physiologique et psychologique. L’insuffisance salivaire est responsable de caries cervicales, altération des muqueuses, dysgueusie, difficultés lors de la mastication, d’altération du sommeil, et diminution de la rétention des prothèses adjointes (3), (4).
La pilocarpine (ou Chlorhydrate de Pilocarpine) est un agent parasympathomimétique cholinergique qui augmente la sécrétion des glandes exocrines (sudoripares, salivaires, lacrymales, gastriques, pancréatiques, intestinales ainsi que celles des cellules muqueuses des voies respiratoires). Elle est communément prescrite en France dans
le cas des syndromes de Gougerot-Sjögren. Cependant, elle est encore peu connue et très peu prescrite dans le cadre des xérostomies post-radiques. L’objectif principal de ce travail était d’évaluer, grâce à une revue de la littérature, l’efficacité de la Pilocarpine dans le cadre des xérostomies postradiothérapie. Les objectifs secondaires étaient : - De rechercher un éventuel effet radioprotecteur et préventif de la pilocarpine dans le cas où elle est administrée pendant la radiothérapie et avant l’apparition des symptômes de la xérostomie.
- D’établir un protocole de prescription de la Pilocarpine en fonction de l’efficacité et des effets indésirables.
II. Méthode
II.1. Critères d’inclusion
Les critères d’inclusion pour le choix des articles inclus dans la revue systématique étaient les suivants : - Type d’étude : Essai clinique comparatif. - Date de publication : 1990 à nos jours. La date de publication a été limitée à 1990 afin de privilégier les données les plus récentes - Langue : Anglais ou Français
- Population étudiée : Patients avec un cancer des voies aérodigestives supérieures diagnostiqué ayant ou devant recevoir un traitement par radiothérapie
- Objectifs :
o Objectif 1 : Evaluer l’efficacité de la Pilocarpine dans le cadre des xérostomies radio-induite
o Objectif 2 : Evaluer l’effet radioprotecteur de la Pilocarpine administrée pendant la radiothérapie
- Paramètres étudiés :
o Symptômes subjectifs de la xérostomie : sensation bouche sèche, inconfort, capacités concernant la mastication, le sommeil, l’élocution, le port de prothèses. o Symptômes objectifs de la xérostomie : mesure du flux salivaire avec ou sans stimulation, effets secondaires. - Formé galénique de la Pilocarpine : comprimés
II.2. Stratégie de recherche
Une recherche électronique a été réalisée et plusieurs bases de données ont été interrogées : - PUBMED - SCOPUS - COCHRANE Les termes suivants ont été combinés pour cette recherche : Pilocarpine, radiotherapy, xerostomia, radiations, head and neck cancer. Une recherche a été réalisée par la suite en explorant les références bibliographiques des articles précédemment sélectionnés dans les bases de données. II.3. Stratégie de sélection des articles Les articles ont été sélectionnés en 4 étapes : - 1e étape : Lecture des titres - 2e étape : Lecture des résumés - 3e étape : Lecture du corps de l’articles puis sélection des articles présentant les critères d’inclusion prédéfinis - 4e étape : Tri des articles sélectionnés selon leurs objectifs :
• Objectif 1 : Evaluer l’efficacité de la Pilocarpine dans le cadre des xérostomies radio-induite
• Objectif 2 : Evaluer l’effet radioprotecteur de la Pilocarpine administrée pendant la radiothérapie
II.4. Stratégie de collecte des données
Les articles sélectionnés ont ensuite été analysés. Les données extraites ont été classées pour les 2 objectifs en différentes catégories :
- Titre, Auteurs, revue, date de publication - Population étudiée
- Paramètres de la radiothérapie
- Méthodologie : Dosage, fréquence et durée du traitement Pilocarpine/Placebo - Paramètres étudiés - Principaux résultats Les données ont été ensuite analysées et comparées.
III. Résultats
III.1. Choix des articles inclus dans la revue systématique L’interrogation des bases de données a permis d’obtenir un total de 438 articles. Suite à l’analyse de ces articles, 14 articles ont été retenus.L’exploration des références bibliographiques des articles sélectionnés a permis d’obtenir un article supplémentaire. Au total, 15 articles ont été sélectionnés dont 4 articles correspondants à l’objectif 1 et 11 correspondants à l’objectif 2. La figure 1 décrit la procédure de sélection des articles ainsi que les motifs d’exclusion.
Figure 1. Schéma de la procédure sélection des articles Recherche sur bases de données Références bibliographiques PUBMED 148 articles SCOPUS 283 articles COCHRANE 47 articles 1 article 99 articles exclus 233 articles exclus 31 articles exclus Lecture des titres Lecture des résumés 34 Articles exclus • Hors-sujet : 18 • Forme galénique : 6 • Type d’étude : 7 • Date de publication : 2 • Langue : 1 34 Articles exclus • Hors-sujet : 13 • Type d’étude : 11 • Forme galénique : 5 • Date de publication : 2 • Doublons : 2 • Langue : 1 3 Articles exclus • Date : 1 • Forme galénique : 1 • Type étude : 1 Lecture de l’article entier 3 Articles exclus - Forme galénique : 2 - Population étudiée : 1 - 1 Articles exclus • Type étude : 1 Articles retenus dans la revue systématique : OBJECTIF 1 : 4 articles retenus OBJECTIF 2 : 11 articles retenus 1 Articles exclus - Doublon : 1
III.2. Caractéristiques des articles sélectionnés
Les articles sélectionnés étaient des études cliniques expérimentales prospectives comparatives et randomisées.
Ont été exclus des études : les mineurs, les patients présentant une espérance de vie inférieure à 6 mois ou nécessitant pendant l’étude clinique, un traitement oncologique.
Les patients avec un historique médical présentant une sclérose, bronchite chronique, maladie pulmonaire obstructive chronique, asthme, diabète, pathologies ophtalmiques (glaucome, antécédents de chirurgie, prescription ophtalmique de Pilocarpine), grossesse, ou absence de contraception chez les femmes non ménopausées ont également été exclus.
Les paramètres objectifs ont été recueillis grâce à des mesures salivaires exprimées en millilitres par minutes (ml/min), ou en grammes (g) (15), (16) avec et/ou sans stimulation salivaire au préalable.
Les données subjectives ont été collectées par des questionnaires et une échelle analogique visuelle croissante ou décroissante (EVA) sur 100 millimètres (mm) ou numérique. Les patients ont été questionnés sur la sensation de bouche sèche, de confort oral et sur leurs capacités concernant la mastication, l’élocution, le sommeil et le port de leurs prothèses dentaires.
L’échelle de LENT SOMA (= Late Effects of Normal Tissues Subjective, Objective, Management and Analytic) (20), utilisée dans trois articles (11), (17), (19), est un système international d’évaluation des effets tardifs dus aux radiations au niveau des tissus sains. Il comprend quatre grades des symptômes mineurs ne nécessitant pas de traitement, aux dégâts fonctionnels irréversibles nécessitant des interventions chirurgicales majeures.
III.3. Objectif 1 : Efficacité de la Pilocarpine dans le cadre des xérostomie radio-induite III.3.1. Caractéristique des études Un nombre total de 684 patients ont été inclus dans les quatre études sélectionnés dont 392 dans le groupe Pilocarpine et 292 dans le groupe contrôle.
Les patients inclus dans les études sélectionnées devaient présenter un cancer des voies aérodigestives diagnostiqué et avoir reçu de la radiothérapie d’une dose supérieure à 40Gy, incluant au moins une glande parotide, au moins 4 mois avant le début de l’étude. Les patients présentaient donc déjà à différents degrés des symptômes objectifs et subjectifs d’une xérostomie radio-induite.
Différents dosages en milligrammes (mg) de Pilocarpine ont été administrés : 2,5mg, 5mg et 10mg, 3 ou 4 fois par jours pendant une durée allant de 3 à 36 mois dans le but d’évaluer son efficacité à différents dosages, sur le court et le long-terme.
L’efficacité du traitement Pilocarpine a été contrôlée face à un traitement placebo, excepté dans l’article d’Abbasi (8) ou le groupe contrôle est représenté par un traitement à la Bromhexine, agent mucolytique.
Les paramètres objectifs et subjectifs ont été étudiés avant le début de l’étude, pendant et après le traitement, pendant une durée allant 3 à 36 mois pour évaluer l’efficacité dans le temps de la Pilocarpine. Les effets secondaires apparus ont été relevés et évalués pour chaque dose, selon leur sévérité. Le tableau suivant résume les principales caractéristiques des 4 articles sélectionnés ayant pour objectif d’évaluer l’efficacité de la Pilocarpine après la radiothérapie en
incluant la population étudiée, les paramètres de la radiothérapie, la méthodologie (dosage et fréquence du traitement) et les paramètres étudiés.
Population étudiée Méthodologie Paramètres étudiées Articles (Titre, Auteur, Publication, Date) N (Pilocarpine/ Contrôle) Paramètres
radiothérapie Groupe Pilocarpine Groupe contrôle Fréquence Objectifs Subjectifs
Oral Pilocarpine for post-irradiation xerostomia in patients with head and neck cancer. Johnson Johnson JT et al. N Engl. J Med (1993 ) (5) N=207 Groupe 1 : n = 73 Groupe 2 : n = 69 Groupe contrôle : n= 65 40>Dose (Gy) <65 Durée traitement : 12 semaines Groupe 1 : 5mg Groupe 2 : 10mg 3 fois par jours Placebo Avant le début de l’étude puis toutes les 4 semaines - Mesure débit salivaire avec et sans stimulation - Mesure débit salivaire de la parotide avec et sans stimulation - Effets secondaires Questionnaire + EVA sur 100mm
A multicenter maintenance study of oral Pilocarpine tablets for radiation-induced xerostomia Jacobs CD et al. Oncology (1996) (6) N = 265 (150/115) ≥ 40 Gy ≥ 4mois avant le début du traitement Durée traitement : 36 mois - Dose de départ : 5mg - Ajustement selon les réponses observées à 2,5, 5 ou 10mg - 3 fois par jours Placebo 3 jours avant la fin du traitement Effets secondaires Questionnaire + EVA sur 100mm A multicenter, randomized, double-blind, placebo-controlled, dose-titration study of oral Pilocarpine for treatment of radiation-induced xerostomia in head and neck cancer patients. Leveque et al. F.G. J Clin Oncol. (1993) (7) N = 162 (75/87) 50>Dose (Gy)<60 - Durée traitement : 12 semaines - Ajustement toutes les 4 semaines selon les réponses observées à 2,5, 5 ou 10mg - 3 fois par jours Placebo Avant le début de l’étude puis toutes les 4 semaines - Mesure débit salivaire avec et sans stimulation - Mesure débit salivaire de la parotide avec et sans stimulation Questionnaire + EVA sur 100mm
Tableau 1. Principales caractéristiques des articles de l’objectif 1 Efficacy of Pilocarpine and Bromhexine in Improving Radiotherapy-induced Xerostomia. Abbasi et al. J of Dental Research (2013)(8) N = 25 ≥ 45 Gy ≥ 6 mois avant le début du traitement - 5 mg Pilocarpine 4 fois par jours pendant 2 semaines - 2 semaines d’arrêt - 8 mg Bromhexine 4 fois par jours pendant 2 semaines - 8 mg Bromhexine 4 fois par jours pendant 2 semaines - 2 semaines d’arrêt - 5 mg Pilocarpine 4 fois par jours pendant 2 semaines Avant et après chaque traitement Mesure débit salivaire sans stimulation au préalable Questionnaire
III.3.2. Principaux résultats
Le tableau suivant regroupe les principaux résultats obtenus dans les études sélectionnées, concernant les symptômes objectifs, subjectifs ainsi que les effets secondaires selon le dosage administré.
L’article de Johnson inclus une analyse statistique utilisant le test du χ2 afin de comparer les résultats des deux groupes, avec un seuil de significativité de (p<0.05).
Principaux résultats objectifs Effets secondaires Principaux résultats subjectifs Articles (Titre, Auteur, Publication, Date)
Dosage Pilocarpine/Contrôle Dosage Pilocarpine/ Contrôle Dosage Pilocarpine/ Contrôle
2,5mg 5mg 10mg 2,5mg 5mg 10mg 2,5mg 5mg 10mg Oral Pilocarpine for post-irradiation xerostomia in patients with head and neck cancer. Johnson JT et al. N Engl J Med (1993) (5) Augmentation significatives des mesures salivaires et de la salive parotidienne chez le groupe pilocarpine durant les 8 premières semaines - Sévérité modérée dans la majorité des cas - Aucun effet secondaire grave observé - Amélioration significative de la sensation de bouche sèche chez groupe Pilocarpine (p=0.010) - Amélioration significative concernant le sommeil, la mastication et port de prothèse (p<0.01) 3 cas de sudation sévères sur 69 Amélioration sensation de bouche sèche (p=004) Amélioration sensation bouche sèche (p=0.018) A multicenter maintenance study of oral Pilocarpine tablets for radiation-induced xerostomia Jacobs CD et al. Oncology (1996) (6) - Sudation = effet le plus observé - Aucun effet secondaire grave observé - Pas d’effet sur la thérapeutique tumorale - 18% d’abandons liés aux effets secondaires - Amélioration chez le groupe traité de la : Sensation de bouche sèche (23.9% à 42%) Capacité à parler (47.9% à 57.1%) Capacité à manger (24.4% à 42.8%) - Usage de substituts salivaire : Diminution : 31% Aucune différence : 66% Augmentation : 3% - Globale évaluation de la xérostomie de 56.1/100 à la fin du traitement
- Pas de signes significatifs de diminution des effets avec le temps A multicenter, randomized, double- blind, placebo- controlled, dose-titration study of oral pilocarpine for treatment of radiation-induced xerostomia in head and neck cancer patients. Leveque, F.G. J Clin Oncol. (1993) (7) - Doses finales obtenus : 2,5mg : 13% 5mg : 27% 10 mg : 60% - Augmentation significative des mesures de toute la salive et de la salive parotidienne avec et sans stimulation chez le groupe Pilocarpine - Sudation = effet le plus observé - Dose-dépendent - Sévérité modérée dans la majorité des cas - 1/162 cas sévère avec dosage Pilocarpine 10mg - Amélioration de la sensation de bouche sèche chez 42.4% chez groupe Pilocarpine vs. 27.3% groupe placebo - Amélioration peu significative concernant le confort de la bouche et langue (25.9% contre 20.3%) Pas d’amélioration des symptômes Efficacy of Pilocarpine and Bromhexine in Improving Radiotherapy-induced Xerostomia. Abbasi et al. J Of Dental Research (2013) (8 - Pas de différences significatives des mesures salivaires après le traitement de Bromhexine - Amélioration des mesures salivaires dans 100% des cas après le traitement Pilocarpine / contre 28% après le traitement à la Bromhexine - Amélioration de la capacité à mastiquer et parler dans 100% des cas après le traitement Pilocarpine contre 14.3% après le traitement Bromhexine - Diminution de l’altération du goût dans 90.9% des cas après le traitement Pilocarpine contre 20.8% après le traitement Bromhexine Tableau 2. Principaux résultats des articles de l’objectif 1
III.3.3 Analyse (i) Symptômes objectifs Tous les articles mesurant le débit salivaire ont montré une augmentation supérieure chez les patients traités par la Pilocarpine. L’article de Johnson (5) a révélé une augmentation du débit salivaire à la fin du traitement chez 56,3% des patients du groupe placebo contre 69,1% des patients du groupe Pilocarpine à 5mg et 72,7% dans le groupe Pilocarpine à 10mg. L’article d’Abbasi (8) a révélé une augmentation du débit salivaire chez 100% des patients traités par la Pilocarpine contre 28% après avoir été traité avec la Bromhexine et dans l’article de Leveque (7), les mesures salivaires ont augmenté chez 42,7% des patients du groupe placebo contre 68,9% dans le groupe traité par la Pilocarpine. Concernant les mesures salivaires sans stimulation provenant de la glande parotide, l’article de Johnson (5) a montré une augmentation de la sécrétion salivaire chez 7,9% des patients du groupe placebo contre 12,1% et 16,3% chez les patients traités par la Pilocarpine à 5mg et 10mg. Dans l’article de Leveque (7), les mesures ont augmenté chez 2,9% chez le groupe contrôle contre 35% des patients du groupe Pilocarpine. (ii) Symptômes subjectifs
Dans l’article de Johnson (5) et de Leveque (7), la réponse au traitement était considérée comme étant positive quand on observait une augmentation du score de l’échelle analogue visuelle supérieure ou égale à 25mm.
Concernant la sensation de bouche sèche, dans l’article de Johnson (5), une réponse positive a été observée à la fin du traitement chez 25,4% du groupe placebo, 50,8% du groupe Pilocarpine à 5mg et 47,1% du groupe Pilocarpine à 10mg.
Dans l’article de Leveque (7), 27,3% du groupe placebo ont eu une réponse positive contre 42,4% du groupe Pilocarpine.
L’article de Jacob (2) a révélé une amélioration globale de la xérostomie à la fin du traitement évaluée en moyenne à 56,1 sur 100 chez le groupe Pilocarpine.
L’usage des substituts salivaire a diminué chez 31% des patients du groupe Pilocarpine dans l’article de Jacobs (6). Dans l’article de Johnson (5), 25,4 et 32.1% du groupe Pilocarpine à 5 et 10mg contre 10,9% du groupe contrôle et chez 26.1% du groupe Pilocarpine contre 13% dans le groupe contrôle dans l’article de Leveque (7). (iii) Effets secondaires Le tableau résume, à travers tous les articles, les effets indésirables observés ainsi que leur fréquence selon les différents dosages.
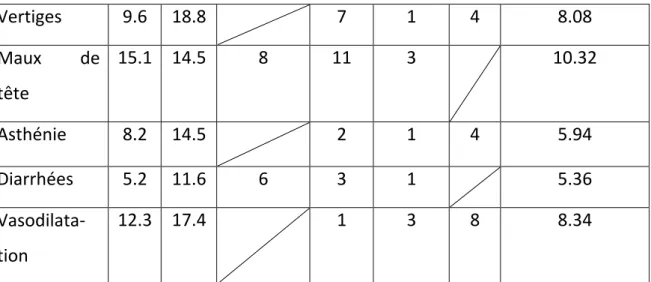
Articles Johnson (5) Jacob (6) 5 Leveque (7) Dosage Pilocarpine (mg) 3 fois/jours 5 10 2.5 5 10 N 73 69 265 75 68 52 Incidences des effets secondaires (%) Moyennes Sudation 37 79,7 55 9 21 52 42.2 Pollakiurie 13.7 14.5 11 3 3 10 9.2 Nausées 8.2 21.7 5 4 6 8.98 Frissons 1.4 23.2 1 4 4 6.72 Rhinite 4.1 18.8 27 5 6 8 11.48
Vertiges 9.6 18.8 7 1 4 8.08 Maux de tête 15.1 14.5 8 11 3 10.32 Asthénie 8.2 14.5 2 1 4 5.94 Diarrhées 5.2 11.6 6 3 1 5.36 Vasodilata-tion 12.3 17.4 1 3 8 8.34 Tableau 3. Incidences et moyennes des effets secondaires chez les patients traités par la Pilocarpine Dans toutes les études, la sudation et la rhinite étaient les effets indésirables les plus observés chez les patients traités par la Pilocarpine. La sévérité des effets indésirables a été évaluée de faible à modérée. 4 cas sévères ont été révélés à travers tous les articles dans le groupe Pilocarpine 10mg et aucun effet indésirable grave n’a été observé.
III.4. Objectif 2: Effet radioprotecteur de la Pilocarpine dans le cadre des xérostomie radio induite III.4.1. Caractéristiques des études Un nombre total de 896 patients a été inclus dans les onze études sélectionnés dont 450 dans le groupe Pilocarpine et 446 dans le groupe contrôle. Toutes les études étaient contrôlées et randomisées. L’efficacité de la Pilocarpine a été testée dans un cadre préventif en étant administrée pendant la radiothérapie et contrôlée par un traitement placebo. Excepté pour l’étude de Nyrady (14) où le groupe contrôle était représenté par des patients ayant déjà achevé la radiothérapie et débutant le traitement à base de Pilocarpine après la radiothérapie pendant 5 semaines, ainsi que l’article de Rode (18) où l’efficacité de la Pilocarpine a été comparée à celle du Bipéridène, un anti-cholinergique. Les patients inclus dans ces études présentaient un cancer des voies aérodigestives et devaient commencer la radiothérapie. Au moins 50% des 2 glandes parotides ont reçu pendant la radiothérapie une dose d’au moins 40Gy. Excepté l’article de Burlage (17) formant 3 groupes de patients selon le volume exposé des glandes parotides de 25% à plus de 75% pour évaluer l’influence de l’exposition des glandes parotides. Le traitement a été administré dès le début de la radiothérapie jusqu’à 1 à 3 mois après la fin de la radiothérapie. Avec un dosage de 5mg, 3 ou 4 fois par jours pour toutes les études. Les paramètres objectifs et subjectifs ont été collectés avant, pendant et jusqu’à 1 an après la fin du traitement. Le tableau suivant résume les principales caractéristiques des 9 articles sélectionnés ayant pour objectif d’évaluer l’effet radioprotecteur de la Pilocarpine lorsqu’elle est administrée pendant la radiothérapie.
Population étudiée Méthodologie Paramètres étudiés Articles (Titre, Auteur, Publication, Date) N (Pil/ Ctrl) Paramètres
radiothérapie Pilocarpine Groupe contrôle Groupe Fréquence Objectifs Subjectifs
Evaluation of radioprotective effect of Pilocarpine ingestion on salivary glands. Pimentel et al. Anticancer Res (2014) (9)
11 (5/6) 35 à 50 Gy 5mg 3 fois/jours Placebo 1 fois par semaine pendant 5 semaines pendant la RT Collections salivaires avec et sans stimulation Use of Pilocarpine during Head and neck radiation Therapy to Reduce xerostomia and Salivary Dysfunction. Valdez IH et al. Cancer (1993) (10) 10 (5/5) 23 à 72 Gy - Glandes salivaires partiellement affectées (N=9) - Glandes salivaires entièrement affectées (N=1) 5mg 4 fois/jours Du début de la RT à post 3 mois après Placebo 1 fois par semaine pendant la RT et après 3, 4, 5, 6, 12 mois après la RT Collections salivaires de la glande parotide et submandibulaire avec et sans stimulation Questionnaire
A randomized, double-blind, placebo-controlled trial of concomitant Pilocarpine with head and neck irradiation for prevention of induced xerostomia. Haddad P. et al Radioth Oncol (2002) (11) 39(18/21) ≥40 Gy incluant une majeure partie des glandes parotides 5mg 3 fois/jours Du début de la RT à post 3 mois après Placebo 6 mois après
la fin de la RT Mesure objective de la xérostomie selon l’échelle croissante de LENT SOMA de 1 à 4 Questionnaire d’échelle analogique décroissante Concomitant Pilocarpine during head and neck irradiation is associated with decreased posttreatment xerostomia. Zimmerman et al. Int J Radiat Oncol Biol (1997) (12) 35(17/18) ≥45Gy incluant les 2 glandes parotides 5mg 4 fois/jours du début de la RT à post 3 mois après Placebo 16 mois après
la RT Questionnaire + EVA croissante sur 100mm
A phase III placebo-controlled trial of oral Pilocarpine in patients undergoing radiotherapy for head and neck cancer Warde P et al. Int J radiat Ocol Biol Phys (2002) (13) 130 (65/65) ≥50Gy Incluant au moins 50% des glandes parotide 5mg 3 fois/jours J1 RT à +1mois après Placebo 1, 3, 6 mois
après la RT Questionnaires basés sur l’échelle croissante de LASA (**) de 0 à 100 A randomized study to assess the effectiveness of orally administered Pilocarpine during and after radiotherapy of head and neck cancer. Nyrady Z etal. Anticancer Res (2006) (14) 66(33/33) 60 Gy pendant 6
semaines Pilocarpine 5mg 3 fois/jours Du début de la RT à +6sem après Pilocarpine 5mg 3 fois/jours 6 semaines après la RT Toutes les 2 semaines pendant 12 semaines - Collections salivaires sans stimulation 3h après prise Pilocarpine - Bilan parodontal avant et après étude Questionnaire + EVA sur 100
Double-blind randomized, placebo controlled study of Pilocarpine to salvage salivary gland function during radiotherapy of patients with head and neck cancer Gornitsky M et al.Oral Surg Oral Med Oral Pathol Oral Radiol Endo (2004) (15) 58 (29/29) 50Gy 1 e phase : 5mg 5fois/jours du début à la fin de la RT 2e phase 5mg 4 fois/jours après la RT pendant 5 semaines Placebo - Mesures salivaire avec et sans stimulation selon le SAXON Test (***) - Effets secondaires Questionnaire + EVA décroissante sur 100mm Effect of Pilocarpine during radiation therapy: Results of RTOG 97-09, a phase III randomized study in head and neck cancer patients. Scarantino C et al. J Support Oncol (2006) (16) 249 (124/125) 60>Dose (Gy) <70 50% des glandes salivaire reçoivent au moins 50Gy
5mg 4 fois/jours Placebo - Collections salivaires avec et sans stimulation, avant, à la fin et à +3 et 6 mois de la radiothérapie - Contrôles parodontaux avant et pendant RT 3 fois semaine selon échelle RTOG (****) Questionnaire + échelle analogue de 10 à 50 (multiple de 10) selon l’University of Washington Head and Neck Symptom Scale
Protection of Salivary Function by Concomitant Pilocarpine During Radiotherapy: A Double-Blind, Randomized, Placebo-Controlled Study. Burlage FR et al. Int J Radiat Oncol Biol Phys. (2008) (17) 169 (85/84) - ≥50Gy - 3 groupes selon volume exposé des glandes parotides : Entre 25% et 45% Entre 46% et 75% >75% 5mg 4 fois/jours 2 jours avant et 14 jours après la RT Placebo Avant la RT, à 6semaines, 6, 12 mois et après la RT - Collection glandes parotides après stimulation avant et 6sem, 6, 12 mois après RT - Echelle croissante de LENT SOMA (1 à 4) Questionnaire The effect of pilocarpine and biperiden on salivary secretion during and after radiotherapy in head and neck Cancer patients. Rode M et al. Int J Radiat Oncol Biol Phys (1999) (18) 69 (39/30) 40>Dose (Gy) <70 - Groupe A : 5mg Pilocarpine 3 fois par jours pendant la RT - Groupe B : 4mg/jours Biperidène pendant la RT puis 5mg Pilocarpine 3 fois par jours après la RT Groupe C : Aucun traitement Avant, pendant (à 30Gy), à la fin de la RT et après 3,6 et 12 mois Mesures salivaires sans stimulation
** Echelle de LASA = Linear Analog Scale Assessement *** SAXON Test (21) = Mesures salivaire après stimulation exprimé en grammes **** RTOG = Radiation Therapy Oncology Group Tableau 4. Principales caractéristiques des articles de l’objectif 2 Pilocarpine and Prevention of Radiation Induced Xerostomia in HNSCC. Atri R et al. J Cancer Prev Curr Res (2014) (19) 60
(30/30) 64 Gy en 2 semaines de RT 5 mg 4 fois par jours Placebo Avant, à la fin et à 3 et 6 mois après la RT
Echelle croissante de
III.4.2. Principaux résultats Le tableau suivant regroupe les principaux résultats obtenus à travers les 9 articles retenus pour évaluer le rôle radioprotecteur de la Pilocarpine. Des analyses statistiques ont été réalisées dans 7 articles dans le but de comparer les résultats obtenus dans le groupe Pilocarpine avec ceux du groupe contrôle.
Le t-test(10), (11), (12), (14), (15), (16), (17), (18) ou le test du chiχ2 (13) ont été utilisés pour cela, avec
un seuil de significativité de (p<0.05).
Principaux résultats objectifs Principaux résultats subjectifs Articles (Titre, Auteur, Publication, Date)
Groupe Pilocarpine Groupe contrôle Groupe Pilocarpine Groupe contrôle
Evaluation of radioprotective effect of Pilocarpine ingestion on salivary glands. Pimentel et al. Anticancer Res (2014) (9) - Réduction de : • 0.21 ml/min salive non stimulée • 0.55 ml/min salive stimulée - 3 patients sur 5 présentent des signes de xérostomie - Réduction de : • 0.34 ml/min salive non stimulée • 1.43 ml/min salive stimulée - 5 patients sur 6 présentent des signes de xérostomies à partir de la 2e semaine Use of Pilocarpine during Head and neck radiation Therapy to Reduce xerostomia and Salivary Dysfunction. Valdez IH et al. Cancer (1993) (10) - Réduction salivaire moins importante chez le groupe pilocarpine - Différence significative des mesures salivaires de la parotide stimulée entre les 2 groupes à la fin de l’étude à partir de 3 mois (p=0.025) - Pas d’effet de la Pilocarpine chez les patients dont les glandes salivaires étaient entièrement incluses dans la zone de radiation - Significativement moins de symptômes oraux que le groupe contrôle : - Sensation de bouche sèche chez 27% du groupe Pilocarpine contre 82% du groupe placebo - Utilisation de substituts salivaires chez 37% du groupe Pilocarpine contre 78% du groupe placebo
A randomized, double-blind, placebo-controlled trial of concomitant Pilocarpine with head and neck irradiation for prevention of induced xerostomia. Haddad P. et al Radiother Oncol (2002) (11) Pas d’incidence significative de l’âge et du dosage sur les
glandes parotides sur les symptômes de la xérostomie Evaluation globale de la xérostomie : 40.3/100mm Evaluation globale de la xérostomie : 57/100mm
Grade xérostomie de 2.2 Grade xérostomie de 2.6 Différence significative (p=0.02) Différence significative (p=0.01) Concomitant Pilocarpine during head and neck irradiation is associated with decreased post treatment xerostomia. Zimmerman et al. Int J Radiat Oncol Biol (1997) (12) Le groupe Pilocarpine a moins de symptômes subjectifs de sécheresse buccale, inconfort et difficulté à parler et manger contre groupe contrôle (p<0.01) - Sécheresse buccale : 60mm - Capacité à dormir : 90mm - Capacité à manger : 65mm - Sécheresse buccale : 25mm - Capacité à dormir : 45mm - Capacité à manger : 35mm A phase III placebo-controlled trial of oral Pilocarpine in patients undergoing radiotherapy for head and neck cancer. Warde P et al. Int J radiat Ocol Biol Phys (2002) (13) Pas de différence significative entre les 2 groupes (p=0.92) - 1e Mois : 40.2/100mm - 3e Mois : 33.9/100mm - 6e Mois : 33.5/100mm - 1e Mois : 36.6/100mm - 3e Mois : 43.8/100mm - 6e Mois : 32.3/100mm
A randomized study to assess the effectiveness of orally administered Pilocarpine during and after radiotherapy of head and neck cancer. Nyrady Z et al. Anticancer Res (2006) (14) - Réduction salivaire de 6.92±2.65ml à 4.77±2.66ml à la fin RT - Augmentation de 5.79±2.66ml à la fin de l’étude - Réduction salivaire de 7.0±2.54ml à 2.18±1.61ml à la fin RT - Augmentation de 4±1.75ml à la fin de l’étude Symptômes subjectifs de la xérostomie globale : - Augmentation de 64.12±24.51% à la fin de la RT - Augmentation 87.0±11.57% à la fin de l’étude Symptômes subjectifs de la xérostomie globale : - Réduction de 90.42±12.49% à 34.78±24.13% à la fin RT - Augmentation de 72.6±24.7% à la fin de l’étude Réduction salivaire significativement moins importante chez le groupe traité pendant et après RT (p<0.001) Mesures salivaire toujours plus importantes chez le groupe D (p<0.05) Valeurs l’échelle analogue visuelle concernant la capacité à manger, dormir, parler et le port de prothèse sont toujours plus importantes chez le groupe traité pendant et après RT (p<0.001) Double-blind randomized, placebo controlled study of Pilocarpine to salvage salivary gland function during radiotherapy of patients with head and neck cancer. Gornitsky M et al.Oral Surg Oral Med Oral Pathol Oral Radiol Endo (2004) (15) Pas de différences significatives de réduction salivaire entre les 2 groupes ayant reçu le traitement pendant la RT Groupe Pilocarpine présente moins de symptômes subjectifs après la radiothérapie. - Diminution salivaire sans stimulation de 1.7g avant et après la RT - Diminution salivaire avec stimulation de 2.3g avant et après la RT - Diminution salivaire sans stimulation de 1.6g avant et après la RT - Diminution salivaire avec stimulation de 2.9g avant et après la RT - Sensation de sécheresse buccale après RT : 52.2mm - Difficulté lors de la phonation : 57.5mm - Difficulté lors de la mastication : 47.4mm - Troubles du sommeil : 37.3mm - Sensation de sécheresse buccale après RT : 65.5mm - Difficulté lors de la phonation : 37.3mm - Difficulté lors de la mastication : 61.8mm - Troubles du sommeil : 49.6mm
Effect of Pilocarpine during radiation therapy: Results of RTOG 97-09, a phase III randomized study in head and neck cancer patients. Scarantino C et al. J Support Oncol (2006) (16) - Réduction salivaire chez 72% des patients - Diminution salivaire sans stimulation de 0.4g entre le début et la fin de la RT - Réduction salivaire chez 85% des patients - Diminution salivaire sans stimulation de 1.1g entre le début et la fin de la RT Pas de différences significatives entre les 2 groupes (p=0.67) Pas de différences significatives concernant la salive avec stimulation (p=0.15) Protection of Salivary Function by Concomitant Pilocarpine During Radiotherapy: A Double-Blind, Randomized, Placebo-Controlled Study. Burlage FR et al. Int J Radiat Oncol Biol Phys. (2008) (17) - Pas de différences significatives concernant les mesures de la salive parotidienne à 6sm, 6 et 12 mois (p=0.41-0.31-0.35) - Pas de différences significatives concernant les mesures salivaires submandibulaires - Résultats sur l’échelle de LENT SOMA significativement meilleurs chez le groupe pilocarpine avec dose>40Gy à partir de 12 mois (p=0.017) - Pas de différences significatives chez les patients avec dose entre 0 et 40 Gy - Résultats significativement plus bas chez le groupe pilocarpine avec dose >40Gy à partir de 6 mois (p=0.05)
Tableau 5. Principaux résultats des articles de l’objectif 2 The effect of Pilocarpine and Biperiden on salivary secretion during and after radiotherapy in head and neck cancer patients. Rode M et al. Int J Radiat Oncol Biol Phys (1999) (18) Quantité salivaires moyennes obtenus Groupe A : - Avant RT : 0.5ml/min - Pendant RT (30Gy) : 0.1ml/min - Fin RT : 0.01 ml/min - + 6 mois après RT : 0.06ml/min Groupe B : - Avant RT : 0.53 ml/min - Pendant RT (30Gy) : 0.25mL/min - Fin RT : 0.18 ml/min - + 6 mois après RT : 0.09ml/min Groupe C : - Avant RT : 0.58ml/min - Pendant RT (30Gy) : 0.27ml/min - Fin RT : 0.16 ml/min - + 6 mois après RT : 0.02ml/min Pilocarpine and prevention in radiation induced xerostomia in HNSCC Atri et al. J Cancer Prev Curr Res (2014) (19) Grade Echelle de LENT SOMA : - Avant RT : Grade 1 - Fin RT : Grade 2.7 - + 3mois après RT : Grade 2.3 - + 6 mois après RT : Grade 2.3 Grade Echelle de LENT SOMA : - Avant RT : Grade 1 - Fin RT : Grade 3 - + 3 mois après RT : Grade 2.5 - + 6 mois après RT : 2.5 Sécheresse buccale : - Avant RT : 100mm - Fin RT : 48mm - + 3mois après RT : 57mm - + 6 mois après RT : 62mm Sécheresse buccale : - Avant RT : 100mm - Fin RT : 37mm - + 3mois après RT : 41mm - + 6 mois après RT : 44mm
III.4.3. Analyse (i) Débit salivaire Six articles mesuraient le débit salivaire sans stimulation au préalable. Une diminution du débit salivaire a été observée chez la majorité des patients dès la première semaine de radiothérapie et persistant jusqu’à la fin de l’étude. Cependant, l’article de Pimentel (9), Nyrady (14), Scarantino (16) et Rode (18) montraient une diminution significativement moins importante chez les patients ayant reçu de la Pilocarpine durant la radiothérapie. L’article de Gornistsky (15) n’a pas montré de différence significative de réduction salivaire entre les 2 groupes étudiés. Sur les trois articles mesurant le débit salivaire après stimulation, l’article de Scarantino (16) et Gornitsky (15) ont montré une diminution du débit salivaire après la radiothérapie mais aucune différence significative n’a été observée entre le groupe ayant reçu de la Pilocarpine et le groupe ayant reçu le traitement placebo. On observait dans l’article de Pimentel (9) une réduction significativement moins importante chez le groupe Pilocarpine de 0,55mL/min contre 1,43mL/min chez le groupe contrôle.
Les collections salivaires provenant des glandes salivaires majeures (glande parotide et submandibulaire) dans l’article de Burlage (17) ne montrait pas de différence significative entre les 2 groupes. Dans l’article de Valdez (10), la diminution du débit salivaire provenant des glandes majeures était toujours inférieure chez le groupe Pilocarpine. Cependant la différence entre les 2 groupes était significative uniquement lors des mesures du 3e mois. (ii) Echelle de LENT SOMA Tous les articles évaluant la xérostomie en se basant sur l’échelle de LENT SOMA ont montré une dégradation du fonctionnement des glandes salivaires supérieures chez les patients n’ayant pas reçu de Pilocarpine. (11), (17), (19)
(iii) Echelle visuelle analogique
Quatre articles ont inclus dans leur méthode l’EVA croissante pour évaluer la xérostomie de manière subjective. Les résultats obtenus et présentés dans le tableau suivant montre que les résultats entre le groupe Pilocarpine et le groupe contrôle étaient similaires avant le début de la radiothérapie. A la fin de la radiothérapie, les scores diminuaient de manière globale, cependant les scores du groupe Pilocarpine étaient supérieurs au groupe contrôle. Entre 1 et 3 mois, les scores entre les deux groupes étaient semblables et supérieurs à ceux de la fin de radiothérapie.
Les articles ayant poursuivi l’étude jusqu’à 6 à 12 mois après la radiothérapie ont montré de meilleurs résultats chez le groupe ayant reçu la Pilocarpine. Zimmerman (12) Warde (13) Nyrady (14) Atri (19) Moyennes N=
Pil Ctrl Pil Ctrl Pil Ctrl Pil Ctrl Pil Ctrl Pil Ctrl
Avant la RT 80.2 77.9 88 90 100 100 89.4 89.3 128 128 Fin RT 40.2 36.6 65 35 48 39 51 36.9 128 128 + 1 mois RT 33.9 34.8 85 60 59.5 47.4 98 98 + 3 mois RT 33.5 46 57 42 45.3 44 95 95 + 6 mois RT 62 44 62 44 30 30 + 12 mois RT 60 25 60 25 17 18 Tableau 6. Scores et moyennes de la xérostomie globale subjective sur l’EVA (mm)
IV. Discussion
IV.1. Efficacité de la Pilocarpine administrée après la radiothérapie
Les données extraites des articles retenus montraient que la Pilocarpine est cliniquement efficace face aux symptômes de la xérostomie post-radique.
Les articles inclus dans l’étude ont montré une augmentation statistiquement significative du débit salivaire ainsi qu’une nette amélioration des symptômes subjectifs : sécheresse buccale, habilité à parler, mastiquer, dormir ainsi que le confort intra-oral. Les effets de la Pilocarpine semblaient être immédiats, en effet, la comparaison des mesures salivaires entre avant et après chaque prise de la Pilocarpine montraient une différence significative entre les patients du groupe traité et du groupe contrôle (7). Cette efficacité était exercée à la fois sur les glandes salivaires majeures et mineures puisque l’augmentation du débit salivaire était observée à la fois lors des collections de toute la salive et lors des collections de la salive provenant de la glande parotide. (5), (7)
La sudation et la rhinite étaient les effets secondaires les plus observés, suivis en décroissance par les maux de tête, pollakiurie, nausées, vasodilatation, vertiges, frissons, asthénie, et diarrhée. La sévérité de ces effets était dose-dépendant. Ils ont été considérés comme acceptables avec une dose de 5mg. Cependant, aucun effet secondaire grave chez les patients traités par la Pilocarpine n’a été observé. La pilocarpine est donc un traitement pouvant être considérés comme sûr et n’ayant aucun effet sur la thérapeutique tumorale.
Concernant le dosage, l’article de Leveque (7) montrait que la Pilocarpine prescrite à 2,5mg trois fois par jour est une dose insuffisante n’induisant pas d’amélioration significative des symptômes cliniques de la xérostomie.
Le dosage de 5mg semble avoir de meilleurs résultats lorsque l’efficacité et les effets secondaires sont considérés. Cependant, des réponses insuffisantes au traitement dosé à 5mg ont été observées à travers les études (5), (6), (7). Il est parfois nécessaire d’augmenter la dose à 10mg pour observer une réponse au traitement. La cause de la réponse insuffisante à 5mg n’a pas été recherchée à travers les études. Elle pourrait être liée à la dose reçue lors la radiothérapie et au volume des glandes salivaires majeures incluses dans la zone d’irradiation. Sur le long terme, l’article de Jacob (6) montrait qu’après 36mois de traitement, les effets de la Pilocarpine restaient modérément efficaces face aux symptômes subjectifs de la xérostomie. Le dosage de 5mg semblait être également la dose optimale en terme de maintenance. Cependant l’efficacité de la Pilocarpine sur le long terme n’a pas été testée face aux symptômes objectifs de la xérostomie à travers cet article. De plus, il aurait été intéressant d’évaluer la constance de l’efficacité de la Pilocarpine sur le long terme en multipliant la fréquence des analyses.
On peut également se demander si la Pilocarpine reste efficace dans le cas où les glandes salivaires majeures sont entièrement exposées aux radiations.
IV.2. Efficacité de la Pilocarpine administrée pendant la radiothérapie
Concernant les symptômes objectifs, les études semblent démontrer une réelle efficacité de la Pilocarpine pendant la radiothérapie sur le débit salivaire sans stimulation. Seul l’article de Gornitsky (15) ne démontrait pas cette efficacité concernant le débit salivaire. La méthode de collection salivaire utilisée uniquement dans cette étude peut être mise en cause. La technique de mesure consistait à peser en grammes une compresse stérile avant et après avoir été imprégnée de salive pendant deux minutes (21). On peut considérer que cette méthode peut être moins précise que la
méthode classique de collection salivaire et exprimée en mL/minutes, utilisée dans les autres études.
L’efficacité de la Pilocarpine concernant le débit salivaire après stimulation est néanmoins discutable. Seul l’article de Pimentel (9) et Valdez (10) montrait son efficacité, cependant ces résultats ne sont pas extrapolables du fait du faible effectif. L’étude Gornitsky (15) et Scarantino (16) n’ont pas révélé de différences significatives entre les 2 groupes, cependant la mesure du débit salivaire exprimée en grammes dans ces deux études peut s’avérer être une unité de mesure peu précise.
Les autres études mesurant le débit salivaire provenant des glandes majeures ne montraient pas de réelle efficacité de la Pilocarpine sur le débit de salive stimulé. Ces résultats peuvent s’expliquer par le fait que la glande parotide est souvent la glande la plus exposée aux radiations et donc la plus altérée. L’efficacité de la Pilocarpine dépendrait donc de la dose de radiation reçue par les glandes majeures. De plus, dans l’étude de Valdez (10), aucune réponse à la Pilocarpine n’a été observé chez le seul patient dont les glandes majeures étaient entièrement inclues dans la zone irradiée. En comparant les résultats obtenus par l’EVA concernant les symptômes subjectifs entre le début et la fin de la radiothérapie, l’apparition des premiers symptômes de la xérostomie a été observée chez les patients des deux groupes. Cependant, la sévérité de ces symptômes est moins importante chez les patients traités par la Pilocarpine. La Pilocarpine aurait donc un effet sur les glandes salivaires avant l’effet des radiations. La majorité des études inclues dans la revue systématique contrôlaient l’efficacité de la Pilocarpine pendant la radiothérapie face à un traitement placebo. Même si les résultats étaient globalement positifs, le traitement placebo ne permet pas d’évaluer le rôle de la Pilocarpine en prévention de manière optimale. L’article de Nyrady (14) est le seul à comparer un groupe traité pendant et après la radiothérapie à un groupe traité uniquement après la radiothérapie. L’analyse de cette étude montrait des
résultats significativement meilleurs quand la Pilocarpine était prescrite dans un cadre préventif. Il semble donc que la Pilocarpine présente un réel effet radioprotecteur sur les glandes salivaires. Cependant, l’étude est poursuivie uniquement à 1 mois après la fin de la radiothérapie. L’efficacité de la Pilocarpine en prévention sur un plus long-terme ne peut donc pas être discutée. Il aurait été également intéressant de comparer l’efficacité de la Pilocarpine selon la dose d’irradiation et le volume des glandes salivaires majeures exposés aux radiations.
V. Conclusion
La xérostomie radio-induite est considérée comme un effet secondaire mineurs de la radiothérapie. Cependant, elle cause une réelle dégradation de la qualité de vie des patients concernés. De plus, les substituts salivaires sont souvent peu tolérés et difficilement utilisables sur le long terme.
Les données extraites des articles retenus montrent le réel bénéfice de la Pilocarpine pour améliorer la qualité de vie des patients atteints de xérostomie radio-induite avec un rapport bénéfice-risque optimal obtenu avec un dosage de 15 à 30 milligrammes par jours. Les effets secondaires sont sans gravité et n’a aucun effet sur la thérapeutique tumorale.
Il n’existe aujourd’hui aucune thérapeutique préventive face aux symptômes de la xérostomie radio-induite. L’idéal en terme de santé publique serait de pouvoir prévenir la xérostomie post-radique. Les résultats obtenus à travers les articles sont encourageants concernant l’effet radioprotecteur de la Pilocarpine sur les glandes salivaires. Cependant, d’autres études sont nécessaires pour le confirmer.
La Pilocarpine devrait être une thérapeutique systématique face aux signes de xérostomies causés par la radiothérapie. Cependant, son coût et son caractère non remboursable peuvent s’avérer être des limites à sa prescription.
VI. Bibliographie
(1) Les cancers en France, Les Données, INCa, édition 2015. Disponible sur
http://www.e-cancer.fr/
(2) BENSADOUN R-J, PINEL B. Radiothérapie des cancers oto-rhino- laryngologiques. EMC - Oto-rhino-laryngologie 2013, 8(1) :1-13 [Article 20-902-A-10].
(3) GARG AK, MALO M. Manifestations and treatment of xerostomia and associated oral effects secondary to head and neck radiation therapy. The Journal Of American Dental Association, Volume 128, Issue 8, August 1997, Pages 1128-1133. (4) BURKE S, KWASNICKI A J, KAURA L. Dental management of patients post head and neck cancer. Dental Nursing, Vol. 10, Iss. 5, 01 May 2014, pp 258 – 265. (5) JOHNSON JT, FERRETTI GA, NETHERY WJ, VALDEZ IH, FOX PC, Ng D, et al. Oral Pilocarpine for post-irradiation xerostomia in patients with head and neck cancer. The New England Journal of Medicine 1993, 329(6):390-5.
(6) JACOBS CD, VAN DER PAS M. A multicenter maintenance study of oral Pilocarpine tablets for radiation-induced xerostomia. Oncology (Williston Park) 1996, 10(3 Suppl):16-20.
(7) LEVEQUE F.G, MONTGOMERY M, POTTER D. et al. A multicenter, randomized, double-blind, placebo-controlled, dose-titration study of oral
Pilocarpine for treatment of radiation-induced xerostomia in head and neck cancer patients. Journal Of Clinical Oncolology 1993, 11 :1124–113. (8) ABBASI F, FARHADI S, ESMAILI M. Efficacy of Pilocarpine and Bromhexine in Improving Radiotherapy-induced Xerostomia. Journal of Dental Research, Dental Clinics, Dental Prospects 2013, 7 :86-90.
(9) PIMENTEL MJ, FILHO MM, ARAUJO M, GOMES DQ, et al. Evaluation of radioprotective effect of Pilocarpine ingestion on salivary glands. Anticancer Research 2014, 34:1993-9.
(10) VALDEZ IH, WOLFF A, et al. Use of Pilocarpine during Head and neck radiation Therapy to Reduce xerostomia and Salivary Dysfunction. Cancer, 1993, 71:1848-1853.
(11) HADDAD P, KARIMI M. A randomized, double-blind, placebo-controlled trial of concomitant Pilocarpine with head and neck irradiation for prevention of induced xerostomia. Radiotherapy Oncology 2002, 64(1):29-32.
(12) ZIMMERMAN RP, MARK RJ, TRAN LM, et al. Concomitant Pilocarpine during head and neck irradiation is associated with decreased post treatment xerostomia. International Journal of Radiotherapy Oncology Biology and Physics 1997, 37:571-575.
(13) WARDE P, O’SULLIVAN MB, ASLANIDIS J, et al. A phase III placebo-controlled trial of oral Pilocarpine in patients undergoing radiotherapy for head and neck cancer. International Journal of Radiotherapy Oncology Biology and Physics 2002, 54; 9-13.
(14) NYRADY Z, NEMETH A, BAN A et al. A randomized study to assess the effectiveness of orally administered Pilocarpine during and after radiotherapy of head and neck cancer. Anticancer Research 2006 26(2B):1557-62.
(15) GORNITSKY M, SHENOUDA G, SULTANEM K, et al. Double-blind randomized, placebo controlled study of Pilocarpine to salvage salivary gland function during radiotherapy of patients with head and neck cancer. Oral Surgery Oral Medicine Oral Pathology Oral Radiology, and Endodontology 2004, 98:45-52. (16) SCARANTINO C, LEVEQUE F, SWANN RS et al. Effect of pilocarpine during radiation therapy: Results of RTOG 97-09, a phase III randomized study in head and neck cancer patients. Journal Of Supportive Oncology 2006 ; 4(5) :252-8.
(17) BURLAGE FR, ROESINK JM, KAMPINGA HH, COPPES RP, TERHAARD C, LANGENDIJK JA et al. Protection of salivary function by concomitant Pilocarpine during radiotherapy: A Double-Blind, Randomized, Placebo-Controlled Study. International Journal of Radiotherapy Oncology Biology and Physics 2008; (70)1: 14-22. (18) RODE M, SMID L, BUDIHNA M, Soba, GASPERSIC D et al. The effect of Pilocarpine and Biperiden on salivary secretion during and after radiotherapy in head and neck Cancer patients. International Journal of Radiotherapy Oncology Biology and Physics 1999, 45(2): 373-8. (19) ATRI R, DHULL AK, KAUSHAL V. Pilocarpine and Prevention of Radiation
Induced Xerostomia in HNSCC. Journal of Cancer Prevention and Current Research 2014, 1(3). (20) MORNEX F, PAVY J.J, DENEKAMP J, BOLLA M. Les effets tardifs de la radiothérapie sur les tissus sains : le système d’évaluation SOMA-LENT. Cancer Radiothérapie 1997 ; 1 :622-7. (21) KOHLER P, WINTER M. A quantitative test for xerostomia. The Saxon Test, an oral equivalent of the Schirmer test. Arthritis and Rheumatism 1985, 28 (10): 1128-32.
Vu, Le Président du Jury, Date, Signature :
Vu, la Directrice de l’UFR des Sciences Odontologiques, Date, Signature :
Vu, le Président de l’Université de Bordeaux, Date, Signature :
SALOMON Céline Le 11 Septembre 2017
Thèse pour l’obtention du diplôme d’état de Docteur en Chirurgie Dentaire 2017 – n°64
Discipline : Chirurgie Buccale
LA PILOCARPINE DANS LE CADRE DES XEROSTOMIES
RADIO-INDUITES
Résumé en Français : La xérostomie est une de complication communément observée suite à la radiothérapie chez les patients atteints d’un cancer des voies aérodigestives supérieures.
La pilocarpine est un agent parasympathomimétique cholinergique indiqué pour le traitement des symptômes de sécheresse buccale et ophtalmique. Cependant, il est peu prescrit en France dans le cadre des xérostomies radio-induites.
Ce travail a pour but d’évaluer à travers une revue de la littérature, l’efficacité de la Pilocarpine dans le cadre des xérostomies radio-induites ; de rechercher un éventuel rôle radio protecteur de la Pilocarpine quand elle est administrée à titre préventif pendant la radiothérapie, afin d’établir un protocole de prescription.
Mots-clés : Pilocarpine, radiothérapie, xérostomie, cancers des voies aérodigestives supérieures, glandes salivaires
Title and Summary: Pilocarpine for Radiation Induced Xerostomia
Xerostomia is one of the most common complication of radiotherapy in patient with head and neck cancer.
Pilocarpine is a cholinergic parasympathomimetic agent indicated for the treatment of symptoms of dry mouth and eyes. However, it is rarely recommend in France as part of post-irradiation xerostomia. The aim of this work is to evaluate, through a review of literature, the efficacy of Pilocarpine for radiations induced xerostomia; to seek a possible radioprotective role of Pilocarpine when it is administered as a preventive measure during radiotherapy, in order to establish a prescription protocol.
Key word: Pilocarpine, radiotherapy, xerostomia, head and neck cancer, salivary glands Intitulé et adresse de l’UFR :
Université de Bordeaux - Collège des Sciences de la Santé UFR d’Odontologie Bordeaux
16 à 20, cours de la Marne 33082 BORDEAUX CEDEX