Relations entre la conductance du mésophylle au CO2
et l'hydraulique des tiges et des feuilles chez des clones
de peupliers hybrides variant en sensibilité à la
sécheresse
Thèse
Guillaume Théroux Rancourt
Doctorat en biologie végétale
Philosophiæ doctor (Ph. D.)
Québec, Canada
Résumé
L'am élioration de l'efficacité de l'utilisation de l'eau (W UE) s'avère un élém ent clé afin d'augm enter la
durabilité des plantes cultivées lors de périodes de sécheresse. Dans ce contexte, cette thèse a étudié la
relation entre la conductance du mésophylle au CO2 (gm), un élém ent contraignant l'assim ilation en carbone,
et l'hydraulique chez des peupliers hybrides, espèces à forte croissance et haute transpiration. Il a été
démontré, à l'aide d'une m éthode améliorée, que gm reste constante durant les prem ières étapes d'un stress
hydrique jusqu'à un seuil de conductance stom atique (gs) d'environ 0,15 mol m "2 s " 1. En dim inuant
expérim entalem ent les lim itations causées par les stomates, gm et la conductance hydraulique des feuilles
n'ont pas été altérées, suggérant une isolation hydraulique partielle du mésophylle. L'application d'acide
abscissique (ABA) exogène et la cavitation du xylèm e ont mis en évidence le délai de réaction de gm par
rapport à gs, suggérant égalem ent l'isolation hydraulique du mésophylle. L'isolation hydraulique serait en
cause et entrainerait un délai dans l’achem inem ent de l'ABA, retardant ainsi la ferm eture d’aquaporines et
entrainant une déviation de l'eau vers la voie apoplastique et une diminution irréversible de gm. Toutefois, une
diminution de la turgescence résultant de la cavitation entraine une diminution de gm réversible par
pressurisation d'eau dans le xylème, suggérant un effet réversible au niveau de la membrane plasmique. Ces
deux m écanism es peuvent égalem ent être observés lors d'un stress hydrique de plus longue durée. Ainsi, la
diminution de gm est retardée de quelques jours par rapport à gs, suggérant un effet de l'ABA endogène.
Toutefois, une variation diurne de gm après plus d'une sem aine de stress suggère une réaction au
changem ent journalier de turgescence. La variation de réponse de gs entre différents génotypes de peupliers
et le délai de réaction de gm perm ettent d’augm enter le ratio gm/gs, et ce dernier est corrélé positivem ent à
l'efficacité de transpiration, une com posante foliaire de WUE. Ainsi, le ratio gm/gs serait un trait à favoriser
dans l'am élioration de W UE afin d'augm enter la résilience des plantes cultivées à la sécheresse, surtout dans
un contexte de changem ents clim atiques où la fréquence et l'intensité des périodes de séchesse sont prédits
Abstract
Increasing w ater use efficiency (W UE) is a key objective to improve the sustainability of cultivated plants to
drought. In that context, this thesis has studied the relation between leaf hydraulics and mesophyll
conductance to CO2 (gm), a com ponent that restricts carbon assimilation, in hybrid poplar clones, plants with
high growth rates and transpiration. It was first shown, using an improved m easurem ent method, that gm
remained constant during the early stages of w ater stress and declined only below a stomatal conductance
(gs) threshold of ~0.15 mol m” 2 s” 1. Removing stomatal lim itations experim entally did not improve gm or leaf
hydraulic conductance (Kleaf), which suggests a partial hydraulic isolation of the mesophyll. Furthermore,
adding xylem -fed abscisic acid (ABA) or inducing xylem cavitation again showed a delayed gm response and
hydraulic isolation of the mesophyll. Two mechanism s would be at play. First, in the case of ABA, hydraulic
isolation would delay its delivery and eventually induce mesophyll aquaporins gating and a shift towards the
apoplastic w ater pathway, thus decreasing gm. However, it is only with a decline in turgor caused by xylem
cavitation that pressurizing w ater allows fo r a full restoration of gm, which suggests a reversible change at the
plasm a membrane level. Those two mechanism s can be observed during a longer w ater stress period. Thus,
the delay in gm decline by a few days compared to gs suggests an ABA response and the partial hydraulic
isolation of the mesophyll. A fter more than a week of w ater stress, diurnal changes in gm indicate a daily turgor
variation. The variation in gs response to drought and the delay in the decline of gm increase the gm/gs ratio,
which is positively correlated to transpiration efficiency, a foliar com ponent of WUE. Thus, the gm/gs ratio was
used to discriminate between five poplar genotypes, and the results suggest that it should be improved to
increase WUE and the resilience of cultivated plants to drought, which is more than ever critical since drought
Table des matières
R É S U M É ... III A B S T R A C T ... V TABLE DES M A TIÈR ES... VII LISTE DES TA B LEA U X... XI LISTE DES F IG U R E S ...XIII LISTE DES AB RÉVIA TIO NS LES PLUS FR É Q U E N TE S ... XV R E M E R C IE M E N TS ... X IX A V A N T-P R O P O S ... XXI
CHAPITRE 1 : INTRO DUCTION GÉNÉRALE ET REVUE DE LITTÉR A TU R E... 1
1.1. ÉCHANGES GAZEUX ET P H O TO SYN TH ÈSE...2
1.1.1. Conductance du m ésophylle... 5
1.1.2. Méthodes de m esures et problém atique associée...8
1.2. HYDRAULIQUE DES PLANTES ET RELATION AVEC LES ÉCHANGES G A ZE U X ... 9
1.2.1. Relations entre l ’hydraulique et les stom ates... 9
1.2.2. Contrôle chim ique des stom ates... 10
1.2.3. Conductivité hydraulique et embolie des xylè m e s ... 11
1.2.4. Relation entre la conductivité hydraulique et la conductance du m ésophylle... 12
1.2.5. Efficacité de l ’utilisation de l ’e a u ... 14
1.3. P E U P LIE R ... 15
1.3.1. Botanique, biologie et h ybride s...15
1.3.2. Utilisation du peuplier h ybride ...17
1.4. PROBLÉM ATIQ UE ET O B JE C T IF S ... 18
CHAPITRE 2 : THRESHO LD RESPONSE OF M ESOPHYLL CO2 CO NDUCTANCE TO LEAF HYDRAULICS IN HIGHLY TRANSPIRING HYBRID POPLAR CLONES EXPOSED TO SOIL D R Y IN G ... 21
2.1. R É S U M É ... 22
2.2. A B S T R A C T ... 23
2.3. IN TR O D U C TIO N ... 24
2.4. M ATERIAL AND M E TH O D S ... 25
2.4.1. Plant m aterial and growing c o n d itio n s ... 25
2.4.2. Gas exchange and fluorescence m easurem ent... 26
2.4.3. M esophyll conductance m easurem ents and c a lib ra tio n ...26
2.4.4. Post-calibration estimation o f Rd from dark respiration m easurem ents...29
2.4.5. Short-term d rought... 29
2.4.6. Reduction o f drought-induced stom atal lim itation using low Ca... 30
2.4.8. Vulnerability c u rv e s ...31
2.4.9. Statistical a n a lysis...32
2.5. R E S U LT S ...32
2.5.1. Calibration o f the chlorophyll fluorescence m ethod for estim ating the photochem ical electron transport ra te s ...32
2.5.2. Gas exchange responses to short-term d ro u g h t... 32
2.5.3. Lowering Ca to decrease drought-induced stom atal lim ita tio n ... 33
2.5.4. Vulnerability c u rv e s ...34
2.6. DISCU SSIO N...34
2.6.1. M ethodological considerations on the estimation o f gm... 34
2.6.2. Threshold response o f gm to drought... 35
2.6.3. Exposure to low Ca decouples gs and gm...36
2.6.4. Delayed gm response to drought favors water use efficiency in hybrid p o p la r... 38
2.7. C O N C LU S IO N ... 38
2.8. SUPPLEM ENTARY D A T A ... 39
2.9. A C K N O W LE D G E M E N TS ... 39
2.10. R E F E R E N C E S ... 40
CHAPITRE 3 : M ESOPHYLL CO NDUCTANCE RESPONSE TO XYLEM -FED A B A AND SUDDEN XYLEM CAVITATION SUG G EST PARTIAL HYDRAULIC ISOLATION OF THE M ESOPHYLL IN HYBRID POPLAR ... 59
3.1. RÉSUM É... 60
3.2. A B S TR A C T...61
3.3. IN T R O D U C T IO N ...62
3.4. M ATERIAL AND M E T H O D S ...64
3.4.1. Plant m aterial and grow ing conditions...64
3.4.2. Cut shoot preparation and Kleaf m etho d olo gy... 64
3.4.3. Experim ental protocol fo r the simulation o f drought tre atm en ts ... 66
3.4.4. M esophyll conductance calculation... 67
3.4.5. Statistical a n a lysis...69
3.5. R E S U LT S ...69
3.6. DISCU SSIO N... 71
3.6.1. Conclusion: Why does poplar need a partially isolated water route from the xylem to the m esophyll?...74
3.7. A C K N O W LE D G E M E N TS ... 74
3.8. R E F E R E N C E S ... 75
CHAPITRE 4 : V AR IA BILITY IN THE RESPONSE OF M ESOPHYLL CONDUCTANCE AND LEAF HYDRAULICS TO A W A TE R S TR E S S -R E C O V E R Y CYCLE IN HYBRID AND NATIVE POPLAR G ENOTYPES: IM PLICATION FOR TRANSPIRATION EFFICIEN CY...97
4.1. RÉSUM É... 98
4.2. A B S TR A C T...99
4.3. IN T R O D U C T IO N ...100
4.4. M ATERIAL AND M E TH O D S ...102
4.4.2. Reduced irrigation and rewatering m easurem ent sequence... 102
4.4.3. M esophyll conductance calculation...103
4.4.4. Leak correction...104
4.4.5. L e a f hydraulic co n d u ctan ce ... 105
4.4.6. Stem hydraulic conductance...105
4.4.7. Cuticular conductance... 105
4.4.S. Pressure-volum e c u rv e s ... 106
4.4.9. Growth m easurem ents... 106
4.4.10. Statistical a n a lysis ...107
4.5. R E S U LT S ... 107
4.5.1. Initial clonal differences...107
4.5.2. Clonal response to reduced irrig a tio n ... 10S 4.5.3. Recovery from w ater s tre s s ...109
4.5.4. Growth response to the water stress-recovery c y c le ... 109
4.5.5. Relationships between CO2 assimilation, plant hydraulics and stom atal conductance...110
4.5.6. Transpiration efficiency and g jg s ra tio ... 110
4.6. D IS C U S S IO N ... 111
4.6.1. Differentiating susceptibility to w ater stress in poplar genotypes... 111
4.6.2. M esophyll conductance response to water stress: turgor effect vs. putative ABA involvem ent 112 4.6.3. Faster recovery o f A and gm after water s tre s s ...114
4.6.4. Transpiration efficiency and the g jg s ra tio ... 114
4.7. CO NC LU SIO N... 116
4.8. A C KN O W LED G EM EN TS...116
4.9. R E F ER E N C E S ...117
CHAPITRE 5 : G ENERAL DISCUSSION, PERSPECTIVES AND C O NC LUSIO N... 135
5.1. DOES M ESOPHYLL CO NDUCTANCE DECLINE DURING D R O U G H T ? ...136
5.2. W HAT CAUSES THE THRESHO LD R E S P O N S E ?... 137
5.3. IM PLICATIONS OF THE PROPOSED MECHANISM S AM ONG OTHER PLANT G R O U P S ...140
5.4. W HAT IS THE SIGNIFICANCE OF THE THRESHO LD R E S P O N S E ? ... 142
5.5. BREEDING FOR IMPROVED W ATER USE E F F IC IE N C Y ...143
5.6. CO NC LU SIO N... 144
C O NC LUSIO N...145
Liste des tableaux
Table 2.1. Effect of low air CO2 concentration around leaves on gas exchange and leaf hydraulics of water-
stressed hybrid poplar clones contrasting in drought tolerance...47
Table 3.1. M ixed-effect analysis of the clonal comparison during the different steps in the measurem ents
sequence fo r each drought-sim ulation treatm ents...82
Table 4.1. Description of Populus clones used in this study...125 Table 4.2. P-values for the mixed model analysis of the different m easured variables at the beginning, at the
end of the w ater stress, and after about one week of recovery...126
Table 4.3. Clonal differences in cuticular conductance, biom ass accumulation, aboveground / root biomass
ratio, leaf mass area, and height increase from the beginning of the w ater stress to the end of the recovery period, as influenced by 14 days of reduced irrigation... 127
Table 4.4. Clonal differences in leaf osm otic properties at the beginning and at peak of the w ater stress...127 Table 4.5. Percent loss of stem hydraulic conductivity at the beginning and at the end of two weeks of reduced
Liste des figures
Figure 1.1. Chemin de la diffusion du CO2 de l'extérieur de la feuille jusqu'au strom a...6
Figure 2.1. Relationship between the photochem ical electron transport rate estimated from fluorescence
m easurem ents (Jf) and gas exchange (Jco2) under 1% O2... 48
Figure 2.2. A pparent response of mesophyll conductance (gm) to intercellular CO2 mole fraction (Ci) using the
1% O2 calibration method and the proposed 21% O2 A/Ci calibration method on one Okanese leaf... 49
Figure 2.3. Changes in photosynthesis (A), mesophyll conductance (gm), and leaf hydraulic conductance (Kleaf)
in relation to stomatal conductance to w ater (gsw) during a short-term, moderate w ater stress... 50
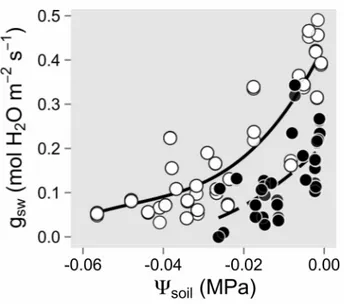
Figure 2.4. Responses of stomatal conductance (gsw) to decreasing soil w ater potential (!soil) during the short
term drought experim ent... 51
Figure 2.5. Time courses of stomatal conductance (gsw) when the upper foliage of well-watered and water-
stressed Assiniboine plants was exposed to a reduction in am bient CO2 concentration (Ca ~75 pm ol
m ol"1)...52
Figure 2.6. Stem vulnerability curve to cavitation (PLC: percent loss conductivity) in drought tolerant Okanese
and sensitive Assiniboine hybrid poplar clones... 53
Figure 2.7. Sensitivity of mesophyll conductance (gm) estim ates to a 10% increase in chloroplastic CO2
photocompensation point ( r * ) or a 50% increase in non-photorespiratory m itochondrial respiration in the light (Rd)...54
Supplem ental Figure S2.1. Apparent sensitivity of mesophyll conductance (gm) to intercellular CO2 mole
fraction (Ci) - comparison of the responses observed under three different gm estimation m ethods...545
Supplem ental Figure S2.2. Schem atic of the large plant cham ber used in the low Ca experim ent... 546 Supplem ental Figure S2.3. Changes in photosynthesis (A), mesophyll conductance (gm), stomatal
conductance (gsw), and leaf hydraulic conductance (Kleaf) during five days of w ater depletion...57
Supplem ental Figure S2.4. Relationship between leaf hydraulic conductivity (Kleaf) and leaf w ater potential
( ! leaf) during five days of w ater depletion fo r one Okanese and one Assiniboine plant...58
Figure 3.1. Schem atic diagram of the m easurem ent setup consisting of a pressure chamber, leaf
psychrometers, and a Licor LI-6400XT leaf gas exchange system combined with a P A M -2 0 0 0 chlorophyll fluorescence probe... 83
Figure 3.2. Tim e course of stomatal conductance (gs) when a hybrid poplar leaf (from a shoot cut under water
in the dark) was illum inated... 84
Figure 3.3. Time course of leaf gas exchange and Kleaf in response to exogeneous ABA application for an
Okanese shoot. Mean relative change from initial maximum values and standard error (right colum n) are presented for both Okanese and Assiniboine during the initial steady conditions before applying ABA, before pressurizing, and during pressurization... 85
Figure 3.4. Zoom over the response of stomatal (gs) and mesophyll conductance (gm) to the ABA treatm ent
Figure 3.5. Tim e response of stomatal conductance (gs) in response to pressurization of both control and
water-stress treatment, fo r one Okanese shoot each...87
Figure 3.6. Time course of leaf gas exchange and Kieaf in response to cavitation fo r an Okanese shoot. Mean
relative change from initial maximum values and standard error are presented for both Okanese and Assiniboine during the initial steady conditions before disconnecting the shoot from w ater to induce cavitation, at the peak of the transpirational burst, before pressurizing, and during pressurization...88
Figure 3.7. Tim e course of leaf gas exchange and Kleaf in response to an exogeneous ABA application
combined with cavitation for an Okanese shoot. Mean relative change from initial maximum values and standard error are presented for both Okanese and Assiniboine during the initial steady conditions before applying ABA, at the peak of the transpirational burst after the shoot was disconnected from water, before pressurizing, and during pressurization... 89
Figure 3.8. Tim e course of leaf gas exchange and Kleaf of a water-stressed Okanese shoot in response to
cavitation. Mean relative change from average well-watered Okanese values and standard errorare presented during the initial steady conditions before disconnecting the shoot from w ater to induce cavitation, before pressurizing, and during pressurization... 90
Figure 3.9. Leaf w ater potential ( ! leaf) fo r a leaf attached fo r a xylem -fed ABA shoot, with or w ithout induced
cavitation...91
Supplem ental Figure S3.1. Relationship between transpiration (E) and stomatal conductance (gs) measured
under constant VPD (1 kPa) on two different Okanese leaves and over three different leaf surfaces (2, 6, and 36 cm 2) using a Li6400-XT... 92
Supplem ental Figure S3.2. Evolution of quantum yield (#psii) measured with an imaging fluorom eter over a
leaf patch equivalent to a 2x3 cm leaf cham ber during the drought simulation treatments: xylem -fed ABA, xylem cavitation, and ABA combined with cavitation...923
Figure 4.1. Changes in photosynthesis (A), mesophyll conductance (gm), stomatal conductance (gs), and leaf
hydraulic conductance (Kleaf) during 14 days of reduced irrigation and 7 days of recovery...129
Figure 4.2. Diurnal variation in leaf and stem w ater potential ( ! leaf and !stem) at the beginning (days 0 - 2 ) of
the w ater stress period, at its peak (days 1 1 -1 4 ), and after ~7 days of recovery by rewatering (days 1 9 -2 1 ) for four hybrid poplar clones and one native Balsam poplar...130
Figure 4.3. Changes in photosynthesis (A), mesophyll conductance (gm), and leaf hydraulic conductance (Kleaf)
in relation to stomatal conductance (gs) during 14 days of irrigation reduction and 7 days of rewatering. ... 131
Figure 4.4. Responses of stomatal conductance (gs) to decreasing soil w ater potential (!soil) in one native and
four hybrid poplar clones... 132
Figure 4.5. Clonal differentiation based on transpiration efficiency (A/E), the gm/gs ratio, and on the relationship
Liste des abréviations les plus fréquentes
Symbole Unité courante Français Anglais
ABA Acide abscissique Abscissic acid
A jm o l m "2 s " 1 Photosynthèse Photosynthesis
Ca |jm ol m o l"1 Fraction molaire du CO2 ambiant,
Concentration en CO2 dans l'air
de la cuvette de mesure
Am bient CO2 mole fraction,
Leaf cham ber air CO2
concentration
Cc jm o l m o l"1 Fraction molaire du CO2
chloroplastique
Chloroplastic CO2 mole fraction
Ci jm o l m o l"1 Fraction molaire du CO2
intercellulaire
Intercellular CO2 mole fraction
Ci* jm o l m o l"1 Point de photocompensation en CO2 intercellulaire
intercellular CO2
photocompensation point
E mmol m"2 s"1 Transpiration foliaire Leaf transpiration
F m' Fluorescence chlorophyllienne
maximale
Maximal chlorophyll fluorescence
Fs Fluorescence chlorophyllienne
stable en conditions illuminées
steady-state chlorophyll fluorescence under light
gs(gsw) mol m" 2 s" 1 Conductance stom atique Stomatal conductance
9m mol m" 2 s" 1 Conductance du mésophylle Mesophyll conductance " * jm o l m o l"1 Point de photocompensation du
CO2 chloroplastique
Chloroplastic CO2
photocompensation point
J jm o l m "2 s " 1 Taux de transport en electrons Electron transport rate
Jf jm o l m "2 s " 1 J estimé par fluorescence Fluorescence estimated J
JCO2 jm o l m "2 s " 1 J estimé par échanges gazeux Gas exchange estimated J
Kfeuille / K leaf mmol m"2 s"1 M P a"1 Conductance hydraulique de la feuille
Leaf hydraulic conductance
Kplant mmol m"2 s"1 MPa" 1
Conductance hydraulique du plant
W hole plant hydraulic conductance
Ktige / Kstem
mmol s"1 Conductivité hydraulique de la tige
Stem hydraulic conductivity
LPI Index du plastochron foliaire Leaf plastochron index
PLC % Pourcentage de perte de
conductivité hydraulique (de la tige)
Percent loss of (stem) hydraulic conductivity
#PSII Efficacité photochim ique du
photosytèm e II
Photochemical efficiency of the photosystem II
o
o
œ
œ
MPa Potentiel hydrique du sol Soil w ater potential
MPa Potentiel hydrique de la feuille Leaf w ater potential
to•-ï=
œ
B-
B
-MPa Potentiel hydrique de la tige (du
xylème)
Stem (xylem) w ater potential
Rd jm o l m "2 s " 1 Respiration des mitochondries à la lumière
M itochondrial respiration in the light
Rn jm o l m "2 s " 1 Respiration à la noirceur Dark respiration
TE jm o l CO2 m m ol"1 H2O Efficacité de transpiration (A / E) Transpiration efficiency (A / E)
Vcmax jm o l m "2 s " 1 Taux de carboxilation maximale Maximum carboxylation rate
VPD kPa G radient de pression de vapeur
de l'air
(Air) vapor pressure deficit
WUE |jm ol CO2
mol"1 H2O
Efficacité d'utilisation de l'eau (A / gs)
W ater use efficiency (A / gs)
À mon père, Marc,
qui n’aura pas vu tout
Remerciements
Un doctorat est un long chem inem ent d'un parcours académique. Ce parcours comprend des embûches, du
doute, mais aussi des réussites et des com plim ents provenant de pairs d'ici et d'ailleurs. Il est difficile
d'achever cette tâche seul : le support d'un grand nombre est nécessaire pour sortir sain et sauf de ce qui
pourrait être (et est) une épreuve.
En prem ier lieu, j'aim erais remercier mon directeur de recherche, Steeve Pepin, et celui qui fut mon co
directeur officieux, G ilbert Éthier. Votre très grande disponibilité, votre bienveillance, votre aide régulière (et
financière), votre rigueur, ainsi que nos nom breuses discussions et réunions (ma foi, parfois interminables)
m 'ont guidé dans ce parcours et m 'ont permis, non pas de devenir un émule de Nigel Livingston, mais bien un
physiologiste. Je vous en suis extrêm em ent reconnaissant.
En second, j'aim erais rem ercier tous les gens qui ont facilité la réalisation des expériences et essais au cours
de mon doctorat. Sans ces personnes, les expériences présentées n'auraient pu aussi bien se dérouler.
J'aim erais spécialem ent remercier l'équipe des serres, Rachel Daigle, Nicole Deblois et Claudette Roy, sans
qui mes peupliers auraient souffert d'une sécheresse plus prononcée. Je remercie Carole Martinez, grande
responsable de la gestion des serres et de l'Envirotron, Ann-C atherine Laliberté, responsable des cham bres
de croissance, et Hugues Joannis, ingénieur responsable de l'électronique des serres à une certaine époque.
Finalement, je remercie les étudiants qui ont m 'ont tous brièvem ent aidé dans mon projet : Jean-François
Bernier, Steffi-Anne Béchard Dubé et Anne-Isabelle Bonifassi.
J'aim erais de plus remercier mes collègues étudiants que j'ai côtoyés au cours des quatre dernières années.
Sans les nom breuses discussions, échanges, jeux de mots et autres, le quotidien n'aurait pu être aussi
agréable. En particulier, je remercie, dans le désordre, Jonathan Lafond, Yann Périard-Larrivée, Guillaume
Létourneau, Simon Boudreault, Salma Taktek, Maggie Bolduc, Mélissa Girard. J'en oublie un grand nom bre...
Mais le plus important, à la fin, est d'avoir un soutien à l’extérieur des « heures de travail ». Je remercie en
prem ier lieu ma mère, Carole. Il est difficile de mettre tous mes rem erciem ents en mots, mais ton soutien m'a
porté et me porte toujours. Je remercie aussi mes beaux-parents, Raymonde et Martial. Outre votre énorme
gentillesse, je ne peux passer sous silence les petits plats que Raymonde m'a donnés! Je remercie aussi ma
belle-famille, en particulier Sophie et François, avec qui j'ai pu partager la vie de doctorant.
Finalement, je remercie celle qui est avec moi depuis le début de cette aventure et qui le sera pour les
prochaines, Myriam. À travers les hauts et les bas, tu as toujours été là pour m'écouter, pour cuisiner
Avant-propos
Cette thèse est rédigée sous form e d'articles scientifiques devant être publiés dans des revues avec comité de
lecture. Les chapitres ont été rédigés en anglais et ont été mis en form e afin de satisfaire aux normes de la
Faculté des études supérieures et postdoctorales par l’ajout d’un résumé en français précédant chaque
chapitre. Pour chaque article, les travaux expérim entaux ont été planifiés avec Gilbert Éthier et Steeve Pepin.
J'ai réalisé les m anipulations expérim entales ainsi que l'analyse des résultats, sous la supervision de Gilbert
Éthier et Steeve Pepin. Seul le chapitre 2 a été soum is pour publication et comprend des contributions
spécifiques des co-auteurs. Les chapitres 3 et 4 seront soum is pour publications : les versions de ces
chapitres sont le fruit de mon travail et n'ont pas encore été retravaillées avec les co-auteurs pour soumission.
Chapitre 2
Théroux Rancourt G, Éthier G, Pepin S. 2014. Threshold response of mesophyll CO2 conductance to leaf
hydraulics in highly transpiring hybrid poplar clones exposed to soil drying. Journal of Experimental Botany 65,
741-753.
Ce chapitre a été soum is le 6 août 2013 et accepté après révisions le 20 novem bre 2013. J'ai écrit la première
version de ce chapitre, et la version soum ise a été co-rédigée avec les co-auteurs. Le volet sur l'amélioration
m éthodologique de la mesure de la conductance du mésophylle a été conçu et rédigé principalem ent par
Chapitre 1 :
Introduction générale et
revue de littérature
Une sécheresse peut avoir des effets dévastateurs sur les végétaux. Selon la durée et l'intensité, celle-ci peut
m ener à une rupture hydraulique causant des dom m ages irréversibles par assèchement, ou une privation de
carbone par dim inution prolongée de la photosynthèse, m enant à l'inanition (McDowell et al., 2008). Bien que
les événem ents de sécheresse extrêm es soient moins fréquents dans l'Est canadien que dans les milieux plus
secs du centre du pays, il n'en dem eure pas moins que la fréquence et l'intensité des événem ents extrêm es
devraient augm enter avec les changem ents clim atiques (Sterl et al., 2008), ce qui implique une augmentation
du nombre d'événem ents de sécheresse (Dai, 2011). L'augm entation de ces événem ents pourrait nuire
grandem ent à certaines cultures, particulièrem ent chez les cultures non-irriguées et en pays en
développem ent (Huang et al., 2002). Les plantations d'arbres ne seraient pas en reste (Allen et al., 2010; Way
et al., 2013), surtout chez des arbres ayant une forte transpiration, comm e les peupliers hybrides, qui peuvent
aller jusqu'à puiser dans la nappe phréatique lors d'étés très secs (Perry et al., 2001). Ainsi, l'efficacité
d'utilisation de l'eau s'avère aujourd'hui un critère essentiel dans la sélection de végétaux afin d'augm enter
leur résilience aux changem ents climatiques.
D'un point de vue physiologique, les stom ates doivent rester ouverts afin de perm ettre la diffusion du CO2 vers
les chloroplastes, ce qui entraîne une perte d'eau par évaporation (c'est à dire la transpiration). Cette eau
circule du xylèm e directem ent vers l'épiderm e ou par le mésophylle pour évaporation dans l’espace sous-
stomatique. Les cellules du mésophylle, où se trouvent la majorité des chloroplastes, sont donc un lieu m ajeur
de rencontre des chem ins de l'eau et du CO2 dans la plante. La conductance du mésophylle au CO2 (gm)
représente la diffusion du CO2 sous form e liquide depuis l'espace sous-stom atique jusqu'aux sites de
carboxylation à l'intérieur des chloroplastes (Tholen et al., 2012). Bien que l'im portance de gm dans le contrôle
de la photosynthèse soit reconnue depuis de nom breuses années et que cela en fait de plus en plus une
mesure essentielle, certaines questions restent d'actualité. La réponse de gm à la sécheresse a notam m ent
présenté certains résultats contradictoires. Une façon de résoudre cette problém atique serait d'augm enter
notre com préhension des relations entre gm et le transport de l'eau dans la plante et la feuille. L'étude de ces
relations perm ettrait de m ieux com prendre les mécanism es affectant les processus biochim iques et
d'échanges gazeux reliés à la photosynthèse et à l'utilisation de l'eau au niveau de la feuille. Ceci permettrait,
à terme, d'être utilisé dans l'am élioration de la résilience de végétaux face au stress hydrique et aux
changem ents climatiques.
1.1. Échanges gazeux et photosynthèse
Les échanges gazeux de CO2 et de vapeur d'eau entre la feuille et l'air sont des m esures de base pour les
intercellulaire en CO2 (Ci) sont les variables les plus couram m ent déterm inées lors de ces mesures. À cause
de la double fonction de l'enzyme photosynthétique ribulose-1,5-biphosphate carboxylase-oxygénase
(Rubisco), on définit A com m e étant le taux net d'assim ilation en CO2 d'après :
A = Vc - 0,5Vo - Rd [1.1]
où Vc est le taux de carboxylation, Vo le taux d'oxygénation et Rd la respiration des mitochondries à la lumière
(modèle FvCB; Farquhar et al., 1980). C 'est entre autres avec ces variables que Farquhar, von Caem m erer et
Berry ont m odélisé les processus biochim iques de la photosynthèse afin d'obtenir le taux de carboxylation
maximale (Vcmax) et le taux de transport en électrons sous conditions saturées en lumière et CO2 (Jmax), deux
param ètres ayant de grandes variations écophysiologiques et génotypiques. Cette m odélisation a ensuite
permis une augmentation d'échelle, au niveau d'un peuplem ent (Collatz et al., 1991; Sellers, 1985), et à une
échelle plus vaste en incluant ces mesures dans des modèles globaux d'échanges gazeux (Cox et al., 1998).
Le modèle FvCB a eu un impact m ajeur sur les études liées à la photosynthèse, mais ce dernier a été critiqué
puisqu'il insérait un biais dans les résultats du modèle et pouvait augm enter l'erreur associée à l'estimation
des paramètres, entre autres à cause du fait que gm n'y est pas incluse (Éthier et Livingston, 2004; Flexas et
al., 2008). Éthier et Livingston (2004) ont donc dérivé le modèle FvCB et l'ont reformulé afin d'y inclure gm.
Leur modèle prend la form e d'une équation quadratique (version de Éthier et al., 2006) :
A - - b [1.2]
2a 1 J
Ac : a - 1/gm
b - (Vcmax “ Rd)/gm + Ci + Kc(1 + O/Ko) c - Rd(Ci + Kc(1 +O/Ko)) - Vcmax(Ci - " * )
Aj : a - -1/gm
b - (J/4 - Rd)/gm + Ci + 2 P c - Rd(Ci + 2 P ) - J/4(Ci - " * )
où Ac et Aj sont, respectivement, les taux d'assim ilation en conditions ribulose-1,5-biphosphate (RuBP)-
saturées (généralem ent Ci < 300 ppm) et RuBP-lim itées (généralem ent Ci > 300 ppm), Kc et Ko sont les
constantes catalytiques pour la carboxylation et l'oxygénation de la Rubisco, O est la concentration en
oxygène, r * , le point de photocompensation du CO2 chloroplastique, soit la Ci où A égalerait zéro si Rd était
nulle.
Il est à noter que la déterm ination de r * nécessite des m esures biochim iques puisqu'il est lié aux cinétiques
intercellulaire, car celui-ci est plus facilem ent mesurable grâce aux appareils de mesures d'échanges gazeux.
La conductance stom atique (gs) représente quant à elle la facilité avec laquelle la diffusion de la vapeur d'eau
se produit entre l'espace sous-stom atique et l'atm osphère, bien que les stom ates servent aussi d'entrée au
CO2 lors de la photosynthèse (la diffusion du CO2 est 1,6 fois plus petite que celle de la vapeur d’eau). La
conductance stom atique est régulée selon l'ouverture des stomates, qui varie selon des signaux chim iques et
hydrauliques (abordé à la section 1.2).
Lors d'un stress hydrique ou osmotique, on observe en général une diminution de la conductance stomatique,
ce qui perm et de dim inuer les pertes d'eau. Ceci a été observé chez de nom breuses espèces ou génotypes
(Populus sp. : Bassman et Zwier, 1991; Braatne et al., 1992; Chen et al., 2002; Desrochers et al., 2007; Vitis sp. : Flexas et al., 2009; Medrano et al., 2003; Vitis vinifera et Olea eoropaea : Perez-M artin et al., 2009). La
diminution de gs est le plus souvent associée à une diminution de la photosynthèse puisque la ferm eture de
stom ates entraine une dim inution de la diffusion de CO2 vers l’ intérieur de la feuille. La relation entre la
diminution de A et de gs est en général très robuste, tel qu'observée dans les études auparavant citées.
Toutefois, si l'on compare des lignées parentales à leurs hybrides, on observe que les traits physiologiques en
lien avec la tolérance à la sécheresse sont parfois améliorés lors de croisem ents entre deux espèces. Par
exemple, il a été observé que chez un clone de Populus trichocarpa " deltoides, les taux de photosynthèse
étaient supérieurs à ceux des deux lignées parentales, ce qui n'était pas le cas pour gs (Bassman et Zwier,
1991). Bien que A n'ait pas été mesuré par Braatne et al. (1992), ces derniers ont quand même observé qu'un
hybride F1 avait une efficacité de transpiration supérieure à ses parents lors d’ une sécheresse. Ainsi, les
hybrides auraient des propriétés de productivité ou de tolérance à la sécheresse supérieures à leurs parents.
Bien que la dim inution de A et gs en réaction à la sécheresse soit en général une relation robuste, ceci est plus
nuancé en ce qui a trait à la relation entre A et la productivité ou la croissance des plants, une réponse à plus
long terme. Celle-ci peut être parfois faibles, comm e pour une étude effectuée sur deux clones de peupliers
hybrides affectés par un stress hydrique (Dickmann et al., 1992). Néanmoins, la mise en évidence d'une
relation entre A et la productivité des plants est parfois très robuste pour un grand nombre d’espèces de
différents groupes fonctionnels et ayant poussés sous différentes conditions (ex.: stress osmotique, niveaux
de phosphore différents). En effet, la relation entre le taux de croissance relatif et la photosynthèse par unité
de masse foliaire totale ou de masse totale du plant était très forte (R2 > 0.8) lorsque les données de 19
études étaient com binées (Kruger et Volin, 2006).
Ainsi, les relations entre les variables liées aux échanges sont généralem ent fortes entre elles et sont aussi
reliées à la croissance des plants. Toutefois, une com posante importante de la diffusion du CO2 n'a pas été
chloroplastes. Attardons-nous à cette conductance afin d'avoir un portrait plus com plet des effets des stress
hydriques sur la photosynthèse.
1.1.1. Conductance du mésophylle
La conductance du mésophylle (gm = 1 / résistance du m ésophylle) représente une série de résistances au
passage du CO2 de l'espace sous-stom atique jusqu'aux sites de carboxylation dans les chloroplastes, ce qui
implique principalem ent une phase liquide (Evans et al., 2009; Terashim a et al., 2011; Tholen et al., 2012; voir
Figure 1.1). Le CO2 doit donc traverser de nom breuses mem branes et m ilieux : paroi cellulaire, membrane
plasmique, cytosol, enveloppe du chloroplaste, enveloppe des strom as et le strom a en tant que tel. Toutefois,
la paroi cellulaire et l’enveloppe du chloroplaste offriraient les plus importantes résistances à la diffusion du
CO2 (Tholen et Zhu, 2011). Le CO2 peut être diffusé dans la phase liquide tel quel, mais cela peut être facilité
grâce à l'anhydrase carbonique qui perm et de convertir le CO2 sous la form e de bicarbonate (HCO3- ) (Evans
et al., 2009). Cette diffusion sous form e de HCO3- , qui nécessite une diffusion égale du CO2, de HCO3- et
d'ions H+, est facilitée par le gradient de pH entre l'apoplaste, légèrem ent acide, et le stroma, légèrem ent
alcalin. De plus, la diffusion du CO2 peut aussi être facilitée grâce à protéines membranaires, les porines, des
canaux facilitant le passage de m olécules spécifiques. Les aquaporines, des transporteurs spécifiques aux
m olécules d'eau, auraient une double nature perm ettant le passage à la fois de l'eau et du CO2 (Kaldenhoff,
2012; Terashim a et al., 2011; Uehlein et al., 2008). Ainsi, tous ces éléments, soit les propriétés anatom iques
des m embranes et du mésophylle, l'activité de l'anhydrase carbonique, de la Rubisco et des aquaporines,
Figure 1.1. Chemin de la diffusion du CO2 de l'extérieur de la feuille jusqu'au stroma. La partie de gauche
m ontre une coupe transversale d'une feuille et les différentes concentration en CO2 (Ca : air ambiant; Cs :
espace sous-stom atique; Ci : espace intercellulaire). La partie de droite montre le passage du C O2 de l'espace
intercellulaire vers le stroma. Le C O2 passe soit directem ent vers le strom a collé à la membrane plasm ique du
m ésophylle (chemin A) ou par le cytosol (chemin B). Le schém a du bas montre la décom position des
résistances (R) au passage du CO2 et correspond à la résistance du mésophylle (1/gm). Le C O2 traverse en
prem ier la paroi cellulaire (Rw). Viennent ensuite les différentes résistances cellulaires (Rc) : membrane
plasm ique (Rpm), cytosol (Rcytosol), enveloppe du chloroplaste (Renv) et strom a (Rstroma). Lors du passage à
travers les membranes, le C O2 peut prendre deux chemins, soit directem ent à travers la m em brane (rpm bm et
renv,bm) ou par l'interm édiaire des aquaporines (rpm,aq et renv,aq). Figure provenant de Terashim a et al. (2011) et
Historiquement, g m a longtemps été considérée com m e étant infinie, c'est-à-dire que la résistance à la
diffusion du CO2 était négligeable (Flexas et al., 2008). En d'autres mots, Ci égale à Cc, la concentration en
CO2 dans les chloroplastes. Toutefois, depuis une trentaine d'années, de nom breuses recherches ont montré
le contraire (voir par exem ple Harley et al., 1992). En effet, com m e chez plusieurs plantes ligneuses décidues,
g m atteint des valeurs sous les 0,2 mol m-2 s " 1, ce qui serait suffisant pour lim iter la photosynthèse (ex. :
Populus maxim owiczii, 0 ,0 4 -0 ,2 0 , Hanba et al., 2001; P. balsamifera, 0 ,1 7 -0 ,4 5 , Soolanayakanahally et al., 2009; P. deltoïdes " P. nigra, 0,50, Roupsard et al., 1996; voir aussi la revue de littérature de Éthier et
Livingston, 2004).
En général, gm dim inue lors de stress hydriques, et cette diminution aurait lieu conjointem ent à celle de gs et
de la capacité photosynthétique et serait presque aussi rapide que celle-ci (revue par Flexas et al., 2008). À
court terme, gm ne serait pas affectée par une variation du gradient de pression de vapeur d'eau dans l'air
(VPD; Warren, 2008), mais un effet du VPD à moyen term e a été observé chez Vitis vinifera et Olea europea,
et ce, en combinaison avec un stress hydrique (Perez-M artin et al., 2009).
À l'instar de gs, la diminution de g m serait toutefois réversible. Par exemple, il a été dém ontré chez le riz (Oryza
sativa) que gm et A pouvaient revenir en moins de 24 h à leurs valeur initiale, avant l'im position d'un stress hydrique (Centritto et al., 2009). Cette même étude a montré que les génotypes possédant une g m plus élevée
étaient capable de m aintenir A plus élevée lors d'un stress hydrique. Cette différence entre génotypes a aussi
été observée chez P. balsam ifera, où l'on a observé en serre que des génotypes de l'Arctique canadien
possédaient une g m 2,4 fois supérieure aux génotypes du Sud canadien, laquelle fut attribuée à la longueur de
la saison de croissance, les génotypes arctiques devant com pléter leur cycle végétatif plus rapidement, donc
nécessitant une assimilation nette plus importante (Soolanayakanahally et al., 2009). Cette différence de g m
était associée à une A plus importante, tandis qu'aucune différence n'était observée pour gs, ce qui indique
que dans des conditions de croissance similaires, les contraintes non stom atiques sont importantes dans le
contrôle de A. Toutefois, ceci n'em pêche pas les génotypes du Sud d'être productifs, ceux-ci devant
com penser pour une saison de croissance et une durée de vie foliaire plus longue en dim inuant gm.
Ainsi, g m serait une contrainte importante à A lors de stress hydriques (Perez-M artin et al., 2009). Néanmoins,
certaines études portant sur des épisodes de sécheresse de courte ou de moyenne durée ont montré peu ou
pas de relation entre gs et g m (Galle et al., 2009; Resco et al., 2009). Récemment, il a été suggéré que gm varie
peu lorsque le chemin que l'eau doit parcourir du xylèm e jusqu'aux sites d'évaporation est petit (# 20 mm),
mais que g m dim inue linéairem ent lorsque la distance augm ente au dessus de cette longueur minimale (Ferrio
et al., 2012). Toutefois, ce seuil, ainsi que la relation entre gs et g m, pourraient être expliqués par
al., 2012). L'augm entation de l'apport en CO2 de la photorespiration pourrait expliquer les différences de
réponse à des stress hydriques d'intensités variables et pourrait en soit être un artefact de la dim inution du Ci,
et non une réduction de la perm éabilité des mem branes cellulaires tel que proposée par Ferrio et al. (2012).
La relation entre gs et gm sem ble donc être conflictuelle et le deuxièm e chapitre de la présente thèse a pour
but de l'évaluer à nouveau en tenant com pte des récents développem ents en ce qui a trait à l'estim ation de gm.
1.1.2. Méthodes de mesures et problématique associée
Il a été discuté précédem m ent de A et gs. Il est important de spécifier que ces valeurs sont facilem ent
m esurables à l'aide d'appareils de mesures d'échanges gazeux portatifs de type « ouvert », tel le LI-6400 (LI
COR Biosciences, Lincoln, NE, États-Unis), sur lesquels on peut fixer un module perm ettant de m esurer la
fluorescence chlorophyllienne émise lors de la photosynthèse. L'utilisation de cuvettes de mesures de type
« pince » a aussi grandem ent facilité les mesures d'échanges gazeux. Toutefois, ces cuvettes ne couvrent
qu'une portion de la feuille et, par conséquent, on observe fréquem m ent des fuites, tant en CO2 qu'en vapeur
d'eau (Flexas et al., 2007; Long et Bernacchi, 2003; Pons et al., 2009; Rodeghiero et al., 2007). Bien que ces
fuites soient souvent relativem ent faibles (ex. : ± 0,5 pm ol CO2 mol-1 et ± 0,05 mmol H2O mol-1 à un flux
variant de 500 à 600 mol s-1, observation personnelle), elles peuvent être plus importantes lorsque la
différence entre les conditions ambiantes et celles à l'intérieur de la cuvette sont grandes, ainsi que lorsque le
flux d'air entrant dans la cuvette est faible (Rodeghiero et al., 2007). Les erreurs causées par ces fuites sont
parfois importantes et ont une implication majeure, com m e c'est le cas avec la technique dite de « Laisk »
pour estim er les valeurs de Rd et de Ci*. Certains auteurs ont donc remis en question la précision des
estim ations des param ètres du modèle FvCB et le débat est toujours d'actualité (Jahnke et Pieruschka, 2006;
Long et Bernacchi, 2003; Rodeghiero et al., 2007; Tholen et al., 2012).
En ce qui concerne les mesures de g m, une multitude de méthodes sont possibles afin d’estim er cette
conductance. Une méthode couram m ent utilisée pour sa sim plicité et sa rapidité est la mesure du taux
variable de transport des électrons (« variable J »), im pliquant des mesures sim ultanées de fluorescence
chlorophyllienne et d'échanges gazeux (Harley et al., 1992). Une autre méthode se base uniquem ent sur les
échanges gazeux en utilisant des courbes détaillées de A-Ci (Éthier et Livingston, 2004; Gu et al., 2010;
Sharkey et al., 2007). Enfin, un troisièm e groupe de m éthodes couram m ent utilisées se base sur la
discrimination isotopique des produits de l'assimilation et de la respiration (sous form e gazeux) ou sur les
sucres solubles récem m ent synthétisés (Centritto et al., 2009; Pons et al., 2009; Tazoe et al., 2011). Toutefois,
aucune de ces m éthodes n'est parfaite et les sources potentielles d'erreur ne doivent pas être négligées, gm
Harley et al., 1992; Pons et al., 2009). Selon les époques, certaines m éthodes sont discréditées et certaines
recherches les réhabilitent par la suite (Pons et al., 2009; Tholen et al., 2012). Par exemple, la m éthode du J
variable, ayant de nom breuses limites, peut cependant être améliorée par une calibration plus détaillée
(Gilbert et al., 2011) et par des m esures à un Ci norm alisé (suggéré par Tholen et al., 2012; voir aussi chapitre
2). Il faut donc être vigilant lors des mesures d'échanges gazeux réalisées dans le but d'estim er g m et être
conscient des sources potentielles d'erreurs afin de tenter de les minimiser.
1.2. Hydraulique des plantes et relation avec les échanges
gazeux
1.2.1. Relations entre l’hydraulique et les stomates
La quasi-totalité de la consom m ation d'eau d'une plante se produit dans les feuilles, qui sont le plus souvent
éloignées des sources d'eau dans le sol. Le transport de l'eau peut être exprimé par analogie à la loi d'Ohm,
où la consom m ation en eau (transpiration : E) est le résultat d'une conductivité (conductivité hydraulique de la
plante; Kplante) et d'un gradient de potentiel (gradient potentiel hydrique du sol - feuille : !s o l - !feuille)
(Comstock, 2002). Étant donné que E = gs " VPD (déficit de pression de vapeur), ceci donne :
gs = Kplante (!so l - !feuille) / VPD [1.3]
Cette équation suggère donc un contrôle hydraulique des stomates, et de nom breuses études ont dém ontré la
validité de ce type de contrôle (Brodribb et al., 2003; Sack et Holbrook, 2006; Sperry, 2000). Le contrôle
hydraulique des stom ates a été mis en évidence par des relations avec des variables reliées au continuum
so l-plante-atm osphère. Ainsi, il a été dém ontré dans de nom breuses études que ce qui entraine une
diminution de la conductivité hydraulique (ex. cavitation du xylèm e : (Brodribb et Feild, 2000; Cochard et al.,
2002; Johnson et al., 2012; Sack et Holbrook, 2006; Tyree et al., 1992)) ou une modification du gradient de
potentiels (ex. pressurisation des racines : Fuchs et Livingston, 1996; Passioura et Munns, 1984; Solari et
DeJong, 2006) entraine une m odification de gs. De plus, on note des liens spécifiques entre gs et la teneur en
eau ou !s o l (Braatne et al., 1992; Grams et al., 2007), ainsi qu'une corrélation de gs avec le potentiel de
pression du xylème, !tige (Bassman et Zwier, 1991). Finalement, l'assèchem ent de l'air, soit une modification
du VPD, mène à la ferm eture des stom ates (Oren et al., 1999; Warren, 2008), bien que cela dépende de
l'intensité de la transpiration, une transpiration plus faible présentant une plus faible variation liée au VPD
(Brodribb et Jordan, 2008). Ainsi, l’équation 1.3 semble bien décrire les relations observées entre gs et
Bien que le contrôle hydraulique proviendrait de la relation entre !feuille et gs, certains ont observé des relations
faibles de !feuille avec gs, tandis que la relation était beaucoup plus forte avec le potentiel hydrique foliaire
avant l'aube (!p d : indice du potentiel matriciel de la couche de sol dans laquelle les racines participant au
transport de l'eau sont établies) (Reich et Hinckley, 1989). En effet, chez deux espèces de chêne, g max (gs
m aximale pour une journée) plafonnait à plusieurs valeurs de !feuille et chutait lorsque le !feuille atteignait un
seuil de -3 ,5 MPa, ce qui suggère que g max est plus reliée au statut hydrique du sol que de la feuille, donc
qu'un signal de régulation proviendrait des racines. Cette notion de seuil concernant le lien entre gs et le
potentiel de pression du xylèm e a aussi été observée chez des clones de peupliers (Bassman et Zwier, 1991).
De plus, chez deux cépages de vignes, !p d était plus fortem ent corrélé avec gs que !feuille (M edrano et al.,
2003). Il faut toutefois être prudent avec les mesures de !p d puisque, lorsque le déficit de pression de vapeur
entre la feuille et l'air est important, une transpiration nocturne peut se produire, ce qui fait que !p d n'est pas
en équilibre avec le sol et n'est pas un bon indice de !s o l (Kavanagh et al., 2007). Les stom ates ne sont
cependant pas contrôlés uniquem ent de façon hydraulique puisqu'il a été dém ontré qu'ils peuvent se ferm er
sans qu'il n'y ait de baisse de potentiel hydrique des feuilles (Lovisolo et al., 2002).
1.2.2. Contrôle chimique des stomates
Il a été suggéré qu'à cause de leur grande taille, les arbres seraient plus sensibles à un contrôle hydraulique
qui s'avère plus rapide qu'un contrôle chim ique si l'on considère la grande distance pouvant séparer les
feuilles des principaux sites de production d'acide abscissique (ABA) (Fuchs et Livingston, 1996). On
considère toutefois qu'il y a com binaison de ces deux modes de contrôle des stom ates (Comstock, 2002;
Davies et Zhang, 1991; Tardieu et Simonneau, 1998). On reconnaît aussi qu'en réponse à un stress hydrique
ou osmotique, la production d'ABA aurait lieu dans tous les organes de la plante: celle-ci aurait lieu en prem ier
dans les racines et serait suivie par une production dans les feuilles (Neales et McLeod, 1991; Simonneau et
al., 1998). Il n'est toutefois pas nécessaire que la feuille soit dans des conditions hydriques ou hydrauliques
défavorables pour que la production d'ABA ait lieu: l'utilisation d'une experience de type « split-pot » (racines
divisée entre un pot bien irrigué et un pot asséché; ex. Lovisolo et al., 2002) mène à la production d'ABA sans
aucune variation du !feuille.
À la suite de son achem inem ent aux feuilles, l'ABA a pour effet d'envoyer un signal aux cellules de garde, ce
qui mène à la ferm eture des stomates. Ceci a pour effet de dim inuer gs et E (Aasam aa et al., 2002; Pantin et
al., 2013; Ridolfi et al., 1996), ainsi que A (Aasam aa et al., 2002; Schaufele et al., 2011), bien que ce dernier
effet puisse être négligeable (Vrabl et al., 2009). L'ABA serait aussi impliqué dans la régulation des
(Kaldenhoff et al., 2008). Il a tout récem m ent été suggéré que l'ABA régule la ferm eture des stom ates à l'aide
des deux mécanism es : outre l'effet direct sur les cellules de garde, on retrouverait une rétroaction indirecte
causée par la réduction de la perm éabilité des mem branes des tissus vasculaires qui aurait lieu,
vraisem blablem ent, par la régulation des aquaporines au niveau de la gaine périfasciculaire (Pantin et al.,
2013). Cette double action de l'ABA pourrait lier les signaux chim iques et hydrauliques dans la réponse au
stress hydrique. En effet, l'ABA a un effet sur l'hydraulique des plantes, tel qu'observé dans de nombreuses
études : diminution de Kfeuille (Shatil-Cohen et al., 2011), rôle indirect dans le remplissage du xylèm e après
cavitation (Secchi et al., 2012), ainsi qu'une cavitation extrêm e résultant d’une absence de ferm eture des
stom ates chez un peuplier insensible à l'ABA (Cochard et al., 1996). C'est donc en contrôlant au niveau des
stom ates et des aquaporines que l'ABA serait impliqué dans les voies du CO2 et de l'eau au niveau de la
feuille (Pantin et al., 2012).
Toutefois, les résultats ont pour l'instant été contradictoires concernant l'effet de l'ABA sur gm : soit aucun effet
(Vrabl et al., 2009), ou une diminution (Schaufele et al., 2011). Pour ajouter à l'incertitude, des mutants
insensibles à l'ABA d'Arabidopsis thaliana ont montré que gs et gm varient de façon indépendante (Tazoe et al.,
2011), donc que ces deux variables seraient affectées par l'ABA mais par des mécanism es différents. Le
troisièm e chapitre de cette thèse a pour but d’évaluer l’effet de l’ABA et de la cavitation du xylèm e afin de
déterm iner leurs contributions relatives à la diminution de gm lors d'un stress hydrique.
1.2.3. Conductivité hydraulique et embolie des xylèmes
Tel que vu précédem m ent, lors d'un stress hydrique, outre la production d'ABA, on observe une réponse
hydrique (ex. dim inution de !feuille) et hydraulique (ex. diminution de Kplante). Toutefois, ces dim inutions peuvent
être très néfastes puisqu'elles peuvent entrainer des dom m ages irréversibles à la plante : mort de cellules,
perte de feuilles, de branches, et jusqu'à l'assèchem ent de la plante en cas extrêm es (McDowell et al., 2008).
Chez les plantes ligneuses, le fait que la conductivité hydraulique maximale chute lorsqu'un seuil de potentiel
hydrique est atteint est un indice qu'elles opèrent près d'un seuil critique de tension dans le xylème. Lorsque
ce seuil est dépassé, la cavitation se produit, causant la perte de la continuité de l'eau dans la lumière des
trachéides ou des élém ents de xylèm e et leur em bolie par remplissage avec de la vapeur d'eau et de l'air, ce
qui peut m ener à des dom m ages irréversibles (Tyree et Sperry, 1988). Ce phénom ène de seuil critique a été
observé chez plusieurs espèces d'arbres, dont certaines espèces de peupliers (Bond et Kavanagh, 1999;
Tyree et al., 1994). Le potentiel hydrique dans le xylèm e diminue avec (i) une dim inution de !s o l puisque cette
tension doit être plus élevée afin de prélever l'eau résiduelle dans le sol ou (ii) une augm entation de la
ferm eture partielle des stom ates afin de conserver la conductivité hydraulique sous un certain seuil,
perm ettant ainsi d'opérer au seuil de la rupture hydraulique. Un des effets de cette rupture hydraulique et des
em bolies qui en résultent est la perte de feuilles et de tiges secondaires, ce qui suggère que des plantes aux
feuilles pérennes nécessiteraient des élém ents de xylèm e plus résistants à la cavitation que des espèces à
croissance rapide et aux feuilles décidues, tel le peuplier (Bond et Kavanagh, 1999).
Chez plusieurs espèces, les conductivités hydrauliques de la tige et de la feuille, Ktige et Kfeuille, sont corrélées
positivem ent à gs et à A, et c’est grâce à cette régulation entre l’hydraulique et les échanges gazeux que
certaines espèces m aintiendraient leur seuil critique de tension du xylèm e (Aasam aa et Sôber, 2001; Brodribb
et Feild, 2000; Chen et al., 2010; Cochard et al., 1996; Sack et Holbrook, 2006; Santiago et al., 2004; Tyree et
al., 1992). Au niveau de la tige, l'eau circule dans le xylèm e et y rencontre peu de résistance. Toutefois, dans
les feuilles, la sortie de l'appareil vasculaire peut entrainer des résistances majeures au m ouvem ent de l'eau
et être la cause d'une diminution importante de Kfeuille, mais cela est principalem ent le cas chez des plantes
dont la Kfeuille maximale est faible ou chez des plantes d’ombre (Sack et al., 2004; 2005). De plus, lors d'un
stress hydrique, il y aura déplacem ent du m ouvem ent de l'eau d'un transport m ajoritairem ent cellulaire (voies
sym plastique et transcellulaire combinées) vers un transport m ajoritairem ent apoplastique (Pou et al., 2013),
ce qui augm ente la longueur du chem in que l'eau doit parcourir à cause de la tortuosité plus élevée de
l'apoplaste.
Les aquaporines seraient aussi impliquées dans la régulation de la conductivité hydraulique. Au niveau du
xylème, les aquaporines sont impliquées dans le remplissage des vaisseaux après cavitation, tant au niveau
de la tige (Secchi et Zwieniecki, 2010) que du pétiole (Perrone et al., 2012). Au niveau de la feuille, les
aquaporines sont impliquées dans la régulation de Kfeuille (Cochard et al., 2007; Pou et al., 2013), et, sous
l'action d'ABA, une ferm eture d'aquaporines au niveau de la gaine périfasciculaire m ènerait à cette diminution
(Pantin et al., 2013; Shatil-Cohen et al., 2011).
1.2.4. Relation entre la conductivité hydraulique et la conductance du mésophylle
S'attarder aux relations entre l'hydraulique des plantes et la conductance du mésophylle implique l'étude de
ces relations au niveau de la feuille et particulièrem ent le lien avec la conductivité hydraulique des
feuilles (Sack et Holbrook, 2006). Il a été suggéré que la majorité de l'évaporation de l'eau dans la feuille se
produit au niveau de l'épiderme par les cellules près des stomates, soit la zone péristom atique (ex. Tyree et
Yianoulis, 1980). Une évaporation plus importante au niveau de l'épiderme rend valide les modèles
(Farquhar et Sharkey, 1982). Cette hypothèse a été validée à l'aide de modèle, mais n'a pas été validée
expérim entalem ent puisque la mesure de l'évaporation dans les différentes parties de la feuille est difficile.
Toutefois, cela semble être en accord avec l'im portance des différents chem ins de transpiration de l'eau dans
la feuille où, par exemple, l’eau est transportée préférentiellem ent du xylèm e vers l’épiderm e par la gaine
périvasculaire pour la majorité des angiosperm es (Zwieniecki et al., 2007). Bien que l'hypothèse de la
dom inance de l'évaporation péristom atique soit généralem ent reconnue comm e étant valide, il y a
certainem ent des variations entre espèces en ce qui a trait à la dom inance de cette source d'évaporation
intrafoliare (Buckley et al., 2011). De plus, certains ont estimé que l'évaporation provenant du mésophylle
pouvait être aussi importante que celle provenant de la zone péristom atique (Pieruschka et al., 2010) et une
récente étude de m odélisation dém ontre aussi que l'évaporation peut avoir lieu dans toute la feuille (Rockwell
et al., 2014).
Peu importe le site principal d'évaporation de l'eau, il n'en dem eure pas moins qu'une partie du chemin
em prunté par l'eau par les voies apoplastique—sym plastique—transcellulaire du m ésophylle est partagée avec
le CO2 diffusant vers le chloroplaste (Evans et al., 2009). Puisque gm représente principalem ent la diffusion du
CO2 dans la phase liquide, on pourrait s'attendre à un lien fonctionnel entre gm et le transport de l'eau dans les
feuilles, voire avec Kfeuille, soit par l'état hydrique de la paroi cellulaire ou par l'activité des aquaporines (Maurel
et al., 2008; Sack et Holbrook, 2006; Uehlein et al., 2012). Aasam aa et al. (2005) ont montré que Kfeuille
augm ente avec la porosité du mésophylle, donc avec la diminution de sa densité, ce qui perm ettrait aussi
d'augm enter gm (Loreto et al., 1992). De plus, Aasam aa et al. ont suggéré que d’autres traits reliés aux
mem branes du mésophylle, tels que leur perm éabilité ou la fréquence des mem branes plasm iques et
tonoplastes, ont une influence sur Kfeuille. Toutefois, l'effet d'un contrôle m em branaire sur gm est toujours un
sujet controversé (discuté par Kaldenhoff, 2012), mais cela pourrait perm ettre de réconcilier l'effet potentiel de
variation de l'état hydrique sur gm si l’hypothèse d'une dom inance de l'évaporation péristom atique est valide
puisque le flux de transpiration aurait peu d'influence sur le mésophylle (en considérant les résultats de
Zwieniecki et al., 2007).
Récemment, Ferrio et al. (2012) ont suggéré que la relation entre gm et Kfeuille serait présente seulem ent
lorsqu'un seuil serait atteint: dans leur cas, cela représentait une certaine longeur que l'eau doit parcourir à sa
sortie du xylèm e (voir la section 1.1.1). On peut présum er que la diminution en parallèle de gm et Kfeuille lors
d'un stress hydrique serait le résultat de la diminution de la perm éabilité de la membrane plasmique au CO2 et
à l'eau, ce qui redirigerait le transport de l'eau de la voie sym plastique—transcellulaire vers la voie apolastique,
augm entant ainsi la tortuosité du chemin em prunté (Ferrio et al., 2009; 2012). Cette hypothèse d'un seuil de