HAL Id: dumas-01366767
https://dumas.ccsd.cnrs.fr/dumas-01366767
Submitted on 15 Sep 2016
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Des formes topiques classiques aux formes
transdermiques : formulation et procédés
Aude Feurtet
To cite this version:
Aude Feurtet. Des formes topiques classiques aux formes transdermiques : formulation et procédés. Sciences pharmaceutiques. 2006. �dumas-01366767�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
thesebum@ujf-grenoble.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteur
1111111
lif
IÏl~i1i11i'lll
l llll
D 11 s 087788 6
Année: 2006
UNIVERSITE JOSEPH FOURIER
FACULTE DE PHARMACIE DE GRENOBLE
No
~'101
J
DES FORMES TOPIQUES CLASSIQUES AUX FORMES TRANSDERMIQUES : FORMULATION ET PROCEDES
THESE
PRESENTEE POUR L'OBTENTION DU TITRE DE DOCTEUR EN PHARMACIE
Aude FEURTET
DIPLÔME D'ETAT
THESE SOUTENUE PUBLIQUEMENT A LA FACULTE DE GRENOBLE
Le :27 avril 2006
DEVANT LE JURY COMPOSE DE
Président du jury : Mr Aziz BAKRI, Professeur de Pharmacie Galénique à la faculté de Pharmacie de Grenoble
Membres:
Mr Patrice SEBERT, Professeur de Pharmacie Galénique à la faculté de Pharmacie de Lyon Mr Vincent JANNIN, Docteur en Pharmacie, Responsable R&D, Gattefossé
Année: 2006
UNIVERSITE JOSEPH FOURIER
FACULTE DE PHARMACIE DE GRENOBLE
No
DES FORMES TOPIQUES CLASSIQUES AUX FORMES TRANSDERMIQUES :
FORMULATION ET PROCEDES
THESE
PRESENTEE POUR L'OBTENTION DU TITRE DE DOCTEUR EN PHARMACIE
Aude FEURTET
DIPLÔME D'ETAT
THESE SOUTENUE PUBLIQUEMENT A LA FACULTE DE GRENOBLE
Le : 27 avril 2006DEVANT LE JURY COMPOSE DE
Président du jury : Mr Aziz BAKRI, Professeur de Pharmacie Galénique à la faculté de Pharmacie de Grenoble
Membres:
Mr Patrice SEBERT, Professeur de Pharmacie Galénique à la faculté de Pharmacie de Lyon Mr Vincent JANNIN, Docteur en Pharmacie, Responsable R&D, Gattefossé
BAKRI BURMEISTER CALOP DANEL DECO UT DEMENGE DROUET FA VIER GOULON GRILLOT LECLERC MARIOTTE PEYRIN RIBUOT ROUSSEL SEIGLE-MURANDI. STE IMAN WOUESSID-JEWE
UNIVERSITE JOSEPH FOURIER FACULTE DE PHARMACIE DE GRENOBLE
Domaine de !a Merci 38700 LA TRONCHE Doyen de la Faculté: M. le Professeur P. DEMENCE
Vice-Doyenne: Mme A. VIL LET
PROFESSEURS DE PHARl\'IACIE
Abdelaziz Pharmacie Galénique Wilhelm Biophysique
Jean Pharmacie Clinique et Bio-Technique Vinceni Toxicologie
Jean-Luc Chimie Bio-Inorganique Pierre Physiologie/ Pharmacologie
Emmanuel Immunologie/ Microbiologie/ Biotechnologie Alain Biochimie/ Biotechnologie
Chantal Biophysique Renée Parasitologie Gérard Chimie Organique Anne-Marie Pharmacognosie
Eric Chimie Analytique
Christophe Physiologie/ Pharmacologie Anne-Marie Biochimie
Françoise Botanique et Cryptogamie Régine Biologie Cellulafre Denis Pharmacie Galénique
PROFESSEUR ASSOCIE (PAST)
MAITRESDECONFERENCESDEPHARMACIE
ALDE BERT ALLENET BARTOLI BOUMENDJEL BRETON CHOISNARD DE LETRAZ DEMEILLERS DESIRE DIJOUX-FRANCA DURMORT-MEUNIER ESNAULT FAURE FAURE-JOYEUX FOUCAUD-GAMEN GEZE GERMI GILLY GODIN-RIBUOT GROSSET GUIRAUD HININGER-FAVIER KRIVOBOK MORAND NICOLLE PINEL RAVEL RA VELET RIO ND EL SEVE TARBOURIECH VANHAVERBEKE VILLEMAIN VILLETPROFESSEUR AGREGE (PRAG) 1.WUTABOUL Delphine Benoit Marie-Hélène Ah cène Jean Luc Martine Christine Jérôme Marie-Geneviève Claire Danielle Patrice ·Marie Jacqueline Annabelle Raphaële Catherine Diane Catherine Pascale Isabelle Serge Jean-Marc Edwige Claudine Anne Corinne Jacqueline Michel Nicolas Cécile Danielle Annick Christel Parasitologie Phannacie Clinique
Pharmacie Clinique et Biotechn. Pharmacognosie
Parasitologie
Pharmacotechnie et génie de la formulation Droit Pharmaceutique Economie
Biochimie Chimie Bioorganique Phannacognosie Virologie Chimie Analytique Biochimie Physiologie-Pharmacologie Immunologie Pharmacotechnie Galénique Bactériologie Chimie Thérapeutique Physiologie - Pharmacologie Chimie Analytique
Biologie CeJJulaire et Génétique Biochimie
Botanique - Cryptogamie Chimie Thérapeutique
Chimie Organique I Chimie Thérapeutique Parasitologie
Chimie Analytique Chimie Analytique
Physiologie - Pharmacologie Ens. Physique I Rech. Biochimie Chimie Bio-Inorganique
Mathématiques I Informatique Chimie Analytique
J'aimerais tout
a
a6onf aaresser mes remerciements
àmon <Directeur de 11ièse, :Mr )Iziz
Œak.,ri, non seufement pour I'intérêt qu'i{ a porté
àmon travai{ et fes connaissances qu'i{ m'a
transmises tout au Cong de mes études, mais aussi pour fe temps et {'attention qu 'i{ consacre
généreusement au quotitfien
àtous ses étuaiants.
:Mes remerciements s'aaressent ensuite au:cmem6res de mon jury:
:Mr Œ'atrice Sé6ert, pour sa genti{fesse et sa aisponi6iuté et pour m'avoir accoraé fes
conseifr â' une personne compétente et intéressée.
<Et :Mr 1/incent Jannin, pour avoir gentiment accepté de juger mon travail Son point
de vue professionne[ de Œ'harmacien â'inaustrie, m'intéresse tout particu[ièrement.
Je tenais égafement
àremercier fes services de aocumentations des Ca6oratoires
:Novartis Œ'harma ( aont :Mme Œernadette Cor6ietj et
P
oumier, pour m'avoir gracieusement
envoyé aes aocuments très utifes pour mes recherches, ainsi que :Mrs Loï'c et Jacques
Œutavantf, pour m'avoir gentiment transmis feurs connaissances surfes compressifs.
Œ'our finir, je remercie profonaément ma fami{{e et mes amis qui m'ont toujours
soutenue tout au Cong de mes études. J'ai Ca chance â'être Gien entourée et d'être com6Cée par
{'amour et {'amitié qu 'ifr me portent.
REMERCIEMENTS ... 1
TABLE DES MATIERES ... 3
INTRODUCTION ... 0 • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • 7 PREMIERE p ARTIE
···••D••···
10CONSIDERATIONS ANATOMO-PHYSIOLOGI UES ... 10
1. STRUCTURE ET FONCTION DE LA PEAU •••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••• 11 1.1. LE STRATUM CORNEUM ...•...•...•...•. 12
1.1.1. Anatotnie du stratum corneum ... 13
1.1.2. Les différents passages ... 13
1.1.2.1. Passage intercellulaire ... 14
1.1.2.2. Passage transcellulaire ... 14
1.2. INFLUENCE DES COUCHES VIABLES ... 15
1.2.1. Passage des couches profondes et des jonctions ... 15
1.2.2. Le métabolisme cutané ... 15
1.2.3. La circulation sanguine et lymphatique ... 16
1.3. INFLUENCE DE LA QUALITE DE LA PEAU SUR L'ABSORPTION ... 16
1.3.1. L'âge ... 16
1.3.2. La région du corps ... 17
2. AsPECTS THEORIQUES DE L'ABSORPTION CUTANEE ••••••••••••••••••••••••••••••••••••••••••••••••••••••• 18 2.1. MECANISME DEL' ABSORPTION PERCUTANEE ...•...•... 18
2.2. MODELESMATHEMATIQUES .••... 19
2.2.1. Perméation à l'équilibre (dose infinie) ... 19
2.2.2. Perméation transitoire (dose détertninée) ... 21
3. PRINCIPES GENERAUX DE FORMULATION DERMIQUE ET TRANSDERMIQUE ••••••••••••••••• 23 3.1. SELECTIONDUPRINCIPEACTIF ... 24 3.2. ACTIVITE THERMODYNAMIQUE •... 25 3.2.1. Solution saturée ... 25 3.2.2. Supersaturation ... 25 3.2.3. Suspension ... 26 3.3. HYDRATATION ...••....•...•...•...•... 27
3.4. PROMOTION CHIMIQUE DEL' ABSORPTION ...•...••.•...•...•. 27
DEUXIEME PARTIE ... 31
LES FORMES TOPI UES CLASSI UES ... 31
1. GENERALITES ...••.•.•...•.•.•.•...••.•..•..•..•.•...•••....•....•.•..•.•...•..•...•.•.•••...••.••.•.•.•....••...•••.•• 32
1.1. DEFINITION ...•....••...•...•...••...•...•...•.•...•.•... 32
2. PRESENTATION DES FORMES GALENIQUES ET CARACTERISTIQUES DE LIBERATION •••• 33
2.1. LES FORMES LIQUIDES ET SOLIDES ... 34
2.2. LES FORMES SEMI-SOLIDES··· ... 34
2.2.1. Les pommades ... 34
2.2.2. Les pâtes ... 35
2.2.3. Les émulsions ... 36
2.2.4. Les gels ... 39
3. DEVELOPPEMENT D'UNE FORME TOPIQUE ••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••• 41 3.1. ELABORATION ... 41
3.1.1. Etudes de préformulation ... 42
3.1.2. Formulation ... 44
3.1.2.1. Particularité de la voie cutanée ... 44
3.1.2.2. Les excipients ... 45
3.2. DEVELOPPEMENT D'UNE EMULSION ... 4 7 3.2.1. Complément de définition ... 4 7 3.2.2. Instabilités ... 48
3.2.3. Exemple d'émulsion E/H contenant de fhydrocortisone ... 50
3.2.4. Exemple de microémulsion contenant de l'estradiol ... 52
3.3. DEVELOPPEMENT D'UN GEL ...•...• 54
3.3.1. Complément de définition ... 54
3.3.2. Propriétés physiques et instabilités ... 55
3.3.3. Exemple de gel contenant de l'estradiol.. ... 58
3.4. CONTROLES DE FABRICATION ET VALIDATION DU PROCEDE INDUSTRIEL. ... 59
3.4.1. Contrôles ... 59
3.4.2. Validation ... 63
TROISIEME PARTIE ... 64
LES FORMES TRANSDERMIQUES ... 64
1. GENERALITES ••••.••••.•••••.•.••••••.••.•..•..••.••••••.•••..•••.•••.• ··••·••·•··••·•··•···••••••·••••••••••••··•••••••·••···• 65
1.1. DEFINITION ...•...•... ··· ... 65
1.2. HISTORIQUE ...•...••... 65
2. PRESENTATION DES DISPOSITIFS TRANSDERMIQUES •••••••••••••••••••••••••••••••••••••••••••••••••••••• 67 2.1. CONSTITUTION D'UN DISPOSITIF TRANSDERMIQUE ...•... 67
2.2. CARACTERISTIQUES DES ELEMENTS ...•...•... 69
2.3. PRINCIPAUX TYPES DE DISPOSITIFS TRANSDERMIQUES ET CARACTERISTIQUES DE LIBERATION ...•...•...•.•...•....•... 70
2.3.1. Systèmes réservoirs ... 70
2.3.1.1. Systèmes à réservoir fluide ... 71
2.3.1.2. Systèmes à réservoir solide ... 71
2.3.2. Systèmes matriciels ... 72
2.3.2.1. Système matriciel classique ... 73
2.3.2.2. Système adhésif actif ... 74
2.3.2.3. Système matriciel multicouche ... 75
2.3.3. Systèmes à microréservoirs ... 75
3. DEVELOPPEMENT D'UN SYSTEME TRANSDERMIQUE •••••••••••••••••••••••••••••••••••••••••••••••••••••• 77 3.1. ELABORATION ...••....•...•.••....•...••..••...•...•...•...•....•...•...• 77
3.1.1. Etudes de préfonnulation ... 77
3.1.2. Formulation ... 78
3.1.2.1. Généralités ... 78
3.1.2.2. Les polymères ... 79
3.1.2.2.1 L'adhésif ... 84
3.1.2.2.2 La matrice adhésive d'un DIA ... 85
3.2. FABRICATION DES DISPOSITIFS TRANSDERMIQUES ... 87
3.2.1. Présentation des opérations unitaires de la fabrication ... ; ... 87
3.2.2. Fabrication des systèmes« DIA» ... 89
3.2.2.1. Enduction en phase solvant ... 89
3.2.2.1.1 Une alternative: l'enduction en phase aqueuse ... 90
3.2.2.1.2 L'étape critique du séchage ... 90
3.2.2.2. La technologie « hot melt » ... 92
3.3. DEVELOPPEMENT D'UN SYSTEME« DIA» CONTENANT DE L'ESTRADIOL. ... 95
3.4. CONTROLES DE FABRICATION ET VALIDATION DU PROCEDE INDUSTRIEL. ... 97
4. PROJETS ACTUELS ET A VENIR EN TECHNOLOGIE TRANSDERMIQUE ••••••••••••••••••••••••••• 100 CONCLUSION ... 104
BIBLIOGRA.PHIE ... 107
ABREVIATIONS ... 113
L'application d'un médicament sur la peau a pour but le plus souvent la recherche d'un effet superficiel pour le traitement d'affections cutanées locales, ceci évitant les effets indésirables d'un traitement systémique.
Ce domaine thérapeutique bénéficie de nombreuses formes topiques de mieux en mieux conçues pour une bonne tolérance cutanée et une bonne conservation.
La voie dermique a, néanmoins, plusieurs limites qui sont dues principalement aux excellentes propriétés de barrière de la peau et en particulier de sa couche superficielle, le stratum corneum.
Elle pennet cependant, dans certaines conditions, d'exercer une activité en profondeur voire générale.
L'arrivée de nouveaux matériaux, en particulier dans le domaine des polymères, a contribué au développement de ce concept: l'administration par voie transdermique. Il s'agit alors, pour obtenir une action systémique, de faire pénétrer un principe actif dans l'organisme à
travers la peau saine. Cette application offre certains avantages en évitant les problèmes liés aux voies orale et parentérale.
Ce secteur a connu la plus grosse explosion ces vingt dernières années : plusieurs générations de patchs se sont succédées, les premiers étant une simple évolution des formes conventionnelles. Aujourd'hui, différents dispositifs transdermiques sont fréquemment utilisés pour l'administration de principes actifs comme la trinitrine, la scopolamine, l'estradiol ou la nicotine... Ces systèmes connaissent un intérêt grandissant principalement dû à leur confort d'utilisation, notamment pour les principes actifs à administrer au long cours. Certains peuvent délivrer au cours du temps une dose constante et programmée de principe actif, alors que les formes topiques classiques délivrent le principe actif à un taux décroissant en fonction du temps.
Les récents progrès scientifiques et techniques ont permis une meilleure connaissance des mécanismes d'absorption cutanée, une mise au point de nouveaux excipients et de nouveaux matériels de fabrication et de contrôle. Les systèmes transdermiques sont de plus en plus confortables, plus petits, capables de libérer des quantités plus importantes de principes actifs tout en respectant la peau pendant la durée du traitement. L'objectif est également d'administrer des molécules plus grosses, à priori incapables de traverser la barrière de la peau.
La compétition étant de plus en plus grande sur le marché pharmaceutique, il est indispensable d'évaluer et de maîtriser les critères de conception, aussi bien des formes conventionnelles que des formes nouvelles.
Le succès est la satisfaction et l'observance du patient, ainsi que la combinaison d'un bon médicament dans une bonne formule, ceci réalisé dans les bonnes pratiques de fabrication.
Cette étude présente l'évolution globale entre les formes topiques et les formes transdermiques.
Dans un premier temps, nous ferons un rappel de la structure de la peau et des particularités de l'administration à travers celle-ci.
Puis, pour les formes topiques classiques d'une part et les systèmes transdermiques d'autre part, nous rappellerons les différentes formes existantes et leurs exigences de mise au point.
Nous insisterons, pour les formes topiques, sur la grande famille des émulsions, mais également sur la forme gel qui par sa composition, s'inscrit dans l'évolution vers la forme patch.
Pour les formes transdermiques, nous déterminerons les dispositifs les plus prometteurs et nous privilégierons leur étude.
Nous nous concentrerons à l'aide d'exemples sur l'importance du choix du galéniste pendant les étapes de préformulation et formulation, et sur le rôle essentiel de l'excipient véhicule dans l'activité thérapeutique.
Pour chaque grande classe, mais plus particulièrement pour les systèmes transdermiques, nous détaillerons les points critiques des procédés de fabrication à maîtriser pour garantir une reproductibilité de qualité du produit et de libération du principe actif.
Enfin, tout en expliquant brièvement les méthodes physiques d'amélioration d'absorption, nous évaluerons l'avenir de la technologie transdermique.
PRE1vfIERE PARTIE
CONSIDERATIONS
ANATOMO-PHYSIOLOGIQUES
La peau est l'organe le plus important du corps humain, elle représente environ 10% de la masse corporelle et sa surface est en moyenne de 1,70 m2 pour un adulte. Elle offre donc de multiples
sites d'administration thérapeutiques pour des actions à la fois locales et systémiques.57
Dans le cas d'une administration topique, le principe actif diffuse vers un tissu cible à la proximité de l'application pour produire ses effets thérapeutiques avant d'être distribué dans la circulation systémique pour être éliminé6 (Fig.1). L'utilisation d'hydrocortisone pour une dermatite ou de néomycine pour une infection superficielle sont des exemples de cette administration.
Dans le cas où la peau sert de lieu d'administration pour un principe actif à activité systémique, le médicament appliqué est distribué premièrement dans la circulation systémique et ensuite transporté au tissu cible pour atteindre son action thérapeutique (Fig.1). Un exemple est l'administration de nitroglycérine par patch transdermique pour l'angine de poitrine.
PA dans son véhicule
l
Libération LOCALISE TOPIQUE PA dans les sécrétions de la peau ABSORPTION TRANSDERMIQUEL
SYSTEMIQUE PA dans tissu cibleÎI
DISTRIBUTIONIl
PA dans la circulation sanguine Réponse Ill> pharmacologique --•Ill> ELIMINATIONFig.1 : Représentation schématique de l'administration à visée topique ou transdermique d'un principe actif.
(Chien, 1987)
Cependant, grâce à sa structure, la peau joue un rôle de barrière imperméable et de protection très important.
1.
Structure et fonction de
la
peau
Nous allons étudier brièvement la structure générale de la peau, en s'arrêtant plus précisément sur les éléments importants dans l'administration percutanée.
La peau est constituée de trois couches superposées qui sont respectivement de l'extérieur vers l'intérieur (Fig.2) :
L'épiderme, d'une épaisseur de 0,06 à 0,8 mm. Cet épithélium pavimenteux stratifié et complexe, est dépourvu de vaisseaux sanguins. Il se différencie en épiderme vivant et en couche cornée appelée aussi stratum corneum.
Le derme, d'une épaisseur de 3 à 5 mm, est composé essentiellement de fibres de collagènes enrobées dans un gel de mucopolysaccharides, ce qui en fait un tissu élastique de support. Il est riche en vaisseaux sanguins, en vaisseaux lymphatiques et en terminaisons nerveuses.
L'hypoderme, épais de plusieurs millimètres, est un tissu adipeux protecteur de l'organisme.
FORMULATION
ôO ---7 Drug dissolution
drug diffusion i.to skin surface SHUNT ROUTES Pariitio11ing INTRAC~~;~;;;;0ROIJTE INJ0~~.~!~~lAR ROUTE .. --- into sebum ---••
~'.omecyq-Jt> , /ipids ', 1 · or sweat
(ÇDiRu'i"n
b
~ ç;::::i·--~---1Stratum ) "PM.'r.e.1 ~ ((·.,.··.f'li!::)~ ~
corneum 't~~1~~~~:::;.;:;: o
'-.:/~'---..._/c:::=2 ~
Viob!e f Porfilion i111ô ~ :-: • -f~;lifon inlo : DHfuûon throug.h Pcrlitionirig into
epidermi:i viable epi.c!ermis "viable epidermis t viable epideim1.-. - - ~ viable _epidermt:S
r
Dermis ./. \ ' Portirioning in!(> der mi~ - - - Hoir follicleFig. 2 : Représentation des différentes couches de la peau et des principaux mécanismes et passages intervenant dans
la pénétration cutanée. (Williams, 2003)
Le stratum corneum joue le rôle le plus important dans la barrière cutanée.
1.1.
Le
stratum corneum
Il est recouvert d'un film hydrolipidique de surface, émulsion eau dans huile (E/H) qui provient des sécrétions sudorales et sébacées. Ce film maintient le pH acide de la peau (5,5 à 6) et la protège contre le dessèchement et les agressions provoquées par les microorganismes. 68
En effet, la présence de stapf?ylococcus epidermidis et autres micro-organismes à la surface de la peau,
peut dégrader les molécules et intervenir sur leur biodisponibilité.
1.1.1. Anatomie du stratum corneum
Le stratum comeum est le résultat des étapes de différenciation de cellules qui progressent depuis la première couche de l'épidenne. Le turn-over de cette différenciation est d'environ vingt-et-un
• 57
JOurS.
Il comprend entre 10 et 15 couches de cellules mortes, anucléées, kératinisées et enrobées dans une matrice lipidique continue.
Son rôle est de réguler les pertes en eau du corps et de prévenir l'entrée de corps étrangers. L'eau joue un rôle de plastifiant et permet d'augmenter son épaisseur.
La nature de cette barrière dépend de ses constituants: 75 à 80% de protéines, qui sont des a. et 13 kératines, 5 à 15 % de lipides, attachés de manière covalente aux protéines. Le mélange de lipides est unique et leur taux varie entre les individus et selon le site du corps. Les composants majoritaires sont des céramides (huit classes différentes), acides gras, cholestérols, sulfates de cholestérols et esters de stérols. Cette composition entraîne des variabilités considérables entre les
• 3
patients.
La structure complexe de cette couche lipidique intercellulaire est très stable et constitue la principale barrière limitante et la première étape déterminante de la pénétration pour la plupart des molécules.58
1.1.2. Les différents passages
La pénétration du stratum comeum se fait uniquement par transport passif. A ce jour aucun transport actif n'a été reporté.
Il existe essentiellement deux passages pour traverser de manière intacte le stratum comeum : le domaine lipidique intercellulaire et le passage transcellulaire (Fig.2).
La plupart des molécules vont pénétrer par la combinaison de ces routes dont la contribution par rapport au flux va dépendre des propriétés physico-chimiques des principes actifs.
1.1.2.1. Passage intercellulaire
Les lipides créent une phase continue à travers la membrane. Sauf exception, cette route est le principal passage par lequel la plupart des petites molécules non chargées, traversent le stratum corneum. L'hydratation maintenue entre les kératinocytes permet un passage par diffusion.
Contrairement à la perméation transcellulaire, où le passage est direct et la longueur du trajet correspond à l'épaisseur du stratum corneum, la route intercellulaire est plus tortueuse, et le trajet beaucoup plus long. D'après Buri (1987), cc facteur peut devenir limitant pour les substances facilement absorbées par la peau, comme la nitroglycérine.
1.1.2.2. Passage transcellulaire
Ce passage est considéré comme une route polaire à travers la membrane. La diffusion se faisant majoritairement par les molécules de kératines hydratées, les molécules hydrophiles diffusent très rapidement dans cet environnement. Cependant, la présence de domaines lipidiques, entre les cellules de kératine constituent de nombreux obstacles et oblige les molécules à de multiples partages entre ces deux domaines, ce qui constitue un facteur défavorable surtout pour les molécules très hydrophiles et très lipophiles. 58 De plus, la kératine offre des sites potentiels de
liaison pour les solutés, créant ainsi un effet réservoir. L'utilisation de solvant va permettre d'augmenter le flux des principes actifs.
En plus de ces deux routes, il existe des annexes, les follicules pilosébacées et les glandes sudoripares, incluses dans la profondeur de la peau au niveau du derme et débouchant à la surface de l'épiderme. 68 (Fig.2) Par ces annexes, les molécules peuvent atteindre directement les
couches profondes. Le canal pilosébacé contient un mélange de sébum et de sueur apocrine. Ce mélange, qui est en fait une émulsion, peut augmenter ou diminuer le transport des molécules selon leurs caractéristiques physicochimiques. 67
Les annexes représentent 0,1 % de la surface totale de la peau donc leur contribution dans le passage transcutané est généralement considérée comme insignifiante pour la plupart des molécules.
Ce shunt est pourtant important dans les premiers temps d'une diffusion, dans la pénétration des grosses molécules polaires, polymères et colloïdes et lors de l'administration transdermique par stimulation électrique (Cf troisième partie, §4.).
1.2. Influence des couches viables
1.2.1. Passage des couches profondes et des jonctions
Dans l'épiderme vivant et le derme, les espaces intercellulaires sont perméables et vont créer une barrière pour les molécules fortement lipophiles.48 Dans l'hypoderme, seule la viscosité de la
substance peut retarder sa diffusion.
Les molécules vont rencontrer cependant des surfaces d'échanges, appelées jonctions, entre le stratum corneum et l'épiderme vivant, et entre l'épiderme et le derme. (Fig.2) Ce sont des structures de continuité qui vont forcer les molécules à se partager pour être traversées.
1.2.2. Le métabolisme cutané
L'épiderme et les annexes contiennent les enzymes principales trouvées dans les autres tissus du corps.46 Les composés appliqués peuvent être métabolisés, ce qui résulte en une altération de
l'activité pharmacologique ou en une action toxicologique. La nature potentiellement toxique des métabolites doit être considérée : ils peuvent être irritants, allergènes ou carcinogènes, que ce soit localement ou de façon systémique.
L'effet de ce métabolisme sur la réponse biologique est difficile à mesurer in vivo sans interférence avec les enzymes systémiques, cependant cette activité reste minime par rapport à celle du foie.
Comme dans le reste de l'organisme, l'activité métabolique se déroule en deux phases:
Phase I: Introduction d'un groupe polaire réactif par le Cytochrome P450 dépendant de monooxygénases (activité de 1 à 5% de celle du foie).
Phase II: Réactions de conjugaisons (avec acide glucuronique, glutathion) par les transférases (activité de 10% de celle du foie), qui rendent le substrat plus hydrophile et plus facile à éliminer.
Dans de nombreux cas, les métabolites formés à partir de composés parents ont été déterminés et les réactions métaboliques identifiées. Par exemple l'acétylation d'amine primaire a été montrée comme une étape métabolique importante.
Cette activité métabolique peut être utilisée pour transformer une prodrogue en principe actif désiré, ou utiliser des combinaisons principe actif - prodrogue pour augmenter le flux.
D'après Mantelle (2001), l'hydrolyse d'ester est une réaction métabolique significative intervenant dans la peau. Les combinaisons principes actifs - esters de principes actifs sont donc préférentiellement utilisées.
1.2.3. La circulation sanguine et lymphatique
Le flux sanguin à ce niveau, 0,05
ml/
min, est un paramètre important pour la circulation des molécules ayant traversé les couches externes de la peau.En effet, pour l'administration transdermique de médicament, l'apport sangUill maintien un gradient de concentration entre la formulation apportée à la surface de la peau et la vascularisation à travers la membrane de la peau. C'est ce gradient de concentration qui provoque une force motrice pour la diffusion du médicament.
Les vaisseaux lymphatiques peuvent également transporter les molécules à travers le derme, et intervenir dans ce phénomène dynamique.
1.3. Influence de la qualité de la peau sur l'absorption
Nous entendons ici par «qualité», les conditions anatomo-physiologiques qm, en plus de la composition, vont entraîner des variabilités sur l'absorption cutanée.
1.3.1. L'âge
Avec l'âge, mais surtout avec les effets de l'environnement, des traitements chimiques et des ultraviolets, la peau subit des altérations de structure, notamment une diminution de l'épaisseur, de la teneur en eau ainsi que du flux sanguin. Ces changements sont cependant peu significatifs dans une thérapie transdermique. Le formulateur devra pourtant prendre en compte la différence
importante de perméabilité entre une peau mature et la peau d'un nouveau-né. La perméabilité accrue chez le nouveau-né, signifie un potentiel de toxicité important.
1.3.2. La région du corps
Le graphique suivant révèle la différence de perméabilité existant entre plusieurs régions du corps (Fig.3). Celle-ci ne dépend pas uniquement de l'épaisseur. Le site d'application doit être sélectionné de façon scientifique et rationnelle: le scrotum est utilisé pour l'administration de testostérone, la scopolamine est administrée derrière l'oreille, région où sa perméabilité est relativement haute.
Le tronc et l'avant bras, ayant une perméabilité intermédiaire, sont souvent utilisés pour une raison pratique et pour une amélioration de l'observance des patients.
N E! 500 " ti; 400 2
..
300 .., Ule
.... 200 -.-<"'
..,.,
100 -.-< ""
"' " or Temps (h) 10 15 20Peau pos t.auriculaire
0 Dos
Poitrine Estomac Avant-bras
Fig 3 : Représentation graphique du passage in vitro de la scopolamine à travers la peau selon différentes régions du corps.
(Buri, 1989)
Par ces spécificités de structures et de conditions, il paraît difficile de contrôler l'administration cutanée. Ceci peut être envisagé par une connaissance plus approfondie des mécanismes de libération à partir d'un véhicule, et de perméation dans la peau.
NB: Nous entendons par « perméation » le mouvement d'un pnnc1pe actif à travers la membrane. Ceci comprend le partage de la molécule et sa diffusion à travers les différents domaines. «Pénétration» signifie l'entrée dans un tissu mais pas nécessairement le passage à travers celui-ci.58
2. Aspects théoriques de l'absorption cutanée
2.1. Mécanisme de l'absorption percutanée
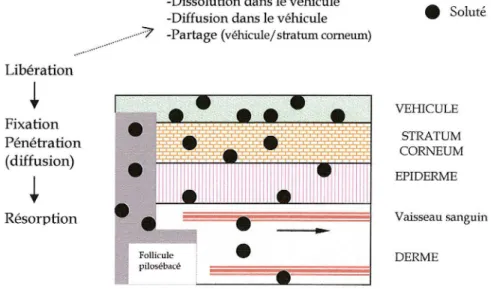
Ce phénomène peut être divisé en trois grandes phases et chacune peut être le facteur limitant de la suivante. ··· Libération
i
Fixation Pénétration (diffusion)i
Résorption-Dissolution dans le véhicule -Diffusion dans le véhicule
... 7 -Partage (véhicule/ stratum comeum)
Follicule pilosébacé • Soluté VEHICULE STRATUM CORNEUM EPIDERME Vaisseau sanguin DERME
Fig. 4 : Représentation schématique du mécanisme de l'absorption percutanée. (j'vfodifié de Noizet, 2000).
• Phase de libération
Le principe actif diffuse de la formulation vers la surface cutanée. La diffusion des molécules à
travers le véhicule dépend de la nature de la formulation. Les molécules adjacentes à la surface du stratum comeum se répartissent dans la membrane, surtout en fonction du coefficient de partage du principe actif entre l'excipient et la peau, qui doit être en faveur de la peau.
•
Phase de pénétrationLe principe actif pénètre dans le stratum comeum, subit des partages aux jonctions des couches et diffuse pour atteindre l'épiderme et le derme. Il doit être lipophile mais également suffisamment hydrophile pour diffuser dans les couches profondes de la peau où l'eau est en quantité non négligeable (60 à 70%).68
•
Phase de résorptionC'est le transfert de la substance active à travers la matrice fondamentale du derme sous-jacent et à travers l'endothélium des capillaires sanguins et lymphatiques vers la circulation générale.
2.2. Modèles mathématiques
Malgré la complexité de la peau, de simples traitements mathématiques peuvent être appliqués aux données obtenues à partir d'expérience sur peau humaine car ces données indiquent que celle-ci se comporte de façon analogue à une membrane homogène.58
Deux situations sont considérées :
•
•
Quand le principe actif est appliqué en dose infinie, sa concentration diminue peu durant le temps de l'application (par exemple avec un patch),
Quand une petite dose déterminée est appliquée et donc qu'une perméation à l'équilibre ne peut être atteinte (par exemple avec une émulsion pour application locale).
2.2.1. Perméation
à
l'équilibre (dose infinie)Les molécules ont un mouvement en réponse à la force thermodynamique provenant du gradient de concentration de part et d'autre de la peau. C'est le mécanisme de diffusion passive décrit par la loi de Fick.
J =
-D. de
(Equation 1)dx
J :
Flux de la moléculeD : Coefficient de diffusion de la molécule dans le stratum comeum
de/ dx ; Gradient de concentration c : Concentration
La quantité de substance diffusée par unité d'aire d'une section et par unité de temps, est proportionnelle au gradient de concentration mesuré.
La seconde loi de Fick, utilisée pour les données de traitements mathématiques, suppose que la diffusion est unidirectionnelle et dérive de l'équation (1) :
&=DÔ2C (Equation 2\
ôt
ôx2 1Comme différents types de peau sont utilisés pour les expériences et différents passages sont possibles, les résultats de cette loi doivent être utilisés comme des approximations.
La plupart des expériences in vitro tendent à mimer le plus possible la situation in vivo. Le plus souvent, une membrane (l'épiderme) sépare deux compartiments, un contient le principe actif dans un véhicule (solution donneuse) et l'autre est le récepteur.
Quand l'équilibre est atteint, la seconde loi de Fick peut être exprimée par :
M = quantité cumulée de principe actif (PA) passant à travers la membrane par unité d'air et en temps t
Cv = Co/P = concentration dans le véhicule
dM D.P.Cv (Equation 3)
dt h
Co = concentration du PA dans la première couche de la
membrane.
h = épaisseur de la membrane
P = coefficient de partage du PA entre la peau et le véhicule. Une représentation graphique de M en fonction du temps donne le profil de perméation typique.
c " 0 E 0 " > ~ ~ u '--y-' logtime
Gradient :: pseudo-steady state flux
Ti me
Fig.5 : Représentation graphique du profil de perméation à l'équilibre (Williams, 2003).
Le temps de latence avant l'apparition du principe actif dans la circulation sanguine correspond au délai nécessaire à son passage à travers l'épiderme et le derme. Passé ce temps de latence, la quantité ayant diffusé atteint de manière exponentielle un état d'équilibre constant.
Cette expression permet le calcul du coefficient de diffusion apparent, mais nécessite une approximation de l'épaisseur de la membrane.
Le coefficient de perméabilité est souvent utilisé pour caractériser la perméation du principe actif à travers la peau et peut être défini par :
Kp=P.D (Equation 5)
h Donc dans l'équation (4), dM_J-K
dt - -
P• C V (Equation 6)2.2.2. Perméation transitoire (dose déterminée)
Dans certaines circonstances, la perméation à l'équilibre n'est pas atteinte. Les données de perméation cumulée quand une dose définie est appliquée augmente jusqu'à un plateau au-delà duquel la quantité pénétrée demeure constante à moins que des doses supplémentaires soient appliquées sur la membrane.
Tirne c " ~ D " > ·-g :; E " u
Fig. 6 : Représentation graphique du profil de perméation transitoire (Williams, 2003).
Un pic est observé dans le profil, il correspond à l'apparition dans la solution réceptrice de la majorité de la dose appliquée. La largeur du pic indique l'importance de la liaison avec la membrane.
Il a été montré que l'amplitude de
J
max est donnée par : 2 (Equation 7) r l,85D.Co.ô Jmax h De même ou considérablement inférieur à h.D = coefficient de diffusion apparent
Co= concentration du principe actif dans la première couche du SC
h = épaisseur du stratum corneum
ù = épaisseur de la dose définie à la surface de la
peau
h2
Tmax
=
6D (Equation 8), comme Ô est supposé être
Les modèles mathématiques permettent idéalement de prédire les paramètres exigés pour une formulation pour obtenir un certain profil de libération. Ce qui facilite l'optimisation de produits existants et le développement de nouveaux produits. Mais il n'existe pas de modèle mathématique général, il est important d'en identifier un adéquat pour un système spécifique en fonction de sa composition.
3. Principes généraux de formulation dermique et transdermique
La barrière de la peau entraîne une gêne au flux de principe actif, obligeant le formulateur à
trouver des moyens de réduire cette gêne ou de la contourner. En premier lieu, l'optimisation de la libération topique ou transdermique passe par la sélection d'un bon candidat et l'utilisation de l'énergie thermodynamique (Fig.7).
Prodrogue Promoteurs Acti,,ité thermodynamique Amélioration de l'absorption Hydratation Site et conditions à traiter ::séiè~~ii :cili.i:
:>
~ ... f - - - :::::~&;~~1é::::;:
Fig.7: Ensemble des principes généraux de formulation dermique et transdermique. (Modifié de Nakano).
Nous pouvons noter à ce niveau que la définition d'un système thérapeutique transdermique est un système qui dicte la vitesse d'arrivée d'un principe actif dans la circulation générale (dans ce cas, ce n'est pas la peau qui joue ce rôle).
Parmi ces systèmes, nous retrouvons les dispositifs transdermiques, mais aussi parfois des formes plus conventionnelles.
3.1. Sélection du principe actif
D'après
Barry
(2001), l'étude de l'équation du flux à l'équilibre (3)(§
2.2.1.) permet de déduire les propriétés idéales d'une molécule pour être transportée à travers la barrière de la peau à une vitesse acceptable (Tab.1).Propriétés Recommandations Explications
Poids De préférence MW < 600 Da Relation inverse entre flux transdennique et poids
moléculaire moléculaire.
MW Présomption de la sphéricité de la plupart des molécules.
Coefficient de P o/w entre 10 et 10000 soit 1 <log P<4 Dirige la concentration initiale dans la première couche
partage P du stratum comeum.
(entre le Dirige le principe actif préférentiellement dans un des
véhicule et le passages à travers la peau :
stratum 1 <log P<4 ~ route intercellulaire
comeum) log P > 4 ~ route intercellulaire
log P < 1 ~ route transce//ulaire
Molécules très f?ydrophiles et chargées ~Annexes
Solubilité Adéquate dans l'eau et dans l'huile Intervient dans le gradient de concentration de part et Solubilité> lOOµg/mL dans l'eau et d'autre de la membrane et donc sur la force motrice de
-> 1 mg/mL dans huile de paraffine diffusion.
Point de fusion < 100 °C En corrélation avec une bonne solubilité
pKa Proche du pH cutané (=: 6) Favorise le passage du principe actif sous sa forme non ionisée.
Coefficient de Bonne perméabilité cutanée Relation avec la lipophilie du composé :
perméabilité Kp Log Kp (cm/sec) =0.71 logP -0.0061xMW - 2,74
quand l<P<4
Tab.1: Propriétés idéales d'un principe actif pour la pénétration cutanée. Recommandations de diverses littératures. (Barry, 2001; Guy, 2002; Saunai, 2002; Sournac et Belhadj-Tahar, 2005)
Une alternative : l'utilisation d'une Prodrogue
Si le principe actif ne possède pas les propriétés physicochimiques correctes, une prodrogue avec un coefficient de partage optimal pour pénétrer dans la peau, peut être utilisée Elle sera ensuite activée par les enzymes du tissu viable.
3.2. Activité thermodynamique
Une alternative de l'équation de Barry, utilise l'activité thermodynamique (Higuchi 1960)
dm aD
=
dt (Equation 9)
a
=
activité thermodynamique du principe actif dans son véhiculey = coefficient d'activité effective de la peau.
Le flux est le même pour une molécule malgré le donneur utilisé et pour différentes concentrations, car l'activité thermodynamique est la même.
Pour une vitesse maximale de pénétration, le pnnctpe actif doit être à son activité thermodynamique la plus haute dans le véhicule.3
•58
3.2.1. Solution saturée
Généralement le flux maximal est obtenu quand le principe actif est saturé dans le système donneur. Il se trouve à sa solubilité limite. Ainsi, pour une molécule lipophile, comme l' estradiol (log P0;w = 2,49), le partage dans les lipides du stratum corneurn à partir d'une solution aqueuse
saturée, sera favorable. 58
La saturation pose cependant quelques problèmes : quand par exemple la préparation est formulée à 25°C, une fois appliquée sur la peau où la température est d'environ 32°C, la solubilité du principe actif augmente et l'activité thermodynamique diminue.
Plus important quand la même formulation est stockée dans un environnement frais, la solubilité limite diminue, le système devient supersaturé, et à un stade métastable, le principe actif cristallise.
3.2.2. Supersaturation
Cet état, où le potentiel chimique est encore plus important, peut néanmoins augmenter de façon transitoire le flux : par exemple pour les contacts courts avec une dose définie, la disparition d'un élément volatil quand la forme est appliquée sur la peau génère un état supersaturé et un « jet »
d'agent thérapeutique sera rapidement libéré dans la peau.58
Cependant les systèmes obtenus sont instables et vont par exemple cristalliser pendant leur stockage.11 La stabilisation de telles préparations peut être obtenue sur des périodes limitées en
utilisant des polymères dits « anti-nucléants »38 : hydroxypropyle méthyle cellulose (HPMC),
hydroxypropyle cellulose (HPC), polyvinylalcool, polyvinyl pyrrolidone (PVP), polyéthylène glycol (PEG) ou certains Eudragit® sont reportés comme étant des polymères pouvant retarder la cinétique de recristallisation. Cette technique est essentiellement utilisée dans les dispositifs transdermiques.
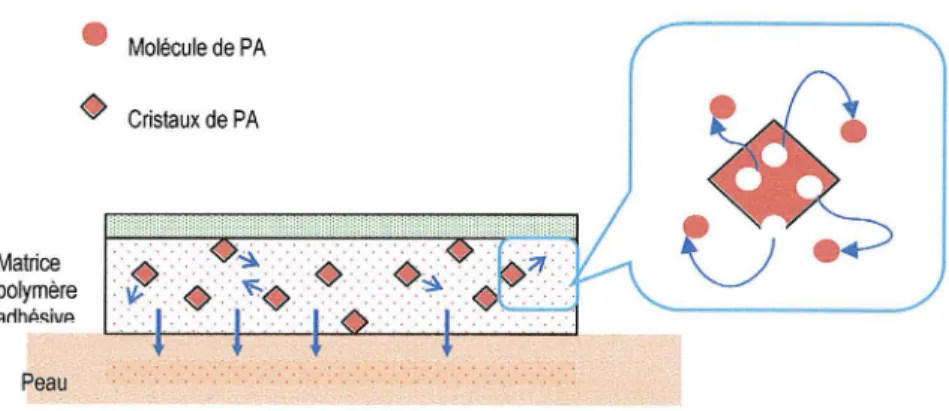
3.2.3. Suspension
Dans le cas où le pnnc1pe actif a une faible solubilité dans le véhicule ou une très haute perméabilité dans la peau, la formulation peut être rapidement dépourvue en principe actif et l'activité thermodynamique dans le système chute de façon spectaculaire.
Pour contrebalancer cette déplétion, un principe actif solide peut être mis en suspension dans la formulation. Le solide est en équilibre avec le principe actif dissout. Au fur et à mesure que ce dernier pénètre dans la peau, le solide se dissout pour refournir le donneur et donc maintenir la
force motrice de perméation.
Matrice polymére ;,rlhA~ÎVA Peau • Molécule de PA
0
Cristaux de PAFig. 8 : Représentation de la libération d'un principe actif sous forme de suspension à partir d'une matrice adhésive. Modifiée de Nakano, 2000.
Pour que cette approche réussisse, les particules en suspension doivent se dissoudre rapidement. La vitesse de dissolution dépend de la taille des particules (équation de Noyes et Whitney), ainsi les particules microcristallines sont plus à même de refournir la solution du donneur sans introduire une barrière limitante à la perméation.
A présent la biodisponibilité à partir de la plupart des formulations appliquées est de l'ordre de 1 à 3 %, il y a donc un gaspillage excessif de principe actif.
Par des formulations appropriées, il est possible de réduire la quantité de médicament dans une formulation tout en maintenant son activité thermodynamique : par le taux d'hydratation de la peau, la promotion chimique, la vasoconstriction, la promotion physique58 (évoquée Troisième
partie,§ 4.) ... Mais tout ceci reste dans un ordre de grandeur limité.
3.3. Hydratation
L'augmentation du niveau d'hydratation du stratum corneum permet d'améliorer la perméation transdermique de la plupart des médicaments. Cet effet peut être simplement réalisé par occlusion de la peau grâce à l'utilisation de patchs ou d'excipients occlusifs. Les substances compactes du stratum comeum s'écartent, et la perméabilité peut alors augmenter jusqu'à cinq fois. Le résultat obtenu dépend de l'importance de l'occlusivité.48
' 58
L'occlusion entraîne aussi une élévation de température qui, à un gradient de concentration fixé, augmente le coefficient de diffusion du composé.
De plus, l'utilisation d'un pansement occlusif par un film étanche empêche l'évaporation des principes actifs volatils et leur disparition de la surface cutanée par exfoliation ou par frottement, ce qui augmente la durée de contact du produit avec la peau. 52
Prolonger l'hydratation de la peau peut cependant être problématique par rapport à la croissance microbienne et l'irritation (effets généralement réversibles). L'avantage de laisser la formulation exposée est bénéfique à long terme quand on utilise un véhicule volatil ; le principe actif se sature extrêmement et les quantités qui pénètrent le stratum corneum augmentent.
L'occlusion est donc intéressante quand la libération de principe actif est requise pour une période prolongée et pour avoir un effet systémique.
3.4. Promotion chimique de l'absorption
L'équation de Fick montre que le flux
J
dépend aussi des propriétés du véhicule. 48La plupart des excipients courants ayant un bon pouvoir de pénétration, ils pourront modifier la structure de la couche cornée, ce qui aura pour conséquence des changements des constantes de diffusion D et de partage P.
Les promoteurs d'absorption sont des substances qui augmentent la pénétration d'une molécule à
travers la peau en modifiant la structure ou les propriétés du stratum comeum. 66
D'après Barry (2001), toute substance pharmacologiquement inerte, non toxique et qui augmente l'hydratation de la peau est un promoteur d'absorption: par exemple l'eau, les facteurs mouillants naturels et l'urée.
D'autres facteurs peuvent expliquer le phénomène de promotion : la relation structure activité (terpènes et sesquiterpènes), la longueur des chaînes, la polarité et la présence de groupes spéciaux.
Un promoteur chimique doit également posséder comme caractéristiques, une action immédiate et réversible, une compatibilité chimique et physique et une acceptabilité cosmétique.11
Il est difficile de trouver toutes ces propriétés et souvent nécessaire de faire des compromis. D'après Walters (2002), l'importance de la promotion dépend des véhicules dans lesquels les promoteurs sont appliqués, d'où la nécessité d'optimiser également ie véhicule.
Une classification simple de ces substances peut se faire selon le concept lipide-protéine-partage. Cette hypothèse suggère que les substances agissent selon une ou plusieurs des trois possibilités. (Tab.2).
Action Conséquences Exemples
Action lipidique Désorganisation des lipides du stratum comeum. La plupart des promoteurs: Formation de microcavités dans la bicouche. azone, terpènes, acides gras,
Dt Promoteurs lipophiles (optimum :
tête polaire et longue chaîne alkyle C10-C14
Parfois extraction de lipides DMSO, éthanol, Brij36T, acide oléique.
Modification des Intéraction avec la kératine, ouverture de la structure Surfactants ioniques,
protéines de la protéine. Kp t, D
t.
Moins bonne alternative car décylméthylsulfoxyde, DMSO route transcellulaire n'est pas la plus importante.Augmentation du Changement des propriétés du stratum comeum en Ethanol (augmente pénétration partage (par PA lui- altérant l'environnement chimique. de nitroglycérine et estradiol).
même,co- Pt propylène glycol, Transcutol®,
promoteurs, ou co- N-méthylpyrollidone
solvant).
En théorie, les promoteurs non solvants dont l'activité principale est d'augmenter D, augmenteraient aussi le coefficient de partage des principes actifs lipidiques.
Le problème de la plupart des promoteurs est l'irritation, comme ils interfèrent avec les cellules viables. Les scientifiques limitent donc souvent leur recherche pour un promoteur adapté parmis des matériaux connus pour être bénins sur la peau : substances GRAS « generally regarded as safe ». Par exemple le répulsif pour insecte N,N-diéthyl-m-toluamide est aussi un promoteur et est aujourd'hui formulé dans les patchs contenant de l'estradiol.
Quelques compagnies font des recherches pour développer des promoteurs appliqués aux principes actifs. Un des premiers promoteurs qui vient de cette recherche est SEP A (Soft enhancement of percutaneous absorption), une famille de dioxolanes, et ressemble de près aux GRAS. D'après des examens microscopiques, SEPA améliore la pénétration de la peau en altérant de façon réversible la :fluidité des lipides du stratum comeum sans interaction chimique avec le principe actif.
De nouveaux promoteurs d'absorption tels que ceux proposés par les sociétés Acrux (gamme Across™), Nexmed (NexAct™) ou Bentley (CPET~· .. sont préférentiellement utilisés dans les formes topiques types gels ou sprays. Ces composés sont de mieux en mieux connus sur le plan de leur tolérance cutanée.37
H
3
C~
;r
Dermac SR-38
NexACT88
L'administration cutanée ou transcutanée est donc une voie intéressante en thérapeutique. Elle présente certains avantages, comme essentiellement l'absence de geste invasif, l'éviction de la
lumière intestinale et de sa dégradation associée par la présence d'enzymes, d'aliments et d'autres médicaments, ainsi que l'éviction de l'effet de premier passage hépatique.
Cependant, cette voie ne s'adresse pas à toutes les molécules actives. Le principe actif doit entre autre avoir une bonne tolérance cutanée, l'inconvénient essentiel de cette voie étant la tolérance locale avec risque de réaction allergique de contact. C'est un critère important que le formulateur doit prendre en compte, ainsi que de nombreuses autres caractéristiques afin de mettre au point une forme d'administration adaptée à l'effet souhaité.
Nous allons reprendre les principes de formulations évoqués dans cette partie, en étudiant les formes topiques et transdermiques.
Généralement les formes liquides sont sélectionnées pour une entrée rapide du composant dans la peau, les formes semi-solides pour augmenter le temps de séjour dans la peau et les patchs transdernùques pour prolonger le temps de libération à travers la peau.58
DEUXIEME PARTIE
1.
Généralités
1.1. Définition
Les formes topiques sont destinées à être appliquées sur la peau ou les muqueuses. De leur voie d'administration, vont dépendre leur consistance et leur formulation.
Nous allons nous intéresser essentiellement aux médicaments appliqués sur la peau. Ceux-ci sont surtout utilisés pour leur action locale mais également pour leur action systémique.
1.2. Historique
Ces produits figurent parmi les prenuers médicaments; ils existent depuis l'antiquité où des onguents à base de plantes étaient utilisés à des fins médicinales.
Récemment, un pot de crème presque intact datant de l'ère romaine, a été découvert lors de fouilles à Londres. L'utilisation de la crème n'est pas formellement identifiée, mais elle révèle déjà une technologie complexe.69
Richard Evershed, chimiste à l'université de Bristol, a analysé les ingrédients : Graisse animale fondue servant de base dans les pommades,
Amidon, probablement obtenu à partir d'ébullition de céréales, émollient et servant de couverture protectrice dans les pommades,
Oxyde d'étain, opacifiant et créant une couleur blanche.
Il a mis en avant un surprenant degré de « sophistication technologique », notant que l'oxyde d'étain était très probablement synthétique.
Ce n'est qu'à partir du XIXième siècle, que les chimistes isolent les molécules actives et
développent la production industrielle de médicaments.
Au cours du x:Xème siècle, de grands progrès au niveau des mécanismes d'absorption et de la mise
en forme galénique, ont permis d'améliorer les formes pharmaceutiques existantes. Deux directions sont particulièrement travaillées :
la stabilité à la conservation la tolérance cutanée.
Aujourd'hui, les formulations modernes sont conçues sur mesure selon le prmc1pe actif à
délivrer.46
2. Présentation des formes galéniques et caractéristiques de libération
Le principe actif est incorporé dans un système topique de transport : le véhicule qui varie sensiblement dans sa nature physicochimique, son effet sur la peau et le potentiel de libération du principe actif.46
Une classification simple des préparations topiques est basée sur l'état du système: liquide, semi-solide ou semi-solide ; et peut également être selon la nomenclature Pharmacopée : pommade, pâte, émulsion, gel. Ces formes sont généralement subdivisées en fonction de leur caractère lipophile ou hydrophile et suivant l'état du principe actif dans l'excipient : dissous ou dispersé (Fig.10).21
Fig.10 : Présentation schématique des principales formulations topiques existantes selon leur nature. Modifié de Hugues, 1993
- Phase hydrophile Phase lipophile Phase solide
En plus des caractéristiques biopharmaceutiques propres à la formule et aux principes actifs, la prescription de formes topiques repose sur des critères cliniques :
les véhicules hydrophiles sont administrés sur les lésions suintantes afin d'apporter un effet« rafraîchissant» et d'éliminer les exsudats ;
les véhicules lipophiles sont administrés sur les lésions sèches afin de reconstituer le film
2.1. Les formes liquides et solides
La préparation dermatologique liquide la plus simple est la lotion, forme appliquée avec ou sans friction. L'excipient est généralement aqueux ou hydro-alcoolique, son évaporation à la surface de la peau apporte un effet rafraîchissant et calmant.
Les préparations liquides simples ou complexes sont peu efficaces pour une libération topique et transdermique à cause du temps de résidence relativement faible.
Les formes solides sont des poudres utilisées telles quelles en dermatologie en raison de leur excellent pouvoir couvrant. Elles lubrifient, protègent la peau et ont une forte capacité d'absorption des exsudats.
Pour libérer les matériaux à travers le stratum comeum, la poudre doit être au préalable dissoute. Des sprays topiques existent alors pour déposer la poudre à la surface de la peau, mais ils incluent généralement un solvant volatil qui dissout une partie de la poudre avant de s'évaporer. Il en résulte un phénomène de supersaturation qui permet la pénétration du médicament.
2.2. Les formes semi-solides
La majorité des préparations topiques est semi-solide et a une bonne résidence sur la peau.32
2.2.1.
Les pommades
Les pommades, d'aspect homogène, sont principalement composées d'une masse grasse dans laquelle est dispersée et/ ou dissoute la matière active.46 Leurs fonctions émollientes et
protectrices dues à leur nature hautement occlusive sont importantes. Elles préviennent la perte en eau de la surface du stratum comeum, ce qui induit une augmentation de l'hydratation de la peau et une augmentation significative de perméabilité du principe actif.52
Selon la nature chimique des matières premières, les pommades peuvent être hydrophiles. Elles sont alors formées d'excipients miscibles à l'eau, se liquéfient à la surface de la peau et sont aisément éliminées par lavage.
Les pommades sont généralement préparées par fusion. Les constituants sont chauffés à une température plus élevée que le point de fusion de tous les matériaux, avant d'être refroidis. Une agitation constante pendant le refroidissement permet d'obtenir un produit plus homogène. L'étape critique est le mode d'introduction du principe actif : si celui-ci est soluble, il est dissous dans un excipient fondu. Il faut alors faire très attention aux produits volatils, au problème de recristallisation après refroidissement et à la stabilité des matières premières à différentes températures.
Si le principe actif est insoluble, il s'agit de pulvériser la matière première de façon très fine dans la base d'excipients. Opérations Chauffage Excipients + PA Dissolution Dispersion Mélange Refroidissement Mûrissement
Fig.11 : Logigramme de fabrication d'une pommade. 56
2.2.2.
Les pâtes
Contrôles Température Homogénéité Conformité Vitesse Durée d'agitation Température Homogénéité Température, Consistance AspectLes pâtes sont des préparations relativement fermes qui contiennent une forte proportion de poudre (supérieur à 50%) en suspension dans une base grasse: il s'agit principalement d'excipients de charges. Les pâtes sont moins grasses que les pommades étant donné le pouvoir d'adsorption de la poudre pour certains hydrocarbures, mais elles sont également occlusives et hydratent le stratum corneum.
D'après certaines littératures, l'incorporation d'importantes quantités de poudres dans un gel conduit à l'obtention de pâte. Nous retrouvons dans ce cas, les dentifrices ou les pâtes à l'eau.
2.2.3. Les émulsions
Ce sont les préparations dermatologiques les plus employées pour leur aspect agréable et pour leur pénétration rapide sans résidus. Elles sont utilisées quand un effet occlusif n'est pas nécessaire. Elles désignent le plus souvent des mélanges hétérogènes, ou dispersion d'un liquide sous forme de fines gouttelettes (entre 0.25 et 20 µm) dans un autre liquide. Il y a donc une phase dispersée ou discontinue et une phase dispersante ou continue, l'une ou l'autre étant soit aqueuse soit huileuse.
A l'interface de ces deux phases, des composants stabilisent l'émulsion en se plaçant en couche monomoléculaire, ce sont des émulsionnants ou tensio-actifs, molécules amphiphiles possédant à
la fois une extrémité apolaire et une extrémité polaire (Fig.12). Elles orientent leurs têtes polaires vers l'eau et leurs chaînes carbonées vers l'huile, formant ainsi une liaison entre la phase aqueuse et la phase huileuse. Selon leur nature chimique, elles orientent l'émulsion dans le sens huile dans eau (H/E), la plus courante, ou eau dans huile (E/H), légèrement plus occlusive (Fig.13). Elles empêchent également le rassemblement de gouttelettes, ou micelles, évitant le phénomène de coalescence. Les micelles sont des globules dont la taille est un critère relatif de stabilité de la préparation.
- - - - 0
'-~~ ~-)
y
L_ __j
-y-Partie lipophile Partie hydrophile
Fig.12 : Schéma d'une moléctùe tensio-active.
Fig.13: Représentation schématique d'une micelle d'une émulsion H/E et d'une émulsion E/H.
Les émulsions H/E subissent plus de métamorphoses du véhicule après application : le frottement provoque l'évaporation de la phase aqueuse et entraîne un effet rafraîchissant. Comme ces émulsions ne déposent pas de film huileux à la surface de la peau, elles peuvent libérer des matériaux lipophiles dans la peau aussi bien que des molécules solubles dans l'eau à partir de la phase continue. 52
Décrire la libération topique et transdermique de médicament à partir d'une émulsion est difficile, le système étant dynamique. Tandis que la phase continue s'évapore, l'émulsion se casse.
Si un principe actif soluble dans l'eau est appliqué dans une crème H/E, quand l'eau va s'évaporer de la surface du tissu, le degré de saturation du principe actif dans la phase aqueuse augmente. Cela peut augmenter sensiblement la libération de médicament, surtout si la phase huileuse inhibe la cristallisation du principe actif, permettant ainsi la formation d'un état super-saturé et la promotion de la perméation.
Inversement si un principe actif aqueux est incorporé dans une crème E/H, une couche huileuse va se déposer à la surface de la peau, provoquant une barrière de plus à la perméation du principe actif hydrophile. Préparation phase aqueuse Chauffage Opérations Préparation phase huileuse Chauffage Incorporation d'une phase dans l'autre
Mélange Refroidissement
Homogénéisation
Mûrissement
Fig.14: Logigramme de fabrication d'une émulsion.
Contrôles
Homogénéité
Température, Poids restant
Sens
Vitesse, durée d'agitation Température Aspect, consistance Taille des particules Durée Température Consistance
Dans la famille des émulsions, nous distinguons les crèmes et les laits selon la nature de la dispersion et la viscosité du produit fini. Les crèmes ont une consistance plus visqueuse, et les laits ont une consistance plus fluide.
D'autres types d'émulsions existent également: émulsions à cristaux liquides, émulsions multiples, émulsions sans eau, gels-crèmes, silicones, oil free, sprayables, microémulsions, ...
• Les émulsions multiples Il s'agit d'émulsions d'émulsions.
Système E/H/E: système le plus répandu dans lequel des globules d'eau sont dispersés dans des globules d'huile eux-mêmes dispersés dans la phase aqueuse.
Système H/E/H : système dans lequel des globules d'huile sont dispersés dans des globules aqueux, eux-mêmes dispersés dans une phase huileuse externe.
La libération du principe actif se fait - soit par diffusion à travers les globules sous l'influence d'une pression osmotique
- soit, appliquée sur la peau, l'eau s'évapore, les globules se rompent et un mélange huile - principe actif se retrouve à la surface de la peau.
0--Émulsio11narH hyc'.r-ophile 9 - E:.mulslcru1a.n1 Hpcphi'J.e
Fig.15 : Représentation schématique d'une émulsion multiple E/H/E.
• Les microémulsions
Ce sont des dispersions isotropes de domaines d'eau et d'huile séparés par une monocouche d'agents de surface ou tensioactifs, et thermodynamiquement stables. Les microémulsions se forment spontanément sans apport d'énergie. La monocouche d'agents de surface est fluide, par rapport à celle des émulsions qui est rigide. Les particules sont comprises entre 1 et 1 OO nm. Par rapport aux émulsions classiques, le pouvoir solubilisant est augmenté et il y a une meilleure répartition et protection des actifs, ce qui en fait une forme d'administration transdermique intéressante. Elles ont une faible tension interfaciale
(=:
10-2 N/m), une faible viscosité et lepouvoir mouillant est augmenté. Leur formation spontanée à température ambiante les rend facilement industrialisables et diminue les coûts de production. L'incorporation d'actifs thermosensibles est possible à toute étape de la fabrication. Leur stabilité thermodynamique assure une absence de séparation de phase au cours du temps et permet un retour à la structure initiale après congélation ou chauffage.
Cependant, l'utilisation d'un pourcentage élevé d'agents de surface (entre 15 et 70 %), entraîne des phénomènes d'intolérance et, leur formation dépendant de la température, il y a un risque d'évaporation des phases.
2.2.4.
Les gelsIls se définissent comme des systèmes dispersés à une ou deux phases, thermodynamiquement stables consistant soit en une suspension de petites particules inorganiques (système à deux phases) ou en de grosses molécules organiques interpénétrées par un liquide constituant un réseau tridimensionnel (gel à phase unique).54 Ils sont en général transparents ou translucides.
La consistance est due à des agents gélifiants qui appartiennent principalement aux polymères.38
Des forces intermoléculaires lient les molécules de solvant au réseau, ce qui entraîne une mobilité réduite, augmente la viscosité et met en valeur des propriétés viscoélastiques. Une quantité de différents grades et poids moléculaires de ces polymères est disponible, ils sont utilisés entre 1 et 5% dans une formulation ajustant ainsi la viscosité finale de la préparation et facilitant son application (Cf§ 3.3.).
Les hydrogels, les plus fréquents dans les applications pharmaceutiques, sont constitués d'une base aqueuse ou alcoolique épaissie par des polymères naturels, (comme les carrageenanes, la pectine, ou des polymères synthétiques comme l'hydroxypropylcellulose ou les carbopols). L'évaporation des constituants volatils provoque une sensation rafraîchissante et laisse à la surface de la peau un résidu plus ou moins adhésif, non occlusif, lavable, à partir duquel le principe actif diffuse à travers le tégument. Les hydrogels peuvent toutefois contenir un corps gras émulsionné.
Les oléogels sont préparés à partir de solutions huileuses, ils ne sont pas lavables et laissent sur la surface de la peau un film occlusif.