Utilisation du bourdon Bombus impatiens pour la
gestion de la pollinisation de pommiers sous filet
d'exclusion en verger commercial
Mémoire
Mélanie Normandeau Bonneau
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
II
UTILISATION DU BOURDON BOMBUS IMPATIENS POUR LA
GESTION DE LA POLLINISATION DE POMMIERS SOUS FILET
D’EXCLUSION EN VERGER COMMERCIAL
Mémoire
Mélanie Normandeau Bonneau
Sous la direction de :
Valérie Fournier, directrice de recherche
Gérald Chouinard, codirecteur de recherche
Résumé
Ayant démontré leur efficacité dans plusieurs contextes, les filets d'exclusion sont de plus en plus utilisés pour lutter contre les ravageurs des cultures. Toutefois, la gestion de la pollinisation sous les filets doit être mieux étudiée pour que ceux-ci puissent être utilisés de façon optimale. Dans cette étude, l’efficacité de la pollinisation de ruchettes commerciales du bourdon Bombus impatiens (Hymenoptera: Apidae) a été évaluée pour des pommiers sous filets d’exclusion dans un verger expérimental du Québec sur une période de deux ans. Des données de rendement et de qualité des fruits (poids, calibre, nombre de pépins) ont été analysées en fin de saison afin de comparer 1) la pollinisation des bourdons commerciaux sous filets à celles des abeilles présentes dans l’environnement du verger et 2) deux positionnements des ruchettes commerciales sous les filets d’exclusion. Les résultats démontrent que les fruits produits dans les parcelles sous filets, pollinisées par les bourdons introduits étaient de qualité équivalente à ceux produits conventionnellement suite à une pollinisation par les abeilles et que le positionnement de la ruchette au milieu de la rangée de pommiers a permis une meilleure homogénéité de la charge en fruits comparativement au positionnement en bout de rangée.
IV
Abstract
Having demonstrated their effectiveness in many contexts, exclusion nets are increasingly used to control crop pests. However, pollination management under nets must be better studied if they are to be widely used. For this research, the pollination effectiveness of commercial bumblebee hives of Bombus impatiens (Hymenoptera: Apidae) was studied for apple production under exclusion nets in a research orchard located in Quebec over a period of two years. Yield and fruit quality (weight, size, number of seeds) data were analyzed at the end of the season to compare 1) the pollination of commercial bumblebees with that of bees in the orchard environment, and 2) two positionings of commercial hives under exclusion nets. Results show that under exclusion nets, bumblebees provided adequate pollination and fruit quality was equivalent to apple fruits conventionally pollinated by honeybees and wild bees. Moreover, we found that positioning the commercial bumblebee hives in the middle of the tree row provided a better fruit load homogeneity compared to the positioning at one end of the row.
Table des matières
Résumé... III
Abstract ... IV
Table des matières ... V
Liste des tableaux ... VII
Liste des figures ... VIII
Remerciements ... X
Avant-propos... XII
Introduction générale... 1
Chapitre 1 : État des connaissances ... 2
1.1. La pomiculture en Amérique du Nord ... 3
1.1.1. Historique de la culture ... 3
1.1.2. Importance économique de la culture ... 4
1.1.3. Le pommier domestique, Malus domestica Borkhausen ... 6
1.1.4. Calendrier phénologique du pommier ... 8
1.1.5. Régie de culture conventionnelle ... 9
1.1.6. Principaux insectes et maladies en pomiculture... 10
1.1.7. Production fruitière intégrée ... 13
1.2. Les filets d’exclusion en pomiculture ... 14
1.2.1. Historique et efficacité de la technique ... 14
1.2.2. Caractéristiques des filets anti-insectes ... 15
1.2.3. Types d’exclusion ... 16
1.2.4. Effets des filets sur l’environnement et la qualité des fruits ... 17
1.3. La pollinisation en pomiculture ... 17
1.3.1. L’abeille domestique, Apis mellifera Linnaeus ... 18
1.3.2. Les bourdons, Bombus spp. Latreille ... 19
1.3.3. Obstacles à la pollinisation des fleurs de pommier ... 22
1.3.4. Problématique de la pollinisation avec les filets d’exclusion ... 22
1.4. Objectifs et hypothèses de recherche ... 25
1.4.1. Objectif général ... 25
1.4.2. Objectif spécifique 1 ... 25
1.4.3. Objectif spécifique 2 ... 25
Chapitre 2 : Use of commercial bumblebee (Bombus impatiens) hives under exclusion
nets for apple management pollination in orchards. ... 26
Résumé... 27
VI
Introduction ... 29
Materials and Methods ... 31
Results ... 34 Discussion ... 36 Conclusion ... 38 Acknowledgments ... 38 References ... 39 Figures ... 43
Chapitre 3 : Conclusion générale ... 47
Bibliographie ... 51
Annexe 1 ... 63
Liste des tableaux
Tableau 1 : Production mondiale de pommes pour l’année 2016 (FAOSTAT, 2018). ... 4 Tableau 2 : Nombre d’exploitations et superficie des vergers au Québec par région pomicole en 2016 (ISQ,
2018). ... 6 Tableau 3 : Synthèse d’information sur les insectes, acariens et maladies primaires des pommiers ciblés par
les traitements chimiques des vergers du nord-est de l’Amérique du Nord1,2,3. ... 12
VIII
Liste des figures
Figure 1 : Stades phénologiques du pommier domestique, Malus domestica Cultivar McIntosh. Photos : Bernard Drouin, MAPAQ. ... 8 Figure 2: Experimental unit of a complete exclusion net in apple orchard. ... 43 Figure 3: Distribution categories of apple seeds per carpel used to represent all possible combinations
(Sheffield, 2014). ... 43 Figure 4a: Apple fruit weight (g) and fruit size (mm) for each treatment for two production years (2016-2017).
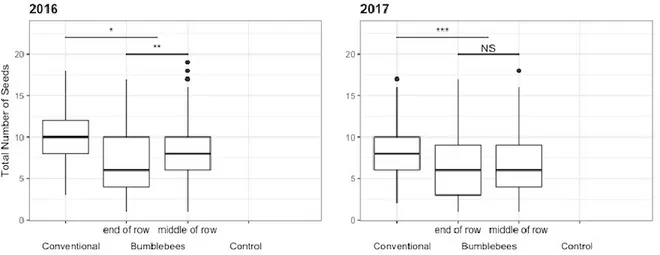
NS p > 0.05 ∗p ≤ 0.05, ∗∗p ≤ 0.01, ∗∗∗p ≤ 0.001. Grey dots added to show fruit distribution in each treatment. ... 44 Figure 4b: Total number of seeds for each treatment for two production years (2016-2017). NS p > 0.05
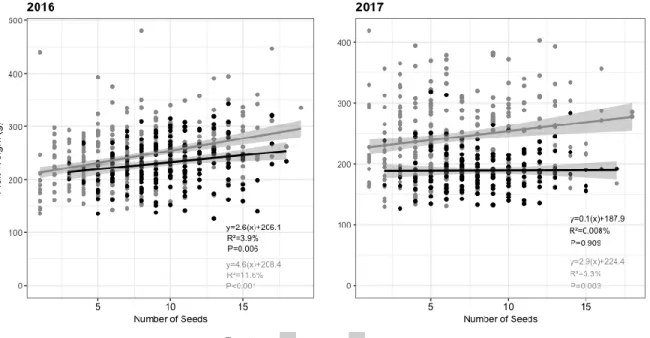
∗p ≤ 0.05, ∗∗p ≤ 0.01, ∗∗∗p ≤ 0.001. ... 44 Figure 5: Apple fruit weight (g) versus the number of seeds per fruits for two production years (2016-2017). CI
= 95%. ... 45 Figure 6: Apple fruit weight (g) versus carpel category in each treatment for two production years (2016-2017).
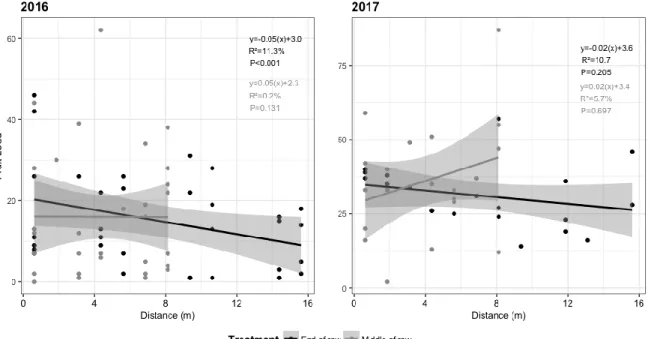
Boxes sharing the same letters are not significantly different. Grey dots added to show number of fruit per carpel category. ... 45 Figure 7a: Fruit load versus distance (m) for the two locations of commercial bumblebee hives under nets for
two production years (2016-2017). CI = 95%. ... 46 Figure 7b: Fruit load per tree for each year. ... 46
À Mathieu et mes parents, je vous aime!
.
« Imitons l’abeille, elle fait de grandes
randonnées, sans perdre son objectif. »
- Louis-Marie Parent
X
Remerciements
J’aimerais tout d’abord remercier ma directrice Valérie Fournier et mon codirecteur Gérald
Chouinard pour leur soutien. Vous m’avez permis de vivre cette expérience unique qu’est la maîtrise et vous
avez su bien me conseiller et me guider à travers ce long processus. Maintenant, j’ai la piqûre pour la recherche en entomologie et je souhaite, dans un avenir rapproché, perfectionner mon expertise pour la lutte intégrée en pomiculture.
Aussi, je remercie chaleureusement mes évaluatrices Madeleine Chagnon, professeure associée à l’Université du Québec à Montréal (UQAM), et Ève-Catherine Desjardins, chercheure au Centre d’Expérimentation et de Développement en Forêt Boréale (CEDFOB), d’avoir accepté d’évaluer mon mémoire. J’aimerais également remercier l’équipe du laboratoire en Production Fruitière Intégrée de l’Institut de Recherche et de Développement en Agroenvironnement (IRDA), tout particulièrement Francine Pelletier et
Mikael Larose. Et surtout, un grand merci au temps donné par les étudiants stagiaires, sans quoi le projet
n’aurait pas aussi bien fonctionné : Frédérique Beaulieu pour ton merveilleux sourire, Charlotte
Farley-Legault pour ton travail assidu et Sara Gervais pour ton rire communicatif. Sans oublier tous les autres
étudiants stagiaires qui ont également donné un peu de leur temps au travers des autres projets : Catherine
Bolduc, Élizabeth Ménard, Sandrine Corriveau, Charles Sasseville et Romain LeGléau.
Je voudrais aussi remercier mes collègues de l’Université Laval qui ont également donné du temps pour la relecture de l’article scientifique, la validation des résultats statistiques ou la prise de données : Olivier
Samson-Robert, Amélie Gervais, Frédéric McCune, Stéphanie Patenaude, Marianne Lamontagne-Drolet, Sabrina Rondeau et Phanie Bonneau.
Ce projet n’aurait pu avoir lieu sans la participation et l’appui de Benoit Gadbois et Jocelyn Tardif au verger expérimental de l’Institut de recherche et de Développement en Agroenvironnement (IRDA). Vous avez été d’une patience d’or durant toute la durée du projet en répondant à mes millions de questions et vous m’avez très bien conseillée lorsque j’éprouvais des problèmes phytosanitaires dans ma parcelle.
Merci aux fournisseurs: Thierry Chouffot de Koppert Canada Limited pour les colonies de bourdons,
Brad Moore et Ryan Reisbick de Firman Pollen Inc. pour le pollen de pommier et les conseils pour la
germination in vitro et Dubois Agrinovation pour le matériel ayant servi à la confection des filets d’exclusion. Je tiens à remercier mes amis d’avoir été là pour moi. Un merci tout particulier à Virginie
Lemieux-Labonté, qui était toujours là quand j’avais des problèmes statistiques. Tu as également pris de ton précieux
Monette à qui je pouvais me confier sans crainte d’être jugée durant nos soirées où l’on écoutait des animés.
Ça m’a permis de décompresser pour mieux repartir sur le bon chemin. Je remercie également Marc
Pinsonneault, mon collègue de travail au Salon de thé Le-Vieux-Moulin, pour son soutien. Sérieusement,
merci de m’avoir parlé de roches et de poissons, tu ne sais pas à quel point ça m’a fait du bien. J’ai adoré les moments passés ensemble et je suis heureuse de voir enfin nos rêves se réaliser. Et finalement, merci
Baptise Gabet parce que tu es toujours là pour moi… même si tu habites de l’autre côté de l’océan atlantique!
Je ne saurai oublier mon fiancé, Mathieu Gauvin, qui partage ma vie depuis ces six dernières années et qui m’a fortement soutenue durant cette étape de ma vie. Tu as su m’épauler et m’aimer comme toi seul sait le faire. Tu as supporté mes sautes d’humeurs et mes déprimes passagères avec douceur et compassion. Tu m’as même aidée bénévolement en comptant sans broncher des fleurs de pommiers en pleine chaleur pendant plus de 12 heures… Mais surtout, merci d’endurer mes trillions de pots de pilules remplis d’insectes dans le congélateur! Mon amour je t’aime tellement!
J’aimerais finalement remercier les personnes qui contribuent directement à qui je suis. Maman,
Papa… merci d’avoir cru en moi et d’avoir soutenu ma passion pour les insectes. C’est sûr que ça n’a pas
toujours été facile, mais vous avez toujours été fiers de moi que ce soit de mes réussites comme de mes échecs. Je vous en serai toujours reconnaissante, je vous aime énormément!
XII
Avant-propos
Le chapitre II de ce mémoire est présenté sous forme d’article scientifique rédigé en anglais et sera soumis pour publication dans une revue révisée par les pairs.
Les éléments nécessaires à la production de ce mémoire, tel que la récolte des données, l’analyse et l’interprétations des résultats, ainsi que la rédaction de l’ensemble des textes sont issus de la candidate.
Les coauteurs du manuscrit scientifique sont Valérie Fournier (directrice), Ph.D., professeure d'entomologie à l'Université Laval et Gérald Chouinard (codirecteur), Ph.D. chercheur à l’Institut de Recherche et de Développement en Agroenvironnement et Olivier Samson-Robert (professionnel de recherche). Ils ont collaboré au manuscrit via leurs corrections et suggestions, permettant l’amélioration du texte.
Introduction générale
Chez le pommier, la pollinisation croisée est primordiale afin d’assurer la mise à fruit et ainsi obtenir un rendement acceptable. Dans les vergers commerciaux, on retrouve plusieurs cultivars de pommiers pollinisateurs qui fournissent du pollen génétiquement compatible aux autres cultivars. La pollinisation est essentiellement assurée par l’abeille domestique Apis mellifera L., une espèce qui, depuis plusieurs décennies, est le principal pollinisateur en vergers commerciaux. Or, des études récentes ont démontré que les espèces d’abeilles sauvages, comme les bourdons (Bombus spp.), sont bien présentes dans l’environnement des vergers et qu’elles peuvent être beaucoup plus efficaces pour assurer la pollinisation croisée des fleurs de pommiers.
Avec la demande croissante des consommateurs pour des pommes sans pesticides, il est à prévoir que les filets d’exclusion seront utilisés à plus grande échelle dans les années à venir, pusique qu’ils offrent une gestion plus écologique de la culture. Dans les vergers où les filets d’exclusion sont utilisés comme méthode de lutte alternative aux insecticides pour la répression des insectes ravageurs, la location de ruches d’abeilles domestiques ne s’avère pas être une méthode de gestion idéale. L’ouverture des filets d’exclusion durant la floraison pour laisser entrer les butineuses demande une gestion trop lourde en plus de permettre l’entrée de ravageurs hâtifs. De plus, l’intégration de ruches d’abeilles domestiques à l’intérieur des filets n’est pas envisageable puisque cette espèce tolère mal être restreinte à un espace clos. Les bourdons commerciaux sont, quant à eux, reconnus comme étant d’excellent pollinisateurs à l’intérieur de structures confinées comme les serres et les tunnels. Nous présupposons donc qu’ils ne seront pas gênés par l’étroitesse de l’espace sous les filets d’exclusion.
Afin de mieux comprendre les comportements des bourdons sous filets d’exclusion, notre étude a été effectuée au verger expérimental de l’Institut de recherche et de développement en agroenvironnement (IRDA) sur une période de deux ans. L’objectif principal était de tester l’efficacité du bourdon commercial
Bombus impatiens Cresson (Hymenoptera : Apidea) confiné sous filets d’exclusion à polliniser les fleurs de
pommiers sans nécessiter leur ouverture. Ainsi, les objectifs spécifiques étaient de : 1) comparer la pollinisation réalisée par les ruchettes commerciales de bourdons Bombus impatiens sous filets à celle conventionnelle obtenue par les abeilles présentes dans l’environnement du verger (abeilles domestiques et sauvages) et 2) comparer l’efficacité selon deux positionnements des ruchettes commerciales de bourdons
Bombus impatiens sous les filets d’exclusion, soit en bout ou en milieu de rang. Les résultats de cette étude
ont pour but de contribuer au développement d’une nouvelle technique de pollinisation sous filets d’exclusion en vergers commerciaux de pommiers.
2
1.1. La pomiculture en Amérique du Nord
1.1.1.
Historique de la culture
Contrairement au pommetier sauvage (Malus coronaria Mill.), le pommier domestique (Malus
domestica Borkh.) n’est pas une espèce indigène à l’Amérique du Nord. C’est avec l’arrivée de Samuel de
Champlain au Nouveau Monde en 1604 que les premières semences de pommiers ont été plantées sur le continent dans l’objectif de permettre l’établissement de cette culture (AAC, 2015).
Comme les pommiers poussent très rapidement, vivent longtemps, sont faciles d’entretien et que les pommes peuvent être entreposées et conservées pendant une partie l’année, ce fruit est rapidement devenu un aliment important dans la diète des premiers colons en Amérique du Nord. Au Canada, des jeunes pommiers étaient donnés aux paysans du sud de l’Ontario et du Québec pour qu’ils puissent être plantés sur leurs fermes (AAC, 2015). Puisque la culture de la pomme est bien adaptée aux climats tempérés, elle devient alors la plus accessible aux nouveaux arrivants (Martin, 2002). Les colons établissent des pommeraies près des grands centres comme Québec et Montréal, puis le long de la vallée du Saint-Laurent. La première mention écrite d’une production commerciale de pommiers remonte à 1796 en Ontario (Martin, 2002; Hancock, 2008). À mesure que les pionniers se déplaçent vers l’ouest, la culture du pommier devient indispensable. Vers la fin des années 1800, plusieurs vergers voient le jour le long de la côte ouest, dont ceux encore présents dans la fertile vallée de l’Okanagan en Colombie-Britannique (Hancock, 2008).
Après des centaines d’années d’hybridation et de manipulations culturales, l’Amérique du Nord possède aujourd’hui ses propres cultivars1 de pommiers adaptés au sol et au climat du continent. Les
variétés que l’on retrouve aujourd’hui dans les vergers commerciaux résultent de croisements effectués dans les laboratoires et les fermes expérimentales afin de satisfaire aux rigoureux critères de mise en marché (Martin, 2002). Plus d’une centaine sont originaires de l’Amérique du Nord (Beach, 1905) mais seulement quelques-unes sont cultivées commercialement, telles la McInstosh, la Red Delicious et la
Golden Delicious, la Honeycrisp, la Jonagold, la Empire, la Ambrosia, la Cortland et la Spartan (US Apple
Association, 2018a; BC Tree Fruits, 2018; Ontario Apple Growers, 2018; Pommes Qualité Québec, 2018). De nouvelles variétés, comme la Fuji (Japon) et la Gala (Australie), remplacent graduellement des variétés devenues moins populaires auprès des consommateurs.
_______________________________
1Un cultivar est un type végétal résultant d'une sélection, d'une mutation ou d'une hybridation (naturelle ou provoquée) et cultivé
4
1.1.2.
Importance économique de la culture
En 2013, la production annuelle mondiale de pommes s’estimait à environ 81 millions de tonnes, ce qui faisait de la pomme le 4e fruit cultivé en importance après les agrumes (135 millions de t), les
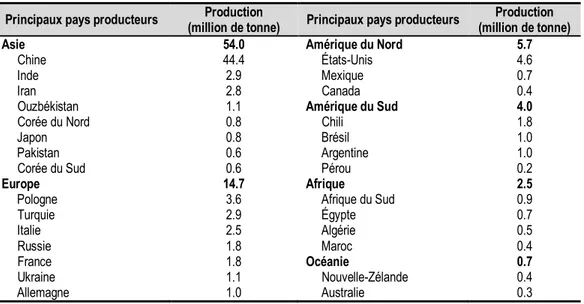
pastèques (108 millions de t) et les bananes (106 millions de t), suivie de près par les raisins (77 millions de t) (FAOSTAT, 2016). Le tableau suivant montre les principaux pays producteurs de pommes (Tableau 1). La République populaire de Chine est, depuis 2004, le plus gros producteur au monde avec environ 44,4 millions de tonnes, ce qui classe le pays bien loin devant ses autres concurrents.
Tableau 1 : Production mondiale de pommes pour l’année 2016 (FAOSTAT, 2018). Principaux pays producteurs (million de tonne) Production Principaux pays producteurs (million de tonne) Production Asie Chine Inde Iran Ouzbékistan Corée du Nord Japon Pakistan Corée du Sud 54.0 44.4 2.9 2.8 1.1 0.8 0.8 0.6 0.6 Amérique du Nord États-Unis Mexique Canada Amérique du Sud Chili Brésil Argentine Pérou 5.7 4.6 0.7 0.4 4.0 1.8 1.0 1.0 0.2 Europe Pologne Turquie Italie Russie France Ukraine Allemagne 14.7 3.6 2.9 2.5 1.8 1.8 1.1 1.0 Afrique Afrique du Sud Égypte Algérie Maroc Océanie Nouvelle-Zélande Australie 2.5 0.9 0.7 0.5 0.4 0.7 0.4 0.3
Avec une production annuelle se situant à environ 4,6 millions de tonnes et un chiffre d’affaires annuel qui s’élève à plus de 4 milliards de dollars américain, les États-Unis se classent au 2e rang des
producteurs de pommes (FAOSTAT, 2018; US Apple Association, 2018b). Le pays réunit près de 7 500 producteurs répartis sur une superficie totale d’environ 322 000 acres (US Apple Association, 2018b). Plus de 32 états américains cultivent la pomme, dont 10 se démarquent par leur volume de production : Washington, New York, Michigan, Pennsylvanie, Californie, Virginie, Caroline du Nord, Oregon, Ohio et Idaho (US Apple Association, 2018b). Environ 67% des pommes cultivées sont destinées au marché frais, c’est-à-dire les pommes fraîches consommées immédiatement par les acheteurs, et le reste (33%) vont pour la transformation en jus, compote et quartiers ensachés (US Apple Association, 2018b). Les États-Unis exportent 25% de leur production à l’étranger et importent environ 6% de pommes fraîches en provenance principalement du Chili, de la Nouvelle-Zélande et du Canada, pour garnir les étalages des épiceries de mars à juillet (US Apple Association, 2018b). Près de 100 variétés sont cultivées commercialement aux États-Unis, dont la plus populaire est maintenant la Gala bien que la Red Delicious reste encore bien appréciée des consommateurs (US Apple Association, 2018b).
C’est avec environ 0,4 million de tonnes et un chiffre d’affaire annuel évalué à environ 223 millions de dollars que le Canada peut s’afficher dans le palmarès des pays producteurs de pommes (AAC, 2017; FAOSTAT, 2018). Malgré un déclin progressif depuis 1999 de l’exportation de pommes fraîches principalement expliquée par l’augmentation de la compétition mondiale pour le marché frais et transformé, la pomiculture a pu rester une des cultures les plus importantes au Canada (AAC, 2012). Elle est la 2e culture au pays en termes de revenus et le 3e fruit le plus consommé par
la population (10,66 kg/personne) (AAC, 2017). Les 17 378 hectares de vergers au pays, dont 15 491 étaient en production en 2017, se répartissent dans principalement quatre provinces : l’Ontario, le Québec, la Colombie-Britannique et la Nouvelle-Écosse (Statistiques Canada, 2018). Bien que l’on constate également une diminution des superficies de plantations, la production canadienne est demeurée relativement stable (AAC, 2012). Plusieurs vergers de pommiers standards, moins profitables à exploiter, ont été partiellement ou complètement remplacés par des pommiers nains et semi-nains (Charest, 2006) ou bien par d’autres cultures (AAC, 2012). Ainsi, la modernisation des vergers permet de produire un plus grand volume de pommes de qualité par hectare tout en réduisant les coûts de production. La majorité des vergers de pommiers actuellement en production sont devenus des vergers «à haute densité» , une technique permet une augmentation des volumes de production sur de plus petites surfaces et compense en partie la perte des superficies en culture (MAPAQ, 2015). Comme aux États-Unis, la majorité de la production, soit près de 77%, est destinée au marché frais et le reste (23%) est utilisé pour la transformation (AAC, 2015). La variété la plus cultivée au Canada est la McIntosh (AAC, 2015).
Au Québec, la culture de pommes est la culture fruitière la plus importante : avec près de 29% de la production totale de pommes canadiennes, le Québec est la 2e province productrice de
pommes derrière l’Ontario (37%) et suivie de près par la Colombie-Britannique (21%) (AAC, 2015). En 2017, les vergers couvraient une superficie totale de 5 192 ha sur le territoire québécois dont 4 259 étaient en production (Statistiques Canada, 2018). Les vergers sont principalement localisés en Montérégie (Est et Ouest), dans les Laurentides et l’Estrie (Tableau 2) (ISQ, 2018). La production québécoise est presque totalement destinée au marché intérieur et en grande majorité disponible pour la cueillette à l’automne ou bien vendue toute l’année dans les comptoirs des épiceries (MAPAQ, 2015). Une petite portion est également envoyée pour la transformation, sous forme de sous-produits, dont le distinctif cidre de glace (MAPAQ, 2015). Les dix principaux cultivars de pomme du Québec sont, par ordre chronologique de récolte : la Sunrise, la Paulared, la Ginger
Gold, la Lobo, la McIntosh, la HoneyCrisp, la Gala, la Spartan, la Cortland et la Empire (G.
6
en 2015 42% du volume de production (MAPAQ, 2015). Cette variée est sans conteste la plus populaire auprès des consommateurs québécois (Pommes Qualité Québec, 2018).
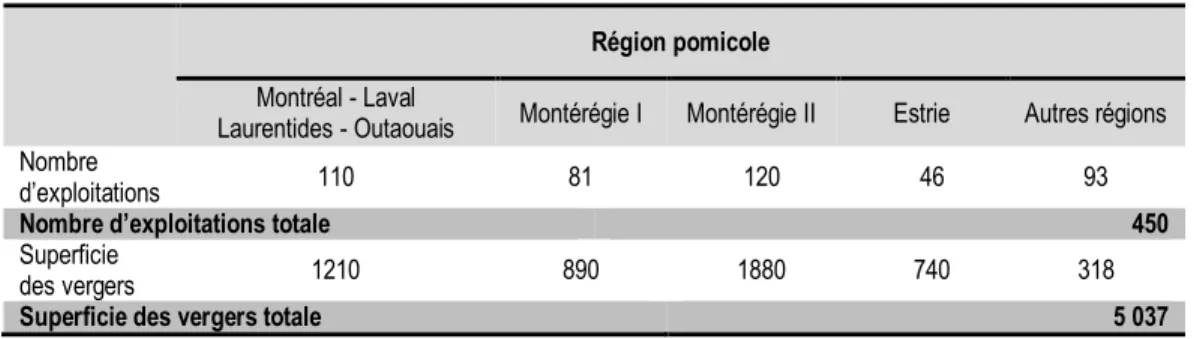
Tableau 2 : Nombre d’exploitations et superficie des vergers au Québec
par région pomicole en 2016 (ISQ, 2018).
Région pomicole Montréal - Laval
Laurentides - Outaouais Montérégie I Montérégie II Estrie Autres régions Nombre
d’exploitations 110 81 120 46 93
Nombre d’exploitations totale 450
Superficie
des vergers 1210 890 1880 740 318
Superficie des vergers totale 5 037
1.1.3.
Le pommier domestique, Malus domestica Borkhausen
Le pommier, Malus spp., est un arbre fruitier de la famille des Rosaceae, sous-famille des
Pomoideae (Hancock, 2008). Cette famille comprend plus de 100 genres et 3 000 espèces réparties dans le
monde entier, principalement dans les régions tempérées (Velasco et al., 2010). Le genre Malus est tout aussi diversifié et comprend approximativement 28 à 55 espèces, en raison de l’hybridation qui existe entre celles-ci. Selon de récentes analyses génétiques, le pommier domestique (Malus domestica Borkh.) descendrait principalement d’une espèce de pommier sauvage, M. sieversii Ledeb. (Velasco et al., 2010). Cette espèce, découverte en 1929 par le biologiste soviétique Nikolaï Vavilov, origine des montagnes du Tien Shan en bordure de la Chine et du Kazakhstan (Hancock, 2008; Vavilov, 1992 cité dans Richards et al., 2009). Les pommiers sauvages de cette espèce offraient des pommes aux goûts et couleurs très variés dont les fruits étaient plus gros et goûteux que ceux des autres pommiers sauvages du genre Malus (Luby et al., 2001 cité dans Richards et al., 2009). Le pommier domestique d’aujourd’hui est le résultat de sa domestication par l’Homme et n’a donc pas évolué de manière naturelle. En raison de leur facilité à s’hybrider, les caractéristiques des pommiers ont été façonnées par manipulations génétiques pour obtenir des variétés uniques. C’est surtout grâce à la pollinisation croisée (définition plus bas), effectuée naturellement par les pollinisateurs ou manuellement par les producteurs, qu’une dizaine d’espèces ont contribué au bagage génétique de M. domestica. C’est d’ailleurs plus de dix mille cultivars qui auraient été ainsi créés depuis que l’espèce est cultivée (Velasco et al., 2010).
Bien que les pommiers se reproduisent de façon naturelle via les pépins, ceux-ci ne sont pas utilisés dans les productions commerciales. La reproduction s’effectue plutôt de façon végétative à l’aide de greffons, de sorte que les producteurs sont en mesure de sélectionner ce qu’ils désirent cultiver (Hancock, 2008). Les pommiers cultivés sont divisés physiologiquement en deux parties distinctes; le scion et le
porte-greffe (Hancock, 2008). Le scion est la partie aérienne qui permet de déterminer, entre autres, l’apparence générale de l’arbre, les caractéristiques des fruits produits et la résistance aux maladies et aux insectes ravageurs. Le porte-greffe est la partie souterraine qui permet de déterminer l’adaptation au climat et au type de sol, la tolérance aux mauvaises herbes, la taille générale de l’arbre (nain, semi-nain ou standard) et la tolérance à certains insectes ou maladies (Charest, 2006). Il est important pour un producteur d’avoir une bonne diversité de cultivars dans son verger, puisque les fleurs de pommiers, bien qu’hermaphrodites, sont autostériles, c’est-à-dire qu’elles ne peuvent pas féconder les fleurs d’un même cultivar et requièrent donc l’apport de pollen d’autres cultivars pour produire un fruit (Ramírez & Davenport, 2013). La pollinisation croisée désigne ce transport du pollen des étamines d’un cultivar pollinisateur vers les stigmates d’un autre cultivar pour produire des fruits (Janick et al., 1996). Ce type de pollinisation augmente grandement l’hétérozygotie et si ces pommiers polyploïdes venaient à se reproduire par graines, leurs caractères ne seraient pas stables et les arbres ainsi produits présenteraient une forte variabilité entre eux. En conséquence, cela affecterait négativement la production de fruits; ceux-ci auraient des tailles variables ainsi qu’un aspect et une qualité médiocre. En vergers commerciaux, il faut consacrer au minimum 10 % de la superficie à des cultivars dits «pollinisateurs» (i.e. des cultivars compatibles ou des pommetiers spécialisés) afin d’assurer une bonne qualité de la production (ACIA, 2014). Les pommetiers sont parfois utilisés à cette fin dans les vergers commerciaux, car ces arbres fleurissent abondamment et fournissent de grandes quantités de pollen compatible.
En moyenne, les pommiers sur porte-greffe mesurent entre 2 et 5 m de hauteur selon le cultivar et ceux naturalisés2 peuvent atteindre entre 10 et 15 m de hauteur. Les conditions optimales pour la
croissance des pommiers sont les zones tempérées froides, où l’intensité lumineuse est forte et où les jours sont chauds et les nuits sont fraîches (ACIA, 2014). La durée de la saison de végétation varie selon les cultivars et dépend essentiellement de la température. Les pommiers poussent mieux dans les sols loameux avec un pH neutre et une forte teneur en matière organique (ACIA, 2014). Ils ne tolèrent pas les sols mal drainés, c’est pourquoi les vergers sont généralement plantés sur les pentes de collines. Idéalement, la pente devrait être faible et faire face au sud, ce qui maximise l'exposition au soleil, le drainage de l’air, diminue le risque de gel au printemps et maximise l’irrigation du sol (ACIA, 2014). La durée de vie moyenne d’une plantation commercial est estimée à environ 20 ans mais celle-ci est dépendante de plusieurs facteurs dont la densité de plantation, les types de cultivars utilisés, la qualité du sol, les conditions du milieu, la rentabilité du verger et l’évolution de la préférence des consommateurs.
_______________________________
2Phénomène écologique dans lequel une espèce non-native (cultivée ou non) s’intègre à un écosystème sauvage et où elle est en
8
1.1.4.
Calendrier phénologique du pommier
Le développement phénologique des pommiers (voir Figure 1) est directement lié à la température. Les degrés-jours sont ainsi utilisés pour estimer la croissance et le développement des fleurs et fruits des arbres au cours de la saison. De plus, les pommiers requièrent la vernalisation, c’est-à-dire une période de froid prolongée (800 à 1200 heures en dessous de 0°C) nécessaire pour lever la dormance des bourgeons floraux (ACIA, 2014).
L’inflorescence possède en général trois à six fleurs de couleur rosé tirant sur le blanc (Dennis, 1986 & 2003 cité dans Ramírez & Davenport, 2013), chacune composée de cinq pétales et sépales, de 20 étamines et d’un pistil avec cinq styles (Janick et al., 1996). L’ovaire possède en général cinq carpelles avec deux ovules chaque, qui résultera en la formation d’un total de 10 pépins après fécondation (Janick et al., 1996). Exceptionnellement, certaines variétés peuvent former jusqu’à 18 pépins (Hancock, 2008).
Les jeunes pommiers provenant des pépinières sont encore au stade non florifère (végétatif) après leur plantation. C’est après une période de deux à trois ans qu’ils pourront produire des fruits de façon commerciale. La période de floraison varie selon les conditions météorologiques et peut durer en moyenne neuf jours mais la prolongation des températures froides, les hausses rapides des températures et le vent peuvent faire grandement varier cette période (Morris, 1921 cité dans McGregor, 1976). La floraison débute par l’ouverture de la fleur centrale. Celle-ci est très importante puisqu’elle a le potentiel de produire le fruit le plus gros. Pendant la pollinisation, les insectes pollinisateurs déposent des grains de pollen sur le pistil. Ceux-ci vont alors germer et féconder l’ovule. Au cours du premier mois, le fruit se noue et croit rapidement. Au bout d’environ deux mois et demi de croissance, le fruit atteint sa taille définitive puis commence à murir et prendre ses couleurs. En général, les fruits sont prêts pour la cueillette après une croissance d’une durée de 120 à 150 jours. En verger commercial, très peu de fleurs, soit environ 1 à 5% complèteront leur développement et produiront des fruits mûrs (ACIA, 2014). Ce processus physiologique normal est dû à la compétition interne entre les fruits (Way, 1978). Cependant, un pourcentage de mise à fruit plus faible peut être dû entre autres à l’absence de pollinisation, l’incompatibilité génétique, la compétition entre les fruits, l’éclaircissage commercial, l’alternance3 et les
problèmes phytoparasitaires.
_______________________________
3L'alternance se produit lorsqu'une année de production abondante inhibe la formation des boutons floraux, ce qui a pour effet de
réduire la floraison au cours de l'année suivante (Monselise & Goldschmidt, 1982).
Figure 1 : Stades phénologiques du pommier domestique, Malus
domestica Cultivar McIntosh.
1.1.5.
Régie de culture conventionnelle
Au Québec, la production de pommes sans pesticides (insecticides, fongicides, etc.) est difficile en raison du climat humide et des nombreuses espèces d’insectes et maladies qui endommagent la récolte et affectent le rendement (Tableau 3) (Vincent & Bostanian, 1988; Vincent & Roy, 1992). Les vergers sont, en général, des habitats assez stables qui supportent une entomofaune riche et diversifiée. Plus du quart des espèces est considérée comme nuisible à plus ou moins grande échelle (Cross et al., 2015) et, sans interventions phytosanitaires, jusqu’à 98% des pommes peuvent être endommagées par les ravageurs (Chouinard et al., 2006). Les ressources alimentaires étant toujours les mêmes année après année, les cultures pérennes permettent de soutenir le développement des populations de ravageurs (Simon et al., 2010). De plus, dans les systèmes agricoles, un déclin des communauté d'arthropodes bénéfiques (prédateurs et parasitoïdes) peut grandement perturber le processus écosystémique naturel qui, normalement, maintenait à des seuils acceptables les populations d'espèces indésirables (Root, 1973; Andow, 1991; Symondson et al., 2002; Losey et Vaughan, 2006). On voit ainsi apparaître les problèmes de prolifération. C’est donc pourquoi les pommiers sont si sensibles aux maladies et aux insectes et que la pomiculture est considérée comme l’une des productions agricoles utilisant le plus de pesticides à l’hectare (MDDELCC, 2003). L’utilisation des pesticides de synthèse permet ainsi aux producteurs de préserver la qualité visuelle des fruits en prévenant les dommages et en réduisant les pertes dues au déclassement.
Dans un verger commercial conventionnel, plus de 14 applications en moyenne peuvent être nécessaires en une saison pour lutter contre les ravageurs (Morin & Chouinard, 2001). Certains pesticides requièrent même plus d’une application en fonction de l’importance de l’infestation du ravageur ou de la virulence de la maladie. Les pesticides utilisés sont généralement peu spécifiques ce qui permet d’atteindre plusieurs ravageurs simultanément, mais qui peut provoquer des effets sur une multitude d’autres organismes, qu’ils soient bénéfiques ou non à la culture (Thistlewood, 1991; Bishop et al., 2000; Biddinger et al., 2013). Les pesticides sont également reconnus pour avoir des impacts négatifs sur l’environnement, de même que sur la santé et la sécurité humaine (Pimentel, 2005; Coronado et al., 2006). De plus, l’application intensive et l’utilisation répétée de produits contenant des matières actives d’un même groupe chimique peut accélérer la sélection naturelle d’individus résistants (Tabashnik & Croft, 1985). En effet, plusieurs espèces de ravageurs, confrontées à des traitements chimiques répétitifs, peuvent s’ajuster aux nouvelles conditions pour assurer leur pérennité. Ils s’adaptent rapidement grâce à leur capacité de multiplication rapide dans le temps qui leur a permis de transmettre leurs gènes de résistance. Par exemple, des essais en laboratoire ont démontré que les larves et les mâles adultes d’un des principaux ravageurs du pommier, le carpocapse de la pomme (Cydia pomonella L.), avaient une sensibilité réduite à deux insecticides couramment utilisés dans les vergers de l’Est du Canada, l’azinphosméthyl et le thiaclopride
10
(Grigg-McGuffin et al., 2014). Le développement d’une sensibilité réduite à plusieurs insecticides homologués (azinphosméthyl, thiaclopride, méthoxyfenzide et chlorantraniliprole) a également été observé dans des populations de carpocapse échantillonnées dans des vergers du Québec et de l’Ontario (Grigg-McGuffin et al., 2014).
Les pesticides utilisés en pomiculture sont bien règlementés mais malgré tout, une vaste gamme de produits chimiques sont disponibles aux producteurs pour lutter contre les insectes, les maladies et les mauvaises herbes. Les insecticides les plus utilisés vont généralement agir sur le système nerveux des organismes en inhibant l’acétylcholinestérase, une enzyme impliquée dans le fonctionnement du système nerveux et musculaire (Gepner et al., 1978). Cette inhibition provoque la propagation continue d’influx neveux, la contraction involontaire et répétée des muscles, puis la mort de l’insecte. Pour maximiser leur efficacité, il est le plus souvent recommandé d’appliquer ces produits pendant la période mobile des adultes, mais, les traitements peuvent viser les œufs, les larves et les adultes. Ces insecticides agissent principalement par contact direct ou par ingestion de résidus laissés à la surface des fruits ou du feuillage. Toutefois, il est parfois assez difficile de contrôler efficacement certains ravageurs puisque les larves résident longtemps dans le fruit, à l’abri des interventions.
1.1.6.
Principaux insectes et maladies en pomiculture
Dans les vergers du nord-est de l’Amérique du Nord, on retrouve plus d’une dizaine d’espèces d’insectes pouvant causer des dégâts importants aux pommiers (Leskey et al., 2009) (voir Tableau 3 pour la liste des principaux ravageurs arthropodes). À défaut de traitements appropriés, des pertes appréciables de plus de 10% en moyenne peuvent être observées (Morin & Chouinard, 2001). Le stade adulte de ces insectes peut endommager les fleurs au niveau du calice ce qui empêche le développement du fruit, ou encore directement affecter les fruits en provoquant des lésions de nutrition ou de ponte à leur surface. Mais le plus souvent, c’est le stade larvaire qui cause des dommages en se logeant directement dans la chair des fruits pour s’en nourrir. Les larves creusent de nombreuses galeries à l’intérieur des fruits et peuvent aussi y laisser des excréments, ce qui rend les fruits impropres à la consommation. Dans la plupart des cas, les pommes attaquées tombent au sol. Les principaux insectes ravageurs de la pomme dans les vergers du nord-est de l’Amérique du Nord sont le carpocapse de la pomme (C. pomonella), le charançon de la prune (Conotrachelus nenuphar Herbst), la mouche de la pomme (Rhagoletis pomonella Walsh) et la punaise terne (Lygus lineolaris P. de B.) (Agnello et al., 2006). D’autres insectes ravageurs sont aussi présents à l’occasion et peuvent causer, en cas d’infestation, des dégâts importants sur les pommiers. C’est le cas de l’hoplocampe du pommier (Hoplocampa testudinaea Klug), de la tordeuse à bandes obliques (Choristoneura rosaceana Harris) et de la mineuse marbrée (Phyllonorycter blancardella Fab.) (Agnello et
al., 2006). Les acariens comme le tétranyque rouge (Panonychus ulmi Koch) et le tétranyque à deux points (Tetranychus urticae Koch), les pucerons (Aphis pomi De Geer, Dysaphis plantaginea Passerini et
Eriosoma lanigerum Haus.) ainsi que la cicadelle blanche du pommier (Typhlocyba pomaria McAtee)
peuvent, selon les espèces, endommager le feuillage des arbres ou la surface des fruits, de même que causer un retard dans leur croissance ou provoquer leur chute prématurée. Il existe une vingtaine d’autres insectes ravageurs pouvant occasionner des dommages à plus ou moins grande échelle dans les vergers du nord-est de l’Amérique du Nord (Agnello et al., 2006).
Les maladies (voir Tableau 3 pour la liste des principales maladies) regroupent les infections d’origine bactérienne, virale ou fongique. Dans la plupart des cas, elles s’attaquent au feuillage des pommiers, parfois même des fruits, et empêchent le bon fonctionnement de la photosynthèse entraînant une diminution de la production de fruits ou le dépérissement des arbres touchés. La principale maladie affectant les pommiers est la tavelure du pommier (Venturia inaequalis Cook) (Agnello et al., 2006). Cette maladie, causée par un champignon, est observable par la présence de taches circulaires brun-noir sur le feuillage. La tavelure peut aussi s’étendre sur les pommes et provoquer le même type de taches retrouvées sur les feuilles ayant un aspect duveteux mais qui, en vieillissant, évolueront en crevasses à la surface du fruit. La deuxième maladie en importance est le feu bactérien (Erwinia amylovora Burrill), aussi appelée brûlure bactérienne, qui affecte d’abord les fleurs, puis se propage dans les autres parties de l’arbre via la sève (Agnello et al., 2006) ou par des portes d’entrées secondaires comme les microblessures. La bactérie se développe lors de temps chaud et les premiers symptômes s’observent lorsque les fleurs et les branches atteintes brunissent et se recourbent en crosse. On peut aussi y observer la présence d’un liquide orangé qui suinte des zones particulièrement infectées. Lorsque la maladie n’est pas traitée assez rapidement, elle peut s’attaquer à l’arbre entier et causer la mort de celui-ci. Les spores sont propagées d’un arbre à l’autre pendant la floraison par les pollinisateurs ou lors de violents orages. Dans les conditions propices et lorsque qu’il n’est pas contrôlé à temps, le feu bactérien peut détruire un verger entier. Plusieurs autres maladies peuvent affecter les vergers en fonction de la sensibilité des cultivars (Agnello et al., 2006). Une infestation non contrôlée d’insectes suceurs comme le puceron peut aussi causer la formation de fumagine, complexe de champignons qui forme un dépôt noirâtre sur le feuillage des arbres et qui survient suite à l’accumulation de miellat. Certains champignons ou bactéries peuvent aussi apparaître après la récolte durant l’entreposage des fruits. On peut alors remarquer sur la surface de ceux-ci la présence de pourritures et de moisissures (AAC, 2015).
12
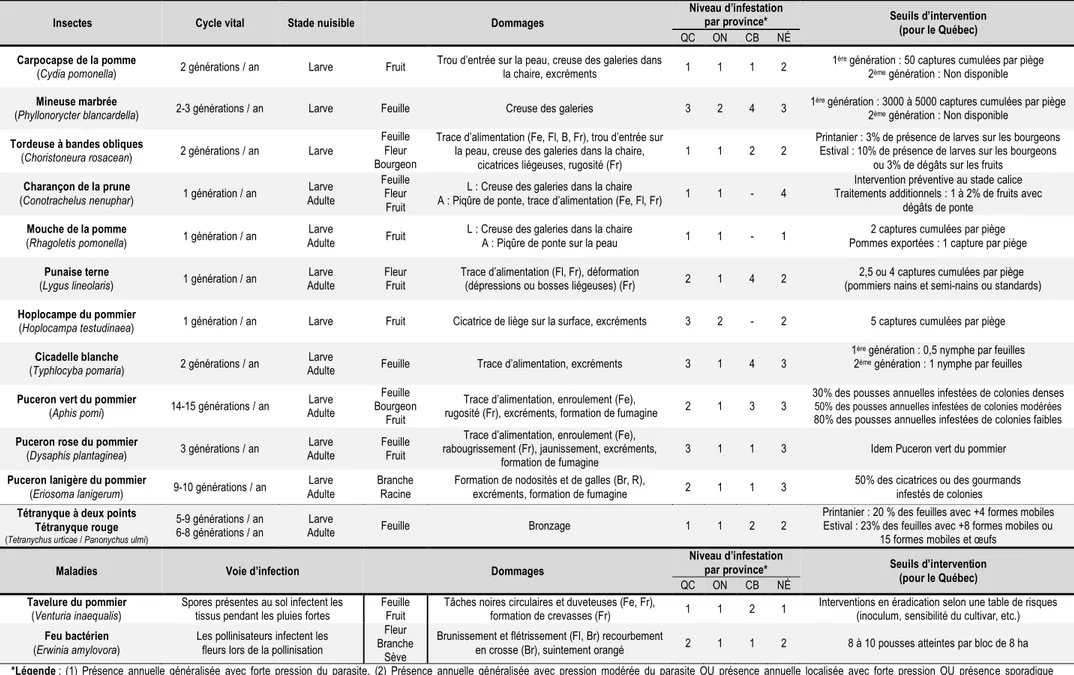
Tableau 3 : Synthèse d’information sur les insectes, acariens et maladies primaires des pommiers ciblés par les
traitements chimiques des vergers du nord-est de l’Amérique du Nord1,2,3.
Insectes Cycle vital Stade nuisible Dommages
Niveau d’infestation
par province* Seuils d’intervention
(pour le Québec)
QC ON CB NÉ
Carpocapse de la pomme
(Cydia pomonella) 2 générations / an Larve Fruit Trou d’entrée sur la peau, creuse des galeries dans la chaire, excréments 1 1 1 2 1
ère génération : 50 captures cumulées par piège
2ème génération : Non disponible
Mineuse marbrée
(Phyllonorycter blancardella) 2-3 générations / an Larve Feuille Creuse des galeries 3 2 4 3 1
ère génération : 3000 à 5000 captures cumulées par piège
2ème génération : Non disponible
Tordeuse à bandes obliques
(Choristoneura rosacean) 2 générations / an Larve
Feuille Fleur Bourgeon
Fruit
Trace d’alimentation (Fe, Fl, B, Fr), trou d’entrée sur la peau, creuse des galeries dans la chaire,
cicatrices liégeuses, rugosité (Fr) 1 1 2 2
Printanier : 3% de présence de larves sur les bourgeons Estival : 10% de présence de larves sur les bourgeons
ou 3% de dégâts sur les fruits
Charançon de la prune
(Conotrachelus nenuphar) 1 génération / an Adulte Larve
Feuille Fleur
Fruit
L : Creuse des galeries dans la chaire
A : Piqûre de ponte, trace d’alimentation (Fe, Fl, Fr) 1 1 - 4
Intervention préventive au stade calice Traitements additionnels : 1 à 2% de fruits avec
dégâts de ponte
Mouche de la pomme
(Rhagoletis pomonella) 1 génération / an Adulte Larve Fruit L : Creuse des galeries dans la chaire A : Piqûre de ponte sur la peau 1 1 - 1 Pommes exportées : 1 capture par piège 2 captures cumulées par piège
Punaise terne
(Lygus lineolaris) 1 génération / an Adulte Larve Fleur Fruit Trace d’alimentation (Fl, Fr), déformation (dépressions ou bosses liégeuses) (Fr) 2 1 4 2 (pommiers nains et semi-nains ou standards) 2,5 ou 4 captures cumulées par piège
Hoplocampe du pommier
(Hoplocampa testudinaea) 1 génération / an Larve Fruit Cicatrice de liège sur la surface, excréments 3 2 - 2 5 captures cumulées par piège
Cicadelle blanche
(Typhlocyba pomaria) 2 générations / an Adulte Larve Feuille Trace d’alimentation, excréments 3 1 4 3
1ère génération : 0,5 nymphe par feuilles
2ème génération : 1 nymphe par feuilles
Puceron vert du pommier
(Aphis pomi) 14-15 générations / an Adulte Larve
Feuille Bourgeon
Fruit
Trace d’alimentation, enroulement (Fe),
rugosité (Fr), excréments, formation de fumagine 2 1 3 3
30% des pousses annuelles infestées de colonies denses 50% des pousses annuelles infestées de colonies modérées 80% des pousses annuelles infestées de colonies faibles
Puceron rose du pommier
(Dysaphis plantaginea) 3 générations / an Adulte Larve Feuille Fruit
Trace d’alimentation, enroulement (Fe), rabougrissement (Fr), jaunissement, excréments,
formation de fumagine 3 1 1 3 Idem Puceron vert du pommier
Puceron lanigère du pommier
(Eriosoma lanigerum) 9-10 générations / an Adulte Larve Branche Racine Formation de nodosités et de galles (Br, R), excréments, formation de fumagine 2 1 1 3 50% des cicatrices ou des gourmands infestés de colonies
Tétranyque à deux points Tétranyque rouge
(Tetranychus urticae / Panonychus ulmi)
5-9 générations / an
6-8 générations / an Adulte Larve Feuille Bronzage 1 1 2 2
Printanier : 20 % des feuilles avec +4 formes mobiles Estival : 23% des feuilles avec +8 formes mobiles ou
15 formes mobiles et œufs
Maladies Voie d’infection Dommages
Niveau d’infestation
par province* Seuils d’intervention
(pour le Québec)
QC ON CB NÉ
Tavelure du pommier
(Venturia inaequalis) Spores présentes au sol infectent les tissus pendant les pluies fortes Feuille Fruit Tâches noires circulaires et duveteuses (Fe, Fr), formation de crevasses (Fr) 1 1 2 1 Interventions en éradication selon une table de risques (inoculum, sensibilité du cultivar, etc.)
Feu bactérien
(Erwinia amylovora) Les pollinisateurs infectent les fleurs lors de la pollinisation
Fleur Branche
Sève
Brunissement et flétrissement (Fl, Br) recourbement
en crosse (Br), suintement orangé 2 1 1 2 8 à 10 pousses atteintes par bloc de 8 ha
*Légende : (1) Présence annuelle généralisée avec forte pression du parasite, (2) Présence annuelle généralisée avec pression modérée du parasite OU présence annuelle localisée avec forte pression OU présence sporadique
généralisée avec forte pression, (3) Présence annuelle généralisée avec faible pression du parasite OU présence sporadique généralisée avec pression modérée OU présence sporadique localisée avec forte pression, (4) Présence annuelle localisée avec pression faible à modérée du parasite OU présence sporadique généralisée faible OU présence sporadique localisée avec pression faible à modérée OU le parasite n’est pas préoccupant, (5) Parasite présent et préoccupant mais aucune donnée sur sa distribution, sa fréquence et son importance n’est disponible, (ND) Non disponible, (-) Parasite non présent dans la province.
1.1.7.
Production fruitière intégrée
Les méthodes de lutte chimique sont de moins en moins acceptables en raison de l’apparition de résistances, de leurs effets négatifs bien documentés sur la santé humaine et l’environnement et de la demande toujours croissante venant des consommateurs en produits biologiques. Malgré tout, l’application de pesticides dans la culture est nécéssaire afin d’éviter d’énormes pertes dues aux insectes et aux maladies. Les fruits qui sont destinés au marché frais doivent répondre aux normes de qualité qui sont souvent très sévères quant à l’aspect esthétique. La pression pour la production de fruits de haute qualité reste encore très forte sur les producteurs, ce qui les oblige à fournir des pommes quasi «parfaites». Les producteurs doivent donc être informés et sensibilisés sur les risques et les impacts reliés à l’utilisation des pesticides. C’est d’ailleurs ce que vise la production fruitière intégrée (PFI) : réduire les risques reliés à l’utilisation des pesticides tout en conservant la rentabilité à long terme des entreprises pomicoles (Chouinard, 2016). Les programmes de PFI, récemment développés au Québec et en Europe, visent ainsi à répondre à la demande sociétale d’une production de pommes qui est compatible avec une optique écologiquement responsable.
La production fruitière intégrée est une méthode de production qui inclut une variété de techniques de lutte aux ravageurs (biologiques, physiques et culturales), qui favorise l’utilisation de cultivars résistants, l’emploi de pesticides à moindre impact uniquement lorsque nécessaire et la gestion de la résistance via la rotation des produits utilisés (Chouinard, 2016). Ainsi, les producteurs peuvent choisir les techniques qui conviennent le mieux en fonction de leur efficacité, des coûts et de leurs préférences personnelles.
Avec sa vision plus large que la lutte intégrée, la PFI englobe aussi tous les aspects de la production, pas seulement la lutte antiparasitaire (Chouinard, 2016). Elle favorise l’adoption de bonnes pratiques agricoles et la production de fruits de qualité dans le respect de l’environnement, de la santé et de la sécurité des producteurs et des citoyens (Chouinard, 2016). À plus long terme, la PFI permet le développement et la durabilité des entreprises, de minimiser le risque que les ravageurs s’adaptent aux changements drastiques de leur environnement causés par la culture intensive et de favoriser la transition graduelle d’une régie conventionnelle vers une régie biologique.
Au Québec, la culture biologique en pomiculture en est à ses débuts. En effet, en 2013, seulement 37 producteurs de pommes, soit 6% des exploitations, possédaient une acréditation biologique (Gendreaud-Martineau, 2014). La taille des entreprises biologiques (1,5 ha) était également bien inférieure à la moyenne des entreprises toutes catégories (8,4 ha). Pour éviter de lourdes pertes, les producteurs en régie biologique doivent suivre régulièrement l’évolution des populations d’insectes et les risques de propagation des maladies. Afin d’assurer leur rentabilité, ces entreprises doivent transformer la portion de leur production qui est attaquée par les ravageurs et donc moins attrayante pour les marchés frais. Bien que les producteurs en régie biologique aient moins d’outils phytosanitaires pour lutter contre les ravageurs que les producteurs en régie
14
alternatives, les filets d’exclusion est une nouvelle technique qui se développe rapidement et fait ses preuves un peu partout dans le monde.
1.2.
Les filets d’exclusion en pomiculture
Considérant les conséquences néfastes de l’utilisation intensive des insecticides en production de pommes, il s’avère important de chercher à effectuer certains changements dans les techniques de production. Les caractéristiques et l’efficacité des systèmes d’exclusion adaptés aux productions fruitières ont été étudiées pour plusieurs ravageurs clés de la pomme et ce type de système représenterait l’un des meilleurs moyens disponibles pour protéger les vergers sans recourir aux insecticides (Chouinard et al., 2016). Les filets impliquent des coûts d’investissement élevés, mais grâce à leur popularité grandissante en Europe et leur émergence en Amérique du Nord, cette technique tend à devenir de plus en plus rentable (Tasin et al. 2008). Le développement des filets d’exclusion pourrait donc permettre de répondre à la demande d’une production de pommes respectueuse de l’environnement tout en réduisant les pertes causées par les ravageurs actuels et futurs à un niveau acceptable.
1.2.1.
Historique et efficacité de la technique
Les filets d’exclusion, dont le mode d’action principal est d’offrir une barrière physique infranchissable autour de la culture pour éviter l’entrée d’espèces nuisibles, sont utilisés en agriculture depuis le milieu du 20e siècle (Scarascia-Mugnozza et al., 2012). Ce n’est toutefois que récemment que les outils d’exclusion ont été perfectionnés dans le but bien précis de diminuer les pertes économiques notamment dans les cultures sous régie biologique (Granatstein et al., 2016). Les filets sont largement employés comme protection contre des animaux vertébrés (oiseaux et chauves-souris frugivores) ainsi que, plus rarement, contre les insectes ravageurs ou autres vecteurs de virus (Scarascia-Mugnozza et al., 2012). Ils sont également utilisés pour diminuer les effets des conditions météorologiques adverses (grêle, pluie, neige, vent, insolation) et même pour modifier le microclimat autour des cultures (Castellano et al., 2008; Scarascia-Mugnozza et al., 2012; Chouinard et al., 2016).
En France, les filets d’exclusion ont notamment fait leurs preuves contre le carpocapse de la pomme (C. pomonella) dans les vergers pomicoles. Développés en 2005, les filets de type Alt’Carpo ont été créés dans le but de réduire l’application des insecticides contre ce ravageur (Sévérac & Romet, 2008). Ils ont un mode d’action double qui offre 1) un effet physique empêchant les femelles de pondre sur le végétal et 2) un effet comportemental sur l’environnement des arbres perturbant l’accouplement des adultes à l’intérieur. Testés en 2007 dans 15 vergers commerciaux en régie biologique et PFI (30 ha), les filets mono-rang ont permis de maintenir les dégâts moyens de carpocapse à 0,06%, et ce, sans avoir recours à des traitements insecticides ou de confusion sexuelle (Severac, 2010). Une autre étude, comparant des rangs couverts et non-couverts, a démontré la faisabilité d’une réduction significative du nombre de traitements insecticides contre le carpocapse sans poser de risques majeurs pour la production (Alaphilippe et al., 2016). De plus, lorsqu’installé
juste avant l’émergence des adultes de la première génération, les filets Alt’Carpo ont permis de grandement réduire les dommages (Sévérac & Romet, 2008). Toutefois, cela n’exclut pas la possibilité du carpocapse à arborer des comportements différents suite à des changements dans son environnement immédiat (Siegwart et al., 2013). Bien que ce type de filet ait été conçu pour exclure une seule espèce, celui-ci semble aussi efficace contre d’autres espèces nuisibles. Il n’aurait également pas d’effets perturbateurs significatifs sur certains auxiliaires (Sévérac, 2010) mais peut fortement favoriser le développement des colonies de pucerons roses (D. plantaginea) et lanigères (E. lanigerum) de même que les populations de la tordeuse orientale du pêcher (Grapholita molesta Busck) et celles de la tordeuse Capua (Adoxophyes orana Fischer von Röslerstamm) (Alaphilippe et al., 2016). Suite au grand succès de cette méthode d’exclusion, c’était plus de 2000 ha de production qui étaient couverts de filets Alt’Carpo en 2012 en France après seulement cinq ans d’innovation.
Une autre étude, cette fois effectuée en Suisse, a également démontré que les filets d’exclusion de type BiocontrolNet 1.3 étaient une excellente méthode de lutte alternative aux pesticides pour protéger les cerisiers contre la mouche de la cerise (Rhagoletis cerasi L.) (Höhn et al., 2012). L’étude, qui visait à comparer quatre méthodes de couverture en variant le moment et la durée de l’installation des filets, a démontré que leur efficacité était quasi-totale lorsque installés avant le début du rougissement des cerises et lorsque qu’ils étaient retirés deux jours avant la récolte.
Au Québec, des filets d’exclusion ont été testés comme contrôle physique contre la drosophile à ailes tachetées (Drosophila suzukii Matsumura) dans une bleuetière (Cormier et al., 2015). Les résultats ont démontrés qu’aucune drosophile n’a été capturée dans lespièges à appâts sous filet et qu’aucune émergence d’adulte n’a été observée dans des bleuets prélevés des bleuetiers sous ces filets et mis sous incubation. Les filets d’exclusion, installés, cette fois dans un verger expérimental, ont également fourni une excellente protection contre tous les ravegeurs clefs, dont le carpocapse de la pomme (Chouinard et al., 2017). Toutefois, un ravageur secondaire lépidoptère, la tordeuse à bandes obliques (C. rosaceana) a vu sa population augmenter sous filets. Certains dommages de punaises pentatomides ont également été observés. Des outils complémentaires (ex. agents répulsifs) sont présentement à l’étude pour tenter d’éloigner ou de dissuader les femelles des deux espèces de pondre sur les filets (Chouinard et al., 2017).
1.2.2.
Caractéristiques des filets anti-insectes
Selon la définition proposée par Castellano (2008), les filets agricoles sont des produits constitués de fils de plastique reliés entre eux par d’autres, tissés ou tricotés, formant une structure géométrique poreuse permettant le passage des fluides. Les deux matériaux les plus utilisés en agriculture sont les filets fabriqués de polyéthylène haute densité (PE-HD) et ceux fabriqués de polypropylène (PP) (Castellano et al., 2008). Cependant, les filets PE-HD offrent une plus grande durabilité et résistent mieux aux diverses conditions environnementales avec une durée de vie moyenne se situant entre six (Sauphanor et al., 2012) et 10 ans
16
(Rigden, 2008). De plus, le polyéthylène est un matériau recyclable et non toxique, ce qui lui permet d’être utilisé en contact direct avec la plante (Castellano et al., 2008).
La grosseur des mailles du filet doit être choisie en fonction de la problématique ciblée. Dans le cas des filet anti-insectes, on préfèrera des mailles plus serrées, qui offriront une barrière étanche. Par exemple, les filets Alt’Carpo, spécifiques à une espèce, ont une taille de mailles de 2,2 x 5,4 mm (Sévérac & Romet, 2008) alors que d’autres filets multi-espèces offriront une taille de mailles variable se situant entre 0,2 et 3,1 mm (Castellano et al., 2008). De plus, un projet italien a également démontré que l’efficacité des filets était maximale lorsque ceux-ci étaient attachés hermétiquement au niveau du tronc alors que les dommages était réduit entre 88 et 91% (Grassi & Profaizer, 2010). Ces résultats viennent également supporter la méthode d'exclusion proposée par Chouinard et al. (2016 & 2017).
La couleur des filets peut varier, mais le noir (ou gris foncé) et blanc (ou transparent) sont les plus utilisées. Les filets noirs, surtout employés comme protection anti-grêle ou contre les oiseaux, permettent également de réduire l’incidence des dégâts fruitiers de cause abiotique comme le frottement causé par le vent, les coups de soleil et la roussissure (Widmer, 2001; Middleton & McWaters, 2002) mais, ils sont souvent associés à une moindre qualité des fruits, surtout au niveau de la coloration (Solomakhin & Blanke, 2007). Les filets blancs, eux, sont généralement utilisés pour éviter une baisse des performances de la plante (rendements, photosynthèse, etc.) en raison de l’ombrage du filet (Castellano et al., 2008), le niveau de lumière (rayonnement photosynthétique actif) n’étant réduit que de seulement 8 à 12% comparativement aux filets noirs (18 à 25%) (Widmer, 2001). Cette couleur est donc préférablement choisie pour les filets anti-insectes dans les régions tempérées, afin de ne pas nuire à la productivité de la culture couverte, surtout si les filets sont déployés pendant toute la saison de production.
1.2.3.
Types d’exclusion
Au cours des dernières années, deux systèmes d’exclusion ont été étudiés dans les cultures d’arbres fruitiers, soit l’exclusion complète et l’exclusion incomplète, et ce, en Europe (Romet & Sévérac, 2008) et au Québec (Chouinard et al., 2016). Les exclusions complètes sont utilisées en mono-rang lorsque le filet englobe chacun des rangs de pommiers individuellement en venant se refermer au bas des troncs. Ainsi, le sol est exclu du système ce qui permet d’arrêter le développement de certains insectes ravageurs qui complètent leur cycle de vie dans le sol ou à la base du tronc (Chouinard et al., 2016). Les filets mono-rang réduisant les espaces de circulation pour les travailleurs, il devient plus difficile dans ce système d’effectuer certaines opérations comme l’éclaircissage, taille des gourmands et les pulvérisations. Les exclusions incomplètes, utilisées surtout en mono-parcelle, recouvrent normalement un bloc de plusieurs rangs de pommiers et dans ce système le filet vient s’accrocher au sol. Puisque le filet couvre une plus grande surface, il est ainsi facile pour les travailleurs ainsi que la machinerie agricole de circuler entre les rangs de pommiers. Cependant, si des ravageurs sont déjà présents sous les filets, leur effet d’exclusion se trouve fortement réduit
puisqu’ils peuvent compléter leur cycle vital sans problème et atteindre un niveau de population similaire à celui à l’extérieur de l’exclos (Sévérac & Siegwart, 2013). Pour les deux types d’exclusion, les pommiers nains et semi-nains sont parfaitement adaptés à la protection par les filets.
1.2.4.
Effets des filets sur l’environnement et la qualité des fruits
Les filets sont susceptibles d’influencer le microclimat et l’intensité de cette influence dépend principalement des facteurs climatiques du site et des caractéristiques physiques des filets, soit leur couleur ou bien encore la taille de leurs. Depuis une dizaine d’années, plusieurs chercheurs étudient les conditions retrouvées sous les filets anti-grêle et anti-insecte et leurs effets sur les arbres fruitiers. De manière générale, les filets offrent un obstacle aux radiations solaires, réduisant ainsi la pénétration de la lumière. L’humidité, quant à elle, peut être légèrement moindre sous filets (Chouinard, non publié) ou bien augmenter car elle reste emprisonnée après de fortes pluies (Middleton & McWaters 1996 & 2002; Rüegg, 1997). De plus, l’évaporation étant réduite les pommiers sous filets seraient moins sujets aux stress hydriques et aux températures chaudes et sèches (Rigden, 2008). Les températures sous filets sont généralement similaires aux températures extérieures, soit à 1 ou 3°C près dépendamment des climats et des types de filets (Middleton & McWaters 1996 & 2002; Chouinard et al. 2016). Toutefois, les températures peuvent grandement varier en fonction de leurs couleurs; plus froide sous un filet noir et au contraire plus chaudes sous un filet blanc (Middleton & McWaters 1996 & 2002; Rigden, 2008).
Les filets peuvent également affecter la mise à fruit, la croissance, la grosseur et la couleur des fruits. Les effets demeurent assez variables, toujours selon le type de filet utilisé, mais également en fonction du cultivar et de la vigueur du pommier. De façon générale, on constate chez les pommiers nains et semi-nains installés sous filets que la grosseur des fruits est similaire ou plus élevée à l’intérieur que ceux à l’extérieur (Chouinard, non publié). Toutefois, les effets de l’ombrage sont plus importants sous les filets foncés; la croissance accrue des pousses végétatives, des feuilles plus larges et la réduction de la nouaison sont des réponses classiques à l'ombrage (Rigden, 2008). La maturation des fruits sous filets peut également être retardées de quelques jours mais n’affecterais pas la coloration des fruits de façon significative (Chouinard et al. 2016). Ouvrir les filets quelques jours avant la récolte permettrait de rattraper le retard (G. Chouinard, IRDA, Comm. pers.).
Cependant, la qualité des fruits repose avant tout sur le travail des pollinisateurs et le bon fonctionnement de la pollinisation croisée sous les filets d’exclusion.
1.3. La pollinisation en pomiculture
La pollinisation est couramment définie comme étant le transfert mécanique de grains de pollen des anthères jusqu’à l’extrémité du pistil, le stigmate (Abrol, 2012; Ramírez & Davenport, 2013). Une fois sur cette