FACULTE DE MEDECINE
THESE PRESENTE
A L'ECOLE DES GRADUES DE L‘UNIVERSITE LAVAL
POUR L'OBTENTION
DU GRADE DE MAITRE ES SCIENCES (M.Sc.) PAR
EUGENE ROUSSEL
BACHELIER ES SCIENCES PURES DE L'UNIVERSITE LAVAL
L' IMMUNOSUPPRESSION A MEDIATION CELLULAIRE CHEZ LES CANCEREUX: ETUDE FONCTIONNELLE ET QUANTITATIVE DES SOUS-POPULATIONS LEUCOCYTAIRES IMMUNOREGULATRICES EN RELATION AVEC LA DENUTRITION CHEZ DES PORTEURS D'UNE NEOPLASIE DIGESTIVE.
"Chacun ajoute un peu à notre
connaissance de la nature et de tous les faits assemblés s 'élève la grandeur"
J'aimerais exprimer en premier lieu toute ma gratitude à mes chers parents qui ont su m1 intéresser tout jeune à 1'étude et qui m'ont approuvé et soutenu dans la réalisation de ces études avancées.
Les mots sont bien pauvres pour décrire ma reconnaissance la plus sincère à celle dont la qualité des échanges et la finesse des conseils furent d'un réconfort et d'un appui indispensable pour foncer sans couler sur cette mer d'incertitude qu'est la recherche, ma chère Marie-Claude.
Je voudrais enfin remercier de façon toute spéciale le docteur Robert Letarte, mon directeur de thèse, pour la qualité et l'efficacité de sa direction, sa souplesse à 1 'intérieur des lourdeurs de structure du système, son honnêteté et la confiance exceptionnelle qu'il m'a accordée
dans 1 'aventure que fut la réalisation de ma maîtrise. Son ouverture face à mes intérêts et ma conviction fut essentielle à la réalisation de ce projet et elle m'a permis un cheminement original, très formateur, que j'ai grandement apprécié.
L'immunosuppression est fréquente chez les cancéreux et serait possi blement reliée à la dénutrition. Nous avons investigué s'il existait des
relations entre la quantification des sous-populations leucocytaires du sang périphérique Tl 1+ (T-matures), T4+ (T-inducteurs), T8+ (T-suppres- seurs), B1+ (lymphocytes B) et Mo2+ (monocytes), la réponse à la PHA et la dénutrition chez 16 cancéreux porteurs d'une néoplasie digestive. Nous
avons trouvé des altérations significatives en nombre absolu/ml pour les cellules T11 + , T4+, B1+ et Mo2+ qui étaient plus importantes chez les
cancéreux dénutris que chez les non-dénutris. La réponse à la PHA (SI) était aussi diminuée significativement chez les dénutris. L'analyse par régression linéaire des pourcentages des sous-populations avec SI a montré que seulement les cellules T4+ offraient une corrélation avec SI. Les résultats de cette étude suggèrent que le nombre absolu/ml des cellules T4+ est un indicateur sensible de la dénutrition chez les patients porteurs
d'une néoplasie digestive.
Il est bien connu que les cancéreux sont souvent immunosupprimés. Cette immunodéficience serait attribuable à deux raisons : 11 immunogénicité
de la tumeur qui activerait démesurément les mécanismes immunosuppresseurs et la dénutrition qui accompagne souvent l'état cancéreux et dont 1'influence sur 11 immunocompétence a été bien montrée. Mais dans quelle
mesure chacune de ces causes affecte t-elle 1'immunocompétence du cancé reux? C'est dans cette optique que nous avons quantifié, à l'aide des récents marqueurs spécifiques Tll (T-matures), T4 (T-inducteurs), T8 (T-suppresseurs), B1 (lymphocytes B) et Mo2 (monocytes), les sous-popula tions leucocytaires immunorégulatrices du sang périphérique; que nous avons mesuré la réponse à la PHA, tout en évaluant la dénutrition protéique chez des porteurs d'une néoplasie digestive. Notre but était de vérifier s'il existe des relations entre ces sous-populations leucocytaires et la dénutrition chez ce type de patient. Nous avons étudié 16 cancéreux porteurs d'une néoplasie digestive. L'évaluation de leur dénutrition a mis
deux groupes en évidence, l'un apparemment normal (10 patients) et l'autre dénutri (6 patients). La quantification des sous-populations nous a révélé
T4+, B1+ et Mo2+. Le groupe dénutri est apparu plus affecté que le groupe normal, avec une diminution de 50% des cellules T11+, T4+ et B1+ par comparaison au groupe contrôle. L'index de stimulation (SI) de la réponse à la PHA était aussi significativement dimunué chez les dénutris. L'analy se par régression linéaire des pourcentages des sous-populations avec SI a montré que seulement les cellules T4+ offraient une corrélation avec SI
(r: 0.6169 p <0.01).
En conclusion, les résultats de cette étude suggèrent que le nombre
absolu/ml de cellules T4+ est un indicateur sensible de la dénutrition chez
Avant-propos. . . III Résumés. . . IV Table des matières. . . VII
Liste des tableaux et figures. . . X
CHAPITRE I - Introduction. . . 1.
1.1 Présentation. . . 1. 1.2 Constatation du phénomène de 11 immuno
suppression chez les cancéreux. . . 2. 1.3 Causes possibles de 1'immunosuppression
du cancéreux. . . 3. 1.4 L'immunogénicité des tumeurs. . . 4. 1.5 Altération dans 11 immunité cellulaire
des cancéreux et mécanismes suppresseurs
de 11 immunité anti-tumorale. . . 6. 1.5.1 Macrophages et lymphocytes T suppresseurs. . . 6.
1.5.3 Cellules K et NK. . . 12.
1.5.4 Facteurs sériques. . . 13.
1.5.4.1 Facteurs bloquants et complexes immuns. . . 13.
1.5.4.2 Facteurs circulants libérés par les cellules tumorales. . . 14.
1.6 Conclusion et objet de la thèse. . . 15.
CHAPITRE II Quantification des sous-populations leucocytaires immunorégulatrices et de la réponse à la PHA en relation avec la dénutrition chez des cancéreux porteurs d'une néoplasie digestive. . . 18.
2.1 Résumé. . . 19. 2.2 Introduction. . . 20. 2.3 Sujets et méthodes. . . .22. 2.4 Résultats. . . 27. 2.5 Discussion. . . 34. 2.6 Références 39.
CHAPITRE III Discussion générale. . . 42.
Bibliographie. . . 45.
Tableau 1. Données générales et profil de dénutrition
pour chacun des patients cancéreux. . . 28.
Tableau 2. Profil de dénutrition des groupes. . . 29.
Figure 1. Proportion des sous-populations leucocytaires estimée par anticorps monoclonaux et
flux-cytométrie. . . 30.
Figure 2. Nombre absolu/ml des sous-populations
leucocytaires calculé par: (pourcentage de cellules positives) X (décompte total des
mononucléaires). . . 31.
Figure 3. Index de stimulation de la réponse
à la PHA. . . 33.
Figure 4. Fréquence de distribution des stages de
INTRODUCTION
1.1 PRESENTATION
Cet ouvrage a pour sujet général I'immunosuppression à médiation cellulaire chez les cancéreux. Il comporte deux principales parties: le
premier chapitre qui développe le sujet général et le second chapitre qui constitue l'étude fonctionnelle et quantitative des sous-populations leucocytaires immunorégulatrices en relation avec la dénutrition chez des porteurs d'une néoplasie digestive. Un troisième chapitre conclut le tout
par une discussion.
Le premier chapitre que voici a pour thème: les phénomènes d'immuno suppression de l'immunité à médiation cellulaire chez les cancéreux
non-lymphomateux. L'objectif de ce chapitre est de faire un tour d'horizon des principaux phénomènes d'immunosuppression de 1 ' immunité cellulaire
rattachés à l'état cancéreux tout en restant à l'écart des lymphomes. L'immunologie des lymphomes constitue un cas particulier qui ne nous intéresse pas ici puisque le lymphome est un cancer du tissu immun alors que notre intérêt est centré sur l'effet du développement de néo plasies non-immunitaires sur la fonction de l'organe immunitaire. L'idée
ici n'est pas d'étayer toutes les controverses ayant existé au cours de 1'évolution des différents thèmes abordés, mais plutôt d'essayer de cerner et d'intégrer les différents phénomènes d'immunosuppression de 1'immunité cellulaire de l'état cancéreux afin d'établir une vue globale et à jour
du sujet. Ce premier chapitre introduit finalement le second en éta blissant les cadres du contexte du deuxième chapitre qui est la thèse
proprement dite.
1.2 CONSTATATION DU PHENOMENE DE L'IMMUNOSUPPRESSION CHEZ LES
CANCEREUX
Il est observé depuis longtemps que les cancéreux meurent souvent d'une infection quelconque (surtout post-opératoire) plutôt que de leur
cancer lui-même (1). Cette sensibilité marquée du cancéreux aux infections est due à un état immunodéficient que l'on identifie en clinique par une anergie totale ou partielle aux tests cutanés d'hypersensibilité retardée (2,3). L'équipe de Meakins et Pietsch a démontré qu'un état anergique total ou partiel élevait fortement les risques mortels. Dans une étude totalisant 472 patients et échelonnée sur 2 ans au Royal Victoria Hospital
des malades cancéreux ou non, présentant un état d'anergie totale ou partielle, et que 11 incidence de mortalité chez ces patients post-opérés, infectés et demeurés en état d'hypoergie ou d'anergie, était de 100% (4,5).
1.3 CAUSES POSSIBLES DE L'IMMUNOSUPPRESSION DU CANCEREUX
Chez les cancéreux, on observe fréquemment un état de dénutrition qui se traduit par un amaigrissement considérable causé principalement par un auto-catabolisme des protéines, conduisant à une perte de la masse protéique corporelle (6). Ce phénomène se retrouve concomitant à 1‘anorexie (7) ou à la suite de chimio ou radiothérapie (8,9) ou dans les cas de néoplasies digestives (10), là où la fonctionnaiité de 1 'appareil digestif est fortement perturbée. Il est démontré cliniquement et expéri
mentalement que la malnutrition amène 1 'immunodéficience (11-14). L'idée que 1'immunosuppression du cancéreux soit causée par la malnutrition a porté à explorer l'effet de la nutrition contrôlée sur 1'immunocompétence. Les travaux des équipes de Copeland (15), Daly (16) et S mal e (17) ont montré que la nutrition contrôlée par hyperalimentation intra-veineuse diminue les risques d'infection et augmente les chances de survie.
Cependant, si près de la moitié des dénutris cancéreux voit leur immuno
compétence restorée par 1'hyperalimentation, les autres restent immuno- supprimés. Ces faits suggèrent que la malnutrition n'est pas l'unique facteur responsable de 1'incompétence immunitaire chez ces patients mais
que la masse tumorale pourrait agir en activant les mécanismes d'immuno
Les travaux réalisés jusqu'à maintenant suggèrent qu'il y aurait deux
causes principales pouvant engendrer 1'immunosuppression lors de cancer: la dénutrition et 1 'immunogénicité de la tumeur. Les deux causes n'appa
raissent pas en opposition mais sont plutôt nées d'approches différentes. La dénutrition n ' ayant offert qu'une partie des réponses, étant donné le
succès obtenu avec 1 'hyperalimentation, la question de 1'immunogénicité des tumeurs et de ses effets sur l'organe immun n'en revêt que plus d'importan
ce, surtout que l'on ne connaît pas encore la pondération respective de chacun des deux facteurs dans les altérations immunes encourues.
1.4 L'IMMUNOGENICITE DES TUMEURS
C'est en 1970 que Burnet publiait sa théorie sur le concept de l'immunosurveillance anti-cancéreuse (18). Deux écoles de pensée allaient
alors se dresser, les tenants du pour et ceux du contre, ces derniers utilisant comme principal argument que les tumeurs spontanées, au contraire
des tumeurs induites en laboratoire, se révélaient incapables d'induire une réponse immunitaire (19). Beaucoup de travaux sur la question de l'immuno
surveil lance et de 1'immunogénicité des tumeurs ont été publiés depuis. Si avant les années 80 on n 'avait pas encore réussi à mettre en lumière des
antigènes propres aux cellules cancéreuses, les antigènes trouvés étant plutôt du type onco-fétal (20), le début de la huitième décennie a permis,
en évidence des antigènes spécifiques aux cellules cancéreuses apparaissant exclusivement sur certains types de tumeurs (21, 22), démontrant hors de tout doute le potentiel immunogénique propre des tumeurs. Ceci n'entraîne pas qu'une tumeur sera indubitablement immunogénique. Dans une récente étude révisant les derniers travaux sur le potentiel immunitaire tumoral,
David Naor (23) propose les 3 types d'immunogénicité possible des cellules tumorales soit: la non-immunogénicité, explicable par le fait que les déterminants antigéniques sont topographiquement inaccessibles au système immun; la suppressogénicité, la tumeur possédant des entités antigéniques stimulant 1'apparition de cellules suppressives inhibant le potentiel immunologique des cellules anti-tumorales; et finalement l'immunogénicité,
la tumeur exprimant des entités immunogéniques contre lesquelles réagissent les cellules immunes anti-tumorales. A l'appui de son hypothèse, il présente des évidences sur la présence d'épitopes immunogéniques et suppressogéniques sur différents types de macromolécules et comment l'étude des entités immunogéniques présentes sur 3 types différents de cellules malignes (la tumeur YAC, la tumeur MCA et l'AD 12) a révélé
la coexistance d'épitopes immunogéniques et suppressogéniques sur la même tumeur. Mais en définitive, si ces études proposent des mécanismes
possibles s'appuyant sur des vérifications in vitro dans l'expression de l'immunosuppression tumorale, les phénomènes d'immunosuppression découlant de 1'altercation entre la tumeur et le système immunitaire in vivo appa
1.5 ALTERATIONS DANS L'IMMUNITE CELLULAIRE DU CANCEREUX ET MECANISMES SUPPRESSEURS DE L'IMMUNITE ANTI-TUMORALE
1.5.1. Macrophages et lymphocytes T suppresseurs
L'incidence d'altération de 1 ' immunité cellulaire chez les cancéreux est très élevée (24). Elle est associée à une diminution de la
résistance de l'hôte (2,3,25) et correspond souvent à un pronostic pauvre quant à 1 'évolution de la néoplasie (56,58,59). Les altérations retrouvées dans 1'immunité cellulaire lors du développement tumoral sont multiples.
11 est bien connu maintenant que la lymphocytopénie est associée à l'état cancéreux (26). De plus, des études sur la fonctionalité des lymphocytes ont permis de mettre en lumière la réponse anormalement diminuée de la population leucocytaire chez les cancéreux (27,28) suite aux stimuli mitogéniques. Cette première phase connue, les recherches se sont concen trées d'une part, à élucider l'immunité anti-tumorale spécifique et d'autre
part, à chercher les mécanismes responsables de 1'immunosuppression. Dans une étude sur 28 patients porteurs d'ostéosarcome, Yu et coll. (29) en 1977
ont montré que les mononucléaires du sang périphérique de douze malades présentaient une activité cytotoxique tumoro-spécifique. Chez les autres le manque de cytotoxicité apparaissait relié à 1 'absence de cellules cytoxiques ou à la présence de lymphocytes suppresseurs inhibant 1'activité
cytotoxique. L'année suivante, Berlinger (30) dans une étude avec des cancéreux de la tête et du cou, Jerrells (31) avec des cancéreux du sein et
suppressives dans les néoplasies arrivèrent à la conclusion que 2 types de cellules sont responsables de 1'immunosuppression: des cellules adhérentes répondant à la description des macrophages et des cellules non-adhérentes
correspondant aux lymphocytes T. Des études subséquentes de Wood et col 1. (33), et de Goodwin et col 1. (34), montrèrent sans équivoque chez les
cancéreux que le pourcentage d'immunosuppression lors de la stimulation des leucocytes à la PHA, augmentait proportionnellement avec le nombre de
monocytes présent. Au même moment, Rice et col 1. (35) publiaient les résultats d'une étude des phénomènes modulant la lymphoprolifération des
lymphocytes T du sang chez des sujets normaux. Trois systèmes suppresseurs étaient caractérisés: le système inducteur de suppression, effectif par une sous-population de lymphocytes T, le système suppresseur des cellules adhérentes ou monocytes et le système suppresseur relié aux prostaglandi
nes, effectif par des monocytes mais différent du précédent par la non- sensibilité à une diminution des cellules adhérentes alors qu'il est inhibé
par 1'indométhacine (inhibiteur de synthèse des prostaglandines). De plus, l'activation de chacun de ces systèmes ne requiert pas de réplication cellulaire, ce qui implique qu'ils peuvent être activés sans qu'on décèle une augmentation ou une réplication des cellules impliquées.
D'autres travaux sur l'implication des monocytes dans 1 'immuno suppression des cancéreux révèlent une corrélation entre la diminution de
la réponse induite par la PHA, 1'augmentation du nombre de monocytes et la diminution du nombre de lymphocytes T circulants (36). De quelle façon 1'augmentation des monocytes chez les cancéreux compromet-elle
1 'immunocompétence ? L'action pourrait se faire à différents niveaux. Schulof (37), dans une étude chez des porteurs de mélanomes, montre que les monocytes sont responsables de la suppression complète de l'activité
cytotoxique des lymphocytes contre la tumeur autologue dans certains cas. D'autre part, Unger (38) en étudiant le fonctionnement des monocytes de
cancéreux remarque que le nombre de ces cellules augmente ou diminue selon le type de cancer et que leur fonctionnalité est aussi changée telle la
capacité de se différentier en macrophages. Dans ce domaine, les travaux de Pike et Snyderman (39) ont mis en lumière les effets anti-inflammatoires
des néoplasmes, les tumeurs sécrétant des facteurs ayant la propriété d'inhiber la réponse chimiotactique et l'activité cytolytique des macro
phages, le tout disparaissant avec la résection tumorale. Finalement, Nakayama (40) dans une étude incluant plusieurs types de cancer, a démontré
que chez les cancéreux avec métastases, la présence d 'interleukine-2 dans le surnageant de culture des mononucléaires stimulés à la PHA était
fortement diminuée comparativement à des témoins normaux alors que les cultures des mêmes cancéreux sans cellules adhérentes répondaient normale ment. Ses travaux suggèrent que les monocytes pourraient nuire à la production d'interleukine-2; une lymphokine produite par les lymphocytes T
et démontrée essentielle dans l'activation et la fonction de plusieurs
types de lymphocytes.
Plusieurs études mentionnées plus haut reconnaissent aussi des cellules suppressives de nature non-adhérente apparentées aux lymphocytes
cellules suppressives décrites dans les situations non-tumorales (41). L'induction de lymphocytes T suppresseurs spécifiques apparaît provoquée par les antigènes tumoraux (42,43,44). La présence de lymphocytes T
suppresseurs spécifiques a été mise en évidence dans plusieurs modèles de tumeurs (41,45,46). Avec l'apparition de techniques plus précises pour l'identification des sous-populations de lymphocytes T, définissant les T-porteurs de récepteurs pour la partie Fc des IgG comme fonctionnellement
suppresseurs et ceux porteurs de récepteurs pour la partie Fc des IgM comme T-inducteurs (47), des études chez les cancéreux à tumeurs solides révèlent
une diminution de près de 30% en proportion et 50% en nombre absolu chez
les Tfl alors que les Tq apparaissent augmentés de 50% en proportion par rapport à des témoins normaux et que leur nombre absolu ne l'est que légèrement (48,49). Peu de temps après, avec l'apparition d'anticorps monoclonaux spécifiques aux T-inducteurs et T-suppresseurs, les Tg se sont révélés hétérogènes; comprenant des T-suppresseurs, des NK ou natural killer, des K ou cellules killer à cytotoxicité anticorps-dépen dante et même des monocytes (50). La disponibilité de ces anticorps monoclonaux marqueurs spécifiques des T-inducteurs (T4) et T-suppresseurs (T8) sur le marché, a permis d'investiguer l'hypothèse de la régulation de
1 'immunocompétence par le rapport T4/T8 dans une foule de maladies où l'on savait exister des désordres immunologiques. Chez les cancéreux non- lymphomateux, très peu d'études ont été réalisées jusqu'à maintenant. McCluskey (51), dans une étude chez des cancéreuses du sein, ne remarque
pas de différence dans la distribution des sous-populations de lymphocytes T dans les 3 premiers stages de la maladie, alors que les patientes en
stage IV affichent une baisse de 30% dans leur proportion de cellules T4+ et une diminution d'environ 50% en nombre absolu. Les T-suppresseurs sont augmentés uniquement chez les stages IV aussi, en proportion de près du double et en nombre absolu d'environ 40%. Un même type d'étude effectuée
chez des patients porteurs de tumeurs solides par l'équipe de Harris et Braun (52) révèle aucune différence comparativement à des témoins normaux dans le pourcentage de cellules 0KT3+ (T-matures), T4+ et T8+, alors que le
nombre absolu pour chacune de ces mêmes cellules baisse de façon signifi cative, principalement de l'ordre de 50% pour les cellules T4+ et 20% pour les cellules T8+ dans les cas avancés, les cas encore peu développés étant quasi normaux. Finalement, une étude de Bernengo (53) chez des porteurs de
mélanomes révèlent des résultats semblables aux précédents, soit une baisse significative en pourcentage et en nombre absolu des cellules T4+ et T8+
chez les patients ayant des métastases seulement. Elle remarque de plus que chez les patients qui ont développé des métastases ou sont décédés, la
réduction des T-totaux est due à une diminution des cellules T4+. Ces récentes études, contrairement aux précédentes avec Tg et Tm, font ressor tir beaucoup plus une diminution draconnienne dans le nombre absolu de cellules T-inducteurs plutôt que quelque changement au niveau des
T-suppresseurs.
1.5.2 Indice pronostic
L'indice pronostic de ces altérations dans les proportions des cellules immunorégulatrices entre elles est encore à découvrir. Cependant,
des études sur le pronostic du décompte lymphocytaire et des lymphocytes T ont déjà été réalisées. Papatestas et col 1. en 1974 (54) publiaient qu'un haut décompte lymphocytaire avant 1‘opération dans le cas de cancer du sein, était associé à une survie de plus de 5 ans sans métastases. En 1978, Meyer (55) publiait, toujours en rapport avec le cancer du sein, qu'un décompte lymphocytaire inférieur à 2000 cellules/mm3 qui remontait
après résection tumorale, diminuait les chances de récurrence comparative ment à des patients conservant un décompte élevé avant et après 1'opéra
tion. De plus, ses travaux montraient qu'une chimio ou radiothérapie effectuée sur des patientes à décompte lymphocytaire inférieur à 2000 cellules/mm3 augmentait les chances de récurrence, alors que c'était
1 'inverse chez des patientes ayant plus de 2000 lymphocytes/mm3. En 1983,
Own by (56) publiait des résultats arrivant aux mêmes conclusions que Papatestas. La même année Bernengo (57), dans une étude échelonnée sur
cinq ans chez des porteurs de mélanomes où elle effectuait le décompte des lymphocytes T et nuis, montrait que les patients décédés accusaient une réduction des lymphocytes T et des nuis par rapport à ceux restés en vie, de même que les patients ayant développés des métastases par rapport à ceux sans métastases. Elle montrait de plus que les lymphocytes nul s décroissent linéairement chez les patients morts alors qu'ils augmentent
linérairement chez les survivants. Elle en conclua en disant que la survie semble toujours fonction des tests immunologiques, peu importe le site du mélanome.
1.5.3 Cellules K et NK
Les cellules NK (natural killer) et K (killer) sont ainsi nommées pour leur pouvoir cytotoxique à lyser des cellules cibles sans pré-sensi
bilisation. On pense que les cellules K et NK seraient responsables de la surveillance immune initiale contre les tumeurs et virus (58,59) jusqu'à ce qu'un groupe de cellules sensibilisées émergent en assez grand nombre pour prendre la relève. Les cellules K et MK étaient caractérisées auparavant par le fait qu'elles expriment un récepteur pour la partie Fc des IgG et qu'elles étaient des lymphocytes granulés trouvés dans la fraction des lymphocytes nuis des mononucléaires du sang (60,61). On les identifie beaucoup plus simplement maintenant par l'anticorps monoclonal HNK-1 mis au
point par Abo et coll. en 1981 (62).
L'étude des NK chez les cancéreux révèle principalement une baisse en nombre (63). Une étude exhaustive effectuée par Bal ch et coll. en 1983
(64), avec le marqueur HNK-1, sur 247 patients ayant différents types de néoplasies, a montré une diminution significative du pourcentage de cellules HNK-1 positives du sang périphérique chez les cancéreux. Le type de cancer influençait cependant dans l'ampleur de 1'altération. Toutefois, il est encore impossible de dire si la baisse de ces cellules précède l'évolution du cancer ou si elle en découle.
1.5.4.Facteurs sériques
Pour faire suite aux phénomènes d'altération de 1'immunité cellulaire
et d'immunosuppression chez les cancéreux, nous présentons maintenant un résumé des changements remarqués dans le sérum des cancéreux et ses implications avec 11 immunité cellulaire.
Les facteurs sériques immunosuppresseurs se classent en deux caté gories: les facteurs bloquants et complexes immuns et les facteurs circu lants libérés par les cellules tumorales.
1.5.4.1. Facteurs bloquants et complexes immuns
Hellstrom et col 1. (65) ont montré que le sérum d'animaux porteurs de
tumeurs en développement, abroge spécifiquement, in vitro, les réactions de cytotoxicité des lymphocytes envers les cellules tumorales. Les facteurs bloquants responsables ont été mis en évidence et décrits comme pouvant être des anticorps protégeant les cellules tumorales contre l'agresssion par les lymphocytes en masquant les antigènes de surface, des antigènes tumoraux solubles circulants ou dans la majorité des cas, des complexes antigènes-anticorps. Ils peuvent agir soit directement sur les cellules effectrices en les inhibant ou sur les cellules tumorales cibles
en les protégeant (66,67). Ils peuvent également stimuler les cellules suppressives (68). Les évidences in vivo résident principalement dans le fait que plusieurs auteurs ont injecté des éluats de cellules tumorales
renfermant des complexes antigènes-anticorps ou des préparations d'antigè
nes tumoraux et ont observé alors une facilitation de la croissance tumorale (68,69,70).
1.5.4.2. Facteurs circulants libérés par. les cellules tumorales
L'activité anti-inflammatoire des tumeurs a été démontrée dans des
situations de greffes tumorales allogéniques et syngéniques avec divers types de tumeurs et chez différentes espèces animales. North et col 1 - (71)
ont montré que la greffe tumorale entraîne un affaiblissement de la résistance à une infection par Listeria monocytogenes dans laquelle les macrophages jouent un rôle essentiel. Les effets anti-inflammatoires des
tumeurs ont pu être reproduits par 11 injection de facteurs isolés de surnageant de culture de cellules tumorales, d'extraits tumoraux ou de plasma et d'urine d'animaux porteurs de tumeurs (72,73,74). Ces différents
facteurs se sont montrés capable in vitro d 'inhiber diverses propriétés et fonctions des macrophages: adhérence, étalement, migration, réponse chimio
tactique et acquisition d'une activité cytolytique. Ces effets inhibiteurs peuvent être responsables in vivo d'une diminution de 1'activité anti tumorale non-spécifique des macrophages au site de la tumeur.
Des taux élevés de prostaglandine E (PGE) ont été retrouvés dans le sérum de patients et d'animaux porteurs de divers types de tumeurs. Les
taux de PG dans les tumeurs, ainsi que la production de PG par les cellules tumorales in vitro, sont très augmentés par rapport à ce qui est observé
avec le tissu homologue (75,76). Les prostaglandines, plus particulière
ment la PGE, sont des régulateurs de la réponse immune (77). En effet ijn vitro, un grand nombre de fonctions immunitaires (production d'anticorps, réponse proliférative des lymphocytes à une stimulation par des mitogènes ou des cellules allogéniques, différentiation des lymphocytes T cytolyti
ques, production de lymphokines par les lymphocytes T, cytotoxicité cellulaire dépendante des anticorps, activité cytolytique des cellules NK, activité tumoricide des macrophages) sont inhibées par l'addition de PGE exogènes. Cette libération de PG par les cellules tumorales pourrait être très impliquée dans 1'immunosuppression observée chez les patients porteurs de tumeurs. Les travaux de Plescia et col 1. (78) de même que ceux de Pel us et Strausser (79) sont particulièrement intéressants à cet égard. Il
faut mentionner cependant qu' in vivo, les inhibiteurs de la synthèse des PG ne se sont pas révélés aussi efficaces qu'on aurait pu le croire, ils provoquent un ralentissement de la croissance tumorale mais l'effet n'est pas régulier (80,81,82).
En résumé, les tumeurs peuvent subvertir les mécanismes de défense de l'hôte par 11 intermédiaire des PG qu'elles libèrent en grande quantité, ou
dont elles stimulent la production par d'autres types cellulaires comme les
macrophages (83).
1.6 CONCLUSION ET OBJET DE LA THESE
sous-populations immunorégulatri ces chez les cancéreux et 1'immunosuppres sion en cause, est que les systèmes suppresseurs existants chez les normaux sont activés exagérément chez les cancéreux par 1'immunogénicité de la tumeur (induction des T-suppresseurs, augmentation de production de PG par les macrophages) et que d'autre part, les facteurs libérés par les cellules tumorales perturbent directement l'organe immunitaire (inhibition des macrophages, des lymphocytes cytolytiques et des cellules NK).
Sur un autre plan, les modifications métaboliques qu'entraîne le
développement d'une tumeur provoquent des carences en nutrition auxquelles est sensible l'organe immunitaire. Dans quelle mesure 1'immunodéficience du cancéreux est-elle pondérée par chacune de ces deux causes possibles que sont la malnutrition et 1'activation de mécanismes suppresseurs en réaction aux cellules tumorales? La réponse reste à définir. Les études rencon trées jusqu'à date font surtout état de réussites plus ou moins complètes rattachées à l'effet de 1'hyperalimentation sur 1 ' immunocompétence de
cancéreux dénutris. Le problème est que 1'on peut perdre un argent et un temps précieux à hyperalimenter un cancéreux immunodéficient si l'on ne peut pondérer l'effet de la malnutrition sur son immunodéficience, comme il peut être très dangereux voire même mortel de négliger le problème et d'opérer dans des conditions d'immunodéficience, alors que cette dernière aurait pu être atténuée par une hyperalimentation pré-opératoire. Etant donné que les caractéristiques de 1'immunité affectée du patient dénutri ont été bien étudiées et que l'on a, d'autre part, élucidé une bonne partie des mécanismes immunitaires altérés par la présence d'une tumeur, il est
possible que la caractérisation, à l'aide de récentes techniques plus
puissantes, de 11 immunité du cancéreux dénutri par rapport au cancéreux non-dénutri, puisse offrir des éléments de réponse à cette question de pondération respective. La complexe immunité à médiation cellulaire peut en effet renfermer des éléments qui sont affectés principalement par la
malnutrition et d'autres qui le sont par la présence antigénique des cellules tumorales. Cette hypothèse est le fondement de l'étude sur les
sous-populations immunorégulatrices en relation avec la dénutrition, que nous avons effectué chez des cancéreux de 1‘appareil digestif, et qui est
QUANTIFICATION DES SOUS-POPULATIONS LEUCOCYTAIRES IMMUNOREGULATRICES ET DE LA REPONSE A LA PHA EN
RELATION AVEC LA DENUTRITION CHEZ DES CANCEREUX PORTEURS D'UNE NEOPLASIE DIGESTIVE
Ce chapitre est le texte intégral d'un manuscrit intitulé "Immunoregu- latory leucocyte subset typing and PHA response in relation to the nutri
tional state in cancer patients with gastrointestinal neoplasia", avec comme auteur Eugène Roussel. Ce papier fut soumis à Diagnostic Immunolo
gy sur invitation de 1'éditeur, suite à une présentation de ces résultats
au congrès de l'AAI en juin 1984. Il est actuellement publié dans Diagnos
Cancer patients are frequently immunodepressed and this could be related to undernutrition particularly in gastrointestinal (GI) neoplasia. We therefore, looked for correlations between different leucocyte subsets (Tll+, T4+, T8+, Bl+ and Mo2+) cells in the peripheral blood of these patients and their nutritional state. Significant alterations were found in
absolute number/ml of T11+, T4+, B1+ and Mo2+ cells. Malnourished cancer patients were more affected than those appearing well-nourished, exhibiting a decrease of 50% in the number of T11+, T4+ and B1+ cells as compared with healthy controls. The phytohemagglutinin A (PHA) stimulation index (SI) was also significantly decreased in the mal nourished group. Linear regression analysis between SI and these leucocyte subsets revealed that only the
T4+ cells offered a significant correlation (r: 0.6169 p <0.01). These results suggest that the absolute number/ml of T4+ cells reflects the nutritional state of patients bearing GI tumors.
Key words : Leucocyte subset typing PHA response
Nutritional state Cancer patients
Cell-mediated immunity has been reported to be impaired by protein- calorie malnutrition (1). The frequency of peripheral blood rosette-forming T-lymphocytes is reduced (2), delayed cutaneous hypersensitivity (DCH) is
impaired (3,4) and the lymphocyte proliferative response to PHA is depressed (5,6). Cancer patients are frequently immunodepressed and this may be related to their undernutrition (7,8), particularly in patients with GI neoplasia. This possibility is supported principally by the observations that more than 50% of anergic and hypoergic cancer patients are restored to normal DCH responsiveness after nutritional repletion with intravenous
hyperalimentation (9,10). Since DCH tests are only qualitative, a better response on second challenge may be the result of a higher sensitivity to the antigen rather than any effect of therapy (11,12). We therefore looked for a new quantitative and reproducible immunological test that would better reflect the nutritional state of cancer patients.
T-lymphocyte subsets, B-lymphocytes and monocytes are the most
important cells implicated in the activation and regulation of the immune response (13-17). The ability to characterize these populations with the
monoclonal antibodies Til (T-lymphocytes), T 4 (T-helpers), T 8 (T-suppressors), 81 (B-lymphocytes) and Mo2 (monocytes) gives us a highly
cells in the peripheral blood. Although some studies have been made on leucocyte subsets in the cancer patient (18-20) and in the malnourished patient (21,22) we have found no reports on these defined leucocyte subsets
in the malnourished tumor-bearing patient. Therefore, in this study, we
have investigated how the PHA response and the proportion and absolute number of these cells were changed in patients with GI neoplasia and whether there was any relation between these changes and the nutritional state of
Subjects
The patient population included 16 patients with GI neoplasia (3 oesophagus, 3 stomach, 5 pancreas, 1 biliary vesicule, 3 colon and 1 rectum carcinomas). Their mean age was 65 ± 11 years. These patients appeared infection free and were included in this study before receiving any treat ment. They were selected according to the protocol of the ethics committee of the Hotel-Dieu de Quebec hospital. The control population included 12 healthy volunteers having a mean age of 72 ± 6 years.
Nutritional assessment
Nutritional state was initially assessed with a physical examination and then determined by an evaluation of protein malnutrition. Visceral protein mass was estimated by 3 currently utilized techniques (23). These were serum albumin, transferrin, and total lymphocyte count. Since none of these tests is recognized as being more accurate than another and because there is also no existing nutritional index formula (23), we classified a patient as well-nourished when 2 out of 3 tests were in the normal range and malnourished when 2 out of 3 tests were below the normal range. Nutri tional tests were performed by the medical laboratories at the
Hotel-Dieu de Quebec hospital.
Albumin: Serum albumin concentration was evaluated by the bromocresol green method with an autoanalyser Astra 8 (Beckman).
Transferrin : Serum transferrin concentration was evaluated by turbidi metric method using a laser nephelometer (Hylan) and monospecific antisera
(Behring).
Total Lymphocyte Count (TLC): The total white blood cell (TWBC) count was obtained on a Coulter Counter C+ and differential leucocyte count was calculated by examining 200 cells on a May-Grunwald-Giemsa-stained blood film. TLC was calculated by (TWBC) x (percentage of lymphocytes counted).
Immunological tests
Isolation and character i zat i on of peripheral blood mononuclear cells (PBMC) : Whole blood heparinized at 15 Ill/ml (heparin, Gibco) was obtained from patients or healthy volunteers by venipuncture. It was diluted with an equal volume of saline solution and heparinized at 100 IU/ml then layered on Ficol1-Paque (Pharmacia) and centrifuged at 900g for 20 minutes at room temperature. The mononuclear cell layer was removed and washed twice in Hank's balanced solution (HBSS, Gibco) heparinized at 10 IU/ml. Cells from
the first washing were centrifuged at 65Og for 15 minutes and the second at 400g for 10 minutes. The pellet was then resuspended in RPMI 1640 (Gibco) supplemented with 10% (v/v) fetal calf serum (PCS), 1% (v/v) glutamine 200mM
and 21 (v/v) penicillin 5000 IU/ml, streptomycin 5000 mcg/ml. All supple
counted and characterized into percentage of lymhocytes and percentage of
monocytes and granulocytes with a Coulter Counter and Channelyser. Concen tration was adjusted to 106 lymphocytes/ml for subsequent manipulations.
Analysis with monoclonal antibodies and flow cytometry: PBMC were prepared
for immunof 1 uorescent analysis according to the Coulter procedure for indirect immunofluorescence cell surface staining with Coulter Clone antibodies. We used Til, T4, T8, B1 and Mo2 monoclonal antibodies and
GAM-FITC, a fluorescein labelled goat antibody against mouse F(ab')2 immunoglobulin. Lyophilized Coulter monoclonal antibodies were rehydrated with distilled water and centrifuged at 100,000g at 4°C for 10 minutes.
Then, each antibody was diluted to the specified concentration with calcium
and magnesium-free phosphate buffered saline (PBS) containing 0.01% NaNg and 2% FCS, to a volume of 0.2 ml and incubated with 106 lymphocytes/ml of PBMC at 4°C for 30 minutes. The reaction mixture was washed twice with
PBS-NaNg-FCS by centrifugation at 400g for 4 minutes. A second incubation with similarly prepared GAM-FITC utilized the same conditions and was washed
3 times as described above. Finally, the pellet of cells was resuspended in 1 ml of PBS-NaN] and analyzed immediately by the flow-cytometric immuno fluorescence method.
We used an Electronics Programmable Individual Cell Sorter (Coulter EPICS V system). The instrument distinguished individual lymphocytes and
monocytes by their particular light-scattering (LS) properties and concomi tantly recorded the green fluorescence intensity (G FI) signal enited by each cell (24). A logarithmic histogram of LS by GFI/105 cells was obtained for
each marker and analyzed with MDADS program 2.1 (Coulter immunology) to obtain the percentage of the cells that had reacted with the specific marker. The absolute number/ml of leucocyte subsets for each blood donor was calculated as follows (mononuclear cells count/ml of blood) x (percen tage of the cells that had reacted with the subpopulation specific marker). Response to PHA: The early response of PBMC to PHA was determined by
measuring the rate of protein synthesis (25). Cell suspension (0.2 ml) prepared as previously described, was incubated for 18 hours with 1 pg/ml of PHA (Burroughs Welcome) and 1 pCi/ml of 3H-leucine (New-England Nuclear) in
12 x 75mm glass tubes with Morton caps, at 37°C, 5% CO2 and 95% humidity. The incubation was stopped by adding 2 ml of cold (4°C) PBS containing NaNg
0.1%. The tubes were centrifuged at 400g for 10 minutes and the supernatant removed by suction. Following a second wash, the cells were frozen and kept
for 2 or 3 weeks. At the appropriate time, they were thawed and 0.1 ml of PBS-NaN] containing 2.5 mg/ml of bovine serum albumin (Sigma) as carrier
protein was added, followed by 2 ml of 6% (w/v) trichloroacetic acid (TCA) containing 65mg/l leucine for protein precipitation. Tubes were incubated at 4°C for 30 minutes and the cells were collected by centrifugation at 1250g for 10 minutes. The pellet was dissolved by adding 0.1 ml of 1 N NaOH and incubated at 56°C for 5 minutes with occasional mixing. Precipitation
of protein with TCA was repeated as above and the pellet was dissolved at this time with 1.0 ml of NCS solubilizer (Amersham) at 56°C with mixing.
One ml of scintillation fluid (toluene based fluid (Baker Chemical Co.) con taining 0.5% PP0 and 0.05% P0P0P, (two Amersham products) was added, mixed vigourously and transfered to a scintillation vial. Tubes were rinsed
with an additional ml of scintillation fluid. Final volume of the vial was completed to 10 ml with the same fluid. Protein-associated radioactivity
was measured with a liquid scintillation counter (LKB). Protein synthesis was expressed as the mean of disintegrations per minute for triplicate tubes minus a nonincubated control. Stimulation index (SI) refers to the ratio of the value for cells with PHA (triplicates mean) over the value for cells without PHA.
Statistical analysis
Differences between groups were analysed by the Mann and Whitney "U"
test. Correlation coefficients were calculated with Spearman's rank order method on all groups taken together.
The nutritional state of 16 patients with GI neoplasia was assessed with serum albumin, transferrin and peripheral blood lymphocyte count (table 1). On the basis of the criteria mentioned in the methods, we classified 10 patients as well-nourished (the CW group) and 6 patients as malnourished (the CM group). On the average, the CM group showed a decrease of more than 20 per cent for each of their nutritional tests. This decrease was signifi cant for albumin measurements and of borderline significance for transferrin measurements when compared with the CW group (table II).
Analysis of PBMC according to leucocyte subset markers showed no significant difference in the percentage of lymphocyte subsets between the
control group and the CW or CM groups (figure 1). The percentage of monocytes, however was significantly increased in the CM and CW groups when compared with the control group.
In contrast, figure 2 shows that the absolute number/ml of some
leucocyte subsets was reduced. For the CM group, significant decreases were found in the number of T11+ (p<0.01), T4+ (p<0.01 ) and B1+ cells (p<0.02) when compared with the control group. The CW group had a significant decrease only in the number of T4+ cells (p<0.04). There was no significant
Table I. Nutritional state of patients with gastrointestinal neoplasia
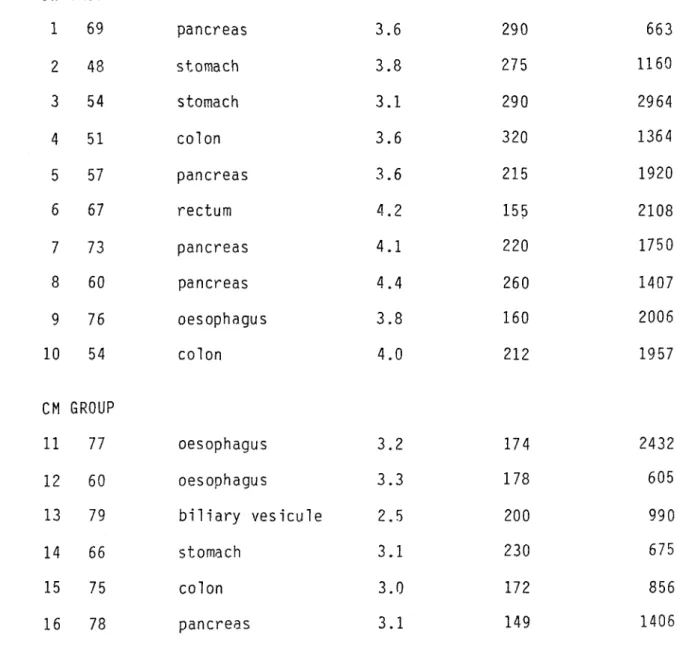
Mo Age Cancer Type Albumin Tranferrin Lymphocytes (g/100ml) (mg/100ml) (mm3) CW GROUP 1 69 pancreas 3.6 290 663 2 48 stomach 3.8 275 1160 3 54 stomach 3.1 290 2964 4 51 colon 3.6 320 1364 5 57 pancreas 3.6 215 1920 6 67 rectum 4.2 155 2108 7 73 pancreas 4.1 220 1750 8 60 pancreas 4.4 260 1407 9 76 oesophagus 3.8 160 2006 10 54 colon 4.0 212 1957 CM GROUP 11 77 oesophagus 3.2 174 2432 12 60 oesophagus 3.3 178 605 13 79 biliary vesicule 2.5 200 990 14 66 stomach 3.1 230 675 15 75 colon 3.0 172 856 16 78 pancreas 3.1 149 1406
Table II. Nutritional profile for each group
Normal (1) CW group CM group
3.8 ± 0.1(2) 3.0 ± 0.1 240 ± 18 184 ± 11
1730 ± 198 1161 ± 280
1. In conformity with the report of Grant et al (23) and data laboratories of the Hotel-Dieu de Quebec hospital.
2. Mean ± SEM
3. Value of p for significant difference between CW and CM groups. Albumin (g/100 ml) 3.5-5.0 Transferrin (mg/100 ml) 200-400 Lymphocytes (mm3) 2000 p<0.01(3) p<0.07 p<0.11 of medical
Histograms are mean of the group ± SEM. ( | |= Controls ; V CM) .
A b s o l u t e n u m b e r / m l x 1 0 0 o f p o s i t i v e c e l l s 11. 40 - 1.20 - 0.60 0.40 - - 0.40
0.20
-Figure 2: (percent HistogramsAbsolute number/ml of leucocyte subsets of positive cells) X (total mononuclear
are mean of the group ± SEM. (Q[]= Controls
calculated by: cell count).
increase in the number of Mo2+ cells for the CW group (p<0.02) and the CM group (p<0.02). No significant difference was detected between the CW and the CM groups except in terms of the number of B1+ cells (p<0.01).
Functional immunocompétence of the patients and controls was assessed by measuring their in vitro PBMC response to PHA. The response to PHA (expressed as a SI) represents the rate of early protein synthesis in stimulated cells. The CM group showed a significantly lower SI than the
control group (p<0.02), whereas the CW group was unchanged (figure 3). Because the PHA test was always done at the same concentration of lympho cytes, we did linear regression analysis between the percentage of the leucocyte subsets and SI to see if the PHA response could be related to the variation in proportion of some leucocyte subsets. We found significant positive correlations between SI and percentages of T11+ and T4+ cells (r :
0.4696 p <0.02 and r: 0.6169 p <0.01 respectively). No other leucocyte subset showed any significant correlation.
S t i m u l a t i o n i n d e x n 3.0 2.5 -2.0 - - 2.0 1.5 -1.0 -0.5 - - 0.5 Figure 3: the group
Stimulation index of PHA response. ± SEM ([^3= Controls; V =CW; ^ = CM)
This study shows that some leucocyte subsets are significantly altered in patients with GI neoplasia. These alterations were not significant in relative number for lymphocyte subsets but were significant in absolute number/ml, reflecting the accompanying 1eucopenia. These results were in
agreement with a recent study of Harris et al on cancer patients with solid tumors using monoclonal antibody reagents (20). Our study also showed that leucocyte subsets were not equally affected by this general 1eucopenia.
The number of T11+, T4+ and B1+ cells decreased, the number of T8+ cells was unchanged while the number of Mo2+ cells increased. Moreover, the CM group was more affected than the CW group when compared with controls. Linear regression analysis revealed that T11+ and T4+ cells were the only
subsets correlated with the SI of the PHA response. T11+ cells correspond generally to the sum of T4+ and T8+ cells. Thus the correlation found between T11+ cells and SI was due to the T4+ cells because the T8+ cells showed absolutely no correlation with SI (r: 0.0411 p > 0.10). This suggests that the immunodépression detected by the SI was mainly due to a reduction in the number of T4+ cells. There was an association but no significant correlation between the increasing proportion of Mo2+ cells and the decreasing SI (r:-0.3125 p < 0.15). The monocytes were shown to be implicated in the tumor associated immunosuppression (26,27). It was also suggested that their suppression could be mediated by the release of
non-specific immunosuppressive factors such as prostaglandins (17). In our study, considering the fact that no correlation was seen between the
percentage of Mo2+ cells and SI but a good one was obtained with the percentage of T4+ cells, it appeared that the level of immunosuppression due to the monocytes was less important than the reduced proportion of T4+ cells
in the decrease of the PHA response.
Even though it appears that there is no statistically significant difference between the CW and CM groups, the latter group did have an
altered SI and absolute number of T4+ cells. This suggests that malnu trition is associated with these alterations. Moreover, the strong correla
tion between SI and the percentage of T4+ cells suggests that the T4+ cell subsets should be indicative of the malnutrition. In accord with this idea,
the recent work of Chandra (21,22) showed a relation between a numerical decrease of T4+ cells and malnutrition, and the restoration of the number of T4+ cells with the reversion to a wel1-nourished state.
In our study, the lack of a significant difference in SI and absolute
number of T4+ cells between the CW and CM groups might be due to the limitations of the nutritional tests that we used or might truly reflect
the lack of a clear difference between these groups. The CW and CM groups
together had significantly lower absolute number of T4+ cells than the normal group (p<0.01). Therefore, it is possible that the CW and CM groups are actually one significantly malnourished group with different levels of malnutrition within it. This variability may be reflected by the gradual
decrease of the absolute number of T4+ cells. Accordingly, one may think
that the absolute number of T4+ cells may be a good indicator of malnutri tion because T4+ cells were shown to be sensitive to malnutrition and the absolute number of T4+ cells, which is calculated by (total mononuclear
cell count) x (relative number of T4+ cells), includes the effect of lymphocytopenia (TLC) which is already a current technique in nutritional
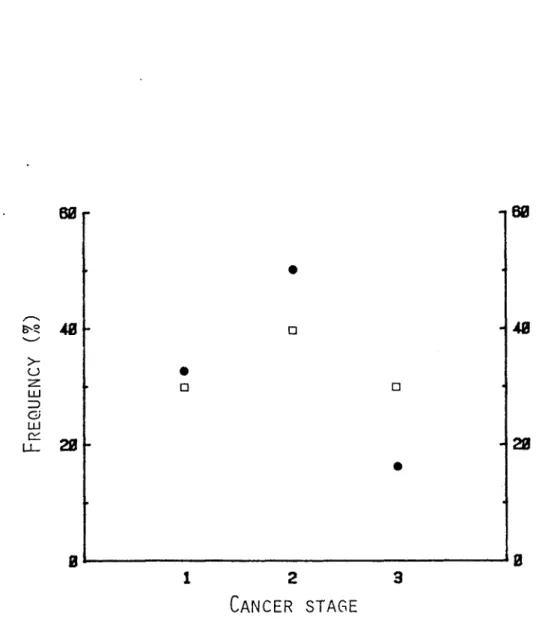
assessment. Finally, the distribution curve of the different cancer stages was the same for each nutritional group (figure 4) which means here that the nutritional state was varying independently of the cancer stage, and the absolute number of T4+ cells was decreased with the malnutrition state. This suggests that the absolute number of T4+ cells was influenced by the
malnutrition instead of the cancer in this study. Moreover, studies of T4+ cells in other types of cancer that have less effect on the nutritional state in the initial stages, showed no influence on T4+ cells (18,19).
In conclusion, based on the present data, we suggest that the absolute number of T4+ cells is an indicator of the nutritional state of patients
60 r B-S > u z LU ZD G LU CZ 40 20 0 □ □ 60 40 - 20 0 12 3 Cancer stage
Figure 4: Frequency distribution of cancer stage in cancer groups. (O =CW; S =CM). Cancer stage were defined as follow: 1. Local invasion, 2. Local and ganglionic invasions, 3. Local and ganglionic invasions with hepatic metastases.
We wish to express our thanks to surgeon Roch Lapointe and surgical services of the Hotel-Dieu de Quebec hospital for close collaboration during all the study. We also thank Dr. Arnold H. Greenberg for his very helpful comments and
Ms. Ricky Kraut for her critical review of the manuscript. Special thanks to Janis Zamick for typing this manuscript.
1. Chandra RK. Immunocompétence. Clin, in Lab. Med. vol. 1 no 4: 631-645 , 1981.
2. Chandra RK. Rosette-forming T lymphocytes and cell-mediated immunity in malnutrition. Br. Med. J. 3: 608-609, 1974.
3. Chandra RK. Immunocompétence in undernutrition. J. Pediatr. 81: 1194-1200, 1972.
4. Neumann GC, Lawlor GJ, Stiehn ER, Swenseid ME, Newton C, Herbert J, Ammann AJ , Jacob J. Immunologic responses in malnourished children. Am. J. Clin. Nutr. 28: 89-104, 1975.
5. Moore DL, Heyworth B, Brown J. PHA-induced lymphocyte transformation in leucocyte transformation in leucocyte cultures from malarious, malnourished and control Gambian children. Clin. Exp. Immunol. 17: 647-656, 1974.
6. Chandra RK. Cell-mediated immunity in nutritional imbalance. Fed. Proc. 39: 3088-3092, 1980.
7. Dionigi P, Dionigi R, Nazari S, Bonoldi AP, Griziotti A, Pavesi F, Tibaldeschi C, Ci vidini F, Gratton I. Nutritional and immunological evaluations in cancer patients. Relationship to surgical infections. J. Par. Ent. Nutr. vol. 4 no 4: 351-356, 1980.
8. Dionigi R, Compani M. Nutritional and immunological abnormalities in malignant disease. Acta. Chir. Scand. (Suppl.) 507: 435-474, 1981.
9. Copeland EM, Macfadyen BV, Dudrick SJ. Effect of intravenous hyperalimen tation on established delayed hypersensitivity in the cancer patient. Ann. Surg. 184: 60-64, 1976.
10. Dudrick SJ, Copeland EM, Daly JM. Cancer and Immunocompétence. Acta. Chir. Scand. (Suppl.) 498: 146-150, 1980.
11. Moore FD. Delayed scientific hypersensitivity. J. Par. Ent. Nutr. vol. 6 no 1: 1-2, 1981.
12. Twomey P, Ziegler D, Rombeau J. Utility of skin testing in nutritional assessment: A critical review. J. Par. Ent. Nutr. vol. 6 no 1: 50-58, 1981.
13. Reinherz EL, Schlossman SF. Regulation of the immune response. Inducer and suppressor T-lymphocyte subsets in human beings. N. Engl. J. med. 303: 370-373, 1980.
14. Chess L, Schlossman SF. Human lymphocyte subpopulations. In: Advances in Immunology vol. 25, ed. Dixon FJ and Kunkel HG. New York: Academic Press, pp 213-241, 1977.
15. Kincade PW. Formation of B-lymphocytes in fetal and adult life. In: Advances in immunology vol. 31, ed. Dixon FJ and Kunkel HG. New York: Academic Press, pp 177-245, 1981.
16. Unanue ER. The regulatory role of macrophages in antigenic stimulation part two: Symbiotic relation between lymphocytes and macrophages. In: Advances in immunology vol. 31, ed. Dixon FJ and Kunkel HG. New York: Academic Press, pp 1-136, 1981.
17. Rice L, Laughter AH, Twomey JJ. Three suppressor systems in human blood that modulate lymphoprolifération. J. Immunol. 122: 991-996, 1979.
18. McCluskey DR, Roy AD, Abram WP and Martin WMC. T-lymphocyte subsets in the peripheral blood of patients with benign and malignant breast disease. Br. J. Cancer 47: 307-309, 1983.
19. Bernengo MG, Lisa F, Puiatti P, Meregalli M, Berruto G and Zina G. T-cell subsets in melanoma patients evaluated by anti-T cell monoclonal antibodies. Thymus 5: 223-233, 1983.
20. Harris JE, Deboer KP, Vahey AL, Braun DP. The measurement of leucocyte subsets in the peripheral blood of cancer patients with solid tumors using monoclonal antibody reagents. Med. Ped. Oncology 10: 185-194, 1982.
21. Chandra RK. Numerical and functional deficiency in T helper cells in protein energy malnutrition. Clin. exp. Immunol. 51: 126-132, 1983.
22. Chandra RK, Joshi P, Au B, Woodford G, Chandra S. Nutrition and immunocom- petance of the elderly: Effect of short-term nutritional supplementation on cell-mediated immunity and lymphocyte subsets. Nutr. Res. 2: 223-232, 1982. 23. Grant JP, Custer PB, Thurlow J. Current techniques of nutritional
assessment. Surg. Clin. North Am. 61: 437-463, 1981.
24. Ip SH, Rittershaus CW, Heafy KW, Struzziero CC, Hoffman RA, Hansen PW. Rapid enumeration of T-lymphocytes by a flow-cytometric immunofluorescence method. Clin. Chem. 28: 1905-1909, 1982.
25. Waithe WI, Hirshhorn K. Lymphocyte response to activators. In: Handbook of experimental immunology, ed. Wein DM. Oxford: Blackwell, ch. 26, 1978.
26. Wood GW, Neff JE, Stephens R. Relationship between monocytosis and T-lymphocyte function in human cancer. J. Natl. Cancer Inst. 63: 587-592, 1979.
27. Zembala M, Mytar B, Popiel a T and Asherson L. Depressed in vitro peripheral blood lymphocyte response to mitogens in cancer patients: The role of suppressor cells. Int. J. Cancer 19: 605-613, 1977.
DISCUSSION GENERALE
Les récentes études sur 11 immunité cellulaire des cancéreux réalisées
avec les nouveaux marqueurs de surface font ressortir une baisse marquée du nombre absolu des cellules T4+ (T-inducteurs ), en plus d'altérations
principalement au niveau des cellules T8+ (T-suppresseurs) et des mono cytes. Si les altérations des T-suppresseurs et des monocytes ont été
plutôt associées à la pathologie cancéreuse, il ne semble pas y avoir
encore d'étude proposant une cause spécifique pour 1 'altération des cellules T4+ chez les cancéreux.
Notre étude de 1'immunité cellulaire chez les cancéreux, dans laquelle
l'objectif était 1 'analyse des altérations des sous-populations leucocy taires en fonction de la dénutrition, suggère une corrélation étroite entre la dénutrition et la baisse des cellules T4+ chez les porteurs de néoplasie digestive. Ce résultat de notre étude et le fait que la baisse suivie du retour à la normale des cellules T4+ aient été montrés étroitement associés
à la mal nutrition suivie de sa cure chez des patients dénutris en protéi nes, suggèrent que la pondération de la dénutrition dans 1'immunodéficience des cancéreux porteurs d'une tumeur solide pourrait possiblement s'évaluer en terme de quantification du nombre absolu des cellules T4+.
Il est évident que le sujet est loin d'être clos. La valeur de notre étude est principalement qu'elle suggère des perspectives intéressantes
pour une étude d'envergure sur les cellules T4+ comme indicateur de dénutrition chez les cancéreux porteurs d'une tumeur solide.
L'importance d'investiguer du côté des cellules T4+ est plutôt récente mais non sans argument. Il est en effet possible que nous tenions un
nouveau test indicateur pour la malnutrition qui permettrait de plus, de suivre l'effet d'une thérapie de nutrition pour rétablir une partie importante des fonctions du système immunitaire soit 1 'activité des T-inducteurs. Et l'on sait maintenant que les T-inducteurs sont les
principaux producteurs de 1 'inter!eukine-2 (84), facteur déterminant dans 1'amplification de la réponse immune et aussi agent effecteur pour les
T-cytolytiques (85) et les NK (86). L'importance des cellules T4+ dans la défense anti-tumorale est aussi confirmée de plus en plus avec 1'immuno thérapie par infusion de lymphocytes clonés pré-sensibilisés à 1'antigène
tumoral. En effet, de récents travaux effectués sur la souris par Mills et col 1. (87), Mazumber et col 1. (88) et chez le rat par Fernendez-Cruz et coll. (89) permettent d'obtenir des régressions tumorales complètes par infusions intra-veineuses de lymphocytes T autologues clonés avec
11 interieukine-2 et l'antigène cancéreux. Et le phénotype des cellules infusées obtenues après clonage s'est révélé être celui de T-inducteurs activés pré-sensibilisés.
On est en mesure de penser actuellement que ces récents progrès en immunothérapie pourront très bientôt s'appliquer à l'homme. Il apparaît maintenant que cette nouvelle voie d1 immunothérapie par immunomodulation représente un espoir sérieux principalement dans la lutte contre les métastases (88).
1. Inagaki J., Rodriguez V., Bodey G. Causes of death in cancer patients. Cancer 33: 568-573, 1974.
2. Di on igi R., Gnes F., Bonera A., Dominioni L., Fossati G.S. Delayed hypersensitivity response (DHR) and infections in surgical cancer patients. British Journal of Surgery 66: 900, 1979.
3. Dionigi R., Campani M. Nutritional and immunological abnormalities in malignant disease. Acta Chirurg. Scand. (Suppl.) 507 : 435-47 4 , 1981.
4. Meakins J., Pietsch J.B., Bubenick 0., Kelly R., Rode H., Gordon J., MacLean L.D. Delayed hypersensitivity: Indicator of acquired failure of host defense in sepsis and trauma. Ann. Surg. 186: 241-250, 1977. 5. Pietsch J., Meakins J.L. Predicting infection in surgical patients.
Surg. Clin, of North Am. 59: 185-197, 1979.
6. Brennan M.F., Burt M.E. Nitrogen metabolism in cancer patients. Cancer Treat. Rep. 65 (Suppl. 5): 67-78, 1981.
7. Costa G., Bewley P., Aragon M., Siebold J. Anorexia and weight loss in cancer patients. Cancer Treat. Rep. 65 (Suppl. 5): 3-7, 1981.
8. Donaldson S.S. Effects of therapy on nutritional status of the pediatric cancer patients. Cancer Research 42 (Suppl.): 729-736, 1982.
9. Dudrick S.J., Copeland E.M., Duly J.M. Cancer and Immunocompétence. Acta Chirg. Scand. (Suppl. 1) 498: 146-150, 1980.
10. Serrou B., Cupissol D. Nutritional Support and the immune system in cancer management. A critical review. Cancer Treat. Rep. 65
11. Chandra R.K. Rosette-forming T-lymphocytes and cell-mediated immunity in malnutrition. Brit. Med. J. 3: 608-609, 1974.
12. Chandra R.K. Interactions of nutrition, infection and immune response. Acta P
ed. Scand. 68: 137-144, 1979.
13. Daly J.M., Dudrick S.J., Copeland E.M. Effects of protein depletion on cell-mediated immunity. Ann. Surg. 188: 791-796, 1978.
14. Law D.K., Dudrick S.J., Abdou N.I. Immunocompétence of patients with protein-calorie malnutrition: The effects of nutritional repletion. Ann. Intern. Med. 79: 545-550, 1973.
15. Copeland E.M., MacFadyen B.V., Dudrick S.J. Effect of intravenous hyperalimentation on established delayed hypersensitivity in the cancer patient. Ann. Surg. 184: 60-64, 1976.
16. Daly J.M., Dudrick S.J., Copeland E.M. Evaluation of nutritional indices as prognostic indicators in the cancer patient. Cancer 43: 925-931, 1979.
17. Smale B.F., Mullen J.L., Buzby G.P., Rosato E.F. The efficacity of nutritional assessment and support in cancer surgery. Cancer
47: 2375-2381, 1981.
18. Burnet F.M. The concept of immunological surveillance. Prog. Exp. Tumor Res. 13: 1, 1970.
19. Hewitt H.B., Blake E.R., Walder A.S. A critique of the evidence for active host defense against cancer, based on personnel studies of 27 murine tumors of sponntaneous origin. Br. J. Cancer 33: 241, 1976.
20. Sega E., Mottolese M., Curcio C.G., Citro G. Specific blastogénie response of peripheral blood lymphocytes from lung cancer patients to a fetal lung antigen. J. Natl. Cancer Inst. 64: 1001-1006, 1980.
21. Cairncross J.G., Mattes M.J., Beresford H.R., Albino A.P., Houghton A.N., Lloyd K.O., Old L.J. Cell surface antigens of human astrocytoma defined by mouse monoclonal antibodies: Identification of astrocytoma subsets. Proc. Natl. Acad. Sci. U.S.A. 79: 5641-5645, 1982.
22. Fradet Y., Cordon-Cardo C., Thomson T., Daly M.E., Whitmore W.F., Lloyd K.D., Melamed M.R., Old. L.J. Cell surface antigens of human bladder cancer defined by mouse monoclonal antibodies. Proc. Natl. Acad. Sci. U.S.A. 81: 224-228, 1984.
23. Naor D. Coexistence of immunologic and suppressogenic epitopes in tumor cells and various types of macromolecules. Cancer Immunology Immunotherapy 16: 1-10, 1983.
24. Lamb D. A comparative study of the incidence of energy in patients with carcinoma, leukemia, Hodgkin's disease and other lymphomas. J. Immunol. 89: 555, 1962.
25. Lawrence H.S. Transfer factor and cellular immune deficiency disease. N. Engl. J. lied. 283: 411 , 1970.
26. Zacharski L.R. Lymphocytopenia. Its causes and significance. Mayo Clin. Proc. 46: 168, 1971.
27. Mekori T., Sher S., Robinson E. Suppression of the mitogenic response to phytohemagglutinin in malignant neoplasia: Correlation with clinical stage and therapy. J. Natl. Cancer Inst. 52: 9-12, 1974.
28. Simo-Camps E., Anguera A., Ma V.J. Immunologic impairment in patients with non lymphoid cancer. Correlation with the tumoral stage, response to treatment and survival. Cancer 37: 724-728, 1976.
29. Yu A., Watts H., Jaffe N., Parkman R. Concomitant presence of tumor-specific cytotoxic and inhibitor lymphocytes in patients with osteogenic sarcoma. N. Engl. J. of Med. 297: 121-127, 1977.
30. Berlinger N.T., Hilal E.Y., Oettgen H.F., Good R.A. Deficient cell-mediated immunity in head and neck cancer patients secondary to autologous suppressive immune cells. The laryngoscope 88: 470-483, 1978.
31. Jerrels T.R., Dean J.H., Richardson G.L., McCoy J.L., Herberman R.B. Role of suppressor cells in depression of in vitro lymphoproliférative responses of lung cancer and breast cancer patients. J. Natl. Cancer Inst. 61: 1001-1009, 1978.
32. Kirchner H. Suppressor cells of immune reactivity in malignancy. Eur. J. Cancer 14: 453-459, 1978.
33. Wood G.W., Neff J.E., Stephens R. Relationship between monocytosis and T-lymphocyte function in human cancer. J. Natl. Cancer Inst. 63: 587-592, 1979.
34. Goodwin J.S., DeHoratus R. , Israel H., Peake G.T., Messner R.P. suppressor cell function in sarcoidosis. Annals of Intern. Med. 90: 169-173, 1979.
35. Rice L., Laughter A.H., Twomey J.J. Three suppressor systems in human blood that modulate lymphoprolifération. J. of Immunol. 122: 991-996, 1979.
36. Braun D.P., Harris J.E. Relationship of leukocyte numbers, immuno- regulatory cell function, and phytohemagglutinin responsiveness in cancer patients. J. Natl. Cancer Inst. 67: 809-814, 1981.
37. Schulof R.S., Michitsch R.W., Livingston P.0., Gupta S. Monocyte- mediated suppression of lymphocyte cytotoxic activity for cultured autologous melanoma cells. Cell. Immuno. 57: 529-532, 1981.
38. Unger S.W., Bernhard M.I., Pace R.C., Wanebo H.J. Monocyte dysfunction in human cancer. Cancer 51: 669-674, 1983.
39. Pike M.C., Snyderman R. Depression of macrophage function by a factor produced by neoplasm: A mechanism for abrogation of immune surveil lance. J. Immunol. 117: 1243-1249, 1976.
40. Nakayma E., Asana S., Takuwa N., Yokota J., Miwa S. Decreased TCGF activity in the culture medium of PHA stimulated peripheral mono nuclear cells from patients with metastatic cancer. Clin. Exp. Immunol. 51: 511-516, 1983.
41. Fujimoto S., Greene M., Sehon A.H. Regulation of the immune response to tumor antigens. I. Immunosuppressor cells in tumor-bearing hosts. J. Immunol. 116: 800-806, 1976.
42. Greene M., Perry L., Benacerraf B. Regulation of the immune response to tumor antigens. V. Modulation of suppressor T cell activity in
vivo. Am. J. Path. 95: 159-169, 1979.
43. Hellstrom K.E., Hellstrom I. Evidence that tumor antigens enhance tumor growth in vivo by interacting with a radiosensitive
(suppressor?) cell population. Proc. Natl. Acad. Sci. U.S.A. 75: 436-440,
44. Nepom G.T., Hellstrom I., Hellstrom K.E. Suppressor mechanisms in tumor activity. Experientia 39: 235-242, 1983.
45. Levy J.G., Maier T., Kilburn D.G. Further characterization of thymic suppressor cells and a factor that suppress the generation of cells cytotoxic for a syngenic tumor in DBA/2 mice. J. Immunol. 129: 766-771 , 1979.
46. Perry L.L., Greene M.I. T-cell subset interactions in the regulation of syngeneic tumor immunity. Fed. Proc. 40: 39-44, 1981.
47. Morretta L., Ferrarini M., Mingari M.C., Moretta A. Subpopulations of human T-cells identified by receptors for immunoglobulins and mitogen responsiveness. J. Immunol. 117: 2171-2174, 1976.
48. Cobleigh M.A., Braun D.P., Harris J.E. Quantitation of lymphocytes and T-cell subsets in patients with disseminated cancer. J. Natl. Cancer Inst. 64: 1041-1045, 1980.
49. Kaszubowski P.A., Husby G., Tung K.S.K., William R.C. T-lymphocyte subpopulations in peripheral blood and tissues of cancer patients. Cancer Research 40: 4648-4657, 1980.
50. Reinherz E.L., Moretta L., Roper M., Bréard J.M., Mingari M.C., Cooper M.D., Schlossman S.F. Human T-lymphocyte subpopulations defined by Fc receptors and monoclonal antibodies. A comparison. J. Exp. Med. 151: 969-974, 1980.
51. McCluskey D.R., Roy A.D., Abram W.P., Martin W.M.C. T-lymphocyte subsets in the peripheral blood of patients with benign and malignant breast disease. Br. J. Cancer 47: 307-309, 1983.
52. Harris J.E., DeBoer K.P., Vahey A.L., Braun D.P. The measurement of leukocyte subsets in the peripheral blood of cancer patients with solid tumors using monoclonal antibody reagents. Med. Ped. Oncology 10: 185-194, 1982.
53. Bernengo M.G., Lisu F., Puiatti P., Meregalli M., Berruto G., Zina G. T-cell subsets in melanoma patients evaluated by anti-T-cell mono clonal antibodies. Thymus 5: 223-233, 1983.
54. Papatestas A.E., Kark A.E. Peripheral lymphocyte counts in breast carcinoma. An index of immune competence. Cancer 34: 2014-2017, 1974.
55. Meyer K.K. Survival after mastectomy for breast cancer: Predictive value of lymphocyte count its change after mastectomy in patients with metastases to one to three axillary nodes. World J. Surg. 2: 331-339, 1978.
56. Ownby H.E., Roi L.D., Isenberg R.R., Brennan M.J. Peripheral lympho cyte and eosinophil counts as indicators of prognosis in primary breast cancer. Cancer 52: 126-130, 1983.
57. Bernengo M.G., Lisa F., Meregalli M., DeMatteis A., Zina G. The prognostic value of T-lymphocyte levels in malignant melanoma. A five-year follow-up. Cancer 52: 1841-1848, 1983.
58. Lamon E.W. The immune response to virally determined tumor associated antigens. Biochim. Biophys. Acta 355: 149-176, 1974.
59. Marx J.L. Natural killer cells help defend the body. Science 210: 624-626, 1980.