UNIVERSITE TOULOUSE III- PAUL SABATIER U.F.R Sciences
THESE
En vue de l’obtention du
DOCTORAT DE L’UNIVERSITE DE TOULOUSE délivré par l’Université Toulouse III- Paul Sabatier
Discipline : Physiopathologie moléculaire, cellulaire et intégrée
Présentée et soutenue par
Carla SAMPAIO
Le 31 mars 2008
RÔLE DE GAB1 DANS L’INTERCONNECTION ENTRE LES VOIES
Ras/MAPK ET PI3K EN AVAL DU RECEPTEUR DE L’EGF
Directeurs de thèse :
Pr. Jean-Pierre Salles et Dr. Patrick Raynal
JURY :
Pr. Bertrand Perret INSERM U563, Toulouse Président
Dr. Jacques Nunès INSERM UMR 891, Marseille Rapporteur Pr. Gérard Mauco INSERM ERM 324, Poitiers Rapporteur
Pr. Marie-Odile Jauberteau Faculté de Médecine EA 3842, Limoges Examinateur Dr. Patrick Raynal INSERM U563, Toulouse Examinateur Pr. Jean-Pierre Salles Université Paul SABATIER, Toulouse III Examinateur
INSERM U563 – Centre de Physiopathologie de Toulouse Purpan Département Lipoprotéines et Médiateurs Lipidiques
Je dédie ce travail
A mes parents,
Je tiens tout d’abord à remercier les membres du jury :
Monsieur le Professeur Bertrand Perret, pour avoir accepté de présider ce jury. Je vous suis
également reconnaissante pour votre disponibilité et pour l’intérêt que vous avez porté à mon
travail tout au long de ma thèse.
Monsieur le Docteur Jacques Nunès et Monsieur le Professeur Gérard Mauco pour avoir
accepté d’être rapporteurs de ce cette thèse. Je les remercie pour le temps qu’ils ont consacré pour
juger ce travail. Merci de l’intérêt que vous avez porté à cette thèse.
Madame le Professeur Marie-Odile Jauberteau pour avoir accepté de juger ce travail en
tant qu’examinateur. Je tiens à vous exprimer ma respectueuse considération et ma sincère
gratitude. Merci d’avoir pris le temps de venir à Toulouse et pour votre gentillesse.
Monsieur le Professeur Jean-Pierre Salles et Monsieur le Docteur Patrick Raynal, mes
directeurs de thèse, pour m’avoir accueillie dans leur équipe.
Je remercie tous les membres passés et présents du labo 107 :
Merci à Marie et à Armelle pour votre participation pour le papier, pour votre motivation. Bonne
chance à toutes les deux autant sur le plan professionnel que personnel.
Merci à Alex pour tes conseils et également pour ta disponibilité. Bonne chance en Suisse pour ton
post-doc et dans la réalisation de tes projets personnels.
Merci à Audrey pour ta gentillesse, ta bonne humeur. Merci également pour le nouvel an très
réussi (tu remerciera Thibault également). Je te souhaite bonne chance pour la suite de ta thèse.
Merci à Marie-Anaïs pour ta gentillesse, ta spontanéité. J’espère que tu réussiras à avoir une
bourse de thèse. Je te souhaite le meilleur pour la suite. Et à Sophie que je remercie pour sa bonne
humeur. Je te félicite pour ton mariage.
Au milieu de toutes ces filles, il y a quand même deux représentants de la gente masculine. Tout
d’abord, le premier venu, le docteur Thomas. Je le remercie pour sa gentillesse, sa motivation, sa
bonne humeur, son écoute. Bonne chance pour la suite tant du point de vue professionnel que
Remerciements
personnel. Enfin, Jean-Philippe pour sa motivation et sa gentillesse. Je te souhaite bonne chance
pour la suite de ta carrière. Tes enfants sont vraiment mignons, profites en bien.
Je penses également à deux personnes qui sont passées au 107 : Delphine et Rana.
Je les remercie pour leurs encouragements, leur gentillesse, leur bonne humeur.
Bonne chance à toutes les deux : Delphine en Alsace et Rana entre la France et le Liban.
Après le 107, je tiens à remercier les autres personnes qui font partis du premier étage :
Merci tout d’abord à Nicole pour ta gentillesse, ta disponibilité et les conversations que nous
avons eu. Merci pour ta contribution pour le papier.
Je remercie également Clo pour tout ce que tu fais pour le labo, pour ton franc parlé, pour ta
disponibilité et ta gentillesse.
Merci à Monique pour autant de gentillesse, de disponibilité.
Je remercie également Fabienne, Muriel, Anne, Marianne, Sara et Hélène pour leur gentillesse et
leur bonne humeur quotidienne.
Merci à Safouane pour tes encouragements et tes bons conseils. Merci également pour ta
gentillesse.
Merci également à Françoise qui m’a aidé pour les transfections dans les HEK293. Merci pour ton
naturel et ta gentillesse.
Merci à Ama et à layal pour leur gentillesse et leurs encouragements.
Merci à Ronan pour sa gentillesse. Bonne chance pour la fin du master.
Je finirai par les expertes en lipidomique : Véronique et Justine. Merci pour votre naturel et votre
gentillesse.
Je remercie également deux personnes qui ont fait parti du premier étage : Michel Record et Caro.
Merci à tous les deux pour votre bonne humeur, votre simplicité. J’ai été contente de vous revoir
au congrès du GSO. Merci Caro pour nos longues conversations quand tu étais au bâtiment C. Je
te souhaite bonne chance pour la fin de ta thèse et pour ta soutenance. Tu es courageuse car tu fais
une thèse en étant maman de deux mignonnes petites filles. Bravo !
Je remercie également l’ensemble des personnes qui font parti du thème A :
Merci à Claudia pour ses encouragements et ce qui l’a caractérise avant tout, sa gentillesse.
Je remercie Aurélie, Pierre, Anne-Lise, Mihaela pour leur naturel, leur gentillesse et leur soutien.
Merci beaucoup.
Un grand merci également à Michel, Christine C., Christine P., Coco pour votre bonne humeur,
votre disponibilité, votre gentillesse.
Je remercies également le reste des membres du thème A : Xavier, François, Laurent, Eric, Gérald,
Véro, Jayati, Stéphane.
Un très grand merci à Yvette qui est toujours disponible pour nous tous. Merci pour ta gentillesse
et tes qualités humaines. Bonne chance pour la suite.
Je vous remercie tous pour vos encouragements.
Je vous souhaite à tous une bonne continuation, une bonne réussite. Bon courage et bonne chance
à tous les étudiants.
Je remercies également mes ami(e)s qui m’ont encouragé tout au long de ces quatre années
de thèse :
Merci à Faby pour ton écoute, d’avoir été toujours là pour moi. J’espère que je ne t’ai pas trop
embêtée avec mes ras le bol. Tu es une véritable amie. Merci d’être venue à ma soutenance. Merci
à Nico pour ses encouragements, et son soutien. Dommage que tu ne sois pas venu à ma
soutenance. J’espère qu’on aura bientôt l’occasion de se revoir.
Merci à Nath et Nico d’avoir pris votre journée pour venir m’encourager. Dommage que vous
n’ayez pas pu rester le soir. On se fera un restau à Limoges. Vivement le 26 juillet, tu vas être
magnifique dans ta robe Nathalie. J’ai intérêt d’emmener les mouchoirs. Je vous remercie encore
d’avoir été là.
Merci à Catherine que je n’avais pas vu depuis de nombreuses années. J’ai été vraiment contente
de te revoir. Merci d’être venue. Je te souhaite bon courage pour la fin de ta thèse. Tu y arriveras
sans problème.
Merci à Abdel et à Ibtissam (poupougne), que j’ai connu pendant mon année de DEA, pour votre
soutien. Merci Ibtissam d’être venue à ma soutenance. Vous avez un petit garçon magnifique. A
très bientôt à Limoges.
Remerciements
Un grand merci à mes ami(e)s de Dijon avec lesquels(lles) je n’ai pas eu l’occasion de fêter
ma réussite:
A Natacha qui est mon amie depuis plus de 15 ans, et avec qui j’ai passé de bons moments. Merci
pour tes appels qui m’ont détendu pendant que j’écrivais mon manuscrit.
A Rémy et à Emilie pour vos encouragements. Super moments sur msn. Elles sont belles tes photos
Rémy.
A Delph, JC et leur petit Gaby qui maintenant habitent assez loin de Dijon. J’espère avoir
l’occasion de venir voir votre maison. Merci pour votre soutien.
On fera la fête lors de ma venue sur Dijon.
Je remercie également Nono, Cris, Cédric et Céline pour vos encouragements. Il faut absolument
qu’on se revoie car ça fait un moment. Le temps passe vraiment vite.
Je pense également à Maha qui est partie en Palestine depuis plus d’un an. Bonne chance à toi.
J’espère pouvoir te revoir un jour. Merci également à Séverine pour tes encouragements. J’espère
qu’on pourra se revoir bientôt.
Merci à chacun pour votre amitié. Que cette amitié dure encore longtemps. Je vous souhaite à tous
beaucoup de bonheur.
Un grand merci à mes parents qui ont cru en moi, qui m’ont encouragé et qui ont fait des
sacrifices pour que je réussisse. C’est grâce à eux que j’ai réussi, je leur serais à tout jamais
reconnaissante. Je vous dois énormément. Encore merci ! Je vous aime.
J’ai une pensée particulière pour ma grand-mère qui aurait été très contente et fière.
Je remercie également mes futurs beaux parents pour être venus à ma soutenance après un
long voyage. Merci pour vos encouragements et votre soutien.
Enfin, un grand merci à Christophe pour ton amour, ta présence, tout ce que tu as fait pour
moi. Merci pour m’avoir tant aidé durant ces quatre années de thèse, de m’avoir soutenue.
Heureusement que tu étais là pour me préparer à l’oral. Je t’aime.
Sommaire
Résumé……….4
Abstract……...……….5
Abréviations……….…6
Liste des figures et des tableaux……….8
Introduction générale………..………...…10
Introduction bibliographique………..……...…..12
Chapitre I: Les récepteurs à activité tyrosine kinase………..………...13
I. Généralités sur les récepteurs à activité tyrosine kinase………....………...13
1. Introduction………...13
2. Structure des RTK………..14
2.1. Le domaine extracellulaire……….……..14
2.2. Le domaine transmembranaire……….15
2.3. Le domaine intracellulaire et l’activité tyrosine kinase………...15
3. Activation des RTK………16
3.1. Dimérisation des récepteurs………...…..16
3.2. Autophosphorylation des tyrosines………...…...18
II- Les récepteurs de la famille ErbB………..……...19
1. Introduction……….………….…… 19
2. Structure des récepteurs ErbB………..………..19
3. Les ligands des récepteurs ErbB………21
4. Dimérisation des récepteurs ErbB ………22
5. Rôles physiologiques des récepteurs ErbB ………23
6. Transactivation des récepteurs ErbB……….…………25
7. Mécanismes de régulation de l’activation de l’EGFR ………...…27
7.1 Régulation par des antagonistes de l’EGFR………27
7.2. Régulation par les protéines phosphatases………...28
7.3. Régulation par l’inhibition de l’activité catalytique par la PKC………..…29
7.4 Régulation par endocytose dépendant de la clathrine………...…29
8. Les voies de signalisation activées par les récepteurs ErbB………...………30
Chapitre II : Les voies de signalisation Ras/MAPK et PI3K……...…33
I. La voie de signalisation des MAPK………..….. 33
1. La voie canonique Ras/MAPK………...34
1.1. Présentation de la superfamille Ras ………34
a. Structure des isoformes de Ras……….…..……….……….36
b. Modifications et localisation des isoformes de Ras ………37
c. Activation de Ras……….38
d. Mécanismes de régulation négative de l’activation de Ras………..……39
e. Effecteurs de Ras……….……….39
f. Invalidation de Ras chez la souris……….……41
1.2. Le module Raf/MEK/ERK………..42
1.2.1. La famille Raf……….42
a. Structure des protéines de la famille Raf………..42
b. Activation de Raf1………....43
c. Inhibition de Raf………44
d. Invalidation des isoformes de Raf chez les souris……….…………44
1.2.2. Les kinases MEK1/2………...45
1.2.3 Les kinases ERK1/2……….…46
1.2.4 Les substrats de ERK1/2………..………...46
a. Substrats nucléaires………...…47
b. Substrats cytoplasmiques ……….…47
1.2.5 Régulation de la voie des MAPK………48
a. Les protéines dites scaffold………..………49
b. Les régulateurs positifs et négatifs………..…………51
c. Les phosphatases………..52
II. Les protéines Gab et SHP2……….…52
1. Les protéines Gab………...52
1.1. Structure et expression………..……….52
1.2. Phosphorylation des protéines Gab………54
1.3. Recrutement des protéines Gab……….…55
1.4. Rôles fonctionnels des protéines Gab : études des KO……….……55
2. La protéine phosphatase SHP2………...………56
3. Gab1, SHP2 et la voie des MAPK……….…………57
III. La voie PI3K………..………….…59
1. Présentation de la famille des PI3K………...………….…59
2. Fonctions biologiques des différentes isoformes des PI3K………...…….…61
3. Mécanisme d’activation des PI3K de classe I………62
4. Les 3- phosphoinosides ……….…….……63
4.1 Phosphatidylinositol 3-phosphate (PI3P)……….……….……64
4.2 Phosphatidylinositol 3,5-bisphosphate (PI3,4P2)……….……64
4.3 Phosphatidylinositol 3,4,5-trisphosphate (PIP3)……….…………..……64
4.4 Phosphatidylinositol 3,4-bisphosphate (PI3,4P2)……….…65
5. La sérine/thréonine kinase Akt………..………….…65
5.1. Structure et expression de Akt………..…….……66
5.2 Mécanisme d’activation de Akt……….……….……67
5.3 Effets biologiques de l’activation de la voie PI3K/Akt………….……….……68
6. Régulation des PI3K………..……….……70
7. Gab1, SHP2 dans l’activation de la voie des PI3K………72
IV. Interconnection entre les voies Ras/MAPK et PI3K………...……73
1.Régulation de la voie MAPK par la voie PI3K………..………74
Chapitre III : Implications des récepteurs ErbB dans les cancers…..77
I. Dérégulations des récepteurs ErbB dans les cancers………77
II. Inhibiteurs des ErbB en thérapie anti-cancéreuse………...………81
1. Les anticorps monoclonaux………..81
2. Les inhibiteurs de l’activité kinase………..………….84
3. Autres inhibiteurs……….85
III. Phénomène de résistance………..……86
Résultats expérimentaux……….88
Rôle conditionnel de PI3K dans l’activation de la voie Ras/MAPK en fonction du mode de recrutement du module Gab1/SHP2……….……….89
I. Introduction………...………….89
II. Résultats……….……90
III. Conclusion………...……...106
Perspectives...108
Résumé
Résumé
Mes travaux de thèse se sont portés sur l’étude des voies de signalisation cellulaire induites par le récepteur de l’EGF (EGFR) et plus particulièrement sur l'activation de la voie Ras/MAPK en aval de l’EGFR. L’EGFR joue des rôles fondamentaux en terme de prolifération, de différenciation et de survie cellulaire, notamment au cours du développement embryonnaire de multiples organes.
L’activité biologique de l’EGFR est étroitement liée à sa capacité à initier des voies de signalisation telles que la voie Ras/ Mitogen-Activated Protein Kinases (MAPK) et la voie des phosphoinositide-3-kinases (PI3K). De plus, la dérégulation de l’EGFR, sa surexpression ou des mutations oncogéniques sont retrouvées dans de nombreuses tumeurs solides (les glioblastomes, les cancers du sein, les cancers ovariens, etc...) et sont corrélées à un mauvais pronostic. Ainsi, la compréhension des mécanismes moléculaires mis en jeu dans ces voies de signalisation permettrait d’identifier de nouvelles cibles potentielles aboutissant à une pharmacologie anti-tumorale.
Le but de notre travail a été de rechercher dans quelles conditions la PI3K participe à l’activation de la voie Ras/MAPK en réponse à l’EGF. Nous avons alors proposé un modèle selon lequel la dépendance de la voie Ras/MAPK vis-à-vis de PI3K, en réponse à l’EGF serait en fait conditionnée par le mode de recrutement du module Gab1/SHP2. En effet,nous avons montré que selon la force du signal ou la quantité d’EGFR mobilisés, le module Gab1/SHP2 est soit recruté par le domaine PH de Gab1 qui présente une affinité spécifique pour le PIP3, soit par l’intermédiaire de la protéine adaptatrice Grb2, rendant ainsi l’activation des MAPK dépendante ou pas de la voie PI3K.
De plus, nous avons montré que ce mécanisme de recrutement de Gab1 est retrouvé dans les cellules de glioblastomes résistantes aux inhibiteurs de l’EGFR. Ainsi, dans les cellules de glioblastomes qui présentent une activation résiduelle de l’EGFR, ce mécanisme de recrutement de Gab1 devient nécessaire pour activer efficacement la voie Ras/MAPK, ce qui pourrait alors expliquer la résistance aux inhibiteurs de l’EGFR. Dans ce cas là, les inhibiteurs de PI3K combinés aux inhibiteurs de l’EGFR vont permettre d’inhiber l’activation de la voie Ras/MAPK.
Ainsi, la protéine adaptatrice Gab1 a pu être identifiée comme étant la protéine centrale dans l’activation de la voie Ras/MAPK induite par l’EGFR. De ce fait, Gab1 pourrait potentiellement devenir une cible thérapeutique de choix dans une stratégie anti-tumorale dirigée contre certaines tumeurs solides comme par exemple les glioblastomes, permettant ainsi de ralentir la croissance tumorale et à terme une diminution de la masse tumorale.
Abstract
My thesis work fell on the study of signalling pathways induced by the EGF (Epidermal Growth Factor) receptor (EGFR) and more particularly on the activation of the Ras/MAPK pathway downstream of EGFR. EGFR plays fundamental roles in proliferation, differentiation and cell survival, particularly during embryonic development of multiple organs.
The biological activity of EGFR is closely linked to its ability to initiate signalling pathways such as the Ras/ Mitogen-Activated Protein Kinases (MAPK) and the phosphoinositide-3-kinase (PI3K) pathways. In addition, dysregulation of EGFR, its overexpression or oncogenic mutations are found in many solid tumors (glioblastoma, breast cancer, ovarian cancer…) and are correlated with a poor prognosis. Thus, understanding the molecular mechanisms involved in these signalling pathways would identify new targets leading to a potential anti-tumor pharmacology.
The goal of our work was to seek conditions when PI3K is involved in the activation of the Ras/MAPK pathway in response to EGF. We then proposed a model according to which the dependence of the Ras/MAPK pathway towards PI3K in response to EGF is in fact determined by the mechanism of recruitment of Gab1/SHP2 module. Indeed, we have shown that depending on the signal strength or the amount of EGFR mobilized, the Gab1/SHP2 module is either recruited through the Gab1PH domain which displays a specific affinity for the PIP3, either through the adaptor protein Grb2, thus making the activation of MAPK dependent or no of the PI3K pathway. In addition, we have shown that this mechanism of Gab1 recruitment is found in glioblastoma cells resistant to EGFR inhibitors. Thus, in glioblastoma cells where there is a residual activation of EGFR, the mechanism of Gab1 recruitment becomes necessary to activate effectively the Ras/MAPK pathway, which could explain the resistance to EGFR inhibitors. In this case, PI3K inhibitors combined with EGFR inhibitors will help to inhibit the activation of the Ras/MAPK pathway.
Thus, the docking protein Gab1 has been identified as the central protein to the activation of the Ras/MAPK pathway induced by EGFR. As a result, Gab1 could potentially become a therapeutic target in an anti-tumor strategy against some solid tumors such as glioblastomas, thus slowing tumor growth and ultimately a reduction of the tumor mass.
Abréviations
ABREVIATIONS
ADAM: A Disintegrin and Metalloprotease
ADN: Acide désoxyribonucléique
AMPc: Adénosine monophosphate cyclique
ARN: Acide ribonucléique
ATP: Adénosine Trisphosphate
CR: Conserved Region
CRD: Cystein-rich domain
CREB: cAMP response element-binding
CNK: Connector Enhancer of KSR
EGF: Epidermal Growth Factor
EGFR: Epidermal Growth Factor Receptor
EPO: Erythropoïétine
Eps15: EGFR pathway substrate 15
ERK : Extracellular-Regulated Kinase
FGF: Fibroblast growth factor
FGFR: Fibroblast growth factor receptor
FYVE: Fab1p, YOTB, Vps27p, EEA1
Gab: Grb2-adapter binder
GAP: GTPase Activating Protein
GEF: Guanine Nucleotide Exchange Factor
GDP: Guanosine diphosphate
GH: Growth hormone
GHR: Growth hormone receptor
GM-CSF: Granulocyte Macrophage Colony Stimulating Factor
Grb2: Growth Factor Receptor binding Homology 2
GSK3: Glycogen Synthase Kinase 3
GTP: Guanosine Trisphosphate
GTPase: Guanosine triphosphate hydrolase
HB-EGF: Heparin-Binding Epidermal Growth Factor
HGF: Hepatocyte Growth Factor
HGFR: Hepatocyte Growth Factor receptor
HRS: Hepatocyte growth factor regulated tyrosine kinase substrate
Hsp: Heat Shock Protein
Ig: Immunoglobuline
IGF-1: Insuline Growth-1
IL: Interleukine
KO: Knock out
KSR: Kinase Supprossor of Ras
MAPK: Mitogen-Activated Protein Kinase
MAPKK: MAPK Kinase
MAPKKK: MAPKK Kinase
MEK: MAPK/ERK Kinase
MK: MAPK-activated protein kinases
MBD: Met Binding Domain
MDCK: Madin-Darby canine kidney
MKP: MAPK Phosphatase
MNK: MAPK interacting kinases
MORG1: MAPK Organizer
MP1: MEK Partner 1
MSK: Mitogen- and stress activated kinases)
NF: Neurofibromine
NF1: Neurofibromatose de type 1
NFkB: Nuclear factor κB
NGF: Nerve Growth Factor
NRG: Neuréguline
PDGF: Platelet Derived Growth Factor
PDK: Phosphatidylinositol-dependent kinase
PH: Pleckstrin Homology
PI: Phosphatidylinositol
PI3,4,5P3: Phosphatidylinositol 3,4,5 triphosphatase
PI3,4P2: Phosphatidylinositol 3,4 biphosphatase
PI3K: Phosphoinositide 3-Kinase
PI3P: Phosphatidylinositol 3 Phosphatase
PI4,5P2: Phosphatidylinositol 4,5 biphosphate
PKA, PKB, PKC: Protein Kinase A, B, C
PLC, PLD: Phospholipase C, D
PP: Protein phosphatase
PRD: Paired domain
PTB: Phosphotyrosine Binding
PTEN: Phosphatase and tensin homolog
PTK: Protéine Tyrosine Kinase
PTP: Phosphotyrosine Phosphatase
RA: Ras Associating
RASSF: Ras-association domain family 1
RBD: Ras Binding Domain
RCPG: Récepteur Couplé aux Protéines G
RIN: Ras and Rab Interactor
RSK: Ribosomal S6 Kinase
RKIP: Raf kinase inhibitor protein
RTK: Récepteur à activité Tyrosine Kinase
SH2: Src Homology 2
SH3: Src Homology 3
SHIP2: SH2 domain-containing Inositol 5-Phosphatase
SHP2: SH2 domain-containing Phosphatase 2
SHPS-1: SHP Substrate
SIRP: Signal-Inhibitor Regulatory Protein
Sos: Son of Sevenless
SPRED: Sprouty- related proteins with EVH1 domains
Spry: Sprouty
STAT: Signal transducer and activator of transcription
Sur8: Suppressor of Ras
TGFα: Transforming Growyh Factor α
TKI: Tyrosine kinase inhibitor
Liste des figures et tableaux
LISTE DES FIGURES ET TABLEAUX
Figures :
Figure 1: Classification des récepteurs à activité tyrosine kinase (RTK), représentés suivant leurs
caractéristiques structurales
Figure 2: La liaison du ligand stabilise la formation de dimères activés
Figure 3: Modèle de stimulation des tyrosines kinases par dimérisation des récepteurs Figure 4: Structure schématique des récepteurs ErbB
Figure5: Mécanisme d’hétérodimérisation des récepteurs ErbB, exemple de l’hétérodimère
ErbB2/ErbB3
Figure 6: Activation des récepteurs ErbB indépendante du ligand, exemple de l’EGFR Figure 7: Mécanismes de transactivation des récepteurs ErbB par les RCPG
Figure 8: Mécanisme de régulation par endocytose de l’EGFR
Figure 9: Schéma représentant les résidus phosphotyrosines spécifiques et la liaison des protéines
de la signalisation aux récepteurs ErbB
Figure 10: Les voies de signalisation des MAP kinases Figure 11: Le cycle des GTPases
Figure 12: Structure des isoformes de Ras : HRas, NRas, KRas4A et KRas4B Figure 13: Modifications et localisation des protéines Ras
Figure 14: Effecteurs de Ras et leurs réponses biologiques correspondantes Figure 15: Structure des trois isoformes de Raf.
Figure 16: Schéma récapitulatif de l’activation de la voie des MAPK Figure 17: Les substrats des MK
Figure 18: Activation de la voie des MAPK dans des compartiments cellulaires variés. Figure 19: Les protéines scaffold impliquées dans la voie des MAPK
Figure 20: Liste des protéines scaffold (à gauche) et des régulateurs négatifs et positifs (à droite) de
la voie des MAPK
Figure 21: Structure schématique des protéines Gab1, Gab2 et Gab3 humaines et des résidus
tyrosine impliqués dans une interaction protéique
Figure 22: Représentation schématique de la protéine phosphatase SHP2 Figure 23: Les différentes classes de PI3K
Figure 24: Les voies de synthèse des PI
Figure 25: Les différents effecteurs des PI3K de classe I Figure 26: Structure des trois isoformes humaines de Akt/PKB
Figure 27: Représentation schématique du mode d'activation de Akt et de certaines voies de
signalisation activées par Akt
Figure 28: Modèle de la régulation de l’activation de PI3K par la protéine phosphatase SHP2 Figure 29: Schéma de l’activation des voies Ras/MAPK et PI3K en réponse à l’EGF et de
l’interconnection entre ces deux voies
Figure 30: Mécanismes selon lesquels l’EGFR devient oncogénique
Figure 31: Classification des différents anticorps monoclonaux (murin, chimérique, humanisé et
humain)
Figure 32: Schéma illustrant le rôle conditionnel de la PI3K dans l’activation de la voie Ras/MAPK
Tableaux :
Tableau 1 : Les récepteurs ErbB et leurs ligands connus
Tableau 2 : Conséquences biologiques de l’invalidation des gènes codant pour les récepteurs ErbB
ou pour leurs ligands dans des organes
Tableau 3 : Liste des antagonistes de l’EGFR
Tableau 4: Protéines tyrosine phosphatases régulant l’EGFR
Tableau 5: Conséquences biologiques de l’invalidation des gènes codant pour les protéines Ras Tableau 6: Conséquences biologiques de l’invalidation des gènes codant pour les sous-unités des
PI3K
Tableau 7: Liste des protéines régulant l’activité de la sérine/thréonine kinase Akt/PKB
Tableau 8: Conséquences biologiques de l’invalidation des gènes codant pour les protéines PTEN
et SHP1 et 2
Tableau 9: Dérégulations des récepteurs de la famille ErbB retrouvées dans les cancers Tableau 10: Mutations de l’EGFR
Tableau 11: Liste d’anticorps monoclonaux anti-ErbB utilisés en thérapie anti-cancéreuse
Tableau 12: Liste d’inhibiteurs de l’activité kinase des récepteurs ErbB utilisés en thérapie
Introduction générale
Introduction générale
Les récepteurs à activité tyrosine kinase intrinsèque (RTK) constituent une grande famille de récepteurs. Ces récepteurs sont généralement activés par dimérisation après fixation du ligand, entraînant alors un changement conformationnel permettant ainsi une augmentation de leur activité tyrosine kinase. Une fois activés, les RTK vont être capables d’initier diverses voies de signalisation, leur permettant d’induire de nombreux effets biologiques tels que la prolifération et la différenciation, ou encore la migration cellulaire. Les RTK, notamment un des plus étudiés actuellement, le récepteur de l’EGF (epidermal growth factor) qui fait partie de la famille des récepteurs ErbB, induisent de nombreuses voies de signalisation mitogènes et en particulier, les voies Ras/MAPK (mitogen-activated protein kinase) et PI3K (phosphoinositide-3 kinase). Ces deux voies jouent un rôle dans de nombreuses fonctions cellulaires comme la prolifération, la survie ou la différenciation. Sur le plan physiopathologique, une hyperactivation ou diverses altérations de l’EGFR ou d’acteurs de ces deux voies sont associées à de nombreuses pathologies, notamment les cancers. Ainsi, ces différentes observations font de ces récepteurs ou des acteurs de ces voies de signalisation des cibles privilégiées en thérapie anti-cancéreuse.
Ce manuscrit portera plus particulièrement sur l’étude des 2 voies de signalisation majeures, les voies Ras/MAPK et PI3K, induites par le récepteur de l’EGF. D’ailleurs, ces deux voies sont étroitement liées. Il semble de plus que deux acteurs majeurs communs à ces 2 voies, interviennent dans les interconnections entre ces deux voies : la protéine adaptatrice Gab1 et la protéine phosphatase SHP2.
Ainsi, comme nous le verrons dans ce manuscrit, les voies Ras/MAPK et PI3K présentent de nombreuses connexions entre elles et peuvent agir l’une sur l’autre par un réseau complexe de rétrocontrôles positifs ou négatifs, démontrant ainsi que la signalisation induite par les RTK est loin d’être linéaire. De ce fait, si on agit sur une seule de ces 2 voies, il peut y avoir des conséquences majeures sur la deuxième, soulignant donc l’importance de leur régulation et du maintien de leur intégrité.
Dans un premier chapitre de l’introduction bibliographique, nous nous intéresserons tout d’abord aux récepteurs à activité tyrosine kinase et plus particulièrement aux récepteurs ErbB. Nous décrirons leur structure, leur mode de fonctionnement. Nous nous intéresserons également aux voies de signalisation induites par les récepteurs ErbB. Ensuite dans un deuxième chapitre, nous traiterons en détail de deux voies qui sont induites par l’EGFR : la voie Ras/MAPK (Mitogen-Activated Protein Kinase) et la voie PI3K (phosphoinositides-3-kinase). Nous nous intéresserons également dans ce chapitre à la protéine adaptatrice Gab1 et à la protéine phosphatase SHP2 et nous aborderons l’importance de ces deux protéines dans l’activation de ces deux voies. Nous
terminerons ce chapitre par les interconnections entre les voies Ras/MAPK et PI3K. Le troisième chapitre sera consacré à l’implication physiopathologique des récepteurs ErbB notamment dans les pathologies cancéreuses. Nous traiterons des dérégulations de ces récepteurs, des différents composés utilisés pour inhiber les récepteurs ErbB et enfin nous nous intéresserons aux résistances aux inhibiteurs anti-ErbB développées par les cellules.
D’après la littérature, il existe des interconnections entre la voie Ras/MAPK et la voie PI3K. Dans certains modèles cellulaires, sous certaines conditions, il a été admis que l’activation de la voie Ras/MAPK pouvait être dépendante de la voie PI3K en réponse à l’EGF. Pourtant, cette observation n’a pas été retrouvée dans certains types cellulaires. Au vu de ces contradictions, il semblerait que l’activation de la voie Ras/MAPK par la voie PI3K dépende de la force du signal ou du type cellulaire considéré. De plus, le mécanisme moléculaire mis en jeu lors de cette dépendance n’a pas été identifié. Le but de ce travail de thèse a donc consisté à identifier le mécanisme moléculaire qui permet à la PI3K de participer à l’activation de la voie Ras/MAPK selon la force du signal de stimulation. Nous avons donc réussi à démontrer que la dépendance de la voie Ras/MAPK vis-à-vis de PI3K est conditionnée par le mode de recrutement du module Gab1/SHP2. En effet, nous avons montré que lors de stimulation de forte intensité, le module Gab1/SHP2 est recruté par l’intermédiaire de la protéine adaptatrice Grb2, ce qui rend alors l’activation de la voie Ras/MAPK indépendante de PI3K. Au contraire, lors de stimulation de forte intensité, le module Gab1/SHP2 est recruté par l’interaction du domaine PH de Gab1 avec les produits de PI3K, ce qui rend alors l’activation de la voie ras/MAPK dépendante de PI3K. De plus, nos résultats suggèrent que cette activation des MAPK dépendante de la PI3K par le mode de recrutement du module Gab1/SHP2 pourrait être impliquée dans la résistance à un inhibiteur de l’EGFR observée dans des lignées de glioblastomes.
Les résultats obtenus ont donc permis de démontrer que la protéine adaptatrice Gab1 et la phosphatase SHP2 jouent un rôle important dans l’activation des voies Ras/MAPK et PI3K.
De plus, les protéines Gab1 et SHP2 interviennent lors des processus cancéreux, donc elles pourraient devenir des cibles thérapeutiques de choix. Ainsi, en ciblant le recrutement du module Gab1/SHP2 à la membrane, l’activation de Ras/MAPK serait inhibée, ce qui devrait entraîner une diminution de la prolifération cellulaire.
Chapitre I : Les récepteurs à activité tyrosine kinase
I. Généralités sur les récepteurs à activité tyrosine kinase.
1. Introduction
Les récepteurs à activité tyrosine kinase intrinsèque (RTK) également appelés récepteurs des facteurs de croissance, sont des glycoprotéines transmembranaires composées d’un domaine extracellulaire très variable capable de fixer le ligand, d’un domaine transmembranaire permettant l’ancrage dans la membrane cellulaire et d’un domaine intracellulaire (cytoplasmique) qui renferme l’activité tyrosine kinase et permet la transduction du signal au sein de la cellule. L’activité enzymatique des RTK est localisée dans le cytoplasme et permet le transfert du phosphate γ de l’ATP vers l’hydroxyle des tyrosines des protéines cibles et/ou du récepteur lui-même, c’est ce qu’on appelle l’autophosphorylation. Les RTK sont d’importants régulateurs de la communication intercellulaire, ils jouent en effet un rôle important dans le contrôle de nombreux processus biologiques, tels que le cycle cellulaire, la migration cellulaire, le métabolisme, la croissance, la prolifération et la différenciation cellulaire (Ullrich and Schlessinger, 1990; Zwick et al., 2002). Ces récepteurs membranaires sont des composants essentiels des voies de signalisation cellulaires qui sont actives durant le développement embryonnaire et l’homéostasie cellulaire chez l’adulte. Les RTK sont une famille de 58 récepteurs de surface cellulaire de type I comportant des caractéristiques structurales et fonctionnelles similaires (Schlessinger, 2000). Selon leur organisation structurale, ces récepteurs se regroupent en plusieurs familles. Vingt familles de RTK ont été décrites jusqu’à présent (figure 1). Parmi ces différentes familles, on distingue les récepteurs à l’insuline (IR), les récepteurs aux facteurs de croissance de l’épiderme (EGFR), les récepteurs aux facteurs de croissance dérivé des plaquettes (PDGFR), les récepteurs aux facteurs de croissance de l’endothélium vasculaire (VEGFR) et les récepteurs aux facteurs de croissance des fibroblastes (FGFR).
Introduction bibliographique Chapitre I : Les récepteurs à activité tyrosine kinase
Figure 1: Classification des récepteurs à activité tyrosine kinase (RTK), représentés suivant leurs caractéristiques structurales. Abréviations: AB: boîte acide, CadhD: domaine de type
cadhérine, CRD : domaine riche en cystéine, DiscD: domaine de type discoidine, EGFD : domaine de type EGF (facteur de croissance épidermique), FNIII: domaine de type fibronectine type III, IgD: domaine de type immunoglobuline, KrinD : domaine de type kringle, LRD: domaine riche en leucine. D’après (Blume-Jensen and Hunter, 2001).
2. Structure des récepteurs RTK
Les RTK sont composés de trois domaines distincts : le domaine extracellulaire, le domaine transmembranaire et le domaine intracellulaire.
2.1. Le domaine extracellulaire
Le domaine extracellulaire des RTK, qui permet la fixation de ligands est très diversifié et très glycosylé. Ce domaine extracellulaire présente une variété d’éléments conservés tels que les domaines de type immunoglobuline (IgD), de type fibronectine III (FNIII), de type facteur de croissance épidermique (EGFD), riche en cystéine et riche en leucine. Ces différents domaines déterminent la spécificité de la liaison au ligand. En effet, la liaison du ligand au domaine extracellulaire provoque des changements conformationnels qui induisent et stabilisent la dimérisation du récepteur (Heldin, 1995).
2.2. Le domaine transmembranaire
Le domaine transmembranaire est constitué d’un seul segment de 22 à 26 acides aminés, organisé en une seule hélice. Le domaine transmembranaire est caractérisé par une séquence hydrophobe dont la fonction est l'ancrage du récepteur à la membrane. Des mutations ont été identifiées dans les domaines transmembranaires d’au moins deux familles de RTK, fibroblast growth factor receptor (FGFR) et epidermal growth factor receptor (EGFR) aboutissant à une activation constitutive du récepteur par une dimérisation indépendante du ligand (Sternberg and Gullick, 1989; Webster and Donoghue, 1996). Même si ce domaine ne joue pas un rôle dans l’activation du récepteur, il pourrait jouer un rôle au niveau de sa conformation et de la stabilisation des récepteurs dimériques.
2.3. Le domaine intracellulaire et l’activité tyrosine kinase
Le domaine intracellulaire se compose d’une région juxta-membranaire suivie par le domaine catalytique tyrosine kinase et terminé par la région carboxy-terminale. Ces régions contiennent des sous-domaines régulateurs influençant négativement ou positivement la liaison du substrat et la phosphorylation, ainsi que les sous-domaines impliqués dans la dimérisation et/ou dans les changements structuraux pendant l’activation de la kinase après la liaison du ligand. La longueur et la séquence des domaines juxta-membranaire et carboxy-terminal varient suivant les RTK et contiennent des sites de phosphorylation tyrosine et sérine/thréonine. Ces sites peuvent être phosphorylés par le récepteur lui-même (autophosphorylation) ou par des protéines kinases (Hubbard, 2002).
Il a été établi que le domaine tyrosine kinase comporte onze sous-domaines majeurs (I à XI). Les domaines I à V forment le domaine de liaison à l’ATP, complexé aux ions Mn2+ ou Mg2+. Les domaines VI et VII sont dotés de l’activité phospho-transférase. Les kinases possèdent une boucle d’activation comprenant les sous-domaines VII et VIII comportant entre une et trois tyrosines. L’activité kinase est cruciale pour l'activation des voies de transduction aboutissant à l'induction des réponses cellulaires comme la survie, la prolifération et la différenciation (Hubbard and Till, 2000). Un domaine tyrosine kinase intact est absolument nécessaire dans la signalisation du récepteur. En effet, des mutations d’un seul résidu dans ce domaine peuvent entraîner la perte de la fonction du récepteur.
Introduction bibliographique Chapitre I : Les récepteurs à activité tyrosine kinase
3. Activation des RTK
3.1. Dimérisation des récepteurs
L’élément déclencheur de l’activation des RTK est la fixation du ligand, qui conduit à la dimérisation non covalente des récepteurs.
Les RTK sont présents à la surface cellulaire sous forme d’une seule chaîne polypeptidique et monomérique en l’absence de ligand. L’exception à cette règle est la famille HGFR et la famille des récepteurs à l’insuline. Ainsi, le récepteur aux facteurs de croissance des hépatocytes (famille HGFR), possède une chaîne α liée par un pont disulfure à une chaîne β dans le domaine extracellulaire donc ce récepteur se trouve déjà sous forme de dimère. Les récepteurs à l’insuline et IGF-1 possèdent deux chaînes α extracellulaires, chacune d’entre elles étant liée à une chaîne β par un pont disulfure, pour former un hétéro-tétramère α2β2 (Schlessinger, 2000).
L’interaction du ligand avec le domaine extracellulaire conduit donc à la dimérisation du récepteur et à la formation d’un complexe protéique généralement constitué de deux chaînes de récepteurs et de deux molécules de ligands. Ainsi, les complexes EGF-EGFR et FGF-FGFR montrent une stoechiométrie 2 :2 (ligand-récepteur) (Lemmon et al., 1997; Plotnikov et al., 1999). Dans le cas du complexe FGF-FGFR, les interactions FGF-FGFR ne sont pas suffisantes pour stabiliser le dimère FGFR, qui nécessite des molécules d’héparine qui sont essentielles à la stabilité du complexe (Spivale-Kroizman et al 1994). Par contre, des études menées sur le ligand GH et son récepteur GHR ont montré que GH se fixe sur son récepteur avec une stoechiométrie 1 :2 (ligand-récepteur). Le ligand se fixe simultanément sur deux récepteurs (Kossiakoff and De Vos, 1998). La liaison du ligand va stabiliser le dimère actif stimulant ainsi l’activité tyrosine kinase. Il a été proposé que des dimères actifs existent même en l’absence de liaison du ligand puisque l’autophosphorylation des RTK peut être augmentée par des inhibiteurs des protéines tyrosines phosphatases ou par une surexpression du récepteur même en absence de liaison du ligand (Schlessinger, 2000). L’existence de différents états d’équilibre entre dimères actifs et inactifs est représentée dans la figure 2.
Figure 2 : La liaison du ligand stabilise la formation de dimères activés. Les récepteurs
monomériques (vert) sont en équilibre avec les récepteurs dimériques inactifs (vert) ou actifs (bleu). Les récepteurs dimériques actifs existent dans une conformation compatible avec la trans-autophosphorylation et la stimulation de l’activité protéine tyrosine kinase. La fixation de ligand stabilise la formation de dimère actif. D’après (Schlessinger, 2000).
La dimérisation non covalente des RTK, induite ou stabilisée par la fixation de ligand, est le mécanisme déclencheur de l’autophosphorylation des tyrosines (Heldin, 1995; Ullrich and Schlessinger, 1990). La fixation de ligand au domaine extracellulaire peut induire un réarrangement structural des récepteurs hétérotétramèriques (exemple du récepteur à l’insuline), facilitant l’autophosphorylation des tyrosines dans le domaine cytoplasmique. Dans certains cas, la dimérisation est certes nécessaire pour l’activation tyrosine kinase mais n’est pas suffisante (Bennasroune et al., 2004). Par exemple, dans le cas du récepteur tyrosine kinase Eph, la dimérisation est suffisante pour l’autophosphorylation des récepteurs, à la condition d’une organisation des récepteurs en tétramère pour susciter toutes les réponses biologiques dans la cellule (Stein et al., 1998). De plus, dans le cas du FGFR, l’activation du récepteur nécessite aussi la coopération avec certains protéoglycanes de la matrice extracellulaire pour stabiliser le complexe . Dans la plupart des cas, la dimérisation des RTK est probablement suffisante pour la transduction du signal.
De plus, une boucle activatrice est présente dans les domaines tyrosine kinase cytoplasmiques. En conformation dite fermée, la boucle masque le site de liaison à l’ATP, réduisant ainsi l’activité catalytique de la protéine. Lorsque les résidus tyrosines appartenant à la boucle sont phosphorylés par un récepteur voisin (trans-autophosphorylation), elle se stabilise dans une conformation dite ouverte permettant alors la fixation de l’ATP et la phosphorylation.
Introduction bibliographique Chapitre I : Les récepteurs à activité tyrosine kinase 3.2. Autophosphorylation des tyrosines
L’augmentation de l’activité catalytique intrinsèque du récepteur et la création de sites de fixation dans le domaine intracellulaire, afin de recruter les protéines de signalisation, sont les deux étapes clés de l’activation des récepteurs. Pour la plupart des RTK, la réalisation de ces deux étapes nécessite l’autophosphorylation des résidus tyrosines du domaine intracellulaire, permise par l’oligomérisation des récepteurs déclenchée par la fixation du ligand. L’autophosphorylation des résidus tyrosines de la boucle activatrice du domaine tyrosine kinase génère des sites de fixation pour les protéines de signalisation pouvant reconnaître les séquences contenant des phosphotyrosines. L’autophosphorylation des tyrosines peut être cis, dans ce cas la phosphorylation est effectuée par le récepteur lui-même ou trans où la phosphorylation s’effectue entre les récepteurs. La cis-autophosphorylation est probablement due à un changement conformationnel provoqué par la fixation de ligand sur le récepteur. La transautophosphorylation ne nécessite aucun changement conformationnel: le simple effet de proximité engendré par la dimérisation suffit à déclencher la phosphorylation des tyrosines (Hubbard and Till, 2000). A partir de ces structures, Hubbard et al. ont établi un modèle de stimulation de l’activité tyrosine kinase par dimérisation des récepteurs (figure 3) (Hubbard et al., 1998).
Figure 3: Modèle de stimulation des tyrosines kinases par dimérisation des récepteurs. La
boucle activatrice des RTK est relativement mobile et adopte de nombreuses conformations. La conformation majoritaire (rouge) interfère avec la fixation de substrat et donc empêche la fixation d’ATP. En vert, la conformation de la boucle activatrice est compatible avec la fixation d’ATP. En l’absence de ligand, la probabilité de trans-autophosphorylation est faible. La fixation de ligand au domaine extracellulaire augmente la concentration de récepteur et permet ainsi la trans autophosphorylation de la boucle activatrice et déplace l’équilibre vers une conformation active permettant la fixation de substrat et d’ATP. D’après (Hubbard et al., 1998)
II- Les récepteurs de la famille ErbB
1. Introduction
Les récepteurs ErbB appartiennent à la famille des RTK de classe I. Les récepteurs ErbB sont exprimés dans la quasi-totalité des tissus non hématopoïétiques. Ils sont impliqués dans différents processus biologiques tels que la prolifération, la différenciation, le contrôle du métabolisme cellulaire, la migration et la survie cellulaire. Des altérations des récepteurs ErbB telles que des mutations oncogéniques ou des surexpressions sont retrouvées dans de nombreux cancers, en particulier des tumeurs solides (cancer du sein, du poumon, etc …). Ces récepteurs suscitent donc un grand intérêt en tant que cibles dans les thérapies anti-cancéreuses (Blume-Jensen and Hunter, 2001; Schlessinger, 2000).
Chez le nématode C. elegans, un seul orthologue de l’EGFR a été identifié, Let23, comptant un seul ligand (Lin-3). Chez la drosophile un seul orthologue de l’EGFR a également été identifié, DER, et celui-ci est activé par quatre ligands différents (Vein, Spitz, Gurken et Argos) (Leahy, 2004). Chez les mammifères, cette famille comprend quatre récepteurs qui sont : ErbB1/HER1 ou EGFR, ErbB2/HER2 (Neu chez le rat), ErbB3/HER3 et ErbB4/HER4.
L’EGFR a été le premier récepteur de cette famille à avoir été identifié et cloné par Carpenter en 1978, et il est codé par le proto-oncogène ErbB1 (Carpenter et al., 1978). L’EGFR est une glycoprotéine de 170 kDa composée d’une seule chaîne polypeptidique de 1186 acides aminés. L’EGFR a été détecté dans le noyau de nombreuses lignées cellulaires où il peut fonctionner comme un facteur de transcription pour l’activation de gènes impliqués dans le processus de prolifération. Lin et al. (2001) ont montré qu’après la stimulation par l’EGF à la surface cellulaire, l’EGFR migre dans le noyau où il peut lier une séquence consensus riche en AT et augmenter ainsi la transcription de gènes par une région riche en proline. En utilisant la technique d’immunoprécipitation de la chromatine, ils ont montré que l’EGFR est associé à la région promotrice du gène codant pour la cycline D1 in vivo, une protéine qui peut jouer un rôle clef dans la mitogenèse (Fickova, 2002; Lin et al., 2001;Wong and Chang, 2001).
2. Structure des récepteurs ErbB
Les récepteurs ErbB sont composés de trois domaines (figure 4):
- Un domaine extracellulaire de 621 acides aminés contenant le site de liaison pour le ligand. Ce domaine comprend quatre régions (Warren and Landgraf, 2006):
Introduction bibliographique Chapitre I : Les récepteurs à activité tyrosine kinase 1. la région I (L1) est importante dans la dimérisation induite par le ligand (Fernandes
et al., 2001)
2. les régions II (S1 ou CR1) et IV (S2 ou CR2) sont riches en cystéines (Abe et al., 1998) et sont liés par un pont disulfide intra-chaîne, contenant 22 et 20 résidus cystéine.
3. la région III (L2)
Les régions I et III sont impliquées dans la fixation des ligands et les régions II et IV sont impliqués dans la dimérisation induite par la fixation de ligand.
Le domaine extracellulaire de ces récepteurs est peu conservé dans cette famille suggérant que ces récepteurs membranaires ont des spécificités différentes dans la liaison du ligand (Olayioye et al., 2000; Yarden and Sliwkowski, 2001).
- Un domaine intracellulaire (ou cytoplasmique) de 542 aa contenant un domaine catalytique tyrosine kinase, un domaine juxta-membranaire et une longue queue C-terminale. Le domaine juxtamembranaire est une région régulatrice importante. Cette région est sujette à des phosphorylations par des protéines kinases comme la protéine kinase C (PKC) permettant d’atténuer ou de moduler la signalisation par les récepteurs ErbB. La queue C terminale contient d’une part cinq sites d’autophosphorylation (Tyr 992, Tyr 1068, Tyr 1086, Tyr 1168 et Tyr 1173) qui lient spécifiquement les protéines contenant les domaines SH2 ou PTB, d’autre part au moins trois motifs d’internalisation, et également des sites pour la transphosphorylation, l’activation protéolytique et la dégradation (Fernandes et al., 2001). Le domaine intracellulaire est fortement conservé bien que celui-ci contienne des substitutions d’acides aminés inactivant l’activité tyrosine kinase. L’activité catalytique des récepteurs ErbB réside dans le domaine tyrosine kinase. En effet, l’inhibition de celui-ci élimine l’activité biologique des récepteurs ErbB. Il existe un motif dans le domaine juxtamembranaire qui peut lier les protéines G hétérodimériques (Wells, 1999).
Figure 4: Structure schématique des récepteurs ErbB. Le domaine extracellulaire est composé
de quatre régions, homologues deux à deux, appelées L1 et L2 (région I et III) et S1 et S2 (région II et IV) riche en cystéine. S’ensuivent le domaine transmembranaire, le domaine juxtamembranaire, le domaine tyrosine kinase et un domaine C-terminal qui porte les sites majeurs de phosphorylation sur tyrosine D’après (Burgess et al., 2003).
3. Les ligands des récepteurs ErbB
Les récepteurs ErbB sont activés par la liaison d’une famille de ligands contenant un domaine EGF-like (Holbro and Hynes, 2004). Douze ligands sont actuellement connus pour ces quatre récepteurs offrant un grand nombre de combinaisons possibles aboutissant ainsi à une grande diversité des voies de signalisation (Gullick, 2001).
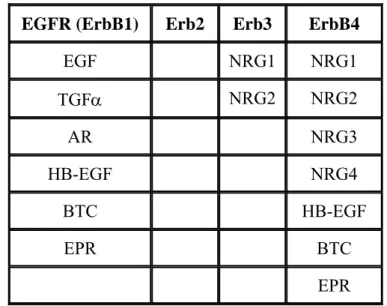
Les ligands des récepteurs ErbB peuvent être divisés en trois groupes (tableau 1). Le premier groupe comporte 3 ligands spécifiques de l’EGFR qui sont l’epidermal growth factor (EGF), le transforming growth factor α (TGF-α) et l’amphiréguline (AR). Le second groupe comporte la beta-celluline (BTC), l’heparin-binding epidermal growth factor (HB-EGF) et l’épiréguline (EPR), qui montrent une spécificité double en liant l’EGFR et ErbB-4. Le troisième groupe est composé des neurégulines (NRGs) et peut être sub-divisé en trois sous-groupes basés sur leur capacité à lier ErbB-3 et ErbB-4 (NRG-1 et NRG-2) ou seulement ErbB-4 (NRG-3 et NRG-4) (Carraway et al., 1997; Harari et al., 1999; Normanno et al., 2006; Zhang et al., 1997). On ne connaît pas de ligand se fixant au domaine extracellulaire du récepteur ErbB2 (Citri et al., 2003). L’EGF est parmi les premiers facteurs de croissance à avoir été découvert. L’EGF a été initialement isolé des glandes sous-maxillaires des souris (Cohen, 1962).
Introduction bibliographique Chapitre I : Les récepteurs à activité tyrosine kinase
EGFR (ErbB1) Erb2 Erb3 ErbB4
EGF NRG1 NRG1 TGFα NRG2 NRG2 AR NRG3 HB-EGF NRG4 BTC HB-EGF EPR BTC EPR
Tableau 1. Les récepteurs ErbB et leurs ligands connus. Abréviations : EGF : Epidermal Growth
Factor ; HB-EGF : Heparin Binding EGF-like factor; TGF-α : transforming growth factor α; AR: amphiréguline; EPR : épiréguline ; NRG : neurégulines ; BTC : beta-celluline.
Tous ces ligands sont de petites protéines solubles (d’environ 55 aa) qui dérivent par protéolyse de précurseurs membranaires (Massague and Pandiella, 1993). Le clivage de ces précurseurs membranaires est dû à l’intervention de métalloprotéases appartenant aux familles ADAM, en réponse à divers stimuli en particulier à l’activation des récepteurs couplés aux protéines G. La structure tridimentionnelle des ligands est caractérisée par l’existence d’un domaine EGF-like et de trois ponts disulfures intramoléculaires. Le domaine de liaison au récepteur contient d’autres motifs structuraux comme des domaines Ig-like, des sites de liaison à l’héparine et des sites de glycosylation (Yarden and Sliwkowski, 2001).
4. Dimérisation des récepteurs ErbB
Les récepteurs de la famille ErbB sont activés après la fixation de ligand entraînant l’homo ou l’hétérodimérisation. Il existe des interactions directes entre les récepteurs dimérisés mise en avant par la boucle de dimérisation formée dans le domaine II. La structure de l’EGFR, de ErbB3 et de ErbB4 inactifs est caractérisée par les interactions intramoléculaires entre les domaines II et IV qui maintiennent les domaines de fixation du ligand en conformation fermée (ou auto-inhibée). Cependant, dans le cas du récepteur ErbB2 la même caractéristique n’est pas observée. En effet, le domaine extracellulaire de ErbB2 adopte une conformation ouverte similaire à celle des autres récepteurs ErbB activés par la fixation du ligand. Dans cette conformation ouverte, les interactions fortes entre les domaines I et III ne permettent aucune liaison du ligand, ce qui peut expliquer l’absence d’affinité de ErbB2 pour un ligand. ErbB2 se trouve donc dans une conformation
favorable à la dimérisation (Citri et al., 2003; Marmor et al., 2004). En ayant une conformation ouverte, ErbB2 est capable d’interagir avec les autres récepteurs ErbB expliquant ainsi son rôle de co-récepteur avec les autres récepteurs ErbB en absence de liaison directe avec le ligand. En effet, ErbB2 est le partenaire favori pour l’hétérodimérisation avec les autres récepteurs ErbB (Graus-Porta et al., 1997). Les hétérodimères contenant le récepteur ErbB2 ont des caractéristiques particulières, comme une endocytose plus lente qui induit alors un signal plus prolongé et plus puissant, ce qui permet une prolifération cellulaire plus importante.
Figure 5 : Mécanisme d’hétérodimérisation des récepteurs ErbB, exemple de l’hétérodimère ErbB2/ErbB3. Le domaine extracellulaire de chaque récepteur ErbB consiste en quatre regions (I à
IV). (a) En absence de ligand, le domaine extracellulaire de ErbB3 et de EGFR (non montré ici) est dans une conformation fermée qui ne permet pas la dimérisation. (b) Après fixation du ligand, ErbB3 ou l’EGFR se trouve en configuration ouverte. Les domaines I et III sont impliqués dans la liaison du ligand, et ensuite la boucle de dimérisation située dans le domaine II est exposée. (c) et permet alors l’interaction récepteur-récepteur. ErbB2 se trouve en conformation ouverte qui est similaire à l’état de ErbB3 et de l’EGFR activés par le ligand. D’après (Hynes and Lane, 2005).
Le récepteur ErbB3 quant à lui ne possède pas d’activité tyrosine kinase, bien que le domaine tyrosine kinase soit très conservé parmi les récepteurs ErbB (Guy et al., 1994). Sans une activité tyrosine kinase fonctionnelle, ErbB3 doit s’apparier avec un autre récepteur ErbB pour pouvoir participer à la transduction du signal. Le partenaire favori de ErbB3 est le récepteur ErbB2 et le complexe ErbB2/ErbB3 provoque le plus fort signal prolifératif (Citri et al., 2003).
5. Rôles physiologiques des récepteurs ErbB
Les récepteurs ErbB sont exprimés dans des tissus d’origine épithéliale, mésenchymateuse et neuronale où ils jouent des rôles dans le développement, la prolifération et la différenciation (Olayioye et al., 2000). L’EGF et son récepteur sont aussi impliqués dans le développement
Introduction bibliographique Chapitre I : Les récepteurs à activité tyrosine kinase embryonnaire précoce et dans le renouvellement des cellules souches dans des tissus normaux comme la peau, le foie et l’intestin (Campbell and Bork, 1993; Salomon et al., 1990).
L’utilisation de modèles de souris transgéniques a permis de définir le rôle des récepteurs ErbB et de leurs ligands dans le développement de différents organes (tableau 2).
Le knockout (KO) de l’EGFR provoque la mort des souris au stade embryonnaire ou juste après la naissance. De plus, les souris invalidées du gène codant l’EGFR présentent des anomalies du développement épithélial et de différents organes tels que le cerveau, la peau, les poumons ou le tractus gastrointestinal (Miettinen et al., 1995; Sibilia et al., 1998; Sibilia and Wagner, 1995). Les souris egfr-/- présentent aussi une neurodégénérescence sévère et progressive suggérant que l’EGFR joue un rôle dans la prolifération et/ou la différenciation des astrocytes et dans la survie de neurones post-mitotiques (Sibilia et al., 1998). Des souris invalidées des gènes codant pour ErbB2 et ErbB4 présentent quant à elles des défauts du système nerveux et des anomalies du coeur provoquant la mort (Gassmann et al., 1995; Lee et al., 1995; Leu et al., 2003). De plus, l’invalidation du gène codant pour ErbB2 provoque l’arrêt du développement des oligodendrocytes et l’arrêt de la formation de myéline (Park et al., 2001). L’invalidation du gène codant pour ErbB3 provoque la mort des souris au stade embryonnaire. Cette mort est due à des défauts de formation de la valve cardiaque (Erickson et al., 1997). Les récepteurs ErbB jouent également un rôle essentiel dans l’organisme adulte. Par exemple, ils jouent un rôle important dans le développement des glandes mammaires pendant la puberté et la grossesse (Marmor et al., 2004). Des KO des gènes codant les ligands des récepteurs ErbB ont montré que les ligands jouent un rôle important dans le développement de certains organes (Normanno et al., 2006) (tableau 2). Contrairement aux KO des récepteurs ErbB, les KO des ligands des récepteurs ErbB n’induisent pas de mort embryonnaire (Normanno et al., 2006).
Des KO conditionnels ont donc confirmé l’importance des récepteurs ErbB dans le développement du système cardiovasculaire (ErbB2 en particulier), du système nerveux (ErbB3, ErbB4), des glandes mammaires ainsi que des épithéliums en général (Casalini et al., 2004; Holbro and Hynes, 2004). Chez l’adulte, ces récepteurs restent impliqués dans le fonctionnement normal de ces organes.
Cible mutée localisation des défauts
EGFR Épiderme, glande mammaire, poumon, pancréas, intestine, système nerveux central
ErbB-2 Glande mammaire, Coeur, système nerveux central
ErbB-3 Cœur, système nerveux central
ErbB-4 Glande mammaire, Coeur, système nerveux périphérique et central
EGF Prostate, système nerveux périphérique et central
TGF-α Epiderme, prostate, yeux
HB-EGF système nerveux central
AR/EGF/TGF-α Tractus gastrointestinal
Tableau 2 : conséquences biologiques de l’invalidation des gènes codant pour les récepteurs ErbB ou pour leurs ligands dans des organes. (Normanno et al., 2006)
6. Transactivation des récepteurs ErbB
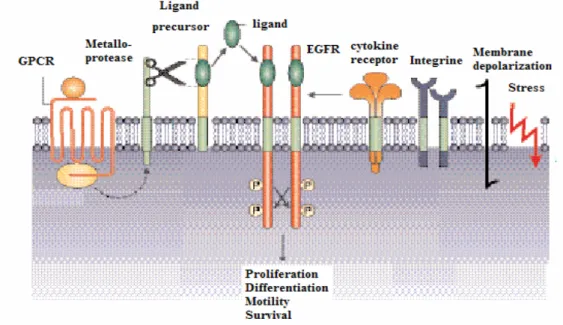
La stimulation de la phosphorylation de l’EGFR peut se produire après le traitement par des stimuli non physiologiques, incluant l’hyperosmolarité, le stress oxydatif, le stress mécanique, la lumière UV et les γ-irradiations. En complément des stimuli non physiologiques, l’activation du récepteur peut aussi être induite par les chemokines, par des molécules d’adhésion cellulaire et des RCPG (Gschwind et al., 2004) (figure 6).
Figure 6 : Activation des récepteurs ErbB indépendante du ligand, exemple de l’EGFR.
L’EGFR peut être activé par des signaux qui viennent des récepteurs aux cytokines, des intégrines, de la dépolarisation de la membrane, du stress cellulaire et des récepteurs couplés aux protéines G (RCPG). D’après (Gschwind et al., 2004)
Introduction bibliographique Chapitre I : Les récepteurs à activité tyrosine kinase
Transactivation des récepteurs ErbB par les RCPG (figure 7)
L’activation des RCPG par des agonistes tels que l’endothéline, l’acide lysophosphatidique, la bradykinine ou la thrombine peut provoquer la phosphorylation de l’EGFR permettant ainsi l’activation de voies de signalisation comme la voie des MAPK.
Figure 7: Mécanismes de transactivation des récepteurs ErbB par les RCPG . (Yarden and
Sliwkowski, 2001)
Les RCPG peuvent activer indirectement Src (probablement par l’intermédiaire de Pyk2) qui peut phosphoryler l’EGFR sur des résidus tyrosines autres que ceux phosphorylés par la kinase de l’EGFR (Arteaga et al., 2002; Carpenter, 1999). L’activation de l’EGFR dépend alors de Src. En plus des kinases Src, les kinases sérine/thréonine PKC (protéine kinase C) peuvent être impliquées dans la transactivation de l’EGFR. Dans les cardiomyocytes, les cellules PC-12 et les cellules HEK-293, la transactivation de l’EGFR est strictement dépendante de l’activité de la PKC (Fischer et al., 2003; Kodama et al., 2002; Tsai et al., 1997; Venkatakrishnan et al., 2000). Cependant, dans des systèmes cellulaires différents comme les cellules musculaires lisses, les fibroblastes cellulaires, les cellules PC-12, les concentrations intracellulaires en calcium sont nécessaires à la transactivation de l’EGFR. Dans ce cas, l’activation des récepteurs ErbB par les RCPG est dépendante du calcium intracellulaire. La tyrosine kinase Pyk2 qui pourrait être activée par le calcium serait impliquée dans la transactivation de l’EGFR (Fischer et al., 2003; Keely et al., 2000; Soltoff, 1998).
Les RCPG peuvent également activer des métalloprotéases (identifiées comme des membres de la famille ADAM) qui vont alors cliver le pro-ligand (comme la proHB-EGF), ce qui va
permettre la libération du ligand mature (comme l’HB-EGF). La libération de facteurs de croissance matures active alors l’EGFR ainsi que les voies de signalisation.
De plus, il a été montré que les hormones stéroïdiennes peuvent avoir un effet positif sur la signalisation des récepteurs ErbB en activant la transcription des gènes codant pour les ligands des récepteurs ErbB (Yarden and Sliwkowski, 2001).
De nombreuses études ont montré que la transactivation de l’EGFR se fait dans des types de cellules variées, telles que les cellules musculaires lisses, les kératinocytes, ou les cellules PC12 (Daub et al., 1997; Eguchi et al., 1998; Zwick et al., 1997).
7. Mécanismes de régulation de l’activation de l’EGFR
L’activité de l’EGFR comme celle des autres RTK doit être hautement régulée afin de permettre une activité cellulaire normale et une réponse aux nombreuses stimulations par des facteurs de croissance. En effet, une expression anormale ou un dysfonctionnement de l’EGFR est responsable de plusieurs pathologies et désordres du développement. Par conséquent, afin de permettre au signal induit par l’EGFR d’être régulé, la cellule met en place des mécanismes de régulation négative.
Dans cette partie, quatre mécanismes de régulation seront décrits: - les antagonistes de l’EGFR
- l’inhibition par les protéines tyrosines phosphatases - l’inhibition de l’activité catalytique par la PKC
- par des mécanismes d’endocytose dépendants de la clathrine 7.1. Régulation par des antagonistes de l’EGFR
Il existe des antagonistes de l’EGFR qui régulent l’activation de l’EGFR. Chez la drosophile, il existe la protéine Argos (antagoniste) qui est sécrétée par la cellule après stimulation. Argos inhibe alors l’activité de DER (homologue de l’EGFR) par compétition avec Spitz (agoniste) (Casci and Freeman, 1999). Dans les cellules de mammifères, on retrouve la décorine, un protéoglycane riche en leucines, qui agit comme un antagoniste de l’EGFR (Iozzo et al., 1999). La décorine inhibe la dimérisation et l’activation de l’EGFR.
Introduction bibliographique Chapitre I : Les récepteurs à activité tyrosine kinase
Tableau 3 : Liste des antagonistes de l’EGFR (Ledda and Paratcha, 2007).
7.2. Régulation par les protéines phosphatases
Les protéines tyrosine phosphatases (PTP) jouent un rôle important dans le contrôle de l’activité des RTK et dans les voies de signalisation qu’elles régulent. Les PTP déphosphorylent les sites de régulation du récepteur résultant alors dans l’inactivation de l’activité enzymatique du récepteur. Ainsi, la phosphatase PTP1B permet la diminution de l’activation de l’EGFR (Lammers et al., 1993). Les fibroblastes de souris déficients en PTP1B montrent une phosphorylation augmentée et sous-tenue de l’EGFR après stimulation (Haj et al., 2003). SHP1 a aussi été identifiée comme une phosphotyrosine phosphatase qui régule négativement l’EGFR. Ainsi, le recrutement de la tyrosine phosphatase SHP1 sur la Tyr1173 de l’EGFR, un site majeur d’autophosphorylation du récepteur, se traduit par la déphosphorylation du récepteur et la terminaison des signaux émis lors de sa stimulation (Keilhack et al., 1998).
Tableau 4: Protéines tyrosine phosphatases régulant l’EGFR (d’après (Ostman and Bohmer,