Université de Sherbrooke
Rôle de Calnuc dans le triage endosomial des récepteurs lysosomiaux et implication potentielle dans les maladies du lysosome
Par Heidi Larkin
Programme de pharmacologie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de philosophiae doctor (Ph.D.) en pharmacologie
Sherbrooke, Québec, Canada 21 janvier 2016
Membres du jury d’évaluation Dre. LAVOIE Christine
Directrice de recherche, Pre. Département de pharmacologie, Sherbrooke Dr. PSHEZHETSKY Alexey
Juge externe, Pr. Université de Montréal, Montréal Dr. ROUCOU Xavier
Juge interne, Pr. Département de biochimie, Sherbrooke Dr. GRANDBOIS Michel
Directeur de programme, Pr. Département de pharmacologie, Sherbrooke
R
ÉSUMÉ FRANÇAISRôle de Calnuc dans le triage endosomial des récepteurs lysosomiaux et implication potentielle dans les maladies du lysosome
Par Heidi Larkin
Programme de doctorat en pharmacologie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de philosophiae doctor (Ph.D.) en pharmacologie à la Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
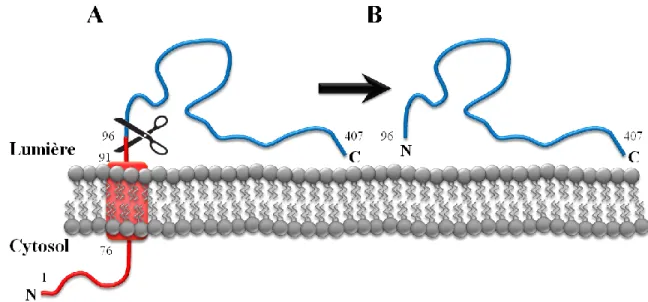
Calnuc est une protéine ubiquitaire qui lie le calcium et qui est présente au réseau trans-golgien (TGN) ainsi qu'aux endosomes. Notre groupe a précédemment mis en évidence le rôle de Calnuc dans le transport de Low density lipoprotein receptor-related protein 9 (LRP9), un récepteur aux lipoprotéines de faible densité qui cycle entre le TGN et les endosomes. Les récepteurs lysosomiaux au mannose-6-phosphate (MPR) et Sortiline sont bien caractérisés et empruntent également cette voie. À l'image de LRP9, nous avons montré que Calnuc prévient leur dégradation aux lysosomes en participant à leur recyclage à partir des endosomes vers le TGN. En fait, Calnuc est importante pour l'activation et l'association membranaire de Rab7, une petite protéine G qui recrute ensuite le complexe Rétromère responsable du transport rétrograde des récepteurs. La glycoprotéine lysosomiale Ceroid lipofuscinosis neuronal 5 (CLN5) est également impliquée dans ce processus. La structure et la fonction de cette dernière n'étant pas clairement définies, nous avons établi qu'elle est synthétisée sous forme d’une glycoprotéine transmembranaire de type II, mais son domaine N-terminal cytoplasmique et son segment transmembranaire sont rapidement éliminés suivant le clivage du peptide signal de manière à former une protéine CLN5 mature fortement associée à la membrane par une hélice amphipathique (AH). La compréhension des propriétés de base de CLN5 est particulièrement pertinente puisque la protéine est impliquées dans certaines variantes de céroïdes-lipofuscinoses neuronales (NCL), une maladie neurodégénérative rare causée par une surcharge des lysosomes. D'ailleurs, nos données indiquent que les mutants pathologiques de CLN5 dépourvus de cette AH perdent leur association membranaire, sont retenus au réticulum endoplasmique et sont rapidement dégradés. En raison de la similitude des fonctions de Calnuc et de CLN5 au niveau du triage endosomial, nous avons exploré le lien entre les deux protéines. Calnuc cytosolique et CLN5 luminale semblent former un complexe, par l'intermédiaire de la protéine transmembranaire CLN3, de façon à influencer l'activité de Rab7. CLN3 étant aussi associée aux NCL, nous avons finalement exploré la potentielle implication de Calnuc dans la maladie. L'absence de Calnuc entraîne des phénotypes cellulaires typiques des NCL comme un engorgement des lysosomes, une accumulation de matériel autofluorescent et une augmentation de l'autophagie. Les niveaux protéiques de Calnuc sont diminués dans toutes les lignées de fibroblastes de patients atteints de NCL disponibles ce qui indique que Calnuc pourrait être impliquée dans certains types de NCL. La présente thèse couvre donc la découverte de la fonction de Calnuc dans le transport intracellulaire, jusqu'à son implication potentielle dans les NCL, de même qu'une étude topologique de CLN5.
iii
R
ÉSUMÉA
NGLAISCalnuc fonction in endosomal sorting of lysosomal receptors and potential implication in lysosomal diseases
Par Heidi Larkin
Programme de doctorat en pharmacologie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de philosophiae doctor (Ph.D.) en pharmacologie à la Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
Calnuc is a ubiquitous Ca2+-binding protein present on the trans-Golgi network (TGN)
and endosomes. We previously highlighted the role of Calnuc in the transport of Low density
lipoprotein receptor-related protein 9 (LRP9), a low density lipoprotein (LDL) receptor that
cycles between the TGN and endosomes. Lysosomal receptors mannose-6-phosphate receptor (MPR) and Sortilin are well-characterized and also use the TGN-to-endosome trafficking pathway. Similarly to LPR9, we showed that Calnuc prevent their degradation in lysosomes by acting in their recycling from endosomes to the TGN. In fact, Calnuc is a important for the activation and the membrane association of Rab7, a small G protein which then recruit the Retromer complex known to be responsible for the retrograde transport of receptors. Lysosomal glycoprotein Ceroid lipofuscinosis neuronal 5 (CLN5) is also involved in this process. Because its structure and function have not yet been clearly defined, we established that it is synthesized as a type II transmembrane (TM) glycoprotein, but its cytoplasmic N-terminus and TM segment are rapidly removed following signal-peptide cleavage to generate mature CLN5 which is tightly associated to membrane through an amphipathic helix (AH). The understanding of the basic properties of CLN5 is particularly important given that CLN5 is involved in some variants of neuronal ceroid lipofuscinosis (NCL), a rare neurodegenerative disease caused by lysosomal overload. Moreover, our data indicate that CLN5 pathological mutants deprived of AH lose their membrane association, are retained in the endoplasmic reticulum, and are rapidly degraded. Based on the similarity featured by Calnuc and CLN5 in endosomal sorting, we explored the link between these two proteins. Cytosolic Calnuc and luminal CLN5 seem to form a complex, through the transmembrane protein CLN3, in order to influence the activity of Rab7. As CLN3 is also associated with NCL, we finally explored the potential involvement of Calnuc in this disease. Canuc depletion leads to typical NCL phenotypes such as lysosome enlargement, accumulation of autofluorescent material and of an increased of autophagy induction. Canuc's levels are decreased in all fibroblasts cell lines of NCL patients available indicating that Calnuc could be involved in some types of NCL. This thesis thus covers the discovery of the function of Calnuc in intracellular transport up to its potential involvement in the NCL, as well as a topological study CLN5.
À tous les étudiants qui passeront à travers ce tumultueux périple
Aux Débrouillards qui influencèrent une génération de scientifiques
Mais surtout, En mémoire de mon oncle Paul que je n'ai que trop brièvement connu
La science ne sert guère qu'à nous donner une idée de l'étendue de notre ignorance. Félicité Robert de Lamennais
T
ABLE DES MATIÈRESRÉSUMÉ FRANÇAIS ... II RÉSUMÉ ANGLAIS ... III LISTE DES FIGURES ... VIII LISTE DES TABLEAUX ... IX LISTE DES ABRÉVIATIONS ... X
INTRODUCTION ... 1
1 CALNUC ... 1
1.1 Une nouvelle protéine d’intérêt ... 1
1.2 Structure et localisation cellulaire ... 2
1.3 Homologues ... 6
1.3.1 Cab45 ... 7
1.3.2 Calréticuline ... 7
1.3.3 NUCB2 ... 8
1.4 Partenaires d’interaction, fonctions et maladies associées ... 12
1.4.1 Calcium et minéralisation ... 14
1.4.2 Protéines G et sécrétion régulée ... 16
1.4.3 ADN et lupus ... 19
1.4.4 Cancer, apoptose et Caspases ... 20
1.4.5 COX et inflammation ... 21
1.4.6 Activité de protéase à sérine ... 23
1.4.7 ATF6 et réponse au stress réticulaire ... 23
1.4.8 Necdin ... 24 1.4.9 APP et Alzheimer ... 25 1.4.10 LRP10 et transport intracellulaire ... 26 2 TRANSPORT INTRACELLULAIRE ... 27 2.1 Transport antérograde ... 27 2.1.1 Transport dépendant de M6P - MPR ... 28
2.1.2 Transport indépendant de M6P - Sortiline ... 29
2.1.3 Transport du Golgi aux endosomes ... 31
2.1.4 Système endolysosomial ... 32
2.2 Transport rétrograde ... 35
2.2.1 Transport des endosomes précoces au Golgi ... 36
2.2.2 Transport des endosomes tardifs au Golgi ... 41
2.3 Rab comme principaux régulateurs du transport intracellulaire ... 42
2.3.1 Cycle d'activation des Rab ... 42
2.3.2 Localisation des Rab ... 44
2.3.3 Fonctions des Rab dans le transport entre le Golgi et les endosomes ... 45
3 MALADIES ASSOCIÉES AUX LYSOSOMES ... 49
3.1 Lysosomes ... 49
3.2 Maladies de surcharge lysosomiale ... 51
vii
3.3.1 Causes génétiques et protéines associées ... 55
3.3.2 CLN3 ... 56
3.3.3 CLN5 ... 61
3.3.4 Interactosome des CLN ... 65
3.3.5 Aspects cliniques ... 66
4 PROBLÉMATIQUE, HYPOTHÈSE ET OBJECTIFS ... 69
4.1 Problématique ... 69 4.2 Hypothèse ... 69 4.3 Objectifs ... 70 ARTICLE 1 ... 71 RÉSUMÉ – ARTICLE 1 ... 72 ARTICLE 2 ... 111 RÉSUMÉ – ARTICLE 2 ... 112 ARTICLE 3 ... 146 RÉSUMÉ – ARTICLE 3 ... 147 DISCUSSION ... 181 CONCLUSION ... 196 REMERCIEMENTS ... 197
LISTE DES PUBLICATIONS ... 200
ANNEXE 1 ... 231
ANNEXE 2 ... 254
L
ISTE DES FIGURESFIGURE 1-STRUCTURE DE CALNUC. ... 3
FIGURE 2-COMPARAISON ENTRE CALNUC (NUCB1) ET NUCB2. ... 11
FIGURE 3-DISTRIBUTION DE CALNUC ET DE SES DIVERS PARTENAIRES D'INTERACTION. ... 13
FIGURE 4-PRINCIPAUX MÉCANISMES DE TRANSPORT ANTÉROGRADE ET RÉTROGRADE. ... 33
FIGURE 5-LES RAB COMME PRINCIPAUX RÉGULATEURS DU TRANSPORT INTRACELLULAIRE. ... 43
FIGURE 6-FORMATION ET ULTRASTRUCTURES DE LA LIPOFUSCINE. ... 54
FIGURE 7-SCHÉMA DE LA STRUCTURE DE CLN3. ... 58
FIGURE 8-SCHÉMA DE LA STRUCTURE DE CLN5. ... 62
FIGURE 9-CALNUC INTERAGIT AVEC FURINE,TRKA ET CD-MPR, MAIS PAS AVEC P75/NTR OU EGFR. ... 183
FIGURE 10-LA DÉPLÉTION DE CALNUC INFLUENCE LES NIVEAUX DE CI-MPR,FURINE, CD-MPR ET EGFR. ... 184
FIGURE 11-RÔLES POTENTIELS DE CALNUC DANS LE CYCLE D'ACTIVATION DES RAB. ... 185
FIGURE 12-MODÈLE DU COMPLEXE CALNUC-CLN3-CLN5 INFLUENÇANT LE RECRUTEMENT DE RAB7 ET DU COMPLEXE RÉTROMÈRE. ... 192
L
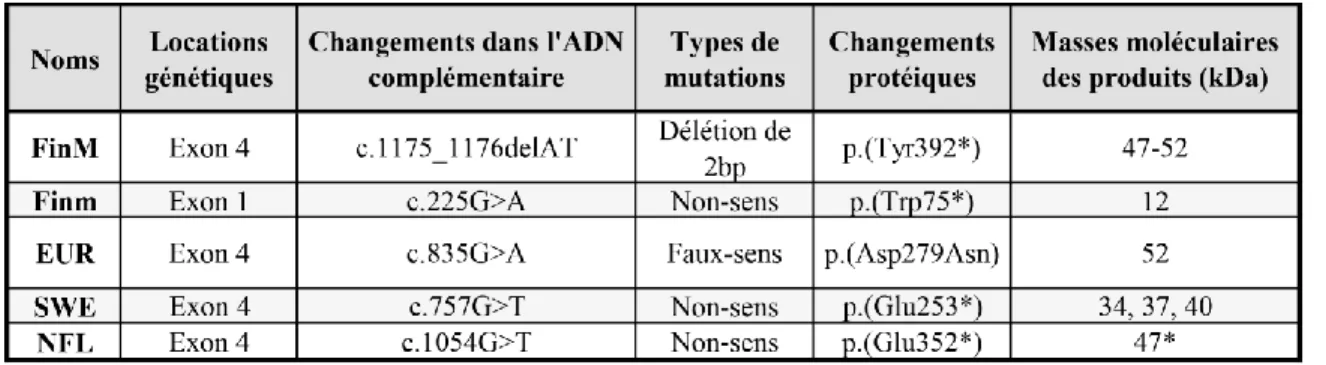
ISTE DES TABLEAUXTABLEAU 1-PATHOLOGIE DES NCL. ... 56 TABLEAU 2-PRINCIPALES MUTATIONS DANS CLN5. ... 65
L
ISTE DES ABRÉVIATIONSA
aa, Acide aminé
AA, Acide arachidonique
AAK1, Adaptor-associated protein kinase 1 ACTH, Hormone adrénocorticotropine ADN, Acide désoxyribonucléique AICD, Domaine intracellulaire d’APP AP, Adaptator protein
ApoE, Apolipoprotéine E
APP, Protéine précurseur de la β-amyloïde AR, Région acide (Acidic region)
Arf-1, ADP-ribosylation factor-binding protein 1 ARN, Acide ribonucléique
ARNm, ARN messager
ARTS-1, Aminopeptidase regulator of TNRF1 shedding ASM, Sphingomyélinase
ATF6, Activating transcription factor 6
ATP13A2, Probable cation-transporting ATPase 13A2 Aβ, Peptide β-amyloïde
B
BACE1, ß-sécrétase
BAR, Bin-Amphiphysine-Rvs Btn, Battenine
BCMP84, Breast cancer membrane protein BDNF, Brain derived neurotrophic factor BR, Région basique (Basic region) C
Ca2+, Calcium
Cab45, 45 kDa calcium-binding protein Casp, Caspase
CCDC53, Coiled-coil domain-containing protein 53 CD-MPR, Cation-dependant MPR
CerS, Ceramide synthase
CI-MPR, Cation-independant MPR CL, Curviligne
CLC-7, Chloride channel 7
CLEAR, Coordinated Lysosomal Expression And Regulation CLN, Ceroid lipofuscinosis neuronal
xi CMH, Complexe majeur d'histocompatibilité
COG, Conserved oligomeric Golgi
CORVET, Class C core vacuole/endosome tethering COX, Cyclooxygénase
CPY, Carboxypeptidase Y Creg1, E1A-stimulated genes 1 CRH, Corticolibérine
CRT, Caréticuline
CSP, Cysteine string protein CTF, Fragment C-terminal CTSB, Cathepsine B CTSD, Cathepsine D CTSF, Cathepsine F
CUB, Complement C1r/C1s, Uegf, Bmp1 D
DIC, Chaîne intermédiaire de la Dynéine DMT1, Divalent metal transporter 1
DNAJC5, DnaJ homolog subfamily C member 5 E
E1A, Adenovirus early region 1A protein EEA1, Early endosome antigen 1
EF, Main EF (EF-hand)
EHD1, EH domain-containing protein 1 ENT1, Equilibrative nucleoside transporter 1
ERC55, Endoplasmic reticulum calcium-binding protein of 55 kDa ERSE, Élément de réponse au stress réticulaire
EUR, Européenne F
FAAH, Amidohydrolase des acides gras
Fe65, Amyloid beta A4 precursor protein-binding family B member 1 FinM, Finlandaise majeure
Finm, Finlandaise mineure
FP, Empreinte digitale (fingerprint)
FYCO1, FYVE and coiled-coil domain–containing protein 1 G
GAE, Gamma-adaptin ear
GAP, Protéine d’accélération de la GTPase
GAPvD1, GTPase activating protein and VPS9 domains 1 GARP, Golgi-associated retrograde protein
GAT, GGA and TOM
xii GDI, Inhibiteur de la séparation des nucléotides de guanine
GDP, Guanosine diphosphate
GEF, Facteur d’échange des nucléotides de guanine
GGA, Golgi-localized, gamma-ear containing Arf binding protein GGT, Geranylgeranyl transférase
GM, Granulocyte/monocyte colony stimulation factor GM130, Golgi matrix protein 130
GPCR, Récepteur couplé aux protéines G GPI, Glycosylphosphatidyl inositol GROD, Granular osmiophilic deposit GRN, Granulins precursor
GTP, Guanosine triphosphate H
HOPS, Homotypic fusion and vacuole protein sorting Hpse, Héparanase
Hsc70, Heat shock cognate protein 70 I
IGF-2, Insulin-like growth factor-2 IgG, Immunoglobuline G
J
JNK, Jun N-terminal kinase K
KCTD7, Potassium channel tetramerisation domain containing 7 Kd, Constante de dissociation
KIF3A, Kinesin Family Member 3A L
LAMP, Lysosome-associated membrane protein
LC3, Microtubule-associated protein 1A/1B-light chain 3 LD, Gouttelette lipidique (Lipid droplet)
LDL-A, Répétition de classe A
LDLR, Récepteur aux lipoprotéines de faible densité LIMP, Lysosomal integral membrane protein
Lpl, Lipoprotein lipase
LRP, Low density lipoprotein receptor-related protein
LSD, Maladie de surcharge lysosomiale (Lysosomal storage disease) LYNUS, Lysosome nutrient sensing
LysoNaATP, canal sodique ATP-sensible
LZ, Fermeture/Glissière en leucine (Leucine zipper) M
M6P, Mannose-6-phosphate Man2b1, α-Mannosidase B1
xiii MFSD8, Major facilitator superfamily domain-containing protein 8
Mg2+, Magnésium
MPR, Récepteur au mannose-6-phosphate (Mannose-6-phosphate receptor) mTORC1, Mammalian target of rapamycin complex 1
N
NCL, Céroïde-lipofuscinose neuronale (Neuronal ceroid lipofuscinose) Necdin, Neurally differentiated embryonal carcinoma-derived protein NEFA, DNA binding, EF-hand, acidic region
Nesfatin, NEFA/NUCB2-encoded satiety- and fat-influencing protein NFL, Terre-Neuve
NGF, Nerve growth factor NLP, Nesfatin-1-like peptide
NLS, Signal de localisation nucléaire (Nuclear localisation signal) NPC1, Niemann-Pick C1 protein NSF, N-éthylmaleimide-sensitive-factor NT, Neurotensine NTR3, Neurotensin receptor 3 NUC, Nucleobindin NUCB1, Calnuc O
OCRL1, Lowe oculocerebrorenal syndrome protein ou Inositol polyphosphate 5-phosphatase
ORP1L, Oxysterol‐binding protein P
PAI-2, Inhibiteur 2 de l’activateur du Plasminogène (Plasminogen activator inhibitor-2) PAT, Perilipine, Adipophiline, TIP47
PC, Prohormone convertase
PDZ, Postsynaptic density 95/discs large/zonus occludens-1 PG, Prostaglandine
PI(3)P, Phosphatidylinositol-3-phosphate
PI(4,5)P2, Phosphatidylinositol-4,5-bisphosphate PI, Phosphatidylinositol
PI3K, Phosphatidylinositol-3-kinase
PPAR-g, Peroxisome proliferator-activated receptor gamma pRB, Retinoblastoma protein
Protéine G, Guanosine nucleotide-binding protein Psap, Prosaposine
PX, Phox homology R
RAB11FIP2, RAB11 family-interacting protein 2 REP, Protéine escorte de Rab
xiv RhoBTB3, Rho-related BR-C, ttk and bab (BTB) domain-containing protein 3
RL, Rectiligne
RILP, Rab7-interacting lysosomal protein
RT-PCR, Transcription inverse combinées à des réactions en chaîne par polymérase S
S1P, Site-1-protease
SAP, Saposine ou Sphingolipid activator protein
SBDS, Shwachmann-Bodian-Diamond syndrome protein SCMAS, Sous-unité C de l'ATP synthase mitochondriale SDF4, Stromal cell derived factor
SERCA, Sarco/endoplasmic reticulum Ca2+-ATPase shRNA, Petits ARN en épingle à cheveux
siRNA, Petits ARN interférents SLC29, Solute carrier family 29 SNAP, NSF attachment protein
SNARE, Soluble N-éthylmaleimide-sensitive-factor (NSF) attachment protein (SNAP) receptor SNX, Sorting Nexin
SorLA, Sorting protein-related receptor containing LDLR class A repeats SP, Peptide signal (Signal peptide)
sp1, Specificity protein 1
SRP, Particule de reconnaissance du signal (Signal recognition particule) SWE, Suédoise
SV40-TAg, Simian Vacuolating Virus 40 large T antigen SWIP, Strumpellin and WASH-interacting protein
T
TAA, Antigène associé aux tumeurs
TBC1D5, Tre2-Bub2-Cdc16-domain-containing protein TFEB, Facteur de transcription EB
TfR, Transferrin receptor
TGN, Réseau trans-golgien (trans Golgi network) TIP47, Tail interacting protein of 47 kDa
Tip60, 60 kDa Tat-interactive protein TNF, Tumor necrosis factor
TNFR1, Tumor necrosis factor receptor 1 TPP1, Tripeptidyl peptidase I
TRAPP, Transport protein particle
TRPML1, Transient receptor potential cation channel, mucolipin subfamily, member 1 U
uPAR, Récepteur de l'Urokinase UPR, Unfold protein response UPRE-like, UPR element-like
xv V
VAMP, Vesicule-associated membrane protein VHS, Vps27, Hrs, Stam
Vps, Protéine de triage vacuolaire (Vacuolar protein sorting) W
WASH, Wiskott–Aldrich Syndrome protein (WASP) and Suppressor of cAR (cAMP receptor) (SCAR) homologue
WASP, Wiskott–Aldrich Syndrome protein Z
ZBD, Domaine de liaison au zinc (Zinc-binding domain) Zn2+, Zinc
Autres
β2-AR, Récepteur bêta-adrénergique Ø, Résidu hydrophobe encombrant Φ, Résidu aromatique
I
NTRODUCTIONLe transport des hydrolases acides jusqu’aux lysosomes nécessite leur triage, dans le réseau trans-golgien (TGN), par des récepteurs tels que le Récepteur au mannose-6-phosphate (MPR) et Sortiline. Ces derniers permettent l’empaquetage des enzymes dans des vésicules de clathrine puis leur transport antérograde du TGN vers les endosomes. Dans l’environnement acide des endosomes, les hydrolases se dissocient des récepteurs et sont acheminées aux lysosomes pour assurer la dégradation des macromolécules dispensables à la cellule tandis que les récepteurs sont redirigés vers le TGN pour un nouveau cycle de transport. Ce transport rétrograde requiert de nombreuses protéines dont le complexe Rétromère et la protéine Ceroid lipofuscinosis neuronal 5 (CLN5). L’ensemble des mécanismes de régulation du triage endosomial est essentiel pour maintenir la fonction lysosomiale. En effet, un défaut à ce niveau influence la livraison des hydrolases aux lysosomes, causant une accumulation intracellulaire de métabolites qui sont caractéristiques des maladies de désordres lysosomiaux, comme les céroïdes-lipofuscinoses neuronales (NCL).
Nous avons récemment démontré l’implication de Calnuc dans le triage rétrograde de Low density lipoprotein receptor-related protein 9 (LRP9), un récepteur peu caractérisé qui cycle entre le TGN et les endosomes. Le but de la présente étude est, dans un premier temps, de démontrer que Calnuc agit comme régulateur général du transport rétrograde des récepteurs des enzymes lysosomiales, CI-MPR et Sortiline. D’autre part, nous examinerons le rôle de Calnuc dans les désordres lysosomiaux de type NCL.
1 Calnuc
1.1 Une nouvelle protéine d’intérêt
Calnuc a été isolée en 1986 à partir d’un surnageant de lymphocytes B issu d’un modèle murin (MRL/lpr) de lupus érythémateux disséminé, une maladie systémique auto-immune chronique (Kanai et al., 1986). Originalement nommée Nucleobindin (NUC) en
2 raison de sa capacité à lier l’acide désoxyribonucléique (ADN) in vitro (Miura et al., 1992), Calnuc a alors été identifiée alors comme une protéine soluble de 55 kDa promouvant la formation d’anticorps dirigés contre l’ADN (Kanai et al., 1990; Kanai et al., 1986).
Les études subséquentes ont permis de démontrer que Calnuc est hautement répandue dans le règne animal étant présente de Ciona intestinalis à Homo sapiens (Kanuru et al., 2009). L’analyse de sa structure primaire révèle que les différents domaines sont bien conservés à l’intérieur d’espèces rapprochées d’un point de vue évolutif indiquant que la protéine doit maintenir ses fonctions. Aussi, sa séquence est davantage conservée chez les organismes supérieurs qui présentent deux isoformes. Ces derniers, codés par des loci géniques indépendants, proviendraient de la duplication d’un gène ancestral, modifié au travers de l’évolution.
Par contre, malgré une structure protéique conservée, le gène codant Calnuc est considérablement variable, suivant la complexité de l’organisme, en ce qui concerne son organisation ainsi que sa quantité d’exons et d’introns (Aradhyam et al., 2010). Chez l’humain, le gène qui code NUCB1 est localisé au niveau du chromosome 19q13.2-q13.4 et est composé de 13 exons dont 12 codants (Miura et al., 1996). La région en amont contient des promoteurs communs aux gènes ubiquitaires nécessaires pour le maintien de la fonction cellulaire de base comme des sites de liaison pour le facteur de transcription Specificity protein 1 (sp1), une boîte CCAAT, une boîte TATA et plusieurs sites d’initiation (Miura et al., 1996). D’ailleurs, Calnuc est exprimée dans tous les tissus et cellules humains investigués jusqu’à présent (Lin et al., 1998; Miura et al., 1996). Le caractère ubiquitaire de Calnuc laisse croire qu’elle aurait un rôle important dans la maintenance de la machinerie cellulaire.
1.2 Structure et localisation cellulaire
La forme humaine de Calnuc compte 461 acides aminés arrangés en structure principalement hélicoïdale (Kanuru et al., 2009; Miura et al., 1994). La partie N-terminale est compacte et globulaire alors que la partie C-terminale est allongée (Kapoor et al., 2010).
3 Calnuc contient, dans sa séquence, plusieurs motifs et domaines (figure 1) (Ren et al., 2009), dont certains qui influencent sa localisation cellulaire faisant d’elle une protéine modulaire multicompartimentale.
Figure 1 - Structure de Calnuc.
Représentation des différents éléments structuraux de Calnuc à l'échelle. SP (peptide signal), BR (région basique), AR (région acide), LZ (fermeture en leucine), ZBD (domaine de liaison au zinc), NLS (signal de localisation nucléaire), EF (main EF). Figure crée avec DOG 2.0, DOG 1.0 : Illustrator of Protein Domain Structures. Ren et al. Cell Research (2009) 19:271-273.
Entre autres, elle possède un signal bipartite de localisation nucléaire (NLS) (figure 1) (Dingwall and Laskey, 1991) suggérant sa présence au noyau (figure 3A) (Miura et al., 1994; Wang et al., 1994). En effet, ce motif basique est reconnu par des Importines et permet le transport à travers les pores du noyau. Il se trouve d’ailleurs dans 50% des protéines nucléaires contre seulement 5% des protéines non nucléaires (Petersson et al., 2004). Quoiqu’allant de pair avec la capacité de Calnuc à lier l’ADN, cette localisation est encore aujourd’hui controversée.
Aussi, la séquence de Calnuc débute par un peptide signal (SP) de 26 acides aminés (figure 1). Cette structure tripartite au cœur hydrophobe se lie à la Particule de reconnaissance du signal (SRP) ce qui permet l’adressage au réticulum endoplasmique lors de la traduction (figure 3A). Calnuc est donc synthétisée au niveau de la lumière du réticulum endoplasmique, à travers le Translocon, et subit le clivage de son SP par une peptidase signal. Rapidement, la protéine est transportée au Golgi (figure 3A), probablement via un récepteur encore inconnu et par un mécanisme dépendant de sa proline
4 en position 28 (figure 1) (Tsukumo et al., 2009). À cet endroit, Calnuc va subir des modifications post-traductionnelles, dont des O-glycosylations, des sialylations et des sulfatations, la faisant passer de 60 à 63 kDa (Lavoie et al., 2002; Tsukumo et al., 2007).
La particularité principale de Calnuc, est de posséder deux mains EF (figure 1) qui lui permettent de lier le calcium (Ca2+). Ces motifs sont constitués d’une hélice alpha (notée ‘E’), d’une boucle et d’une seconde hélice α (notée ‘F’). L’ion est maintenu par la boucle qui forme une pochette de liaison composée d’atomes d’oxygène de la chaîne latérale (positions 1, 3, 5, 12), la chaîne principale (position 7) et une molécule d’eau (position 9). Un résidu hydrophobe (position 8) et une glycine (position 6) sont également nécessaires (Kretsinger, 1987). La première main EF (EF1) de Calnuc présente ce profil idéal et lui confère une forte affinité pour le calcium avec une constante de dissociation (Kd1) de 6,3
µM. Quant à elle, la seconde main (EF2) possède une arginine en position 6 nuisant considérablement à la liaison du calcium (Kd2 = 73,5 µM) (Lin et al., 1999). Globalement,
Calnuc lie donc le calcium avec une faible capacité (~1,1 µmol Ca2+/µmol de protéines) et
une haute affinité (Kd = 6,6 μM) dans un compartiment comme le Golgi qui est riche en cet
ion (0,3 mM). La liaison du calcium entraîne une augmentation du contenu hélicoïdal de Calnuc de 3,3% (Miura et al., 1994) (pouvant potentiellement représenter une hélice allant jusqu'à 15 acides aminés) de même que l’exposition de sites hydrophobes ayant le potentiel d'influencer des interactions avec d’autres protéines. Il est à noter que le magnésium (Mg2+) peut également se lier faiblement au niveau des mains EF (Kd en millimolaire) (Kanuru et
al., 2009). En revanche, les changements structuraux engendrés par ce dernier sont deux fois moindres que ceux observés avec le calcium et les deux ions semblent avoir un effet synergique (Kanuru et al., 2009). Il a été proposé que le magnésium aurait pour rôle de maintenir une conformation intermédiaire facilitant la liaison du calcium (Gifford et al., 2007). En 2012, une étude a révélé la présence de deux sites putatifs conservés pour la liaison de zinc (Zn2+) en N-terminal de Calnuc (figure 1) (Kanuru et al., 2013). Ces motifs HXXEXnH (où n correspond à 108-135 résidus) sont similaires à ceux retrouvés chez les
protéases de type carboxypeptidase A. Par contre, Calnuc est dénuée d’une telle activité catalytique qui dépend de plus amples résidus. La liaison du zinc est de haute affinité (Kd =
5 et le milieu extracellulaire (concentration de l'ordre du micromolaire), mais insuffisante pour la faible concentration du cytosol (concentration de l'ordre du picomolaire). Il en résulte un changement de conformation qui expose la surface hydrophobe de Calnuc, de façon indépendante du calcium (Kanuru et al., 2013). Les variations intracellulaires de zinc, mais aussi de calcium et de magnésium, pourraient donc s’avérer primordiales pour modifier la conformation structurale de Calnuc de manière à moduler ses fonctions.
En C-terminal, Calnuc possède également une glissière en leucines (LZ) (figure 1) (Kanai and Tanuma, 1992; Miura et al., 1992) caractérisée par une hélice alpha qui présente des leucines à intervalle de sept résidus. Ces dernières sont orientées du même côté de manière à former, avec les résidus non polaires adjacents, une région hydrophobe longitudinale qui peut s’enrouler autour d’une autre hélice de même nature. Cette structure tridimensionnelle permet normalement de lier l’ADN et, par conséquent, est principalement retrouvée au niveau des facteurs de transcription comme Fos et Jun. Quoique Calnuc possède également un signal de localisation nucléaire et une région basique de liaison potentielle à l’ADN (figure 1), aucune évidence n’a démontré son rôle comme régulateur de l’expression génique. La glissière en leucines de Calnuc lui permet de dimériser (Kanuru et al., 2009; Kapoor et al., 2010) tout en constituant un site potentiel pour lier diverses protéines. D'ailleurs, elle a été proposée comme élément permettant à Calnuc de se fixer à la membrane du Golgi via des interactions protéiques.
D’autres mécanismes, on été proposés comme étant responsables de la rétention de Calnuc au Golgi. Entre autres, Calnuc possède une région de 15 résidus hydrophobes en C-terminal (figure 1) (Lin et al., 1998) qui pourrait, comme c’est le cas pour Synaptobrevin, suffire à son ancrage (Kutay et al., 1993; Whitley et al., 1996). Le point isoélectrique de 4,9 de la protéine suggère qu’elle est fortement liée à la membrane de l’organite empêchant son extraction par des traitements alcalins. Finalement, en 2001, un groupe a démontré qu’une région riche en leucines et en isoleucines située en N-terminal (acides aminés (aa) 67-120) (figure 1) est essentielle pour le maintien de la protéine au Golgi (Nesselhut et al., 2001). Calnuc est donc retenue au Golgi faisant d’elle une protéine résidente (Lin et al., 1998). C’est d’ailleurs à cet endroit qu’on la retrouve principalement et, de manière plus marquée,
6 au niveau du réseau cis-golgien et du cis-Golgi (Lin et al., 1998). Elle représente environ 0,4% (3,8 g/mg) des protéines golgiennes chez les cellules de foie de rat (Lin et al., 1999) faisant d'elle la protéine soluble la plus abondante du compartiment (Gilchrist et al., 2006). Calnuc va demeurer dans l'organite jusqu’à 24h avant d’être sécrétée par les voies constitutive et constitutive-like (Lavoie et al., 2002) pour se retrouver dans le milieu extracellulaire (figure 3A).
Outre sa localisation au niveau de la voie sécrétoire et au niveau extracellulaire, Calnuc se retrouve aussi dans le cytosol, plus particulièrement à la surface du Golgi, de la membrane plasmique, des endosomes et des granules de sécrétion (figure 3A) (Brodeur et al., 2009; Lin et al., 2009). Cette localisation au cytoplasme est quelque peu inhabituelle pour une protéine possédant un peptide signal, mais peut s’expliquer par deux hypothèses. D’abord, Calnuc pourrait subir une rétrotranslocation vers le cytoplasme via le Translocon, comme c’est le cas pour Calréticuline (Afshar et al., 2005). D’autres protéines liant le Ca2+, dont la Phospholipase A2, peuvent transloquer au Golgi en réponse à des variations du Ca2+ cytosolique (Evans et al., 2001). Aussi, il est possible que la reconnaissance du peptide signal de Calnuc fasse parfois défaut ce qui préviendrait l’insertion de Calnuc dans la lumière du RE et mènerait à sa synthèse au niveau du cytosol. C’est d’ailleurs le cas pour l’Inhibiteur 2 de l’activateur du Plasminogène (PAI-2) qui subit une translocation variable (Belin et al., 1996). La différence de mobilité de Calnuc lors de fractionnements suggère l’ajout de modifications post-traductionnelles distinctes en fonction de la localisation ce qui suggère une régulation du peptide signal (Lin et al., 2000).
1.3 Homologues
L'homologie entre protéines est d'une grande utilité afin d'identifier des domaines et motifs d'intérêt qui apportent des indices relativement aux fonctions et interactions protéiques. Calnuc possède peu de similarité avec d'autres protéines si ce n'est avec son paralogue NUCB2 ainsi qu'avec deux autres protéines liant le calcium, soit Cab45 et Calréticuline.
7
1.3.1 Cab45
Tout comme Calnuc, 45 kDa calcium-binding protein (Cab45), aussi connu sous le nom de Stromal cell derived factor (SDF4), est une protéine soluble résidente du Golgi qui lie le calcium (Scherer et al., 1996). L'ion est nécessaire à sa rétention au Golgi et ses 362 acides aminés contiennent six mains EF (Koivu et al., 1997). Cab45 lie des cargos de façon dépendante du calcium et permet leur triage au TGN vers la voie de sécrétion (von Blume et al., 2012). Elle pourrait aussi être nécessaire pour l'homéostasie calcique, d'autant plus qu'elle présente une forte homologie avec les protéines Réticulocalbine et Endoplasmic reticulum calcium-binding protein of 55 kDa (ERC55) qui lient le calcium au RE (Scherer et al., 1996). Aussi, Cab45 possède environ 30% de similarité, mais aucune homologie marquée, avec Calnuc à l'exception d'une courte séquence AANXE (E/D) (Lin et al., 1998).
1.3.2 Calréticuline
Caréticuline (CRT) est une protéine chaperonne soluble qui interagit avec les protéines mal repliées de manière à prévenir leur export du RE. Malgré l'absence de mains EF dans sa séquence, elle lie également le calcium avec une faible affinité et une haute capacité pour en faire une réserve mobilisable au niveau du même organite. Calnuc a une homologie de séquence considérable de 30% avec CRT de rat (Lin et al., 1998). La similarité la plus importante (43%) se trouve dans la région C-terminale qui présente beaucoup de résidus acides et deux motifs conservés AY(I/A)EE et QRLX(Q/E)E(I/E)E de fonction inconnue (Lin et al., 1998). Caractéristique de la famille des lectines, le domaine P (riche en prolines) de CRT contient trois motifs hélice-boucle-hélice (Michalak et al., 1996) et est semblable (36%) aux mains EF de Calnuc (Lin et al., 1998) alors que la région N-terminale présente moins de similarités (26%) (Lin et al., 1998). Par contre, plusieurs motifs d'importance de CRT sont absents chez Calnuc comme les trois répétitions NPD/E, le motif KPEDWD typique de la famille Calnexine/Calréticuline (Nash et al., 1994) et le motif KDEL de rétention au RE expliquant leur divergence de localisation (Lin et al., 1998). Il est à noter que CRT peut également être sécrétée par les odontoblastes (Somogyi
8 et al., 2003) et inhiberait la minéralisation (St-Arnaud et al., 1995). Comme nous le vérrons ultérieurement, Calnuc aurrait également une fonction au niveau des os.
1.3.3 NUCB2
En 1994, le groupe de Hilschmann a identifié une protéine de 55 kDa hautement homologue à Calnuc et possédant 61,56% d'identité (Barnikol-Watanabe et al., 1994; Karabinos et al., 1996). Nommée alors DNA binding, EF-hand, acidic region (NEFA), cette dernière fut rebaptisée NUCB2 étant probablement un isoforme de Calnuc (NUCB1). Une analyse rapide par le programme 'Lalign' confirme 61,4% d'identité et 81,9% de similarité sur 415 acides aminés des séquences humaines (figure 2A). Les deux protéines coexistent uniquement chez les organismes supérieurs et sont issues de loci géniques différents (19q13.2-q13.4 et 11p15.1-p14) suggérant qu'elles ont évolué à partir d'un gène ancestral commun modifié au travers l’évolution. En effet, les protéines à mains EF sont formées à partir d'un précurseur eucaryotique à un domaine nommé CTER (Nakayama et al., 1992). Ce dernier s'est ensuite transformé en un dérivé à quatre domaines duquel, selon l'analyse phylogénétique, originent Calnuc et NUCB2 (Karabinos et al., 1996). Il serait responsable de la présence de domaines fonctionnels communs dont le SP, le NLS, le LZ, la région acide et évidemment les mains EF (figure 2A). Chez NUCB2, ces dernières lient le calcium avec des kd de 0,08 μM et 0,2 μM permettant une capacité deux fois supérieure à Calnuc (2 μmol Ca2+/μmol protéine) et une augmentation quatre fois supérieure (13%) du contenu hélicoïdal (Kroll et al., 1999). Les deux protéines sont divergentes au niveau des régions N-terminale et C-terminal ainsi qu'au niveau du LZ, mais la principale différence réside dans le fait que, comparée à NUCB2, Calnuc a une extension d'environ 40 résidus (figure 2A).
Les variations entre Calnuc et NUCB2 ne sont pas sans rappeler que les deux protéines ont acquis, au travers leurs 830 millions d'années d'évolution indépendante (Gu, 1998), des différences induisant l'apparition de fonctions distinctes. D'ailleurs, jusqu'à présent les études portant sur NUCB2 mettent en lumière des rôles très divergents de ceux attribués à Calnuc. Entre autres, il a été montré que l'association, dépendante du calcium, de
9 NUCB2 avec le Aminopeptidase regulator of TNRF1 shedding (ARTS-1), au niveau des vésicules exosome-like, est nécessaire pour promouvoir la relâche extracellulaire du Tumor necrosis factor (TNF) receptor 1 (TNFR1) (Islam et al., 2006). Ce dernier peut alors moduler l'effet de la cytokine TNF dans une foule de processus tels que l'inflammation, les fonctions immunitaires et l'apoptose, ainsi que dans les pathologies associées comme l'arthrite, le cancer et la sclérose en plaque.
Pratiquement au même moment, NUCB2 a été identifiée comme protéine régulée par le récepteur nucléaire Peroxisome proliferator-activated receptor gamma (PPAR-g) qui contrôle l'homéostasie du glucose et des lipides de même que la prise de nourriture (Oh et al., 2006). NUCB2 agit d'ailleurs comme suppresseur de l'appétit. La présence de plusieurs fragments de NUCB2 ainsi que de sites de clivages conservés pour les prohormones convertases (PC) a indiqué aux auteurs de l'étude que NUCB2 pourrait être à l'origine de plusieurs peptides bioactifs (Oh et al., 2006). Basé sur le motif consensus R/K–Xn–R/K↓ (où X est un acide aminé, n est le nombre de résidus espaceurs (soit 0, 2, 4 ou 6) et ↓ est le site de clivage) (Seidah and Chretien, 1999), NUCB2 serait divisé en trois fragments. Suivant la nouvelle fonction de NUCB2, ils ont été nommés NEFA/NUCB2-encoded satiety- and fat-influencing protein (Nesfatin)-1 (résidus 1-82), Nesfatin-2 (résidus 85-163) et Nesfatin-3 (résidus 166-396) (figure 2B) (Oh et al., 2006). Nesfatin-1 a été montré comme étant responsable de l'effet anorexigénique et son clivage, vraisemblablement par PC1/3 et PC2, est nécessaire à cette fonction (Oh et al., 2006). En effet, l'injection centrale (intracérébroventriculaire) ou périphérique de Nesfatin-1 réduit de façon significative la prise de nourriture chez les rongeurs (Goebel et al., 2011; Oh et al., 2006; Stengel et al., 2010) alors que le jeûne diminue l'expression de l'acide ribonucléique messager (ARNm) de NUCB2 dans les glandes endocrines gastriques (Stengel et al., 2009). Le mécanisme qui sous-tend l'effet anorexigénique demeure nébuleux et serait indépendant de la voie de la Leptine (Oh et al., 2006; Shimizu et al., 2009), dépendant de celle de la Mélanocortine (Oh et al., 2006) et potentiellement médié par celles de l'Oxytocine (Maejima et al., 2009) et de la Corticolibérine (CRH). Actuellement, Nesfatin-1 est l'objet d'un engouement pour son potentiel dans le traitement de l'obésité. Son fragment central de 30 résidus (M30) (figure
10 2B), responsable de l'effet anorectique (Shimizu et al., 2009), constitue un modèle pour la conception rationnelle d'analogues thérapeutiques. Nesfatin-1 aurait également un effet anti-hyperglycémique insulino-dépendant chez les souris obèses hyperglycémiques (Su et al., 2010) indiquant un potentiel rôle dans la pathogenèse du diabète. L'expression de Nesfatin-1 dans les tissus adipeux est augmentée par une diète induisant l'obésité alors que la privation de nourriture a l'effet contraire (Ramanjaneya et al., 2010). On observe aussi une diminution des niveaux plasmatique Nesfatin-1 chez les patients à jeun atteints de diabète de type 2 (Li et al., 2010). De plus amples études seront nécessaires pour comprendre la fonction de Nesfatin-1 dans cette maladie. Les voies responsables du contrôle de la masse corporelle sont généralement impliquées dans la puberté et la fertilité. Ces phénomènes ont rapidement été associés à Nesfatin-1 qui est exprimée dans les gonades (Garcia-Galiano et al., 2012). Dans ce sens, l'expression hypothalamique de NUCB2/nesfatin-1 augmente pendant la puberté et sa diminution retarde les signes de puberté et diminue les niveaux circulant de LH chez les rats femelles (Garcia-Galiano et al., 2010; Garcia-Galiano and Tena-Sempere, 2013).
Nesfatin-1 fait également partie des neuropeptides qui participent à la création de la réponse au stress (Emmerzaal and Kozicz, ; Merali et al., 2008). L'injection centrale de Nesfatin-1 entraîne une élévation des niveaux circulant de composantes majeures de l'axe hypothalamo-hypophyso-surrénalien, soit l'axe du stress, comme l'hormone Adrénocorticotropine (ACTH) et la Corticostérone (Konczol et al., 2010; Yoshida et al., 2010). On observe également une modulation de la réponse cardiovasculaire, dont de l'hypertension, via la voie Oxytocine-Mélanocortine (Yosten and Samson, 2009; Yosten and Samson, 2010; Yosten and Samson, 2013; Yosten and Samson, 2014).
Tout comme Calnuc, NUCB2 est localisée au niveau extracellulaire et intracellulaire, dans le cytosol et au Golgi (Lavoie et al., 2002; Morel-Huaux et al., 2002). Il a été proposé que, tout comme Calnuc (voir section 'Calcium et minéralisation'), NUCB2 formerait une
réserve de calcium mobilisable par agoniste (Kalnina et al., 2009). De son côté, Nesfatin-1 est dépourvu de mains EF, mais serait tout de même impliqué dans l'homéostasie calcique en induisant une augmentation intracellulaire de l'ion via les canaux de type L, N ou P/Q
11 Figure 2 - Comparaison entre Calnuc (NUCB1) et NUCB2.
(A) Alignement des séquences humaines de NUCB1 et NUCB2 marquant le degré de conservation des acides aminés selon l'échelle allant du rouge au bleu, où rouge (10)
12 représente une forte conservation et bleu (0) une faible conservation. Figure crée avec PRALINE multiple sequence alignment (http://www.ibi.vu.nl/programs/pralinewww). (B) Représentations à l'échelle de NUCB1, tel que présenté en figure 1, et de NUCB2 avec ses différents fragments (incluant le SP). Les domaines de Nesfatin-1 sont également représentés. Figure crée avec DOG 2.0, DOG 1.0 : Illustrator of Protein Domain Structures. Ren et al. Cell Research (2009) 19:271-273.
(Brailoiu et al., 2007). Cet effet est bloqué par la toxine pertussique indiquant qu'un récepteur couplé aux protéines Gi/o serait également impliqué. GPCR12, GPCR3 et GPCR6 sont les principaux candidats (Osei-Hyiaman, 2011), mais jusqu'à présent Nesfatin-1 demeure considérée comme un peptide bioactif orphelin.
Récemment, le groupe d'Unniappan, a démontré que Calnuc contient potentiellement un peptide de 77 acides aminés hautement similaire à Nesfatin-1 et surtout, à la région biologiquement active M30 (identité 76,6%) (Ramesh et al., 2015). Ce dernier, nommé Nesfatin-1-like peptide (NLP), est localisé après le SP et est flanqué de sites potentiels de clivage par des convertases de prohormones (sites Lys-Arg) (Ramesh et al., 2015). Des expériences de transcription inverse combinées à des réactions en chaîne par polymérase (RT-PCR) et des expériences d'immunoréactivités ont révélé que le pancréas, et plus particulièrement les cellules bêta productrices d'insuline dans les îlots de Langerhans, sont des sources de Calnuc et possiblement de NLP (Ramesh et al., 2015; Williams et al., 2014). De plus, l'incubation de ces cellules avec du NLP synthétique (10 et 100 nM) démontre une activité insulinotropique à forte concentration de glucose (Ramesh et al., 2015). Cette étude laisse croire que les deux Nucléobindin sont des précurseurs de peptides biologiquement actifs.
1.4 Partenaires d’interaction, fonctions et maladies associées
Calnuc est une protéine multicompartimentale ubiquitaire hautement conservée indiquant qu’elle doit être d’une grande importance pour le maintien des fonctions cellulaires. De plus, elle présente une structure complexe composée de plusieurs domaines modulaires qui constituent des sites d’interactions potentiels pour d’autres protéines. Au travers les années, l’étude de ses différentes composantes et la découverte de partenaires
13 Figure 3 - Distribution de Calnuc et de ses divers partenaires d'interaction.
(A) Calnuc, représentée par les points noirs, se localise dans les différents compartiments de la voie de biosynthèse de même qu'au niveau du cytosol et du milieu extracellulaire. À chaque endroit, (B) Calnuc interagit avec différents partenaires. Modifié de Calnuc : Emerging Roles in Calcium Signaling and Human Diseases. Aradhyam et al. IUBMB Life, 62(6): 436–446, June 2010 avec la permission de John Wiley and Sons. (C) Représentation à l'échelle de Calnuc (NUCB1), tel que présenté en figure 1, et des sites d'interactions de
14 d’interactions variés ont permis d’associer Calnuc à plusieurs fonctions. Bien que ces rôles restent à être approfondis, ils laissent supposer que la préservation de l’intégrité structurale et fonctionnelle de la protéine est nécessaire pour nous prévaloir de multiples pathologies.
1.4.1 Calcium et minéralisation
Le calcium est un élément chimique omniprésent essentiel au bon fonctionnement d'une variété de fonctions biologiques. Il contribue entre autres à la formation osseuse et au maintien du potentiel d'action membranaire tout en agissant comme cofacteur enzymatique et comme second messager dans la transduction de signaux. Au niveau cellulaire, l'efficacité du calcium repose sur sa capacité de lier de nombreuses protéines dont la principale famille est celle des protéines à mains EF. Ces dernières assurent sa compartimentation et sa spécificité d'action agissant d'une part comme tamponneur dans l'homéostasie calcique ou, d'autre part, comme senseur dans la traduction de signaux (da Silva and Reinach, 1991). Les tamponneurs, comme Calbindin D9k et Parvalbumin,
chélatent les ions grâce à une haute affinité (Kd <10-7 M) et subissent peu de changements
conformationnels (Ikura, 1996). De leur côté, malgré une affinité relativement faible pour le calcium (Kd >10-5 M), les senseurs, comme Calmodulin et Troponin C, subissent des
changements conformationnels marqués créant des domaines d’interaction pour une cible à moduler (Ikura, 1996). À l'image de Calbindin D28k (Berggard et al., 2002), Calnuc a été
proposée comme étant à la fois un senseur et un tamponneur de calcium (de Alba and Tjandra, 2004; Kanuru et al., 2009) allant de pair avec sa localisation au Golgi et au cytoplasme (figure 3A et 3C).
Calnuc comme senseur
La fraction cytosolique de Calnuc joue probablement un rôle de senseur permettant la régulation de nombreuses protéines en réponse à une relâche de calcique. Son affinité pour ses partenaires. Casp (Caspase), DGLDP (site de clivage par les caspases), D328-H339-S378 (triade catalytique attribuée à l'activité de protéase à sérine), GBA (G alpha binding and activating), GEF (facteur d’échange des nucléotides de guanine). Figure crée avec DOG 2.0, DOG 1.0 : Illustrator of Protein Domain Structures. Ren et al. Cell Research (2009) 19:271-273.
15 le Ca2+, ainsi que sa sélectivité pour l'ion au détriment du Mg2+, jouent en cette faveur. Lors d'une activation cellulaire, telle une contraction musculaire menant à l'ouverture des canaux Ryanodine, la concentration de calcium dans le cytoplasme passe d'environ 0,1 uM à 1-10 uM (Berggard et al., 2002) entraînant la liaison de l'ion par Calnuc. Cette liaison provoque des changements conformationnels importants dont le repliement des mains EF ainsi que l'exposition des surfaces hydrophobes pouvant servir de sites d'interaction (de Alba and Tjandra, 2004). De multiples interactions décrites plus bas dans cette section sont d'ailleurs influencées par la liaison du calcium laissant croire que Calnuc pourrait agir comme effecteur ou modulateur dans la signalisation.
Calnuc comme tamponneur
Le calcium est nécessaire pour la cellule mais devient toxique à haute concentration. Il doit donc être emmagasiné dans des compartiments comme le réticulum endoplasmique et le Golgi (Grohovaz et al., 1996) de manière à être rapidement mobilisé au cytosol suivant un stimulus. Ces réserves sont maintenues par des protéines liant le calcium tel que Calréticuline au RE. À l'intérieur du Golgi, Calnuc est la principale protéine liant le calcium (3,8 mg Calnuc/mg protéines dans les cellules NRK, soit 0,4% des protéines) (Lin et al., 1998). En effet, la surexpression de Calnuc au Golgi mène à une augmentation de deux à trois fois de la quantité de calcium emmagasiné et pouvant être mobilisée par l'action d'agonistes ciblant le récepteur IP3 de type 1, comme l'ATP et l'IP3 (Lin et al., 1999). Calnuc agirait donc comme tamponneur à cet endroit grâce à sa main EF1 ainsi qu'à l'action de la pompe Sarco/endoplasmic reticulum Ca2+-ATPase (SERCA) qui assure le mouvement des ions vers la lumière du Golgi (Taylor et al., 1997).
Calnuc dans la minéralisation
Le tissu osseux forme une réserve calcique d'un tout autre type. En 1995, Calnuc a été identifiée comme étant une constituante mineure de la matrice extracellulaire des os (Wendel et al., 1995), puis de la dentine (Somogyi et al., 2004). En effet, Calnuc est produite par de nombreuses cellules impliquées dans la formation osseuse, soit les ostéoblastes, les ostéocytes (Wendel et al., 1995) et les odontoblastes (Somogyi et al., 2004), mais est indétectable par hybridation in situ dans les cellules connexes comme les
16 chondrocytes (cellules du cartilage), les ostéoclastes et cellules de la moelle (Petersson et al., 2004). Calnuc est sécrétée dans l'ostéoïde, c'est-à-dire la matrice osseuse non minéralisée essentiellement constituée de collagène de type 1. Cette dernière doit donc subir une étape de minéralisation pendant laquelle s'ajoute une matrice minérale composée de phosphate tricalcique (hydroxyapatite), de carbonates de calcium et de phosphates de magnésium. Suivant sa capacité à être sécrétée et à lier l'hydroxyapatite (Wendel et al., 1995), l'implication de Calnuc dans ce procédé a été proposée. Des analyses ultrastructurelles ont mis en évidence une forte présence de Calnuc au niveau des ostéoïdes d'os nouvellement créés. De plus, durant la prolifération et la différenciation cellulaire, Calnuc a été localisée au niveau du noyau alors que pendant la minéralisation Calnuc se retrouve principalement dans le cytoplasme (Petersson et al., 2004). Ce déplacement intracellulaire est accompagné d'une faible expression durant la phase de prolifération qui augmente considérablement durant la différentiation et la maturation de la matrice pour ensuite diminuer après l'initialisation de la minéralisation (Petersson et al., 2004). Ces données suggèrent que Calnuc contribuerait à l'accumulation et au transport des ions calciques et pourrait agir comme modulateur de la maturation avant le dépôt de minéraux. Il est à noter que Calnuc pourrait aussi agir indirectement dans la destruction de l'os via son interaction avec COX-2 qui a pour effet de stimuler la synthèse de PGE2 et la formation d'ostéoclastes.
1.4.2 Protéines G et sécrétion régulée
Les Guanosine nucleotide-binding proteins (protéines G), sont d’importants messagers qui transmettent des signaux provenant de récepteurs couplés aux protéines G (GPCR) de la membrane plasmique vers l’intérieur de la cellule. Pour ce faire, le récepteur activé par un ligand catalyse l’échange de guanosine diphosphate (GDP) pour du guanosine triphosphate (GTP) sur la unité Gce qui l'active à son tour. À ce moment, les sous-unités Get G associées au récepteur se dissocient pour aller moduler indépendemment une variété d’effecteurs différents. Éventuellement, l'activité GTPase intrinsèque de Gprovoque son inactivation, via l’hydrolyse du GTP, et conséquemment sa réassociation
17 avec le récepteur. Récemment, il a été mis en évidence que les protéines G, ainsi que le dimère G, sont présentes à la membrane de compartiments intracellulaires, comme le Golgi et les endosomes (Wilson et al., 1994), mais leur rôle à ce niveau demeure encore inconnu.
En 1995, une expérience de double hybride a permis au groupe d’Insel d’identifier Calnuc comme partenaire d’interaction direct des protéines Gde type Gi2 (Mochizuki et al., 1995). Ultérieurement, Calnuc a été montrée comme étant capable d’interagir, de façon dépendante du Ca2+ et Mg2+ (Lin et al., 2000), avec les types Gi1 et Gi3, ainsi qu’avec les Gi2, Go1, Gz et Gs, mais pas avec les Gq, G12 et G13 (figure 3B) (Lin et al., 1998). L’étude plus approfondie de la liaison avec Gi3 a permis d’établir que les mains EF de Calnuc, ainsi que la région acide très conservée et flanquée entre ces structures, sont essentielles pour l’interaction (figure 3C) (Lin et al., 1998). Les premières expériences visant à établir la fonction de ces interactions ont montré que la surexpression de Calnuc augmente les niveaux de Gi2 (Mochizuki et al., 1995). À ce moment, l’interaction a été montrée comme étant indépendante de l’état d'activation de la protéine G (Lin et al., 1998). Toutefois, une protéine G active augmente la liaison de Ca2+ sur Calnuc alors qu’une protéine G inactive a pour effet d’entraîner une relâche de l’ion par Calnuc (Kanuru et al., 2009). Ce phénomène laisse croire que Calnuc pourrait être agir comme effecteur dans la signalisation des protéines G ou dans la modulation de leurs fonctions.
Outre leur localisation à la membrane plasmique, les protéines Gi3 sont retrouvées à la surface du Golgi (Stow et al., 1991) et les Gi1/2 à la surface des vésicules de sécrétion (Wilson et al., 1994). Calnuc a également été observée à ces différents endroits (Lavoie et al., 2002) et est partiellement distribuée avec Gi1/2 et Gi3 à la surface des granules de sécrétion (Lin et al., 2009). Il s’agit également de la seule protéine ayant la capacité de lier à la fois les G et le calcium, deux éléments qui stimulent la sécrétion régulée. Son implication dans ce processus physiologique a donc rapidement été confirmée, dans les cellules neuroendocrines, par une augmentation de la sécrétion régulée d’ACTH dépendante des G (Lin et al., 2009). La surexpression de Calnuc entraîne aussi une
18 redistribution de Gi3 sur les granules de sécrétion et de Gi1/2 à la membrane plasmique sans affecter leur activité. Ces résultats indiquent que Calnuc influencerait la sécrétion régulée en agissant comme modulateur, possiblement sensible au calcium, dans la dynamique de distribution intracellulaire des protéines G.
La signalisation des protéines G est dépendante de leur cycle d’activation-inactivation lui-même finement régulée par de nombreuses protéines accessoires. Les facteurs d’échange des nucléotides de guanine (GEF) catalysent l’activation des protéines G via l’échange du GDP pour du GTP. De leur côté, les protéines d’accélération de la GTPase (GAP), dépourvues d’activité catalytique, stimulent l’activité GTPase intrinsèque des protéines G pour mener à leur inactivation. Finalement, les inhibiteurs de la séparation des nucléotides de guanine (GDI) maintiennent les protéines G dans un état d’inactivation. Dernièrement, deux études ont suggéré l’implication de Calnuc dans cette mécanistique en lui attribuant les rôles, quelque peu opposés, de GDI et de GEF. En 2010, le groupe de Sakmar a montré que la forme cytosolique de Calnuc est un dimère physiologique qui peut interagir avec Gαi1-GDP, suivant une affinité de 18,3 μM, mais pas avec Gαi1-GTP (Kapoor et al., 2010). Calnuc a pour effet d’inhiber la relâche du GDP de Gαi1, prévenant ainsi l’activation de la protéine G et l’inhibition de la voie de signalisation subjacente (Kapoor et al., 2010). Ces résultats suggèrent que Calnuc agirait comme une GDI malgré l’absence dans sa structure d’un motif GoLoco normalement associé à cette fonction. La région N-terminale de Calnuc (26-333) serait plutôt en cause (Kapoor et al., 2010). Pratiquement au même moment, le groupe de Farquhar identifiait un motif G alpha binding and activating (GBA) (figure 3C) attribué à l’activité GEF dans plusieurs protéines, dont la G alpha-interacting vesicle-associated protein (GIV) (Garcia-Marcos et al., 2011). Ce motif Ψ-S/T-Φ/Ψ-X-D/E-F-Ψ (où Ψ est un résidu aliphatique et Φ est un résidu aromatique) se trouve conservé dans Calnuc et NUCB2 et leur permet de lier préférentiellement la forme inactive des Gi au niveau de la crevasse entre l’hélice alpha3 et la région Switch II (Garcia-Marcos et al., 2011). Ceci contredit une étude du même groupe qui impliquait l’hélice alpha5 de Gi3 (Lin et al., 2000), une région d’importance impliquée dans la liaison de GDP (Mixon et al., 1995; Sprang, 1997), de GPCR (Lambright
19 et al., 1996) et d’effecteurs (Sunahara et al., 1997). Néanmoins, Gi3 lie davantage de GTP en présence de Calnuc ou NUCB2 indiquant que ces dernières agiraient comme GEF (Garcia-Marcos et al., 2011). La divergence des fonctions apportées par ces articles peut être imputable à l’utilisation de concentrations protéiques différentes (sous les Kd ou
affectant les réactions enzymatiques) ou à des lectures artéfactuelles. Par contre, les deux groupes s’entendent pour dire que Calnuc lie uniquement les formes inactives des protéines Get que le calcium abolit l’interaction. En effet, l’ion entraîne le repliement des mains EF réquisitionnant et dissimulant des résidus nécessaires pour l’interaction avec G (Garcia-Marcos et al., 2011). D’ailleurs, l’interaction entre Calnuc et Gi3 se produit dans un milieu pauvre en calcium, soit dans le cytosol à la surface du Golgi (Weiss et al., 2001). Calnuc est alors libre d’ions et lie Gseulement s’il est ancré aux membranes par ses ancrages lipidiques (Weiss et al., 2001). De plus amples études seront nécessaires afin d’éclaircir le rôle de Calnuc dans le cycle des protéines G, les régions impliquées ainsi que l’effet de l’élévation physiologique du calcium.
1.4.3 ADN et lupus
Calnuc possède une région riche en acides aminés basiques qui lui permet de lier l’ADN (figure 3B et 3C) (Miura et al., 1992) et une fermeture en leucines connue chez plusieurs protéines pour faciliter cette liaison. Une hypothèse stipule que l'interaction entre Calnuc et l'ADN serait importante pour l'induction d'anticorps contre l'ADN, un phénomène en cause dans la physiopathologie du lupus érythémateux disséminé. Il s’agit d’une maladie chronique qui attaque principalement les tissus conjonctifs. Le système immunitaire produit alors des anticorps spécifiques contre des entités normalement présentes dans l'organisme dans le but de les éliminer. À l’origine, Calnuc a été identifiée comme étant un facteur promouvant la formation de tels auto-anticorps ciblant l’ADN double brin, la Ribonucléoprotéine U1, la protéine Lupus La et le facteur rhumatoïde (Kanai et al., 1995b; Kanai et al., 1993). D’ailleurs, l’injection intrapéritonéale de Calnuc cause des symptômes associés au lupus dont une surproduction d’immunoglobuline G (IgG) suivie par l'élévation d'anticorps de même type ce qui accélère la réponse
auto-20 immune (Kanai et al., 1995b). Les souris injectées présentent aussi une fragmentation d’ADN liée à de l’apoptose dans des tissus lymphoïdes comme le thymus et entraînant une accumulation de segments d’ADN dans le sérum. Ce phénomène pourrait être à l’origine de la production d’anticorps dirigés contre l’ADN et de l’auto-immunité (Kanai et al., 1995a). Des études mécanistiques plus approfondies devront être faites pour comprendre les relations de causalité et élucider le rôle nébuleux de Calnuc dans cette maladie.
1.4.4 Cancer, apoptose et Caspases
Le cancer est une maladie caractérisée par une prolifération cellulaire incontrôlée en dépit d'anomalies génétiques. Le système immunitaire peut détecter certains dysfonctionnements cellulaires associés aux tumeurs comme étant immunogéniques. Plusieurs protéines impliquées dans la tumorigenèse servent alors d’antigènes pour la production d’auto-anticorps ce qui n’est pas sans rappeler l’induction d’auto-anticorps par Calnuc dans un contexte de lupus. Dans cette logique, plusieurs groupes ont étudié l’expression antigénique de Calnuc. Dès 1994, une augmentation de Calnuc est décelée dans 10% des adénocarcinomes gastriques et 56% de ceux présentant des métastases aux ganglions lymphatiques (Wang et al., 1994). Également, le niveau d’expression de Calnuc dans les lymphomes non hodgkiniens reflète le degré de prolifération des cellules et donc le grade de la pathologie (Kubota et al., 1998). Aussi, Calnuc est hautement spécifique pour le cancer du côlon puisqu’environ 60% des tissus affectés surexpriment cette protéine en comparaison aux côlons sains qui ne semblent pas l'exprimer en immunohistochimie (Chen et al., 2007). Dans ce même article de 2007, des auto-anticorps contre Calnuc ont été retrouvés dans 11,5% des cancers du côlon contre seulement 1,2% des côlons sains. Calnuc semble donc bel et bien agir comme un antigène associé aux tumeurs (TAA) et contribue favorablement aux outils diagnostiques. De plus amples études seront nécessaires pour établir la fonction exacte de Calnuc et afin de déterminer si la réaction immunitaire est en cause dans le développement du caractère malin de la maladie. En effet, en raison de sa capacité à lier le calcium et les protéines G, Calnuc perturberait l’adhésion et la motilité cellulaire (Mermelstein et al., 2003) de même que la croissance, la prolifération et la migration. Pour les mêmes raisons, Calnuc pourrait être impliquée dans le mécanisme
21 d'action d'autres protéines associées à des cancers. Entre autres, par double hybride, Calnuc a été identifiée comme partenaire d'interaction de la protéine peu caractérisée nommée Breast cancer membrane protein (BCMP84) (Adam et al., 2003). Cette dernière est surexprimée et est déplacée à la membrane plasmique dans les carcinomes du sein et de la vessie.
Le cancer est induit par le blocage de l'apoptose, le processus de mort physiologique par lequel une cellule déclenche son auto-destruction. Ce mécanisme mène à l’activation de multiples Caspases, des protéases à cystéine qui clivent nombre de substrats au niveau de sites consensus spécifiques pour entraîner le démantèlement cellulaire. L’expression de Calnuc dans certains cancers de même que l’induction de l’apoptose dans les tissus lymphoïdes lors de son administration exogène (Kanai et al., 1995b) suggèrent l’implication de la protéine à ce niveau. Dans le même ordre d'idées, in vitro, NUCB1 a été identifiée comme substrat potentiel pour les Caspases 3, 6 et 8 alors que son homologue NUCB2 serait clivé par Caspase 3, 6, 7, 8 et 9 (Valencia et al., 2008). Un site général de clivage DXXD est hautement conservé à travers les espèces. Chez la forme humaine de Calnuc, ce motif non optimal DGLDP (figure 3C) est localisé entre le NLS et la première main EF suggérant que les Caspases pourraient découpler les domaines fonctionnels en situation d’apoptose. En effet, le fragment C-terminal comprend les mains EF et la glissière en leucines qui sont essentielles pour la liaison du calcium et la liaison à des partenaires, dont l’ADN. Par contre, il est dépourvu de son domaine riche en leucines et isoleucines ainsi que de son NLS, ce qui signifie qu’il n’est pas retenu au Golgi et qu’il ne transloque pas au noyau. De son côté, le fragment N-terminal contenant les domaines de liaison au zinc est rapidement dégradé.
1.4.5 COX et inflammation
Les Cyclooxygénases (COX) sont des enzymes qui permettent la synthèse de prostanoïdes, à partir d’acide arachidonique (AA) de manière à moduler divers effets physiologiques. Alors que la COX-1 est constitutive, la COX-2 est inductible par de multiples facteurs pro-inflammatoires dont le Granulocyte/monocyte colony stimulation
22 factor (GM) et le TNF. En 1996, une étude a démontré que Calnuc peut interagir avec les COX, de manière indépendante du calcium, via une région qui comprend ses 123 résidus en N-terminal (figure 3B et 3C) (Ballif et al., 1996). Malgré une affinité plus forte pour la COX-1 que la COX-2, les deux enzymes, fortement liées à la membrane luminale du RE, diminuent de plus de 80% la sécrétion de Calnuc en condition de surexpression. Elles participeraient ainsi à la rétention intracellulaire de Calnuc (Ballif et al., 1996). Pour faire suite, un groupe québécois s’est concentré sur la COX-2, qui prédomine dans la production de prostaglandines (PG) E2 dans les cellules inflammatoires telles que les neutrophiles. Ils
ont démontré que Calnuc interagit et colocalise avec la COX-2 au niveau du RE et du Golgi dans des neutrophiles stimulés au GM/TNF (Leclerc et al., 2008). Calnuc se retrouve également dans les mêmes fractions que les enzymes impliquées dans la génération de prostanoïdes (Microsomal PGE2-synthase-1, Thromboxane-synthase, Calcium-dependent
phospholipase A2) (Leclerc et al., 2008). À ce sujet, des essais sur neutrophiles stimulés ont démontré que Calnuc recombinante augmente de 5 fois la synthèse de PGE2 via la COX-2 et de manière dépendante de la dose (Leclerc et al., 2008). Calnuc présente donc des propriétés régulatrices des COX durant l’inflammation alors que ces dernières jouent un rôle dans la rétention intracellulaire de Calnuc.
Dans le même ordre d'idées, en 2015, Calnuc a été identifiée comme protéine liant les lipides (Niphakis et al., 2015). Plus de 1000 protéines, dont plusieurs transporteurs, enzymes et protéines peu caractérisées, ont été enrichies avec une sonde semblable à l'acide arachidonique (arachidonoyl) (Niphakis et al., 2015). Il a été montré que le lipide se lie à Calnuc au niveau du domaine d'interaction des COX et que le calcium augmente significativement et sélectivement l'interaction (Niphakis et al., 2015). Calnuc perturbe le métabolisme oxydatif et hydrolytique des endocannabinoïdes et des eicosanoïdes. En effet, l'utilisation de deux ligands sélectifs de Calnuc (MJN228 et KML110) ou de petits acides ribonucléiques (ARN) en épingle à cheveux (shRNA) dirigés contre Calnuc a pour effet d'élever la concentration cellulaire d'acides gras (Niphakis et al., 2015). Ces résultats tendent à démonter que Calnuc faciliterait le métabolisme des acides gras en les transférant à des enzymes comme l'Amidohydrolase des acides gras (FAAH) et la COX2 (Niphakis et al., 2015).