Étude de l’impact de la glycation sur la guérison des
plaies cutanées
Mémoire
Kiefer Thouin
Maîtrise en biologie cellulaire et moléculaire
Maître ès sciences (M. Sc.)
Québec, Canada
Étude de l’impact de la glycation sur la guérison des
plaies cutanées
Mémoire
Kiefer Thouin
Sous la direction de :
iii
Résumé
La cicatrisation d’une plaie cutanée est un processus essentiel pour rétablir la fonction barrière de la peau afin de prévenir les pertes liquidiennes et les risques d’infections. Il s’agit d’un processus gouverné par de nombreux facteurs, dont l’inflammation est un des principaux. De plus, le système nerveux périphérique joue un rôle majeur dans ce processus en induisant l’inflammation neurogène via la sécrétion de neuropeptides, en particulier la Substance P (SP) et la Calcitonin Gene-Related Peptide (CGRP), par les neurones sensoriels. Dans le cadre d’une pathologie très commune, le diabète, la cicatrisation des plaies cutanées peut être fortement compromise. L’hyperglycémie induite par le diabète a pour effet de provoquer la glycation des tissus, qui se traduit par la formation des ‘’advanced glycation end-products’’ (AGEs), comme la N-carboxyméthyl-lysine (CML) exprimée dans la peau. Une neuropathie peut être observée chez certains patients ce qui peut aggraver davantage la déficience de la cicatrisation de plaies. Cela peut conduire au développement d’ulcères et ultimement à l’amputation des membres inférieurs dans certains cas. Nous voulons donc, par un traitement avec une molécule anti-glycante, l’aminoguanidine (empêche la formation d’AGE), et avec les neuropeptides SP et CGRP, inhiber les effets délétères des AGEs dans la fermeture de plaies cutanées. Par conséquent, ceci permettrait de compenser l’absence de neuropeptides sécrétés due à la neuropathie, ce qui accélérerait la fermeture de plaie cutanée. Cette approche pourrait permettre à certains patients diabétiques d’éviter d’avoir recours à l’amputation de membres inférieurs en refermant efficacement les ulcères ainsi qu’en évitant d’autres complications comme l’infection.
iv
Abstract
The wound healing process is essential to restore the skin barrier function to prevent fluid loss and infection. It is a process led by many factors and inflammation is an important one. Furthermore, the peripheral nervous system plays an important role in this process by inducing neurogenic inflammation that lead to neuropeptides secretion, more specifically P substance (SP) and Calcitonin Gene-Related Peptide (CGRP), by sensitive neurons. Diabetes is a common pathology that can cause neuropathy and aggravates wound healing closure. Hyperglycemia induced in diabetes can causes tissues glycation by the formation of advanced glycation end-products (AGEs), like N-carboxymethyl-Lysin (CML) that is expressed in skin. Some patients develop a neuropathy that participated in the wound healing alterations. That can lead to ulcer development and high risks of lower limb amputation. Our interest to find a treatment with AGE-breaker, aminoguanidine (prevent AGE formation), and neuropeptides SP in combination of CGRP is attractive because it inhibits deleterious effects by AGEs in wound healing and it compensate for the neurons death and the decrease of neuropeptides. Results show that our proposed treatment accelerated wound closure. This approach could avoid to some diabetic patients to the need of lower limb amputation by rapidly and efficiently closing foot ulcer and at the same time, avoid other complications like infections.
v
Table des matières
Résumé ...iii
Abstract ... iv
Table des matières ... v
Liste des figures ... vii
Liste d’abréviations ... viii
Remerciements ...x
Chapitre I : Introduction et problématique ... 1
1.1 Introduction : ... 3
1.1.1 La peau ... 3
1.1.1.1 L’épiderme ... 5
1.1.1.2 Le derme ... 6
1.1.2 Les nerfs sensoriels cutanés ... 8
1.1.2.1 Le système nerveux ... 8
1.1.2.2 Les neurones sensoriels ... 10
1.1.2.3 L’inflammation neurogène ... 12
1.1.2.4 Les neuropeptides ... 12
1.1.3 Les plaies cutanées ... 13
1.1.3.1 Les différents types de plaies ... 14
1.1.3.2 La guérison de plaies ... 15
1.1.3.3 La ré-épithélialisation ... 17
1.1.4 Le diabète ... 19
1.1.4.1 Les types de diabète ... 19
1.1.4.2 Les problématiques dans la pathologie ... 20
1.1.4.3 Recherches et solutions ... 21
1.1.5 La glycation ... 22
1.1.5.1 Les «Advanced glycation End-products» (AGEs) ... 23
1.1.5.2 Problèmes associés à la glycation ... 25
1.1.5.3 Tentatives pour contrôler la quantité d’AGE. ... 30
1.2 Problématiques : ... 34
1.3 Hypothèse de recherche ... 36
vi
Chapitre II : Présentation d’article ... 37
2.1 Avant-propos ... 38
2.2 Article ... 39
Abstract ... 41
1. Introduction ... 42
2. Material and methods ... 45
2.1 Cell culture ... 45
2.2 Keratinocyte transduction with GFP ... 46
2.3 Preparation of the collagen - chitosan biomaterial ... 46
2.4 Preparation of the glycated wound healing model (WHM) ... 47
2.5 Histology ... 48
2.6 Measurement of wound closure ... 49
2.7 Indirect immunofluorescence staining ... 49
3. Results ... 50
3.1 Characterization of the impact of glycation on wound closure in the WHM. ... 50
3.2 Effect of glyoxal on wound closure in vitro... 54
3.3 Influence of CGRP, SP and aminoguanidine on wound closure in glycated WHM. ... 55
4. Discussion ... 60
5. Conclusion ... 62
6. Acknowledgments ... 63
7. References ... 63
Chapitre III : Discussion et Conclusion ... 65
3.1 Discussion ... 66
3.2 Conclusion ... 68
vii
Liste des figures
Mémoire :
Figure 1 : Composantes du système tégumentaire chez l’humain. ... 4
Figure 2 : Composantes et différentes couches de l’épiderme. ... 6
Figure 3 : Structure du système nerveux. ... 9
Figure 4 : Structure d’un neurone. ... 10
Figure 5 : Les récepteurs neuronaux cutanés. ... 11
Figure 6 : Différents types de plaies cutanées. ... 15
Figure 7 : Stades classiques de la réparation et régénération de la peau. ... 16
Figure 8 : Différentes façons de générer la formation d’AGEs... 23
Figure 9 : Altération au niveau des cellules dans la glycation. ... 28
Figure 10 : Neuropathie au niveau de la peau dans la glycation par le diabète... 30
Article : Fig. 1: Impact of glycation on the WHM shown by histology. ... 52
Fig. 2: Impact of glycation on the WHM characterized by immunofluorescence. ... 54
Fig. 3: Influence of glyoxal on wound closure in the WHM. ... 55
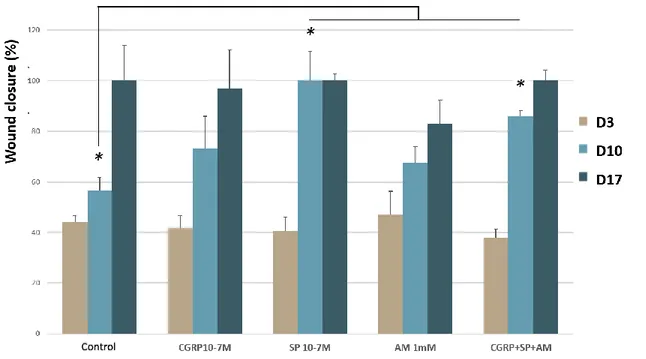
Fig. 4: Influence of SP, CGRP, Ala and AM on wound closure in a glycated WHM. ... 57
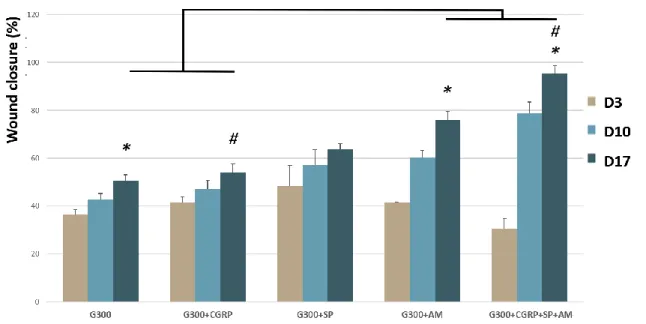
Fig. 5: Effect of CGRP, SP and aminoguanidine on wound closure in the non-glycated WHM. ... 58
viii
Liste d’abréviations
ADN: Acide désoxyribonucléique AGE: Advanced glycation end-product ALT-711: Alagébrium
AM: Aminoguanidine
FGF: Fibroblast growth factor BM: Basal membrane
CALCRL: Calcitonin receptor-like receptor CGRP: Calcitonin Gene-Related Peptide CML: Caboxyméthyl-Lysine
DHc:
DMEc: Complet dulbecco's modified eagle medium DMEM: Dulbecco's modified eagle medium
DRG: spinal cord dorsal root ganglia MEC: Matrice extracellulaire
EGF: Endothelial growth factor GFP: Green fluorescent protein
HUVEC: Human umbilical vein endothelial cell IL-1: Interleukine 1
K14: Cytokératine 14
KGF: Keratinocytes growth factor LDL: Low density lipid
MMP-9: Matrix metalloproteinase-9 NK1: Neurokinine 1
NKA: Neurokinine A
PBS: Phosphate-buffered saline PDGF: Platelet derived growth factor
PECAM-1: Platelet-endothelial cellular adhesion molecule-1 RAGE: Receptor for advanced glycation end-products RAMP1: Receptor activity-modifying protein
ix ROS: Reactive oxygen species
TGF-β: Transforming growth factor beta TNF-α: Tumor necrosis factor alpha SN: Système nerveux
SNA: Système nerveux autonome SNC: Système nerveux central SNP: Système nerveux périphérique SNS: Système nerveux somatique SP: Substance P
UV: Ultra violet
x
Remerciements
J’aimerais, pour commencer, remercier mon directeur de recherche, Dr. François Berthod, sans qui rien de ce qui a été fait dans l’étude n’aurait été possible. C’est grâce à lui si j’ai pu faire une maîtrise très stimulante et sur un projet vraiment intéressant. Il m’a fait confiance tout au long de ma contribution dans son équipe et a toujours été disponible pour des questions ou du support. J’ai également pu jouir d’une autonomie dans la réalisation de mon projet par la confiance qu’il m’accordait. J’aimerais aussi remercier Dr. François Auger et Dr. Lucie Germain qui ont permis l’établissement du centre de recherche le LOEX et qui ont permis à plusieurs étudiants, professionnels de recherche, assistants de recherche, employés ainsi qu’à moi-même d’acquérir de nouvelles expériences en recherche dans un laboratoire très stimulant.
Un merci très spécial aussi à Sabrina Bellenfant, qui m’a formé dans les pratiques de laboratoire en culture cellulaire et qui a toujours été disponible pour de l’aide et aussi du support. Sans sa présence, sa bonne humeur et son sens de l’humour, ma maîtrise n’aurait pas été aussi plaisante durant ces deux dernières années. Merci aussi à Thiéry De Serre-Bérard qui m’a beaucoup aidé dans les manipulations et analyses et qui a été un très bon stagiaire. Je suis content qu’il prenne le flambeau du projet et qu’il poursuive ses études graduées dans l’équipe.
Un gros merci aussi à Todd Galbraith, Maxime Picard-Deland et Fabien Kaweki qui m’ont épaulé dans les moments les plus difficiles au laboratoire et qui ont su faire d’excellents amis.
Merci également à toute ma famille pour les encouragements dans toute la progression de mesétudes.
1
Chapitre I : Introduction et problématique
3
1.1 Introduction :
1.1.1 La peau
La peau fait partie des organes les plus importants du corps humain. C’est en fait le plus gros organe autant en surface occupée qu’en poids. Chez l’adulte, la surface totale de la peau peut être supérieure à deux mètres carrés et son poids peut aller jusqu’à 4,5-5 kilogrammes.1 Son importance vient principalement du fait qu’elle permet au corps de conserver une température constante, elle protège le corps des stress environnementaux extérieurs et fournit des informations sensorielles sur ce qui nous entoure. La régulation homéostatique de la température du corps (la thermorégulation) est régulée par la sécrétion de sueur par les glandes sudoripares exocrines et par la régulation du flux sanguin.1 Cependant, de tous les organes, c’est celui qui est le plus exposé aux infections, maladies et blessures. Sa capacité d’auto régénération et de protection est donc plus que nécessaire.
Au niveau structurel et organisationnel, la peau est très complexe. Elle est composée de poils, de vaisseaux et capillaires sanguins, de nerfs sensitifs, de glandes sudoripares et sébacées et de muscles.1 Cet organe peut être séparé en deux sections principales : l’épiderme et le derme. La section la plus mince et en contact avec l’environnement extérieur du corps est l’épiderme alors que la portion en dessous et d’une plus grande épaisseur se nomme le derme. Il est important de noter que l’épiderme n’est pas vascularisé. C’est la raison pour laquelle nous ne saignons pas à chaque fois que notre peau est endommagée. Dans des coupures plus profondes, le derme, qui lui est vascularisé, peut être atteint et c’est dans cette situation que le sang peut jaillir d’une plaie.1
4 Figure 1 : Composantes du système tégumentaire chez l’humain.
(Principles of Anatomy & Physiology. Tortora GJ, Derrickson B. Wiley; 2012.)
Plus profondément que le derme, il y a l’hypoderme. Cette couche est composée de tissus aérolaire et adipeux, mais ne fait pas réellement partie de la peau. L’hypoderme sert davantage à l’entreposage du dépôt de gras et contient de larges vaisseaux sanguins qui aident à l’échange de nutriments entre la peau et le reste du corps. Cette région contient aussi des nerfs qui sont sensibles à la pression et qui connectent avec le derme.1
5 1.1.1.1 L’épiderme
L’épiderme est composé d’un tissu épithélial stratifié, kératinisé, pavimenteux, squameux et non vascularisé qui recouvre le derme. C’est en fait la couche superficielle de la peau qui est couverte par des cellules mortes kératinisées qui desquament et protègent les régions inférieures de la peau.2 Elle est composée de quatre principaux types cellulaires dont les kératinocytes, les mélanocytes, les cellules de Langerhans et les cellules de Merkel.1 Les kératinocytes, qu’on retrouve en majorité (90%), sont extrêmement dynamiques et subissent une prolifération et différenciation permanente, ce qui permet le renouvèlement constant des cellules mortes de la couche cornée par desquamation.2 Ce processus peut prendre de quatre à six semaines pour un épiderme d’environ 0,1mm, le temps que les kératinocytes forment une strate basale, montent à la surface, se kératinisent et se décollent. De plus, ils sécrètent de la kératine qui est une protéine fibreuse intracellulaire qui permet d’assurer une résistance mécanique importante dans la cohésion intercellulaire avec les desmosomes. Les mélanocytes, quant à eux, permettent d’absorber les rayons UV captés par la peau puisqu’ils produisent de la mélanine qui sert de chromophore. C’est en fait cette protéine qui est responsable de la pigmentation de la peau et des poils.1 Finalement, les
cellules de Langerhans sont des cellules dendritiques qui sont responsables de la défense immunitaire et celles de Merkel sont responsables de la perception tactile avec les neurones sensoriels. 1 Nous n’entrerons pas en détail ici, mais il est important de savoir que les
kératinocytes qui forment l’épiderme se retrouvent dans différents stades de développement ce qui sépare l’épiderme en cinq couches : stratum basale, stratum spinosum, stratum granulosum, une mince stratum lucidum et stratum corneum.1
6 Figure 2 : Composantes et différentes couches de l’épiderme.
(Principles of Anatomy & Physiology. Tortora GJ, Derrickson B. Wiley; 2012.)
1.1.1.2 Le derme
La deuxième partie principale de la peau, le derme, est composée de tissu conjonctif irrégulier et dense qui contient du collagène de plusieurs types (principalement de type I), de l’élastine (qui procure une bonne élasticité à la peau) et une matrice fibrillaire constituée de glycosaminoglycanes, de protéoglycanes et de glycoprotéines. En plus d’avoir une bonne capacité de résistance à la tension grâce aux fibres, le derme a aussi la capacité de reprendre sa forme normale après un étirement. Parmi les quelques cellules retrouvées dans le derme, on retrouve en grande majorité des fibroblastes, des macrophages et quelques adipocytes situés près de la zone de liaison avec la couche sous-cutanée (hypoderme). On retrouve également des mastocytes, des cellules dendritiques et des cellules souches près des follicules pileux.1 Le derme est en fait essentiel à la survie des cellules de l’épiderme et des couches adjacentes et participe beaucoup aux caractéristiques structurelles et fonctionnelles de la peau. Les vaisseaux sanguins et lymphatiques, les nerfs, les glandes et
7 les follicules pileux se retrouvent entre autres dans la couche du derme.1 Elle contient aussi
des mécanorécepteurs qui permettent le sens du toucher et des thermorécepteurs qui permettent de percevoir la température extérieure sur la peau.3
Le derme peut être séparé en deux sections, soit une mince région papillaire et une région réticulaire plus épaisse et plus profonde.1 La région papillaire est composée de tissu conjonctif aréolaire qui s’étend vers l’épiderme et qui contient des réseaux terminaux de capillaires sanguins et les extrémités des nerfs sensitifs.3 Elle est composée de fines fibres de collagène relâchées et d’une structure ondulée de type digitiforme qui permet d’augmenter la surface de contact avec l’épiderme et donc d’améliorer les échanges thermiques et de nutriments.4 La région réticulaire, quant à elle, est attachée à l’hypoderme et est composée de fibres épaisses de collagène empaquetées. Les fibres de collagène sont organisées de façon à ce que l’arrangement soit plus régulier que la région papillaire, comme un filet compacté.1
8
1.1.2 Les nerfs sensoriels cutanés
1.1.2.1 Le système nerveux
Le système nerveux est composé de neurones qui sont responsables de l’envoi, de la réception et du traitement des influx nerveux dans le corps. On distingue le système nerveux central (SNC) du système nerveux périphérique (SNP). Le SNC regroupe le cerveau, la moelle épinière et les ganglions spinaux et ses rôles principaux sont de recevoir, enregistrer et interpréter les informations qui viennent du SNP. Il est entouré par des enveloppes conjonctives, qu’on appelle les méninges. Le SNP, constitué par les nerfs crâniens et les nerfs spinaux, transmet des informations des membres et des organes au SNC. Le SNP peut être divisé en deux catégories : le système nerveux somatique (SNS) et le système nerveux autonome (SNA). Les neurones sensoriels et moteurs somatiques du SNS permettent le transfert d’informations provenant des récepteurs associés au toucher, à la vue, à l’ouïe, à l’équilibre, au goût et à l’odorat, en plus de transmettre des informations des muscles squelettiques jusqu’au SNC.5 Ensuite, les neurones sensitifs et moteurs autonomes du SNA permettent le transfert d’informations entre les muscles cardiaques, les glandes, les organes viscéraux comme les muscles lisses ainsi que les organes que l’on retrouve au niveau du thorax, de l’abdomen et du pelvis, et le SNC.
9 Figure 3 : Structure du système nerveux.
(Principles of anatomy and physiology, Tortora G., Derrickson B.; 2012)
Les neurones sont les cellules qui permettent le transport de l’information dans le corps sous forme de stimulus. Ils sont principalement composés de dendrites, d’axones, d’un noyau et de synapses. Lorsqu’il y a un stimulus au niveau des dendrites, les neurones transforment le signal sous forme de signal électrique qui se propage le long de l’axone pour se rendre jusqu’aux synapses. Ensuite, des molécules comme des neurotransmetteurs peuvent être sécrétées pour transmettre l’information à d’autres neurones du SNP ou au SNC directement. Des gaines de myéline peuvent se retrouver sur les axones des neurones pour favoriser et accélérer la vitesse de transmission de l’influx nerveux.1
10 Figure 4 : Structure d’un neurone.
(Boundless, Introducing the Neuron; 2016)
1.1.2.2 Les neurones sensoriels
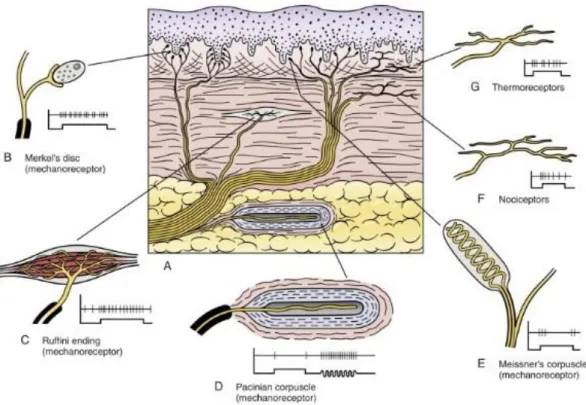
C’est grâce aux nerfs sensoriels cutanés que nous avons la capacité de ressentir les variations de la température ambiante, que nous ressentons la douleur et que nous avons le sens du toucher. Les neurones sensitifs qui innervent notre peau permettent la perception et la réaction à des stimuli provenant de l’extérieur (extéroceptif) et de l’intérieur (intéroceptif) du corps humain pour envoyer un signal qui se rend jusqu’au cerveau afin de donner l’information sur le stimulus.6 De plus, l’innervation de la peau participe aussi à
plusieurs mécanismes dans le maintien de l’homéostasie de la peau et participe à plusieurs processus physiologiques comme la guérison de plaie cutanée.7 La première étape de la perception sensorielle implique l’activation des neurones sensoriels primaires qui se situent dans les ganglions de la racine dorsale (DRG) et les ganglions sensitifs crâniens, qui s’étendent jusque dans la peau. Ces neurones sensoriels primaires se divisent en deux branches axonales qui se prolongent afin de s’associer à des cibles périphériques leur permettant de pénétrer dans la moelle épinière pour transmettre le signal à d’autres neurones de deuxième ordre par des synapses.7 Finalement, le signal est transmis au
11 thalamus où des neurones thalamo-corticaux transmettent le signal au cortex somatosensoriel.8 C’est via l’intermédiaire des neuropeptides, de neurohormones et de
neurotransmetteurs que les neurones sensoriels peuvent communiquer entre eux et avec différentes cellules de la peau.9
Figure 5 : Les récepteurs neuronaux cutanés.
(Susan A. Darby, Robert J. Frysztak, in Clinical Anatomy of the Spine, Spinal Cord, and Ans (Third Edition), 2014)
Il existe plusieurs types de fibres nerveuses différentes qui sont classées par leur diamètre et leur vitesse de conduction de signal. Les fibres nerveuses cutanées peuvent être composées de fibres myélinisées Aβ qui ont un diamètre entre 6 et 12 μm et une vitesse de conduction entre 35 et 75 m/s, de fibres myélinisées Aδ qui ont un diamètre entre 1 et 5 μm et une vitesse de conduction entre 4 et 30 m/s et finalement des fibres non myélinisées de type C qui ont un diamètre entre 0,2 et 1,5 μm et qui ont une vitesse de conduction entre 0,5 et 20 m/s.5
12 1.1.2.3 L’inflammation neurogène
L’inflammation neurogène est un mécanisme pro-inflammatoire de sécrétion de neuropeptides par les neurones sensitifs en réponse à une blessure ou à un stress au niveau d’un tissu. C’est aussi un phénomène fréquemment retrouvé dans certaines pathologies dont libèrent le psoriasis, l’eczéma et le diabète.10 Lorsqu’une des complications énumérées survient, les terminaisons nerveuses des neurones sensitifs sécrètent de façon très importante de la Substance P (SP), de la Calcitonin Gene-Related Peptide (CGRP) et de la neurokinine A (NKA).11 Ceci a pour effet de stimuler l’inflammation par une série de réponses vasculaires et non vasculaires favorables à certaines complications dont la fermeture de plaie cutanée.12 Néanmoins, dans certaines pathologies telles le diabète, une neuropathie peut être induite ce qui nuit à la quantité de neuropeptides sécrétés dans l’inflammation neurogène. C’est entre autres ce qui peut expliquer la maladie du pied diabétique, où le manque de neurones au niveau des membres inférieurs induit une diminution de neuropeptides sécrétés lorsqu’il y a formation d’une plaie menant à une inflammation neurogène qui n’est plus efficace pour contribuer à la fermeture de la plaie.
1.1.2.4 Les neuropeptides
Les neuropeptides sont de petites protéines sécrétées par les neurones qui jouent plusieurs rôles comme la communication entre les neurones, l’expression de gènes, la circulation sanguine locale, la synaptogenèse, dans la morphologie des cellules gliales, etc.13 Plus de 100 peptides différents sont sécrétés par les neurones. Généralement, ces neuropeptides se lient à des récepteurs métabotropiques ou à des récepteurs couplés à des protéines-G pour envoyer des signaux spécifiques aux cellules. La SP et la CGRP font partie des plus importants, surtout au niveau de la peau.14 À noter que des neuropeptides peuvent aussi être sécrétés par les kératinocytes de la peau.15
La SP est un membre de la famille des neuropeptides tachykinines (famille caractérisée par une séquence C-terminale commune, Phe-X-Gly-Leu-Met-Nh2, où X est soit un acide
13 aminé aromatique ou un acide aminé aliphatique) qui agit comme un neurotransmetteur et un neuromodulateur.16–18 Ce neuropeptide a un impact important dans la vasodilatation,
l’inflammation, la douleur et module de manière importante la migration, la prolifération et la croissance cellulaire. C’est par sa liaison au récepteur neurokinine 1 (NK1) que des signaux sont transmis dans des voies de signalisation complexes. Ensuite, la SP est internalisée dans la cellule et est dégradée. Il est maintenant connu que la SP a un effet direct sur les kératinocytes, puisqu’ils expriment le récepteur NK1. Suite à la liaison de la SP, NK1 stimule la production autocrine de SP par les kératinocytes et stimule leur prolifération cellulaire. 19 Au niveau des kératinocytes de la peau par exemple, si on ajoute de la SP dans un environnement sans neurone sensoriel in vitro et in vivo, il est connu qu’elle favorise une ré-épithélialisation plus rapide. 12
La CGRP est un neuropeptide de la famille des calcitonines et il existe deux formes différentes chez l’humain : l’α-CGRP et la β-CGRP. Leurs fonctions sont très similaires et leurs différences ne résident qu’en trois acides aminés différents.20 Ce neuropeptide est sécrété autant par les neurones périphériques que les neurones du système nerveux central (SNC). Ses fonctions sont sensiblement les mêmes que la SP, mais il est aussi impliqué dans la régénération de tissu nerveux lors de dommages.21 C’est par sa liaison à des
récepteurs hétérométriques composés de récepteurs couplés à des protéines-G, appelées Calcitonin receptor-like receptor (CALCRL), et à un receptor activity-modifying protein (RAMP1) que les effets de la CGRP se manifestent.22 On retrouve ces récepteurs au travers du corps au complet, ce qui suggère que ce neuropeptide est aussi très important dans la modulation de fonctions physiologiques.20
1.1.3 Les plaies cutanées
Comme mentionné plus tôt, la peau est l’organe le plus large du corps et agit comme première ligne de défense contre les pathogènes, les toxines et les stress de l’environnement extérieur. Elle joue aussi un rôle critique dans l’homéostasie des fluides et assure les fonctions sensorielles ainsi que la thermorégulation. Des dommages ou perte d’intégrité de
14 la peau provenant de blessures ou de maladies peuvent mener à une morbidité importante ou même dans certains cas, à la mort s’il n’y a pas de guérison.23 C’est pourquoi un
système de réparation de la peau est capital. Cependant, les mécanismes impliqués dans la guérison de plaies peuvent être altérés dans certaines pathologies comme le diabète, ce qui nuit à la guérison normale de plaie.
1.1.3.1 Les différents types de plaies
Il existe deux groupes différents de plaies dépendamment du temps de guérison. Les plaies dites aigues guérissent dans les temps normaux et sont sans complication suite à une coupure ou une brûlure. Les plaies chroniques, tant qu’à elles, prennent plus de temps à guérir et des complications peuvent survenir.24 Ce sont par exemple des plaies chroniques
que l’on retrouve dans certaines pathologies suite à une mauvaise circulation sanguine ou dans le diabète. En effet, on note dans le diabète la complication du pied diabétique dans laquelle les plaies formées ne se referment pas normalement.
Par la suite, les plaies peuvent être séparées en trois types en fonction de la gravité de la plaie. Il y a les plaies de premier degré qui ne sont pas très graves et où seulement l’épiderme est endommagé. Ensuite, il y a les plaies de deuxième degré qui sont un peu plus profondes et vont se rendre jusqu’à endommager le derme. On peut caractériser ce degré en deux soient les plaies superficielles et les plaies profondes. Le type superficiel signifie que le derme papillaire est atteint alors que le type profond représente une plaie qui va aller jusqu’à affecter la région réticulaire du derme. Finalement, les plaies de troisième degré sont caractérisées par des plaies très profondes qui provoquent la destruction du derme et de l’épiderme. Les terminaisons nerveuses de la peau peuvent aussi être gravement affectées dans ce dernier cas.
15 Figure 6 : Différents types de plaies cutanées.
(Source : Dr. François Berthod)
1.1.3.2 La guérison de plaies
La guérison de plaies est un processus essentiel pour rétablir la fonction barrière de la peau afin de prévenir les pertes liquidiennes et les risques d’infections. Le processus de réparation de la peau est initié immédiatement après une blessure par le relâchement de plusieurs facteurs de croissance, de cytokines, de composés à faible poids moléculaire provenant du sérum de vaisseaux sanguins endommagés et de plaquettes dégranulées.25 Les cytokines, entre autres, favorisent la guérison de plaies en stimulant la production de composants de la membrane basale, ce qui prévient la déshydratation, l’augmentation de l’inflammation et l’accélération de la formation de tissus de granulation.26 Il y a quatre
phases dans la guérison de plaies cutanées : l’hémostase, l’inflammation, la prolifération et le remodelage. 27 Le système nerveux périphérique joue aussi un rôle majeur dans ce processus en induisant l’inflammation neurogène via la sécrétion de neuropeptides, comme la SP et la CGRP.
16 Figure 7 : Stades classiques de la réparation et régénération de la peau : a) Inflammation, b)
Formation de nouveau tissue, c) remodelage.
(Wound repair and regeneration, Gurtner G.C., Werner S., Barrandon Y., Longaker M.T.; 2008)
Immédiatement lorsqu’il y a formation d’une plaie, l’hémostase est entamée pour sceller les vaisseaux sanguins et stopper la fuite de sang. Pour se faire, les plaquettes se dirigent vers la blessure afin de permettre la coagulation du sang et la formation d’une matrice de fibrine qui sert d’échafaudage pour la migration de cellules vers la zone endommagée. Les plaquettes sécrètent aussi des facteurs de croissance comme le PDGF (Platelet-derived Growth Factor) pour recruter des neutrophiles et monocytes qui stimulent le recrutement de cellules épithéliales et de fibroblastes. Ensuite, il y a l’inflammation qui peut durer jusqu’à quatre jours après la réalisation de la plaie et durant laquelle les neutrophiles sont relâchés dans le tissu environnant. Ils sont la première ligne de défense contre les infections. Ils produisent une grande variété de protéinases et des espèces réactives de l’oxygène (ROS) pour défendre le corps contre les microorganismes contaminants et induisent la phagocytose de débris cellulaires.28 Ils sont aussi impliqués dans la phase d’initiation proliférative de cellules lors de la guérison de plaies et sont une source importante de
17 facteurs de croissance et de cytokines.29 Lors de cette étape, les monocytes vont se
différencier en macrophages grâce à la libération de cytokines (IL-1, TNF-α, TGF-β…) qui dégraderont le tissu nécrosé de la plaie et servirent de seconde ligne de défense en s’occupant de la phagocytose des bactéries. L’étape de prolifération va par la suite commencer environ quatre jours après la réalisation de la plaie et peut durer de 21 jours jusqu’à plusieurs mois, dépendamment de la grosseur de la plaie. Cette phase est caractérisée par de l’angiogenèse, le dépôt de collagène, la formation de tissu granuleux, la contraction de la plaie et la ré-épithélialisation.28 Les fibroblastes vont sécréter leur propre collagène pour permettre la régénération du derme et les kératinocytes vont se différencier pour former une strate supérieure protectrice ou le stratum corneum. Les cellules endothéliales vont permettre la réparation des capillaires sanguins par angiogenèse. La formation de matrice extracellulaire (MEC) est stimulée par les macrophages et différents facteurs tels que le VEGF, bFGF, l’IL-1, TNF-α, TGF-β et le PDGF. Finalement, le remodelage du collagène permet le réalignement des tissus permettent une bonne force de tension à la peau nouvellement régénérée. Cette dernière étape commence environ 21 jours après que la plaie soit faite et peut durer jusqu’à deux ans, dépendamment de la grosseur de la plaie.28
Les modèles murins sont souvent utilisés dans l’étude de la peau, mais il est important de mentionner que les plaies cutanées chez la souris se guérissent davantage par contraction. Chez l’humain, la guérison se fait principalement par la migration de kératinocytes, la ré-épithélialisation. 12
1.1.3.3 La ré-épithélialisation
Un élément important dans la guérison de plaie est la restauration d’une barrière épidermale intacte pour protéger l’organisme. On appelle ce mécanisme la ré-épithélialisation, elle est caractérisée par la migration et la prolifération des kératinocytes à partir du bord de la plaie et de la différenciation des cellules souches que l’on retrouve sur les bulbes des follicules pileux.30 C’est grâce à une balance complexe entre l’expression et la régulation de facteurs
18 de signalisation et de protéines de surface que la survie et la motilité des kératinocytes sont favorisées pour activer la ré-épithélialisation de la plaie. La motilité des kératinocytes se fait grâce à leur attachement via les desmosomes, les hémidesmosomes et les intégrines, et par l’expression de kératines.31 Ce processus très complexe est favorisé principalement par
la présence de facteurs de croissance épidermique (EGF), par les facteurs de croissance des kératinocytes (KGF) et par le facteur de croissance transformant (TGF-α)26. Dans le cas de certaines pathologies comme le diabète, la prolifération ainsi que la migration des kératinocytes sont altérées ce qui nuit de façon importante à la ré-épithélialisation.
19
1.1.4 Le diabète
Le diabète est une maladie métabolique très répandue dans le monde entier qui atteint des proportions pandémiques. Plus de 3 millions de personnes sont atteintes de cette maladie uniquement au Canada et on estime que ce nombre va augmenter jusqu’à 3,5 millions dans les dix prochaines années.32 Cette pathologie ne se guérit pas, mais il est possible de la traiter et de la contrôler. C’est en fait une maladie chronique qui est causée par une résistance ou une déficience d’une hormone appelée insuline. Elle est sécrétée par les cellules β du pancréas et permet normalement le stockage du glucose dans les cellules pour abaisser le taux de glucose dans le sang. Après avoir mangé un repas, de l’insuline est sécrétée sous l’influence de l’élévation de la glycémie pour réduire les aliments glucidiques en glucose et procurer l’énergie nécessaire aux cellules. Chez les diabétiques, l’inefficacité de l’insuline est ce qui entraîne la complication majeure dans la pathologie, soit une hyperglycémie. Une accélération de la réaction de glycation est observée dans l’hyperglycémie ce qui provoque une augmentation de la formation de molécules appelées « Advanced glycation end-products » (AGEs). Ce sont ces molécules qui sont principalement responsables des complications dans l’hyperglycémie. La formation d’AGE est davantage décrite dans la section « Glycation » suivante.
1.1.4.1 Les types de diabète
Il existe deux types principaux de diabète : celui de type I et celui de type II. Le diabète de type I est habituellement retrouvé chez les personnes plus jeunes dû à la destruction auto-immune sélective des cellules β qui produisent l’insuline, ce qui mène à une déficience en insuline.33 Environ 5% des personnes diabétiques sont touchées par ce type et ces personnes dépendent donc d’injections quotidiennes d’insuline ou d’une pompe à insuline pour assurer leur survie.34 Ensuite, le diabète de type II, qui représente l’autre 95% des cas, est caractérisé par une hyperglycémie et une insensibilisation à l’insuline dans l’obésité. L’insenbilité à l’insuline est le résultat de la résistance à l’insuline, la diminution de la production de l’insuline et à une éventuelle insuffisance de cellules β du pancréas. Ceci
20 mène à une diminution du transport du glucose dans le foie, les cellules musculaires et les cellules adipeuse. On observe donc une augmentation de la répartition des graisses avec l’hyperglycémie. Ce type de diabète résulte de l’interaction entre la génétique, l’environnement et les habitudes de vie. Les mauvaises habitudes qui favorisent le développement de cette maladie sont l’inactivité physique, une vie sédentaire, fumer la cigarette et la consommation excessive d’alcool. Il a été montré que l’obésité contribue approximativement à 55% des cas observés. Le diabète de type II est donc moins dangereux pour les personnes atteintes, mais rend tout de même vulnérable à des complications à long et court terme, qui mènent souvent à une mort prématurée. En général, un changement dans l’alimentation, la pratique de sports et la perte de poids permet de réguler leur diabète, mais des injections d’insuline peuvent être nécessaires pour réguler la glycémie sanguine.34
1.1.4.2 Les problématiques dans la pathologie
L’hyperglycémie prolongée est reconnue comme étant le principal facteur de cause dans la majorité des complications associées au diabète. 35 Un taux élevé de sucre dans le sang finit par entraîner plusieurs complications, notamment au niveau des yeux, des reins, des nerfs, du cœur et des vaisseaux sanguins.34 Les diabétiques sont aussi davantage à risque de
développer de sérieux problèmes cérébro-vasculaires que les personnes non-diabétiques et courent un risque accru d'accident vasculaire cérébral et d'infarctus du myocarde causés par de l’occlusion vasculaire. 36–38 Une micro angiopathie peut aussi se développer. Cette
complication est caractérisée par des dommages progressifs aux cellules endothéliales et des cellules murales des capillaires sanguins ce qui provoque des occlusions aux capillaires, une ischémie et un affaiblissement d’organes. Ceci peut être néfaste au niveau de la peau. En effet, plus de 15% des personnes diabétiques vont développer des ulcères aux pieds et la guérison de ces ulcères est grandement altérée.32 Ces ulcères diabétiques ont un impact négatif considérable sur la psychologie, le social et sur le bien-être physique des personnes atteintes. Certaines de ces personnes doivent se rendre jusqu’à avoir recourt à l’amputation de membres inférieurs. Des frais de plus de 150 millions de dollars sont encourus chaque
21 année par le système de soins en santé canadien.32 C’est pourquoi il est indispensable de
trouver une solution pour aider les personnes atteintes par cette complication.
1.1.4.3 Recherches et solutions
Les traitements de prévention du diabète ont beaucoup évolué depuis la meilleure compréhension de la structure et de l’utilité de l’insuline en 1921 par Frederick Banting.32
Grâce à cela, le développement de traitements a permis de sauver et de rallonger l’espérance de vie de certaines personnes diabétiques. Bien que les stratégies de prévention face à la pathologie soient meilleures, il est important de connaître davantage les raisons et les mécanismes du développement de complications dans le diabète pour tenter de trouver des solutions spécifiques aux différents problèmes. Par exemple, les complications dans la maladie du pied diabétique (ulcère sur les membres inférieurs) peuvent être bien étudiées et éventuellement mieux comprises par l’utilisation de modèles animaux ou par génie tissulaire. L’utilisation de modèles animaux est une approche bien accessible mais, la peau humaine et la peau murine sont très différentes. Pour ce faire, le glyoxal et le méthyl-glyoxal peuvent être utilisés pour induire le phénotype de glycation dans les modèles, pour mimer l’effet du diabète, en induisant la formation de molécules impliquées dans la pathologie du diabète, les AGE. La grande majorité des équipes de recherche induisent la glycation en premier lieu sur les protéines de la MEC et ajoutent les cellules sur cette MEC glyquée. Ils arrêtent le traitement qui induit la glycation après avoir ensemencé les cellules puisque le traitement est toxique pour les cellules. Cette approche utilisant des kératinocytes et des fibroblastes permet d’analyser plusieurs mécanismes d’action dans la formation et l’effet des AGEs pour finalement mieux comprendre et guérir les ulcères dans la maladie du pied diabétique.
22
1.1.5 La glycation
La glycation est normalement induite par un processus lent qui s’étend sur plusieurs années. C’est un processus naturel responsable de la liaison entre un sucre réducteur et des protéines de la MEC. 39 Cette réaction non-enzymatique est un processus pathologique qui est retrouvé dans le vieillissement et produit des géronto-toxine, les AGEs. Cependant, certaines pathologies, comme le diabète, peuvent accélérer leur formation. 40
Le processus de la glycation est caractérisé par une réaction non-enzymatique entre les groupes aminés des protéines, lipides et acides nucléiques, (plus précisément, sur un groupe ε-amino d’un résidu lysine et sur un groupe α-amino du N-terminal d’une protéine) avec les formes réactives alpha oxoaldéhydes des sucres réducteurs comme le glyoxal, le méthylglyoxal et la 3-déoxyglucosone.41,42 Ces molécules produisent initialement des bases de Shiff, qui subissent ensuite un réarrangement de type Amadori ce qui mène à la formation de liens kétoamine stables pour générer les AGEs via une réaction chimique que l’on appelle la réaction de Maillard.43,44 La progression des réticulations entre les protéines
se fait lentement dans un réarrangement des Amadori pour créer les intermédiaires réactifs qui vont réagir avec les groupes aminés avant la formation irréversible des AGEs.45 La présence de groupes aminés sur certains phospholipides comme la phosphatidyléthanolamine et la phosphatidylsérine constituent des sites appropriés avec lesquels le glucose peut réagir pour former des AGE.46 Ensuite, les AGEs peuvent subir une
oxydation, une déshydratation, une polymérisation ou une réaction de dégradation oxydative pour former de nombreux AGEs.47–49 Les AGEs sont donc un groupe de molécules très hétérogènes.
23 Figure 8 : Différentes façons de générer la formation d’AGEs.
(Glycation-a sweet tempter for neuronal death., Brain Research Review, Kikuchi S. et al.; 2003)
1.1.5.1 Les «Advanced glycation End-products» (AGEs)
Les AGEs sont des molécules endogènes qui sont formées naturellement au courant du vieillissement. Leur quantité peut être contrôlée par plusieurs mécanismes dont le plus important est leur liaison à certains récepteurs extracellulaires. Plusieurs cellules ont développé une voie de détoxification intrinsèque contre l’accumulation d’AGEs notamment via le bris oxydatif des produits de la glycation par des enzymes et par l’interaction avec des récepteurs cellulaires.50–52 Un système naturel basé sur des récepteurs in vivo permet de supprimer les produits de la glycation des tissus, ce qui limite leurs effets délétères. L’interaction entre les protéines AGE-modifiées et le système de récepteurs peut activer des voies de signalisation intracellulaire ainsi que provoquer l’invagination des AGEs dans la cellule pour ensuite être transportés et dégradés hors de la cellule. Parmi ces récepteurs,
24 l’un des plus importants retrouvés sur la majorité des différents types cellulaires, dont les cellules de la peau, est le récepteur RAGE. Le récepteur RAGE est un membre multi ligands de la superfamille des immunoglobulines. Les rôles de RAGE sont entre autres de provoquer l’endocytose et des changements des AGE, mais son rôle est aussi grandement lié à la transduction de signal intracellulaire et pro-inflammatoire.45 De ce point de vue, les RAGE sont plus précisément liés à la famille des molécules et cofacteurs qui induisent un signal de stress oxydatif. Plusieurs facteurs en lien avec le diabète comme le glucose, l’insuline, les AGEs et les ‘’reactive oxygen species’’ (ROS) vont moduler les différentes fonctions du système des récepteurs aux AGEs.53–55 Ces facteurs peuvent par exemple stimuler la production de cytokines inflammatoires par les macrophages et peuvent avoir un impact sur l’expression autorégulée de certains de ces récepteurs. Il existe d’autres récepteurs comme ScR-II et CD36 qui provoquent aussi l’invagination et le transport des AGE, mais RAGE est celui majoritairement retrouvé.
La production d’AGE est significativement plus élevée chez les patients diabétiques et les patients avec une clairance rénale insuffisante.56,57 En effet, il a été démontré que la
formation d’AGE intracellulaire peut être jusqu’à 14 fois plus rapide en condition de forte concentration en glucose (30 mM) comme dans le diabète.58 Il est maintenant évident que
même en absence de diabète, les AGE peuvent être introduits dans la circulation avec des nutriments en chauffant la nourriture et en fumant du tabac.59 La transformation de la nourriture par la chaleur, l’ionisation ou l’irradiation en industrie accélère significativement la génération de nouveaux AGE.60 Cependant, c’est par le diabète qu’ils sont formés le plus rapidement et en plus grande proportion dans le corps humain. Les modifications provoquées par les AGEs, lorsqu’il y a accumulation, impliquent l’oxydation de protéines et de lipides, perturbent la conformation moléculaire, altèrent des activités enzymatiques et résultent d’une reconnaissance et d’activations anormales de récepteurs.61–64
Les principaux AGEs formés par la glycation sont la CML, la N-carboxyéthyl-lysine et la pentosidine.65 Ils ont été bien étudiés et sont couramment utilisés comme marqueurs d’AGE.66 Le CML, qui est l’AGE que l’on retrouve en grande majorité dans la peau, peut
25 être formé de plusieurs façons. Il peut être le produit de la coupure oxydative67 du glyoxal
formé par autoxydation du glucose ou d’un glycolaldéhyde formé par le produit de base de Schiff.68 Pour qu’il y ait production de CML, il doit y avoir une réaction de glycation et des réactions d’oxydation entre un sucre et une protéine. Cet AGE est donc le produit d’une réaction de glycosylation.69 Certains acides gras insaturés comme l’acide oléique et l’acide linoléique peuvent également participer à sa production. En revanche, le CML est un bon marqueur de glycation au niveau de la peau.70
1.1.5.2 Problèmes associés à la glycation
Les AGEs peuvent être formés normalement pendant le vieillissement ou dans l’alimentation et participent à plusieurs fonctions intracellulaires. Seulement, lorsque le niveau global d’AGE dans le milieu extracellulaire et intracellulaire excède la capacité de défense des antioxydants natifs, la glycation peut poser plusieurs problèmes.71 En effet, les effets délétères les plus importants dans la glycation liée au contexte du diabète ciblent le système vasculaire, ce qui peut mener à une rétinopathie, des dysfonctions au niveau des reins, des maladies cardiovasculaires et aussi une neuropathie.72,73
Les AGEs sont connus pour altérer des mécanismes dans les cellules et les tissus par deux façons différentes : par des modifications de protéines de longue longévité, ou par leur liaison avec des récepteurs cellulaires RAGE. La liaison réticulaire des AGEs avec des protéines peut inhiber la fixation récepteur-ligand en provoquant une déformation conformationnelle ou en masquant l’épitope. Ainsi, plusieurs fonctions cellulaires sont affectées. Ces modifications peuvent aussi augmenter la rigidité de la MEC et compromettre la survie cellulaire par des altérations du cytosquelette.74 Il y a donc une altération importante au niveau de la structure et de la fonction des molécules et cela accélère les réactions de stress carbonyle, de glycation non-enzymatique et de stress oxydatif.75 Les protéines qui font partie de la MEC et qui font partie de la membrane vasculaire basale (BM) sont parmi celles qui ont la plus longue longévité dans le corps et sont très sensibles aux modifications en AGE. Ceci peut provoquer d’importantes
26 altérations au niveau de la MEC et de la BM en réduisant leur solubilité, en diminuant les digestions enzymatiques et en causant des anomalies structurelles et fonctionnelles.76,77
Ensuite, les modifications provoquées par la formation d’AGE dans la glycation des lipides et des lipoprotéines sont caractérisées par l’augmentation de protéines à faible densité (LDL). Ceci prédispose donc les patients diabétiques à développer une athérosclérose, qui peut provoquer une augmentation des risques de développer des maladies et d’avoir une crise cardiaque.78 D’autre part, le diabète pendant la grossesse a été associé à des malformations congénitales et à une augmentation de la mortalité et de la morbidité fœtale.79 Il a même été estimé que les femmes avec un diabète dépendant à l’insuline
avaient deux à trois fois plus de chance d’avoir un enfant avec des malformations congénitales, comparativement aux femmes non diabétiques.80 Ces études ont montré l’évidence de l’implication des AGEs dans ces embryopathies diabétiques. La formation d’AGE peut aussi provenir des nucléotides de l’ADN réagissant avec un sucre réducteur intracellulaire. La formation d’AGE sur l’ADN peut ensuite causer des cassures simple brin dans le génome, menant à de sérieux effets tératogéniques.81–83
En plus des problèmes engendrés aux organes par les AGEs, la peau est particulièrement affectée par la glycation, comme observé dans le syndrome de la maladie du pied diabétique.84 On note une insuffisance du dépôt de collagène, une modification de
l’organisation et de l’épaisseur de la matrice extracellulaire et des altérations du système microvasculaire, du réseau neuronal ainsi que dans la différenciation de l’épiderme.85,86 Il faut savoir que la majorité de ces mécanismes sont interreliés ; les neurones sensitifs favorisent la prolifération des kératinocytes et l’angiogenèse via le relâchement de neuropeptides, alors que les kératinocytes supportent la maintenance du réseau neuronal par la sécrétion de facteurs neurotrophiques, qui sont aussi angiogéniques.87 Ainsi, la détérioration des vaisseaux sanguins aussi bien que la dégénération des fibres nerveuses sont les principales causes des dommages au niveau de la peau dans la glycation.88,89 Ces complications provoquent des altérations dans les mécanismes de ré-épithélialisation, ce qui nuit à la guérison de plaie chez les diabétiques et les prédispose à de l’infection. Certains patients doivent avoir recours à l’amputation de membres inférieurs lorsque les plaies sont graves pour leur santé. Les mécanismes fondamentaux dans la
ré-27 épithélialisation qui sont affectés plus précisément sont la prolifération et la migration cellulaire, le dépôt et remodelage du collagène, l’angiogenèse et finalement la contraction des plaies.
Dans la ré-épithélialisation, ce sont les kératinocytes qui sont principalement sollicités. Ils sont directement affectés dans la glycation puisque certaines de leurs fonctions sont altérées, comme leur prolifération, leur migration et leur différenciation.90 C’est ce qui explique la difficulté des plaies à se refermer chez les diabétiques. De plus, les AGEs induisent une diminution de l’expression de la β-defensine-3 sur les kératinocytes, ce qui explique en partie la prévalence d’infections dans les plaies diabétiques.91,92 La liaison des
AGEs à leur récepteur, les RAGEs, peut aussi augmenter l’expression de la matrice-métalloprotéinase-9 (MMP-9) dans les kératinocytes. Il faut savoir qu’une expression excessive de métalloprotéinases est délétère dans la guérison de plaies cutanées et il a été montré que la sévérité clinique des ulcères corrèle avec l’expression de MMP-9.93,94 Ensuite, les kératinocytes de l’épiderme s’attachent à la fibronectine, qui est une glycoprotéine exprimée transitoirement durant la ré-épithélialisation, dans la zone de plaie par l’expression de l’intégrine αvβ6 pour migrer. Cependant, lorsque la fibronectine est glyquée, il a été observé en culture 2D que cela compromettait son attachement à l’intégrine αvβ6, ce qui inhibe la migration des kératinocytes dans la ré-épithélialisation.52
28 Figure 9 : Altération au niveau des cellules dans la glycation.
(Diabetes and vessel wall remodeling : from mechanistic insights to regenerative therapies, Spinetti G., Kraenkel N., Emanueli C. and Madeddu P.; 2008)
Une autre complication majeure qui peut survenir dans la glycation est la neuropathie, surtout au niveau des membres inférieurs. La neuropathie de la peau et la plus commune des complications reliées au diabète, touchant plus de la moitié de tous les patients. Les neurones sensoriels sont directement affectés par la glycation et y sont très sensibles. En effet, on peut observer sur un modèle in vitro en 2D une agrégation des neurofilaments glyqués qui provoque une dégénérescence axonale.95 Une dégénérescence du réseau microvasculaire vasa nervorum des nerfs périphériques aussi bien qu’un dommage direct des neurones et des cellules gliales induisent la neuropathie chez les diabétiques.96,97 Elle se caractérise par la perte de la sensation dans la peau avec un risque élevé de développement d’ulcère aux pieds et aussi de douleur chronique. L’absence d’innervation sensorielle
29 cutanée affecte négativement tous les stades dans la guérison de plaie.98 Elle est due en
partie à la déficience en capillaires sanguins des nerfs périphériques, mais la formation d’AGE induit aussi des dommages directs sur les neurones sensitifs.99 Cette perte
d’innervation fait en sorte que la quantité de neuropeptides sécrétés diminue de manière importante. Les neuropeptides, comme la SP ainsi que le CGRP qui participent entre autres à favoriser la fermeture de plaie cutanée et à transmettre les signaux de douleur, se retrouvent donc en plus faible concentration et ne sont plus suffisant pour jouer leur rôle habituel. Le médiateur de l’effet bénéfique des neurones sur la ré-épithélialisation est encore mal compris, mais on sait qu’une blessure au niveau de la peau stimule la sécrétion de neuropeptides par les neurones sensitifs, tels que la SP et la CGRP.100 Il a été montré que les neurones sensoriels induisent une fermeture de plaies complète par ré-épithélialisation 2,2 fois plus rapidement in vitro en sécrétant des neuropeptides comparativement à un modèle sans innervation. Cet effet a aussi été confirmé in vivo en greffant des peaux reconstruites par génie tissulaire sur des souris CD1.12 En utilisant des souris immunocompétentes (CD1), l’avantage principal est d’évaluer l’effet de l’inflammation, par la signalisation de neutrophile, en présence et en absence d’innervation tout en utilisant des kératinocytes humains dans le modèle pour analyser la ré-épithélialisation. Il est aussi connu que la SP induit une inflammation neurogène en régulant le débit sanguin et module les fonctions immunitaires locales en se liant à son récepteur, neurokinine-1 (NK1).101 Trois
jours après une application topique de la SP sur une plaie pleine épaisseur sur une souris, la densité de leucocytes et de macrophages augmentait. 102 De plus, on sait aussi que la SP a un effet direct sur les kératinocytes puisqu’ils expriment le récepteur NK1. Suite à la liaison de la SP, NK1 stimule la production autocrine de SP par les kératinocytes et stimule leur prolifération cellulaire. 19
30 Figure 10 : Neuropathie au niveau de la peau dans la glycation par le diabète.
(Diabetic Neuropathy And Nerve Damage, Mandelsohn A.; 2010)
Finalement, la combinaison des effets délétères de la glycation sur les capillaires sanguins de la peau, sur le réseau de nerfs et sur l’épiderme peut expliquer la déficience de la guérison de plaies chez les diabétiques. Ces problèmes peuvent mener à la formation d’ulcères et dans certains cas, à la nécessité d’amputation de membres inférieurs.75
1.1.5.3 Tentatives pour contrôler la quantité d’AGE.
Les AGEs sont modifiés dans le corps par des enzymes de dégradation, par le système immunitaire et par des récepteurs qui provoquent leur capture et leur dégradation. Les enzymes de dégradation principales sont les glyoxalase I et II.103 Elles prennent en charge la détoxification en catalysant tout d’abord l’isomérisation de l’adduit hémithioacétal formé entre un glutathion et les α-oxoaldéhydes (comme le méthylglyoxal par exemple) en
S-2-31 hydroxyacylglutathion par la glyoxalase I.104,105 Ensuite, la glyoxalase II hydrolyse les liens
thioesters pour produire des molécules plus petites qui pourront être éliminées.106 Une autre
voie de détoxification existe via la réduction par la réductase d’aldose et carbonyle. Ces systèmes ciblent une grande variété de substrats possédant un groupe carbonyle et ils catalysent en fait la conversion des intermédiaires du glucose en molécules plus petites qui pourront être assimilées ou dégradées.107 Il y a aussi des protéines qui permettent de lier les AGEs pour empêcher leur liaison à d’autres molécules et de causer une toxicité cellulaire.108 Généralement, les molécules d’AGEs sont reconnues et invaginées par des récepteurs cellules-surface et sont dégradées suite à leur endocytose et leur transport hors de la cellule, pour produire des molécules plus petites. Ces molécules se rendent ensuite aux reins où elles seront éliminées. Cependant, bien que ces systèmes aident à maintenir une homéostasie normale du niveau d’AGE au travers de la vie en conditions normales, il s’avère qu’ils ne sont pas aussi efficaces dans certaines pathologies en conditions d’augmentation chronique d’AGE et de stress oxydatif, comme dans le diabète. En effet, on observe dans cette pathologie une accumulation des AGEs aux niveau cellulaire ce qui induit un stress oxydatif important et altère plusieurs fonctions cellulaires fondamentales.109 C’est pourquoi il serait intéressant de trouver une manière de contrôler leur quantité en testant des composés et molécules qui interagissent directement avec les AGEs et par conséquent, diminuer les effets délétères qu’ils provoquent.
Une tentative efficace pour contrôler le niveau d’AGE est d’utiliser des molécules ayant des propriétés anti-glycantes et déglycantes qui permettent d’interagir directement avec les AGEs, provoquent leur élimination. Cependant, il est important de faire la distinction entre ces deux types de molécules. Une molécule dite anti-glycante va prévenir la formation d’AGE en interceptant les intermédiaires carbonyles réactifs qui font partie de la réaction de Maillard dans la production d’AGE. Pour ce qui est des molécules déglycantes, celles-ci permettent de détruire les AGEs déjà formés en brisant les liens entre les intermédiaires du glucose et les résidus aminés des protéines impliquées.
Une stratégie pharmacologique importante qui permet l’inhibition du processus de Maillard est d’utiliser l’aminoguanidine qui est une molécule anti-glycante. Le petit composé
32 d’hydrazine nucléophile de cette molécule a un potentiel inhibiteur de la réticulation des protéines dans la glycation.110 C’est grâce au groupe aminé terminal de l’aminoguanidine
qu’elle se lie spécifiquement aux réactifs intermédiaires du glucose et prévient leur réticulation avec des protéines. Effectivement, plusieurs études ont montré que l’aminoguanidine peut être utilisée pour prévenir les dommages de tissus et les complications vasculaires causés par le diabète. L’intérêt pour cette molécule est allé jusqu’à se rendre en tests cliniques de phase III.111 Cependant, il a été montré qu’un
traitement systémique avec l’aminoguanidine bloque la conversion en forme active de la vitamine B6 chez les patients.112 Ceci est un effet secondaire très toxique quand on sait que la vitamine B6 est impliquée dans de nombreux mécanismes fondamentaux du corps comme la biosynthèse de neurotransmetteurs et la régulation du niveau d’homocystéine.113 Elle participe aussi à plus de 100 réactions enzymatiques différentes.114 L’idée de développer un traitement topique avec l’aminoguanidine serait donc intéressant dans le sens que le traitement pourrait se faire localement et ainsi diminuer de manière importante les effets secondaires toxiques.
D’un autre côté, l’utilisation de molécule déglycante permet d’attaquer les réticulations intermoléculaires irréversibles des AGEs formés dans un système biologique. Cette alternative est attrayante puisqu’elle cible et détruit les AGEs préaccumulés.115,116
L’alagébrium, aussi appelée ALT-711, semble être une molécule déglycante efficace et il a été montré qu’elle permet de reverser la rigidité vasculaire et la distensibilité induites par les AGEs entre autres chez le rat.117
Une autre approche qui pourrait être intéressante serait de prévenir l’interaction entre les AGEs et leurs récepteurs ou les autres corps de protéines pour éviter de stimuler les voies de signalisation qui induisent un stress oxydatif. Les propriétés de liaison des AGEs aux lysozymes118 sont aussi une stratégie intéressante puisqu’elles permetent de réduire le niveau d’AGE avec un dialysat pour des patients diabétiques qui ont des problèmes aux reins.119
33 Le génie tissulaire peut être une bonne approche pour faire des tests et tenter de développer un traitement pour favoriser la fermeture de plaie dans la maladie du pied diabétique. Pour accélérer le processus de la glycation dans le modèle in vitro, le glyoxal est souvent utilisé dans la littérature à la place du glucose ou du ribose.120 Son fort pouvoir réducteur permet d’induire rapidement la formation d’AGEs, sans toutefois être trop toxique, ce qui permet de faire les manipulations dans des temps raisonnables. Finalement, des molécules antiglycantes et déglycantes comme l’aminoguanidine et l’alagébrium, respectivement, sont de bonnes cibles pour contrôler la quantité d’AGE produits.
34
1.2 Problématiques :
La peau est, comme mentionné précédemment, l’organe le plus important en taille et en poids du corps humain et procure une protection des autres organes aux stress environnementaux comme des pathogènes extérieurs par exemple. La guérison de la peau est un mécanisme qui permet de régénérer celle-ci lorsqu’elle est endommagée pour prévenir la perte liquidienne, les infections et pour rétablir la fonction barrière de la peau. Les neurones sensitifs qui innervent la peau contribuent entre autres à ce mécanisme de guérison de la peau en sécrétant des neuropeptides comme la SP et la CGRP qui peuvent se lier à leur récepteur retrouvé sur les kératinocytes de l’épiderme et ainsi stimuler leur prolifération et la sécrétion autocrine de neuropeptides. Ceci accélère donc la ré-épithélialisation et permet une fermeture rapide et efficace de plaie cutanée.
Cependant, dans certaines pathologies comme le diabète, une neuropathie (une perte d’innervation) peut être observée au niveau des membres inférieurs ce qui peut nuire à la fermeture de plaie lorsqu’il y a blessure. Des molécules appelées AGEs sont formées de manière importante et induisent un stress oxydatif dans les cellules et tissus. C’est ce qui participe majoritairement à induire la neuropathie des membres inférieurs. Cette complication est plus communément appelée la maladie du pied diabétique. En bref, l’absence de neurone provoque une diminution ou une absence de neuropeptides sécrétés par les neurones lors d’une inflammation neurogène en présence d’une plaie ce qui fait en sorte que la fermeture de plaie est grandement ralentie. La plaie ne se ferme donc pas efficacement et peut même aller jusqu’à constamment grossir, surtout au niveau des pieds. C’est en fait la prolifération et la migration des kératinocytes qui sont diminuées par la déficience de l’innervation cutanée et de la vascularisation par les AGEs. Ceci peut mener à d’autres complications importantes comme des infections.
Les ulcères cutanés chez les diabétiques sont un problème très fréquent et important qui touche plus de 345 000 canadiens, ce qui représente 15% des personnes diabétiques.121 De plus, la déficience de la fermeture de plaie cutanée nécessite dans plusieurs cas l’amputation de membre inférieur. Ces amputations d’ulcères diabétiques représentent en
35 fait 85% des amputations totales de pied.122 La qualité de vie des personnes diabétiques qui
ont recours à l’amputation est donc grandement diminuée et des frais importants y sont associés. Effectivement, les coûts reliés aux ulcères diabétiques étaient évalués à 547 millions de dollars en 2011.123 Il est donc plus que pertinent de développer un traitement, plus efficace que ceux déjà sur le marché, afin de prévenir la nécessité d’amputation et accélérer la guérison de plaie chez les diabétiques. Leur qualité de vie serait ainsi augmentée et les frais hospitaliers diminués.