Caractérisation des activités protéolytiques et autolytiques de
souches de Lactococcus lactis ssp.cremoris pour l’élaboration
d’un ferment à haute aptitude technologique
Mémoire
Nacira Tahiri
Maîtrise en sciences et technologie des aliments
Maître ès sciences (M.Sc.)
Québec, Canada
Caractérisation des activités protéolytiques et autolytiques de
souches de Lactococcus lactis ssp.cremoris pour l’élaboration
d’un ferment à haute aptitude technologique
Mémoire
Nacira Tahiri
Sous la direction de :
iii
Résumé
La fabrication du Cheddar repose sur plusieurs facteurs, le choix du ferment est l’un des plus déterminants pour la formation du caillé. Les ferments utilisés peuvent être des mélanges de souches, qui n’ont pas toutes les mêmes performances, ce qui entrainent une grande variation dans la qualité du fromage obtenu.
L’objectif de cette étude est d’examiner chez 19 souches de Lactococcus lactis ssp.
cremoris, certaines caractéristiques d’intérêt technologique tel que l’acidification, la
protéolyse et l’autolyse afin d’évaluer leur potentiel pour un éventuel usage dans des ferments dans le but d’optimiser la qualité du fromage avec des caractéristiques constantes. Le test de Pearce est utilisé pour se rapprocher le plus des conditions fromagères. À la suite de ce test, les activités enzymatiques (protéolytique et autolytique) ont été mesurées. L’activité autolytique varie de 424 mU/ml pour la souche 73 à 47 mU/ml pour la souche 83. Pour l’activité protéolytique, on a utilisé deux substrats, MS-Arg et S-Glu. Deux souches (SK11 et E2) se sont distinguées par une activité S-Glu (2,81 et 4,40 mU/ml) plus élevée que Ms-Arg (0 et 0,55mU/ml) dans un tampon sans le NaCl, alors que pour les autres souches, l’activité d’hydrolyse de Ms-Arg était supérieure. La souche E2 a la meilleure activité PepN (14,43 mU/ml) alors que ce sont les souches 83 et E2 qui ont la plus forte activité PepX (40,01 et 20,29 mU/ml). En se basant sur ces résultats, 12 ferments constitués de 3 souches ont été formulés. Les paramètres recherchés pour avoir un ferment considéré comme idéal sont une production d'acide lactique rapide, une activité peptidasique sans génération d'amertume et une capacité d'autolyse dans le fromage. Dans cette étude, une méthode simple et rapide est utilisèe pour caractériser les activités enzymatiques des souches, qui pourrait être utilisée par l’industrie et les résultats obtenus pourraient servir à l’élaboration de nouveaux ferments.
iv
Abstract
The manufacture of Cheddar is based on several factors; the choice of the ferment is one of the most determining factors for the formation of the curd. The ferments used may be mixtures of strains, which do not all have the same performance, which results in a large variation in the quality of the cheese obtained.
The objective of this study was to examine 19 strains of Lactococcus lactis ssp. cremoris, certain characteristics of technological interest such as acidification, proteolysis and autolysis in order to evaluate their potential for eventual use in ferments in order to optimize the quality of the cheese with constant characteristics.
The Pearce test is used to get closer to cheese conditions by following a temperature diagram specific to the manufacture of Cheddar. Following this test, enzymatic activities (proteolytic and autolytic) were measured. Autolytic activity varies from 424 mU / ml for strain 73 to 47 mU / ml for strain 83. For proteolytic activity, two substrates, MS-Arg and S-Glu, were used. Two strains (SK11 and E2) were distinguished by higher S-Glu activity (2.81 and 4.40 mU / ml) than Ms-Arg (0 and 0.55 mU / ml) in buffer without NaCl, whereas for the other strains the Ms-Arg hydrolysis activity was greater. The E2 strain has the best PepN activity (14.43 mU / ml) whereas strains 83 and E2 have the highest PepX activity (40.01 and 20.29 mU / ml). Based on these results, 12 ferments consisting of 3 strains were formulated. The desired parameters for a ferment considered as ideal are a rapid lactic acid production, a peptidase activity without generation of bitterness and an autolysis capacity in the cheese. In this study, a simple and rapid method was used to characterize the enzymatic activities of the strains, which could be used by the industry and the results obtained, could be used to develop new ferments.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des figures ... viii
Liste des tableaux ... ix
Liste des abréviations ... x
Remerciements ... xi
Chapitre 1 Introduction et problématique ... 1
Chapitre 2 Revue de littérature ... 3
2.1. Les protéines du lait ... 4
2.1.1. Les protéines lactosériques ... 4
2.1.2. Les caséines ... 4 2.2. La fabrication du fromage ... 6 2.2.1. La coagulation ... 7 a. La coagulation acide ... 7 b. La coagulation présure ... 7 c. La coagulation mixte ... 9 2.2.2. L’égouttage ... 9 2.2.3. L’affinage ... 10
2.3 Facteurs qui influencent l’affinage ... 10
2.3.1. L’activité de l’eau (aw) ... 10
2.3.2. Le sel ... 10
2.3.3. Le pH ... 11
2.3.4. La température ... 11
2.4. Les bactéries du fromage ... 11
2.4.1. Les bactéries lactiques ... 11
2.4.2. La flore secondaire NSLAB (Non Starter Lactic Acid Bacteria) ... 13
2.5. Activités métaboliques dans le fromage ... 13
2.5.1. Métabolisme du lactose et du lactate ... 13
vi
2.5.2.1. Le système protéolytique des lactocoques ... 17
2.5.2.2. La régulation des gènes codant pour les transporteurs de peptides ... 18
2.5.2.3. Intérêt technologique de la protéolyse ... 19
2.6. L’autolyse des bactéries lactiques ... 22
2.6.1. Processus de l’autolyse ... 22
6.2.2. Les facteurs qui influencent l’autolyse ... 23
6.2.2.1. La température ... 23
6.2.2.2. Le pH ... 23
6.2.2.3. La concentration en sel ... 23
2.7. Interaction entre flores microbiennes ... 25
2.7.1. Les interactions positives ... 25
2.7.2. Les interactions négatives ... 26
2.8. Hypothèse et objectifs ... 28
Chapitre 3 Matériel et méthodes ... 29
3.1. Souches bactériennes et conditions de culture ... 30
3.2 Test de Pearce ... 30
3.3. Mesure de l’autolyse ... 31
3.4. Mesure de l’activité protéolytique... 32
3.5. Dosage de l’activité des aminopeptidases ... 32
3.6 Dosage des protéinases membranaires (CEP I et CEP III) ... 33
3.7. Comptes bactériens ... 33
3.8. Les mélanges de souches ... 33
Chapitre 4 : Résultats ... 35
4.1. Les cultures pures ... 36
4.1.1. La croissance et l’acidification ... 36
4.1.2. L’autolyse ... 39
4.1.4. L’activité des protéases ... 41
4.2. Les ferments ... 43
4.2.1 Croissance et acidification ... 44
4.2.2 L’autolyse ... 44
4.2.3 Activité d’hydrolyse de MS-Arg et de S-Glu ... 45
4.2.4 Les aminopeptidases ... 47
vii
5.1 Le test de Pearce ... 49
5.2 La croissance et l’acidification ... 49
5.4 Activité des protéases ... 53
5.7 La croissance et l’acidification des ferments ... 58
5.8 L’activité autolytique ... 58
5.9 L’activité des protéases ... 59
5.8 L’activité des aminopeptidases ... 59
Conclusion ... 61
viii
Liste des figures
Figure 1:Structure de la micelle de caséines (Phadungath, 2005) ... 6 Figure 2:Étapes de fabrication du fromage Cheddar (adapté de Fox & Cogan, 2004) ... 8 Figure 3: Schéma générale des principales voies métaboliques ayant un impact
technologique chez les bactéries lactiques. A protéolyse, B lipolyse, C métabolisme du lactose (McSweeney & Sousa, 2000) ... 14 Figure 4: Métabolisme du pyruvate (de Vos, 1996) ... 15 Figure 5: Représentation schématique du système protéolytique chez Lactococcus lactis18 Figure 6 : Présentation schématique de la régulation du système protéolytique de L. lactis (Guedon et al., 2001 ; Doeven et al., 2005 ; Savijoki et al ., 2006). ... 20 Figure 7: Schéma général du catabolisme microbien des acides aminés (Roudot -Algaron & Yvon, 1998). ... 21 Figure 8: Structure du peptidoglycane des Lactocoques et les sites d’action de l’hydrolyse du peptidoglycane (Crow et al.,1995 b ; Pillidg et al., 2002) ... 22 Figure 9: Étapes du test d’activité de Pearce modifié (Tiré de Dachet et al., 2010). ... 31 Figure 10: Variation du pH du lait inoculé par les différentes souches au cours du test de Pearce... 36 Figure 11: Correspondance entre la vitesse d’acidification de la souche 103 avec le test de Pearce... 38 Figure 12: Mesure de l’activité LDH en mU/ml libérée dans le tampon de suspension par les cellules lysées ... 39 Figure 13: Activités des aminopeptidases PepN et PepX en mU/ml des souches de
Lactococcus lactis ssp. cremoris ... 40
Figure 14: Activité d’hydrolyse de Ms-Arg et S-Glu par les souches de Lactococcus lactis ssp cremoris en absence de NaCl ... 41 Figure 15: Activité d’hydrolyse de Ms-Arg et S-Glu par les souches de Lactococcus lactis ssp. cremoris en présence de NaCl ... 42 Figure 16: Évolution du pH du lait au cours du test de Pearce pour les ferments... 44 Figure 17: Mesure de l’activité LDH en mU/ml libérée dans le tampon de suspension par les cellules des ferments lysées ... 45 Figure 18: Activité MS-Arg (CEPI) et S-Glu (CEP III) pour ferments en mU/ml. U = μmol/min ... 46 Figure 19 : Activité PepN et PepX des ferments exprimée en mU/ml ... 47
ix
Liste des tableaux
Tableau 1: Exemple de caractéristiques biochimiques d’intérêt technologique de quelques espèces de bactéries lactiques (Cholet, 2006) ... 24 Tableau 2:Inventaire des interactions microbiennes dans le fromage (Irlinger et Mounier, 2009) ... 27 Tableau 3: pH du caillé à la fin du test de Pearce. ... 37 Tableau 4: Activité relative des protéases des souches de Lactococcus lactis ssp.cremoris à l’égard des substrats Ms-Arg et S-glu en présence et absence de NaCl ... 54 Tableau 5: Classification des protéases membranaires de souches de Lactococcus lactis ssp. cremoris ... 55
x
Liste des abréviations
°C : degrés Celsius
AcmA : N actylmuramidase A
Aw : Activité de l’eau ( water activity) CaCl2 : Chlorure de calcium
CEP : Cell Envlope Proteinase CN : Caséines
CO2 : Gaz carbonique h : Heure
KH2PO4 : Phosphate de potassium monobasique LDH : Le lactate déshydrogénase
MES : Acide 2-(N-morpholino) Ethane Sulfonic mL : millilitre
mM : milimolaire mU : miliunité
NADH : Nicotinamide adénine dinucléotide hudrogene NSLAB : Flore secondaire
Opp : Oligopeptidases
PepN, PepO : aminopeptidases PepX : X prolyl dipeptidyl pH : Potentiel d’hydrogène ssp. : Sous-espèce
T : temps U : unité
xi
Remerciements
Mes remerciements et ma reconnaissance vont tout d’abord à ma directrice de recherche, Pr Gisèle LaPointe pour son encadrement méthodique et ses compétences dont elle m’a fait bénéficier et cela dans de nombreux domaines et aspects gravitant autour des bactéries lactiques.
Mes vives reconnaissances vont également à Nathalie Vernoux, qui m’a accompagné depuis mes premiers pas de paillasse jusqu’au traitement des résultats et elle trouvait toujours le temps de vérifier avec moi chaque étape. Je tiens à lui exprimer ma profonde gratitude pour son aide précieuse, ses bons conseils et ses qualités scientifiques et humaines qui m’ont permis d’intégrer l’équipe du laboratoire.
Je tiens aussi à remercier toute l’équipe du laboratoire, Nassim Mecheri, Patricia Savard, Émilie Desfossés-Foucault, et enfin je remercie Mérilie Gagnon de répondre à toutes mes questions avec patience, tant scientifiques que culturelles.
Et je finis par un immense merci à ma famille pour être là chaque fois pour m’encourager et pour donner le meilleur de moi-même.
1
2
L'industrie fromagère constitue un secteur d'activité extrêmement important. Au Canada, le fromage Cheddar est produit à raison de 138 050 tonnes par an, et 67 936 tonnes de cette production sont faites au Québec, ce qui correspond à 31,6 % de la production fromagère de l’année 2010 (Source : Statistique Canada, Tableau 003-0010 Section Calculs réalisés par AAC-DIA, Secteur laitier. prod_cheddar.xls).
L’intérêt des bactéries lactiques dans l’industrie agroalimentaire réside principalement dans leur capacité à transformer certains sucres en lactate et ainsi à acidifier le milieu environnant et de produire des composés d’arôme donnant au produit des caractéristiques uniques. Comme aucune souche prise individuellement n'est capable de fabriquer un fromage Cheddar de bonne qualité, des mélanges de souches sont utilisés. Ainsi, lorsqu'une souche est caractérisées pour une activité précise, on pourra l’associer à une autre souche pour avoir des caractéristiques optimales pour la fabrication fromagère (Exemple: acidification, désamérisation, texture...). L'activité résultante de toutes les activités enzymatiques individuelles permet d'obtenir un fromage avec des propriétés d'arômes et de textures optimales autorisant sa commercialisation.
Malgré cette importance, l'industrie fromagère demeure un secteur vulnérable aux pertes économiques. En effet, l'accroissement de la productivité et l'utilisation répétée des mêmes ferments lactiques augmentent le risque d'échec fermentaire dû à la présence naturelle de bactériophages dans le lait cru et pasteurisé (Chopin, 1980). Un grand nombre de souches est requis par l'industrie afin de pouvoir effectuer la rotation des ferments. Une meilleure connaissance des ferments, ainsi qu'une meilleure caractérisation des activités métaboliques de leurs souches semblent être très importantes afin de réduire les coûts reliés à la maturation et ainsi optimiser les productions fromagères.
Le but de ce travail est de permettre une meilleure connaissance des activités protéolytiques, aminopeptidasiques et autolytiques des souches de Lactococcus lactis ssp.
cremoris lors d’une simulation de la fabrication du fromage Cheddar, puis de réévaluer ces
activités une fois que les souches sont mises en mélange de trois, afin de déterminer s’il ya des interactions qui s’établissent entre ces souches et de choisir les meilleurs ferments pour fabriquer du fromage Cheddar.
3
4 2.1. Les protéines du lait
D’un point de vue physico-chimique, le lait peut être considéré comme une émulsion de matière grasse dans une solution aqueuse, contenant de nombreux éléments, dont les uns sont à l’état dissous (lactose, sel, vitamines, protéines et composés azotés solubles) et les autres sont sous forme colloïdale (micelles de caséines, phosphate de Ca et de Mg). Les protéines dans le lait ont une teneur moyenne de 34g / L. Ces protéines sont partagées en deux fractions principales, classées selon leur solubilité à pH 4.6; une fraction soluble qui est composée de protéines lactosériques et une fraction colloïdale qui est formée par les caséines, ces fractions représentent respectivement 20% et 80% des protéines totales (Luquet, 1990).
2.1.1. Les protéines lactosériques
Les protéines du lactosérum, qui représentent 5-7 g / l, sont la fraction qui reste soluble lors d’une précipitation à pH 4.6 et à 20°C. Elles regroupent différentes entités ayant une bonne valeur nutritionnelle et dotées d’activités biologiques, on distingue principalement : la β-lactoglobuline, la α-lactalbumine, les immunoglobulines, l’albumine sérique bovine et les protéose-peptones. D’autres protéines et enzymes sont aussi présentes mais à des proportions plus réduites (Brule et al., 1997).
2.1.2. Les caséines
Les caséines (CN) sont des phosphoprotéines de 150 à 200 acides aminés. Elles se définissent comme étant la fraction protéique qui précipite à pH 4.6 et à 20°C. Les caséines sont au nombre de quatre: caséine-αs1, caséine-αs2, caséine-β et caséine-κ (Fox et al ., 2000).
En raison de leur importance commerciale, les caséines sont étudiées intensivement et sont probablement, le meilleur système protéique caractérisé des aliments (Fox et al., 2005).
CN-β contient 209 résidus d’acides aminés et comporte cinq résidus de sérine phosphorylées (Brule et al., 1997). Elle ne contient pas de résidu de cystéine. Cette protéine possède neuf variantes génétiques (A1, A2, A3, B, C, D, E, F, G) (Farrell et al., 2004). La
5
présence de certaines variantes génétiques des caséines dans le lait, a un effet significatif sur les propriétés de fabrication du fromage (Fox et al., 2000).
Le lait bovin contient environ 9.3 g/L de caséine-β. Celle-ci peut être hydrolysée par la plasmine et générée les fragments 1-28 (PP8f), 1-105/107(PP8s) qui sont également appelés protéose-peptones et qui se retrouvent dans le lactosérum. Les fragments complémentaires sont les caséine-γ1 [29-209], caséine-γ2 [106-209], caséine-γ3 [108-209] sont insolubles à pH 4.6 (Singh et al., 2016; Fox et al., 2000 ; Farrell et al., 2004).
La CN-αs1 bovine est la protéine majeure du lait de vache ; elle représente plus de 40% des caséines totales, elle possède huit variantes génétiques (A, B, C, D, E, F, G et H), le variant B constitué de 199 résidus d’acides aminés est le plus fréquent, il possède huit résidus toujours phosphorylés. La caséine αs1 aurait un rôle de charpente de la micelle (Eigel et al., 1984).
La caséine αs2 bovine contient 207 résidus d’acides aminés, c’est la caséine la moins abondante (10% des caséines totales). Elle est le composant caséinique le plus phosphorylé, avec un degré de phosphorylation variable, allant de 10 à 13 phosphores (Swaisgood, 2003).
La CN-κ bovine contient 169 résidus d’acides aminés (Molle & Leonil, 1995), cette caséine ne précipite pas en présence de calcium et permet donc la stabilisation de la structure micellaire. La caséine-κ a la particularité d’être glycosylées, elle présente six sites de O-glycosylation situés dans la partie C- terminale de la protéine. CN-κ joue un rôle clé dans la coagulation du lait par la présure, son hydrolyse en deux parties, la partie N- terminale (1-105), légèrement cationique et très hydrophobe, et la partie correspondante au glycomacropeptide (106-169) très hydrophile, donne un caractère très amphiphile à la protéine (Creamer, 2002).
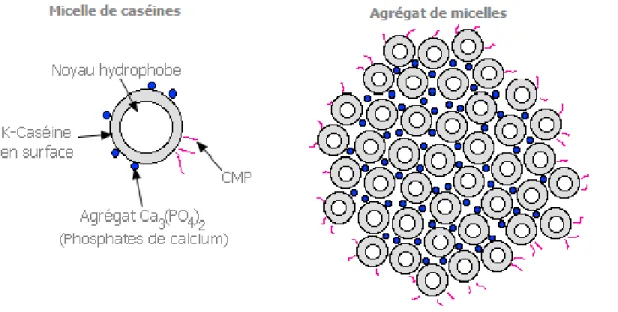
Lors de l’hydrolyse par la présure, la para-caséine κ (1-105) reste accrochée à la micelle, alors que le glycomacropeptide (106-169hydrophile est perdu dans le lactosérum). La micelle en perdant son pôle hydrophile stabilisant et précipite (Figure 1) (Cayot & Lorient, 1998).
6
Figure 1: Structure de la micelle de caséines (Phadungath,2005)
Malgré les variations dans la composition en caséines du lait des différentes espèces. Les caséines se présentent sous la forme de micelles. La micelle de caséine est une particule de taille variante de 50 à 600 nm avec un diamètre moyen de 150-180 nm (Amiot
et al, 2002 ; Fox &Brodkorb, 2008).
L’un des rôles de la micelle est de transporter le phosphate et le calcium dans le lait, permettant de maintenir une concentration élevée de calcium fortement assimilable, formée par l’association des caséines (αs1, αs2, β et κ), de quelques fragments peptidiques (les caséines-γ) et des composants salins. Son poids moléculaire moyen est de l’ordre de 108 Da (Horne, 2011).
2.2. La fabrication du fromage
Le fromage est le produit de la conservation du lait de différentes espèces animales, obtenu grâce à l'élimination plus au moins poussée de l'eau et la récupération des matières sèches du lait (Fox& Cogan 2004).
7 2.2.1. La coagulation
Deux modalités sont en usage pour faire cailler le lait en fromagerie : l'acidification et l'addition de présure; donnant lieu à deux types de caillé, soit le caillé acide et le caillé présure. Les propriétés et le comportement de chacun d'eux diffèrent sensiblement, si bien que leurs différences sont à la base de la technologie et des caractères des divers types de fromage.
a. La coagulation acide
La coagulation de la caséine par acidification (fermentation) résulte de la perte de sa charge électrique jusqu'à son point isoélectrique (pH 4,6). L'abaissement du pH par acidification (ion H+) réduit l'ionisation négative des micelles de caséine jusqu'à sa neutralité, entraînant ainsi leur coagulation complète.
Le coagulum obtenu par acidification présente une certaine fermeté, il est poreux, friable et inapte à se contracter: ce qui rend son raffermissement difficile, d'autant plus qu'il ne se prête pas à des traitements mécaniques.
b. La coagulation présure
C’est un phénomène où le phosphocaséinate de calcium à l'état soluble dans le lait est transformé, sous l'action de la présure, en phosphoparacaséinate de calcium, insoluble. Le caillé présure est compact, souple, élastique, imperméable et contractile. Ces caractères se répercutent principalement au niveau de l'égouttage et du raffermissement du caillé le rendent capable de supporter des interventions mécaniques au cours de la fabrication.
L’action de la présure est influencée par des facteurs tels que la température, l’acidification et la concentration en ions Ca++.
8
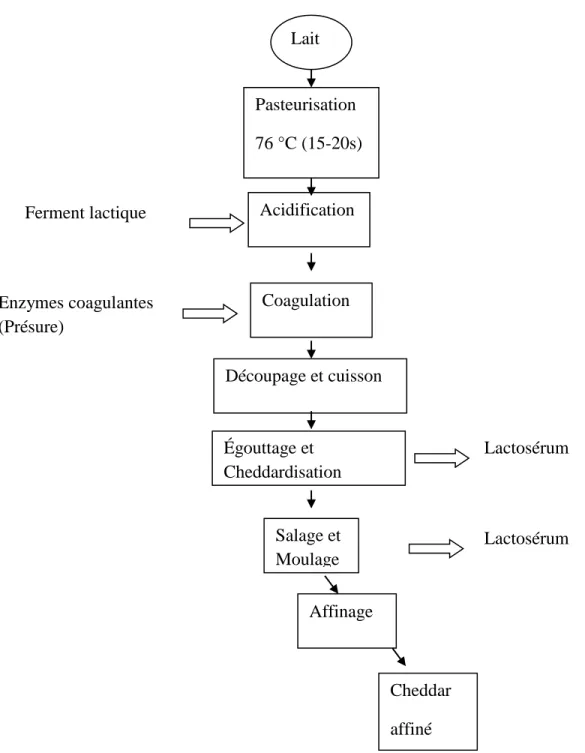
Figure 2: Étapes de fabrication du fromage Cheddar (adapté de Fox &Cogan, 2004) Lait Pasteurisation 76 °C (15-20s) Acidification Coagulation Découpage et cuisson Égouttage et Cheddardisation Salage et Moulage Affinage Cheddar affiné Ferment lactique Enzymes coagulantes (Présure) Lactosérum Lactosérum
9 c. La coagulation mixte
Pour la majorité des fromages, comme le Cheddar, on provoque le caillage du lait par l'action conjuguée de la présure et de l'acidification. Cette coagulation mixte fournit des caillés aux propriétés intermédiaires, moins caractéristiques que celles des caillés obtenus par un seul mode de coagulation. L'emprésurage d'un lait plus ou moins acide, ainsi que l'acidification d'un gel présure sont des applications de la coagulation mixte. On peut noter, entre autres, que dans le premier cas l'acidité diminue le temps de la coagulation présure et, dans le second, le gel présure subit une déminéralisation progressive.
La température du milieu (28 à 35 °C) et le pH de l’emprésurage (6,3 et 6,4) permettent à la fois l’activité optimale des enzymes et le développement des bactéries lactiques.
2.2.2. L’égouttage
Les fromages sont des concentrés de lait. La concentration se réalise par l'expulsion plus ou moins poussée de l'eau et de ses éléments solubles. La pâte qui en résulte est formée essentiellement de caséine et de la matière grasse qui y adhère physiquement. Pour sa part, le lactosérum expulsé entraîne la majeure partie du lactose et des matières azotées non coagulées, ainsi qu'une proportion variable des minéraux. C'est la quantité de sérum retenu dans le caillé qui va déterminer plusieurs caractéristiques qui différencient les variétés de fromage : fermeté, texture, vitesse, intensité de maturation, etc.
Dans le cas du Cheddar, le fromage est soumis à un procédé de cheddarisation qui consiste en une cuisson du caillé à une température entre 38 et 40 °C suivi d’un coupage et de retournements successifs pour éliminer le lactosérum et souder les coagulums de caséine les uns aux autres et ainsi, donner la consistance élastique du fromage Cheddar (Hutkins 2006).
Cette étape peut être complétée par le salage. L’ajout du chlorure de sodium a un triple rôle: il complète l'égouttage et contribue à la formation de la croûte; il règle l'activité de l'eau (Aw) du fromage et par là favorise, freine ou oriente le développement des micro-organismes et les activités enzymatiques au cours de l'affinage; il relève la saveur du fromage et masque ou exalte le goût de certaines substances formées au cours de l'affinage.
10
Le salage se fait soit à sec (manuel ou mécanique), soit par saumurage (Broome, Powell et
al., 2011).
2.2.3. L’affinage
L’affinage correspond à une phase de digestion enzymatique des constituants du caillé, qui implique des enzymes d’origines diverses, elles peuvent provenir directement du lait (plasmine, lipase), être ajoutées (enzymes coagulantes, ferments lactiques) ou produites par la flore d’affinage. L’ensemble de ces enzymes va permettre l’hydrolyse de la matière grasse, la dégradation des protéines et la fermentation du lactose, conférant ainsi au fromage de nouvelles caractéristiques texturales et organoleptiques (Fox, 1989 ; Choisy et
al, 1997a; Mahaut et al., 2000).
2.3 Facteurs qui influencent l’affinage 2.3.1. L’activité de l’eau (aw)
L’activité de l’eau (aw) est un facteur important pour le développement microbien et pour l’expression de l’activité enzymatique, la plupart des bactéries exigent une aw supérieur à 0,98 pour leur croissance. La croissance des microorganismes dans de faibles valeurs d’aw est caractérisée par une augmentation de la phase de latence et une diminution de la vitesse de croissance.
2.3.2. Le sel
Le sel entraine une réduction de l’aw et par conséquence de l’activité des enzymes (lipases et protéases notamment). Il a été démontré par Kikushi et Takafuji (1971) qu’un taux de sel de4 % en poids entraîne une diminution sensible du degré de protéolyse de 40% après vingt jours d’affinage. La nature du sel utilisé a également une importance dans l’affinage, les ions Na+sont des inhibiteurs enzymatiques beaucoup plus efficaces que le K+ (Fox et al., 2000).
11 2.3.3. Le pH
L’influence du pH sur le développement microbien et l’activité enzymatique est particulièrement déterminante. Les bactéries lactiques ont besoin d’un pH inférieur à 5,0 et l’activité de la plupart des protéases microbiennes est maximale pour des pH compris entre 5,5 et 7,5 et celle des lipases pour des pH allant de 7,5 à 9,0. En dessous de pH 4,5, l’activité et la stabilité de nombreuses enzymes sont fortement réduites.
2.3.4. La température
La température joue un rôle déterminant sur le développement microbien et les processus enzymatiques.
Pour un type de fromage donné, une température plus basse ou plus élevée que la normale se traduit par un affinage plus ou moins rapide. Selon le groupe microbien ou le processus enzymatique, l’influence de la température sera plus ou moins grande et la dynamique interne du phénomène sera profondément modifiée. Toute variation de température provoque donc des différences dans les caractéristiques des fromages notamment sur la protéolyse et la texture (Lenoir et al., 1985).
2.4. Les bactéries du fromage 2.4.1. Les bactéries lactiques
Les bactéries lactiques utilisées dans l'industrie fromagère sont des bactéries à Gram positif, immobiles, non sporulées, ne produisant pas de catalase et ont l’aptitude de produire de l'acide lactique à partir du lactose.
Il existe deux types de ferments lactiques, les ferments mésophiles, composés de bactéries dont la température optimale de croissance est proche de 30 °C et les ferments thermophiles, pour lesquels la température optimale se situe entre 37 et 43 °C (Desmazeaud, 1992).
12
Les espèces du genre Lactococcus sont en forme de coques assemblées en chaînettes de longueur variable. Elles sont homofermentaires et produisent exclusivement de l'acide lactique L(+) à partir du lactose. Leur température optimale de croissance est voisine de 30 °C, elles sont thermosensibles et incapables de croître à de fortes concentrations en sel (6,5 % de NaCl) et dans des milieux basiques (pH ˃ 9,6) (Dellaglio et
al., 1994).
L’espèce L. lactis comprend deux sous- espèces, Lactococcus lactis ssp. lactis,
Lactococcus lactis ssp lactis biovar. diacetylactis et Lactococcus lactis ssp.cremoris. Ces
deux sous espèces sont utilisées intensivement en industrie, quoi que pour la fabrication du Cheddar canadien c’est Lactococcus lactis ssp. cremoris qui est la plus utilisée, en raison de sa meilleure qualité technologique, notamment dans la dégradation des peptides amers (Salama et al., 1991; Sandine, 1988; Vedamuthu et al., 1966).
Dans le fromage, les bactéries lactiques ont pour fonction principale la transformation du lactose en acide lactique. Cette activité acidifiante favorise l’égouttage du caillé et règle son degré de minéralisation ainsi que son pH en inhibant le développement de nombreux micro-organismes indésirables (Cantéri, 1997). La flore lactique intervient lors de l’affinage par leurs activités protéolytiques et à moindre degré lipolytiques modifiant ainsi les caractéristiques de goût et de texture du fromage. Les bactéries lactiques produisent de petites quantités de molécules aromatiques (acétaldéhyde, acide acétique, éthanol, diacétyle), à partir du lactose et/ou du citrate (Urbach, 1995). Les autres facteurs responsables de l’affinage des fromages sont la flore secondaire NSLAB (Non Starter Lactic Acid Bacteria) et les enzymes endogènes du lait. De plus, l’autolyse de certaines bactéries lactiques conduit à la libération de leurs enzymes intracellulaires dans la matrice fromagère (Gobbetti et al., 1999 ; Fitzsimons et al., 2001), ce qui accélère l’affinage et contribue au développement de la flaveur des fromages (Husson-Kao et al., 2000 ; Collins et al., 2003).
L’ajout des flores d’affinage concerne seulement certains fromages. Ces flores sont représentées par une variété de microorganismes (bactéries, levures et moisissures) qui peuvent, selon leur nature, contribuer au développement de gaz pour la formation des yeux,
13
assurer la formation de saveurs typiques ou permettre la neutralisation de la surface du fromage pour y assurer l'implantation d'autres microorganismes (El Soda et al, 2000). 2.4.2. La flore secondaire NSLAB (Non Starter Lactic Acid Bacteria)
La flore secondaire (NSLAB) a été définie comme étant une population microbienne qui se développe durant l’affinage du fromage, elle comprend des micro-organismes capables de croitre dans des conditions hostiles (Franklin & Sharpe, 1963), caractérisée par un très faible taux d’humidité (68 à 61 % de matière sèche), 4 à 6 % de sel, un pH variant entre 4,9 et 5,3 et une déficience en nutriments (Fox et al., 2000).
Lactobacillus casei ssp. casei, Lb. casei ssp. pseudoplantarum, Lb. paracasei ssp. paracasei, Lb. plantarum et Lb. curvatus sont les espèces les plus couramment isolées et
sont pour la plupart des hétérofermentaires facultatifs. Ces lactobacilles sont habituellement présents suite à une contamination après pasteurisation, mais constituent également une partie de la microflore du lait qui résiste à la pasteurisation (Martley & Crow, 1993).
2.5. Activités métaboliques dans le fromage
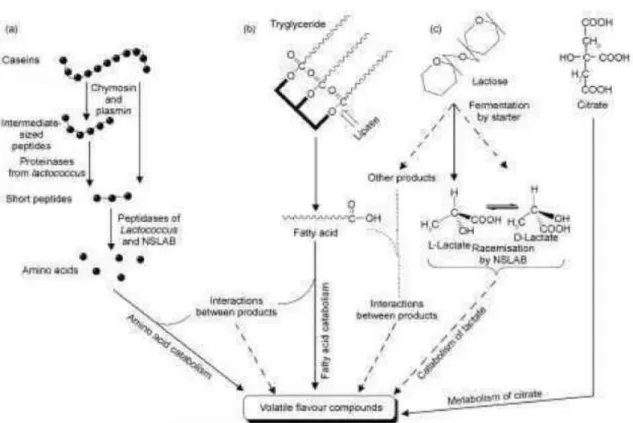
Les principales activités métaboliques impliquées lors de la fabrication du fromage sont la glycolyse, la lipolyse et la protéolyse sous l’action des bactéries lactiques, de la flore NSLAB et des enzymes endogènes (Figure 3) (Tableau1).
2.5.1. Métabolisme du lactose et du lactate
Le lactose, disaccharide, composé de glucose et de galactose, constitue le sucre principal du lait, sa dégradation conduit à la production d’énergie intracellulaire et d’acide lactique. L’évolution des concentrations en lactose et en acide lactique varie suivant le type de pâte et de la flore microbienne utilisée (Mc Sweeney, 2004).
La conversion du lactose en lactate entraîne une chute de pH qui va avoir un impact sur la fabrication et l’affinage du fromage. En effet, l’acide produit accélère la coagulation des caséines et favorise la synérèse. Le pH acide et la faible activité de l’eau réduisent la croissance de certains micro-organismes indésirables tels que Clostridium, Listeria ou
14
travers la membrane cellulaire, le système phosphotransférase (PTS lac), qui phosphoryle le diholoside en lactosephosphate (Figure 4) (de Vos et Hugenholtz, 2004).
Figure 3: Schéma général des principales voies métaboliques ayant un impact technologique chez les bactéries lactiques. A protéolyse, B lipolyse, C métabolisme du lactose (McSweeney & Sousa, 2000)
Le lactosephosphate est clivé par la suite par l’enzyme phospho-β-galactosidase en glucose et galactose-6-phosphate. Le glucose après phosphorylation par le PTS mannose ou la glucokinase (GLK), est catabolisée en pyruvate via la voie métabolique d’Embden-Meyerhof-Parnas (EMP) (ou voie glycolytique), tandis que le galactose-6-phosphate suit la voie du Tagatose-6-phosphate qui elle-même rejoint la glycolyse au niveau des trioses-phosphate (de Vos et Vaughan, 1994; Cocaign-Bousquet et al., 1996).
Le pyruvate est dégradé par quatre enzymes différentes (Figure 4). Le lactate déshydrogénase (LDH), convertit le pyruvate en lactate. Cette réaction se produit majoritairement en excès de lactose ou de glucose dans le milieu, et entraîne une baisse du
15
pH, la LDH est stimulée par les concentrations élevées de fructose diphosphate et de NADH. La deuxième enzyme est le pyruvate-formate lyase qui, à partir du pyruvate, produit le formate et l’acétyl-CoA à pH > 6. Cette enzyme est inhibée par l’oxygène et les trioses phosphates.
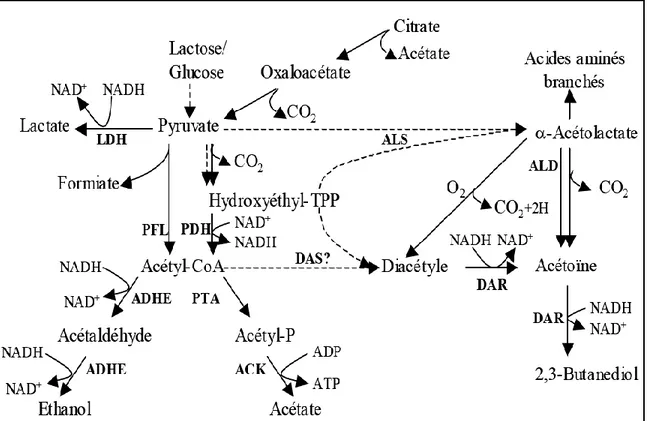
Figure 4: Métabolisme du pyruvate (de Vos, 1996)
LDH : lactate déshydrogénase, PFL : pyruvate formiate lyase, PDH : pyruvate deshydrogénase, PTA : phosphotransacétylase, ACK : acétate kinase, ADHE : alcool deshydrogénase, ALS : α -acétolactate synthase, ALD : α-acétolactate décarboxylase, DAS : diacétyle synthase, DAR : diacétyle-acétoïne réductase
Le troisième est le pyruvate déshydrogénase (PDH) qui catalyse la décarboxylation oxydative du pyruvate en donnant de l’acétyl-CoA et du CO2. La PDH est active en condition aérobie et à pH acide et inhibée par le NADH. Enfin, la quatrième enzyme est l’α- acétolactate synthase qui condense deux pyruvates en α-acétolactate et en CO2. Elle est active à des concentrations élevées de pyruvate et en pH acide (Cocaign-Bousquet et al., 1996; Arnau et al., 1997).
16 2.5.2. La protéolyse et le métabolisme azoté
Dans le lait les bactéries lactiques utilisent en premier lieu les acides aminés libres, mais leur teneur est très faible (de l’ordre de 85 mg/l) (Mills & Thomas, 1981; Juillard et
al., 1995). Cette concentration ne permet que 2% de la croissance totale, ce qui démontre
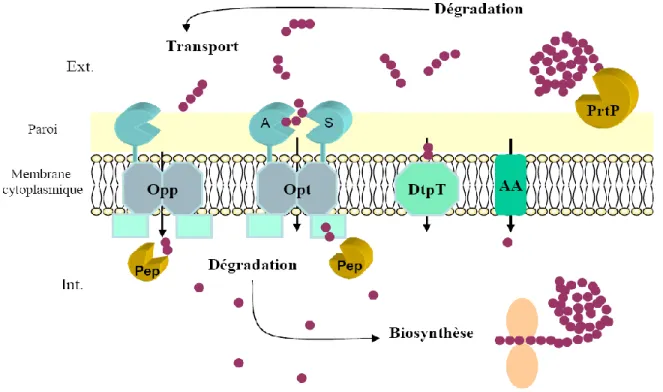
que les acides aminés libres du lait ne jouent qu'un rôle mineur lors de la croissance des bactéries lactiques dans le lait. Ces bactéries, exigeantes d'un point de vue nutritionnel et auxotrophes pour certains acides aminés, doivent donc trouver une source d'azote complémentaire, elles utilisent alors les peptides et les caséines du lait. Cette utilisation requiert l'intervention de la protéase de paroi, qui libère un ensemble d'oligopeptides à partir des caséines qui pourront ensuite être transportés à l'intérieur de la cellule, via le système de transport des oligopeptides.
Les caséines du lait représentent la principale source d'azote pour les lactocoques: 90 % de la croissance leur est imputable (Monnet et al., 1993).
Les caséines sont organisées en micelles, particules sphériques formées par l’association des caséines (S1, S2, , ), de quelques fragments peptidiques (caséine) et de composants minéraux, principalement du calcium et du phosphate. Elles contiennent de nombreux résidus proline qui empêchent la formation de l’hélice et du feuillet permettant ainsi une structure moléculaire ouverte, sensible à l’action des protéases. Leur utilisation met en œuvre un système complexe, qui fait intervenir plusieurs enzymes pour leur dégradation en acides aminés et en oligopeptide et leur transport à l’intérieur de la cellule microbienne (Kunji et al., 1996; Christensen et al.,1999).
17 2.5.2.1. Le système protéolytique des lactocoques
L. lactis produit une sérineprotéase (Cell Enveloppe Proteinase, CEPs) localisée au
niveau de la paroi cellulaire, pivot de la protéolyse des caséines (Smid et al., 1991).Le Ca2+ est nécessaire pour sa fixation à l’enveloppe cellulaire, son pH optimum est entre 5,5 et 6,5 (Law & Haandrikman, 1997). D'un point de vue physiologique, on distingue deux principales catégories de protéases, différentes par leur spécificité d'action sur les caséines du lait et qui sont régulées par la composition du milieu.
Chez Lactococcus, deux types de protéases PrtP, sont distinguéspar leur spécificité d’hydrolyse envers la caséine αS1, β et κ, la -PI et la–PIII (Kunji et al., 1996). Les protéases de type-PI clivent préférentiellement la caséine β, dont la dégradation donnera plus de 100 oligopeptides différents, de 4 à 30 résidus d’acides aminés, cependant, son activité est moins efficace sur la caséine κ et presque nulle pour la caséine αS1, (Juillard et
al., 1995 ; Juillard et al., 1996). Alors que la protéase de type-PIII clive les trois types de
caséines avec la même efficacité (Reid et al., 1991; Coolbear, 2011 ; Reid et al., 1994). Les protéinases PrtP sont en outre classés en sept groupes (a, b, c, d, e, f et g) de par leur spécificité envers le fragment 1 à 23 (F1-23) de la caséine αS1 (Kunji et al., 1996 ; Exterkate et al., 1993). Deux gènes, prtP et prtM, tous deux plasmidiques, sont requis pour la synthèse d’une protéase active (Kok, 1993). Le gène prtP code pour un précurseur de la protéase, tandis que prtM code pour une lipoprotéine impliquée dans la maturation du précurseur de la protéase, qui est localisée au niveau de la membrane cellulaire des lactocoques par le biais d’une séquence d’ancrage C-terminale (de Vos et al., 1989).
L’expression des gènes, prtP et prtM, est contrôlée au niveau transcriptionnel par le contenu en peptides du milieu, et à un moindre niveau par le taux de croissance. Le plus faible niveau d’expression est obtenu dans des milieux riches en acides aminés libres et en peptides (Marugg et al.,1995) (voir la figure 5).
18
Figure 5: Représentation schématique du système protéolytique chez Lactococcus lactis (Savijoki et al., 2006; Doeven et al., 2005, Kunji et al., 1995)
2.5.2.2. La régulation des gènes codant pour les transporteurs de peptides
Il a été démontré chez L. lactis, que l’expression des gènes de plusieurs peptidases (PepX, PepN, PepC), de la protéase de paroi PrtP ainsi que de l’opéron Opp-PepO était dépendante du contenu en peptides du milieu de culture, ces gènes sont réprimés par des dipeptides contenant des acides aminés à chaine latérale ramifiée (valine, isoleucine et leucine) (Figure 6). Après leur internalisation et leur hydrolyse, ces dipeptides exercent leur effet répresseur. En effet, les mutants pepQ incapables de dégrader les dipeptides de type X-Pro, ne présentent plus de signal de répression en présence des peptides Leu-Pro et Val-Pro (Guedon et al., 2001b).
La protéine CodY est un régulateur transcriptionnel qui possède un motif de fixation à l’ADN hélice-tour-hélice dans sa région C-terminale. Il a été démontré qu’elle interagissait directement avec la région promotrice de l’opéron opp-pepO pour exercer son action répressive (den Hengst et al., 2005a). La séquence de fixation de CodY est un
19
palindrome de 15 nucléotides (AATTTTCNGAAAATT) localisée à proximité des boîtes -10 et -35 des promoteurs des gènes régules, et notamment en amont des opérons opt et opp. Des analyses transcriptomiques du mutant codY- de L. lactis ont démontré que ce régulateur agissait sur l’expression de nombreux gènes, principalement ceux impliqués dans le transport et le métabolisme des acides aminés.
Le régulon CodY permet donc d’adapter la synthèse de nombreuses protéines en fonction de la disponibilité en nutriments azotés. Dans ce contexte, la fixation d’acides aminés à chaine latérale ramifiée sur CodY, serait perçue comme un indicateur d’une concentration en acides aminés suffisante pour la croissance, induisant la répression des gènes du régulon dont l’activité n’est plus requise. Il est intéressant de constater que les systèmes Opp et Opt sont tous deux régulés par CodY (den Hengst et al., 2005b; Guedon et
al., 2005).
Chez un mutant codY, les activités peptidolytique et protéolytique ne sont plus réprimées par les peptides issus des caséines. Ces souches pourraient être un avantage lors de la fabrication fromagère. L’augmentation des activités peptidolytique et protéolytique d’une souche pourrait permettre d’améliorer l’affinage de certains fromages et ainsi de modifier leur saveur et leur flaveur (Guedon et al., 2001).
2.5.2.3. Intérêt technologique de la protéolyse
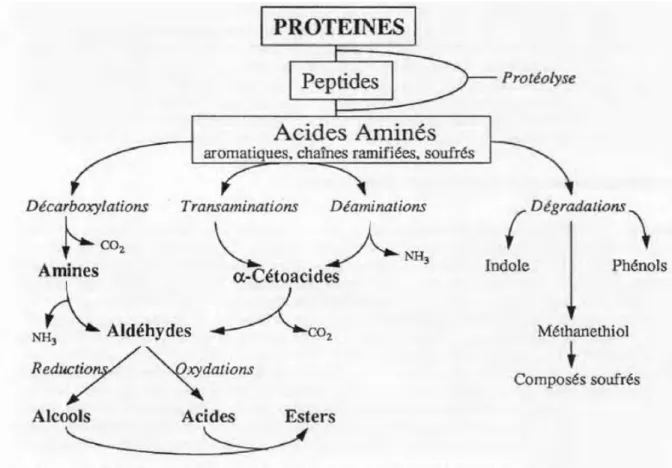
Durant la fabrication de fromage, la protéolyse de la caséine joue un rôle central, Les acides aminés résultants sont les principaux précurseurs d'arôme comme les alcools, aldéhydes, acides, esters et les composés soufrés (Figure 7) (Smit et al., 2005). L’accumulation de peptides hydrophobes comme ceux riche en résidus proline, est un sérieux problème pour l’industrie fromagère car ce sont les principales causes de l’amertume du produit (Smukowski et al., 2003). Les spécificités de la CEP jouent un rôle essentiel dans la production de ces peptides (Visser et al., 1986; Broadbent et al., 2002).
20
Figure 6: Présentation schématique de la régulation du système protéolytique de L. lactis (Guedon et al., 2001 ; Doeven et al., 2005 ; Savijoki et al ., 2006).
a. PrtP Cell-envelope proteinase, Opp oligopeptide permease, DtpT transporteur de di- et tripeptides, Dpp un ABC transporteur de peptides de 2 à 9 résidus d’acide aminé. b. peptidases intracellulaires. PepO et PepF sont des endopeptidases, PepN/PepC/PepP des aminopeptidases, PepX X-prolyl dipeptidyl aminopeptidase, PepT tripeptidase, PepQ prolidase, PepR prolinase, PepI proline iminopeptidase. PepD et PepV dipeptidases D et V. c CodY répresseur transcriptionnel, l’utilisation des résidus acides aminés à chaîne latérale ramifiée (isoleucine, la leucine et la valine) comme cofacteurs, CodY réprime l'expression des gènes du système protéolytique de L. lactis.
L'utilisation de souches déficientes en peptidase indique que PepN, PepX, PepO2 et PepO3, sont impliquées dans la dégradation des peptides amers et dans l'évolution des qualités organoleptiques du fromage (Chen & Steele, 1998; Chen et al., 2003; Christensen & Steele, 2003).
21
Figure 7: Schéma général du catabolisme microbien des acides aminés (Roudot -Algaron & Yvon, 1998).
22 2.6. L’autolyse des bactéries lactiques
Chez les bactéries lactiques, le phénomène d’autolyse présente un intérêt particulier quant à son utilisation potentielle dans la fabrication du fromage.
2.6.1. Processus de l’autolyse
La lyse peut être mise en œuvre soit par une autolyse codée par le matériel génétique, soit par une infection par des bactériophages (Huard et al.,2003). Les deux processus ont en commun, le fait qu'ils requièrent les enzymes hydrolytiques (amidases et muramidases) qui atteignent la paroi de peptidoglycane soit par excrétion directe, soit par la création de pores via la holine de phage (Buist et al.,1995; Huard et al., 2003).
Cinq types d’enzymes lytiques envers le peptidoglycane ont été décrits chez les bactéries à Gram positif (Figure 8) (Crow et al.,1995a).
Figure 8: Structure du peptidoglycane des lactocoques et les sites d’action de l’hydrolyse du peptidoglycane (Crow et al.,1995 b ; Pillidg et al., 2002)
23
Un seul des cinq enzymes, le endo-β –Nacetylmuramidase(AcmA), qui dégrade le peptidoglycane a pu être isolé biochimiquement à partir de souche de lactocoque (L. lactis ssp. cremoris AM2) (Pillidg et al., 2002 ; Buist et al.,1997).
6.2.2. Les facteurs qui influencent l’autolyse
L’autolyse peut se déclencher sous l’influence de plusieurs facteurs qui agissent principalement sur l’activité des enzymes autolytiques.
6.2.2.1.
La températureC’est l’un des facteurs les plus étudiés, en effet plusieurs auteurs s’accordent sur le fait que, plus la température est élevée plus l’autolyse est importante et cela concorde avec les lois de la cinétique enzymatique. Généralement la température optimale pour l’autolyse se situe autour de la température optimale de croissance des bactéries (Dako et al., 1995)
6.2.2.2.
Le pHL’optimum de pH pour l’activité autolytique varie d’une espèce à l’autre et se situe entre 5.5 et 8 (Kang, 1998).
6.2.2.3.
La concentration en selUne augmentation du taux d’autolyse a été démontrée lors de l’exposition des cellules à des milieux fortement hyperosmotiques ou hypoosmotiques. La force ionique du milieu agit sur la conformation spatiale de la paroi en provoquant une contraction ou une dilatation (Kang, 1998)
24
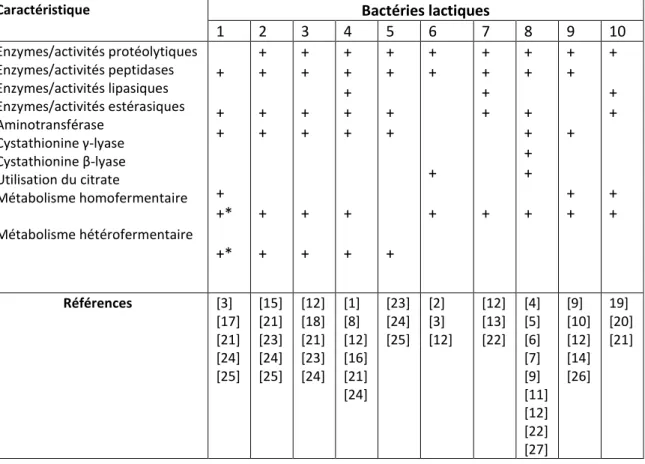
Tableau 1: Exemple de caractéristiques biochimiques d’intérêt technologique de quelques espèces de bactéries lactiques (Cholet, 2006)
Caractéristique Bactéries lactiques
1 2 3 4 5 6 7 8 9 10 Enzymes/activités protéolytiques Enzymes/activités peptidases Enzymes/activités lipasiques Enzymes/activités estérasiques Aminotransférase Cystathionine γ-lyase Cystathionine β-lyase Utilisation du citrate Métabolisme homofermentaire Métabolisme hétérofermentaire + + + + +* +* + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + Références [3] [17] [21] [24] [25] [15] [21] [23] [24] [25] [12] [18] [21] [23] [24] [1] [8] [12] [16] [21] [24] [23] [24] [25] [2] [3] [12] [12] [13] [22] [4] [5] [6] [7] [9] [11] [12] [22] [27] [9] [10] [12] [14] [26] 19] [20] [21]
1. Lactobacillus rhamnosus (sans distinction de souche ou de biovar.) ; 2. Lactobacillus
paracasei ; 3. Lactobacillus curvatus ; 4. Lactobacillus plantarum ; 5. Lactobacillus brevis
; 6. Lactobacillus delbrueckii subsp. bulgaricus; 7. Lactobacillus helveticus ; 8.
Lactococcus lactis subsp cremoris ; 9. Lactococcus lactis subsp lactis ; 10. Enterococcus faecalis.
Les cases vides indiquent l’absence d’information. * concerne les espèces hétérofermentaires facultatives.
[1] Amárita et al. (2001) ; [2] Aubel et al. (2002) ; [3] Bockelmann (1995) ; [4] Bruinenberg et al. (1997) ; [5] Dobric et al. (1998) ; [6] Dobric et al. (2000) ; [7] Engels et al. (2000) ; [8] Freitas et al. (1999) ; [9] Gao et al. (1997) ;[10] Gao &
Steele (1998) [11] ; Holland & Coolbear (1996) ; [12] Jay (1997) ; [13] Khalid & Marth (1990) ; [14] Lange et al. (1994) ;
[15] Macedo et al. (2000) ; [16] Macedo et al. (2003) ; [17] Medina de Figueroa et al. (1998) ; [18] Pereira et al. (2001) ; [19] Sarantinopoulos et al. (2001a) ; [20] Sarantinopoulos et al. (2001b) ; [21] Stiles & Holzapfel (1997) ; [22] Weimer et al. (1997) ; [23] Williams & Banks (1997) ; [24] Williams et al. (2001) ; [25] Williams et al. (2002) ; [26] Yvon et al.
25 2.7. Interaction entre flores microbiennes
Lors de la fabrication du fromage, les levains utilisés sont soit mixtes soit purs; Les levains mixtes (mixed strain starters), sont formés d'un mélange de souches en nombre et en proportions indéfinies contenant des souches acidifiantes et des souches aromatisantes. Quant aux cultures pures (single strain starters) sont des souches sélectionnées en vue d'obtenir une régularité des propriétés organoleptiques et d'acidification. Cela exige une sélection rigoureuse, en particulier en ce qui concerne la résistance aux attaques des bactériophages.
Les différentes souches microbiennes s'entraident pour vivre, entrent en compétition, se supportent et se détruisent (élimination des pathogènes) les unes les autres. L'ensemble de ces interactions gouverne la structure des communautés microbiennes et leurs activités. On les classe en deux catégories: les interactions positives qui se caractérisent par la stimulation d’un ou de plusieurs micro-organismes et les interactions
négatives qui correspondent à une inhibition de la croissance et de l’activité métabolique
(Tableau 2) (Irlinger & Mounier, 2009). 2.7.1. Les interactions positives
Quand on parle d’interactions positives, on différencie le commensalisme où l’un des partenaires est stimulé par la production d’une substance essentielle ou par la destruction d’un facteur inhibiteur, du mutualisme où, dans ce cas, l’interaction est bénéfique aux deux partenaires.
Selon Juillard et ses collaborateurs, (1987), la coopération entre les souches peut être mise en évidence de plusieurs manières; par la production de métabolites particuliers, de nutriments azotés, de l’acidification ou sur la croissance des souches. On a démontré que pour certaines souches le taux de croissance en culture mixte était plus élevé qu’en culture pure ainsi que la quantité d’acide produite. Le phénomène de coopération entre les bactéries lactiques se répercute également sur la production de métabolites dits secondaires. Une coopération entre souches peut être bénéfique à la production de composés d'arôme.
26 2.7.2. Les interactions négatives
Il existe divers mécanismes d’inhibition des micro-organismes entre eux. Si l’inhibition intervient par la production de substances inhibitrices et si un seul des deux micro-organismes est inhibé par l’autre, il convient de parler d’amensalisme. En revanche, si les mécanismes d’inhibition sont réciproques, il s’agit alors d’un phénomène de
compétition. Cette compétition peut s’exercer vis-à-vis de l’espace disponible (inhibition de
contact) et/ou de la disponibilité en substrats (Juillard et al ., 1987).
La production d’acide lactique et l’abaissement du pH initial du lait, contribuent à l’inhibition de certains micro-organismes potentiellement dangereux pour le consommateur (flore pathogène) ou le produit (flore d’altération) (El-Gazzar & Marth, 1992). Cet effet bactériostatique dépend des stéréoisomères de l’acide lactique produits, l’acide L-lactique étant plus inhibiteur que la forme D-lactique (Benthin &Villadsen, 1995). En abaissant le pH du milieu, l’acide lactique permet aussi d’augmenter la toxicité de l’acide acétique (produit par voie hétérofermentaire) envers L. monocytogenes (Adams & Hall, 1988; Ahamad & Marth, 1989; Holzapfel et al., 1995).
L’accumulation du dioxyde de carbone (CO2) dans la bicouche lipidique membranaire peut entraîner un dysfonctionnement de la perméabilité (Eklund, 1984) et, par conséquent, inhiber le développement de certains micro-organismes. En se substituant partiellement ou totalement à l’oxygène, il ralentirait le développement de la flore aérobie stricte et celui de la flore anaérobie facultative en bloquant les décarboxylations enzymatiques (Dacosta, 2000).
Les bactéries lactiques produisent des bactériocines. Il s’agit de substances de nature protéique synthétisée par la voie ribosomique. Elles ont une action bactériostatique ou bactéricide par leur fixation à des récepteurs de la cellule cible. La nisine est une bactériocine, synthétisée par certaines souches de L. lactis ssp. lactis. Elle possède un spectre d’action envers de nombreuses bactéries à Gram positif (dont des streptocoques, staphylocoques, Listeria ou Bacillus) (Benech et al.,2002).
Les interactions qui s’établissent entre les souches ne sont pas à négliger; pour connaitre ces interactions il faut connaitre les caractéristiques des souches individuelles
27
puis les déterminer à nouveau dans les mélanges de souche pour savoir si les souches sont compatibles entre elle et si les interactions qui s’établissent sont bénéfiques ou non pour la qualité du fromage.
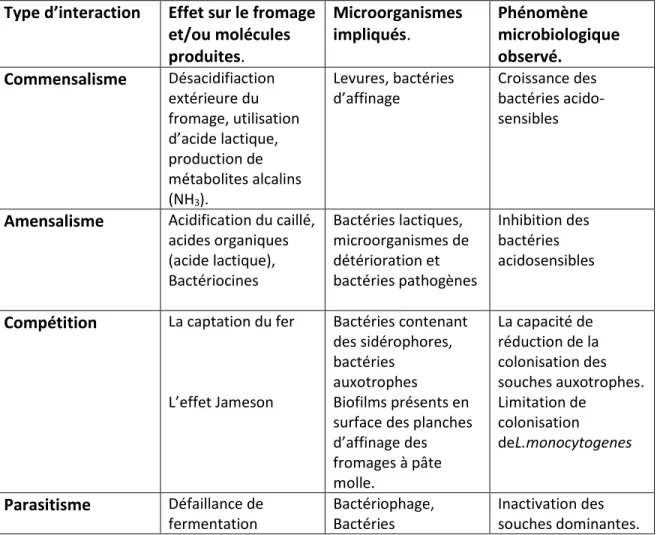
Tableau 2: Inventaire des interactions microbiennes dans le fromage (Irlinger et Mounier, 2009)
Type d’interaction Effet sur le fromage et/ou molécules produites. Microorganismes impliqués. Phénomène microbiologique observé. Commensalisme Désacidifiaction extérieure du fromage, utilisation d’acide lactique, production de métabolites alcalins (NH3). Levures, bactéries d’affinage Croissance des bactéries acido-sensibles
Amensalisme Acidification du caillé, acides organiques (acide lactique), Bactériocines Bactéries lactiques, microorganismes de détérioration et bactéries pathogènes Inhibition des bactéries acidosensibles
Compétition La captation du fer
L’effet Jameson Bactéries contenant des sidérophores, bactéries auxotrophes Biofilms présents en surface des planches d’affinage des fromages à pâte molle. La capacité de réduction de la colonisation des souches auxotrophes. Limitation de colonisation deL.monocytogenes Parasitisme Défaillance de fermentation Bactériophage, Bactéries Inactivation des souches dominantes.
28 2.8. Hypothèse et objectifs
L’hypothèse de ce projet est que la caractérisation de l’activité protéolytique, aminopeptidasique et autolytique de souches pures de L. lactis ssp. cremoris permet l’élaboration de ferments mixtes à haute aptitude technologique. Une telle stratégie permettrait de produire de façon invariable et continue, un fromage Cheddar d’une bonne et constante qualité.
Les objectifs visés par cette étude sont trois :
-Caractériser les activités protéolytiques, aminopeptidasiques et autolytiques des souches de Lactococcus lactis ssp. cremoris en culture pure.
-Caractériser l’activité protéolytique, aminopeptidasique et autolytique des souches de Lactococcus lactis ssp. cremoris en culture mixte.
-Proposer de nouveaux ferments et évaluer leurs activités protéolytique, aminopeptidasique et autolytique.
29
30 3.1. Souches bactériennes et conditions de culture
Dans cette étude, 19 souches de L. lactis ssp. cremoris ont été utilisées. Les souches 71, 72, 73, 81, 82, 83, 91, 92, 93, 101, 102,103, 201, 202 et E2, celles-ci ont été fournies par le partenaire industriel et qui rentre dans la composition de ses ferments pour la fabrication du Cheddar. Les souches de référence SK11 (NCIMB, UK), E8, Wg2 et HP (NIZO, NL) ont aussi été utilisées.
Les souches sont conservées à -80 °C dans un milieu Elliker avec glycérol 20 %. On procède à la réactivation des souches par une incubation de 15 h à 22˚C sur un milieu Elliker additionné de 0,5 % d’extrait de levure (Difco Laboratories, Sparks, MD, États-Unis) et 0,08 % de Tween 80 (Sigma-Aldrich Canada Ltd, Oakville, ON, Canada) (Taibi et
al., 2010). Le repiquage des souches permettra de synchroniser les cultures qui vont servir à
ensemencer le lait pour le test de Pearce. Les incubations sont faites en anaérobiose à 22°C. Deux tubes de 50 ml de lait (Lactantia Pur Filtre 3,25 % de matières grasses) sont utilisés pour le test. Un des tubes est resté stérile tout le long du test et l’autre sert à la mesure du pH.
3.2 Test de Pearce
Le test de Pearce (Feirtag & McKay, 1987; Sheehan et al., 2005) s’est déroulé dans un bain-marie programmable. Les tubes de lait inoculés à 1% par la ou les bactéries d’intérêt sont plongés dans le bain après que la température de l’eau est de 30 °C (T0), suivi de l’ajout de présure (T1) et du CaCl2. La température est augmentée rapidement à 38°C (T2) (températures typiques de cuisson), suivie d’une décente à 35 °C (T3), à cette étape le lactosérum est soutiré pour procéder à la fin au salage à T4. Le test est arrêté au bout de 5h 45mn (T5). Le pH est mesuré à chaque étape pour établir un profil d’acidification des souches (Figure 9).
31
Figure 9: Étapes du test d’activité de Pearce modifié (Tiré de Dachet et al., 2010).
À la fin du test, les cellules bactériennes sont récupérées du fromage après passage dans le«stomacher»en présence du citrate de sodium à 2 %. Les culots obtenus après centrifugation sont lavés trois fois avec Tris 50mM CaCl2 20mM à pH 6.8 pour le tube non stérile, et du KH2PO4 100mM à pH 6 pour le tube stérile. Le surnageant est éliminé et le culot est re-suspendu dans 5ml de Tris 50mM CaCl2 20mM à pH 6.8 pour le tube non stérile et 5ml de MES 50mM pH6 pour le tube stérile.
Des comptes bactériens sur milieu gélosé sont réalisés pour s’assurer du niveau de viabilité des cellules.
3.3. Mesure de l’autolyse
L’autolyse se fait par la mesure de l’activité d’une enzyme intracellulaire, l’enzyme lactate déshydrogénase, LDH, est libérée dans le cas de lyse cellulaire.
La méthode consiste à récupérer les cellules du tube stérile dans le tampon MES et de les incuber à 30°C pendant 24 h (Ouzari et al.,2002). Durant cette période, les cellules des souches autolytiques vont se lyser et libérer le lactate déshydrogénase (LDH). Les cellules non lysées sont éliminées de la solution par centrifugation (Wittenberger &Angelo, 1970).
La LDH est une enzyme intracellulaire qui permet la formation de l’acide lactique à partir du pyruvate durant la glycolyse. Son dosage nécessite un substrat qui est la β-NADH (ε β-NADH, = 6220 M-1.cm-1) à 0,2 mM dans du tampon KH
32
additionné de fructose 1,6 biphosphate 1mM et de pyruvate de sodium 5mM, pour un volume finale de 200μL/puits. La baisse de l’absorbance à 340 nm et à 30°C est enregistrée durant 5 minutes toutes les 5 secondes. Elle témoigne de l’oxydation du NADH par la LDH. Le NADH est un coenzyme d’oxydation nécessaire à la LDH pour synthétiser l’acide lactique quant au fructose 1,6 biphosphate, c’est un cofacteur essentiel à la réaction. Un blanc exempt d’enzyme est aussi réalisé. L’activité de la LDH est exprimée en mU/mL, où une Unité (U) est la quantité d’enzyme catalysant la transformation d’une μmole de substrat par minute.
3.4. Mesure de l’activité protéolytique
La préparation des échantillons aux dosages des aminopeptidases (PepN et PepX) et des protéases membranaires (CEP I et CEP III), commence par la récupération des cellules à partir des flacons non stériles, qui doivent être lavés (3 centrifugations à 14 000 x g à 4°C pendant 10 minutes) avec du tampon Tris 50 mM, CaCl2 20 mM, pH 6,8. Comme précédemment, le culot est récupéré et le surnageant est éliminé. On lyse les cellules en ajoutant environ 2,5 mL de billes de zirconium (0,1 mm de diamètre) à 1 mL de cette suspension. La suspension est ensuite agitée avec l’appareil «beatbeater» pendant une minute, puis placé dans de la glace pendant 2 minutes. La procédure est répétée trois fois. Le lysat est centrifugé à 14 000 x gpendant 20 minutes à 4°C. Ainsi le surnagent va servir pour le dosage des aminopeptidases et le culot est suspendu dans le tampon Tris/CaCl2 pour le dosage des protéases membranaires.
3.5. Dosage de l’activité des aminopeptidases
La présence des aminopeptidases N et X est détectée à l’aide de deux substrats différents préparés dans un tampon calcium. Les deux substrats utilisés (L-lysine-pNA pour PepN et du L-Gly-Pro-pNA pour PepX) sont des solutions d’acides aminés liés à la para-nitro-anilide (ε pNA, = 8800 M-1.cm-1) qui, après sa libération par les aminopeptidases, il pigmente la solution en jaune et qui sera dosée par spectrométrie (Bioteck PowerWave) à 410 nm et 37°C programmé pour faire une lecture chaque minute durant 2 heures. Le blanc est réalisé avec du substrat sans enzyme. Au préalable, la présence des deux
33
aminopeptidases PepN et PepX dans le surnagent et le culot obtenu après la lyse des cellules bactériennes est recherchée, seul le surnagent été testé puisque aucune présence de PepN et PepX n’a été détectée dans le culot (El-soda & Desmazeaud, 1982).
3.6 Dosage des protéinases membranaires (CEP I et CEP III)
Concernant la préparation des échantillons pour le dosage de CEP I et CEP III, elle est identique à celle du dosage des aminopeptidases. Les culots récupérés après la centrifugation sont suspendus dans du tampon Tris 50mM, CaCl2 20mM, pH 6,2, la présence du calcium est importante car elle empêche le relargage des protéases de la paroi et les maintient actives.
Pour le dosage des CEPs I et III, une série de dosages de l’activité des fractions protéiques avec deux substrats différents a été réalisé. De même que pour le test précédent, des solutions d’acides aminés liés à la para-nitro-anilide sont utilisées. Nous utilisons un substrat de type succinyl-alanyl-X-prolyl-phenylalanyl-p-nitranilide (S-Glu) pour le dosage des CEPs III et pour ce qui est du dosage des CEPs I, nous utilisons le substrat spécifique MS-Arg, préparés tous deux dans du méthanol. La mesure de la variation de la DO suite à l’ajout du substrat est faite à 410 nm et 30°C par le spectrophotomètre programmé pour lire chaque puits à 30 minutes d’intervalle durant 10 heures. Un blanc est réalisé avec du substrat sans enzyme (Exterkate et al., 1993).
3.7. Comptes bactériens
Le compte du nombre de bactéries est fait au début et à la fin du test de Pearce sur milieu Elliker gélosé par un ensemencement en masse, puis incubé 24 heures à 30°C. Les résultats sont exprimés en UFC/ml. Un blanc est réalisé avec du milieu gélosé non inoculé 3.8. Les mélanges de souches
Pour les souches en mélanges on a suivi les mêmes étapes d’analyses que sur les souches individuelles.
34
Après avoir revivifié les souches sur milieu Elliker liquide, le lait à 1% a été ensemencé, puis les étapes du test de Pearce sont suivies. Les mélanges sont faits à partir de 3 souches en proportion égale en volume.
Les tests pour les différentes activités sont réalisés selon les mêmes méthodes que sur les souches individuelles.
3.9. Analyses statistiques
Chaque analyse est effectuée en trois répétitions et les résultats présentés sont une moyenne des trois. Toutes les comparaisons de données à la fois pour les souches individuelles ou en mélange ont été effectuées avec le logiciel SAS 9.2 (SAS Institut Inc., Cary, NC, États-Unis). Les différences ont été considérées comme significatives lorsque P < 0,05.
35
36 4.1. Les cultures pures
4.1.1. La croissance et l’acidification
À T0, le pH du lait pour toutes les souches est proche de 6,5, il correspond au pH du lait ensemencé avec une préculture de 16 h. Le pH du lait inoculé avec toutes les souches a diminué au cours du test de Pearce. Après 5h 45 min, le pH du lait inoculé avec les 19 souches varie de 4,21 à 5,55. La vitesse d’acidification dépend de la souche et on peut distinguer trois groupes qui se rapprochent selon le pH final; 83, 93, 103, Wg2, 71 comme étant les plus acidifiantes avec un pH entre [4,21- 4,49], et 201 la moins acidifiante avec un pH de 5,55 (Figure10) (Tableau3).
Figure 10: Variation du pH du lait inoculé par les différentes souches de L. lactis ssp
37 Tableau 3: pH du caillé à la fin du test de Pearce.
Vitesse d’acidification pH du lait culture de 16hpH du caillé à 5h45 min Rapide pH ˂ 4.6 Moyenne pH ≈4.6 Lente pH ˃ 4.6 91 102 83 93 92 103 WG2 81 71 93 103 83 71 Wg2 81 SK11 E8 73 101 73 82 SK11 72 HP 202 E2 E8 201 92 82 101 91 202 102 HP E2 72 201
Le pH au début de test de Pearce n’est pas le même pour toutes les souches puisque le pH des précultures de 16 h varie d’une souche à l’autre. Les résultats obtenus après 16h d’incubation dans le lait, nous ont permit de classer presque la totalité des souches testées, dans la catégorie des bactéries acidifiantes à l’exception de la souche 201 qui se révèle la plus faiblement acidifiante avec un pH de 5,97.
Certaines souches comme 82, 201, HP, E8, SK11 et E2 ont un pH supérieur au point isoélectrique des caséines (4,6), ce qui fait que dans leurs cas le lait ne coagule pas après 16 h de culture à 22°C.
38
D’après le tableau3 et la figure 12 on peut constater que le comportement acidifiant des souches varie peu, c’est-à-dire que le pH du lait chute au cours du temps avec une légère variation d’une souche à l’autre. La vitesse d’acidification varie d’une étape à l’autre correspondant au changement de température ou à l’ajout de sel au fromage comme monter dans la figure11.
Figure 11: Correspondance entre la vitesse d’acidification de la souche 103 avec le changement de température au cours du test de Pearce