UNIVERSITÉ DU QUÉBEC
À
MONTRÉAL
SYNTHÈSE
DE GLYCOSIDES BIVALENTS BIOLOGIQUEMENT
ACTIFS
MÉMOIRE
PRÉSENT
É
COMME EX
IGENCE
PARTIELLE
D
E
LA
MAÎTRISE EN
C
HIMIE
PAR
MILAN BERGERON-BRLEK
UNIVERSITÉ DU QUÉBEC À
MONTRÉAL
Service des bibliothèques
·
Avertissement
La
diffusion de ce mémoire se fait dans le
' respect des droits de son auteur, qui a signé
le formulaire
Autorisation de reproduire et de diffuser un travail de recherche de
.
cycles
supérieurs
(SDU-522 - Rév .01-2006). Cette autorisation
.
stipule que <<conformément
·
à
l'article 11 du Règlement no 8 des études de cycles supérieurs, {l'auteur] concède
à
l'Université du Québec
à
Montréal une licence non exclusive d'utilisation et de .
publication .de la totalité ou d'une partie importante de [son] travail de recherche pour
des fins pédagogiques et non commerciales.
Plus précisément, {l'auteur] autorise
l'Université
.
du Québec
à
Montréal
à
reproduire, diffuser, prêter, distribuer ou vendre des
.
·
copies de
.
{son] travail de recherche
à
des fins non commerciales sur quelque support
que ce soit, y compris l'Internet. Cette licence et cette autorisation n'entraînent pas une
renonciation de [la] part [de l'auteur]
à
[ses] droits moraux ni
à
[ses] droits de propriété
intellectuelle. Sauf ententé contraire, [l'auteur] conserve la liberté de diffuser et de
commercialiser ou non ce travail dont [il] possède un exemplaire .
.
»
D
e
s idées
,
tout le
mond
e e
n a.
Souv
e
nt
l
e
s m
ê
m
e
s.
Ce
qu
'
il
faut
,
c
'es
t savoir
s
'e
n s
e
rvir.
-Co
luche-L
'e
xpéri
e
n
ce e
st un
e
bougi
e
qui
n
'é
clair
e
qu
e c
elui qui la port
e
.
-
Confucius
-N
e
r
é
p
é
t
ez
pas l
e
s m
ê
m
e
s t
ac
tiqu
es
vi
c
tori
e
us
e
s
,
mais adapte
z
-vous aux
c
ir
c
onstan
ce
s chaqu
e
fois particuli
è
res
.
-
Sun Tzu
-P
o
ur l
e
bon
s
trat
ège,
l
'e
s
se
nti
e
l
e
st dans
la
victoir
e,
non pas dans l
e
s op
é
rations
pr
o
l
o
n
gées
.
Tzu-REMERCIEMENTS
J
e vo
udr
a
i
s
r
e
m
erc
1er p
a
rticuli
ère
m
e
nt l
e
Pr. R
e
n
é
R
oy
p
o
ur
so
n
s
upp
o
rt
e
t
so
n
acce
uil d
a
n
s
l
e
l
a
b
o
r
a
t
o
ir
e.
Mes
d
é
but
s e
n t
a
nt qu
e
chimiste
o
r
ga
ni
cien
,
je
l
es
d
o
i
s a
u Pr
.
R
oy,
qui m
'a
dirigé
a
u
co
ur
s
d
e
plu
s
i
e
urs
s
t
ages e
t
a
u
ss
i d
e
cette
maîtri
se, ce
qui m
'
a
p
e
rmi
s
d
'
ex
pl
o
r
e
r l
e
d
o
m
a
in
e
fascinant
d
e
l
a
r
ec
h
e
r
c
h
e e
n
c
himi
e
organique.
La
réali
sa
tion de ce travail n'aur
a
it pa
s é
t
é
possible
sans
la
s
upervision ni le
s
idée
s
et
la
v
ision uniqu
e
d
e
la
c
himi
e
du Dr. D
e
ni
s
Gigu
èr
e
qui m'a
permis
d
e
m'am
é
li
o
r
er e
n
tant
qu
e
chimiste organicien
et e
n
tant
qu
'écriv
a
in d
a
n
s
l
a
r
é
dacti
o
n
de
m
o
n pr
e
mi
e
r manu
sc
rit.
Merci
p
o
ur
ta patience
à
m
on éga
rd
.
Je
voudrais
éga
l
e
ment remerci
e
r
Tze
C
hieh
Shiao
pour l
e
trav
a
il
colossal
qu
'
il
fait
dans le laboratoir
e
et
sa g
rande di
s
ponibilit
é
d
e
tous
le
s
jours p
o
ur r
é
p
o
ndr
e a
u
x
question
s
et
a
pporter d
e
n
o
uv
e
lle
s
id
ées.
Merci
spécialement
à
Sylvain
R
oc
hel
ea
u pour
so
n humour
et
p
o
ur
so
n tr
ava
i
1 de
m
o
d
é
li
sa
tion
,
à
Y
oa
nn
C
habr
e
pour
sa
pr
ése
n
ce e
t
sa g
r
a
nd
e
ouverture
,
Leila Abassi
,
Cat
h
e
rin
e Sa
uci
e
r
et
tous
l
es
m
em
br
es
du
lab
o
rat
o
ir
e et
l
es a
n
c
i
e
n
s
comme
A
l
ex
le
Grec
.
M
e
rci
à
t
o
u
s
l
es
profe
sse
urs qui m'o
nt
e
n
se
i
g
n
é
et
plu
s
p
a
rticuli
è
r
e
m
e
nt
Sylvain
Ca
nesi
et André
C
h
a
r
ette
pour leur
s
excellents
co
ur
s
d
e sy
nthè
se stéréosé
lecti
ve
.
Je
voudra
is
finalement remerc1er
m
a fam
ill
e
pour
l
e
ur
s
upp
ort a
u
co
ur
s
de mes
ét
ud
es.
Particulièrement mon
p
ère avec
qui
j
e v
is
et
qui
m'a
id
e à faire
de
s
c
h
o
i
x éc
l
a
ir
és.
Ce
travail n'
a
ur
a
it
pas
été
p
oss
ibl
e
sa
n
s
l
e
s
uppmt
fi
n
a
n
cier
du
FQRNT et
du
CRSNG.
TABLE DES
MATIÈRES
LISTE DES F
I
GURES .
.
.
. .
.. .
.
. .
.
..
.
.
.. .
.. .
.. . ..
.
.
.. . .. .. .
. .
.. .. ... .. .. . .
.
.
. .
.. .
.
.
.
.. . .. .
.. . ....
vii
LISTE DES TABLEAUX .. .. .. .. .. .. .. .. .. .. .. .. .. .. .... .. .. .. ..
. ...
.. .. .. . .. . .. .. .. .. .. .. .. ..
ix
LISTE DES SCHÉMAS
.
.
.
. .
.
. . .
.
.
. .
.
.
.
. . .
.
. .
.
.
.
.
.
.
.
.
.
. . .
. .
.
.
.
.
.
. .
.
. .
.
.
. .
.
.
.
.
.
.
. .
.
.
.
. . .
.
.
. . . .
x
LISTE DES ABRÉVIATIONS
. .
.
.. .
.. .
. . .. . .. . .
. . .
.
.
.. . . .. .. .
.. .. .. .. .
.
.. .. .
.
..
.
. ..
.
.
..
.
.. ....
xu
RÉSUMÉ
.
.
....
...
...
...
.
...
.
...
..
.
.
....
.
....
...
....
...
..
...
..
..
...
...
XVIICHAPITRE
1
INTRODUCTION ...
...
.
..
.
..
...
...
...
...
....
.
..
...
.
...
.
...
.
...
..
... .
1.1
Importance
biologique des hydrates de carbone
.
....
...
..
.
.
.
....
.
...
...
...
.. ..
1.2
Interactions protéine
-
saccharide multivalentes
.
.
...
.
....
..
...
.
...
...
...
.
.
.
1.3
1.4
1.5
1.6
1.7
Les
l
ectines et leurs li
gands naturel
s ....
...
...
...
...
....
.. .
Intérêt des
glycosides bivalents
...
..
...
.
..
..
...
.
...
.
...
.
Travaux précédents sur
l
es g
l
ycosides bivalents ...
.
..
Couplages organométalliques et composés bi aryles ...
..
..
.
...
..
Objectifs ....
.
...
...
...
.
....
..
...
...
...
...
...
..
..
...
..
...
.
... ..
CHAPITRE II
6
9
12
23
25
SYNTHÈSES PRÉALABLES
.
.
.
.
.
.
. . .
. . . .
.
. . . .
.
.
.
.
.
.
.
.
.
. .
.
.
.
.
.
. ..
.
.
.
.
.
. .
.
. .
. .
.
. . . .
. . . .
.
.
.
.
.
...
26
2.1
2.2
Stratégies de synt
hèse de g
lycosi
des bival
ents .
...
.
.
.
.
.
.
..
..
.
...
.
..
Synthès
e des matériaux de dép
ali
...
...
....
...
..
.
.
...
..
...
..
....
...
... ..
CHAPITRE III
26
26
COUPLAGE DE TYPE ULLMANN
CATALYSÉ AU PALLADIUM .. .. .
.. .... .. .
..
..
30
3.
1
Optimisation des conditions réactionnelles
....
...
.
...
...
..
....
..
30
3.2
Champ d'app
l
ication en utilisant d'autres substrats ...
...
...
.
..
...
.. ..
32
Évaluation
de l
a capacité réticulante des
mannosides bivalents avec
la lectine
" .) ."
.)concanavaline A ...
.
...
..
...
..
...
..
...
..
..
.
.
.. ..
36
3.4
Modélisation des
complexes
li
gand-lectin
e ...
.
...
...
..
..
....
...
...
..
.
...
...
...
.
40
CHAPITRE IV
COUPLAGE DE SONOGASHIRA
.
. . .
.
.. . . .
.
.
.
. .
.
.
.. .
.. . .
. . .. .. .. .. . .
. . .. .
.. .
.
. . .
.
.
.. .. .
.
...
42
4.1Synthèse de glyco
sides
bivalents à partir d'espaceurs de type éthylène glycol
de longueur variable
.
...
..
...
.
...
.
...
...
...
..
...
...
..
..
.
42
4.2
Résultats et discussion ....
..
...
..
....
...
....
...
...
...
... .
43
Vl
CHAPITRE V
CONCLUSION
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 . . 0 0 0 0 0 . . 0 0 0 0 0 o 0 0 0 . . . . 0 0 046
501
5.2
Conclusions
gé
n
éra
l
es
0 0 0 0 0 0 0 . . 0 0 0 0 . . 0 0 . . 0 0 0 0 0 . . . 0 0 0 . . 0 0 . . . . 0 0 0 0 0 0 0 0 0 0 0 0 . 0 0 0 0 0 0 . . . .P
e
r
s
pecti
ves
0 0 0 0 0 . . 0 0 0 . o o . . 0 0 0 0 0 0 0 0 0 0 0 0 0 . . . . 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 .0 0 0 0 0 . . 0 0 0 0 0 . 0 0 0 0 . . 0 0 ° 0 0 0 ° . . ..46
47
CHAPITRE VI
PARTIE EXPÉRIMENTALE
oo o o o o o o o oo oo O o o o o o o o o oo o oo o o oo o oo o o oo oo o o o o o oo ooO o oooo o oo o oo O O O OO48
601
602
603
Généra
lit
és
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 . 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 • 0 0 0 0 0 . 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0Protoco
l
es gé
n
éraux
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 . . . . 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 . . 048
51
6
0
201
Proto
co
l
e
A :
H
omocouplage de
t
ype
Ullmann catalysé au palladium
51
6.202
Pr
o
to
cole
B :
Trans
es
t
érification
ou de-0-acétylation par
l
e
m
ét
hanolat
e
de sodium
ou «
Zemplén
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 051
60 20 3 Protocole C : Couplage
de Sonogashira
0 0 0 0 0 0 0 . 0 0 0. 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0051
Modes
opéra
toire
s et
caractérisation
s
0 0 0 0 0 0 0 0 0 0 0 0 . . . 0 0 . . 0 0 . . 0 0 . .. . . 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0052
CHAPITRE VIl
ANNEXES
o o o o o o oo o oo o o o O O o o o o o o o o o o o oo . . . . o . . o o o oo o o o o oo o oo O O o O OO O o o o O o o o oo O OOo Ooo o oO ooo o O O o O oo o o87
BIBLIOGRAPHIE GÉNÉRALE
0 0 0 0 0 0 0 0 0 . . . 0 0 0 0 . . 0 0 . . 0 0 . . 0 0 0 0 . . . . 0 0 0 0 0 0 0 0 0 . . 0 0 0 0 0 0 0 0.0 0 0 0. . .1
65
Figure
1.1
1.2
1.
3
1.4
1.5
1.61.7
1.81.
9
1.10
1.113.
1
3.2
3.3
LISTE DES
FIGURES
Assoc
iation
multi
valente:
illustration
de
«
l'Effet
Cluster
Glycosidique
»
...
.
....
.
...
..
.
...
.
...
.
Interactions
multivalentes
récepteur-l
igand:
(a) Effet chélate;
(b)
Assemblage
de récepteurs;
(c) Association au
so
us-site; (d)
Réassociation statist
ique: Augmentation de la concentrati
on
locale ..
.
Chélation et
réticulation
de
récepteurs
divalents pas des
ligands
divalents
... .
Effet de
1
'espaceur sur
le mode de
liaiso
n:
A)
EntTopie optimale;
B)
Perte en entropie; C) Système tendu;
D) Stoechiométrie 2:1
...
.
Structure
homotétramérique de
la Concanavalin A
isolée de
Canavalia ensiformis ...
..
...
...
..
..
.
... .
Structure cristalline de
la Fiml
-
I Kl2 de Escherichia
coli
incorporant
le
pui
ssant inhibiteur
butyle
aMan (PDB
1
UWF).
Présence
des
tyrosines 48 et
1
37
formant une
interaction hydrophobe ..
...
....
..
..
.
Adhésion du
virus
de l'
influenza à
la cellu
le hôte par
une interaction
hémmaglutinine-acide sialique ....
....
..
...
...
...
...
... .
Astérisques glycosylés
via
cyclotrimérisation
d'alcynes
bivalents
glycosy
lés ...
..
...
....
...
...
...
...
.
a) Réseaux
réticu
lés
observés
par microscopie
électron
iqu
e;
b)
Modélisation
mol
éculaire
de BC2L-A
en
présence d'un
rnannosid
e
bivalent réticulant
ri
gide
...
..
...
...
...
..
..
..
...
....
.
Structure
de la
Con A et distance entre
deux
domaines de
Page
2
5
6
6
7
8
9
10
11
reconnaissance du saccharide correspondant . . . .
.
. . .
.
.
.
. .
.
.
.
. .
.
. . .
.
.
. . . .
..
11
Microturbidimétrie démontrant
les
propriétés
réticulantes
des
mannosi
des bivalents 47 ( ) et 48b ( ) en présence de
Con A ...
.
Évolution
temporelle
du test
de
microturbidimétrie démontrant les
propriétés
de réticulation des mannosides 123
et
124 envers Con A ..
Distribution de diamètre hydrodynamique
du a)
ligand
monovalent
a-D-m
annopyranose de p
-iodophényle et
du b)
ligand bivalent 123
à
diverses concentrations
en
présence de Con A (3 11M) dans
le
tampon HEP ES ...
...
..
...
... .
Distribution de diamètre hydrodynamique des
ligands bivalent
a)
124 et
b)
125
à diverses concentrations en présence de Con A (3
11M) dans le tampon HEP
ES
..
...
...
..
...
...
...
...
.
19
37
39
3.4
7.
1
7.2
7.3
7.4
7.5
7.6
7.7
7.8
7.9
7.
10
7.1
1
7.12
7.1
3
7.
1
4
7
.15
7
.
16
7.17
7.18
7
.19
7.20
7.21
Modélisation moléculaire de deux sous-unités monomérique de Con
A de
Canavalia ensiformis avec
: a) 1
23;
b)
124
...
...
...
.
Distribution de taille de Con A 3 11M dans HEPES
(Rh max
=8 nm)
.. .
p-
Iodophényle
a
-D-mannopyranose 1.5
~lM+
Con A
3
11M dans
HEPES ...
.
...
...
...
..
...
...
...
.
p-lodophényle a-D-mannopyranose 0.75 11M
+
Con A 3
11M
dans
HEPES
...
...
...
...
...
...
..
...
...
...
.
.
p
-Iodophényle a-D-mannopyranose 0.38
11M
+
Con A
3
11M dans
HEPES ..
....
..
...
..
...
...
...
...
....
...
..
.. .
p-
Iodophényle
a-D-mannopyranose
0.19
~lM+
Con A 3 11M dans
HEPES
...
...
..
...
...
...
...
... .
125
1.5 11M
+ Con A 3 11M dans
HEP ES
.
...
...
..
..
.... .
125
0.75
11M
+Con A 3 11M
dans HEPES ....
...
...
..
.. ..
125 0.38
11M
+Con A 3 11M
dans HEP ES
...
...
... .
1
25 O. 19 11M +Con A 3 11M dans HEPES ...
..
....
...
...
...
.
.
123
1.5
11M + Con A 3 11M dans HEP
ES ....
..
...
...
...
.
123
0.75 11M +Con A 3 11M dans HEPES
....
..
..
...
... .
1
23
0.38 11M +
Con A 3 !lM dans HEPES ....
...
...
...
...
....
...
.
1
23
0.
1
9 J..!M
+
Con A 3 11M dans HEPES ...
....
...
...
... .
J23
0.09
~lM+Con
A 3 f.LM dans HEPES
... ..
1
23
0.05 f.LM
+
Con A 3 f.LM dans
HEP ES
...
..
..
...
.
124
1.5
11M
+
Con
A 3 f.LM dans HEP
ES ....
....
...
.
124 0.75 11M
+
Con
A 3 f.LM
dans HEPES
..
...
... ..
124 0.38 f.LM
+
Con A 3 f.LM dans HEPES
..
...
...
...
...
.
124 0.19 11M +
Con A 3 11M
dans HEPES
...
...
..
1
24 0.09 f.LM
+ Con A 3 f.LM dans HEPES
...
..
..
...
.
124 0.05
f.LM
+Con A 3 f.LM dans HEPES
...
..
Vlll
41
88
88
88
88
88
89
89
89
89
90
90
90
90
90
90
91
91
91
91
91
91
Tableau
l.l
1.2
1.3
3.1
3.2
..,
..,
.J . .J4.1
- - - - -- -- - -- - - --LISTE DES TABLEAUX
Propriétés d'i
nhibition relatives de
g
lycoside
s bivalents obtenus par
«
Click Chemistry » ...
...
...
...
.
.
..
....
...
.
. .
Propriétés d'i
nhibition relatives de
glycosides
bivalents obtenus par
couplage de Sonogashira ..
.
.
.
...
.
... .
Propriétés d'inhibition relatives
de
glycosides b
i
valents obtenus
par
couplage de Glaser
..
...
...
.
...
...
...
...
...
... .
Optimisation de
l'homocouplage
catalysé au
pall
adium du
manno
side
iodophény
l
e 90
pour
former
l
e
mannoside biva
l
ent
113
...
Glycosides bivalents
114
-
120 obtenus
à partir
de
94,
96,
98,
99,
101
,
1
03 et 105 ..
...
....
.
...
...
...
.
...
....
..
.
...
...
.
Mannosides bival
ents
113,
121
et
1
22
obtenus
à
pa11ir de
90
-
92,
suivi
par la déprotection des
hydroxyl
es
fournissant
1
23 - 125
...
...
.. .
Synthèse
des
g
l
ycosides
bival
ents
126
-
145 par
l
a
réaction de
Sonogashira ...
...
...
.
...
...
.
...
.
...
...
...
..
.
....
.
Page
16
1
8
20
31
34
35
44
Schéma
l.l
1.
2
1.3
1.4
1.
5
1.
6
1.7
1.8
1.9
1.1
0
1.11
1.12
1.13
1.14
1.1
5
2
.1
LISTE D
E
S SCH
É
MAS
Propriét
és
d'inhibi
ti
o
n re
la
ti
v
e d
es
m
a
nno
s
id
es
1
-
4
co
ntre
l'
interaction de
l
a fimbr
ia
e d
e
E
sc
herich
ia co
li
0
25
d
ans
Pa
ge
l
'
ag
g
lut
in
a
tion de
l
a
le
vure
.
..
.
.
...
...
....
..
....
.
.
..
.
..
..
.
..
.
.
..
....
..
.
..
4
G
ly
co
s
id
es
bi
v
al
e
nt
s
ob
t
enu
s
par bi
s-g
l
y
c
osyla
ti
o
n
...
...
.
...
.. .
G
ly
co
s
ide
s
bi
vale
nts
sy
mét
r
ique
s o
b
ten
u
s
p
a
r
« Cl
ick
C
h
e
mi
s
tr
y » à
p
a
rt
i
r d
'es
paceur
s
de t
y
pe éth
yl
è
n
e
gly
co
l
bi
s-
prop
a
rgy
lés ...
...
.
Gly
co
s
id
es
bi
va
l
e
nt
s sy
m
é
tri
q
u
esob
t
e
nu
s
p
a
r
«C
l
ic
k
C
h
e
m
is
tr
y
»
à
p
a
rtir d
e cycles
aromat
i
qu
es
d
e s
ub
s
ti
t
uti
o
n
va
ri
a
b
le e
t d
'
un
ca
l
i
x
ar
è
n
e
b
is
ub
s
it
u
é ....
...
.
..
...
....
...
..
...
.
:
.
...
....
.
.
..
....
...
.
Gl
ycos
id
e
biv
ale
nt flu
ores
cent obt
e
nu par
« Cl
i
c
k
C
h
e
mi
s
tr
y » ...
.
.
.
.
G
ly
co
si
d
es
bi
vale
n
t
s mi
x
te
s o
bte
n
u
s
p
a
r
«
Cl
i
ck
Che
mi
s
tr
y » ..
..
....
.
G
ly
co
si
de
s
biv
a
l
e
nt
s
s
y
métrique
s
o
b
tenu
s
p
a
r
m
é
t
a
t
hèse ..
...
... .
Gl
y
co
s
id
es
bi
v
a
l
en
ts
a
sy
m
é
tr
i
qu
es
obt
e
nu
s
p
a
r coup
l
a
ge
de
Sonoga
s
h
i
ra
...
.
.
..
...
.
...
.
..
...
.
.
.
..
...
.
..
...
..
.
...
...
.
.
.
.
...
....
. ..
Gl
y
co
s
ide
s
bi
v
a
l
ent
s sy
m
é
triqu
es
'
o
bt
e
nu
s
p
a
r c
o
upl
age
d
e
Sono
gash
ira .
.
...
...
.
...
.
...
...
..
...
..
.
.
..
..
...
..
...
..
...
..
.
...
..
... .
Glycos
i
cle b
i
vale
nt
sy
m
ét
r
iq
u
e obte
nu
par couplage de J-T
e
ck ...
.
... .
Glycos
i
cles
bi
va
l
e
n
ts
symé
t
r
iqu
es o
bt
e
n
us pa
r
co
upl
age ox
i
cla
ti
f
d
e
Glase
r ..
.
.
..
..
...
.
.
...
...
..
..
..
.
..
...
.
.
.
.
..
.
.
...
..
...
..
...
..
.
G
lyc
o
s
id
es
bi
va
le
nt
s sy
m
é
triqu
es
: thi
oglycos
id
es e
t di
s
u
l
fure
s ..
..
..
..
G
ly
co
s
id
es
bi
va
l
ent
s sy
métriqu
es:
thiour
ées e
t c
a
rbam
a
t
es
.
.
....
.
..
.. .
Gl
y
co
s
id
es
bi
va
lent
s sy
métriqu
es: a
mide
s ..
....
...
....
.. .
Coup
l
a
g
e
s
vari
és ca
t
a
l
ysés
au p
allad
ium(O
) e
t
a
u cui
v
re(I
)
impliq
u
ant
l
e
s g
ro
u
pem
e
nt
s
ar
y
le
e
t alc
y
n
e e
ntre
g
l
y
co
s
ide
s
Ret R
1:a) Coup
lag
e
s
d
e
Son
og
a
s
h
i
r
a
et Gla
se
r p
r
é
c
édemm
e
nt d
é
crit
s;
b
)
Co
upl
age
p
e
rm
e
tt
a
n
t
l
'o
b
te
n
t
i
o
n d
'
u
n es
p
ace
u
r
d
e type ary
l
e
-
ary
l
e
sy
m
é
trique
s
....
.
...
..
.
.
..
.
...
.
.
...
...
..
.
...
..
..
.. .
a) Sy
nth
èse de g
l
ycos
id
es
bi
va
l
e
n
ts sy
m
ét
r
i
qu
es par
c
o
u
p
l
age
d
e
type U
ll
ma
n
n ca
t
a
l
ysé
a
u p
a
ll
a
di
um
à
p
aJii
r d
'
i
o
d
o-a
r
y
l
es
glycosides.
b)
Synthèse
de
glycosides
bivalents
symétriques
p31·
co
upla
ge
d
e So
no
gas
hi
ra
à
pmi
i
r
d
e glycosi
d
es
i
od
o-
ary
l
es et
d'espace
u
rs de ty
p
e ét
h
y
l
è
n
e g
l
yco
l
p
r
op
a
rgy
l
és ..
....
... ..
1
2
1
3
1
4
15 151
7
17
18
1
9
2
0
2
1
2
2
22
23
26
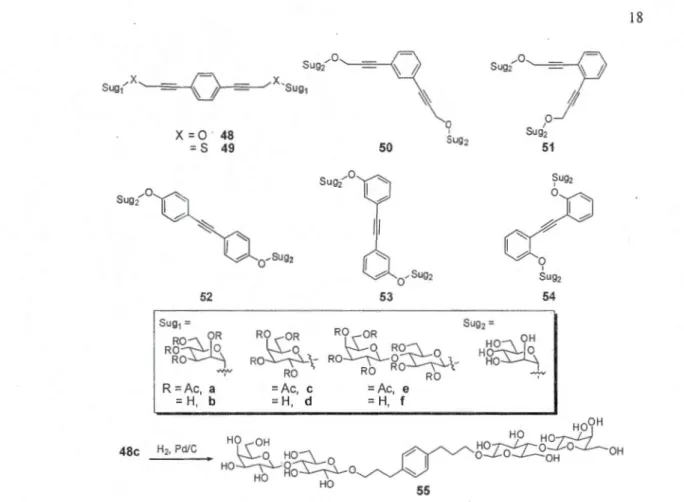
2.2
2.3
2.4
3.1
3.2
4.1
4.2
4.3
4.4
4
.5
4.6
Synth
èse de glycosides iodoaryles: mannosides
90 -
92, glucoside 94
et galactoside
96
....
...
....
.
...
.
...
.
...
....
...
.
Synthèse de glycosides
iodoaryles:
xyloside
s
98 et 99,
lactoside
101,
maltoside
103
et mélibioside
105
..
...
.
..
...
.
...
...
...
.
.
.. .
Synthèse des
espaceurs éthylène glycol
proparg
y
lés
de
longueur
variable et éther
propargylique
...
...
.
.
...
..
.
...
.
.
...
.
.
...
..
....
.
Mécanisme
général
proposé
pour la
réaction d
'
homocouplage
au
palladium de
type Ullmann
..
.
...
..
...
...
.
...
...
....
..
..
....
.
..
....
.
Mécani
s
me de tran
sesté
rification de Zem
pl
én
...
....
.
...
...
..
Mécanisme de
la réaction de
Sonogashira ...
..
... .
Lactoside
s
biva
lents
126
-
130 obtenus par r
éactio
n de Sonogashira ..
Synthèse des glycosides
bival
e
nt
s
13
1
-
145
par réaction de
Sonogashira
.
..
..
...
.
.
.
...
.
.
.
..
.
...
.. ..
Déprotection
des groupements
hydro
xy
l
es
de
126 -
130 par
transestérification de Zemp1én
...
....
...
..
Synthèse
du
lactoside
bivalent
plus
flexibl
e
152
par
hydrogénation
catalytique de 126 puis par déprotection de
s
groupements hydroxy
les
en conditi
ons de Zemplén
....
..
...
..
.
....
.
...
..
..
...
.
.
..
...
.
.
.
Synthèse
du
lactoside
monovalent
154
par
réaction
de
Sonogashira
pui
s
tran
ses
térification de Zemp
lén
... ..
Xl
27
28
29
35
36
42
43
43
45
45
45
LISTE DES ABRÉVIATIONS
 Ângstrom
a
Alpha[a
]
o
Pouvoir rotatoire spécifique aM eMan a-o-Mannopyranoside de méthyleAc Acétyle
AcOH Acide acétique
AcOK Acétate de potassium
A cO Et Acétate d'éthyle
Ar Aromatique/ Aryle
~
BétaBF3•Et20 Étherate de trif1uorure de bore
c
Concentration (g/100 mL)c
CarboneCa Calcium
CCM Chromatographie sur couche mince
CH Ch Chloroforme
CH2CI2 Dichlorométhane
CI3CCN Trichloroacétonitri le
cm Centimètre
Con A Concanavaline A
COSY COrrelated Spectroscop Y
Cul Iodure de cuivre
Cs2C03 Carbonate de césium
d Deutérium
6.
ChauffageDC-SIGN
décomp.
DLS
4
-
DMAP
DMF
E.
coli
équiv.
Et
3N
Et
2NH
FAB
FimH
gGal
Gal-3
hH
H
z
H
2NNH
30Ac
H
z
O
HBr
HCI
HEP
ES
HPLC
HSQC
Kcal/mol
Kd
XliiDendritic
Cell-Specific
fntercellular
adhesion molecule-3-Grabbing
Non-integrin (Anglais)
Décomposition
Diffusion
dynamique de
la lumière
4-
N,N
-Diméthylaminop
y
ridine
N,N-Diméthylformamide
Escherichia coli
Éthylène glycol
Ether
diéthylique
Éthanol
Équivalent
Triéthylamine
Diéthy
l
amine
Bombardement par
atomes
r
a
pides
Adhésine
de type
1 des fimbriae de Escherichiacoli
Gramme
Galactose
Galectine-3
l
-
I
e
ure
Hydrogène
Dihydrogène
Acétate d'hydrazine
Eau
Bromure d'h
y
dro
gène
Acide chlorhydrique
Acide 4-(2-hydroxyéthyl)-1-pipérazine éthane
s
ulfonique
Hight Performance
Liquid Chromatography
Heteronuclear Simple Quantum Correlation
Kilocalorie par
mol
e
Constante de
dissociation
Longueur
d
'o
nde
XlV
Lac
Lactose
Litt.
Littérature
J.l
Micro
m
Méta
M
Mo
l
a
r
ité; concentra
t
ion (mol/L)
Man
Mannose
Me
Méthyle
Mél
i
Mélibio
se
Me OH
·
Méthanol
MeON a
Méthanolate de
s
odium
mg
M
i
lligramme
MgS04
S
ul
fate de ma
g
nésium
MHz
MégaHert
z
min
Minute
mL
Mi
llil
itre
mmol
Millimo
l
e
Mn
Man
g
anè
s
e
MOE
Mod
é
l
i
sa
tion Orbita
l
e É
l
ec
t
r
onique
mol
%
Pourcenta
ge
m
o
l
a
i
r
e
m/z
Rapport mas
se/
c
h
a
rge
N
Azote
NaH
Hyd
r
ure de
sodium
NaHC0
3H
y
drogénocarbonate d
e so
dium
Na
2C03
Carbonate de
sodium
NaOAc
Acétate de
sodium
Na OH
Hydroxyde de
s
odi
u
m
N~CIChlorure d'ammonium
nmNanomètre
nM
Nanomolaire
0Ortho
0
Oxygène
x
v
O.D
.
Den
s
it
é o
p
t
iqu
e
p
Para
Pd
0Pall
a
dium
ze
ro
PDB
Protein databa
s
e (
a
n
g
lai
s)
Pd
(
dba
)
2Bi
s
( diben
zy
lidène
a
c
ét
one
)
p
a
lladium
Pd/C
Pall
a
dium
s
ur ch
a
rbon
Pd(OAc)2
Acétate de palladium
Pd(PPh3
)
4T
étra
k
i
s
-
t
riph
é
n
y
lph
os
ph
ine
d
e
p
a
ll
ad
ium
Pd(PPh
1
)
z
Clz
Chl
o
rure d
e
b
is
(triph
é
n
y
lph
os
phine)
pa
ll
ad
ium
P
f
Point
de
fu
s
i
o
n
Ph
Ph
é
n
y
l
e
PPh
3
Triph
é
n
y
lpho
s
phin
e
pp rn
pmii
e
p
ar
milli
o
n
Rend
.
Rend
e
men
t
R
f
Rapp
o
rt
fronta
l
R
h
Ra
y
on h
y
dr
o
d
y
n
a
miqu
e
R
h
maxR
ay
on h
y
dr
o
d
y
n
a
miqu
e
d
'
int
ens
it
é maxima
l
e
RMN
R
éso
n
a
n
ce
M
ag
n
ét
i
q
u
e N
u
c
l
éa
ir
e
r
t
ro
o
m t
empe
r
atu
r
e
(a
n
g
l
a
is
)
s
Soufre
S
M (
ES
I
)
S
pectr
o
m
ét
ri
e de masse ( é
l
ec
tr
os
pr
ay
)
S
MHR
Sp
ec
tr
o
m
é
tri
e
d
e masse
h
au
t
e
r
éso
lu
t
i
on
Ta
mi
s
m
o
l.
Tami
s mo
l
éc
ul
ai
r
e
T
B A Br
Br
o
mur
e
d
e
t
étra
bu
ty
l
a
mm
o
ni
u
m
T
BAHS
H
y
dr
ogé
n
os
ul
f
at
e
d
e
t
é
tr
a
but
y
l
a
mm
o
nium
T
B
A
I
Iodur
e
d
e
t
étrab
u
ty
l
ammon
iu
m
t
-BuOK
T
ert
-butanol
ate
d
e po
t
ass
iu
m
TFA
Ac
i
de trifl
u
oroacéti
q
ue
TfOH
Acide trifluorométhanesulfonique
THF
Tétrahydrofurane
TOF
TP
Ts
IJ.L
!lM
uv
VIH
Time offlight (anglais)
Température pièce
Tosyle
Micro litre
Micromolaire
Ultraviolet
Virus d'immunodéficience humaine
R
ÉSU
M
É
Le
s
p
a
th
ogè
ne
s se
lient
s
ouv
e
nt
à
la
ce
llul
e o
u
a
u ti
ss
u h
ô
t
e v
i
a
d
es
int
e
r
a
cti
o
n
s
g
l
yc
oc
o
nju
gé
-pr
o
t
é
in
e fa
ibl
es,
mai
s a
cqu
é
rant un
e
h
a
ut
e sé
l
ec
ti
vé
par l
e
ur
ca
r
a
c
tè
r
e
multiv
a
l
e
nt.
Les
lectine
s
b
a
ct
é
ri
e
nn
es,
comm
e
l
a F
imH d
e Esc
h
er
i
c
hi
a co
li
, se
li
e
nt d
e faço
n
sé
l
e
ctiv
e a
u
sac
charid
e
c
o
rr
es
p
o
ndant
e
t j
o
u
e
nt un r
ô
l
e c
l
é
d
a
n
s
l
'a
dh
és
i
o
n d
es
p
a
th
ogè
n
es.
A
fin d
'é
tudi
e
r l
es
int
e
r
ac
ti
o
n
s e
ntr
e
l
es g
l
y
c
oco
nju
gés e
t un
e
pr
o
t
é
in
e
p
ossé
dant un
o
u
plu
s
ieur
s
d
o
m
a
in
es
d
e
r
eco
nn
a
i
ssa
n
ce
du
sacc
h
a
rid
e (C
RO
s),
un
e va
ri
é
t
é
d
e
m
a
nn
os
id
es
d im
é
riqu
es o
n
t é
t
é sy
nth
é
ti
sés ave
c
co
mm
e o
bj
ec
ti
f
d
e
di
s
p
ose
r d
e
1 i
g
and
s
p
o
u
va
nt
s
urp
asse
r
l
'
af
finit
é
d
e
l
a
pr
o
t
é
in
e avec so
n li
ga
nd n
a
tur
e
l p
a
r multi
va
l
e
n
ce
.
Les g
l
ycos
id
es
bi
v
al
e
nt
s
ri
g
ide
s
p
e
rm
e
t
te
nt d
e
réti
c
ul
e
r l
es
p
ro
t
é
in
es so
lubl
es
p
ossé
d
a
nt plu
s
i
e
ur
s C
RO
s et
d
e
f
o
rm
e
r
d
es
r
ésea
ux in
so
lubl
es. U
n
e g
r
a
nd
e
v
a
ri
é
t
é
d
e
r
éac
ti
o
n
s a é
t
é
uti
1i
sée
d
a
n
s
l
a
1 itt
é
r
a
tur
e
p
o
ur
sy
nth
é
ti
se
r d
e
t
e
ll
es
m
o
l
éc
ul
es co
mm
e
l
es co
upl
ages o
r
ga
n
o
m
é
t
a
lliqu
es
d
e So
n
ogas
hir
a e
t d
e
G
l
ase
r.
Ces
pr
écé
d
e
nt
s co
upl
ages
p
e
rm
e
tt
e
n
t
d
'ob
t
e
nir d
es g
l
ycos
id
es
d im
é
riqu
es
sy
m
é
triqu
es o
u
asy
m
é
triqu
es à
p
a
rtir d
'es
p
ace
ur
s a
l
cy
n
es e
t
a
r
y
l
es. Ce
p
e
nd
a
nt
, ces
r
éa
cti
o
n
s
n
e
p
e
rm
e
tt
e
nt p
as d'
accé
d
e
r
à
un
es
p
ace
ur d
e
t
y
p
e
bi
a
r
y
l
e
. L
a
pr
ése
n
ce
d'
un
e ag
l
yco
n
e
a
r
o
m
at
iqu
e
p
e
rm
e
t d
'
accé
d
e
r à d
es
int
e
r
ac
ti
o
n
s seco
nd
a
i
res
f
avo
r
a
bl
es
d
a
n
s
l
e si
t
e ac
ti
f. C'es
t
p
o
urqu
o
i un
e
n
o
u
ve
ll
e
m
é
thod
o
l
og
i
e
d
e co
upl
age a
r
y
l
e
-
a
r
y
l
e
d
e
t
y
p
e U
llm
a
nn
ca
t
a
l
ysé a
u
p
a
ll
a
dium
a été
d
éve
l
o
pp
ée. Ce
tt
e
m
é
th
o
d
e
p
e
ut
gé
n
é
r
e
r
avec ef
fi
cac
i
té
un
e va
ri
é
t
é
d
e
g
l
ycos
id
es
dim
é
riqu
es o
ri
g
in
a
u
x (
10
exe
mpl
es avec des
r
e
nd
e
m
e
nt
s
ju
s
qu
'
à 96%).
L
a
ca
p
a
cit
é
r
é
ti
c
ul
a
nt
e
d
e
tr
o
i
s
m
a
nn
os
id
es
bi
va
l
e
nt
s e
n
ve
r
s
l
a co
n
ca
n
ava
lin
A a é
t
é é
v
a
lu
ée
p
a
r
turbidim
é
tri
e e
t p
a
r dif
f
u
s
i
o
n d
y
namiqu
e
d
e
l
a
lumi
è
r
e.
D
a
n
s
un d
e
u
x
i
è
m
e vo
l
e
t
,
o
nt
é
t
é
sy
nth
é
ti
sés
d
es
la
c
t
os
id
es
bi
va
l
e
nt
s asse
mbl
és
p
ar co
upl
age
d
e So
n
ogas
hir
a et
p
ossé
d
a
nt d
es
es
p
ace
u
rs
d
e
t
y
p
e é
th
y
l
è
n
e g
l
yco
l de l
o
n
g
u
e
ur
va
ri
a
bl
e.
Mots-clés
:
Multi
va
l
e
n
ce,
Lec
tin
es, L
i
ga
nd
s
Bi
va
l
e
nt
s,
R
ét
i
c
ul
a
ti
o
n
,
Ca
l
aty
l
e a
u p
a
ll
a
dium
,
U
llmann
,
S
o
n
ogas
hir
a.
CHAPITR
E 1
INTRODU
CT
ION
1.1
IMPOR
TA
NCE
BIOLOGIQU
E DES HYDRATES DE CA
RBON
E
La
surface
des ce
llul
es
des
mammi
fè
res
prése
nte
une grand
e variété
de
g
l
ycoco
njugés complexes
. Ce
ux-ci j
o
uent
un rô
l
e c
ritiqu
e
de
reconn
aissan
ce
dans
plus
i
eurs
événem
ents bio
l
ogiqu
es
n
orm
aux comm
e
l
es adhé
s
i
o
n
s
ce
llul
a
ir
e
s,
l
a cro
i
s
s
a
n
ce ce
llul
a
ir
e ou
l
a fertili
satio
n
,
m
a
i
s a
u
ss
i
path
o
l
og
iqu
es
comme
l
e
s
méta
s
tases ca
ncéreuses ou
l
'
adhés
ion de
pathogè
n
es
à
leur
s
ce
llul
es o
u
tiss
us
h
ôtes
.
Ces événeme
nt
s so
nt
diri
gé
s
par des
int
eracti
o
n
s
entre
les saccharid
es et les
protéin
es
possédant
l
e
domaine
de
reconna
i
s
sa
n
ce
du
sacc
h
ar
id
e
co
rr
espo
nd
ant.
1.2-'
·
4De
m
a
ni
ère s
urpr
enante
,
l
e
s
mammif
ères
utili
se
n
t se
ul
ement ne
uf
mo
no
saccharides
différents
,
qui
sont toutefo
i
s orga
ni
sés se
l
on un
e grand
e
di
vers
it
é
structura
le.
Les
vari
ations d
'architec
ture so
nt
res
ponsabl
es
de
s
h
autes affinités et
sé
l
ecti
vi
tés
observées
po
ur
des
récepteur
s
di
stincts
.
5Ma
l
gré
l
'
imp
o
rtan
ce
bio
l
og
ique cruc
ia
l
e
des
s
accharides
,
il reste
bea
uc
oup
à
apprendre
de
l
a
g
l
ycobi
o
l
og
ie ca
r
l
'
étude
des
int
eractions
protéin
e
-
saccharid
e a
été
limit
ée en raiso
n de
l
a compl
exité structura
le et fonctionn
e
ll
e
des
hydrates
de carbo
ne
.
1.2
IN
TE
RACTI
ONS PROTÉ
IN
E-SACC
HARID
E MULT
IV
ALENTES
Po
ur
être efficaces
da
n
s
l
e co
nt
exte
bio
l
o
g
ique
précédemment
évoqué,
les
interacti
on
s
protéin
e
-
s
accharide
do
i
vent
ê
tre
h
autement
s
é
l
ecti
ves. Cette sé
l
ectiv
ité
peut
être
représentée
par
l
'
a
n
a
l
og
ie
d
'
une
clé
qui d
é
verrouill
e
une se
rrure
dans
laque
ll
e
l
e
saccharide
e
t
la
proté
in
e compl
émentaire s
'
assoc
ient
de faço
n
s
téréos
pécifique.
1
Gabiu
s,
H.-J.
;
et a
l.
Chemi
cal Bio
l
ogy of
th
e
Su
g
ar
C
od
e
.
C
h
emBi
oC
h
e
m
2004
, 5,
740-764.
2Dwek
,
R. A
.
Glycobiology: Toward
Under
s
tandin
g
th
e
Functio
n of Su
ga
r
s.
C
hem
.
Rev.
1996, 96,68
3
-
72
0
.
3
Y
a
rki
,
A
.
Biolo
g
ic
a
l ro
l
es of
oli
g
o
sa
c
c
harid
es
:
a
li
of
th
e
th
e
ori
es a
r
e
corr
ect.
Clyco
bi
o
l
ogy
1993,3(2)
,
97-
1
30
4
Sh
aron
,
N
.; e
t al.
L
e
ct
in
s
a
s C
el!
Reco
g
nition Mo
l
ec
ul
es.
Sc
ience
1989,24
6,
227
-
23
4
.
5