HAL Id: hal-01603102
https://hal.archives-ouvertes.fr/hal-01603102
Submitted on 5 Jun 2020HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Etude de l’importance de la morphologie des sclérotes
de Sclerotinia sclerotiorum pour sa sensibilité à
Coniothyrium minitans
Christine Roy
To cite this version:
Christine Roy. Etude de l’importance de la morphologie des sclérotes de Sclerotinia sclerotiorum pour sa sensibilité à Coniothyrium minitans. [Stage] France. Institut Universitaire de Technologie d’Avignon (IUT d’Avignon), FRA. 2017, 31 p. �hal-01603102�
Etude de l’importance de la morphologie des
sclérotes de Sclerotinia sclerotiorum pour sa
sensibilité à Coniothyrium minitans
Présentée par Christine Roy
Année 2017
Photo de coupe de Sclérote, crédit Christine Roy
Encadrée par Mme Aline Le Menn à l’IUT d’Avignon
et par M. Philippe Nicot au sein de l’unité de pathologie végétale de l’INRA
Rapport de stage pour l’obtention du DUT génie biologique option agronomie
IUT d’Avignon Université d’Avignon et des Pays du Vaucluse 337 chemin des Meinajaries, PB 1207, 84911 Avignon Cedex 9 +33 (0)4 90 84 14 00
Institut National pour la Recherche Agricole – Unité de recherche de pathologie végétale, Domaine Saint Maurice, 67 allée des chênes CS 60094, F84143 Monfavet
REMERCIEMENT
Je tiens à remercier M. Marc BARDIN pour m’avoir permis de réaliser mon stage de fin d’année au sein de l’unité de Pathologie Végétale de l’INRA d’Avignon dont il est le directeur.
Merci infiniment à mon maître de stage M. Philippe Nicot qui m’a si aimablement accueilli et donné beaucoup de son temps, ainsi que de judicieux conseils.
Merci à toute l’équipe de mycologie de m’avoir chaleureusement intégrée à leur équipe et accompagnée au cours de ce stage, notamment à Mme. Magalie EYGRIER qui m’a beaucoup aidé à la préparation de mes milieux et à Mme. Claire TROULET pour sa disponibilité. Je voudrais remercier tout particulièrement Mme. Magalie DUFAUD, technicienne de laboratoire à qui je dois beaucoup, pour sa patience et son soutien inébranlable.
Je remercie également Mme Laurent CLAUDINE de m’avoir guidée et conseillée dans mes démarches administratives ; ainsi que M. Michel RIQUEAU pour m’avoir aidé à utiliser les outils informatiques de l’INRA.
Merci à mes collègues de bureau et de laboratoire Sabrina, Amélie, Florian et Yousra pour le partage de leur travaux d’étude et leur bonne humeur.
Merci enfin à tous ceux que j’ai rencontré au cours de ce stage d’en avoir fait un moment de partage intellectuel et une agréable expérience humaine.
Page
Table des matières
INTRODUCTION ... 1
I. Présentation générale de la structure d’accueil ... 1
II. Contexte de l’étude ... 1
1) Dangerosité de Sclerotinia sclerotiorum ... 1
2) Rôle des sclérotes dans l'épidémiologie de la maladie ... 2
3) Méthodes de lutte ... 3
4) Mode d'action du mycoparasite Coniothyrium minitans ... 4
5) Variabilité de l'efficacité de C. minitans au champ et hypothèses de recherche .. 4
6) Objectifs spécifiques du stage ... 5
MATERIEL ET METHODE ... 5
I. Matériel fongique ... 5
1) Souches de C. minitans et de S. sclerotorium ... 5
2) Production d'inoculum... 7
II. Approche expérimentale de l’étude de variabilité inter-souches ... 7
1) Production de sclérotes ... 7
2) Mesure des caractéristiques morphologiques des sclérotes ... 7
III. Approche expérimentale de l'étude de variabilité intra-souche ... 8
1) Production de sclérotes de S. sclerotiorum et de conidies de C. minitans ... 8
2) Inoculation des sclérotes avec C. minitans et incubation des sclérotes inoculés . 9 3) Estimation du niveau de dégradation des sclérotes par C. minitans ... 9
4) Mesure des caractéristiques morphologiques des sclérotes ... 11
IV. Analyse des données ... 11
1) Test de différences entre souches de S. sclerotiorum ... 11
2) Evaluation des relations entre la sensibilité des souches de S. sclerotiorum et les caractéristiques morphologiques des sclérotes ... 11
RESULTATS et DISCUSSIONS ... 12
I. Etude de variabilité inter-souche... 12
1) Différences d'épaisseur des sclérotes entre souches de S. sclerotiorum ... 12
2) Lien entre l'épaisseur des sclérotes et la sensibilité des souches : ... 13
4) Lien entre la morphologie des sclérotes et les indices de sensibilité des souches
à C. minitans: ... 14
II. Etude de variabilité intra-souche... 15
1) Photos obtenues ... 15
2) Relations entre sensibilité à C. minitans et caractéristiques morphologiques pour l'ensemble des sclérotes individuels ... 16
3) Les souches de S. sclerotiorum diffèrent-elles dans leur sensibilité à C. minitans et dans leurs caractéristiques morphologiques? ... 19
4) Relations entre sensibilité à C. minitans et caractéristiques morphologiques des sclérotes en distinguant les souches étudiées ... 21
CONCLUSION et PERSPECTIVES ... 23
BIBLIOGRAPHIE ... i
SITES INTERNET CONSULTES ... ii
LOGICIELS UTILISÉS ... ii
ANNEXE ... iii
RESUME ... iv
INTRODUCTION
I.
Présentation générale de la structure d’accueil
L'Institut national de la recherche agronomique (INRA) est le premier institut de recherche agronomique en Europe, et le deuxième en sciences agricoles dans le monde en nombre de publication dans son secteur. Créé en 1946, cet organisme public mène des recherches dans les domaines de l’alimentation, l’agriculture et l’environnement afin de développer la compétitivité des territoires et de concevoir des techniques de développement durable. Ces étendues de recherches et d’application sont donc très vastes et réunis en départements de recherches thématiques. Les départements sont ensuite subdivisés en plusieurs unités de recherche spécialisées.
Parallèlement, un regroupement des unités en centre de recherche avec un budget alloué est fait géographiquement comme en Provence Alpes Cotes d’Azur (PACA). Le Centre PACA créé en 2010 à la suite de la fusion de 2 centres préexistants, réunit 1000 agents travaillant sur 3 axes principaux de recherches : « Adaptation au changement global» (ACG), « Production horticole intégrée» (PHI) et « Santé des plantes» (PSP) ; regroupant 26 unités et localisés sur 10 sites dont celui d’Avignon. C’est au sein de ce dernier, et plus spécifiquement au domaine Saint-Maurice, dans le département « santé des plantes et environnement » et l’unité de pathologie végétale que j’ai réalisé mon stage.
Ce département a pour but d’améliorer l’efficacité de la protection des cultures. Cela nécessite la compréhension des agrosystèmes, des mécanismes pathogènes des micro-organismes ainsi que défensifs des plantes. Ces connaissances permettent alors de prévenir les épidémies et jauger les conséquences des techniques de protection végétale sur l’environnement.
Plus spécifiquement, l’unité de pathologie végétale est focalisée principalement sur l’étude des maladies virales, fongiques et bactériennes des cultures maraîchères du bassin méditerranéen. Son but est de développer des moyens de lutte raisonnée dans le cadre d’une production durable. Elle est composée de 2 équipes : l’une a pour thématique l’étude de la virologie végétale et l’autre, qui m’a accueillie et appelée Mistral, axe ses recherches sur les bactéries et champignons phytopathogènes dont notamment l’agent de la sclerotiniose,
Sclerotinia sclerotiorum.
II.
Contexte de l’étude
1) Dangerosité de Sclerotinia sclerotiorum
Ce champignon de la famille des ascomycètes est un parasite opportuniste polyphage capable d’attaquer plus de 400 espèces végétales différentes allant des espèces de grandes cultures comme le colza, le tournesol et le tabac ; en passant par des légumes tels que la tomate ; ou jusqu’à d’autres comme le persil et la ciboulette ([http] ephytia.inra.fr ; [http] Arvalis-infos.fr ; Unilet, 2014). Sa polyphagie est d’autant plus dangereuse pour les cultures qu’il peut se développer sur des espèces
cultivées comme sur des adventices qui constituent donc une réserve potentielle d’inoculum. Il est actuellement présent partout dans le monde et inflige des dégâts économiquement chiffrables sur les cultures (Bardin et al., 2013). À titre d'exemple on estime 1500 kilogrammes de perte par hectare de colza lorsque les hampes florales sont contaminées ([http] bayer-agri.fr).
Il est à noter que les symptômes dépendent de l’espèce hôte et de la partie contaminée. Cependant, dans la plupart des cas, une pourriture blanche caractéristique d’aspect cotonneux est localement visible sur des tissus végétaux partiellement décomposés présentant une pourriture brune humide. ([http] ephytia.inra.fr ; Agrios 1936) (Figure 1).
Figure 1 : Photo de productions maraichères atteintes de la sclérotniose due à l'agent pathogène S. sclerotiorum. Photos
INRA pour salade et melon, Laboratoire de diagnostic en phytoprotection – MAPAQ pour les carottes
2) Rôle des sclérotes dans l'épidémiologie de la maladie
Sclerotinia sclerotiorum produit une structure de conservation et de dissémination
particulière : le sclérote. C’est un amas compact de mycélium aggloméré qui permet la survie de l’organisme en conditions défavorables (Bardin et al., 2013). D’abord blanc, il devient noir au cours de sa formation car il se mélanise progressivement. Il se présente sous la forme de patatoïdes irréguliers de 2 à 10 millimètres de diamètre (Agrios 1936). Produit sur les végétaux contaminés, il tombe sur le sol à maturité. Particulièrement résistant, il peut se conserver dans un état de dormance de 3 à 5 ans jusqu'à 10 ans en attendant des conditions favorables à sa germination ([http] ephytia.inra.fr ; Unilet, 2014). Ils sont généralement enfouis profondément puis ramenés à la surface au fil des années par les travaux du sol conventionnels, à la suite de quoi ils permettent la production de mycéliums et de spores via les apothécies, sources de contaminations multiples. Le sclérote est par conséquent la première source d’infection par S. sclerotiorum (([http] ephytia.inra.fr ; Unilet, 2014).
La structure du sclérote se résume en 2 parties visible sur la Figure 2. La partie extérieure, aussi appelée zone corticale ou cortex, est constituée de quelques couches de cellules. Cette partie va se Figure 2 : photo de tranche de sclérote
mélaniser au fil du temps, noircir et par conséquent protéger le sclérote des stress physiques qui peuvent l’altérer.
La zone intérieure aussi appelée zone médullaire ou medula, est la première partie formée du sclérote. C’est cette zone qui va s’épaissir au cours de la croissance du sclérote. Elle est constituée d’hyphes agglomérés qui vont se densifier progressivement, conférant une consistance dure à l’ensemble du sclérote et donc une résistance physique.
3) Méthodes de lutte
Il existe différentes méthodes de lutte, toutes préventives :
- La plus utilisée à l’heure actuelle est la lutte chimique. Différentes groupes de fongicides sont utilisables contre S. sclerotiorum comme les inhibiteurs de la succinate deshydrogénase (SDHI), les triazoles, les strobilurines ou les carboxamides (Arvalis et Cetiom, 2015 ; Agridyne, 2017). Cependant, des tests en laboratoire ont montré des cas de résistances au boscalid, une substance active de la famille des carboxamides appartenant au groupe des SDHI. Ces résistances font l'objet d'une surveillance étroite dans les cultures de colza depuis plusieurs années. Leur fréquence a graduellement augmenté, parfois avec le constat de baisses d'efficacité concomitantes au champ (Anses et al., 2017). L’utilisation alternée des familles de fongicide est recommandé, les familles étant spécifiques d’un site d’action, pour éviter le développement des résistances. Des couplages ont également été homologués comme le produit Efilor® qui contient à la fois du boscalid (groupe des SDHI) et du metconazole (famille des triazoles) ce qui augmente l’efficacité et limite l’apparition de souches résistantes ([http] agro.basf.fr). Cependant, il faut déceler la maladie à un stade
précoce comme dans le cas de la lutte sur colza pour que l’application fongicide soit efficace ([http] agro.basf.fr).
- Des mesures prophylactiques et culturales peuvent être prises pour éviter l’installation du champignon en évitant les trop fortes densités de semis et en réduisant les fumures azotées (Agridyne, 2017). Des cultures sont également moins sensibles que d’autres et leur utilisation en rotation de cultures permet l’épuisement de l’inoculum primaire après contamination (Agridyne, 2017 ; Anses et al., 2017)
- la lutte biologique constitue une alternative intéressante. Dans ce cadre, on peut notamment citer le produit de bio contrôle Ballad à base de Bacillus pumilus, homologué sur colza ou encore Contans® WG (Figure 3). Ce dernier a obtenu en 2003 une autorisation de mise sur le marché en France pour l’usage sur des sols dans le cadre de la lutte contre Sclerotinia (Penaud et Michi, 2009). Ce produit permet un nettoyage des sols sur le long terme après contamination. Il est constitué de spores de Coniothyrium minitans, un mycoparasite de S.
sclerotiorum appartenant à la classe des Coelomycètes.
Figure 3 : Contans WG, de haut en bas :
4) Mode d'action du mycoparasite Coniothyrium minitans
Le mycoparasitisme peut s'exercer à la fois sur les filaments mycéliens du champignon cible et sur ses sclérotes.
Le parasitisme mycélien se fait par pénétration d’un hyphe de C.
minitans dans un hyphe de S. sclerotiorum, ce dernier étant 3 à 5 fois
plus gros que son parasite (Tu, 1984 ; Huang et Kokko, 1988). Il y a rupture de la paroi cellulaire de l’hôte au point de pénétration. Par la suite, les hyphes de S. sclerotiorium se rétrécissent, et finalement se nécrosent jusqu’à la mort de du pathogène (Tu, 1984).
La destruction des sclérotes se fait par pénétration du cortex grâce à des enzymes et une pression physique (Phillips et Price, 1983). Une fois cette barrière structurale franchie, C. minitans se développe au sein de la moelle qu’il détruit progressivement (Phillips et Price 1983, Huang et Kokko 1987). A terme, la moelle est entièrement détruite, le sclérote ne peut plus germer (Tu, 1984). Il constitue en revanche une structure de réserve en matière mycélienne de C. minitans puisque le cortex reste en grande partie intact (Bennett et al., 2006). C. minitans produit également des pycnides à l’origine de gouttes de conidies en surface du sclérote afin d’assurer sa propre reproduction (Bennett et al., 2006).
5) Variabilité de l'efficacité de C. minitans au champ et hypothèses de
recherche
Des disparités d’efficacité ont été observées par les utilisateurs de Contans® WG dans différentes régions de France. A partir de cette constatation, un projet de recherche a été organisé au niveau national (le projet "Scléroleg" sur la protection intégrée des cultures légumières vis-à-vis de Sclerotinia) afin d’étudier ces disparités et aider les agriculteurs. Plusieurs partenaires de ce projet (dont le Centre technique interprofessionnel des fruits et légumes (Ctifl), l’Union nationale interprofessionnelle des légumes transformés (Unilet) et de nombreuses stations expérimentales régionales) ont permis la récolte et l’identification de souches de S. sclerotiorum. A partir de cette collection, certaines des expériences du projet Scléroleg ont été menées, et notamment une étude sur la variabilité de l'effet de C. minitans contre 70 souches de S. sclerotiorum d’origine géographique diverse (Nicot et al., 2016 ; Avril, 2016). Il a été montré qu’il existait des différences significatives de sensibilité de ces souches à C. minitans, même si ces différences ne coïncidaient pas avec leur provenance géographique.
Ces résultats ont soulevé la question de comprendre les mécanismes qui sous-tendent ces différences de sensibilité entre souches de S. sclerotiorum. La connaissance actuelle sur le
Figure 4 : Sclérote de
Sclerotinia sclerotiorum parasité par Coniothyrium minitans. Photo: A.J. Peltier
mode d'action du mycoparasite permet d'orienter cette problématique vers différentes hypothèses. Elles incluent notamment que la sensibilité d'une souche serait subordonnée à :
Des paramètres morphologiques tels que l’épaisseur du cortex des sclérotes, qui constitue la barrière initiale de protection contre la pénétration de C. minitans, et la taille des sclérotes, qui délimite l'étendue de colonisation disponible pour le mycoparasite.
Des paramètres physiologiques, et notamment la composition biochimique du cortex, qui pourrait contenir des molécules plus ou moins résistantes à l’attaque de
C. minitans.
Des paramètres métaboliques, comme la production de protéines de défense par S.
sclerotiorum pour perturber le fonctionnement de son agresseur.
6) Objectifs spécifiques du stage
L'objectif de mon travail de stage était de tester des hypothèses portant sur l'influence des paramètres morphologiques des sclérotes. Les hypothèses les plus faciles à tester actuellement et les plus plausibles également, sont que les différences de sensibilité constatées entre souches de S. sclerotiorum seraient dues à des différences de taille des sclérotes ou de l’épaisseur de leur cortex.
MATERIEL ET METHODE
Pour tester ces hypothèses, deux approches ont été menées conjointement. La première approche a consisté à compléter, pour 25 souches de S. sclerotiorum, des données de sensibilité à C. minitans (obtenues précédemment par le laboratoire d'accueil) par l'acquisition de données sur leurs caractéristiques morphologiques moyennes et d'évaluer l'existence de corrélations éventuelles. Cette expérience sera mentionnée sous le nom "étude de variabilité inter-souches" dans le reste de ce rapport parce que les données utilisées seront des moyennes établies par souche.
Du fait d'une variabilité notable des caractéristiques morphologiques des différents sclérotes produits par une souche donnée, une deuxième approche a également été engagée pour étudier des corrélations éventuelles entre les caractéristiques morphologiques et la sensibilité de sclérotes individuels. Cette approche a été réalisée en étudiant individuellement 30 sclérotes pour chacune de 12 souches de S. sclerotiorum. Elle sera mentionnée sous le nom "étude de variabilité intra-souche" dans le reste de ce rapport.
I.
Matériel fongique
1) Souches de C. minitans et de S. sclerotorium
La souche de C. minitans utilisée lors de mes travaux a été mise à disposition par le laboratoire d'accueil sous forme d'aliquotes d'une suspension de conidies (103 spores/ml) conservés à -20°C dans un tampon cryoprotecteur contenant du glycérol et du phosphate
monopotassique (KH2PO4). Cette souche a été isolée initialement à partir du produit Contans WG et multipliée sur milieu Potato Dextrose Agar (PDA).
Les souches de S. sclerotorium utilisées dans les études de moyennes et de sclérotes individuels, ont été mises à disposition par le laboratoire d'accueil sous forme de sclérotes conservés à -20°C. Lors de travaux précédents, elles ont été initialement purifiées à partir des sclérotes échantillonnés en France par les partenaires du projet ScleroLeg.
Les souches de S. sclerotiorium de l’étude de variabilité inter-souche ont été sélectionnées afin de balayer l’intégralité des gammes de sensibilité mise en évidence dans le programme Scleroleg (Nicot et al., 2016 ; Avril, 2016) et ce quel que soit l’indicateur de sensibilité considéré. Ces derniers seront développés ci-après. Les souches de l’étude de variabilité intra-souche ont été sélectionnées parmi les 30 intra-souches utilisées dans l’étude précédente, en gardant un balayage des différents degrés de sensibilités à C. minitans (Tableau 1).
Tableau 1 : Caractéristiques des souches de S. sclerotiorum utilisées au cours de cette étude
Nom de la souche Hôte de prélèvement Origine (département) Etude de variabilité inter- souche Etude de variabilité intra souche ss6 Laitue 84 X ss17 Haricot 29 X X ss24 Haricot 29 X X ss29 Haricot 29 X X ss30 Haricot 29 X X ss31 Haricot 29 X ss34 Haricot 29 X ss35 Haricot 29 X ss37 Haricot 29 X X ss40 Haricot 40 X ss46 Colza 57 X ss48 Colza 18 X X ss58 Endive 60 X X ss65 Endive 80 X X ss75 Melon 82 X X Ss83 Melon 17 X ss120 Colza 21 X ss173 Melon 82 X ss174 Melon 82 X X ss242 Melon 17 X X ss1003 Carotte 33 X ss1234 Carotte 33 X X ss1252 Carotte 33 X ss1592 Melon 17 X ss2062 Carotte 50 X
2) Production d'inoculum
La souche de C. minitans ainsi que toutes celles de Sclerotinia ont été repiquées et mises en culture sur PDA. Ce milieu est préparé à partir de 39g de PDA déshydraté (DIFCOTM) auquel on rajoute 1L d’eau déminéralisée. Le mélange est homogénéisé puis stérilisé à l’autoclave 20 minutes à 120°C. La température du milieu autoclavé est ensuite maintenue à 60 °C et celui-ci est dispensé sous hotte à flux laminaire dans des boîtes de Petri de 90mm de diamètre, à raison de 17 ml par boite.
II.
Approche expérimentale de l’étude de variabilité inter-souches
1) Production de sclérotes
Pour chacune des souches étudiées, un sclérote est sorti de la collection de l’INRA et cultivé sur PDA pendant trois jours. La colonie ainsi formée est repiquée sur un nombre de boîtes de PDA au pro rata de ces capacités de production de sclérote. Dix sclérotes sont nécessaires par souche. Une boîte est donc généralement suffisante, mais pour certaines souches très peu productives, 10 boîtes pourront être inoculées par précaution. Ces boîtes sont incubées à 22°C pendant 3 semaines afin d’obtenir les sclérotes utilisées au cours de l’expérience.
2) Mesure des caractéristiques morphologiques des sclérotes
Parmi les caractéristiques morphologiques influençant potentiellement le plus le phénomène d'invasion des sclérotes par C. minitans figure l'épaisseur du cortex, la première barrière que le mycoparasite devra franchir.
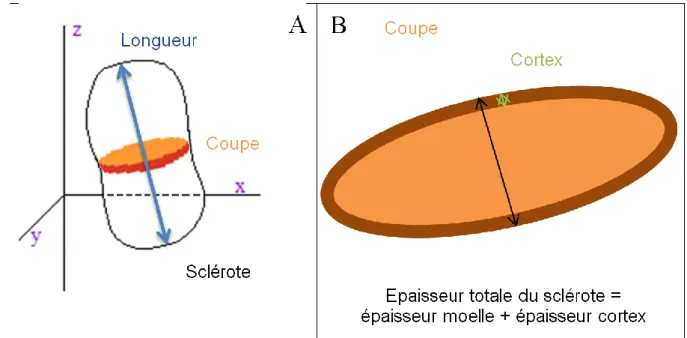
Une deuxième caractéristique morphologique d'intérêt est l'épaisseur des sclérotes, qui va conditionner la distance que devra parcourir le mycoparasite pour détruire la totalité de la moelle. Moins cette épaisseur sera grande, plus le C. minitans aura l'opportunité d'atteindre le cœur de la moelle en un temps donné (Figure 5). La
plus petite épaisseur a donc été utilisée comme caractéristique morphologique mesurée dans la présente étude. Etant donné la grande diversité des formes des sclérotes de S. sclerotiorum, la mesure d'épaisseur a été réalisée sur une coupe pratiquée perpendiculairement à l'axe de la longueur de chaque sclérote examiné, comme indiqué sur la Figure 6A. Sur chaque coupe, deux mesures ont été réalisées: l'épaisseur totale du sclérote l'épaisseur de la moelle (Figure 6B). Ces deux valeurs ont été utilisées pour en
déduire l'épaisseur du cortex. Figure 5 Schéma structural d’un sclérote attaqué
Figure 6 : Schéma de la zone de coupe et localisation des mesures effectuées
Les coupes de sclérote (d'une épaisseur d'environ 500 µm) ont été réalisées à l'aide d'un scalpel stérile sous une hotte à flux laminaire. Les coupes sont ensuite observées sous loupe binoculaire avec un éclairage adapté afin de discerner au mieux la différence de couleur entre la moelle et le cortex.
Une photo est alors prise pour chaque coupe et les mesures sont réalisées à l'aide du logiciel ImageJ (Bethesda).
III.
Approche expérimentale de l'étude de variabilité intra-souche
Le protocole utilisé est adapté à partir des expériences précédemment menées par l'équipe d'accueil dans le cadre du programme Scléroleg.
1) Production de sclérotes de S. sclerotiorum et de conidies de C. minitans
L’obtention des sclérotes se fait comme dans le protocole précédent. Cependant, comme 240 sclérotes sont nécessaire par souches, le nombre de boîtes inoculées par repiquage sera nettement plus important car toujours au prorata des capacités de production de sclérote de chaque souche.Pour C. minitans, plusieurs boîtes de PDA sont ensemencées à partir des aliquotes de suspension de spores de C. minitans à raison de 100µL/boîte. Ces boîtes sont ensuite repiquées pour obtenir les 36 boîtes nécessaires à l’ensemble des inoculations.
Sclerotinia et Coniothyrium sont donc cultivés séparément sur PDA en boite de Pétri et
mis en chambre climatique (T°=22 ±1°C ; J/N=14/10h) pendant 21 jours, au terme desquels l’inoculation des sclérotes par les spores de Coniothyrium est réalisée.
Pour cela, les boîtes saines et bien développée de Coniothyrium sont sélectionnées (5 à 6 en fonction de la croissance du champignon). Une mise en suspension des spores est réalisée sous hotte à flux laminaire par ajout de 4mL d’eau déminéralisée stérile par boîtes puis frottement de la surface de la gélose à l’aide d’un râteau stérile. Le liquide obtenu est alors rassemblé en flacon plastique dont on prélève 10 µL
pour réaliser une dilution au 1/100. Cette dilution est indispensable à la lecture sur lame de Malassez (Figure 7), nécessaire à la détermination de la concentration de spores du mélange obtenu.
En fonction de cette concentration, une dilution est réalisée à partir de la solution mère précédemment obtenue afin d’obtenir 26mL (24mL nécessaire +2mL de sécurité) de solution de spores de Coniothyrium à 1x108. Cette suspension servira à la mise en contact des deux champignons.
2) Inoculation des sclérotes avec C. minitans et incubation des sclérotes
inoculés
Les boîtes de Sclerotinia les plus développées sont sélectionnées afin de prélever 120 sclérotes par souches répartis en six flacons de 20 sclérotes chacun. Trois lots de sclérotes vont être inoculés par trempage dans 2mL de la solution de Coniothyrium pendant 3min ; tandis que les trois autres lots seront les témoins et ne seront donc pas concernés par cette étape. Ils seront en revanche trempés dans 2mL d’eau afin de leur faire subir un traitement similaire.
Au terme de l’inoculation, chaque mélange (sclérote+C. minitans ou sclérote+eau) sera versé dans un flacon stérile plastique rempli de 150g de sable stérilisé à l’autoclave (20min à 120°C) et séché au four pasteur (3h à 180°C). L’incubation se fait dans les flacons fermés placés à l’obscurité trois semaines afin de les mettre en condition de culture au plus proche des conditions naturelles : c’est à dire sur substrat minéral et à l’obscurité. (Figure 8)
Un échantillon de sable sera prélevé par flacon et mis en culture sur milieu PDA pour vérification de la stérilité.
3) Estimation du niveau de dégradation des sclérotes par C. minitans
Après incubation, les sclérotes sont désinfectés de façon superficielle afin d’éliminer le C. minitans de surface qui pourrait fausser les lectures par la suite. Pour ce faire quatre bains de rinçage vont être préparés : un de 2mL de javel à 5% et trois autres de même volume d’eau. Figure 7 : photo sur lame de Malassez de
spores de C. minitans
Figure 8 : flacon d'incubation rempli de sable
Douze des vingt sclérotes incubés par flacons sont alors sortis aléatoirement, et plongés successivement dans le bain de javel puis dans chaque bain d’eau à raison de trois minutes par bain. Enfin, ils sont séchés sur papier absorbant.
Les sclérotes sont ensuite coupés en deux et les deux demis sclérotes sont déposés face de coupe contre une gélose de PDA afin de permettre le développement des deux champignons s’ils sont présents ou de donner toutes les chances à Sclerotinia de s’exprimer dans le cas des sclérotes témoins. Les deux demis sclérotes seront posés à équidistance l’un de l’autre et des bords de la boîte de Pétri afin de leur laisser une place de croissance maximale et égale (Figure 9)
La lecture des boîtes de culture de PDA va permettre de quantifier le développement de C. minitans et de comparer le développement des sclérotes inoculés par rapport aux sclérotes témoins.
En l’absence de C. minitans, les demis-sclérotes vont produire du mycélium qui va progressivement remplir toute la boîte de Petri et produire des sclérotes appelés sclérote fils. Dans les cas où C. minitans a réussi à parasiter le sclérote, une croissance mycélienne de ce dernier devrait également être visible. Plus le sclérote est grand, plus la surface colonisable est grande et par conséquent la réserve en Coniothyrium qui a colonisé cet espace devrait permettre une croissance importante de celui-ci. Si l’intégralité du sclérote n’est pas détruite, une croissance mycélienne de Sclerotinia est également possible mais devrait être réduite par la présence de l’agent de biocontrôle. De même, la production de sclérote fils devrait également être modifiée de par cette présence.
a) Inhibition de production de sclérote de Sclerotinia par C. minitans
Les sclérotes fils seront comptés pour établir une moyenne de prolificité de sclérote fils par souche. Le calcul d’un pourcentage de réduction de croissance de S. sclerotiorum en présence de C. minitans est réalisé pour éviter le biais induit par des différences de prolificité déjà observées entre souche.
𝑖𝑛𝑑𝑖𝑐𝑒 𝑑′𝑖𝑛ℎ𝑖𝑏𝑖𝑡𝑖𝑜𝑛 𝑠𝑐𝑙é𝑟𝑜𝑡𝑒 𝑓𝑖𝑙𝑠 =NBtémoin − NBinoculé
NBtémoin × 100
Avec NBtémoins et NBinoculé respectivement le nombre moyen de sclérotes fils des 30 sclérotes témoins et celui de chaque sclérote incubé 21 jours en présence de C. minitans.
b) Inhibition de croissance de Sclerotinia par C. minitans
Dans les cas où Sclerotinia resterait présent et formerait également une colonie, on mesurera son diamètre 3 jours après dépôt du sclérote sur PDA (J+3), période à laquelle il n’a pas encore atteint les limites de la boîte. Cette mesure réalisée sur les boîtes témoins va permettre d’établir des moyennes de croissance propre à chaque souche. Le calcul d’un pourcentage de réduction de croissance de S. sclerotiorum en présence de C. minitans est également réalisé pour prendre en compte les caractéristiques de croissance propre à chaque
Figure 9 : patron de positionnement
des demi-sclérotes sur boîte de Petri remplie de milieu PDA
Page
souche. Un diamètre de colonie de S. réduit par rapport aux témoins sera marqueur d’une faible vigueur et donc d’un parasitisme important de la moelle.
Le calcul suivant sera réalisé à partir des mesures sur sclérotes inoculés : 𝑖𝑛𝑑𝑖𝑐𝑒 𝑑′𝑖𝑛ℎ𝑖𝑏𝑖𝑡𝑖𝑜𝑛 𝑑𝑒 𝑐𝑟𝑜𝑖𝑠𝑠𝑎𝑛𝑐𝑒 =Dtémoin − Dinoculé
Dtémoin × 100
Avec Dtémoins et Dinoculé respectivement le diamètre moyen des colonies des 60 demi-sclérotes témoins et celui de chaque demi sclérote incubé 21 jours en présence de C. minitans. Ce pourcentage sera donc établi individuellement par sclérote.
c) Quantification de la présence de C. minitans
Dans le cas des sclérotes inoculés, si C. minitans a réussi à pénétrer le sclérote, on devrait observer un développement du parasite contenu dans le sclérote (l’étape de désinfection superficielle ayant supprimé le Coniothyrium potentiellement présent en surface). La croissance et la vigueur du parasite devrait être liée à la colonisation de la zone médullaire du sclérote. Plus le sclérote est parasité, plus la surface de la colonie de Coniothyrium observée devrait être grande. Par conséquent, le diamètre de la colonie de C. minitans sera mesuré à partir des sclérotes inoculés. Une moyenne des colonies des deux demi-sclérotes sera réalisé afin d’obtenir une valeur par sclérote individuel.
4) Mesure des caractéristiques morphologiques des sclérotes
Au moment de la coupe des sclérotes, une fine tranche est prélevée en leur centre selon les mêmes principes de coupe établis dans le protocole précédent. Il en est de même pour la photo et la mesure de la découpe réalisée comme précédemment. Les découpes identifiées sclérote par sclérote permettront de corréler individuellement l’épaisseur du sclérote aux indices de sensibilité mesurés ci-après, obtenus par la culture des deux demis sclérotes.
IV.
Analyse des données
1) Test de différences entre souches de S. sclerotiorum
Des analyses variance, éventuellement suivies de comparaisons multiples de moyennes (Test de Newman et Keuls) ont été réalisées à l'aide du logiciel Statistica (StatSoft, version 1999) pour évaluer des différences éventuelles entre souches pour les caractères morphologiques des sclérotes et les indices de sensibilité à C. minitans.
2) Evaluation des relations entre la sensibilité des souches de S. sclerotiorum
et les caractéristiques morphologiques des sclérotes
Ces relations ont été évaluées à l'aide d'analyses de régressions linéaires réalisées avec le logiciel Statistica. Une analyse a été réalisée pour chaque paire possible d'un indice de sensibilité et d'un caractère morphologique. Dans l'étude de variabilité inter-souches, les régressions étaient calculées sur la base d'une paire de données moyennes pour chacune de 25 souches (17 souches pour les analyses concernant l'épaisseur du cortex). Dans l'étude de
variabilité intra-souche, les régressions étaient calculées sur la base de 30 paires de données (chacune correspondant à un sclérote individuel) pour chacune des 12 souches examinées.
Dans le cadre de l'étude de variabilité inter-souches, des analyses de régression multiple ont également été réalisées pour évaluer le gain potentiel apporté par l'utilisation de plusieurs variables explicatives (caractéristiques morphologiques des sclérotes) pour décrire la variabilité des indices de sensibilité.
RESULTATS et DISCUSSIONS
I.
Etude de variabilité inter-souche
1) Différences d'épaisseur des sclérotes entre souches de S. sclerotiorum
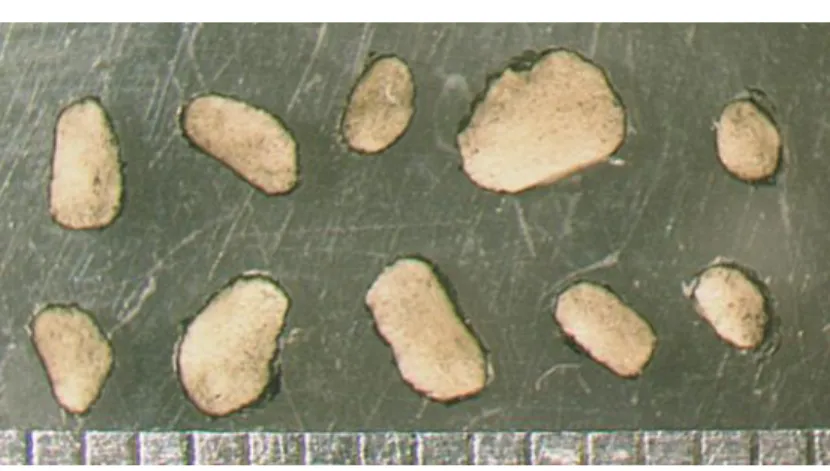
Pour chacune des 24 souches de Sclerotinia étudiées, nous avons observé une variabilité notable de l'épaisseur des sclérotes, comme illustré sur la Figure 10 pour les 10 sclérotes examinés pour la souche ss48. Cependant, le diamètre moyendes sclérotes est
significativement différent entre les souches étudiées (F=5,51 et p<0,0001) (Figure 11). Ce paramètre morphologique pourrait donc être utile pour expliquer les différences de sensibilité constatées entre souches dans les travaux antérieurs du laboratoire d'accueil.
Figure 11 : Epaisseur moyenne des sclérotes de 24 souches de S. sclerotiorum. Chaque barre représente la moyenne de
10 observations ± l'erreur standard de la moyenne. Les nombres associés à des lettres différentes indiquent des différences significatives entre souches (P < 0,05) selon le test de comparaison multiple des moyennes de Newman et Keuls.
a a b a b c a b c a b c a b c a b c d a b c d a b c d a b c d a b c d a b c d a b c d a b c d a b c d a b c d a b c d a b c d b c d c d d e d e d e d e 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 ss 35 ss 31 ss 24 ss 40 ss6 ss 34 ss 46 ss 30 ss 58 ss 10 03 ss 75 ss 17 ss 37 ss 17 4 ss 12 52 ss 29 ss 48 ss 65 ss 15 92 ss 12 34 ss 17 3 ss 24 2 ss 20 62 ss 12 0 Moyenne de la taille des sclérotes
(mm)
souches de S. sclerotiorum
Figure 10 : tranches de 10 sclérotes de la souche ss48 de S. sclerotiorum.
Page
2) Lien entre l'épaisseur des sclérotes et la sensibilité des souches :
Les régressions linéaires entre le diamètre moyen des sclérotes et chaque indice de sensibilité n’ont montré aucune corrélation significative. Les coefficients R² de régression linéaire sont compris entre 1% et 6%, avec des valeurs p>>0,05 (Figure 12).
Pourc ent age d ’i nh ib it ion
Epaisseur moyenne des sclérotes (mm)
Figure 12 : Relation entre l'épaisseur moyenne des sclérotes et les indices de sensibilité moyens de 24 souches de S.
sclerotiorum. (1 point = 1 souche = 10 sclérotes)
Par conséquent, l'épaisseur moyenne des sclérotes d'une souche n’est pas un facteur explicatif pertinent de la variabilité de sensibilité des souches. Un autre caractère morphologique du sclérote pourrait en être l’origine : l'épaisseur du cortex.
3) Différences entre souches de l'épaisseur du cortex :
Pour un sous-ensemble de 17 souches, des observations de 10 tranches de sclérotes par souche ont été réalisées à plus fort grossissement que précédemment pour distinguer correctement la limite du cortex sur les tranches (Figure 13). L’épaisseur moyenne du cortex diffère significativement entre les souches étudiées (Figure 14). L'analyse de variance indique une valeur P = 0,050, bien qu'aucune différence ne soit mise en évidence entre souches individuelles avec le test de comparaison multiple des moyennes de Newman et Keuls.
-100 -50 0 50 100 0,0 0,5 1,0 1,5 2,0 Inhibition de croissance de S.sclerotiorum (%) R² = 0,03 ; p=0,417 -100 -50 0 50 100 0,0 0,5 1,0 1,5 2,0 Inhibition de la production de sclérotes fils (%) R² = 0,01 ; p=0,576 D éve lop pe m en t de C on io th yr ium 0 20 40 60 80 100 0,0 0,5 1,0 1,5 2,0 Présence de C.minitans (%) R² = 0,06 ; p=0,256 0 5 10 15 20 25 30 35 0,0 0,5 1,0 1,5 2,0
Diamètre moyen des colonies de C.
Figure 13 : 10 tranches de la souche ss65 de S. sclerotiorum Graduation = 0,5 mm
Figure 14 : Epaisseur moyenne du cortex des sclérotes par souche de 17 souches de S. sclerotiorum (p= 0,050). Chaque
barre représente la moyenne de 10 observations ± l'erreur standard de la moyenne. Aucune différence significative (P < 0,05) entre souches individuelles n'est mise en évidence par le test de comparaison multiple des moyennes de Newman et Keuls.
L'épaisseur du cortex est donc un caractère morphologique des sclérotes variant entre souches, qu'il parait important de tester pour une relation possible avec leur niveau de sensibilité à C. minitans.
4) Lien entre la morphologie des sclérotes et les indices de sensibilité des
souches à C. minitans:
Les paramètres morphologiques des sclérotes qui se sont avérés variant entre souches sont :
- l’épaisseur de la moelle : celle-ci est différente entre souches, car proche des variations de l'épaisseur totale des sclérotes (F=2,924 et p <0,001, données non montrées)
- l’épaisseur du cortex comme présenté ci-dessus.
Une analyse de régression multiple a été réalisée pour évaluer la relation entre ces paramètres morphologiques (utilisés comme variables prédictives) et chacun des quatre
0 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09 0,1 Epaisseur moyenne du cortex (mm) Souches de S. sclerotinia
Page
indices de sensibilité à C. minitans considérés dans cette étude de variabilité inter-souche. Les résultats de l’analyse pas à pas (stepwise) « forward » sont présentés dans l’Annexe 1. L’analyse « backward » a également été réalisée.
La seule régression significative a été obtenue entre le pourcentage de présence de C.
minitans et l’épaisseur du cortex. Les caractéristiques de cette régression sont présentées dans
le Tableau 2.
Tableau 2 : Caractéristique de la régression linéaire entre un indice de sensibilité de S. sclerotiorum à C. minitans (le
pourcentage de présence de C. minitans) et un paramètre morphologique des sclérotes (l’épaisseur de cortex)
Variables de régression Y= Pourcentage de présence de C. minitans 1
X= Epaisseur moyenne du cortex des sclérotes Statistiques F = 6,97 et p = 0,019
Equation du modèle (Y=aX+b) a= -1933,88 b = 186,21 Erreur standard du modèle σa = 732,57 σb = 49,11
1
: évalué après 7 jours de culture de sclérotes de S. sclerotiorum sur milieu PDA préalablement inoculés et incubés 3 semaines avec C. minitans
D’après l'analyse de régression, l'épaisseur moyenne du cortex est donc liée à un des indices de sensibilité des sclérotes. Cependant, la valeur prédictive de ce caractère morphologique moyen est peu intéressante, avec un R² de 0,32 et les statistiques du modèle obtenu présentent des erreurs standards importantes. De plus, la différence entre souches pour l’épaisseur du cortex est très proche du seuil de significativité. Par conséquent, ce résultat doit être confronté à une analyse sur un plus grand échantillon et avec une plus grande précision : l’expérience par sclérote.
II.
Etude de variabilité intra-souche
1) Photos obtenues
Les sclérotes ayant été conservés 3 semaines dans le sable en présence de C. minitans, ont subi des modifications déjà visibles à partir des photos (Figure 15).
Figure 15 : Exemple de photos de tranches de sclérotes de différentes souches après 3 semaines d'incubation. A = témoin
2) Relations
entre
sensibilité
à
C.
minitans
et
caractéristiques
morphologiques pour l'ensemble des sclérotes individuels
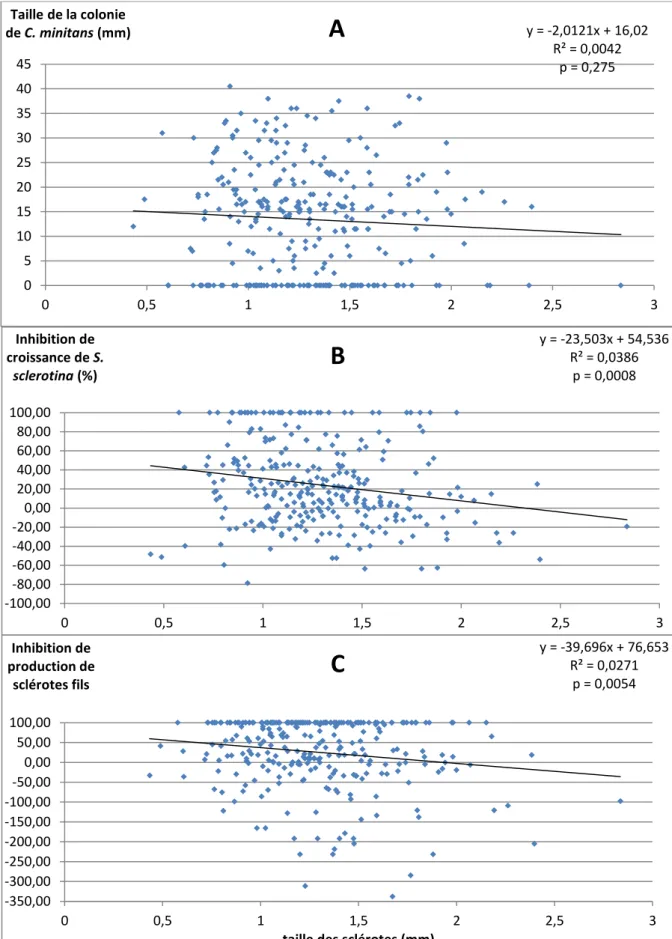
Les trois indices de sensibilité à C. minitans calculés pour chaque sclérote individuel ont été corrélés (30 sclérotes par souche et toutes souches confondues) à l'épaisseur des sclérotes (Figure 14) et de celle de leur cortex (Figure 16).
Aucune corrélation significative n'a été mise en évidence entre le diamètre des colonies de
C. minitans (mesurée après 7 jours d'incubation) se développant à partir des sclérotes et
l'épaisseur de ces sclérotes (p = 0,275; Figure 14A). Par contraste, des corrélations significatives ont été observées entre l'épaisseur des sclérotes et le taux d'inhibition de la croissance mycélienne de S. sclerotiorum (p=0,0008; Figure 14B) ou le taux d'inhibition de la production de sclérotes fils (p=0,0054; Figure 14C). L'observation conjointe de ces paramètres pour 360 sclérotes individuels a donc permis un gain de précision pour l'analyse de ce phénomène, en comparaison avec l'étude précédemment décrite sur les valeurs moyennes de sensibilité des souches. Cependant les régressions correspondantes expliquent moins de 4% (R²=0,0386) et 3% (R²=0,0271), respectivement, de la variabilité de ces deux indices de sensibilité (Figure 14, B et C).
Par ailleurs, aucune corrélation significative n'a été observée entre l'épaisseur du cortex et les trois indices de sensibilité, avec des valeurs P>0,29 et des coefficients de corrélations R²<1% (Figure 16). Dans ce cas, les résultats obtenus dans l'étude précédemment décrite sur l'analyse de valeurs moyennes de sensibilité n'ont pas été modifiés par le gain de précision apporté par l'examen de 360 sclérotes individuels.
Ces analyses de régression ayant été réalisées sur la totalité des données obtenues, sans distinction des 12 souches examinées, l'absence ou la faiblesse des corrélations observées pourraient éventuellement être expliquées par des liens différents pour les différentes souches. Par conséquent une étude complémentaire a été menée en gardant la précision de l’étude par sclérote individuel car réalisée sur le même échantillon. Elle permettra notamment de vérifier si les indices de sensibilité et les paramètres morphologiques sont réellement significativement différents entre souches dans le cas d’un échantillon plus important qu’au cours de l’étude précédente sur les valeurs moyennes de sensibilité.
Page
Figure 16 : Régression linéaire entre les indices de sensibilité à C. minitans et la taille des sclérotes de S. sclerotinia.
Avec les indices de sensibilité A, B, C respectivement la taille de colonie de C. minitans, l’inhibition de croissance de
S. sclerotinia et l’inhibition de production de sclérote fils en présence de C. minitans. R² compris entre 0% et 3%.
y = -2,0121x + 16,02 R² = 0,0042 p = 0,275 0 5 10 15 20 25 30 35 40 45 0 0,5 1 1,5 2 2,5 3 Taille de la colonie de C. minitans (mm)
A
y = -23,503x + 54,536 R² = 0,0386 p = 0,0008 -100,00 -80,00 -60,00 -40,00 -20,00 0,00 20,00 40,00 60,00 80,00 100,00 0 0,5 1 1,5 2 2,5 3 Inhibition de croissance de S. sclerotina (%)B
y = -39,696x + 76,653 R² = 0,0271 p = 0,0054 -350,00 -300,00 -250,00 -200,00 -150,00 -100,00 -50,00 0,00 50,00 100,00 0 0,5 1 1,5 2 2,5 3 Inhibition de production de sclérotes filstaille des sclérotes (mm)
Figure 17 : Régression linéaire entre les indices de sensibilité à C. minitans et la taille du cortex des sclérotes de
S. sclerotinia. Avec les indices de sensibilité A, B, C respectivement la taille de colonie de C. minitans, l’inhibition de
croissance de S. sclerotinia et l’inhibition de production de sclérote fils en présence de C. minitans. R² compris entre 0% et 0,005% y = 38,5x + 11,456 R² = 0,0036 p= 0,3121 0 5 10 15 20 25 30 35 40 45 0 0,02 0,04 0,06 0,08 0,1 Taille de la colonie de C. minitans (mm)
A
y = 119,53x + 20,471 R² = 0,0023 p = 0,8687 -100 -80 -60 -40 -20 0 20 40 60 80 100 0,00 0,02 0,04 0,06 0,08 0,10 Inhibition de croissance de S. sclérotiorum (%)B
y = -309,61x + 38,792 R² = 0,0038 p = 0,2998 -350 -300 -250 -200 -150 -100 -50 0 50 100 0 0,02 0,04 0,06 0,08 0,1 Inhibition de production de sclérotes fils (%) Epaisseur du ccortex (mm)C
Page
3) Les souches de S. sclerotiorum diffèrent-elles dans leur sensibilité à C.
minitans et dans leurs caractéristiques morphologiques?
Sur la base des moyennes calculées pour les 30 sclérotes examinés par souche, des différences significatives (p<0,05) ont été observées entre souches pour les trois indices de sensibilité à C. minitans étudiés (Figure 18). Ces résultats sont en accord avec les observations réalisées par l’étude antérieure de l'équipe d'accueil (Avril, 2016). De plus, une cohérence existe dans le classement de sensibilité de ces souches en comparant les indices de sensibilité entre eux. Les extrêmes notamment, comme les souches ss58 et ss30 présentent respectivement une très faible et une très forte sensibilité pour chacun des paramètres testés.
Figure 18 : moyenne par souche des indices de sensibilité à C. minitans, avec les indices de sensibilité A, B, C,
respectivement la taille de colonie de C. minitans, la réduction de croissance de S. sclerotiorum et la réduction de production de sclérote fils en présence de C. minitans. Chaque barre représente la moyenne de 30 observations ± l'erreur standard de la moyenne. Les nombres associés à des lettres différentes indiquent des différences significatives entre souches (P < 0,05) selon le test de comparaison multiple des moyennes de Newman et Keuls
Par ailleurs, les paramètres morphologiques sont significativement différent entre souches dans le cas de l’épaisseur totale des sclérotes et de la moelle (p<0.05) (Figure 19). Ce constat
a a a a b a b a b a b a b b c b c c c 0 5 10 15 20 25 30 ss58 ss24 ss242 ss48 ss37 ss17 ss174 ss65 ss1234 ss75 ss30 ss29 souches de S. sclerotiorum
A
: Taille de colonie de C. minitans (mm)a a b b c d a a b c b c d a b c b c d e d e c d e e c d e -10 0 10 20 30 40 50 60 70 80 ss 58 ss 24 ss 24 2 ss 48 ss 37 ss 17 ss 17 4 ss 65 ss 12 34 ss 75 ss 30 ss 29 souches de S. sclerotiorum
B
: Inhibition de la croissance de S. sclerotiorum (%) a b c b c b c b c d b b c d c d d d -150 -100 -50 0 50 100 ss 58 ss 24 ss 24 2 ss 48 ss 37 ss 17 ss 17 4 ss 65 ss 12 34 ss 75 ss 30 ss 29 souches de S. sclerotiorumC
: Inhibition de la production de sclérotes fils (%)est également cohérent avec les précédents résultats de la présente étude et confirme la variabilité morphologique entre souches.
Figure 19 : moyenne par souche des paramètres morphologiques avec A, B et C respectivement l’épaisseur totale du
sclérote, celle de la moelle, et celle du cortex. Chaque barre représente la moyenne de 30 observations ± l'erreur standard de la moyenne. Les nombres associés à des lettres différentes indiquent des différences significatives entre souches (P < 0,05) selon le test de comparaison multiple des moyennes de Newman et Keuls. Pour la figure C aucune différence significative observée.
Cependant, à l’examen de l’épaisseur moyenne du cortex entre souche, on ne constate pas de différence significative (p>0.05) (Figure 19, C). Ce résultat tend à confirmer les observations de l’étude de variabilité intra-souche par rapport à l’étude de variabilité inter-souche, selon lesquelles le cortex n’est pas explicatif des variabilités de sensibilité à C.
minitans. Une corrélation des paramètres morphologiques avec les indices de sensibilité par
souche a été menée afin d’appuyer ces constatations et d’approfondir ces analyses au sein même de chaque souche considérée.
b c d a e a b c b a a b c a b c a b c a b c d b c d 0,00 0,20 0,40 0,60 0,80 1,00 1,20 1,40 1,60 1,80 2,00 ss58 ss24 ss242 ss48 ss37 ss17 ss174 ss65 ss1234 ss75 ss30 ss29 souches de S. sclerotiorum
A
: Epaisseur moyenne totale des sclérotes (mm)d e e a b f b c d a b c b c d b c d a b c d a d e c d e 0,00 0,20 0,40 0,60 0,80 1,00 1,20 1,40 1,60 1,80 2,00 ss 58 ss 24 ss 24 2 ss 48 ss 37 ss 17 ss 17 4 ss 65 ss 12 34 ss 75 ss 30 ss 29 souches de S. sclerotiorum
B
: Epaisseur de la moelle (mm) 0,00 0,01 0,02 0,03 0,04 0,05 0,06 ss 58 ss 24 ss 24 2 ss 48 ss 37 ss 17 ss 17 4 ss 65 ss 12 34 ss 75 ss 30 ss 29 souches de S. sclerotiorumC
: Epaisseur moyenne du cortexPage
4) Relations
entre
sensibilité
à
C.
minitans
et
caractéristiques
morphologiques des sclérotes en distinguant les souches étudiées
La représentation graphique des liens entre la réduction de croissance de S. sclerotinia en présence de C. minitans et l'épaisseur des sclérotes montre des nuages de points désordonnés laissant présager l’absence de relation entre les paramètres testés (Figure 20). Ces représentations et les analyses de régression linéaire correspondantes ont également été réalisées entre les autres indices de sensibilité à C. minitans et les autres paramètres de morphologie des sclérotes avec des résultats similaires (données non montrées).
R éduc ti on d e c roi ss an ce d e S. sc ler o ti orum à J+ 3 (% )
Epaisseur totale des sclérotes (mm)
Figure 20 : Régression par souche de la réduction de croissance de S. sclerotiorum en présence de C. minitans en fonction de
la taille totale des sclérotes. 30sclérotes par souche, 1 point = 1 sclérote.
Les statistiques des analyses de régression révèlent qu’il existe des liens significatifs pour certaines souches seulement (Tableau 3, Tableau 4). Ainsi, dans le cas des souches ss1234 et ss58, la variabilité de sensibilité serait en partie expliquée à raison de 21% et de 25 % respectivement par la taille du sclérote totale. Alors que pour d’autres souches (ss29, ss30, ss48), cette variabilité serait expliquée par l’épaisseur du sclérote (Tableau 3). Il existe donc un lien entre ces 2 paramètres morphologiques des sclérotes et la réduction de croissance de
Sclerotinia en présence de l’agent de biocontrôle.
-100 -50 0 50 100 0 1 2 ss1234 -50 0 50 100 0 1 2 ss17 -100 -50 0 50 100 0 1 2 ss174 -50 0 50 100 0 1 2 3 ss24 -50 0 50 100 0 1 2 ss242 -50 0 50 100 0 1 2 ss29 -50 0 50 100 0 1 2 ss30 -50 0 50 100 0 1 2 ss37 -100 -50 0 50 100 0 1 2 3 ss48 -100 -50 0 50 100 0 1 2 3 ss58 -50 0 50 100 0 1 2 ss65 -100 -50 0 50 100 0 0,5 1 1,5 ss75
Tableau 3 : Statistiques des régressions linéaire de la réduction de croissance des souches en présence de C. minitans
avec d’une part l’épaisseur totale du sclérote et d’autre part avec l’épaisseur du cortex. Les cases orange signalent les régressions significatives (p<0,05).
Epaisseur → Sclérote total cortex
↓souches R² p R² p Ss1234 0,21 0,032 <0,01 0,959 Ss17 <0,01 0,955 <0,01 0,981 Ss174 0,01 0,578 0,03 0,499 Ss24 <0,01 0,778 0,07 0,213 Ss242 0,01 0,656 0,01 0,722 Ss29 0,03 0,453 0,20 0,032 Ss30 <0,01 0,800 0,33 0,032 Ss37 0,04 0,283 0,03 0,390 Ss48 0,07 0,185 0,16 0,040 Ss58 0,25 0,008 0,09 0,121 Ss65 0,02 0,496 0,11 0,079 Ss75 <0,01 0,875 0,02 0,431
Par ailleurs, une seule régression est significative entre l’épaisseur du cortex et la croissance de C. minitans (Tableau 4). Il s’agit de la souche ss29 pour laquelle ce caractère morphologique du sclérote explique significativement 31 % de la sensibilité. De plus, il s’agit d’une souche pour laquelle le cortex est significativement lié à un autre indice de sensibilité, ce qui prouve sa forte implication dans les mécanismes de sensibilité pour cette souche en particulier. Par conséquent l’importance du cortex ne peut pas être complètement ignoré dans l’explication de la sensibilité de S. sclerotinia vis à vis de C. minitans même s’il n’est pas explicatif des variabilités de sensibilité entre les souches.
Tableau 4 : Statistiques des régressions linéaire de croissance de C. minitans à partir des sclérotes avec d’une part
l’épaisseur totale du sclérote et d’autre part avec l’épaisseur du cortex Les cases orange signalent les régressions significatives (p<0,05)
Epaisseur → Sclérote totale cortex
↓souches R² p R² p Ss1234 0,02 0,546 0,14 0,091 Ss17 0,17 0,059 0,04 0,368 Ss174 <0,01 0,999 0,05 0,352 Ss24 0,05 0,302 <0,01 0,755 Ss242 <0,01 0,850 <0,01 0,770 Ss29 <0,01 0,963 0,31 0,006 Ss30 0,12 0,226 0,11 0,133 Ss37 <0,01 0,764 0,09 0,103 Ss48 0,03 0,413 0,05 0,264 Ss58 <0,01 0,823 0,05 0,262 Ss65 0,01 0,564 0,06 0,106 Ss75 <0,01 0,705 <0,01 0,861
Page
Un lien est donc visible ici au sein de certaines souches entre l’épaisseur du cortex et leur sensibilité à C. minitans. Pour autant, ces liens significatifs n’expliquent que de 16 à 33% de la variabilité de sensibilité au sein de ces souches et cela ne concerne que cinq souche sur quinze. On peut donc estimer qu’un ou plusieurs autres facteurs, plus prépondérants, sont explicatifs de la diversité de sensibilité au sein des autres souches et seraient à même d’occulter l’influence de la morphologie des sclérotes pour ces dernières.
CONCLUSION et PERSPECTIVES
Les résultats de cette étude ont clairement confirmé la variabilité de sensibilité à C.
minitans entre souches de S. sclerotiorum qui avait été observée lors de précédents travaux
(Nicot et al., 2016). Par ailleurs, une distinction des souches de S. sclerotiorum par la morphologie de leurs sclérotes a été mise en évidence. En effet, les souches ont présenté des tailles de sclérotes significativement différentes. En revanche, la taille de leur cortex semble plus homogène.
Contrairement à l'hypothèse de départ, aucun lien fort n'a été mis en évidence entre ces caractères morphologiques et les indices de sensibilité à C. minitans. Ces paramètres facilement mesurables sur les sclérotes ne pourront donc être utilisés de manière routinière comme prédicteurs de la sensibilité d'une souche de S. sclerotiorum. Cependant, au cours de cette étude, un lien fort à tout de même été établi pour certaines souches entre la morphologie des sclérotes et leurs sensibilités individuelles à C. minitans. Ce lien peut donc exister mais ne serait pas le facteur explicatif prépondérant de la sensibilité d’un sclérote.
Cette étude est la première du genre à étudier l’influence des caractères morphologiques des sclérotes sur la sensibilité de S. sclerotiorum à C. minitans. Ces résultats renforcent l'intérêt qui pourrait être porté à d'autres hypothèses explicatives. Il faudrait par exemple tester la composition du cortex ou encore les molécules produites par S. sclerotiorum en présence de son agresseur.
BIBLIOGRAPHIE
Agrios, G.N., 1936. Sclerotinia diseases. Agrios, G.N., Plant pathology, 5th ed., Elsevier, pages 546-553.
Anses – INRA – Terres Inovia, 2017. Gestion durable de la résistance aux fongicides utilisés contre la sclérotiniose du colza (Sclerotinia sclerotiorum). Note commune.
Arvalis, Cetiom, 2015. Stratégie fongicide sur colza. Arvalis-cetiom info janvier 2015, 26.
Avril, F., 2016. Etude de la sensibilité de souches de Sclerotinia sclerotiorum à l’agent de protection biologique Coniothyrium minitans. INRA, rapport de stage de master 2.
Bardin, M., Bornard, I,. Troulet, C., Boulon, J.P., 2013. Lutte biologique contre la sclérotiniose de la salade par Coniothyrium minitan. Phytoma 662, 40-43.
Bennett, A.J., Leifert, C., Whipps, J.M., 2006. Survival of Coniothyrium minitans associated with sclerotia of Sclerotinia sclerotiorum in soil. Soil Biology & Biochemistry 38, 164-172.
Huang, H.C., Kokko, E.G., 1987. Ultrastructure of hyperparasitism of Coniothyrium minitans on sclerotia of Sclerotinia sclerotiorum. Canadian Journal of Botany, 2483-2489.
Huang, H.C., Kokko, E.G., 1988. Penetration of hyphae of Sclerotinia sclerotiorum by Coniothyrium minitans without the formation of appressoria. Journal of Phytopathology 123, 133-139.
Penaud, A., Michi, A., 2009. Coniothyrium minitans, un agent de lutte biologique au service de la protection intégrée. OCL, agronomie-environnement 16, 158-163.
Nicot, P., Avril, F., Duffaud, M., Leyronas, C., Troulet, C., Villeneuve, F., Bardin, M., 2016. Are there regional differences in the susceptibility of Sclerotinia sclerotiorum strains to Coniothyrium minitans? Biological and integrated control of plant pathogens, IOBC-WPRS 117, 83-87.
Phillips, A.J.L., Price, K., 1983. Structural aspects of the parasitism of sclerotia of Sclerotinia sclerotiorum (Lib.) de Bary by Coniothyrium minitans Campb. Phyto-pathologische Zeitschrift 107, 193-203.
Tu, J.C., 1984. Mycoparasitism by Coniothyrium minitans on Sclerotinia sclerotiorum and its effect on sclerotial germination. Phytopathologische Zeitschrift 109, 261-268.
Unilet, 2014. La lutte biologique en traitement de fond contre le sclerotinia. Unilet Infos 121, 15-17.
SITES INTERNET CONSULTES
Agridyne, Les spéciaux d’Agrydine : comment améliorer la qualité de la récolte colza,
spécial Sclerotinia, dernière consultation 27/07/2017.
http://www.desangosse.fr/medias/files/agriculture/adjuvants/COLZA%20SPECIAL%20SCL EROTINIA.pdf
Arvalis-infos, Sclérotinia - Maladie sur Féverole, dernière consultation le 03/04/2017.
http://www.fiches.arvalis-infos.fr/fiche_accident/fiches_accidents.php?type_cul=5&type_acc=4&id_acc=308&mode=fa
BASF France Division Agro, Le sclérotinia du colza, dernière consultation le 27/0772017. http://www.agro.basf.fr/agroportal/fr/fr/cultures/le_colza/les_maladies_ravageurs_adventices1 _pgc/les_maladies2_pgc/sclerotinia.html
Bayer-Agri, Sclérotinia : jusqu'à 15 q/ha de pertes potentielles, dernière consultation le 03/04/2017. http://www.bayer-agri.fr/protection-cultures/sclerotinia-sur-colza/sclerotinia-jusqua-15-qha-de-pertes-potentielles/
Ephytia.inra ; fiche sur la sclérotiniose, dernière consultation le 03/04/2017
-fiche sur l’épidémiologie de la salade : http://ephytia.inra.fr/fr/C/5815/Salades-Biologie-epidemiologie
- fiche sur l’épidémiologie du tabac : http://ephytia.inra.fr/fr/C/10964/Tabac-Sclerotinia-sclerotiorum et http://ephytia.inra.fr/fr/C/10797/Tabac-Sclerotiniose-Sclerotinia-http://ephytia.inra.fr/fr/C/10964/Tabac-Sclerotinia-sclerotiorum
- fiche sur l’épidémiologie de la tomate : http://ephytia.inra.fr/fr/C/5105/Tomate-Sclerotiniose-Sclerotinia-sclerotiorum
- fiche sur l’épidémiologie du melon : http://ephytia.inra.fr/fr/C/7690/Melon-Sclerotiniose-Sclerotinia-sclerotiorum
- fiche sur l’épidémiologie de la salade : http://ephytia.inra.fr/fr/C/5883/Salades-Sclerotinia-sclerotiorum-Sclerotinia-minor et http://ephytia.inra.fr/fr/C/5413/Salades-Sclerotiniose-Sclerotinia-sclerotiorum-Sclerotinia-minor
LOGICIELS UTILISÉS
ImageJ, Rasband, W.S., U. S. National Institutes of Health, Bethesda, Maryland, USA, https://imagej.nih.gov/ij/, 1997-2016
ANNEXE
Résultat de l’analyse statistique « stepwise forward»
Y testé Steps Degr. of
Freedom F to enter P to enter Effect status diam conio J7
TOTSCLER Step 1 1 0,04917445 0,82749679 Out
MOELLE 1 0,179137 0,67812175 Out CORDIFF 1 2,73154329 0,11915612 Out CORTOT 1 0,55267848 0,46871054 Out CORMIN 1 0,38641434 0,54352299 Out CORMOY 1 2,82590208 0,11345263 Out CORMAX 1 0,29956446 0,59220648 Out Presence conio
TOTSCLER Step 1 1 0,21085543 0,65268182 Out
MOELLE 1 0,56763445 0,46286304 Out CORDIFF 1 6,93047497 0,01883533 Entered CORTOT 1 0,69054917 0,4190092 Out CORMIN 1 0,02251068 0,88273537 Out CORMOY 1 2,36492265 0,14491479 Out CORMAX 1 0,40845454 0,53239391 Out Inhib diam
TOTSCLER Step 1 1 0,03478755 0,85454063 Out
MOELLE 1 0,12827395 0,72521867 Out CORDIFF 1 1,89978803 0,18831463 Out CORTOT 1 0,53465779 0,47592337 Out CORMIN 1 0,30382205 0,58961305 Out CORMOY 1 1,84150449 0,19484515 Out CORMAX 1 0,36052066 0,55718094 Out
Inhib fils TOTSCLER Step 1 1 0,89625415 0,35879067 Out
MOELLE 1 1,17399837 0,295691 Out CORDIFF 1 1,13538498 0,30348135 Out CORTOT 1 1,33601676 0,265817 Out CORMIN 1 0,72519133 0,40783667 Out CORMOY 1 1,45832485 0,24589388 Out CORMAX 1 1,42727445 0,25075887 Out
Page
RESUME
Le champignon phytopathogène Sclerotinia sclerotiorum détruit massivement les cultures et produit des sclérotes, sources de nombreuses contaminations. Un produit de biocontrôle, Contans WG, contenant les spores d’un mycoparasite, Coniothyrium minitans, permet le nettoyage des champs contaminés par destruction des sclérotes dans le sol. Une précédente étude a montré des différences de sensibilité de souches de S. sclerotinia à C. minitans. Notre objectif était de savoir si cette différence de sensibilité de S. sclerotinia à C. minitans pouvait être liée à la morphologie des sclérotes. Pour cela, une première approche a consisté à mesurer l’épaisseur de sclérotes et de leur cortex pour différentes souches et de relier les valeurs moyennes, par analyse de régression linéaire, aux moyennes d’indices de sensibilité obtenues pour ces souches dans la précédente étude. Une seconde approche a été menée pour réaliser la même régression que précédemment mais en utilisant des données obtenues par sclérote individuel. Des coupes de sclérotes parasités ont été mesurées pour étudier l’épaisseur totale des sclérotes et de leur cortex. Les mêmes sclérotes ont ensuite été mis en culture pour obtenir les indices de sensibilité de façon individuelle. Les régressions obtenues par la première approche n’ont pas montré de lien significatif susceptible d’expliquer les différences de sensibilité à C. minitans par souche de S. sclerotiorum. En revanche, l’étude par sclérote individuel a montré jusqu’à 33% de variabilité de sensibilité expliqué par la morphologie des sclérotes au sein d’une même souche. Par conséquent, il existe lien entre la morphologie des sclérotes et la sensibilité de S. sclerotiorum à C.
minitans mais un ou plusieurs autres facteurs restent prépondérants à ce lien entre souches de S. sclerotiorum, comme peut être la composition du cortex.
Mots clés : Sclerotinia sclerotiorum, Coniothyrium minitans, sclérote, sensibilité, mycoparasitisme
ABSTRACT
The plant pathogen Sclerotinia sclerotiorum destroys massively diverse crops and produces sclerotia, a conservation structure which is a source of many contaminations. A biocontrol product, Contans WG, containing spores of the mycoparasitic fungus Coniothyrium minitans, can destroy sclerotia in the soil. A previous study has shown differences in sensibility to C. minitans among strains of S. sclerotiorum. Our purpose was to determine if these differences in sensibility could be linked to the morphology of sclerotia. To do so, a first approach consisted in measuring the thickness of sclerotia and their cortex for different strains. Those means were correlated by linear regression with average sensibility indices determined in the previous study. A second approach consisted in carrying out the same linear regression analysis, but this time on data for individual sclerotia. Cross-sections of parasitized sclerotia were measured individually to know their total thickness and the one of their cortex. Then, the same sclerotia were cultivated to determine their level of sensitivity. The regressions obtained with the first approach were not significant and could not explain the differences of sensibility to C. minitans among strains of S. sclerotiorum. However, the study on individual sclerotia showed that up to 33% of sensibility difference among sclerotia could be explained by the sclerotia morphology for some strains. So, there is a link between the sclerotia morphology and the sensibility to C. minitans but one or more factors are clearly more important than this link, such as, possibly, the chemical composition of the cortex.