HAL Id: dumas-01915046
https://dumas.ccsd.cnrs.fr/dumas-01915046
Submitted on 7 Nov 2018HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Aplasie médullaire chez un enfant traité par
azathioprine : rôle de la thiopurine méthyltransférase,
enzyme du métabolisme de l’azathioprine
Nelly Loiseau Savariau
To cite this version:
Nelly Loiseau Savariau. Aplasie médullaire chez un enfant traité par azathioprine : rôle de la thiop-urine méthyltransférase, enzyme du métabolisme de l’azathioprine. Sciences pharmaceutiques. 1997. �dumas-01915046�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
Ill llll Ill l li Ill Ill li\ 1111111
D 115 018823 4UNIVERSITE Joseph FOURIER - GRENOBLE 1
Sciences Technologie Médecine
U.F.R. de PHARMACIE
Domaine de la Merci - LA TRONCHE
ANNEE 1997 N° d'ORDRE:
~ooy
APLASIE MEDULLAIRE CHEZ UN ENFANT
TRAITE PAR AZATHIOPRINE
ROLE DE LA THIOPURINE METHYL TRANSFERASE,
ENZYME DU METABOLISME DE L'AZATHIOPRINE
THESE
Présentée
à
l'Université Joseph FOURIER - GRENOBLE 1 "pour obtenir le grade de DOCTEUR EN PHARMACIE Par LOISEAU Nelly épouse SAVARIAU
Thèse soutenue publiquement le 18 février 1997
Devant Monsieur le Professeur Jean GALOP, Président du jury Monsieur le Docteur Jean-Pierre CHOURAQUI
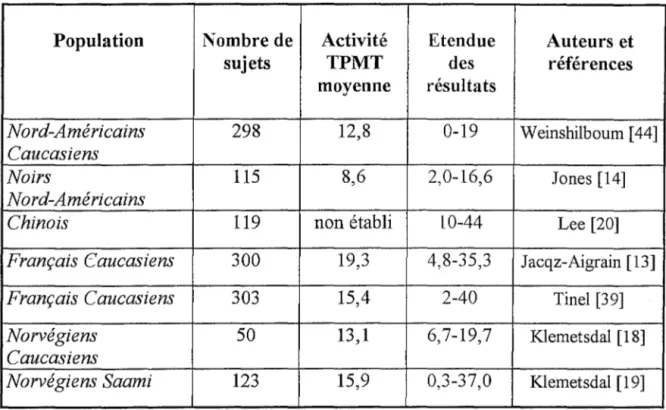
Monsieur le Professeur Germain BESSARD [Données à caractère personnel]
UN
IVERS
ITE
Joseph
FOUR
IER
-GRENOBLE
1
Sciences Technologie Médecine
ANNEE 1997
U
.F
.R
.
de PHARMAC
IE
Domaine de laMerci -LA TRONCHE
N° d'ORDRE:
APLAS
IE
MEDULLA
IRE
CHEZ
UN
ENFANT
TRA
ITE
PAR
AZATH
IOPR
INE
ROLE
DE
LA
TH
IOPUR
INE
METHYL
TRANSFERASE
,
ENZYME
DU
METABOL
ISME
DE
L
'AZATH
IOPR
INE
THESE
Présentée
à
l'UniversitéJoseph FOURIER -GRENOBLE1pour obtenir legrade de DOCTEUR EN PHARMACIE Par LOISEAU Nelly épouse SAVARIAU
Thèse soutenue publiquement le18 février1997
Devant Monsieur leProfesseur Jean CALOP, Président du jury Monsieur leDocteur Jean-Pierre CHOURAQUI
Monsieur leProfesseur Germain BESSARD
i
A Monsieur le Professeur Jean CALOP,
pour l'honneur qu'il me fait en acceptant de présider ce jury. Qu'il soit remercié pour l'intérêt porté à ce travail
et pour la qualité de son enseignement, que j'ai pmiiculièrement apprécié.
A Monsieur le Docteur Jean-Pierre CHOURAQUI,
pour m'avoir confié ce travail et pour l'aide précieuse qu'il m'a apportée tout au long de sa réalisation.
Qu'il soit remercié très sincèrement pour sa disponibilité et sa patience à mon égard. Je lui exprime ici toute ma gratitude.
A Monsieur le Professeur Germain BESSARD, pour avoir accepté de juger ce travail.
Qu'il trouve ici le témoignage de ma reconnaissance et de mon profond respect.
A Madame Françoise SERRE - DEBEAUV AIS, pharmacien hospitalier,
pour avoir accepté avec gentillesse de me guider dans l'élaboration de ce travail, pour sa disponibilité et son accueil chaleureux.
Qu'elle trouve ici le témoignage de mon amitié.
A Monsieur le Docteur Michel MALLARET, pour son aimable participation.
Qu'il trouve ici le témoignage de ma reconnaissance.
A Antoine et sa maman,
A mes parents, pour leur soutien, leur affection et leurs encouragements à l'aboutissement de tous mes projets.
A Didier, pour son soutien, sa patience et son aide de tous les instants au cours de ces années d'études.
Je leur dédie ce travail avec tout mon amour.
INTRODUCTION
Une aplasie médullaire est toujours un événement grave et inquiétant, mettant en jeu la vie du patient.
La recherche du mécanisme d'apparition de celle-ci peut permettre d'éviter une récidive pour le patient, et éventuellement d'éviter ce phénomène chez d'autres personnes.
Le cas clinique étudié concerne un enfant de 13 ans présentant une rectocolite hémorragique, compliquée d'une cholangite sclérosante, et traité de ce fait par immunosuppresseurs, salicylés et corticoïdes.
Suite à ce traitement, il a développé une aplasie médullaire sévère.
Afin d'en déterminer l'origine exacte, nous avons recherché parmi son traitement :
- les médicaments susceptibles d'induire une toxicité hématologique, avec calcul de !'imputabilité de chacun.
- une étude approfondie de l'azathioprine, immunosuppresseur ayant un rôle prépondérant dans la myélosuppression:
~ étude de son métabolisme in vivo, avec dosage des métabolites
cytotoxiques de l'azathioprine, les 6-thioguanine nucléotides.
~ détermination du rôle joué par une des enzymes du métabolisme, la
thiopurine méthyltransférase.
- les éventuelles interactions médicamenteuses ayant pu aboutir à une potentialisation des effets immunosuppresseurs.
Dans un premier temps, nous développerons la rectocolite hém01Tagique ou colite ulcéreuse chez les enfants ainsi que les traitements actuellement utilisés. Nous aborderons succinctement la cholangite sclérosante.
Puis nous exposerons dans une seconde partie le cas clinique étudié.
La troisième partie sera consacrée à la détennination du mécanisme ayant conduit à l'aplasie médullaire.
PREMIERE PARTIE
LA RECTOCOLITE HEMORRAGIQUE CHEZ L'ENFANT
A - Pathologie
La colite ulcéreuse ou rectocolite hémorragique est une maladie inflammatoire de l'intestin (Mil), très proche de la maladie de Crohn. Les critères spécifiques sont parfois insuffisants pour les différencier. Dans 15% des cas de Mil, le type de colite reste indéterminé [ 17].
La rectocolite hémorragique (RCH) est une maladie inflammatoire chronique touchant le colon et le rectum.
La RCH atteint dans 90 % des cas le colon, principalement le colon distal, et dans pratiquement 1 OO % des cas le rectum. Bien que considérée comme limitée au colon, l'inflammation peut être continue jusqu'au caecum et s'étendre jusqu'à 25 cm en amont dans l'iléon terminal [12].
Elle atteint la muqueuse et donne lieu à un syndrome diarrhéique avec émulsion hémorragique et mucopurulente, évoluant par poussées entrecoupées de rémissions plus ou moins longues [12].
L'inflammation est limitée tout d'abord à la muqueuse et évolue continuellement le long de l'intestin en ulcérations, hémorragies, oedèmes puis l'épithélium se régénère. Dans les formes sévères dans lesquelles la muqueuse épithéliale a été détruite, l'inflammation peut atteindre la sous-muqueuse, jusqu'à la musculeuse [ 12].
1 - Etiologie
L'étiologie de la RCH est inconnue [12].
Aucun agent infectieux n'a été trouvé, bien que les lésions ressemblent à celles observées dans les colites infectieuses [12].
Il existe un processus autoimmun puisque des anticorps dirigés contre la muqueuse du colon sont retrouvés dans le sérum, il y a également une activation du système du complément [12]. On retrouve fréquemment chez les patients atteints de RCH des autoanticorps dirigés contre le cytoplasme des polynucléaires neutrophiles (ANCA), ce qui est beaucoup moins fréquent dans la maladie de Crohn [30]. On retrouve parfois des anticorps dirigés contre la tropomyosine [30].
La RCH est associée à une haute prévalence familiale de maladies atopiques et de manifestations extra-intestinales telles qu' érythèmes noueux, arthrites, uvéites et vascularites, ce qui conforte l'intervention de facteurs immunologiques [12].
Cependant, les données que l'on possède actuellement sont insuffisantes pour déterminer si les mécanismes immuns jouent un rôle primaire ou secondaire. Il n'y a pas de preuve suffisante pour affirmer que la RCH est d'origine allergique.
Des facteurs psychosomatiques tels que le stress, la personnalité ou une maladie psychiatrique ne sont pas à l'origine de la RCH, bien que des facteurs émotionnels ou psychosociaux peuvent affecter la présentation et l'évolution de la maladie [12].
2 - Caractéristiques cliniques
La colite ulcéreuse comporte plusieurs stades, que l'on distingue selon l'étendue de l'inflammation de la muqueuse et les signes systémiques.
Les manifestations extra-intestinales peuvent être les premiers signes de la maladie et ainsi masquer les symptômes intestinaux [12].
L'un des premiers signes cliniques caractéristique de la colite ulcéreuse est la présence de sang dans les selles, accompagné de petites crampes abdominales lors de la défécation [ 16].
C" 1 1 ..C:. , ..l 11 1 . 1. - _1 , . ' 1 1 1
.:>eiûn ia irequence ues seues p1us ou moms manne1ques et aes aomeurs abdominales, et la fièvre, on considère que la maladie est bénigne, modérée ou sévère [ 16].
Les signes extra-intestinaux et systémiques sont les suivants [16]:
1-perte de poids
chez 68% des enfants, avec une moyenne de 4, lkg. 2- arthrites et ruihralgies
3- retard de croissance et de maturation sexuelle
le retard de croissance se retrouve chez environ 6 à 12% des enfants. Il s'accompagne d'une diminution des apports nutritionnels.
4- lésions cutanées
des aphtes multiples apparaissent souvent de façon précoce, avant même le diagnostic de la maladie. Lorsque la maladie évolue, apparaissent des érythèmes noueux ou des pyoderma gangrenosum. 5- atteinte rénale
chez 6%, il se développe des calculs rénaux d'oxalate, pouvant être précédés par une hématurie. Les atteintes rénales peuvent évoluer jusqu'à une insuffisance rénale, mais cela reste rare.
6- atteinte hépatobiliaire
elle apparaît chez 4% des enfants ayant une maladie inflammatoire de l'intestin. La cholangite sclérosante est la complication hépatique la plus fréquente. On constate une élévation des phosphatases alcalines et/ou des y-glutamyl-transpeptidases.
3 - Signes biologiques
3.1 - Examens sérologiques et coprologiques
L'examen des selles montre la présence de sang.
L'examen sanguin peut détecter une anémie, une leucocytose ou une thrombocytose, souvent accompagnée d'une hypoalbuminémie [12].
La vitesse de sédimentation, le taux de protéine C réactive (PCR) et d'orosomucoïde sont fréquemment élevés chez les enfants ayant une colite ulcéreuse. Ces signes témoignent de l'inflammation du co Ion [ 12, 16].
3.2 - Evaluation endoscopique
Dans la plupart des cas, l'évaluation endoscopique avec biopsies fournit la documentation nécessaire pour établir le diagnostic d'inflammation intestinale. Mais elle ne suffit pas à elle seule.
Ce diagnostic doit tenir compte des symptômes, de l'examen clinique, des tests de laboratoire (examen biologique) et éventuellement des examens radiologiques [16].
3.3 -Etude radiologique
Elle consiste en une radiographie de la partie gastro-intestinale, avec le suivi du petit intestin, ce qui aide à déterminer l'étendue de la maladie et permet de distinguer lacolite ulcéreuse de lamaladie de Crohn [16].
En effet, la maladie de Crohn atteint le duodénum et l'iléon, associé dans 50% des cas à une atteinte du colon et du rectum. Une atteinte isolée du colon est
~ En revanche, la colite ulcéreuse touche principalement le colon et le rectum,
sans atteinte du grêle dans lamajorité des cas [12].
4 -Complications
1 -Le mégacolon toxique est la plus impmtante complication (5% des patients ayant une colite ulcéreuse). C'est une urgence médicale et chirurgicale [12]. Il s'agit d'une dilatation de la partie malade du colon, le plus souvent le colon transverse.
Le mégacolon toxique peut évoluer vers une perforation du colon, une septicémie à bactéries gram(-) et une hémorragie massive [12].
2 -Une "rigidité" du colon peut apparaître lorsque la colite ulcéreuse est ancienne. Elle peut être dueà une dysplasie ou un carcinome du colon. (Le risque de carcinome augmente de 10% par décade). Elle conduit à une proctocolectomie [12].
3 -Une arthrite touchant les genoux et les chevilles apparaît chez environ 25% des patients. Elle est en corrélation avec l'activité de lamaladie [12].
4-Le pyoderma gangrenosum (ulcération progressivement profonde de la peau) complique les cicatrisations d'éventuelles incisions chirurgicales, de traumatismesmineurs ou de sites de stomies (poches par exemple).
Des greffes de peau peuvent être nécessaires pour les lésions les plus importantes[12].
5 -Les complications oculaires (uvéites principalement) sont relativement rares puisqu'on les constate chez moins de 1% des enfants atteints deMIL Les complications sont plus fréquemment dues à la cmticothérapie: cataracte et augmentation de lapression intraoculaire [16].
6 -La cholangite sclérosante [16,2]. Cette complication étant très fréquente et fortement liée à laRCH, elle sera développée plus loin(cf. Paitie I B).
5 - La thérapeutique
Le traitement de la rectocolite hémorragique de l'enfant peut être chirurgical ou médical. La RCH étant limitée au colon, une colectomie totale sera curative.
Cependant, les complications chirurgicales potentielles et les difficultés d'adaptation à l'iléostomie conduisent à instaurer en première intention un traitement médical [12].
Le but du traitement médical de la RCH de l'enfant est le contrôle des symptômes et la prévention des rechutes. Le choix du traitement dépend de la sévérité de l'inflammation [ 12].
Les traitements permettant d'agir avec succès sur les symptômes des enfants sont la corticothérapie quotidienne, poursuivie dans quelques cas par un traitement d'entretien alterné un jour sur deux, la sulfasalazine ou l'acide 5-aminosalicylique (5-ASA), les immunosuppresseurs et la nutrition entérale [15].
5.1 - Les salicylés
Ils sont prescrits pour le traitement des colites ulcéreuses bénignes [12]. Les enfants répondent généralement au traitement oral par sulfasalazine (SALAZOPYRINE®) ou acide 5-aminosalicylique (PENTASA®). Ils sont utilisés seuls ou combinés à des corticoïdes per os, des mousses de corticoïdes ou du 5-ASA en lavements [ 16].
Les salicylés possèdent des propriétés anti-inflammatoires locales [21, 11] et posséderaient également des propriétés immunosuppressives et antibactériennes [ 42]
5 .1.1 - L'acide 5-aminosalicylique ou mésalazine [ 11]
Le PENT ASA® ou mésalazine est la fraction active de la sulfasalazine ou salazosulfapyridine (SALAZOPYRINE®).
La salazosulfapyridine est une molécule fmmée de deux parties liées par un pont diazoïque. La scission de ce pont sous l'influence des bactéries présentes dans la lumière colique donne naissance à deux molécules:
- la mésalazine, responsable de l'activité thérapeutique
- la sulfapyridine, responsable de la majorité des effets indésirables de la SALAZOPYRINE®.
Les recherches se sont orientées vers la mise au point d'une forme pure de mésalazine, afin d'obtenir un médicament ayant moins d'effets secondaires, tout en restant efficace et spécifique de la symptomatologie inflammatoire digestive.
Le 5-ASA étant un élément important du traitement dans le cas clinique étudié, il sera détaillé après la sulfasalazine (cf. 5 .2).
5 .1.2 - La sulfasalazine
La sulfasalazine induit de nombreux effets indésirables, dus à la sulfapyridine [ 16]:
- maux de tête
- troubles gastro-intestinaux, notamment nausées et diarrhées sanglantes - réactions d'hypersensibilité: éruptions cutanées
- anémie hémolytique
- quelques rares cas d'hépatotoxicité, de neutropénie et de thrombocytopénie.
Quelques enfants ont développé ces mêmes effets indésirables avec le 5-ASA [16]. Cependant, 80 à 90% des patients intolérants à la sulfasalazine tolèrent le 5-ASA sans aucun effet secondaire [21].
Selon Barden et al [3], les enfants ayant une colite ont moins de nausées et de vomissements lorsque la sulfasalazine est remplacée par le 5-ASA à la dose moyenne de 400 mg 2 fois par jour (20 mg/kg/j).
Afin de mimm1ser les effets indésirables, l'introduction de la sulfasalazine est progressive:
25 à 40 mg/kg/j jusqu'à 50-75 mg/kg/j en 2 à 4 prises sans dépasser 4 g/j [16].
La sulfasalazine a prouvé son efficacité dans le contrôle des formes bénignes de la maladie et dans la réduction de la fréquence des rechutes, lorsque la rémission a été obtenue [12].
La sulfasalazine inhibe l'absorption des folates, d'où la nécessité de supplémenter en acide folique (1 mg/j) [12].
5.2 - PENTASA® [11,42]
5.2.1 - Dénominations
- Dénomination commune internationale: mésalazine - Autre dénomination: acide 5-aminosalicylique (5-ASA). 5.2.2 - Formule développée
HOOC
OH
5.2.3 - Présentation
PENTASA® comprimé sécable 250 mg. PENTASA® comprimé sécable 500 mg.
PENTASA® comprimé a été conçu pour libérer de manière constante et prolongée la mésalazine dans la lumière des organes cibles. La mésalazine pure est enfermée dans des microgranules enrobés d'une membrane semi-perméable d'éthylcellulose. Plusieurs centaines de microgranules sont compactés avec les excipients pour réaliser un comprimé [ 11].
5.2.4 - Indications thérapeutiques
- traitement d'attaque de la rectocolite hémorragique en poussée légère à modérée
- traitement d'entretien de la rectocolite hémonagique
- traitement de la maladie de Crohn en poussée légère à modérée
- prévention des poussées aiguës de la maladie de Crohn pour les formes fréquemment récidivantes
5.2.5 - Propriétés pharmacologiques a - Pharmacodynamie
La mésalazine possède une action anti-inflammatoire au niveau de la muqueuse intestinale (intestin grêle, colon, rectum) par libération lente et constante de mésalazine [ 11].
La libération de la mésalazine est indépendante des conditions physiologiques notamment des variations de pH, de la vitesse du transit intestinal et de la composition de la flore intestinale.
Le mécanisme de l'effet thérapeutique reste encore mal connu:
- La mésalazine inhibe de façon imp01iante la 5-lipo-oxygénase, nécessaire à la synthèse des leucotriènes B4 à partir de l'acide arachidonique. Ce sont des médiateurs de l'inflammation, ayant une activité chimiotactique importante [21].
- L'inhibition de la cyclo-oxygénase et donc de la synthèse des prostaglandines ne semble pas avoir d'effet thérapeutique sur les maladies inflammatoires de l'intestin [21].
- Une autre hypothèse est l'élimination des radicaux libres, produits par les macrophages et les polynucléaires neutrophiles et participant au processus de destruction cellulaire [21].
b - Pharmacocinétique
La mésalazine est la fraction active de la salazosulfapyridine (SALAZOPYRINE® ).
- Libération du 5-ASA dans le tractus digestif :
le 5-ASA est encapsulé dans des microgranules , qui sont libérés dans l'estomac lors du délitement du comprimé; le 5-ASA diffuse à travers la membrane de ces granules lors de leur transit sur toute la longueur de l'intestin, du duodénum au rectum. Environ 65% de la dose de mésalazine ingérée sont retrouvés à l'entrée du colon.
- Absorption :
Lors de l'administration réitérée, à la dose de 1500 mg par jour en trois prises, la concentration minimale de 5-ASA à l'état d'équilibre, qui est atteint à partir du 5ème jour, est quasi nulle (en moyenne inférieme à 1 µg/ml); celle de son dérivé acétylé, l'acétyl-5-ASA est très faible, en moyenne inférieure à 2 µg/ml.
Au total, environ 60% de la dose de 5-ASA ingérée sont absorbés : 35% dans l'intestin grêle et 25% dans le colon.
-Métabolisme :
La demi-vie du 5-ASA est comte (de l'ordre d'une heure). Son élimination se fait essentiellement par transformation métabolique; l'acétyl-5-ASAest son principal métabolite et il est probablement inactif [4]. La N-acétylation a lieu en majeure partie dans le foie. La demi-vie terminale de l'acétyl-5-ASAest longue, de l'ordre de 24 heures.
-Elimination :
Lors de l'administration réitéréeà la dose de 1500 mg par jour en troisprises, environ 90% de ladose de 5-ASA ingérée sont retrouvés chez les sujets normaux avec en moyenne, 40-50% dans les selles et 35-50% dans lesurines, dont lamajeure partie sous forme de dérivé acétylé (65-70% dans les selles, 90% dans les urines).
Chez les malades atteints de maladie de Crohn, l'excrétion urinaire de l'acétyl-5-ASA apparaît moins importante que chez les sujets normaux, de même que lestaux sériques sont moins élevés, ce qui témoigne d'une moindre absorption. Quant à l'élimination fécale du 5-ASA et de l'acéty l-5-ASA, elle est comparable à celle des sujets normaux ou sensiblement accrue.
L'excrétion biliaire est minime(1%) et le taux de recirculation en téro-hépatique est d'environ 7% de ladose absorbée.
5.2.6 -Contre-indication
-Hypersensibilité aux salicylés.
-Grossesse et allaitement : en l'absence de données cliniques humaines.
5.2.7 -Précautions d'emploi
La mésalazine doit être administrée avec prudence chez les malades
...~ ... t..,..-.tnno1-nc>11f.fic>!l-nl'P liP.n,;,t1n11Pf'lllrP.n!OllP
5 .2. 8 - Effets indésirables Rares:
- céphalées, nausées, vomissements en début de traitement
- pancréatite aiguë d'évolution bénigne, régressant à l'arrêt du médicament.
Exceptionnels :
- péricardite et myocardite imposant l'arrêt définitif du médicament
- leucopénie réversible à l'arrêt du traitement
- hépatite: la mésalazine est potentiellement hépatotoxique. 5.2.9 - Posologie
Rectocolite hémorragique
Traitement d'attaque : 2 à 4 g par jour, en 3 ou 4 prises.
La posologie sera adaptée en fonction de la réponse au traitement. La durée de traitement recommandée est de 4 à 8 semaines.
Traitement d'entretien: 750 mg à 1,5 g par jour en 3 prises. Maladie de Crohn
Traitement d'attaque : 4 g par jour en 4 prises. Traitement d'entretien : 2 g par jour en 4 prises. Mode d'administration :
avaler les comprimés avec un peu d'eau, sans les croquer ni les mâcher, et de préférence au milieu des principaux repas [11].
5.3 - Les corticoïdes
Les corticoïdes sont efficaces dans les colites ulcérées modérées à sévères[l2]. Les corticoïdes utilisés sont la prednisone (CORTANCYL®), la prednisolone (SOLUPRED®) et la méthylprednisolone (MEDROL®). Ce sont des anti-inflammatoires stéroïdiens. A forte dose, ils possèdent un effet immunosuppresseur [42].
5 .3 .1 - Posologie
La mise en place du traitement se fait par une dose relativement élevée de prednisone ou méthylprednisolone ( 1 à 2 mg/kg/j) en deux prises par jour, jusqu'à ce que la maladie soit contrôlée, soit généralement dans un délai de deux semaines. Cette dose est ensuite maintenue pendant deux à quatre semaines, en une prise quotidienne unique.
Par la suite, le traitement médical est complété par l'addition de sulfasalazine ou un de ses dérivés. La cmiicothérapie est alors diminuée progressivement de 5 mg par semaine, un jour sur deux, tandis que la dose du second jour est de 1 mg/kg. La diminution progressive se poursuit Jgsqu'à l'arrêt complet des corticoïdes. Si l'exacerbation de la maladie empêche leur arrêt, une corticothérapie chronique à jours alternés peut être nécessaire [12].
L'intérêt d'un traitement par les glucocorticoïdes est bien démontré dans la RCH mais il est limité par deux inconvénients majeurs:
- d'une part les corticoïdes ne suppriment l'inflammation que temporairement et ne sont pas capables de maintenir une rémission prolongée
- d'autre part tout traitement corticoïde prolongé à une dose supérieure à 8-25 mg de cortisol, qui correspond à la production physiologique, peut induire un hypercorticisme.
Les corticoïdes habituellement utilisés dans les maladies inflammatoires de l'intestin étant relativement puissants (la prednisone ou la méthylprednisolone, par exemple, sont 4 à 5 fois plus puissantes que le cortisol), la dose "seuil" est équivalente à 2 à 6 mg par jour [33].
5.3.2 - Effets secondaires
Les signes cliniques de l'hypercorticisme iatrogène sont, pour la plupart d'entre eux, ceux du syndrome de Cushing spontané [33]:
Le retard de croissance chez l'enfant, le faciès lunaire, l'acné, les vergetures, la bosse graisseuse de la nuque ("bosse de bison"), la prise de poids, l'amincissement de la peau, les ecchymoses faciles, l'ostéoporose, une mauvaise cicatrisation des plaies, l'augmentation de l'incidence des infections, les troubles psychiques, une myopathie et une faiblesse musculaire. On peut aussi observer une hyperglycémie, une balance azotée négative et des calculs rénaux [33].
De plus, les stéroïdes exogènes sont classiquement responsables d'hypertension, de pancréatite, de vascularite, d'hypertension intracrânienne bénigne, de glaucome et de cataracte [33].
*
Chez l'enfant, le retard de croissance est probablement l'effet secondaire le plus grave. Il est potentiellement irréversible. Un ralentissement de la croissance et un retard de maturation osseuse sont les deux mécanismes impliqués. Il y a également retard de maturation sexuelle [33]._ Un retard de croissance peut apparaître avec des doses de 3-5 mg par jour de prednisolone. Un arrêt de la croissance peut être observé chez des enfants de 10-14 ans avec 10-15 mg par jour [33].
Cependant, les effets sur la croissance sont équivoques puisque la maladie elle-même peut entraîner un retard de croissance [12]. Les symptômes gastro-intestinaux modifient de façon linéaire la vitesse de croissance et le sort des patients colectomisés est le même que ceux recevant un traitement médical [33]. Certains patients retrouvent une vitesse de croissance normale seulement après le suppression de la phase active de la maladie par les corticoïdes. D'autres, en rémission, ne vont retrouver une vitesse de croissance normale qu'après l'arrêt des stéroïdes [12].
*
Parmi les autres effets secondaires importants de la corticothérapie prolongée figure l'ostéoporose (ou ostéopénie ). Elle n'est cliniquement rapportée que chez 2 à 5% de patients atteints de maladies inflammatoires de l'intestin, mais ce chiffre passe à 50% chez les patients qui reçoivent depuis longtemps plus de 5 à 7 mg de prednisone par jour [3 3].Parmi les enfants à risque figurent les enfants de moins de 15 ans. Il semble que la pe1ie osseuse soit plus souvent rapportée chez les patients atteints de maladie de Crohn que de RCH. Elle est liée à une inhibition directe de l'absorption intestinale de calcium et à une hypercalciurie.
Dans les MII, la perte osseuse est rattachée le plus souvent au traitement corticoïde. Une augmentation de la perte osseuse peut également survenir chez des patients ayant une maladie active, en l'absence de traitement corticoïde.
L'administration prophylactique de calcium par voie orale prévient la perte osseuse induite par la corticothérapie [3 3].
*
Les glucocorticoïdes augmentent le risque de maladies infectieuses, lorsque la dose de prednisolone est supérieure à 10 mg/j: les infections àgram (-) (fréquentes septicémies), la tuberculose, les infections mycosiques telle que l'aspergillose, les infections à virus herpétique et bien d'autres encore [33].
5.3.3 - Moyens disponibles pour minimiser les effets secondaires
Afin de minimiser le retard de croissance, la dose de corticoïdes doit être réduite au minimum efficace et il est préférable de prescrire une corticothérapie alternée un jour sur deux. Celle-ci permet le maintien en rémission et s'accompagne d'une croissance nmmale chez les patients atteints de RCH [15,33].
Bien que la corticothérapie à jours alternés engendre un freinage surrénalien et des effets secondaires moindres, les patients restent exposés à un risque plus élevé d'ostéoporose, d'hypertension et de diabète [12].
La dose de corticoïdes nécessaire pour contrôler la maladie peut être réduite par l'utilisation de corticoïdes locaux, sous fonne de lavements ou de mousses. Leur résorption colique est limitée, ils ont très peu d'effets systémiques. Les lavements sont utilisés dans les RCH distales et les mousses dans les formes recto-sigmoïdiennes [ 12].
La dose de corticoïdes peut également être diminuée grâce aux "nouveaux" corticoïdes, tels que la budésonide, qui possèdent une meilleure affinité pour le récepteur stéroïde et moins d'effets systémiques, ou grâce à l'adjonction d'un traitement immunosuppresseur tel que l'azathioprine dans les formes graves [12, 15].
Les nouveaux corticostéroïdes devraient réduire le risque de retard de croissance et la déminéralisation osseuse dans la population pédiatrique [ 16].
5.4 - Les agents immunosuppresseurs
L'utilisation des immunosuppresseurs est principalement envisagée dans trois situations [22]:
1- pour éviter une intervention chirurgicale, au cours d'une poussée sévère de la maladie, en cas d'échec des traitements habituels et notamment de la corticothérapie à forte dose. Cette situation est souvent rencontrée dans la RCH.
2- pour diminuer ou interrompre la corticothérapie chez les patients ayant une maladie chronique active, recevant des corticoïdes de façon fréquente ou continue, depuis plusieurs mois, ou présentant des effets secondaires de ce traitement.
3- pour maintenir la rémission, lorsqu'elle a été obtenue, chez les patients dont la maladie a été active pendant de longs mois ou années.
5.4.1 - Azathioprine et 6-mercaptopurine
Les thiopurines sont les immunosuppresseurs les plus utilisés dans les maladies inflammatoires chroniques de l'intestin [22].
Ils suppriment la maladie dans approximativement 70% des cas [41]. Les doses recommandées sont:
- 1à1,5 mg/kg/j pour la 6-mercaptopurine (PURINETHOL®) - 1,5 à 2 mg/kg/j pour l'azathioprine (!MUREL®) [16].
Des effets secondaires graves, imposant la diminution ou l'arrêt du traitement, sont retrouvés chez 10% des patients [31].
La durée du traitement reste un problème, puisque chez les patients en rémission sous azathioprine ou 6-mercaptopurine, l'arrêt du traitement est associé à un fort taux de rechute ( 41 à 81 % à un an) [22].
Beaucoup de cliniciens restent encore réticents à utiliser des immunosuppresseurs dans les formes chroniques de RCH, du fait du caractère curable de cette affection par la chirurgie [22].
L'IMUREL® étant un élément important du h·aitement dans le cas clinique étudié, nous le développerons ci-après (cf. 5.5).
5.4.2 - Ciclosporine
La ciclosporine (SANDIMMUN®) s'est révélée d'une efficacité remarquable au cours des premières études réalisées chez des enfants ayant une RCH sévère.
Mais avec un recul plus important, le taux de rechute est très élevé, et la plupart devront être colectomisés [15].
On observe également des effets secondaires à type de paresthésies, hypertrichose, tremblements, hypertension artérielle, nausées, vomissements ou toxicité rénale modérée [22].
5.4.3 - Methotrexate
Le methotrexate (METHOTREXATE®) est un puissant inhibiteur de l'acide folique. Une amélioration est observée chez près de 70% des malades,
à la dose de 25 mg par semaine par voie intramusculaire.
Environ 50% d'entre eux ont pu inten-ompre leur corticothérapie. Les effets secondaires observés sont peu sévères [22].
5 .4.4 - Autres traitements immunosuppresseurs ou immunomodulateurs [22] - Anticorps monoclonaux
- Immunoglobulines polyclonales. - Interféron a.
5.5 - IMUREL® [ 45,42] 5.5.1 - Dénomination
Dénomination commune internationale: azathioprine
L'azathioprine est un analogue soufré des bases puriques endogènes: adénine et guanine. 5.5.2 - Formule développée r===iN
'
N N 5.5.3 - Présentation!MUREL® : comprimés dosés à 50mg. 5.5.4 - Indications thérapeutiques
- Prévention du rejet des organes transplantés
transplantations rénales, greffes de moelle osseuse, greffes cardiaques. - Maladies autoimmunes
maladies inflammatoires de l'intestin, lupus érythémateux disséminé, polyarthrite rhumatoïde severe, hépatite chronique active, purpura thrombopénique idiopathique, anémie hémolytique acquise autoimmune, dermatomyosite, périartérite noueuse et pemphigus vulgaris.
L'IMUREL® est indiqué dans les fonnes sévères de ces affections, chez des malades intolérants aux corticoïdes ou qui ne peuvent être contrôlés que par des doses de corticoïdes entraînant des effets secondaires. Dans ce cas, l'IMUREL® permet une réduction importante des doses de corticoïdes.
5.5.5 - Propriétés pharmacologiques a - Pharmacocinétique
- Absorption
La biodisponibilité de l'azathioprine est inférieure à 50%. Le taux plasmatique maximal est atteint 2 heures après l'administration orale.
- Métabolisme
Le processus métabolique de l'azathioprine est important et rapide. La durée de l'action pharmacologique (plusieurs jours) due aux métabolites de la molécule mère est supérieure à ce que laisserait présager la cinétique d'élimination de l'azathioprine (demi-vie d'élimination de 12 minutes).
La voie métabolique principale consiste en une attaque nucléophile sur le cycle méthylnitroimidazole par le glutathion, en présence de glutathion-S-transférase. Le foie et les globules rouges sont les tissus principalement impliqués dans cette réaction.
Ceci aboutit à la formation de 6-mercaptopurine (6-MP) et de l-méthyl-4-nitro-5-(S-glutathionyl)imidazole.
La 6-mercaptopurine va subir à son tour une série de réactions métaboliques:
*
Une partie importante de son métabolisme, la voie anabolique, se déroule au niveau intracellulaire et suit les voies classiques de biotransformation des bases puriques avec formation de thiopurines ribonucléosides et ribonucléotides, dont les 6-thioguanine nucléotides ( 6-TGN). Parmi les métabolites intracellulaires, l'acide thio-inosinique est le principal responsable de l'activité immunosuppressive de l'azathioprine.*
Le catabolisme de la 6-MP comprend deux voies principales:- une voie extracellulaire: oxydation directe par la xanthine oxydase
- une voie intracellulaire: méthylation par la thiopurine méthyl-transférase (TPMT), suivie d'une oxydation des dérivés méthylés.
L'acide thiourique, métabolite inactif, est l'aboutissement des différentes voies métaboliques de l'azathioprine.
- Elimination
L'élimination se fait par voie rénale, essentiellement sous forme de métabolites inactifs.
b - Pharmacodynamie
L'azathioprine, comme la 6-MP, est un immunodépresseur. C'est un antimétabolite intervenant au niveau des enzymes du métabolisme des purines, en inhibant la biosynthèse des nucléotides normaux entrant dans la constitution des acides nucléiques [ 42].
(Le métabolisme et le mode d'action de l'azathioprine seront plus largement développés dans la troisième partie)
5.5.6 - Précautions d'emploi
- L'insuffisance hépatique perturbe le métabolisme de l'azathioprine, l'effet immunosuppresseur apparaît avec retard et son activité est plus faible.
- En cas d'insuffisance rénale, la demi-vie d'élimination de l'azathioprine et de la 6-MP n'est pas modifiée de façon significative. Seuls les métabolites éliminés par voie urinaire persistent plus longtemps chez les insuffisants rénaux.
- L'azathioprine a un effet mutagène et on a noté des modifications chromosomiques chez l'homme, réversibles à l'mTêt du traitement.
Grossesse: L'azathioprine pouvant exercer une action tératogène, son emploi est déconseillé chez la femme enceinte.
- Prendre les comprimés au milieu des repas afin d'éviter les manifestations gastro-intestinales indésirables.
- Manipuler avec précaution les comprimés et éviter au maximum le contact avec les mains.
5. 5. 7 - Interactions médicamenteuses
- Allopurinol
Il inhibe la xanthine oxydase, ce qm augmente l'activité pharmacologique du 6-MP pouvant provoquer une leucopénie ou une pancytopénie. Il faut réduire de 75 à 80% la posologie d'azathioprine.
-Myorelaxants
L'azathioprine est un antagoniste des myorelaxants non dépolarisants, d'où il faut augmenter leurs doses.
- Anticoagulants
Une augmentation des doses en warfarine est nécessaire en présence de 6-MP.
-Captopril
L'association captopril-azathioprine augmente le risque de leucopénie. -Cytostatiques
Ils potentialisent l'effet immunosuppresseur et notamment le risque de myélotoxicité.
-Vaccinations
On risque une réactivation du virus vaccinal pour les vaccins à virus vivants, et une inefficacité des vaccinsà virus tués par défaut de réaction immunitaire.
5.5.8 -Effets indésirables a -Effets à court terme [45]
-Pancréatites survenant dans le premier mois de traitementet nécessitant son interruptiondéfinitive.
-Réactions d'hypersensibilité: fièvre, malaise, hypotension, exanthème, leucocytose,pneumopathie.
-Hépatiques: hépatite cholestatique.
-Sensibilité accrue aux infectionspar suppression de laréponse immunitaire. -Gastro-intestinaux: nausées, vomissements (10à 15% des patients).
-Hématologiques: la cytotoxicité engendre des accidents hématologiques sévères tels que leucopénie, thrombopénie, anémie et parfois pancytopénie, la leucopénieétant laplus fréquente.
La toxicitéhématologique de l'azathioprine est un effet connu mais qui reste cependant rare puisqu'en 1990, 25 ans après sa mise sur le marché, 124 cas ont été répertoriés, dont 13 pancytopénies [45].
La myélosuppression est une complication sévère et parfois létale du traitementpar azathioprine [8].
Connell et al [8] ont étudié sur 27 années les effets de l'azathioprine sur la moelle osseuse, chez des sujets ayant une maladie inflammatoire de l'intestinet recevant 2 mg/kg/j d'azathioprine:
~ Une toxicité médullaire est apparue chez 5% des patients, et plus
spécifiquement chez 3,8% des patients ayant une colite ulcéreuse.
~ leucopénie est laplus fréquente et laplus sévère des complications: on
--->
Une thrombocytopénie est apparue chez 1 % des patients ayant une RCH [ 8].--->
Moins de 1 % des sujets présentent les deux à la fois [8].Jusqu'à aujourd'hui, un seul cas de pancytopénie chez un sujet traité pour une colite ulcéreuse a été décrit. La pancytopénie est apparue après un mois de traitement avec une dose de 2 mg/kg/j et tout est revenu dans l'ordre au cours des 3 mois suivant l'arrêt du traitement. Durant cette période, la colite est restée en rémission [ 6].
Dans la majorité des cas, la toxicité médullaire est apparue au cours du premier mois de traitement [31]. Elle est réversible à l'arrêt du traitement, tout redevient normal dans le mois qui suit [8].
b - Effets à long terme [ 45] - Risques néoplasiques
Une étude faite chez des transplantés rénaux sous azathioprine montre un risque 60 fois plus important de lymphome non-hodgkinien. La prévalence de tumeurs rares est augmentée. Cependant, le risque de tumeur maligne est le même pour des patients sous azathioprine ou sous d'autres immunosuppresseurs, ce qui signifie que ce risque n'est pas imputable au traitement immunodépresseur mais à l'immunodépression [ 45].
Il a été suggéré que le risque de cancer colo-rectal pouvait être accru par la prise d'azathioprine ou de 6-mercaptopurine. Cependant cette affirmation n'est fondée que sur quelques cas isolés [22].
Une étude de Connell et al [9], faite chez des patients ayant une RCH, montre qu'il n'y a pas plus de cancer colo-rectal chez les patients sous azathioprine que dans une population comparable n'ayant jamais reçu ce traitement.
5.5.9 - Surveillance biologique
Ces effets secondaires nécessitent un contrôle régulier des éléments cellulaires sanguins (numération et formule sanguine), de la fonction hépatique et pancréatique, chaque semaine pendant le premier mois puis tous les mois [22,41].
5.5.10 - Posologie Transplantés rénaux
la dose d'attaque peut aller jusqu'à 5 mg/kg puis la dose d'entretien varie de 1 à 4 mg/kg en fonction de la tolérance clinique et/ou hématologique du patient. Sauf contre-indication formelle, le traitement sera poursuivi indéfiniment même à faible dose, l'arrêt du traitement, même après plusieurs années, exposant à des risques de rejet en quelques semaines.
Autres pathologies
la posologie et la durée du traitement sont variables en fonction du cas clinique, de sa gravité et de l'effet recherché. La dose d'attaque n'excède pas 3 mg/kg et la dose d'entretien est comprise entre 1 et 3 mg/kg. Toute complication entraîne une réduction ou un arrêt de l'IMUREL®.
5.6 - La nutrition entérale
Les jeunes patients ayant une maladie inflammatoire de l'intestin ont souvent un retard de croissance. Il est essentiellement lié à des apports nutritionnels insuffisants, car les malades diminuent spontanément leurs apports caloriques, afin de diminuer les symptômes induits par l'alimentation [16].
Une alimentation entérale nocturne quotidienne à l'aide d'une fine sonde nasogastrique peut être nécessaire pour corriger le déficit nutritionnel. Il permet parfois d'aider à obtenir une rémission de la maladie [ 12].
5.7 - Le traitement chirurgical [12, 16]
La chirurgie est indiquée lorsque la thérapeutique médicale et nutritionnelle ont échoué dans le contrôle de la maladie.
Les indications d'une colectomie dans une rectocolite hémorragique sont: - une maladie réfractaire aux traitements habituels
- un retard de croissance et de maturation sexuelle malgré des suppléments nutritionnels
- un mégacolon toxique - une hémorragie incontrôlée - une perforation
- un carcinome de la muqueuse du colon.
On peut effectuer une colectomie partielle ou une proctocolectomie associée alors à une iléostomie.
B - La cholangite sclérosante
[2]
Il s'agit d'un désordre hépatobiliaire chronique, caractérisé par une inflammation des canaux intra ou extrahépatiques ou des deux à la fois. Ceci aboutit à leur dilatation, leur rétrécissement ou leur oblitération.
La cholangite sclérosante primaire est la maladie hépatique chronique la plus fréquente des personnes atteintes de MII: 2 à 5% des patients ayant une colite ulcéreuse développe une cholangite sclérosante.
A l'inverse, il a été estimé que plus de 70% des adultes atteints de cholangite sclérosante ont ou vont développer une RCH.
La cholangite sclérosante peut précéder ou apparaître plusieurs années après la MIL
Chez les enfants, on retrouve cette con-élation entre MII et cholangite sclérosante.
Le pourcentage de malades ayant une MII et développant une cholangite sclérosante est plus élevé chez les jeunes adultes (moins de 20 ans) que chez les plus de 20 ans. Autrement dit, l'incidence de complications hépatobiliaires chez les patients atteints de MII augmente d'autant plus que la MII est apparue tôt dans la vie. Chez les enfants, l'incidence est de 30%.
1 - Caractéristiques cliniques et biologiques
Les premiers signes cliniques de la cholangite sclérosante peuvent apparaître avant même que le diagnostic de MII soit fait. L'évolution est souvent insidieuse.
Les premiers symptômes consistent en une fatigue progressive, malaise, anorexie et perte de poids. Ils peuvent être suivis par un prurit allant jusqu'à l'ictère. D'autres manifestations cliniques telles qu'une douleur abdominale haute et de la fièvre sont souvent observées.
Chez les enfants, la croissance et la puberté sont retardées.
Les principales caractéristiques cliniques et biologiques sont regroupées ci-dessous. Principaux symptômes: - douleur abdominale - ictère - diarrhée chronique - fièvre
observée dans 40% des cas 32%
28% 18%
- perte de poids - cholestase prolongée - prurit Signes cliniques: - hépatomégalie - hépatosplénomégalie Biochimie: 19% 13% 10% 40% 21% - élévation des transaminases 94 % - élévation des phosphatases alcalines 88%
- élévation de la bilirubine 44%
On retrouve également:
- des anticorps anticytoplasmes des polynucléaires neutrophiles (ANCA) chez pratiquement tous les patients ayant une cholangite sclérosante, associée ou non à une RCH [30]
- des anticorps antinucléaires positifs - des anticorps antimuscles lisses - une hypoalbuminémie
- un taux de prothrombine anormal.
Une biopsie hépatique peut être nécessaire pour confirmer le diagnostic [2].
2 -
TraitementLe traitement peut être médical ou chirurgical:
médical - corticostéroïdes: prednisone (CORTANCYL®) prednisolone (SOLUPRED®) - colestyramine (QUESTRAN®)
- acide ursodésoxycholique (URSOLVAN®)* - méthotréxate
- colchicine - pénicillamine - ciclosporine
- association: prednisone et colchicine. chirurgical - lavage "intracanal" par des stéroïdes
- drainage
*L'URSOL V AN® ou acide ursodésoxycholique [ 42] est un constituant naturel de la bile de l'homme. Il agit en dissolvant les lithiases biliaires cholestéroliques.
Il améliore les symptômes cliniques, notamment le prurit, et réduit les valeurs biochimiques.
Il n'a pas d'action irritante sur la muqueuse colique et par conséquent les cas de diarrhée induite sont très rares.
La posologie efficace est de 5 à 10 mg/kg/j.
La prévalence des complications hépatobiliaires lors de maladies inflammatoires de l'intestin doit induire une surveillance et une reconnaissance précoce de la cholangite sclérosante [2].
DEUXIEME PARTIE
PRESENTATION DU CAS CLINIQUE
Antoine D. est un garçon de 13 ans au moment du diagnostic.
A - Diagnostic de la maladie
Première hospitalisation: du 23 novembre au 20 décembre 1994
Hospitalisation pour altération de l'état général, avec asthénie, amaigrissement (perte de 6 kg en 4 mois), anoréxie, hype1thermie fluctuante à 38°C et sueurs nocturnes fréquentes.
Depuis quelques mois, il présente des épisodes de diaffhée liquide d'apparitions brutales avec deux épisodes de rectoffagie, des vomissements, des douleurs abdominales diffuses et des arthralgies fugaces.
Pas d'antécédents familiaux ni personnels notables.
L'hypothèse d'une maladie inflammatoire chronique de l'intestin a amené aux examens suivants (Tableau 1):
Examens biologiques
Les coprocultures, au mveau bactériologique, parasitologique et mycologique, sont normales.
La numération formule sanguine (NFS) est nmmale. Bilan hépatique
Transaminases: transaminases glutamo-oxaloacétiques (TGO)
=
174 UI/l transaminases glutamo-pyruviques (TGP) = 324 UI/lPhosphatases alcalines (PAL)
=
23 20 UI/l y-glutamyl-transpeptidases (y-GT) = 754 UI/lTaux de prothrombine= 100% Facteur V= 100%
Vitesse de sédimentation (VS) = 45 mm à la première heure Tension artérielle (TA)= 115/70 mmHg
Echographie abdominale
Hépatomégalie hétérogène.
Epaississement modéré des parois du colon droit, du colon transverse et du caecum.
Adénopathies.
Endoscopie oeso-gastro-duodénale Résultats normaux.
Coloscopie
Pancolite ulcérée (ulcérations en coup d'ongle et aphtoïdes, fragilité de la muqueuse) évoquant en premier lieu une colite inflammatoire.
Histologie
non informative: remaniements inflammatoires de la muqueuse, avec rares microabcès cryptiques et hyperplasie lymphoïde.
Exulcérations nombreuses. Pas de granulome. Radiologie: transit du grêle
petites spicules sur les bords de l'anse iléale. Biopsie hépatique
Elargissement fibreux étoilé des espaces portes avec canalicules biliaires hyperplasiés et dystrophiques.
Dégénérescence granuleuse des hépatocytes sans cholestase, ni stéatose, nécrose ou granulome.
Immunologie
Cytomégalovirus négatif Epstein-Barr virus négatif Hépatites A, B et C négatives
o ~ anticytoplasmes des polynucléaires neutrophiles (ANCA) positifs
au 1/256eme.
Anticorps anti-protéinases (Anti PR3) positifs Anticorps anti-muscles lissesnégatifs
Anticorps anti-mitochondries négatifs
Complément C4
=
377 mg/l (N=
157-257 mg/l) Absence de pouvoir anti-complémentaire.Les ANCA et les Anti PR3 sont des autoanticorps, témoignant d'une maladie autoimmune. Les ANCA sont des marqueurs de l'activité de lamaladie.
Il ne s'agit pas d'une maladie autoimmune classique car les anticorps ant i-muscles lisses et anti-mitochondries sont négatifs. On retrouve également une activation du système du complément (Tableau1).
Ceci coïncide avec uneMil[30].
Au terme de ce bilan, le diagnostic est celui d'une maladie inflammatoire de l'intestin. Il pourrait s'agir soit d'une maladie de Crohn, soit d'une rectocolite hémorragique, sachant qu'il est souvent difficile de distinguer avec certitude l'une des deux maladies par rapport à l'autre.
Dans le cas présent, on s'oriente davantage vers une rectocolite hémorragique puisqu'on observe une pancolite ulcérée avec intestin grêle intact, ainsi qu'une cholangite sclérosante débutante qu'on ne retrouve en principe pas dans lamaladie de Crohn [16].
De plus, on rencontre beaucoup plus fréquemment des ANCA dans la RCH que dans lamaladie de Crohn [30].
~ 23 novembre le traitementinstauré est le suivant (Figure 1):
*
SOLUMEDROL® intraveineuse directe (IVD) 30 mg 2fois/j (méthylprednisolone)puis SOLUPRED® comprimés 60 mg/j(1,6 mg/kg/j) (prednisolone)
*
FLAGYL® comprimés (métronidazole)*
Nutrition entéraleàdébit continu (NEDC) Le traitementsera complété ensuite par:*
PENTASA® comprimés(acide 5-aminosalicylique)
*
URSOL V AN® gélules(acide ursodésoxycholique)
*
MOPRAL® (oméprazole) gélules500 mg 2 fois/j (27 mg/kg/j)
500 mg 3fois/j (40 mg/kg/j) 200 mg 2fois/j (10 mg/kg/j) 20 mg/j
*
MAALOX® suspension buvable 1cuillère à soupe 3 fois/j (hydroxydes d'aluminium et de magnésium)23/11 /94 25/11 SOLUMEDROL SOLUPRED FLAGYL NEDC 30 mg X 2/j 500 mg X 2/j 30/11 MO PRAL MAALOX PENTASA 05/12 10/12 15/12 60 mg /j 20 mg /j 1 cuillère à soupe x 3/j 500 mg X 3/j 200 mg X 2/j URSOLVAN 1 sachet x 3/j ULCAR STEROGYL CALCIUM SANDOZ GLUCONATE DE POTASSIUM
Figure 1 - Traitement au cours de la première hospitalisation
Légende
>---1 1 jour
>-7 traitement poursuivi
Le 8 décembre, après 15 jours de corticothérapie, l'évolution est globalement favorable (Tableau 1):
- le syndrome inflammatoire a franchement régressé (VS = 12 mm) - une à deux selles par jour, normales ou pâteuses
- stagnation pondérale à 3 8 kg
- persistance d'une douleur abdominale à la palpation, au niveau épigastrique -TA= 120/66 mmHg
L'enfant sort de l'hôpital le 20 décembre 1994, après 1 mois d'hospitalisation, avec le traitement suivant:
*
SOLUPRED® comprimés effervescents à 20 mg: l .5mg/kg/j - 60 mg en une prise le matin les jours pairs- 55 mg en une prise le matin les jours impairs pendant 10 jours, puis diminution de 5 mg tous les 10 jours
*
PENTASA® comprimés à 250 mg 2 cp matin, midi et soir ( 40 mg/kg/j)*
URSOL VAN® gélules à 200 mg 1 gél matin et soir (10 mg/kg/j)*
ULCAR® sachets à 1 g 1 sachet 3fois/j avant les repas*
STEROGYL® solution buvable 5 gouttes/j (vitamine D2 ou ergocalciférol)*
CALCIUM SANDOZ® sirop 1 cuillère à soupe/j (gluconate et lactobionate de calcium)Hospitalisation Transfusion
TGO (Ul/I) TGP (Ul/I) y-GT (Ul/I)
Bilirubine totale (µmol/I) Acides biliaires (µmol/Il
ANCA AntiPR3
Antimyélopéroxydase PCR (mg/I) Ca 1 9-9 (U/ml) Poids (kg) Taille (cm) GB (G/I) GR (T/ll Hb (g/I) Plaquettes (G/I) VS (mmà1h) TA (mmHg) CORTICOIDES
PENTASA®
URSOLVAN®
l
!MUREL®
.
Tableau 1 -Valeurs biologiques et traitements
23 Nov 05 Déc 12 Déc 20 Déc 27 Déc 23 Jan 06 Mar 03 Avr 10 Avr 14 Avr 15 Avr 22 Avr
1994 1995 ///////// //l//ll/I/Ill///// !///!/Ill 174 324 592 26 256 (+) 37 154 10.4 4.9 139 317 45 115/70 126 99 46 216 328 173 754 1191 713 25 2 14 256 25.4 38 37,7 37,6 18 9 4.8 4.7 146 139 342 197 17 12 131 /75 115/64 130/57
<;o
'd/j
SOLUPRED®
1 24 90 431 11 5.05 151 321 ...15od..~ V v ///////// Ill/li/li //////////////!/ CG CG . 28 22 15 17 13 10 6 75 46 34 33 30 25 21 278 52 48 46 46 34 9 40 4 • 17 19 256 128 64 64 64 (+) 80 (+) (+) 65 31 12 <5 37.7 23.8 14.4 40.5 43.5 .44 46. 7 46 46 44 154 154.5 154.5 154.5 11.9 5 153 213 20 40 40 106 132 120 124 130/90 118/67 112/60 120/80 113/65 11 5/62~
~ ~~~ ~~~ ~ ~~
Gorn<j/j
CORTANCYL®
/
1A<»"'j/i'
1
ULCAR®
STEROGYL®
CALC
IUM
SANDOZ®
1
Î
1 1
1 1
Hospitalisation Transfusion
TGO (Ul/ll TGP {Ul/ll lf-GT {Ul/ll
Bilirubine tot.(µmol/I} Ac biliaires (µmol/Il ANCA AntiPR3 Antimyélopéroxydase PCR {mg/Il Ca 19-9 {U/ml) Poids (kg) Taille (cm) GB (Gill GR (T/I} Hb (g/ll Plaquettes {Gill VS (mmà1h) TA (mmHg) CORTICOIDES URSOLVAN® STEROGYL® CALCIUM
Tableau 1 (suite) -Valeurs biologiques et traitements
28Avr 10Mai 13Mai 22Mai 05Jul 22Aoû 250ct 20Déc 05Fév 20Mar 15Mai 15Jul 140ct
1996 //////////////Ill/ //Ill//// 36 43 51 15 15 10 8 15 18 21 25 19 20 65 132 150 57 43 18 20 45 42 50 49 23 34 80 281 295 153 71 21 27 34 17 55 72 40 33 21 5 15 6.5 3 29 64 32 (+) 32 64 64 128 (+) 7 13 26 27 (-) (++) (++( (+) 5 <5 13.9 6.9 7.1 4.6 43 45 45.6 50 51 55 54,5 54 56.3 54.9 56.2 58.6 154 154 154 156,5 156.5 158 158.7 160 162 ~ 7.2 7.8 11.9 6.5 6.1 7 4.4 5.2 7.3 6.6 6.0 ~ 2.9 3.7 4.52 4.21 4.52 4.54 4.5 4.43 4.42 4.46 4.8 ~ 93 148 142 144 144 138 136 139 142 149 ::::::::::§!Mii 129 146 128 191 210 240 184 232 228 196 245 117 80 40 20 21 9 5 4 8 4 22 122/68 120/62 138/75 120/80 120170 125/55
~
60""J/j CORTANCYL® 6o/0Ao
/o
OS TRAM®Tableau 1 (suite) - Valeurs biologiques et traitements
Valeurs normales
TGO (Ul/ll 0-14
TGP (Ul/I) 3-25
y-GT (Ul/I) 5-25
Bilirubine totale (µmol/!) 0-17 Acides biliaires (µmol/!) 0-6
ANCA {-) AntiPR3 {-) Antimyélopéroxydase {-) PCR (mg/!) 1-1 2 Ca 1 9-9 (U/ml) < 25 Poids (kg) à 13,5 ans 45 Taille (cm) à 13,5 ans 157 GB (G/I) 4-10 GR (T/I) 4-5.5 Hb (g/I) 120-160 Plaquettes (Gfl) 150-400 VS (mm à 1 h) < 20 TA (mmHg) 120/70
B - Introduction de l'IMUREL®
1 -Janvier 1995
Le patient se sent toujours fatigué, il présente des douleurs abdominales mais des selles normales. L'examen est normal.
- TGO = 28 UI/l
- TGP = 75 UI/l - y-GT = 278 UI/l -VS =20mm
- TA= 130/90 mmHg La maladie est stabilisée.
Les marqueurs tumoraux des cancers digestifs, les antigènes Ca 19-9, sont à 37, 7 U/ml, alors qu'au moment de l'hospitalisation, ils étaient à 25,4 U/ml.
Cependant, cette valeur n'est pas inquiétante. Traitement:
*SOLUPRED® - 50 mg/j les jours pairs ( 1,2 mg/kg/j) - 50 mg/j les jours impairs, en diminuant de 5 mg tous les 10 jours
*
PENTASA® 250 mg 2 cp matin, midi et soir (37 mg/kg/j) * URSOL V AN® 200 mg 2 gél le matin et 1 gél le soir (15 mg/kg/j)* STEROGYL® 2 gouttes/j
2 - Mars 1995
Les corticoïdes sont alors à 50 mg 1 jour sur 2 et à 30 mg les autres jours (0,9 mg/kg/j).
L'enfant se plaint de douleurs articulaires notamment aux poignets, d'asthénie importante et de douleurs abdominales. Il a une température de 38°C.
Il présente les signes d'une imprégnation cortisolique importante: faciès cushingoïde, vergetures, pilosité très augmentée.
- TA= 118/67 mmHg -VS= 40 mm
-ANCA=256
- Ca 19-9 = 23,8 U/ml
Malgré la VS de nouveau augmentée, la baisse des corticoïdes devient nécessaire en raison des effets secondaires apparus. Cependant il est impératif de continuer à traiter la colite ulcéreuse.
Les marqueurs d'activité de la maladie (ANCA) sont toujours présents, leur valeur n'a pas diminuée depuis le mois de novembre 1994, ce qui signifie que la maladie ne régresse pas et que le patient est corticodépendant.
Les anticorps anti-protéinases et anti-myélopéroxydases, témoignant d'une maladie autoimmune, sont positifs.
On complète alors le traitement par un immunosuppresseur, l'azathioprine
(IMUREL®), à la dose de 2,3 mg/kg/j (100 mg/j). Traitement:
*SOLUPRED® - 50 mg/j les jours pairs
- 30 mg/j les jours impairs, en diminuant de 5 mg tous les 10 jours
* IMUREL® 50 mg 1 cp matin et soir au milieu du repas * PENTASA® 500 mg 1 cp matin, midi et soir (35 mg/kg/j) * URSOL V AN® 200 mg 2 gél le matin et 1 gél le soir (14 mg/kg/j)
*STEROGYL® 2 gouttes/j
C - Aplasie médullaire
Deuxième hospitalisation: du 10 avril au 13 mai 1995
-7 Le 3 avril, de nouveau altération de l'état général, avec une grande asthénie, des douleurs abdominales importantes sans trouble du transit.
On observe toujours une imprégnation cushingoïde. Les corticoïdes sont alors à 50 mg les jours pairs et 15 mg les jours impairs (0, 7 mg/kg/j).
Les différents examens donnent les résultats suivants (Tableau 1): NFS: -leucocytes= 2 G/l -érythrocytes = 3 T /1 -hémoglobine= 93 g/l -plaquettes = 80 G/l VS =40mm TA = 112/60 mmHg
Il y a donc une non-réponse biologique au traitement associant corticoïdes et azathioprine. On observe une aplasie médullaire débutante.
En ce qui concerne le traitement, le PENTASA® est arrêté.
Afin de réduire le processus inflammatoire, la dose de CORTICOIDES est augmentée à 60 mg les jours pairs et 15 mg les jours impairs (0,85 mg/kg/j), ainsi que la dose d'URSOLVAN® qui passe de 600 à 800 mg/j (18 mg/kg/j).
Le traitement par !MUREL® est poursuivi.
Les stigmates d'intolérance aux immunosuppresseurs amènent à multiplier la fréquence des contrôles biologiques, en demandant une NFS toutes les semaines. -7 Le 10 avril, alors qu'il présente depuis quelques jours des céphalées, une rhinorrhée et une candidose buccale, les valeurs sont les suivantes:
NFS: -leucocytes = 2, 84 G/l -érythrocytes= 2,3 T/l -hémoglobine = 71 g/l -plaquettes = 10 G/l VS= 106mm TA = 120/80 mmHg
L'enfant est hospitalisé pour agranulocytose fébrile avec anémie et thrombopénie. Il a une aplasie médullaire.
L'IMUREL® est immédiatement stoppé.
Plusieurs transfusions sanguines seront effectuées entre le 10 et le 24 avril: 3 concentrés de globules rouges et 5 concentrés unitaires de plaquettes. Un bilan infectieux complet est réalisé puis une antibiothérapie par voie IV est instaurée.
Tout le bilan, comprenant hémocultures, cytobactériologie des urines, coprocultures, prélèvement de gorge et les multiples sérologies, est négatif, hormis
la
présence de CANDIDA ALBICANS dans les selles.Le traitement instauré est le suivant:
*
CORTANCYL® comprimés 20 mg 60 mg/j (1,3 mg/kg/j) (prednisone)*
URSOL V AN® 200 mg (acide ursodésoxycholique)*
RANIPLEX® 50 mg (ranitidine)*
AMIKLIN® 500 mg ( amikacine)*
TIENAM® 500 mg (imipénème, cilastatine)*
FLAGYL® comprimés à 500 mg (métronidazole) 2 gél matin et soir ( 17 mg/kg/j) 2 fois/j en IVL1 fois/j en IVL sur 1 heure 3 fois/j en IVL sur 30 mn 1 cp 2 fois/j
*
FUNGIZONE® suspension buvable 1 cuillère à café 3 fois/j soit 1,5 g/j ( amphotéricine B)*
IMMUNOGLOBULINES 40 g en IV sur 6 heures, 2 jours SPECIFIQUES HUMAINES®* PRO-DAF ALGAN®
(pro-paracétamol) 700 mg 6 fois/j en IV en cas de température supérieure à 38,5°C ou de douleurs abdominales.
D'autres médicaments seront administrés au cours de l'hospitalisation (Figure 2):
* LEUCOMAX® IV à 300 µg * V ANCOMYCINE® IV à 500 mg * IMODIUM® gouttes buvables * SMECT A® sachets à 3 g
* PRIMPERAN® solution buvable à 1 mg/ml * MAALOX® suspension buvable
*ULTRA-LEVURE® gélules * CALCIUM SANDOZ FORTE®
comprimés effervescents à 5 OO mg * STEROGYL® solution buvable
* DOLIPRANE® 500 mg si besoin mo lgramostime vancomycme lopéramide diosmectite métoclopramide hydroxydes d'aluminium et de magnésium Saccharomyces boulardii gluconate et lactobionate de calcium ergocalciférol paracétamol
CORTANCYL URSOLVAN RANIPLEX AMIKLIN TIEN AM FLAGYL NEDC 10/04/95 FUNGIZONE IMMUNOGLOBULINES 15/04 20/04 25/04 60mg/j 800 mg /j ~ 50 mg x4/j IVL 500mg/j 500 mg X3/j ~ 500 mg X3/j 500mgX3/j 40g/j ...____. PRO-DAFALGAN ; ~ ~~~~~ i 500 mg x4/j
i
30/04 05/05 10/05 150 mg x 2/j Peros 13105 60mg/j BOO mg /j 300 mg /j 500 mg x3/j ~ ~~~~~ ~ DOLIPRANE MAALOX TRANSFUSION IMODIUM SMECTA PRIM PERAN LEUCOMAX VANCOMYCINE CL..__.... IP+CG CL,____. IP+CG 10 gouttesx4/j 1 sachet x 3/j 5mgx3/j 300 µg/jIVL-
500 mg X 4/j IV ! ! 1 ; l l i UL TRALEVURE !CALCIUM SANobz
~ STEROGYL 1 gélule x 2/j 5o'o mg/j 2gouttes/j CLIP CG CLIP ,____. ,____.
Sortie d'Aplasie
Figure 2 -Traitement au cours de ladeuxième hospitalisation
Légende
1 jour
--7 Le 26 avril, après 16 jours d'hospitalisation, l'enfant sort d'aplasie médullaire. Progressivement les valeurs hématologiques se nmmalisent (Tableau 1).
Sur le plan digestif, cet épisode d'aplasie fébrile a correspondu
à
une recrudescence de la colite ulcéreuse avec une augmentation de la VS jusqu'à 132 mm. On a ensuite constaté une amélioration progressive avec une VS à 40 mm à la sortie de l'hôpital. Les marqueurs d'activité de la maladie sont toujours positifs mais leur valeur est stable: positifs au 1/64ème (Tableau 1).L'échographie abdominale montre une hépatomégalie discrète. On ne note pas de dilatation des voies biliaires intra ou extrahépatiques.
--7 L'enfant sort de l'hôpital le 13 mai avec le traitement suivant:
*
CORTANCYL®*
URSOLVAN®*
RANIPLEX® comprimés à 300 mg*
STEROGYL®*
CALCIUM SANDOZ FORTE®comprimés effervescents à 500 mg
*
FUNGIZONE®--7 Une semaine plus tard, le 22 mai: L'enfant va bien.
Il présente une à deux selles moulées par jour. La NFS s'est normalisée et la VS est à 20 mm. TA= 122/68 mmHg. 60 mg/j (1,3 mg/kg/j) 2 gél 2 fois/j ( 17 mg/kg/j) 1 cp le soir 2 gouttes/j 1 cp/j
Le traitement est identique hormis les corticoïdes qm sont diminués progressivement (Tableau 1):
*
CORTANCYL® -60 mg/j les jours pairs ( 1,3 mg/kg/j)-60 mg/j les jours impairs, en diminuant de 10 mg tous les 10 jours.
D - Suivi régulier du patient (Tableau 1)
1 - Juillet 1995
La dose de corticoïdes est alors de 60 mg un jour sur deux (0,6 mg/kg/j). Le patient s'est fracturé la main gauche.
La TA est de 120/62 mmHg.
Parallèlement, après une hausse des enzymes hépatiques au mois de mai, celles-ci sont revenues à la normale.
On note toujours la présence de marqueurs d'activité de la maladie, à savoir la présence d'anticorps anticytoplasmes des polynucléaires neutrophiles.
Le traitement est le suivant:
*
CORTANCYL® 60 mg 1 jour sur 2 (0,6 mg/kg/j)*
URSOL V AN® 1 g/j au lieu de 800 mg/j soit 5 gél/j (20 mg/kg/j)*
OSTRAM® remplace CALCIUM SANDOZ FORTE®: 1sachetà0,6 g/j*
RANIPLEX® 300 mg 1 cp/j2 - Août 1995 - Février 1996
L'imprégnation cortisolique est modérée. Il n'y a aucune particularité au niveau clinique.
En août, la corticothérapie à jours alternés est diminuée de 5 mg tous les 15 jours. En février, la dose est alors de 15 mg 1 jour sur 2(0,14 mg/kg/j).
Les ANCA sont toujours positifs au 1/64ème. Le Ca 19-9 ne dépasse pas 7, 1 U/ml.
La VS reste inférieure à 10 mm à la première heure.
La TA est de 138/75 mmHg en août et de 120/70 mmHg en février. En février, le traitement est le suivant: