Caractérisation des effets de la metformine sur le
recrutement du neutrophile dans l’inflammation
Mémoire
Geneviève Bertheau Mailhot
Maitrise en Médecine expérimentale
Maître ès sciences (M. Sc.)
Québec, Canada
Caractérisation des effets de la metformine sur le
recrutement du neutrophile dans l’inflammation
Mémoire
Geneviève Bertheau Mailhot
Sous la direction de :
Dr Marc Pouliot
iii
Résumé
La metformine est actuellement le composé le plus utilisé pour le traitement du diabète de type 2. En plus de son implication dans la régulation du glucose sanguin, la metformine diminue la prédisposition aux maladies cardiovasculaires des diabétiques. Notre étude évalue donc l’impact de la metformine sur certains aspects de l'inflammation. L’utilisation de deux modèles murins d’inflammation aiguë a démontré une diminution significative de la migration des granulocytes au site lésé. Cette diminution semble être causée, du moins en partie, par une altération de l’adhésion des granulocytes aux cellules endothéliales. Bien que l’expression des protéines d'adhésion ne semble pas être affectée par la metformine, cette dernière prévient la libération par les cellules endothéliales de certaines chimiokines pouvant être impliquées dans l'adhésion des leucocytes. Les résultats de nos travaux aideront à mieux cerner le potentiel anti-inflammatoire de la metformine dans d'éventuelles applications cliniques.
iv
Summary
Metformin is currently the most prescribed anti-diabetic drug for treatment of type 2 diabetes. In addition to its importance in regulating blood sugar levels, metformin also reduces the susceptibility to secondary complications, such as cardiovascular diseases. Thus, we set up to characterize the impact of metformin on certain aspects of the inflammatory response. Two murine models of acute inflammation revealed a significant decrease in granulocyte migration to the site of injury by metformin. This decrease appeared to be, at least in part, by altered adhesion between granulocytes and endothelial cells. While adhesion protein expression was not affected, the release of chemokines potentially involved in the adhesion and migration of leukocytes was significantly diminished by metformin. Results from our studies should help in deciphering the anti-inflammatory potential of metformin, in view of potential clinical applications.
v
Table des matières
Résumé ... iii
Summary ... iv
Listes des figures et des tableaux ... vii
Listes des abréviations ... viii
Remerciements ... x Avant-propos ... xi CHAPITRE 1 ... 1 Introduction ... 1 1.1 L’Inflammation ... 1 1.1.1 La réaction inflammatoire ... 1
1.1.2 Les polymorphonucléaires neutrophiles ... 3
1.1.3 Les monocytes/macrophages ... 5 1.1.4. Les chimiokines ... 6 1.2 La barrière endothéliale ... 10 1.2.1 Le glycocalyx ... 10 1.2.2 Le glycocalyx et l’inflammation ... 15 1.2.3 Le glycocalyx et le diabète ... 15 1.3 La migration cellulaire ... 16 1.3.1 Roulement et activation ... 17 1.3.2 L’adhésion ferme ... 17
1.4 Modèles in vivo inflammatoires ... 20
1.4.1 Modèle de la poche d’air dorsale ... 20
1.4.2 Modèle au dextran sulfate sodium ... 21
1.4.3 Microscopie intravitale avec blessure au laser. ... 22
1.5 La metformine ... 23
1.5.1 Généralités ... 23
1.5.2 Mécanisme d’action ... 24
1.5.3 Bénéfices associés à la metformine chez les diabétiques ... 25
But de l’étude ... 28
CHAPITRE 2 ... 29
METFORMIN DIMINISHES THE MIGRATION OF CIRCULATING NEUTROPHILS TO TISSUES: IMPAIRED INTERACTION WITH ENDOTHELIAL CELLS ... 29
vi
Résumé ... 30
Abstract ... 31
Introduction ... 32
Materials & Methods ... 34
Mice ... 34
Dorsal air pouches ... 34
Cell viability ... 34
Dextran sulfate sodium experiment ... 35
Histological analysis ... 35
Microscopy ... 36
Myeloperoxidase activity in the colon ... 36
Intravital multi-photon microscopy ... 36
HMECs culture, stimulation, and adhesion assays ... 37
Adhesion protein surface expression assays ... 38
Metabolite measurement in HMECs supernatants ... 38
Statistical analysis ... 38 Results ... 39 Discussion ... 41 Acknowledgements ... 43 Figure legends ... 44 References ... 54 CHAPITRE 3 ... 57 Discussion ... 57
3.1 Comparaison avec les études disponibles ... 57
3.2 Impact direct de la metformine sur le neutrophile ... 59
3.3 Perspectives ... 59
Conclusion ... 61
Bibliographie ... 62
vii
Listes des figures et des tableaux
CHAPITRE1Figure 1 : Mécanismes d’élimination des pathogènes par le neutrophile. ... 4 Figure 2 : Le glycocalyx ... 10 Figure 3 : Représentation schématique des différents protéoglycanes (syndécan, glypican),
glycosaminoglycanes (héparan sulfate, chondroïtine sulfate, acide hyaluronique) et
composantes solubles (perlécan) du glycocalyx situées sur l'endothélium vasculaire.. ... 13 Figure 4 : Migration cellulaire du neutrophile.. ... 16 Figure 5 : Cinétique de l’expression des principales protéines d'adhésion situées sur l’endothélium
vasculaire suivant un stimulus inflammatoire. ... 18 Figure 6 : Structure chimique de la metformine ... 23 Figure 7 : Mécanisme d'action de la metformine.. ... 25 Figure 8 : Impact de la metformine sur la translocation au noyau du facteur de transcription NF- 27 Table 1 : Principaux médiateurs impliqués dans les étapes de la réaction inflammatoire, leurs
origines et leurs fonctions ... 2 Table 2 : Rôles des récepteurs de chimiokines et leurs ligands ... 9 Table 3 : Liste des principales protéines d’adhésion, de leurs ligands et de leur distribution,
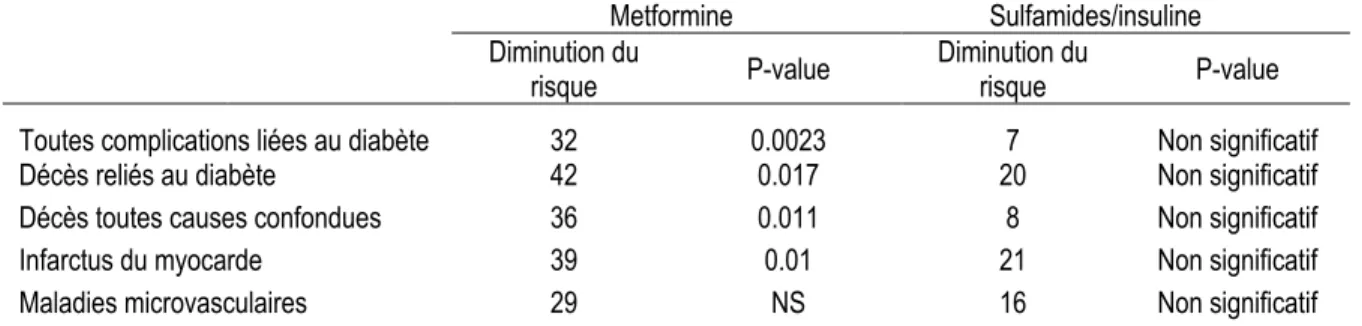
impliquées dans les différentes étapes de migration cellulaire. ... 19 Table 4 : Bénéfices de la metformine, sulfamides/insuline sur différentes complications associées au
diabète.. ... 26 CHAPITRE 2
Figure 1: Impact of metformin on the migration and viability of leukocytes in the murine air pouch model………...47 Figure 2: Colon histology, quantification of myeloperoxydase activity and clinical scores of
DSS-treated CD1 mice and impact of metformin or anti-Ly-6G.……….48 Figure 3: Metformin impact on the in vivo response of neutrophils to a sterile injury……….49 Figure 4: Effect of stimulation of human microvascular endothelials cells (HMECs) by inflammatory
agonists on human neutrophils adhesion, and impact of metformin.………50 Figure 5: Expression of adhesion proteins at the surface of human microvascular endothelials cells
(HMECs), and absence of impact of metformin.………..51 Figure 6: Cytokine/chemokine release from stimulated human microvascular endothelials cells
(HMECs)..………...52 Figure 7: Impact of AICAR incubation on human neutrophils adhesion to HMECs and
viii
Listes des abréviations
AICAR: 5-Aminoimidazole-4-carboxamide ribonucléotide AMP: Adénosine monophosphate
AMPK: 5' AMP-activated protein kinase/protéine kinase activée par l’AMP ATP: Adénosine triphosphate
CCR/CXCR: récepteur de la famille des chimiokines CC/CXC CD62E : E-sélectine
CD62L: L-sélectine CD62P: P-sélectine
CRP: C-reactive protein/Protéine C-réactive CS: Chondroitin sulfate/Sulfate de chondroïtine
DAMP: Damage-associated molecular pattern molecules/ Motifs moléculaires associés aux dégâts cellulaires
DS: Dermatan sulfate
DSS: Dextran sulfate sodium/Dextran sulfate de sodium GAG: Glycosaminoglycanes
GFP: Green fluorescente protein
GLUT: Glucose transporter/Transporteur de glucose GPI: Glycosylphosphatidylinositol
HA: Hyaluronane/Acide hyaluronique HAS: Hyaluronane synthase
HDL: High density lipoprotein/Lipoprotéines de haute densité
HMEC: Human microvascular endothelial cell/Cellule endothéliale microvasculaire humaine HS: Héparane sulfate
HUVEC: Human umbilical vein endothelial cell /Cellules endothéliales vasculaires ombilicales humaines
ICAM: Intercellular adhesion molecule/molécule d’adhésion intercellulaire IL: Interleukine
JAM: Junction adhesion molecule/molécule d’adhésion des jonctions cellulaires KS: Kératane sulfate
LDL: Low density lipoprotein/Lipoprotéines de basse densité LFA-1: Lymphocyte function-associated antigen-1
ix
LPS: Lipopolysaccharide LTB4: Leucotriène B4
MAC-1: Macrophage-1 antigen
MadCAM: Mucosal addressin cell adhesion molecule/Molécule d'adhésion cellulaire de la muqueuse MAPK: Mitogen-activated protein kinase/protéine kinase activée par les mitogènes
MATE: Multidrug and toxin extrusion
MICI: Maladies inflammatoires chroniques de l’intestin MIP: Macrophage inflammatory protein
MPO: Myeloperoxidase/Myéloperoxydase
mTOR: Mammalian target of rapamycin/Cible de la rapamycine chez les mammifères NET: Neutrophils excellular traps/Filet extracellulaire du neutrophile
NK : Cellule Natural Killer NF-: Nuclear factor kappa
OCT: Organic cation transporter/Transporteur de cation organique
PAMP: Pathogen-associated molecular patterns/Motifs moléculaires associés aux pathogènes PECAM: Platelet endothelial cell adhesion molecule/Molécule d'adhésion cellulaire relative à l'endothélium et aux plaquettes
PGE2: Prostaglandine E2 PGI2: Prostaglandine I2
PIA-1: Plasminogen activator inhibitor-1/Inhibiteur de l’activateur du plasminogène 1 PMAT: Plasma membrane monoamine transporter
PMN: Polymorphonucléaire neutrophile PSGL-1: P-selectin glycoprotein ligand-1
ROS: Reactive oxygen species/Espèces réactives oxygénées SDC: Syndécan
TGF-Transforming growth factor/Facteur de croissance transformant TLR: Toll-like receptor/Récepteur de type Toll
TNF: Tumor necrosis factor/Facteur de nécrose tumorale UKPDS: United Kingdom Prospective Diabetes Study
VCAM: Vascular cell adhesion molecule/Molécule d’adhésion cellulaire vasculaire VLA-4: Very Late Antigen-4
x
Remerciements
J’ai eu la chance de travailler au sein d’une équipe formidable, qui a su faire de ces deux dernières années, un séjour mémorable.
J’aimerais remercier tout spécialement le Docteur Marc Pouliot de m’avoir soutenu tout au long de mon parcours et de m’avoir permis de compléter ce projet, dont je suis extrêmement fière. Merci pour les nouveaux défis, les discussions, les remises en questions et les speech d’ascenseur qui m’ont permis de renforcer mon autonomie et mon sens critique. Merci pour la confiance que vous avez eue envers moi et envers le Canadien de Montréal. Ça sent la coupe comme on dit.
Merci Cynthia d’avoir partagé des milliers de café, thé, soirée au cinéma et fous rires. Merci d’avoir été plus qu’une partenaire de laboratoire et de m’avoir démontré que dans une Matrix on peut en rentrer des produits IKEA.
Merci Miriam d’avoir été une deuxième maman pour moi et de m’avoir fait comprendre qu’on a qu’une seule vie à vivre, alors aussi bien vivre la sienne. On se revoit en Norvège!
Merci aux équipes de Dr Vallières et Dr Lacroix d’avoir participé à l’avancement de ce projet.
Finalement merci à Audrey ma « partner in crime » pour m’avoir soutenue encouragé et écouté durant ces deux dernières années.
xi
Avant-propos
Ce mémoire est composé de l’article intitulé METFORMIN DIMINISHES THE MIGRATION OF CIRCULATING NEUTROPHILS TO TISSUES: IMPAIRED INTERACTION WITH ENDOTHELIAL CELLS en voie de soumission pour publication. L’intégralité des méthodes et des résultats y est discutée.
Geneviève Bertheau Mailhot, étudiante à la maitrise dans l’équipe de Dr Pouliot au centre de recherche du CHU de Québec-Université Laval, a effectué la majorité des manipulations in vivo et in
vitro, effectué l’analyse des données, produit les différentes figures citées dans l’article suivant en
plus de participer à la rédaction du manuscrit.
Cynthia Laflamme, professionnelle de recherche dans l’équipe du Dr Pouliot, a participé aux protocoles in vivo de la poche d’air et du Dextran sulfate de sodium. Elle a de plus effectué l’analyse de certaines expérimentations par cytométrie et a participé à l’analyse des données pour ces dernières. Elle a de plus contribué à la révision du manuscrit.
Miriam Giambelluca, stagiaire postdoctorale de l’équipe de Dr Pouliot, a participé à l’élaboration du projet et aidé aux manipulations in vitro et la compréhension des mécanismes moléculaires. Elle a de plus participé à la révision du manuscrit.
Nathalie Bourcier, professionnelle de recherche du Dr Pouliot au centre de recherche du CHU de Québec-Université Laval fut responsable de la culture cellulaire pour les manipulations in vitro. Aline Dumas, professionnelle de recherche du Dr Luc Vallières de l’axe de Neurosciences au centre de recherche du CHU de Québec-Université Laval, a produit les différentes coupes histologiques pour le modèle du Dextran sulfate sodium en plus d’effectuer l’analyse des scores cliniques par microscopie.
Benoit Mailhot, étudiant au doctorat du Dr Steve Lacroix de l’axe Neurosciences au centre de recherche du CHU de Québec-Université Laval, a effectué les expérimentations et analyses des
xii
résultats de la microscopie intravitale. Ces expérimentations ont été effectuées sur des souris ayant un profil spécifique appartenant au Dr Lacroix.
1
CHAPITRE 1
Introduction
1.1 L’Inflammation
1.1.1 La réaction inflammatoire
La réaction inflammatoire est une réponse réversible participant à la défense naturelle de l’organisme. Il s’agit d’un phénomène inné faisant appel à différents types cellulaires, protéines de coagulation, du complément et à des molécules de signalisation possédant des rôles précis dans l’orchestration de cette réponse; [1] elle a comme but l’élimination des pathogènes ainsi que la réparation des tissus lésés. Deux types d’inflammation sont à ce jour décrits. L’inflammation aiguë est de courte durée (quelques heures, quelques jours) et est associée à une guérison spontanée. L’inflammation chronique résulte pour sa part d'une non-résolution du processus et est associée au développement de maladies telles que la polyarthrite rhumatoïde, la maladie de Crohn et la sclérose en plaques. Il est donc essentiel que le processus inflammatoire soit fermement régulé afin de limiter les dégâts qu’il pourrait causer à long terme [2, 3].
Les événements provoquant la réaction inflammatoire peuvent être divers : lésion tissulaire, irritation cutanée, infection bactérienne, etc. Dans plusieurs cas, l’initiation résulte de la reconnaissance de signaux de danger, dont les motifs moléculaires associés aux pathogènes (PAMP) ou les motifs moléculaires associés aux dégâts cellulaires (DAMP), par les cellules résidentes des tissus, comme les macrophages, mastocytes et cellules dendritiques [4]. L’activation de ces cellules conduit en premier lieu à une défense immédiate et locale par l’initiation de la phagocytose des micro-organismes présents. La phase vasculaire est ensuite amorcée par la libération de médiateurs chimiques et/ou lipidiques (présentés dans le tableau 1) par les tissus environnants. Ces facteurs entrainent différents changements dont la vasodilatation des vaisseaux, l’augmentation de la perméabilité vasculaire et l’activation/recrutement des cellules immunitaires [5, 6]. Ces changements vasculaires sont en lien direct avec les quatre signes cardinaux de l’inflammation décrit par Aulus Cornelius Celsus au premier siècle. Effectivement, l’augmentation du diamètre vasculaire conduit à
2
une augmentation de l’afflux sanguin qui est responsable de la sensation de chaleur (calor) et de la rougeur (rubor) que l’on peut observer. L’augmentation de la perméabilité vasculaire permet de plus l’entrée de protéines plasmatiques et de cellules immunitaires de plus forte taille au site lésé, causant le gonflement du tissu (tumor). L'abondance cellulaire entraine l'étirement des membranes en plus d’une pression mécanique sur les récepteurs nerveux occasionnant finalement la sensation de douleur (dolor) [7]. Cette fuite plasmatique, connue sous le nom d’exsudat, est principalement composée de sels, d’immunoglobulines, de fibrine, de polymorphonucléaires neutrophiles (PMN) et d’une faible concentration de macrophages et lymphocytes. L’exsudat permet, dans un premier temps, la dilution des toxines bactériennes présentes au site lésé en plus de favoriser la motilité des leucocytes vers le pathogène cible [7, 8]. Comme il fût mentionné, la réponse inflammatoire se doit d’être transitoire afin de restreindre les dommages tissulaires qu’elle occasionne. La résolution débute par l’élimination du stimulus inflammatoire initial. Les médiateurs pro-inflammatoires laissent alors place aux facteurs de croissance et médiateurs de la résolution jouant un rôle important dans la réparation tissulaire. Un grand ménage est finalement entrepris par des phagocytes professionnels (macrophages, cellules dendritiques) afin d’éliminer les débris et cellules apoptotiques présents au site enflammé et ainsi rétablir l’homéostasie tissulaire [2].
Table 1 : Principaux médiateurs impliqués dans les étapes de la réaction inflammatoire, leurs origines et leurs fonctions
Médiateurs Origine Fonctions Exemples
Amines vasoactives Plasma Mastocytes Plaquettes Douleur Vasodilatation Aug. de la perméabilité Bradykinine Histamine Prostaglandines Leucocytes Cellules endothéliales Plaquettes Vasodilatation Douleur Fièvre PGE2 PGI2 Leucotriènes PMN Chimiotaxie Adhésion cellulaire Aug. de la perméabilité LTB4
Protéines du complément Plasma
Foie Chimiotaxie Activation cellulaire C3a C5a Cytokines/Chimiokines Macrophages Cellules endothéliales PMN Chimiotaxie Dommage tissulaire Activation cellulaire Douleur Fièvre IL-1 TNF CCL2 (MCP-1) CXCL8 (IL-8)
3
1.1.2 Les polymorphonucléaires neutrophiles
C'est dans les années 1880 que le biologiste Elie Metchnikoff réussit à démontrer que la migration des PMN au site enflammé participe à la reconnaissance et la destruction des agents pathogènes [9]. Les PMN sont caractérisés comme étant des cellules destructrices formant la première ligne de défense de l’immunité innée, avec une courte durée de vie [10]. Environ 100 milliards de nouveaux PMN sont dérivés de la moelle osseuse chaque jour, un nombre comparable à celui des neurones d'un cerveau humain [11]. Durant leur maturation, les neutrophiles accumulent de fortes concentrations d’enzymes cytotoxiques nécessaires à la défense de l’organisme, bien conservées dans leurs granules et libérées lors de leur activation. Leur contenu, bien que bénéfique en condition inflammatoire, peut aussi causer beaucoup de dégâts s'il y a libération inadéquate de leurs enzymes cytolytiques. De fait, une suractivation des PMN est impliquée dans certaines maladies, dont la polyarthrite rhumatoïde. C’est pourquoi l’élimination des PMN au site enflammé et en circulation se doit d’être finement régulée. Les neutrophiles sont normalement détruits au niveau du foie, de la rate et de la moelle par les macrophages résidents. Les macrophages présents dans les sites inflammatoires sont aussi responsables de l’élimination des neutrophiles apoptotiques au cours de la résolution de la réponse inflammatoire par efferocytose [11, 12].
Les PMN contribuent à la mise en place des différents éléments clés nécessaires à l’obtention d’une réponse inflammatoire adéquate, étant les premières cellules à migrer au site de combat. Les cytokines (TNF, IL-1), chimiokines (CXCL1/KC/Gro, CXCL2/MIP-2Gro, CXCL8/IL-8) et médiateurs lipidiques (leucotriènes, prostaglandines) produits par les cellules résidentes et/ou les PMN eux-mêmes entrainent leur migration vers le site lésé. Une fois rendu à sa destination, le PMN accomplit sa fonction principale, soit l’élimination des agents pathogènes. La reconnaissance de l’agent infectieux se fait selon deux mécanismes. Le premier nécessite l’opsonisation des agents pathogènes par des anticorps ou molécules du complément qui sont reconnus par les récepteurs Fc des cellules phagocytaires. Le deuxième passe par l’activation des récepteurs toll-like (TLR) par la reconnaissance de PAMP et de DAMP [13]. Suite à l’activation du neutrophile, le micro-organisme est éliminé selon trois mécanismes généraux démontrés dans la figure suivante : la phagocytose, la dégranulation et la production de filets extracellulaires (NET/Neutrophils extracellular traps).
4
La synthèse et la libération de médiateurs inflammatoires par le neutrophile sont aussi fort utiles dans l’élaboration de la réponse inflammatoire. Ces derniers agissent comme messager direct ou indirect permettant la communication entre les différentes cellules impliquées dans la défense immunitaire [10]. L’élimination des neutrophiles est primordiale pour la résolution de la réaction inflammatoire. Suivant la suppression du pathogène, les neutrophiles développent certains signaux apoptotiques, mort cellulaire programmée, dont le signal de reconnaissance Find me et le signal de phagocytose
Eat me qui leur permet d’être reconnus par les macrophages. La mort cellulaire du neutrophile inhibe
de plus le recrutement de nouveaux neutrophiles au site inflammatoire par la sécrétion de médiateurs, dont l’annexine A1 et la lactoferrine [12].
1.1.2.1 La myéloperoxydase
Au cours de leur maturation dans la moelle osseuse, les neutrophiles acquièrent quatre types de granules classés selon leurs principales composantes; granules azurophiles, spécifiques, tertiaires et vésicules sécrétrices. Les granules azurophiles ou granules primaires ne déversent que rarement leurs contenus dans l’espace extracellulaire. Elles possèdent une forte concentration de myéloproxydase (MPO), enzyme importante dans la destruction des micro-organismes. Lors de sa libération dans le phagosome, la peroxydase catalyse la formation de l’acide hypochloreux qui entraine l’altération de nombreuses fonctions cellulaires résultant à une mort imminente du
Figure 1 : Mécanismes d’élimination des pathogènes par le neutrophile. Les neutrophiles peuvent détruire le pathogène cible par
phagocytose, par dégranulation ou encore par la production de NET. Adapté à partir de : laczkowska, E., and Kubes, P Nature Reviews
5
pathogène. Selon plusieurs études, la présence de la MPO chez l’humain serait proportionnelle à l’activation du neutrophile. Les niveaux plasmatiques ou tissulaires sont donc souvent utilisés dans les études portant sur l’activation et l’infiltration du neutrophile. Les concentrations anormales retrouvées dans les exsudats peuvent suggérer une activation excessive ou encore une mort cellulaire accrue des neutrophiles [14, 15].
1.1.3 Les monocytes/macrophages
Présents sous différentes formes dans tous les tissus du corps, les macrophages représentent les sentinelles, et les vidangeurs du système immunitaire de par leur fort pouvoir phagocytaire. Lors de leur sortie de la moelle osseuse, les monocytes sont portés par le flux sanguin, puis migrent vers un tissu spécifique. C’est à partir de ce moment que leur différenciation s'effectue et que le monocyte devient macrophage. Cette différenciation amène une pluralité de macrophages différents dont les fonctions primaires sont caractérisées par le tissu de résidence [16]. Comme il fut mentionné précédemment, les macrophages résidents jouent un rôle important dans l’initiation de la réponse inflammatoire. Ces cellules sont caractérisées comme étant hautement sécrétrices, libérant divers médiateurs important dans le contrôle de la réponse immunitaire [17]. Les cytokines principalement sécrétées par les macrophages sont l’IL-1/, le TNF et l’IL-6. Ces dernières ont pour rôle d’induire la production de protéines importantes dans le processus inflammatoire dont la protéine C-réactive (CRP), protéine souvent quantifiée et utilisée pour le diagnostic d'une inflammation. L’IL-1 et le TNF ont aussi pour effet d’augmenter la perméabilité de l’endothélium vasculaire et l’expression de protéines d’adhésion importantes dans le recrutement des cellules immunitaires en circulation [18]. Les macrophages activés sécrètent de plus des facteurs de croissance qui ont pour cible les cellules hématopoïétiques de la moelle osseuse, précurseurs des monocytes et granulocytes. Cette activation a pour effet d’augmenter la population des cellules en circulation qui viendront supporter les macrophages déjà présents au site de combat [19]. Participants à l’initiation de la réponse inflammatoire, les macrophages sont de plus responsables de sa résolution. Effectivement, ceux-ci effectuent un grand ménage du site lésé en éliminant des débris cellulaires et cellules apoptotiques [20]. Les macrophages reconnaissent aussi des signaux de mort cellulaire exprimés à la surface des neutrophiles, qui favorisent l'élimination de ces derniers et qui induisent une reprogrammation des macrophages, passant d’un phénotype pro-inflammatoire (M1) à un phénotype anti-inflammatoire
6
(M2). La production de cytokines anti-inflammatoires (IL-10, IL-4, TGF-) est alors augmentée, favorisant la réparation tissulaire [21]. En plus de son important rôle dans la réponse immunitaire innée, les macrophages participent à l’orchestration de la réponse adaptative via la présentation d’antigènes aux lymphocytes [22].
1.1.4. Les chimiokines
En conditions physiologiques, les polymorphonucléaires neutrophiles circulent suivant le flux sanguin, les monocytes migrent éventuellement vers les tissus périphériques alors que les lymphocytes se dirigent vers les organes lymphoïdes [18]. Cependant, en situation de stress, les leucocytes sont redirigés par différents stimuli qui leur dictent leur destination finale. Les principaux messagers sont les chimiokines. Cette famille protéique comporte 4 sous types (CC, CXC, CX et CX3C) divisés selon la position de leurs deux premiers résidus cystéines et des différents acides aminés les séparant [23]. Parmi la vaste sélection de chimiokines connues à ce jour, plusieurs d’entre elles jouent un rôle important dans l’orchestration de la réponse inflammatoire ayant comme fonction principale l'aiguillage des leucocytes, qui se dirigent alors suivant un gradient de concentration de l’agent chimiotactique, jusqu’à l’atteinte de leur cible. L’induction de ces médiateurs est principalement occasionnée par des cytokines pro-inflammatoires comme le TNF et l’IL-1 ou encore par la présence d’un constituant bactérien comme le LPS (lipopolysaccharide) ou les peptides formylés [24, 25]. Certaines chimiokines sont retenues à la surface des cellules endothéliales, liées à certains éléments glycosylés de la matrice extracellulaire tels que les glycosaminoglycanes (GAG) permettant une présentation structurée et stable aux cellules en circulation [26]. Ces cytokines chimioattractantes se lient à la cellule via une famille de récepteurs à 7 domaines transmembranaires couplés aux protéines G, dont la nomenclature est donnée selon la sous-famille de chimiokines qui s’y rattache. La majorité des récepteurs ont la capacité de se lier à plusieurs chimiokines du même sous-type tout comme les chimiokines peuvent se lier à plusieurs récepteurs présents à la surface de différents types cellulaires. Cette polygamie permet à la cellule, en absence d’une chimiokine ou de son récepteur, de contourner ce manque et ainsi limiter les perturbations qu’il pourrait occasionner [27]. Les chimiokines, outre leur pouvoir chimiotactique, possèdent aussi un rôle dans l’angiogenèse et l’activation cellulaire [28]. Voici quelques exemples de chimiokines importantes dans la réponse inflammatoire ainsi qu’un tableau (Table 2) résumant leurs principales fonctions connues.
7
1.1.4.1 CCL2 (MCP-1)
La chimiokine CCL2 aussi connue sous le nom de protéine chimioattractante de monocytes (MCP)-1 fait partie d'une famille de quatre protéines (MCP-1, -2, -3, et -4) qui possèdent un pouvoir chimioattractant visant principalement les monocytes/macrophages. Le recrutement des lymphocytes T tout comme les cellules NK (natural killer) serait aussi induit par la CCL2. Son expression peut être augmentée en réponse à un stress oxydatif ou par la présence de cytokines pro-inflammatoires. La CCL2 a pour récepteur le CCR2 qui n’est présent que sur certains types cellulaires (monocytes, cellules endothéliales, lymphocytes et cellules dendritiques). [29, 30]. Il s’agit de la seule cytokine dont la production n’est pas inhibée lors de la période de résolution de la réaction inflammatoire, promouvant le recrutement des monocytes responsables du grand ménage du site enflammé. De plus, la CCL2 serait importante dans l’initiation de la cascade de signalisation en lien avec l’adhésion ferme et la transmigration du neutrophile. [30]
1.1.4.2 CCL3 et CCL4 (MIP-1 et MIP-1)
Les protéines inflammatoires des macrophages (MIP) sont décrites comme étant de petites protéines inductibles et sécrétées qui engendrent le recrutement de cellules inflammatoires incluant les monocytes. Parmi ceux-ci, on retrouve la CCL3 (MIP-1) et la CCL4 (MIP-1) dont la synthèse et la sécrétion sont augmentées par l’activation cellulaire. CCL3 possède trois récepteurs, CCR3, CCR4 et CCR5 tandis que CCL4 MIP-1 se lie aux récepteurs CCR5, CCR9 et CCR10. Cette stimulation entraine une cascade d’évènements intracellulaires qui affectent différentes fonctions cellulaires (chimiotaxie, phagocytose et dégranulation) importantes dans la réaction inflammatoire. Le mauvais contrôle de l’expression de ces protéines est souvent associé à différentes pathologies, dont l’arthrite et l’asthme [31].
1.1.4.3 CXCL1 et CXCL2 (GroKCetGroMIP2)
Les CXCL1 et CXCL2 font partie de la famille des CXC. Elles sont principalement exprimées par les macrophages tissulaires et contrôlent le recrutement précoce des neutrophiles dans la réponse inflammatoire. Les neutrophiles et monocytes activés sont aussi reconnus pour la libération de ces chimiokines au site enflammé. Ces dernières ont pour récepteurs le CXCR1 et CXCR2. [32]. La CXCL1, en plus de stimuler le recrutement des leucocytes, principalement le neutrophile, provoque l’activation de NF-nuclear factor kappa B) et de MAPK (mitogen-activated protein kinase) et
8
l’augmentation de l’expression de l’ICAM-1 (molécule d’adhésion intercellulaire-1), molécule d’adhésion importante dans la migration cellulaire [33].
1.1.4.4 CXCL8 (IL-8)
La CXCL8 ou l’IL-8 est considérée comme étant la chimiokine la plus importante pour le recrutement des neutrophiles humains, étant absente chez la souris. Elle se lie principalement à deux récepteurs membranaires, le CXCR1 et CXCR2. Les réponses cellulaires occasionnées par la liaison de CXCL8 à son récepteur sont diverses. Elle engendre principalement la libération d’enzymes lyzosomales en plus d’augmenter la présence d’intégrines importantes dans la liaison des neutrophiles à l’endothélium [34]. Outre les neutrophiles, la production de CXCL8 est aussi observée chez d’autres types cellulaires dont les monocytes, les cellules de l’endothélium vasculaire, les lymphocytes T, les fibroblastes et les hépatocytes. L’activation cellulaire par la présence de cytokines pro-inflammatoires dont le TNF et l’IL-1 augmente rapidement la libération de la CXCL8, démontrant son implication dans les évènements précoces de la réponse inflammatoire. Des études ont aussi démontré son rôle dans plusieurs maladies inflammatoires, dont la polyarthrite rhumatoïde [35].
9 Table 2 : Rôles des récepteurs de chimiokines et leurs ligands
Adapté à partir de : Charo, IF et Ransohoff. N Engl J Med 2006, 354(6): p. 610-621; Lacotte S. et al. Ann N Y Acad Sci. 2009. 1173:310-317.
Récepteur Chimiokines Types cellulaires Maladies liées et fonctions CCR1 CCL3 (MIP-1), CCL5 (RANTES), CCL7 (MCP-3),
CCL14 (HCC1)
Lymphocytes T, Monocytes, Éosinophiles, Basophiles
Polyarthrite rhumatoïde, Sclérose en plaque CCR2 CCL2 (MCP-1), CCL8 (MCP-2), CCL7 (MCP-3), CCL13 (MCP-4) Monocytes, Cellules dendritiques, Lymphocytes T mémoire Athérosclérose, Polyarthrite rhumatoïde, Sclérose en plaque, Résistance aux pathogènes, Diabète de type 2 CCR3 CCL11 (Eotaxin), CCL7 (MCP-3), CCL5 (RANTES), CCL8 (MCP-2), CCL13 (MCP-4) Éosinophiles, Basophiles,
Mastocytes, Plaquettes Asthme allergique, Rhinite
CCR4 CCL17 (TARC), CCL22 (MDC) Lymphocytes T, Cellules dendritiques, Basophiles, Macrophages, Plaquettes
Infection parasitaire, Rejet de greffes, Retour des lymphocytes à la peau CCR5 CCL3 (MIP-1), CCL4 (MIP-1),
CCL5 (RANTES), CCL8 (MCP-2) Lymphocytes T, Monocytes Rejet de greffes, corécepteur du VIH-1 CCR6 CCL20 (MIP-3) Lymphocytes T et B, Cellules dendritiques Immunité humorale des muqueuses, Asthme allergique
CCR7 CCL19 (ELC), CCL21 (SLC) Lymphocytes T, Cellules dendritiques
Transport des lymphocytes et cellules dendritiques aux ganglions
lymphatiques, Présentation d’antigène, Immunité cellulaire
CCR8 CCL1 (I309) Lymphocytes T, Monocytes, Cellules dendritiques Migration des cellules dendritiques aux ganglions lymphatiques, formation de granulome
CCR9 CCL25 (TECK) Lymphocytes T, Cellules plasmatiques Retour des lymphocytes à l’intestin CCR10 CCL27 (CTACK), CCL28 (MEC) Lymphocytes T Retour des lymphocytes à l’intestin et la peau
CXCR1 CXCL8 (IL-8), CXCL6 (GCP2) Neutrophiles, Monocytes Recrutement des neutrophiles, Prolifération cellulaire, Maladies inflammatoires, Obésité CXCR2 CXCL8 (IL-8), CXCL1 (Gro), CXCL2 (Gro), CXCL3 (Groγ), CXCL5 (ENA-78), CXCL6 (GCP2) Neutrophiles Monocytes, Cellules endothéliales
Recrutement des neutrophiles et macrophages, Angiogenèse, Prolifération cellulaire, Maladies inflammatoires, Cancer CXCR3 CXCL9 (MIG), CXCL10 (IP-10), CXCL11 (I-TAC) Lymphocytes T, Mastocytes
Recrutement des leucocytes, Réponse des Th1, Inflammation, Activation des intégrines, Migration cellulaire CXCR4 CXCL12 (SDF-1) Largement exprimé Hématopoïèse, Migration cellulaire, Angiogenèse, Auto-immunité, Cancer CXCR5 CXCL13 (BCA-1) Lymphocytes T et B Polyarthrite rhumatoïde, Auto-Immunité, Inflammation des neurones
CXCR6 CXCL16 (SR-PSOX) Lymphocyte T, NK
Recrutement des lymphocytes T et NK, Adhésion et phagocytose bactérienne, Syndrome métabolique, Maladies inflammatoires
10
1.2 La barrière endothéliale
L’endothélium vasculaire est un tissu dynamique qui possède plusieurs fonctions, dont la régulation du tonus vasculaire, le contrôle de la perméabilité, l’adhésion cellulaire ainsi que le contrôle de l’inflammation de la paroi vasculaire. Les cellules de l’endothélium s’adaptent selon les stimuli perçus dans l’environnement en modifiant leurs activités. La sécrétion de facteurs endothéliaux, l’expression de protéines d’adhésions ou encore la modification de la conformation cellulaire font partie des moyens utilisés par la cellule pour communiquer avec son milieu et procéder à l’orchestration d’une réponse adéquate en vue de protéger l’organisme d’un dysfonctionnement [36, 37].
1.2.1 Le glycocalyx
Sous des conditions basales, l’endothélium vasculaire est recouvert d’un fin réseau protéique jouant un rôle important dans le maintien de l’équilibre entre les échanges du tissu et du système vasculaire. Ce réseau, appelé glycocalyx (Figure 2), est composé de plusieurs protéines et facteurs interreliés formant une structure serrée. Le glycocalyx a comme principale fonction la protection de la paroi vasculaire et le maintien de la perméabilité vasculaire [38]. La visualisation du glycocalyx dans son ensemble fut très ardue, due à ses nombreux changements au sein de ses composantes, valsant entre dégradation et biosynthèse. Plusieurs méthodes de visualisation ont été développées afin de limiter la destruction naturelle de la membrane. Le glycocalyx fut observé aussi bien dans les grands conduits du système vasculaire que dans les capillaires sanguins et son épaisseur, pouvant
Figure 2 : Le glycocalyx. Visualisation par microscopie électronique du glycocalyx. Issue de : Chappell, D., et al., A rational approach to
11
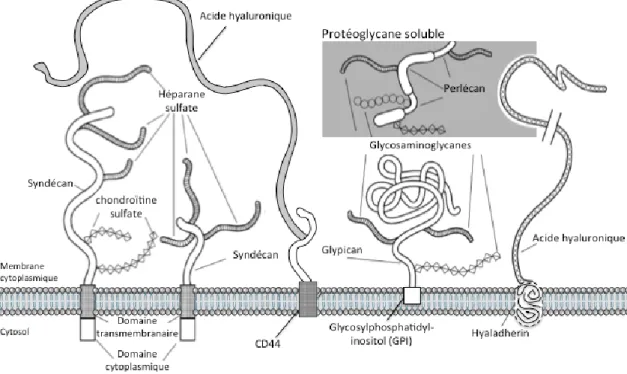
atteindre jusqu’à 5 µm, augmente avec le diamètre vasculaire [39]. Parmi ses principales composantes (Fig.3) on retrouve des GAG, des glycoprotéines et différentes composantes solubles. 1.2.1.1 Les glycosaminoglycanes
Les GAG sont des polysaccharides complexes de longueurs variées composés d’une répétition de diholosides (galactosamide ou glucosamide) reliés à l’acide glucuronique ou iduronique. En conditions physiologiques, la charge négative des GAG limite l’accès de certaines composantes et cellules du flux sanguin à l’endothélium. Cette polarité peut néanmoins amener la liaison de protéines solubles (protéoglycane), d’enzymes, de cytokines et de facteurs de croissance ayant tous un rôle propre dans la régulation de la densité de la membrane et dans l’accomplissement de ses différentes fonctions. Le glycocalyx est composé de cinq GAG distincts : l’héparane sulfate (HS), le chrondroïtine sulfate (CS), le keratane sulfate (KS), le dermatane sulfate (DS) et l’hyaluronae (HA) [40]. L’HS est le plus abondant d’entre tous, représentant environ 50 % du volume total [41]. Ces chaines sulfatées sont liées de façon covalente à différentes protéines membranaires afin de former un protéoglycane. L’HS est composé d’environ 50 à 150 disaccharides. Le chrondroïtine sulfate, faisant aussi partie des GAG les plus abondants du glycocalyx, se lie pour sa part aux fibres de collagène afin d’augmenter la rigidité de la membrane. Composante importante de la matrice du cartilage, son absence est souvent pointée du doigt chez les patients souffrant d’arthrose [42]. Étant lié à une protéine membranaire, le complexe protéique peut atteindre une taille de 3 500 kDa [43]. Contrairement à ses confrères, l’hyalurorane n’est pas une chaine sulfate et ne forme pas de protéoglycane. Il se lie plutôt à un récepteur membranaire (CD44) ou à diverses protéines ayant la capacité de s’y rattacher que l’on surnomme les hyaladhérines. Ces différentes liaisons permettent la stabilisation et la solidification de la paroi vasculaire [44]. L’acide hyaluronique in vivo peut atteindre une taille de 10 000 kDa; elle représente donc la plus longue chaine de glycosaminoglycane présente à la surface de l’endothélium [45].
1.2.1.2 Protéoglycanes
Les protéoglycanes sont les éléments de bases du glycocalyx constituant le squelette de ce tapis protéique. Au nombre de six, ces protéines se lient à différents GAG via leur domaine extracellulaire. Les syndécans (SDC) et glyplicans composent plus de 90 % des protéoglycanes retrouvés à la surface membranaire. La famille des syndécans (SDC) comprend 4 sous-types (SDC1, SDC2,
12
SDC3, SDC4) possédant tous un court domaine cytoplasmique de deux régions conservées, une région variable et un domaine transmembranaire très conservé [46]. La spécificité de leur domaine extramembranaire permet la liaison de différents GAG, majoritairement l’HS dont les sites de liaison sont nombreux au niveau de la région N-terminale. Le SDC1 peut aussi fixer le CS [44]. Chez l’humain, le SDC1 est principalement retrouvé à la surface des cellules épithéliales, le SDC2 sur les cellules endothéliales et fibroblastes, le SDC3 sur les neurones tandis que le SDC4 est exprimé de façon ubiquitaire. Le syndécan agit comme messager cellulaire. Effectivement lors de la liaison de divers ligands sur leurs GAG respectifs, le SDC est activé et engendre différentes réponses cellulaires pouvant induire une réorganisation structurale ou encore un changement dans l’expression de protéines de surfaces selon l’information transmise [47].
Pour ce qui est des glypicans, ceux-ci sont liés de façon covalente par leur domaine C-terminal hydrophobique à la membrane cellulaire via une ancre : la glycosylphosphatidylinositol (GPI). Leur forme arrondie occasionnée par la forte présence de résidus cystéines dans leur domaine terminal leur permet aussi d’être facilement distingués des autres composantes du manteau protéique. Cette famille protéique est reconnue pour la liaison de l’HS sur leurs domaines de liaison situés tout près de la surface membranaire [48, 49].
La présence de protéoglycanes solubles (perlécans, biglycans, versecans, mimecans) est aussi observée dans la composition du glycocalyx. Ces derniers sont produits par l’endothélium et sont maintenus dans sa structure [50]. Le perlécan, plus gros protéoglycane soluble connu à ce jour, est produit par l’endothélium. Cette longue chaine est divisée en trois domaines possédant chacune une fonction spécifique. Le perlécan possède un rôle important dans le maintien de l’intégrité du glycocalyx par sa capacité à se lier aux intégrines situées à la surface cellulaire. Il est aussi reconnu pour augmenter la prolifération cellulaire chez les cellules endothéliales via la liaison de facteurs de croissance [51].
1.2.1.3 Les composantes solubles
Le glycocalyx est présenté comme un réseau protéique réparti en deux couches distinctes. La plus interne est composée des protéoglycanes précédemment décrits tandis que la plus externe est principalement formée de composantes dérivées de la circulation et d’une certaine quantité de
13
protéoglycanes solubles. L’interphase est composée de chaines d’hyaluronanes entrelacées sur lesquelles les protéoglycanes solubles sont maintenues. Les composantes solubles, pouvant provenir de l’endothélium ou encore de la circulation, ont comme fonction le renforcement des liens des différentes composantes, augmentant la stabilité de la structure [50]. Les protéines du sang maintenues dans le glycocalyx, telles que l’albumine et le fibrinogène, maintiennent la charge négative de la membrane, limitant l’accessibilité de cette dernière aux cellules du sang en condition basale [46]. La présence de chimiokines intercalées entre les différentes composantes est aussi observée. Ces chimiokines participent à la formation d’un gradient chimiotactique important pour la migration des leucocytes [52]. Les liaisons entre les protéines solubles, les protéoglycanes solubles et glycosaminoglycanes forment un véritable maillage dont la perte d’un seul de ces importants constituants peut engendrer l’altération de ses principales fonctions.
Figure 3 : Représentation schématique des composantes du glycocalyx. Les différents protéoglycanes (syndécan, glypican), glycosaminoglycanes (héparan sulfate, chondroïtine sulfate, acide hyaluronique) et composantes solubles (perlécan) du glycocalyx sont représentées selon leur caractéristiques principales et leur emplacement sur l'endothélium vasculaire. Adapté à partir de : Alexander V. Maksimenko and Askar D. Turashev, No-Reflow Phenomenon and Endothelial Glycocalyx of Microcirculation, Russian Journal of Bioorganic Chemistry, 2014, Vol. 40, No. 2, p. 119–128.
14
1.2.1.4 Dégradation et biosynthèse
Le glycocalyx est un tissu dynamique dont les composantes sont naturellement remplacées. L’HA est le plus actif d’entre tous n’ayant qu’une courte demi-vie. Cette dernière est de 5 min en circulation et d’une journée sur les tissus et la peau. L’HA se doit alors d’être constamment synthétisé et dégradé. L’HA est formé à la membrane cellulaire par l’une des hyaluronane synthases (HAS1, HAS2, HAS3), synthétisée par l’activation de la voie NF-, dont le site catalytique se situe à la surface interne de la membrane cytoplasmique [53]. Les différents sucres sont donc ajoutés les uns après les autres et la chaine est finalement expulsée à l’extérieur de la membrane dans le milieu extracellulaire où elle se fixe à l’un de ses différents récepteurs [54]. Les HA à longue chaine sont reconnus pour leurs propriétés protectrices et pour leur potentiel anti-inflammatoire, tandis que les HA de courte chaine, causés par la dégradation ou une erreur de synthèse, augmente l’activation cellulaire par leur liaison aux TLR [55]. Sa dégradation, quant à elle, est produite principalement par l’hyaluronidase qui clive la molécule en morceaux de différentes longueurs au niveau des liaisons 1-4. Chaque fragment provoque différentes activités biologiques selon leur composition. Ils agissent principalement comme messager moléculaire avertissant l’organisme d’un danger ou d’un dommage présent. Les oligosaccharides formés sont finalement mobilisés vers les vaisseaux lymphatiques où plus de 80 % de ceux-ci sont complètement dégradés. Les concentrations résiduelles sont finalement éliminées par le foie et les reins [53, 56].
L’HS et le CS, quant à eux, sont synthétisés au niveau de l’appareil de Golgi tandis que le protéoglycane est produit au niveau du réticulum endoplasmique. Suite à la production du corps protéique, la xylosyl transférase vient lier le premier morceau du casse-tête, un xylose, au résidu sérine située sur le corps protéique. Les différents GAG sont tous liés par un même tétrasaccharide composé de GlcA-Gal-Gal-Xyl, formant la base de la chaine sulfatée. Cette étape nécessite la participation de la galactosyle transférase et la GlcA1 transférase. L’expression génique, l’épissage alternatif et les modifications de la chaine glycosylée sont à l’origine de l’importante divergence des protéoglycanes impliqués dans la formation du glycocalyx [57]. L’héparanase est la protéase nécessaire au catabolisme normal de l’HS. Lorsque celle-ci est sécrétée suite au dommage tissulaire, elle clive les GAG présents sur la membrane pour permettre l’adhésion et l’extravasion des cellules immunitaires [58].
15
1.2.2 Le glycocalyx et l’inflammation
Le glycocalyx offre un contrôle de la réaction inflammatoire. Ses mailles étant fermement tissées maintiennent les chimiokines produites par l’endothélium afin que ces dernières soient présentées aux leucocytes au moment opportun. Il a été démontré que le TNF, tout comme le LPS, seraient de forts facteurs induisant la diminution de l’intégrité du tapis protecteur par l’augmentation de la présence d’enzymes de dégradation, dont l’héparanase [39]. Les HA et HS libérées dans la circulation agiraient comme facteurs pro-inflammatoires et stimuleraient la chimiotaxie cellulaire [59]. De plus, lors de l’étape de la résolution de la réponse inflammatoire, les cytokines pro-inflammatoires en circulation sont captées dans ses filets et les sites de liaisons de ces dernières sur cellules endothéliales sont à nouveau bloqués par la biosynthèse de nouvelles composantes [49].
1.2.3 Le glycocalyx et le diabète
Les maladies vasculaires sont souvent recensées comme complications à long terme chez les diabétiques. Effectivement, de hauts taux plasmatiques d’hyaluronane et d’hyaloronidase ont été observés en lien avec l’hyperglycémie associée à la maladie [60]. De ce fait, la dimension du glycocalyx est réduite chez les diabétiques laissant supposer que la diminution de son intégrité pourrait être en lien avec certaines maladies vasculaires souvent retrouvées chez ces patients. [60]. Dans un modèle in vivo murin, Van Der Berg démontre qu’une diminution de la taille du glycocalyx par une diète riche en graisses ou haute en cholestérol affaiblit son pouvoir protecteur envers l’endothélium vasculaire, augmentant ainsi les risques d’athérosclérose chez les souris testées [61]. La restauration et les différentes composantes du glycocalyx pourraient alors être de bonnes cibles thérapeutiques en vue de réduire les complications associées à la maladie.
16
1.3 La migration cellulaire
La migration cellulaire est un des phénomènes importants de la réponse inflammatoire ; elle permet aux leucocytes en circulation de traverser l’endothélium vasculaire et se rendre au site lésé. Grâce à des techniques modernes comme la microscopie intravitale, il est maintenant possible d’observer le mouvement réel des leucocytes [62]. L’activation des cellules de l’endothélium vasculaire, principalement au niveau des veinules post-capillaires, est un évènement capital dans l’initiation de ce processus [63]. Les médiateurs exogènes dérivés des protéines bactériennes (LPS) et endogènes provenant des protéines du complément (C5a) et de l’activation cellulaire (CXCL8/IL-8, TNF), engendrent la mobilisation et l’expression de molécule d’adhésion qui participent aux quatre étapes de la migration cellulaire : le roulement, l’activation, l’adhésion ferme et la transmigration ou diapédèse [64].
Figure 4 : Migration cellulaire du neutrophile. Le glycocalyx est dégradé par la présence d’un stimulus inflammatoire libérant les sites de liaisons des protéines d’adhésion situées sur l’endothélium vasculaire. Le roulement est initié par la liaison des neutrophiles à l’endothélium via les sélectines. L’expression des protéines d’adhésion (P, E-sélectines) est augmentée par l’activation cellulaire par la présence de cytokines issues du site de l’agression. Les intégrines activées changent de conformation en vue d’une interaction avec leurs ligands respectifs. La mobilisation de nouvelles protéines d’adhésion (VCAM, ICAM) via l’activation cellulaire entraine une interaction stable (adhésion ferme). Le neutrophile traverse finalement la membrane par transmigration suivant un gradient chimioattractant via la liaison de nouvelles protéines d’adhésions (PECAM). Adapté à partir de : Sathiyanadan, K., et al., PSGL-1 and E/P-selectins are essential for T-cell rolling in inflamed CNS microvessels but
17
1.3.1 Roulement et activation
Le roulement et l’activation sont contrôlés par les sélectines, protéines appartenant à la famille des lectines qui permettent la capture initiale du leucocyte par l’endothélium. Ces dernières possèdent un domaine lectine extracellulaire de type C qui permet la liaison à leur ligand glycosylé possédant un motif sialyl Lewis X (ex. PSGL-1 : P-selectin glycoprotein ligand-1) [65, 66]. La L-sélectine (CD62L) se situe exclusivement et de façon constitutive sur les leucocytes. La E-sélectine (CD62E) et la P-sélectine (CD62P) sont quant à elles exprimées par les cellules de l’endothélium en réponse à une activation. Contrairement à la CD62E, qui est synthétisée de novo lors d’un stimulus inflammatoire, les CD62P sont concentrées au niveau cellulaire dans les corps de Weiber Palade et libérées au moment opportun. L’expression des sélectines sur les cellules endothéliales est considérée comme maximale dans les 4 à 6 heures suivant l’activation et sont par la suite graduellement dégradées ou clivées en 12 à 24 heures. (Fig. 5) [67, 68]. Le roulement est causé par le flux sanguin qui, par sa force, pousse la cellule à se détacher des sélectines, n’ayant qu’une faible capacité d’adhésion aux leucocytes. La vitesse du roulement est donc inversement proportionnelle à la densité des sélectines sur la paroi vasculaire. La cellule culbute sur les différentes sélectines et sa vitesse de croisade sera ralentie, là où la densité des lectines est la plus forte [67]. L’arrêt du roulement cellulaire est alors occasionné par la présence d’une nouvelle famille protéique possédant une capacité adhésive plus puissante: la famille des super immunoglobulines.
1.3.2 L’adhésion ferme
Les leucocytes possèdent à leur surface des milliers d’intégrines qui ne peuvent se lier que faiblement aux cellules endothéliales dues à leur inactivité en conditions basales. Les intégrines sont formées de deux chaines, et , ayant chacune une fonction distincte. La sous-unité est nécessaire pour la liaison à son ligand tandis que la sous-unité agit comme messager intracellulaire. À ce jour, 18 chaines et 8 chaines ont été caractérisées composant 24 hétérodimères fonctionnels [69]. L’activation cellulaire via la liaison des sélectines ou encore par la présence de médiateurs inflammatoires induit un changement de conformation des intégrines ainsi qu’une restructuration de ces dernières sur la membrane cellulaire. Ces changements augmentent leur affinité et avidité occasionnant un fort pouvoir de liaison à leurs ligands, principalement les
18
protéines de la super famille des immunoglobulines (ICAM, VCAM, PECAM et MadCAM) situées à la surface des cellules endothéliales. Les leucocytes et monocytes expriment principalement les intégrines de la famille 2 qui sont reconnues pour leur liaison aux ICAM présents à la surface de l’endothélium [70]. L’expression d’ICAM-1 et de VCAM est augmentée par les stimuli inflammatoires, contrairement à celle d'ICAM-2 qui est constitutive à la surface de l’endothélium. L’expression maximale des immunoglobulines inductibles serait observée dans les 8 heures suivant l’agression primaire et serait maintenue pendant plus de 72 heures. (Fig. 5) [68]. La liaison des intégrines à l’ICAM-1, en plus d’entrainer une adhésion ferme, amène la sécrétion additionnelle de cytokines pro-inflammatoires et l’expression de nouvelles protéines membranaires qui renforcent alors la réponse inflammatoire. L’adhésion est donc fortifiée par la liaison aux immunoglobulines et la cellule est désormais bien positionnée pour effectuer la dernière étape du phénomène de la migration cellulaire [71].
1.3.3 La transmigration
La transmigration est le point culminant de la migration cellulaire, processus permettant aux cellules d’atteindre le site inflammatoire. La transmigration s’effectue normalement aux jonctions
Figure 5 : Cinétique de l’expression des principales protéines d'adhésion situées sur l’endothélium vasculaire suivant un stimulus inflammatoire.Issue de : Durand, G.V., Les
sélectines et leur rôle dan s l'interaction des leucocytes avec les cellules endothéliales.
19
intercellulaires. L’activation du leucocyte suivant l’adhésion ferme entraine la modification de son cytosquelette afin de former un pseudopode invasif lui permettant de se glisser entre les cellules [72]. La forte présence de la PECAM (platelet endothelial cell adhesion molecule) au niveau des jonctions serrées fait de cette dernière un élément important de cette ultime étape. Effectivement, l’inhibition de cette immunoglobuline entraine une diminution de plus de 70 % de la transmigration des leucocytes in vitro [73]. Les récepteurs de la famille des molécules d’adhésion des jonctions serrés (JAM) sont aussi nécessaires à la diapédèse des leucocytes. Au nombre de trois, ces dernières forme des liaisons avec les JAM situés sur les leucocytes fermement adhérés. Les JAM peuvent de plus se lier aux intégrines 2 des leucocytes permettant une invasion cellulaire plus forte [74, 75]. Finalement l’activation des leucocytes transmigrants entraine la libération d’enzyme de dégradation qui permettra aux leucocytes de traverser la membrane basale. La cellule ayant atteint sa destination peut alors passer à l’action [76].
Table 3 : Liste des principales protéines d’adhésion, de leurs ligands et de leur distribution, impliquées dans les différentes étapes de migration cellulaire.
Adapté à partir de: Chiara Cerletti and all., Platelet – Leukocyte Interactions: Multiple Links Between Inflammation, Blood
Coagulation and Vascular Risk. Mediterranean Journal of Hematology and Infectious Diseases, 2010. 2(3), e2010023.
Molécules Ligands Distribution
Sélectines
L-Sélectine PSGL-1 Leucocytes
E-Sélectine PSGL-1, CD44 Cellules endothéliales activées P-Sélectine PSGL1 Corps de Weiber Palades (cellules endothéliales), Plaquettes Immunoglobulines
ICAM-1 (CD54) 2-intégrines (LFA-1, MAC-1) Leucocytes, cellules endothéliales activées, Fibroblastes, Épithélium, Cellules synoviales
ICAM-2 (CD102) 2-intégrines (LFA-1) Lymphocytes, Monocytes, Plaquettes, Cellules endothéliales
ICAM-3 (CD50) -intégrines (LFA-1) Leucocytes
PECAM (CD31) PECAM-1 Leucocytes, Cellules endothéliales, Cellules synoviales, Plaquettes
VCAM-1 (CD160) 2-intégrines (LFA-1) -intégrines (VLA-4)
Monocytes, Cellules synoviales, Cellules endothéliales activées Intégrines
20
1.4 Modèles in vivo inflammatoires
Les modèles animaux sont utilisés afin de mieux comprendre l’impact d’un facteur à l’étude sur les causes et mécanismes physiologiques liés à une pathologie précise, lorsque l’analyse ne peut être produite chez l’homme et que l’utilisation d’un modèle in vitro ne peut permettre une investigation assez poussée. Il existe actuellement plusieurs modèles in vivo dont certains ont été développés spécifiquement pour mieux comprendre les mécanismes inflammatoires. Par exemple, les modèles murins d’inflammation aiguë sont souvent liés à un marqueur ou symptôme d’inflammation précis, comme la douleur, la chaleur et la migration cellulaire, permettant de tester les effets anti- ou pro-inflammatoires du facteur à l’étude. Les modèles in vivo n’étant cependant pas parfaitement représentatifs de la situation humaine, la combinaison de différents modèles est souvent nécessaire afin d’obtenir une image plus globale des effets obtenus [77].
1.4.1 Modèle de la poche d’air dorsale
Le modèle de la poche d’air dorsale est utilisé depuis les années 50 dans les études in vivo portant sur l’activation et l’infiltration leucocytaire. Ce modèle d’inflammation aiguë se résume en une injection sous-cutanée d’air stérile qui amène la formation d’une cavité que l’on surnomme la poche d’air. La cicatrisation de la plaie suite au décollement cutané entraine la formation d’une nouvelle membrane tissulaire plus dense composée de cellules musculaires lisses, de fibroblastes, de macrophages et de cellules endothéliales [78]. Ce nouveau tissu formé serait comparable à la membrane synoviale qui tapisse la cavité des articulations. L’injection d’un irritant inflammatoire peut être effectuée à l’intérieur de la cavité afin d’étudier divers aspects de la réponse inflammatoire [79]. Les évènements précoces de l’activation inflammatoire occasionnée par l’injection d’un agoniste tel que le LPS incluent le recrutement des leucocytes en circulation vers le site enflammé. La liaison du LPS aux récepteurs TLR4 présents à la surface des cellules endothéliales favorise la mobilisation des protéines membranaires impliquées dans la migration cellulaire. En premier arrivent les PMN, dont l'accumulation culmine entre 4 et 8 heures après l'injection. Dans les 24 à 48 heures suivantes, les PMN sont remplacés par un nombre plus restreint de lymphocytes et monocytes/macrophages.
21
Les cellules activées du tissu formant la membrane, entrainent de plus la libération de médiateurs inflammatoires tels que le TNF, l’IL-1, l’IL-6 et les chimiokines de la famille des CC et CXC, provoquant l’activation et le recrutement des leucocytes en circulation. Les neutrophiles ayant atteint la cavité par transmigration peuvent à leur tour participer à la production de médiateurs importants dans l’orchestration de la réponse inflammatoire [3].
1.4.2 Modèle au dextran sulfate sodium
Le modèle murin de colite ulcéreuse induite au dextran sulfate sodium (DSS) permet de reproduire plusieurs des symptômes cliniques et dommages histologiques retrouvés chez les patients atteints d’une maladie inflammatoire chronique intestinale (MICI) [80, 81]. La toxicité du DSS provoque la détérioration des cellules épithéliales du côlon, entrainant l’augmentation de la perméabilité de l’épithélium [82]. Les voies de pénétration du DSS à travers la barrière intestinale ne sont cependant pas encore clarifiées. L’hypothèse d’un passage actif ou passif de la molécule par un récepteur membranaire aurait été proposée. De récentes études auraient aussi suggéré la formation d’un complexe moléculaire via la liaison du DSS à un acide gras à moyenne chaine formant ainsi une nanovésicule qui aurait la capacité de traverser l’endothélium intestinal. Les sels sodiques étant reconnus pour diminuer l’efficacité des jonctions serrées augmenteraient ainsi la perméabilité de la membrane [83]. L’affaiblissement de la barrière intestinale permet alors l’entrée d’antigènes et de microorganismes du microbiote dans la muqueuse intestinale, provoquant une réponse inflammatoire puissante.
Il existe à ce jour une multitude de variantes de ce modèle selon la concentration, la durée ainsi que la fréquence de la prise du DSS, déclenchant des réponses inflammatoires distinctes [82]. Les symptômes les plus communs sont la perte de poids, la diminution de la longueur du côlon et son épaississement, le recrutement leucocytaire dans le colon, ainsi que l’augmentation des scores cliniques histologiques et endoscopiques. [84]. Le modèle de la colite ulcéreuse représente donc un modèle d’inflammation fort utile dans l’étude de l’infiltration leucocytaire [85].
22
1.4.3 Microscopie intravitale avec blessure au laser.
Depuis plus d’une vingtaine d’années, l’utilisation et le perfectionnement de la microscopie intravitale permet l’analyse de processus cellulaires dans un organisme vivant, et est responsable d’une avancée considérable concernant les processus cellulaires. Plusieurs techniques et modèles ont été conçus selon les différents paramètres à l’étude [86]. Parmi ceux-ci, le modèle de la blessure au laser non invasive combinée à une microscopie deux photons est souvent utilisé dans les études portant sur les interactions cellules-cellules et la migration cellulaire. Dans ce modèle, un dommage tissulaire est provoqué par le faisceau d’un laser dont la longueur d’onde fut intentionnellement diminuée et la puissance augmentée. Cette haute énergie concentrée en périphérie de l’endothélium vasculaire cause donc un dommage de chaleur. La microscopie deux photons permet par la suite d’observer l’impact de ce dommage sur le recrutement cellulaire et le système de coagulation. Le dommage tissulaire au laser est peu invasif et est principalement effectué au niveau de la surface dorsale de l’oreille ou du coussinet plantaire arrière chez la souris, où la peau est assez mince pour permettre d'observer le flux sanguin. L’absence de poils sur la zone cible est aussi nécessaire afin de limiter l’autofluorescence qu’ils peuvent occasionner. Grâce aux techniques de marquages de tissus spécifiques et d’un large éventail de souris exprimant différentes protéines/cellules fluorescentes, il est désormais possible d’observer presque n’importe quelle composante cellulaire ou structure. Les capacités de cette imagerie en temps réel sont alors infinies et permettent de produire des images et vidéos plus informatifs [87, 88].
23
1.5 La metformine
1.5.1 Généralités
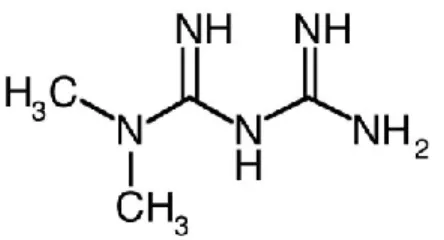
Utilisée depuis 1960, la metformine (N,N-dimethylbiguanide) (Fig. 6), plus connue sous son nom commercial Glucophage, est le normoglycémiant le plus prescrit pour le traitement du diabète non insulinodépendant [89]. Extrait d’une plante du nom de Galega officinalis, cette molécule est composée d’une chaine de deux guanidines reliées par un atome d’azote dont deux groupes méthyles leur sont rattachés [90]. Dû à sa forte solubilité dans l’eau, elle est difficilement absorbée au niveau gastrique. Elle circule dans l’organisme sans être métabolisée et est excrétée par les reins selon une demi-vie d’environ six heures. Contrairement aux sulfamides connus, la metformine n’a pas d’effet sur l’indice de masse corporel des obèses diabétique ou non-diabétique. La raison de la perte de poids, parfois observée chez les patients traités, est plutôt liée aux effets secondaires touchant principalement le système digestif (diarrhée, inconfort abdominal) [91]. Les risques d’acidose lactique sont de plus largement inférieurs, soit environ 10 à 20 fois, à ceux recensés par la prise de la Phenformin (antidiabétique retiré du marché). À long terme, la prise de metformine peut causer une diminution de l’absorption de la vitamine B12 pouvant être en lien avec le développement de maladies cardiovasculaires. Cette carence peut néanmoins être résolue par la prise de suppléments [92]. En comparaison aux différents antidiabétiques sur le marché, la metformine n’agit pas sur la sécrétion d’insuline, mais bel et bien sur la réduction du glucose circulant par une augmentation de la sensibilité des récepteurs à l’insuline. Elle diminue en premier lieu la production du glucose hépatique et augmente sa captation par les tissus jusqu’à l’obtention d’une valeur normale [93, 94].
24
1.5.2 Mécanisme d’action
La metformine, par sa charge positive et sa forte affinité pour l’eau, est distribuée dans les tissus par le biais de différents transporteurs de cations organiques (OCT1-3, MATE et PMAT). Elle agit principalement au niveau du foie, là où la présence d’OCT1 est importante, et a pour effet d’augmenter l’activité des récepteurs à l’insuline en plus d’engendrer la mobilisation des transporteurs de glucose (GLUT-1 et GLUT-4) à la surface cellulaire [95]. La captation du glucose est alors augmentée dans les tissus adipeux, les cellules musculaires et la paroi intestinale. La metformine engendre par le fait même l’inhibition de la néoglucogenèse, de la lipogenèse et l’augmentation de la glycolyse en altérant l’activité des enzymes importantes de ces voies métaboliques. Le mode d’action de la metformine fut pendant très longtemps inconnu. Ce n’est que dans les années 2000 que deux groupes de chercheurs distincts ont enfin découvert son principal mécanisme d’action. La metformine a pour cible la mitochondrie [96]. C’est l’interaction entre le biguanide et les ions cuivrés du métabolite qui entraine l’inhibition du complexe 1 de la chaine de transport d’électron, diminuant ainsi la production d’adénosine triphosphate (ATP) et augmentant par le fait même les taux d’adénosine monophosphate (AMP) circulante. Ce dérèglement de l’équilibre énergétique provoque alors l’activation de la protéine kinase activée par l’AMP (AMPK) [97]. L’AMPK est une protéine kinase de trois sous-unités (). L’activation de cette dernière, par la liaison de l’AMP à sa sous-unité, a pour effet d’inhiber la consommation d’ATP et de stimuler sa production principalement par la captation et l’oxydation du glucose et des acides gras [98]. L’importance de l’activation de l’AMPK par la metformine dans la régulation de l’hyperglycémie chez les diabétiques fut illustrée dans plusieurs études par l’utilisation d’inhibiteur et d’agoniste de la kinase. Les effets obtenus ont démontré une inhibition significative des effets hypoglycémiants de la metformine chez des souris traitées. De plus, l’utilisation d’un agoniste de l'AMPK comme la 5-Aminoimidazole-4-carboxamide ribonucléotide (AICAR) a quant à elle démontré des effets similaires à ceux obtenus par la prise de metformine. Malgré les différentes études démontrant l’AMPK comme étant le principal responsable des effets hypoglycémiques de la metformine, une diminution du glucose sanguin fût observée chez des souris dépourvues de cette kinase. D'autre part, la metformine aurait démontré un effet marqué chez les globules rouges, cellules dépourvues de mitochondries, laissant supposer la possibilité d’un deuxième facteur ou complexe important dans le mécanisme d’action de la metformine [99].