Impact de la moulée sur la performance et l’apparition
de mauvais goût chez la truite arc-en-ciel
(Oncorhynchus mykiss) élevée en système
d’aquaculture en recirculation
Mémoire
Alexandre Pilote
Maîtrise avec mémoire en sciences animales
Maître ès sciences (M. Sc.)
Québec, Canada
iii
Résumé
Les systèmes d‘aquaculture en recirculation (RAS) possèdent plusieurs avantages comparativement aux systèmes d‘élevage ouverts. Parmi ces avantages, notons l‘économie d‘eau, le contrôle de certains paramètres physico-chimiques et le meilleur traitement des eaux usées. Cependant, les poissons élevés en RAS sont souvent pris avec des problèmes de mauvais goût. Ce mauvais goût chez le poisson est dû à l‘accumulation dans les tissus lipidiques de molécules telles que la géosmine et le 2-méthylisobornéol. Les cyanobactéries, les actinomycètes, les myxobactéries, entres autres, sont reconnues comme étant productrices de ces molécules. Lorsque les molécules sont présentes dans les systèmes d‘élevage, l‘accumulation dans la chair des poissons rend le poisson impropre à la consommation bien que non-toxique. La limite de détection humaine pour ces molécules est de l‘ordre du ng/L dans l‘eau et du μg/kg dans la chair de poisson.
Aucune technologie (ozonation, filtration, etc.) n‘est suffisante pour régler complètement ce problème. Cette étude est la première qui étudie l‘impact de la moulée utilisée sur l‘apparition du mauvais goût chez le poisson élevé en RAS. Comme la moulée a une influence directe sur différents paramètres physico-chimiques de l‘eau des bassins, il se pourrait que cela ait un effet sur la quantité de micro-organismes producteurs de molécules du mauvais goût. L‘hypothèse de départ était que l‘utilisation d‘une moulée produisant moins de solides en suspension pourrait limiter l‘apparition de mauvais goût dans la chair de truites arc-en-ciel (Oncorhynchus mykiss).
Pour l‘expérience, deux moulées différentes ont été utilisées. La première est reconnue pour produire des fèces compactes tandis que l‘autre est reconnue pour produire des fèces plutôt friables. La concentration de géosmine était différente entre les deux unités. Aucune corrélation n‘a été observée entre les paramètres physico-chimiques et la concentration de géosmine. Cependant, certains paramètres (concentration de phosphore, quantité de solides en suspension) pourraient avoir un influence dans ce cas-ci. L‘apparition du mauvais goût chez le poisson élevé en RAS peut donc être influencée par la moulée utilisée.
v
Table des matières
Résumé ... iii
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... ix
Avant-propos ... xi
CHAPITRE 1 ... 1
REVUE DES TRAVAUX ANTÉRIEURS ... 1
1. Introduction ... 2
2. L’aquaculture ... 2
2.1 L’aquaculture internationale ... 2
2.2 L’aquaculture au Canada ... 3
2.3 L’aquaculture au Québec ... 3
3. Poisson d’eau douce ... 4
3.1 La truite arc-en-ciel ... 4
4. Système d’aquaculture ... 5
4.1 Système d’aquaculture ouvert ... 5
4.2 Système d’aquaculture en recirculation ... 5
5. Problèmes de mauvais goût en aquaculture ... 6
5.1 Historique de la problématique ... 7
5.2 Micro-organismes producteurs des composés responsables du mauvais goût ... 9
6. Composés responsables du mauvais goût ... 11
6.1 Géosmine ... 12
6.2 MIB (2-méthylisobornéol) ... 12
6.3 Dynamique d’absorption et d’épuration des molécules du mauvais goût ... 13
7. Paramètres influençant l’apparition des molécules du mauvais goût ... 15
8. Méthode d’analyse de la géosmine/2-MIB ... 16
9. Solutions apportées au problème de mauvais goût ... 16
10. Problématique ... 18
10.1 Hypothèses ... 19
10.2 Objectifs ... 20
CHAPITRE 2 ... 21
IMPACT OF DIET ON PERFORMANCE OF RAINBOW TROUT (ONCORHYNCHUS
MYKISS) AND OFF-FLAVOUR DEVELOPMENT IN A RECIRCULATING
AQUACULTURE SYSTEM ... 21
ABSTRACT ... 22
RÉSUMÉ ... 22
1. Introduction ... 24
2. Materials and Methods ... 25
2.1 Experimental system ... 25
2.2 Measured growth parameters ... 28
2.3 Fillet preparation and quantification of off-flavour compounds in fish flesh ... 29
2.4 Lipid analysis of fish fillet ... 29
2.5 Physicochemical analyses ... 29
vi
3. Results ... 30
3.1 Growth ... 30
3.2 Geosmin analysis ... 32
3.3 Lipid analysis ... 33
3.4 Water analysis ... 34
4. Discussion ... 38
5. Conclusion ... 40
References ... 41
Conclusion générale ... 49
Références ... 51
vii
Liste des tableaux
Table 2.1 : Chemical composition of experimental diets ... 27
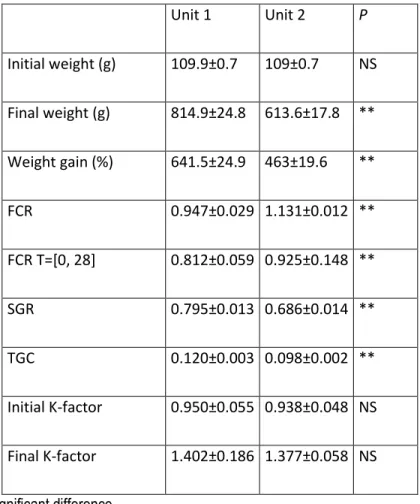
Table 2.2 : Growth parameters ... 32
ix
Liste des figures
Figure 2.1. Schematic representation of the RAS ... 26
Figure 2.2. Fish growth curves for the 252 days study ... 31
Figure 2.3. Concentration of geosmin in rainbow trout flesh for the 252 days study ... 33
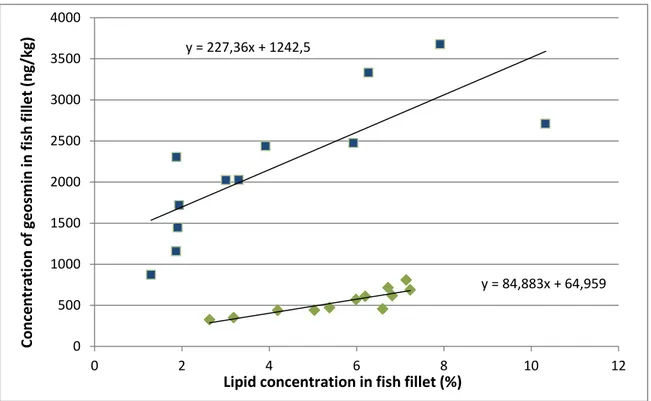
Figure 2.4. Comparison between the lipid concentration and the geosmin concentration ... 34
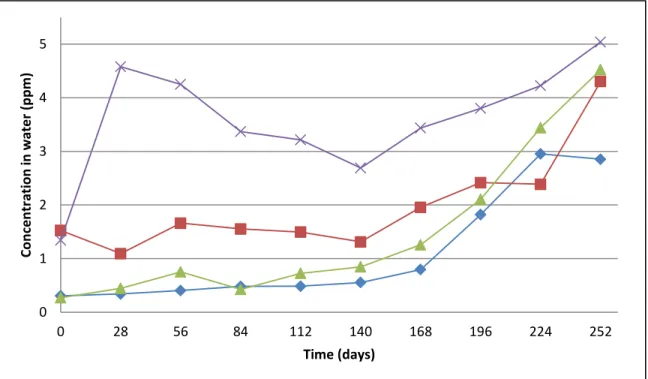
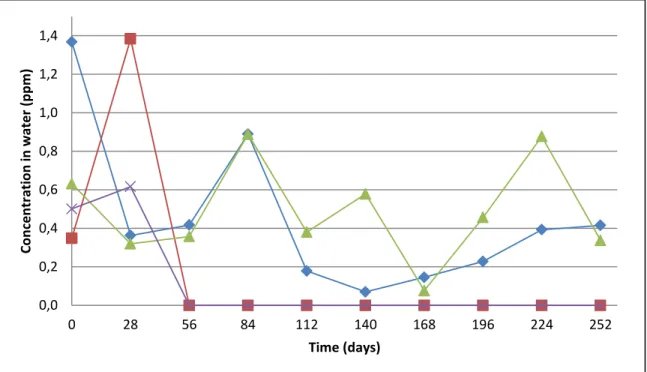
Figure 2.5. Evolution of nitrate, chloride and sodium concentrations in the water ... 35
Figure 2.6. Evolution of sulfate, calcium and magnesium concentration in the water ... 35
Figure 2.7. Evolution of phosphate and potassium concentration in the water ... 36
Figure 2.8. Evolution of nitrite and ammonium concentration in the water ... 37
xi
Avant-propos
Je tiens à remercier sincèrement mon directeur, le professeur Grant W. Vandenberg, pour la confiance qu‘il m‘a témoignée en me confiant ce projet. Également, je souhaite le remercier pour toutes les connaissances apprises lors de ces deux années tant au niveau théorique que pratique.
Je remercie Émilie Proulx pour son soutien, sa disponibilité et la résolution de nombreux problèmes tout au long de ma maîtrise.
Je remercie Pallab Sarker pour les nombreuses connaissances acquises notamment sur l‘aquaculture en général et les conseils de rédaction.
Je remercie Daniel Proulx et Annick Demanche pour leur contribution primordiale lors de la phase initiale du projet.
Je remercie Marc Auffret ainsi que le professeur Richard Villemur (INRS-Institut Armand-Frappier, Laval, QC, CA) pour leur précieuse collaboration et leurs conseils tout au long de l‘étude.
Je remercie Pascal Dubé (INAF – UL), Michel Bisping (Dép. génie civil – UL), Micheline Gingras (Dép. sci. animales – UL) et Nancy Bolduc (Dép. sci. animales – UL) pour leur aide technique en laboratoire.
Je remercie Annabella Bai, Sanja Risticevic et le professeur Janusz Pawliszyn (Univsersité de Waterloo, ON, CA) pour leur accueil lors de mon stage et pour l‘apprentissage reçu lors de mon passage.
Je remercie tous les employés du LARSA sans qui les expériences n‘auraient jamais vu le jour.
Je remercie les membres du groupe de recherche Vandenberg pour leur complicité et leur sincère amitié. Je remercie finalement ma famille pour le soutien qu‘elle m‘a témoignée pendant toutes mes études.
1
CHAPITRE 1
2
1. Introduction
L‘aquaculture désigne un élevage ou une culture de poissons, de crustacés, de coquillages, de reptiles, d‘amphibiens ou de plantes dans des bassins ou en mer qui permettent le contrôle de certains paramètres physiques amenant la récolte directe du produit. L‘aquaculture implique de cultiver des populations en eau douce ou en eau salée dans un environnement contrôlé comparativement à la pêche commerciale qui récolte les populations sauvages d‘organismes aquatiques. La culture se déroule dans des bassins artificiels, des lacs, des rivières ou en pleine mer. Les organismes sont nourris et soignés de façon à ce qu‘ils aient une bonne croissance et une bonne qualité à la vente. Lorsque les individus ont atteint une taille optimale, ils sont récoltés, transformés et expédiés pour la consommation et autres utilités. (MPO, 2011)
2. L’aquaculture
2.1 L’aquaculture internationale
La pêche commerciale et l‘aquaculture ont produit ensemble 142 millions de tonnes de poissons en 2008. Sur les 142 millions, 115 étaient destinés à la consommation humaine, ce qui constitue un record de 17 kg de poissons par habitant. En 2007, la population mondiale tirait des produits aquatiques 15,7 pour cent de l‘ensemble de ses apports en protéines d‘origine animale et 6,1 pour cent de sa consommation totale de protéines. Pour plus de 1,5 milliard de personnes à l‘échelle internationale, le poisson représente 20 pour cent de leur apport en protéines animales. (FAO, 2010)
De 2000 à 2008, la production totale de l‘aquaculture est passée de 32,4 millions de tonnes à 52,5 millions, soit une augmentation de plus de 61 %. De son côté, la production mondiale provenant de la pêche est demeurée relativement stable au cours des dix dernières années. (FAO, 2010) D‘après les prévisions de la FAO, durant l‘année 2012, la fraction de poisson provenant de l‘aquaculture à l‘échelle mondiale dépassera les 50 % pour la première fois. L‘aquaculture est la solution au problème de population toujours grandissante et d‘épuisement des stocks de poissons sauvages. (FAO, 2010)
L‘aquaculture est le domaine de production d‘aliments d‘origine animale le plus prospère et a même réussi à dépasser la croissance démographique. Les disponibilités de produits aquacoles venant de l‘aquaculture sont passées de 0,7 kg par habitant en 1970 à 7,8 kg en 2008. Cette augmentation constitue une hausse de 6,6 pour cent par année. La région de l‘Asie et du Pacifique produit pour 89 pour cent du volume de l‘aquaculture mondiale pour une valeur monétaire de 79 pour cent au niveau mondiale. La production de la Chine seule
3 représente 62 pour cent de la production totale en volume et 51 pour cent de la valeur totale de la production. (FAO, 2010)
2.2 L’aquaculture au Canada
Le Canada est au 23e rang mondial des producteurs aquacoles en ce qui à trait aux volumes de production. Quant à la valeur de production, le Canada se hisse au 20e rang mondial. Même si le Canada contribue pour moins de 0,3 % de la production aquacole mondiale, il se classe au 4e rang des producteurs de saumons d‘élevage. Le saumon est l‘espèce la plus élevée en aquaculture au Canada. Cette espèce représente 73 pour cent du volume de la production canadienne. Les autres espèces majeures sont les moules (14 %) et les huîtres (5 %). (MPO, 2009)
À l‘intérieur du pays, l‘aquaculture représente environ un tiers de la valeur totale des produits aquatiques. Cette valeur a plus que doublé entre 1997 et 2009, passant de 392 millions de dollars à 801 millions de dollars. La valeur économique brute totale générée par l‘aquaculture au Canada atteint 2,1 milliards de dollars. (MPO, 2009)
2.3 L’aquaculture au Québec
L‘aquaculture au Québec reste minoritaire comparativement aux pêches maritimes et d‘eau douce. La pêche maritime produisait 58 727 tonnes en 2009 pour une valeur de 119,7 millions de $ (M$). La pêche en eau douce, beaucoup moins, produisait 645 tonnes pour une valeur de 1,6 M$. L‘aquaculture produisait, pour la même année, 1 838 tonnes pour 12,3 M$. De ce montant, 11,2 M$ provient de la dulciculture (culture en eau douce) et 1,1 M$ de la mariculture (MAPAQ, 2011).
Le nombre d‘entreprise pratiquant la dulciculture au Québec a diminué dans les dernières années. Entre 2000 et 2007, une moyenne de 142 entreprises étaient toujours actives. Ce nombre était descendu jusqu‘à 100 en 2009. Par conséquence, la production a légèrement diminué entre l‘an 2000 et l‘an 2009, passant de 1 446 tonnes à 1 286 tonnes (MAPAQ, 2011).
La truite arc-en-ciel a été l‘espèce la plus cultivée durant la dernière décennie. Cependant, suite à une baisse de production, l‘omble de fontaine est maintenant l‘espèce la plus produite en aquaculture au Québec. Pour l‘année 2009, 651 tonnes d‘omble de fontaine ont été produites. La truite arc-en-ciel reste en deuxième
4
position avec 569 tonnes et suit l‘omble chevalier avec 51 tonnes. Le reste des poissons ne comptant que pour 15 tonnes (MAPAQ, 2011).
Pour la mariculture, le nombre d‘entreprises la pratiquant est plutôt stable aux alentours de 23. La production a légèrement augmenté durant les dernières années, passant de 517 tonnes en 2000 à 552 tonnes en 2009. La valeur économique du produit a également augmenté puisque la valeur totale de production par la mariculture est passé de 756 M$ à 1 052 M$ en 10 ans. La moule reste le facteur majeur dans cette industrie. Sur les 552 tonnes produites en 2009, les moules constituaient 522 tonnes pour un total de 679 M$ (MAPAQ, 2011).
3. Poisson d’eau douce
3.1 La truite arc-en-ciel
La truite arc-en-ciel est originaire de la partie est du Pacifique et des eaux douces à l‘ouest des montagnes Rocheuses. Au Canada, en plus de la Colombie-Britannique, son aire de distribution englobe Terre-Neuve, la partie sud de la Nouvelle-Écosse à l‘Ontario, le nord du Manitoba et de l‘Alberte et le Yukon. La truite arc-en-ciel est, à la base, une espèce d‘eaux froides. Cette espèce se divise principalement en deux sous-espèces dépendamment de leur habitat. Les truites de cours d‘eau préfèrent les rivières étroites, peu profondes dont le lit est graveleux. Les truites de lac préfèrent les lacs froids qui offrent des endroits moins profonds ainsi qu‘une végétation adéquate. Il faut également aux truites de lac l‘accès à une rivière à lit graveleux pour la fraie (MPO, 2010).
La truite arc-en-ciel fraie au printemps tout de suite après la fonte des neiges. L‘éclosion survient entre 4 et 7 semaines plus tard tout dépendant de la région et de l‘habitat. Ce poisson se nourrit normalement près du fond. La truite est un prédateur qui avale insectes aquatiques et terrestres, des crustacés, des œufs de poissons et autres petits poissons (MPO, 2010).
Le corps de la truite arc-en-ciel est long et fin et possède une bande irisée sur les flancs, de la tête jusqu‘à la queue. La couleur générale est plutôt variable, pouvant aller du bleu au jaune-vert, au brun ou au noir. La chair est blanche, légèrement teintée de rose. La saveur de la chair est délicate et légèrement sucrée (MPO, 2010).
5
4. Système d’aquaculture
4.1 Système d’aquaculture ouvert
Dans un système d‘aquaculture ouvert, l‘eau passe dans tout le système seulement une fois avant d‘être rejeté dans l‘environnement. Le débit d‘eau neuve entrant apporte de l‘oxygène aux poissons et permet d‘éliminer les matières en suspension et les différents déchets présents dans le système. La qualité de l‘eau est maintenue en jetant une partie de l‘eau constamment de sorte que les paramètres physico-chimiques tels l‘oxygène dissous, les concentrations en ammoniac et nitrites demeurent sous le seuil limite pour la culture des poissons (MAPAQ, 2006).
L‘emplacement de ces systèmes d‘aquaculture est dépendante de la disponibilité en eau puisque l‘élevage de poisson dans ce type de système requiert énormément d‘eau. Également, la température de l‘eau des bassins est dépendante de la température de l‘eau neuve. Cela limite le nombre d‘espèces cultivables dans les différentes régions du monde (MPO, 2010).
Ce sont les systèmes les plus utilisés mondialement puisqu‘ils sont faciles à administrer et le coût d‘installation est inférieur à d‘autres systèmes d‘aquaculture. Le fort débit d‘eau neuve est aussi la cause d‘introduction de différents pathogènes à l‘intérieur du système car le traitement de l‘eau neuve est coûteux et parfois inefficace (MPO, 2010).
4.2 Système d’aquaculture en recirculation
Les systèmes d‘aquaculture en recirculation (RAS) incorporent différentes technologies additionnelles dans le but de réutiliser l‘eau partiellement. Ces systèmes sont généralement utilisés lorsque, par exemple, l‘approvisionnement en eau est limitée, le risque d‘introduction de pathogènes ou de contaminants dans le système est élevée, la capacité d‘élimination des effluents est limitée ou encore que les opérateurs veulent pratiquer un contrôle strict sur la paramètres de l‘eau.
Ces systèmes sont caractérisés par une complexité technique accrue, des coûts en départ plus élevés et, dans certain cas, des coûts d‘exploitation également plus élevées. Cependant, parce que les RAS permettent des conditions de culture optimales pendant toute l‘année, indépendamment des fluctuations de la qualité de l‘approvisionnement en eau neuve, les taux de croissance peuvent être accélérés. Il est donc possible de produire plus de poissons ou de plus gros poissons dans le même laps de temps. Dans un système bien
6
conçu, les bénéfices de la production l‘emportent sur les coûts supplémentaires résultant en un coût net inférieur de la production (MPO, 2010).
Les RAS visent à maximiser la réutilisation de l‘eau en utilisant un système complet de traitement de l‘eau. Le processus de traitement de l‘eau comprend généralement l‘élimination des solides en suspension par filtration, la biofiltration pour diminuer les concentrations d‘ammoniac et de nitrites, un système de dégazage, d‘oxygénation et de désinfection. En ajustant chaque paramètre par une série de traitements à la place de remplacer l‘eau, il est donc possible d‘obtenir un contrôle optimal des différents paramètres physico-chimiques. (MAPAQ, 2006)
La qualité de l‘eau dans les RAS est tributaire de la complexité et du coût de l‘installation du système de traitement des eaux usées. Une meilleure qualité de l‘eau peut être fournie grâce à l‘utilisation de procédés supplémentaires de traitement. Un système de recirculation typique fournit une recirculation maximale de l‘eau entre 95 et 99 % du débit du système tout en conservant des paramètres idéals pour les poissons. Un équilibre doit être atteint dans la conception du système entre les objectifs de qualité de l‘eau et les coûts des systèmes de traitements (MAPAQ, 2006).
Les réglementations de plus en plus sévères pour l‘utilisation de l‘eau et les exigences environnementales concernant le traitement des eaux usées nous laissent croire à un changement dans la production aquacole. De nouvelles avenues technologiques doivent être explorées pour s‘ajuster à ces nouvelles contraintes. Les coûts de production en circuit ouvert augmenteront suite à ces nouvelles normes, ce qui rapprochera les coûts de production en circuit ouvert de ceux en systèmes de recirculation. Les productions à grande échelle en systèmes de recirculation n‘occupent pas une grande place pour l‘instant, mais cette technologie progresse et elle constitue une voie de l‘avenir en aquaculture (Morin, 2002).
5. Problèmes de mauvais goût en aquaculture
En aquaculture, le contrôle de certains paramètres permet de cultiver des organismes et d‘obtenir une croissance optimale. Cependant, une conséquence importante de notre incapacité à contrôler parfaitement l‘environnement est que l‘animal est porté, de temps à autre, à développer des saveurs non voulues appelées « mauvais goût » (Tucker et Martin, 1991; Haard, 1992). Ce mauvais goût est principalement causé par la géosmine et le 2-méthylisobornéol. Ce sujet sera traité à la section 6.
7 La capacité à détecter les saveurs désagréables à d‘importantes implications au niveau de la survie de l‘être humain puisque cela nous permet d‘évaluer la qualité de la nourriture avant de l‘avaler. Certaines odeurs causées par la détérioration bactérienne peuvent nous indiquer que la denrée est impropre à la consommation même s‘il en est rien. Même si les bactéries ne sont pas pathogènes, il est possible que l‘odeur repousse le consommateur. D‘un autre côté, l‘absence de goût inhabituel dans la nourriture ne permet pas de conclure sur le fait que la denrée est exempte de toxine. Nos sens ne sont donc pas parfaits pour l‘évaluation de la toxicité d‘une denrée. Comme pour l‘exemple du mauvais goût en aquaculture, il est causé par des molécules non-toxiques présentes en infimes concentrations à l‘intérieur de la chair de poisson (Diogini et al, 1993; Nakajima et al, 1996).
Le mauvais goût acquis lors du la croissance du poisson n‘est donc pas relié à la sécurité alimentaire ou à d‘autres facteurs qui influent la croissance et la santé du poisson. Ce problème de mauvais goût affecte grandement les qualités organoleptiques du poisson, ce qui affecte par la suite l‘acceptabilité et le développement du marché. Les produits de l‘aquaculture sont en concurrence avec les produits de la pêche ainsi que d‘autres sources protéiques d‘origine terrestre qui coûtent souvent moins cher. Si les produits possédant un mauvais goût sont commercialisés, le consommateur peut associer ce goût au secteur en général et ne plus vouloir acheter de produit aquacole. Il se tournera donc vers les produits de la pêche tels les fruits de mer, par exemple, ou encore la volaille, le porc ou le bœuf (Tucker, 2000).
5.1 Historique de la problématique
La plupart des problèmes reliés aux saveurs et aux odeurs dans le milieu aquatiques sont causés par des métabolites bactériens et sont décrits comme étant « vaseux », « terreux », « boueux » ou « moisi ». Déjà en 1550, Conrad Gesner a noté dans son traité « Vollkommes Fisch-Buch » que la tanche Tinca tinca acquérait de temps à autre un goût rappelant la boue de fond d‘étang. Deux siècles plus tard, Bloch notait que la carpe Cyprinus carpio acquérait un goût boueux qui pouvait être supprimé en conservant le poisson pendant plusieurs semaines dans de l‘eau propre. Cette observation est remarquable puisque la dépuration en eau fraîche est encore la méthode la plus fiable pour la gestion du mauvais goût chez le poisson (Persson, 1995). Léger (1910) a fait la première contribution importante pour la compréhension de la cause des problèmes du mauvais goût. Il spéculait qu‘une substance relâchée par des amas de cyanobactéries (algues bleues-vertes) Oscillatoria tenuis serait la cause du goût boueux présent chez la truite arc-en-ciel Oncorhynchus mykiss. Le rôle des cyanobactéries dans le processus de mauvais goût chez les poissons a été supporté également par Cornelius et Brandt (1933), qui attribuaient le mauvais goût à la présence de différentes espèces
8
d‘Oscillatoria, des cyanobactéries. Plus tard, Thaysen et Pentelow (1936) ont associé le goût terreux retrouvé dans certains saumons atlantiques Salmo salar capturés en Écosse avec des bactéries actinomycètes qui poussaient dans des lits de roseaux en décomposition. Ils avançaient même qu‘un composé devait être relâché par les bactéries et qu‘il était absorbé à travers les branchies pour ensuite se disperser dans les différents tissus sanguins. Cette théorie sera acceptée plusieurs années après. Ces mêmes chercheurs ont mené une expérience qui visait à cultiver du poisson dans des bassins contenant des cultures d‘actinomycètes. Ils ont ensuite démontré que les poissons perdaient de leur mauvais goût après avoir été transférés dans un bassin d‘eau potable (Tucker, 2000).
L‘identification des agents chimiques responsables du mauvais goût a dû attendre l‘apparition de meilleures techniques de séparation analytiques. Dans le milieu des années 1960, Nancy Gerber et ses collègues de l‘université Rutgers ont utilisé la relativement nouvelle technique de chromatographie sur phase gazeuse afin d‘identifier la géosmine et le 2-méthylisobornéol. Ces deux métabolites étaient les plus communs retrouvés dans les cultures d‘actinomycètes (Gerber et Lechevalier, 1965). Dans une étude de 1969, Aschner et son équipe ont conclu que la cyanobactérie Oscillatoria était associée au mauvais goût terreux de la carpe commune cultivée dans des étangs en Israël. Ils ont suggéré que le poisson obtenait ce goût d‘un composé présent dans l‘eau ou encore en mangeant des biofilms de cyanobactéries. Également, ils notaient que le problème de saveur pouvait être atténué en ajoutant un algicide dans les bassins d‘élevage (Tucker, 2000). Quelques années plus tard, des saveurs reconnues comme étant « terreux ou moisi » ont été détectées dans la barbue de rivière cultivée dans des étangs en Alabama (Lovell et Sackey, 1973) et dans le Kansas (Maligalig et al., 1973). Le mauvais goût retrouvé dans les poissons de l‘Alabama a été révélé comme provenant de la géosmine produite par des cyanobactéries (Lovell et al., 1986). Des apparitions de mauvais goût chez ce même poisson sont apparues au Mississippi. Dans ce cas-ci, le 2-méthylisobornéol a été découvert comme étant la principale cause (Martin et al., 1988; van der Ploeg et al., 1992).
Pour ce qui est des systèmes d‘aquaculture en recirculation, plusieurs évidences ont amené à croire, dernièrement, que le problème de mauvais goût serait également présent dans ces systèmes (Masser et al., 1999; Schrader et al., 2005). Le problème de mauvais goût à l‘intérieur des RAS serait également dû à l‘absorption de géosmine et de 2-MIB par le poisson (Schrader et al., 2005; Guttman and van Rijn, 2008; Schrader and Summerfelt, 2010; Houle, 2011).
9
5.2 Micro-organismes producteurs des composés responsables du mauvais goût
Certaines études affirment que la source principale de MIB/géosmine dans l‘eau en général sont les cyanobactéries (algues bleues) (Watson, 2004; Watson et al., 2008). Des études ont aussi démontré que le MIB/géosmine peut provenir de certains types de bactéries filamenteuses ou d‘actinomycètes (Zaitlin and Watson, 2006). Ces bactéries synthétisent le MIB/géosmine durant leur croissance et ces cellules les relâchent ou les accumulent tout dépendant de la phase de croissance et également des différents paramètres environnementaux. La grande majorité de ces deux composés est relâché durant la mort des bactéries et la dégradation de ces cellules. Les épisodes de mauvais goût sont plus fréquents lorsque les conditions sont eutrophiques, quand il y a surabondance de nutriments et que la température est élevée. Ces conditions amènent une prolifération de bactéries dans l‘eau résultant en une production de MIB/géosmine.
Dans le domaine de l‘aquaculture, la géosmine et le MIB sont produits, généralement, par les même micro-organismes qui sont abondants dans ce genre d‘environnement, soit les cyanobactéries et les actinomycètes (Zaitlin et Watson, 2006; Smith et al., 2008; Schrader et Summerfelt, 2010). Récemment, Guttman et van Rjin (2008) ont observé un grand relâchement de MIB dans le matériel du biofiltre et ont conclu que ce composé était produit par une souche de Streptomyces, un actinomycète.
En plus des cyanobactéries et des actinomycètes, la production de géosmine/MIB peut arriver chez certains types de mycètes (Jüttner et Watson, 2007). Wood et al. (2001) faisait la même conclusion quant aux mycètes. En plus, une production de géosmine a été confirmée chez certaines espèces de myxobactéries, comme chez Myxococcus fulvus (Yamamoto et al., 1994), Stigmatella aurantiaca (Dickschat et al., 2005), et Chondromyces crocatus (Schulz et al., 2004). Même si les espèces de myxobactéries sont normalement associés aux environnements terrestres, des souches de myxobactéries ont été isolés à partir de systèmes d‘aquaculture (Carlson et Pacha, 1968; Yamamoto et al., 1994). De la géosmine a même été détectée dans le développement de certaines espèces de Penicillium. (Larsen et al., 1994, 1995)
5.2.1 Cyanobactéries
Les cyanobactéries sont des micro-organismes aquatiques présentant d‘un côté des caractéristiques d‘algues et, de l‘autre, des caractéristiques de bactéries. Ces bactéries ont besoin de beaucoup de nutriments pour croître tels le phosphore et l‘azote. La prolifération de ces bactéries peut être déclenchée par plusieurs facteurs comme le faible mouvement de l‘eau, la température élevée de l‘eau et la stagnation de celle-ci. Lorsque la prolifération des cyanobactéries est rapide, il est possible de voir à l‘œil nu la formation de « fleurs
10
d‘eau », allant du bleu-vert au rouge. Ces amas de cyanobactéries produisent parfois des odeurs désagréables. À l‘extérieur, ces bactéries sont plus nombreuses vers la fin de l‘été et en automne. Certaines espèces produisent des toxines dépendamment des conditions environnementales. Certaines toxines peuvent nuire à santé des animaux et des humains suite à la consommation d‘eau contaminée. (MAPAQ, 2008) Les cyanobactéries (algues bleues) possèdent plusieurs avantages concurrentiels sur les eucaryotes (algues) ce qui leurs permettent de dominer dans des systèmes où il y a beaucoup de nutriments et de lumière. Parmi ces avantages, on retrouve la capacité de stocker des nutriments et d‘utiliser la lumière comme source d‘énergie (Dittmann et Wiegand, 2006). Certaines espèces peuvent même convertir l‘azote gazeux et l‘ammoniac et l‘utiliser comme source d‘azote (Stewart, 1967). Encore une fois par rapport aux eucaryotes, la structure de la paroi cellulaire des cyanobactéries permet la réduction des dépenses énergétique due au transport actif de certains ions (Raven, 2003).
Des vacuoles de gaz à l‘intérieur des cellules permettent aux cyanobactéries d‘ajuster leur position dans la colonne d‘eau. De cette façon, il est possible pour ces bactéries de se laisser flotter à la surface pour recevoir plus de lumière ou de tomber plus profondément pour avoir accès à plus de nutriments. Le fait de pouvoir descendre dans la colonne d‘eau permet également aux cyanobactéries d‘éviter les dommages causés par une trop forte luminosité (Walsby et Booker, 1980; Klemer et al., 1996). Les cyanobactéries sont également capables de synthétiser de la chlorophylle α et de la phycocyanine (Whitton et Potts, 2000). Ce sont ces composés qui apportent la couleur particulière des cyanobactéries.
Les cyanobactéries sont considérés par certains comme la source principale de composés causant le mauvais goût de l‘eau et, par le fait même, le mauvais goût chez le poisson (Jüttner, 1995). Parmi les cyanobactéries présentes en aquaculture des souches d‘Oscillatoria agardhii, Oscillatoria perornata, Raphidiopsis brookii et Microcystis aeruginosea ont été isolées de systèmes d‘élevage de poisson-chat (Schrader et Dennis, 2005). Une étude anglaise a permis de relier l‘apparition du mauvais goût chez la truite arc-en-ciel d‘élevage avec l‘augmentation du nombre de bactéries Oscillatoria. (Robertson et al., 2006)
5.2.2 Actinomycètes
Les actinomycètes, eux aussi, ont été associés à de nombreuses reprises à des épisodes de mauvais goût chez le poisson. Comme les cyanobactéries, les actinomycètes synthétisent une large gamme de composés volatiles susceptibles d‘altérer l‘odeur de l‘eau et le goût du poisson (Gerber, 1979). La saveur « terreuse » retrouvée chez le saumon atlantique pêché dans certaines rivières Écossaises étudiées provenait
11 principalement d‘actinomycètes d‘après Thaysen en Pentelow (1936). Également, en 1975, Silvey et Roach présentaient avec une certaine évidence que des actinomycètes étaient la cause de problèmes d‘odeur et de saveur à l‘intérieur de réservoirs dans le sud-ouest américain. D‘un autre côté, certaines recherches avancent que les actinomycètes sont relativement inactives dans la plupart des environnements aquatiques (Johnston et Cross, 1976; Cross, 1981). Également, ces études avançaient que la contribution des actinomycètes aux problèmes d‘odeur était principalement le résultat du drainage des bactéries et de leurs métabolites dans l‘eau à partir de zones près du littoral principalement après de fortes pluies.
Différentes espèces de Streptomyces, une famille d‘actinomycètes, ont été observées plusieurs fois dans des systèmes d‘aquaculture. Ces bactéries sont largement distribuées dans les habitats terrestres et aquatiques et ont un intérêt commercial unique du fait qu‘elles sont capables de produite une grande quantité de composés bioactifs (Pathom-aree et al., 2006). Les espèces de Streptomyces sont rencontrées dans une vaste étendue d‘environnements, principalement parce qu‘elles sont capables de produire des spores qui sont rapidement dispersés (Anthony-Babu et al., 2008). Cette capacité les avantage sur d‘autres espèces bactériennes en ce qui concerne la colonisation de l‘environnement disponible.
Les communautés bactériennes de certaines sources d‘eau douce et de systèmes d‘aquaculture contenaient différentes espèces d‘actinomycètes capables de produire de la géosmine et du 2-MIB selon une étude de 2005. Dans ce cas-ci, les actinomycètes représentaient environ 3 % de toute la communauté bactérienne présente. (Klausen et al., 2005). Dans une autre étude récente, des chercheurs ont isolé d‘un système d‘aquaculture en recirculation deux souches de streptomyces qui s‘apparentaient fortement à Streptomyces roseoflavus et Streptomyces thermocarboxydus. Le système était utilisé pour l‘élevage de tilapias hybrides (croisements entre deux espèces de tilapias). Les deux souches bactériennes ont été analysées en laboratoire et la production de géosmine et de 2-MIB a été confirmée pour les deux souches (Guttman and van Rijn, 2008).
6. Composés responsables du mauvais goût
L‘apparition de cyanobactéries, d‘actinomycètes ou de tous autres producteurs du mauvais goût entraîne à tout coup la prolifération de composés responsables du mauvais goût chez le poisson. Les deux composés majeurs du mauvais goût sont la géosmine et le 2-MIB. Plusieurs études ont démontré que la présence de ces composés dans l‘eau était principalement un désavantage au niveau esthétique, mais qu‘ils n‘étaient pas associés officiellement à des problèmes de santé (Dionigi et al., 1993). La présence de géosmine et de 2-MIB n‘a pas non plus été corrélée avec la présence de toxines produites par des cyanobactéries qui peuvent être
12
très toxiques même à de faibles concentrations (Zimmermann et al., 2002). De ce fait, il n‘y a pas de concentration maximale de contamination par la géosmine ou le 2-MIB. Plusieurs études où la géosmine et le 2-MIB avaient été détectés à l‘intérieur de la chair de poisson ont conclu que ces molécules n‘étaient pas toxiques pour le poisson ainsi que pour l‘humain qui consomme ce poisson (Schulz et al., 2004; Robertson et al., 2006).
6.1 Géosmine
L‘une des substances majeures responsables de l‘odeur vaseuse et terreuse de l‘eau et du mauvais goût du poisson est la géosmine. Ce nom provient du grec ―ge‖ pour terre et ―osme‖ pour odeur. La géosmine est un alcool tertiaire bicyclique qui a une odeur caractéristique de terre et de vase dans des solutions aqueuses (MPO, 2010). La géosmine porte aussi le nom scientifique de trans-1,10-dimethyl-trans-(9)-decalol.
Il semble y avoir quelques variations dans l‘établissement de la limite de détection humaine pour la géosmine à l‘intérieur de la chair de poissons. Cependant, selon Robertson et al. (2005), la limite de détection de la géosmine à l‘intérieur de la truite arc-en-ciel serait d‘environ 0,9 μg/kg. Dans l‘eau, le seuil de détection est beaucoup plus bas. Le seuil de détection de la géosmine dans l‘eau serait d‘approximativement 1,3 ng/L (Pirbazari et al., 1992).
Même si la géosmine est non-toxique pour les humains (Schulz et al., 2004; Robedson et al., 2006), il est possible que l‘ingestion de cette molécule soit reliée à différents effets comme des maux de têtes, du stress ou des douleurs à la poitrine (Young et al., 1996).
En ce qui concerne la chimie de la molécule, la géosmine est hydrophobe et possède un coefficient de partition octanol/eau de 3,57 (log Kow) (Howgate, 2004). Par ailleurs, l‘énantiomère (-)-géosmine a été démontré comme étant la forme naturelle du produit (Wherkoff et al., 1991). Dans l‘eau, cet énantiomère possède un seuil de détection humaine 11 fois inférieur à l‘énantiomère (+)-géosmine (Polak et al., 1992). L‘hydrophobie de la molécule est importante dans le contexte de l‘aquaculture puisque la géosmine ne se concentrera pas dans l‘eau, mais bien dans les tissus lipidiques du poisson.
13 Le 2-méthylisobornéol ou 2-MIB ou MIB est également un alcool bicyclique tertiaire. Ce produit était initialement connu comme un produit synthétique préparé exclusivement par la méthylation du camphre. Par après, le produit a été identifié comme un composant naturel des sols et des habitats aquatiques de l‘ensemble du globe. Le 2-MIB porte également le nom scientifique de 1,2,7,7-tetraméthyl-exo-bicyclo[2.2.1.]heptan-2-ol. L‘odeur « moisi » du 2-MIB est difficile à décrire à l‘intérieur de solutions aqueuses diluées, mais à des concentrations plus élevées, l‘odeur du camphre prend le dessus de façon bien distincte (Tucker, 2000).
Le seuil de détection humaine dans l‘eau est d‘environ 0,04 μg/L (Persson, 1979), ce qui est plus élevé que le seuil de la géosmine. Le MIB serait donc « moins odorant » que la géosmine. Inversement, la saveur du 2-MIB dans la chair de poisson est détectée plus facilement (concentration 10 fois inférieur) par un panel d‘experts que la saveur de géosmine. Un expert peut détecter le 2-MIB à une concentration d‘environ 0,1 μg/kg chez le brochet Esox lucius et d‘environ 0,6 μg/kg chez la truite arc-en-ciel (Persson, 1980). Comme pour la géosmine, l‘habileté à détecter le 2-MIB dans l‘eau et dans la chair de poisson varie grandement entre les différentes personnes. Chez le poisson-chat, un panel a estimé que le seuil d‘acceptabilité du consommateur est d‘environ 0,7 μg/kg de 2-MIB dans la chair (Johnsen et Kelly, 1990).
6.3 Dynamique d’absorption et d’épuration des molécules du mauvais goût
Bien que l‘ingestion de bactéries contenant de la géosmine ou du 2-MIB intracellulaire par des poissons puisse mener à une apparition de mauvais goût, ce n‘est pas la première cause de ce problème. La majeure partie vient de l‘absorption des composés dans l‘eau (From et Horlyck, 1984). Cette absorption se fait principalement par les branchies, mais également par la peau et par le tube digestif lors de l‘ingestion accidentelle d‘eau lors de l‘alimentation par exemple. La structure et la fonction des branchies font d‘elles des échangeurs de composés efficaces entre le sang et l‘eau des bassins. Les composés absorbés par les branchies sont apportés par le sang et concentrés dans les tissus riches en lipides (Johnsen et Lloyd, 1992). La vitesse d‘absorption de la géosmine chez le poisson-chat à 25°C est décrite comme suit selon Lelana (1987).
Concentration de géosmine dans la chair (μg/kg) = 0,55 + 2,38(G) + 0,23(t) + 2,68(G)(t)
où G est la concentration de géosmine dans l‘eau d‘élevage en μg/L et t est le temps d‘exposition dans cette eau en heures. Cette équation possède des limites puisqu‘elle ne prend pas en compte la concentration de
14
lipides dans la chair du poisson et la température de l‘eau. Ces deux derniers paramètres sont connus pour avoir une influence dans l‘accumulation de substances lipophiles chez le poisson (Murty, 1986).
De leur côté, Jonhsen et Lloyd (1992) ont exposé des poissons-chats d‘une grosseur commercialisable (> 0,5 kg) dans de l‘eau contenant 0,5 μg/L de 2-MIB. Le mauvais goût apparaissait chez le poisson après seulement 2 heures, mais l‘intensité augmentait durant 24 heures pour atteindre un maximum où l‘équilibre était atteint. Dans cette étude, où la température de l‘eau était de 25°C, l‘absorption était visiblement affectée par la concentration en lipides des différents poissons. Les poissons plus gras pouvaient absorber plus de trois fois plus de 2-MIB que les poissons contenant moins de gras (< 2% de lipides). Néanmoins, quand les essais ont été menés à différentes températures, l‘effet de la température de l‘eau est apparu plus importante que la concentration de lipides (Johnsen et al., 1996). Les chercheurs ont obtenu le modèle suivant pour des poissons-chats exposés à de l‘eau contenant 1,0 μg/L.
2-MIB dans la chair de poisson (μg/kg) = -0,61 + 4,2 [log(t+1)] + 0,0076(°C)(t) + 0,089(°C) où t est la durée d‘exposition en heures et °C est la température de l‘eau.
Ce modèle démontre que la température de l‘eau a non seulement un impact sur la vitesse d‘absorption, mais également sur la concentration finale de 2-MIB.
Les poissons éliminent plus facilement le 2-MIB que la géosmine. Des études (Martin et al., 1988; Johnsen et Lloyd, 1992; Johnsen et al., 1996) indiquent que le 2-MIB peut être éliminé du poisson-chat maintenu en eau tiède en moins de 3 jours. Les vitesses d‘épuration sont influencées par la température de l‘eau et le pourcentage de gras. Également, une étude de Robertson (2005) concluait sur le fait que pour des poissons de masse et de contenus en lipides similaires maintenus dans un environnement de même température, le temps d‘épuration sera directement relié à la concentration initial de géosmine dans la chair.
Certaines évidences semblent montrer que la biotransformation serait au cœur de l‘élimination du 2-MIB par le poisson. Des études (Schlenk, 1994; Schlenk et al., 1995) ont démontré des variations d‘expressions du système enzymatique cytochrome P450 monooxygénase du rein et du foie de poisson-chat qui était maintenu dans de l‘eau contenant du 2-MIB. Ces enzymes sont bien connus comme étant importantes dans la métabolisation et l‘élimination de composés chimiques chez plusieurs espèces.
15
7. Paramètres influençant l’apparition des molécules du mauvais
goût
Le nombre de bactéries présentes dans un système d‘aquaculture est influencé par de nombreux paramètres. Également, tout dépendant des paramètres physico-chimiques, les bactéries vont relâcher plus ou moins de géosmine et de 2-MIB.
Des expériences in vitro ont été menées pour déterminer l‘impact de différents paramètres physico-chimiques sur la croissance d‘une espèce d‘Anabaena, une cyanobactérie. Ces résultats auraient pu être différents avec une autre espèce bactérienne. La concentration maximale de géosmine par biomasse a été enregistrée à une température de 20°C et avec une intensité lumineuse de 17 μE/m2/s. À une température fixe (20°C), une augmentation de l‘intensité lumineuse favorisait la synthèse de géosmine. Pour ce qui est de l‘azote, une plus grande concentration sous forme d‘ammonium ou de nitrites favorisait également la prolifération d‘Anabaena. Le phosphate-P influençait également le nombre de bactéries si bien qu‘il n‘y avait pas de détection de géosmine lorsque la concentration de phosphate-P était inférieure à 118 μg/L. Pour le Cu2+, la relation était inversée. Aucune détection de géosmine n‘a été faite lorsque la concentration de Cu2+ était supérieure à 6,92 μg/L (Saadoun, 2001).
D‘autres études ont confirmé la relation entre la présence de phosphore et la concentration de géosmine. Une étude anglaise a identifié une corrélation positive entre la température, la concentration de phosphore et la concentration de géosmine dans l‘eau d‘un système d‘élevage de truite arc-en-ciel (Robertson, 2006). Dans une autre étude comprenant l‘élevage de truite-arc-en-ciel, l‘augmentation de solides en suspension ainsi que de certains nutriments comme l‘azote et le phosphore totaux favorisaient la croissance des cyanobactéries et l‘apparition de géosmine dans les bassins d‘eau douce (Robin, 2006).
En 2009, plusieurs paramètres physico-chimiques ont été analysés dans 5 différents réservoirs d‘eau douce dans la région du Kansas et les scientifiques n‘ont établi qu‘une seule corrélation avec l‘apparition de mauvais goût chez le poisson. La production de géosmine par les bactéries serait influencée par la concentration de phosphore inorganique. Lorsque le phosphore est en concentration insuffisante, la prolifération des bactéries serait limitée (Dzialowski, 2009). Une étude portant sur des bassins de traitement des effluents d‘une usine à papier rapporte que des cyanobactéries ont été détectées et qu‘elles étaient responsables de mauvaises odeurs dans ces bassins. La production de géosmine était corrélée à la température de l‘eau et la production de 2-MIB à la concentration d‘azote dans les bassins (Watson, 2003).
16
8. Méthode d’analyse de la géosmine/2-MIB
L‘analyse de la géosmine/2-MIB était faite par des techniques analytiques conventionnelles à la fin des années 80. Bien que des méthodes telles le « Purge and trap » et l‘extraction liquide-liquide était efficace, elles étaient coûteuses en plus de demander beaucoup de temps et de travail (Lloyd et al., 1998). Ceci à mener au développement de méthodes basées sur les membranes pour des mesures plus précises de ces composés odorants. La méthode HFSA pour « hollow fiber stripping analysis » utilisait une membrane possédant des micropores hydrophobes ce qui permettait de mesurer des concentrations allant jusqu‘au ppt, soit 10-12 (Zander et Pingert, 1997). Néanmoins, le montage des appareils était complexe et impliquait plusieurs instruments. Dans le même genre, l‘extraction sur phase solide (SPE) rendait possible l‘analyse de faibles concentrations, mais possédait les mêmes points négatifs que la HFSA. En 1996, une nouvelle méthode nommé micro-extraction sur phase solide (SPME) a été utilisée pour mesurer des polluants organiques, plus précisément des composés organiques volatiles (VOCs) comme le benzène et le toluène (Eisert et Levsen, 1996). Cette méthode emploi une fibre de silice pour l‘extraction des contaminants dans l‘espace de tête d‘un échantillon suivi par une injection dans un chromatographe sur phase gazeuse et d‘un spectromètre de masse pour l‘analyse. Comme la SPE, cette méthode ne requiert aucune extraction avec des solvants et la procédure d‘analyse est simple et rapide. Contrairement à la SPE, la fibre SPME peut être réutilisée plusieurs fois. Depuis ce temps, un bon nombre d‘études ont été faites dans le but d‘optimiser l‘analyse de géosmine/2-MIB dans l‘eau à l‘aide de la fibre SPME et c‘est maintenant la méthode standard reconnue (Lloyd et al., 1998; Zimmerman et al., 2002; Chang et al., 2008; Saito et al., 2008). Lloyd et al. (1998) ont comparé la technique SPME-GC à la technique P&T-GC pour l‘analyse de géosmine/2-MIB. Ils en concluent que la précision et la limite de détection obtenus avec la SPME était comparable aux résultats obtenus par P&T, mais que l‘analyse par SPME était plus rapide et pouvait être faite avec de plus petits échantillons. Des essais d‘optimisation de cette technique ont permis d‘abaisser la limite de détection à des concentration en-dessous de 0,4 ng/L (Chang et al., 2008).
9. Solutions apportées au problème de mauvais goût
Plusieurs études ont tenté de trouver une solution au problème de mauvais goût présent en aquaculture. L‘approche souvent utilisée est de retirer les molécules de géosmine/2-MIB des systèmes avant que ces composés soient absorbés par le poisson.
Des traitements conventionnels tels la coagulation, sédimentation et filtration ont été testés. Ces traitements peuvent être efficaces pour retirer une partie des cellules bactériennes, mais sont inefficaces pour enlever des systèmes les composés produits par ces bactéries (Guttman, 2009; Ando, 1992), tels la géosmine et le 2-MIB.
17 Il serait également possible de dégrader la géosmine et le 2-MIB avec l‘aide des ultrasons. Le taux de dégradation serait stable entre des concentrations allant de 10 μg/L à 1 mg/L. Ces tests ont été réalisés sur de faibles volumes d‘eau en laboratoire. Par contre, l‘application de cette technologie sur des systèmes d‘élevage à grande échelle serait onéreuse et l‘efficacité difficile à évaluer (Song, 2007).
L‘oxydation de la géosmine/2-MIB par des produits chimiques tels que l‘ozone ou le chlore ne serait pas entièrement efficace et, de plus, entraînerait une seconde contamination des systèmes (Chow, 1998; Lalezary, 1986; Anselme, 1988).
Le processus de biodégradation connu sous le nom de biofiltration requiert une période de temps significative pour l‘acclimatation et serait trop variable tout dépendant des micro-organismes présents dans le système (Ho, 2007; McDowall, 2007; Sugiura, 2003).
Même la photocatalyse a été utilisée à l‘aide du dioxyde de titane (TiO2) comme catalyseur. Cette technique a permis de détruire complètement la géosmine d‘un échantillon en 1 heure. La concentration initiale était d‘environ 2 μg/L (Lawton, 2003; Robertson et al., 2011). Encore une fois, les chercheurs ne savent pas si ce processus pourrait être utilisé à grande échelle en aquaculture.
Les granules ou la poudre de charbon activé possède des avantages comme une grande surface de contact et leur efficacité à adsorber des composés comme la géosmine/2-MIB. Ces matériaux sont encore difficiles à utiliser considérant leur coût élevé, leur courte durée d‘utilisation, leur perte d‘efficacité en contact avec du matériel organique (Newcombe et al., 1997; Cook et al., 2001) et la formation de boues toxiques causées par des produits chimiques résiduels (Newcombe et al., 2002; Pendleton et al., 1997; Suffet et al., 1995). Également, lorsqu‘utilisé en poudre, ce matériel est très dur à séparer de l‘eau une fois qu‘il a adsorbé la géosmine/2-MIB. Finalement, la difficulté à régénérer le charbon pour de nouvelles utilisations amène l‘utilisateur à ajouter de plus en plus de charbon dans le système. Ellis (1993) a étudié une zéolithe de type Y et a conclu que ce composé avait la même efficacité d‘adsorption que le charbon activé. Le projet n‘est pas allé plus loin en ce qui concerne l‘aquaculture.
Selon Chen, 2011, l‘utilisation de pastilles adsorbants en céramique peut enlever environ 80% de la géosmine contenue dans l‘eau en 10 heures. Le problème demeure le même, c‘est-à-dire que leur utilisation coûte cher et que cela demande du temps pour la régénération de leur efficacité. Récemment, d‘autres adsorbants/absorbants comme le polymère synthétique de cyclodextrine (Mamba et al., 2007; Mhalanga et al., 2007) ou encore le caoutchouc (Kelly et al., 2006) ont été testé. Les résultats semblaient prometteurs selon les auteurs, mais les projets n‘ont pas donné de solution concrète au problème de mauvais goût en aquaculture.
18
Il serait possible d‘enlever plus de 75 % de la géosmine et du 2-MIB en utilisant la nanofiltration. La qualité de l‘eau n‘aurait pas d‘influence sur l‘efficacité de la filtration. Le pourcentage de filtration des 2 composés ne semblaient pas augmenté avec le temps par contre. L‘efficacité était la même si on filtrait 10 ou 80 heures (Dixon, 2011). D‘autres études doivent être faites pour confirmer cette technologie.
Un groupe de recherche suisse a même amené l‘idée qu‘il faudrait déterminer la distribution spatiale (dissoute dans l‘eau ou encore liée aux différentes particules) de la géosmine afin de traiter efficacement les différents cours d‘eau. Par exemple, l‘adsorption à l‘aide de carbone activé serait plus efficace lorsque la géosmine est dissoute dans l‘eau (Durrer, 1999).
L‘ozone a aussi été utilisé pour diminuer les populations bactériennes. Différents paramètres différaient comme la dose injectée, le temps de contact et la combinaison ou non avec une lumière ultra-violette (Summerfelt, 2003; Sharrer et Summerfelt, 2007; Summerfelt et al., 2008, 2009a,b). L‘ozone a également servi pour réduire les composés causant le mauvais goût dans l‘eau potable (Terishima, 1988; Nerenberg et al., 2000; Park et al., 2007). Ces expériences ont été concluantes, mais la concentration d‘ozone injecté était de beaucoup supérieure à ce qui peut être utilisé en système d‘aquaculture. L‘usage de l‘ozone, à des concentrations qui apportent une amélioration aux systèmes en recirculation, mais qui est insuffisante pour désinfecter complètement l‘eau s‘est avéré inefficace pour réduire la concentration de géosmine/2-MIB (Schrader et al., 2010).
10. Problématique
Le problème de mauvais goût est bien réel en aquaculture et est maintenant reconnu comme étant un problème majeur dans les systèmes d‘aquaculture en recirculation (RAS). Aucune solution n‘a encore été trouvée pour palier à ce problème. Les différentes solutions proposées sont soit trop coûteuses ou ne peuvent être appliquées à grande échelle. La solution utilisée par l‘industrie, encore de nos jours, est l‘épuration du poisson avant la mise en marché. Cette activité consiste à placer le poisson en eau fraîche pendant quelques jours (semaines) pour que la concentration en géosmine/2-MIB dans la chair de poisson diminue jusqu‘à un niveau non-détectable. Par contre, ce processus a ses désavantages. Premièrement, le transfert des poissons dans un autre bassin demande du temps et de la main d‘œuvre. Le temps passé en bassin d‘épuration entraîne des retards dans les commandes et les consommateurs se tournent quelques fois vers un autre marché par insatisfaction. Aussi, la période d‘épuration, durant laquelle le poisson perd du poids, entraîne des coûts dû à la mortalité de certains individus (maladie et prédation). Pour donner un exemple, l‘industrie du poisson-chat aux États-Unis subit des pertes potentielles de revenu d‘environ 30 % causées par la nécessité
19 de ces périodes d‘épuration (Smith et al., 2008). L‘industrie serait gagnante si les poissons pouvaient être commercialisés sans passer par cette phase d‘épuration.
La plupart des solutions proposées au problème de mauvais goût en aquaculture travaille à enlever la géosmine/2-MIB des systèmes d‘élevage. Lorsque les micro-organismes sont en trop grands nombres, il semble difficile d‘empêcher la géosmine/2-MIB à s‘accumuler dans la chair de poisson. Avant de tenter d‘enlever la géosmine/2-MIB des systèmes, il pourrait être intéressant d‘étudier l‘impact des paramètres de l‘eau sur la prolifération bactérienne. Plusieurs paramètres physico-chimiques semblent influencer le nombre de bactéries présentes dans les systèmes.
Dans les systèmes d‘aquaculture en recirculation, la moulée utilisée a un impact direct sur la différents paramètres physico-chimiques de l‘eau. Tout en respectant les besoins nutritionnels des poissons, il pourrait être possible d‘influencer la qualité de l‘eau en utilisant différents types de moulées. Pour cette étude, deux moulées commerciales seront étudiées. L‘une des moulée est reconnue pour produire des fèces plus compactes tandis que l‘autre est reconnue pour donner des fèces plus friables. La friabilité des fèces pourrait avoir un impact sur la concentration des solides en suspensions dans les bassins et, par le fait même, sur la concentration de micro-organismes producteurs du mauvais goût.
10.1 Hypothèses
- Il est possible de produire du poisson exempt de mauvais goût à l‘intérieur de systèmes d‘aquaculture en recirculation en contrôlant les différents paramètres physico-chimiques de l‘eau.
- Une moulée causant plus de solides en suspension dans l‘eau entraînera une plus grande prolifération de micro-organismes producteurs de molécules de mauvais goût et, par le fait même, une plus grande concentration de géosmine/MIB dans la chair de poisson élevé dans des RAS.
20
10.2 Objectifs
- Étudier les effets de deux moulées différentes sur l‘apparition du mauvais goût chez le poisson élevé dans des RAS.
- Identifier des paramètres susceptibles d‘influencer la prolifération de micro-organismes producteurs et, du même coup, d‘augmenter la production de géosmine/MIB.
21
CHAPITRE 2
IMPACT OF DIET ON PERFORMANCE OF
RAINBOW TROUT (ONCORHYNCHUS MYKISS)
AND OFF-FLAVOUR DEVELOPMENT IN A
RECIRCULATING AQUACULTURE SYSTEM
22
ABSTRACT
This study aimed to determine the dietary influence on the appearance of off-flavour and to identify physic-chemical parameters that are correlated to the proliferation of geosmin and 2-methylisobornoel (MIB) in Recirculating aquaculture systems (RAS). Rainbow trout fed two different commercial diets (n = 4 tanks/diet/unit) for 252 days then fish growth, geosmin, MIB and physic-chemical parameters were determined. The mean fish weight in Unit 1 (814.9 g) was significantly (p=0.0011) higher than Unit 2 (613.6 g). The specific growth rate (SGR) and thermal-growth coefficient (TGC) were 0.79 and 0.12 for Unit 1 and 0.68 and 0.09 for Unit 2, respectively. The feed conversion ratio (FCR) was 0.94 for Unit 1 and 1.13 for Unit 2. The final concentration of geosmin in Unit 2 was 2181.6 μg/kg, significantly (p<0.0001) higher than Unit 1 (540 μg/kg). The MIB was not found in either Unit at any of the sampling time points. Potassium concentration remains higher (more than 2-fold at some sampling times) in Unit 2 versus Unit 1. The concentration of phosphate increased until the end of the study to a maximum of 4.52 ppm in Unit 2. Suspended solids (turbidity) and phosphate concentration are critical in the process of proliferation of geosmin producers. The types (biochemical composition) of diet can have an influence on the performance of rainbow trout and the appearance of off-flavour in a recirculating aquaculture system.
RÉSUMÉ
Cette étude a pour but de déterminer l‘influence de la ration sur l‘apparition de mauvais goût et d‘identifier les paramètres physico-chimiques qui sont corrélés à la prolifération de géosmine et de 2-méthylisobornéol (MIB) dans un système d‘aquaculture en recirculation (RAS). Des truites arc-en-ciel ont été nourries avec deux moulées commerciales différentes (n = 4 bassins/moulée/unité) durant 252 jours pendant que la croissance, la concentration de géosmine et de MIB ainsi que différents paramètres physico-chimiques étaient mesurés. Le poids moyen des poissons de l‘Unité 1 (814,9 g) était significativement (p=0,0011) plus élevé que ceux de l‘Unité 2 (613,6 g). Le coefficient spécifique de croissance (SGR) et le coefficient de croissance-thermique (TGC) étaient de 0,79 et 0,12 pour l‘Unité 1 et de 0,68 et 0,09 pour l‘Unité 2, respectivement. L‘indice de consommation (FCR) était de 0,94 pour l‘Unité 1 et de 1,13 pour l‘Unité 2. La concentration finale de géosmine dans l‘Unité 2 était de 2181,6 μg/kg, ce qui est significativement (p<0,0001) plus élevée que celle de l‘Unité 1 (540 μg/kg). Le MIB n‘a pas été détecté dans les deux unités, et ce, pour chaque échantillonnage durant toute la durée de l‘expérience. La concentration de potassium est demeurée plus élevée (plus de deux fois plus
23 élevé pour certains échantillonnage) dans l‘Unité 2 que dans l‘Unité 1. La concentration de phosphate a augmenté durant tout l‘expérience jusqu‘à la fin de l‘étude pour un maximum de 4,52 ppm dans l‘Unité 2. Les solides en suspensions (turbidité) et la concentration de phosphate sont critiques dans le processus de prolifération des micro-organismes producteur de géosmine. Les composantes de la moulée (composition biochimique) peuvent avoir une influence sur la performance de la truite arc-en-ciel ainsi que sur l‘apparition de mauvais goût dans un système d‘aquaculture en recirculation.
24
1. Introduction
Recirculating aquaculture systems (RAS) are systems in which a high percentage of water is re-used after undergoing treatment (Rosenthal et al., 1986), resulting in 100-fold reduction in water consumption versus traditional flow through systems (Blancheton et al., 2007). Furthermore the treatment waste water is more effective as waste components are more concentrated and thus more efficiently removed (Léonard, 2000; Pagand, 1999; Piedrahita, 2003). Also, the absence of biological containment issues (Zohar et al., 2005) and facilitated disease management (Tal et al., 2009) are other advantages of RAS.
Geosmin and 2-methylisoborneol (MIB) are two of the major compounds that give an earthy or musty flavor and odour to water. These problems occur in drinking water supplies (Watson, 2004) and in many RAS facilities (Tucker, 2000). When these compounds are released in the water of aquaculture systems, they are absorbed through the gills, skin and gastrointestinal tract and accumulate in lipid tissues (Howgate, 2004). A number of microorganisms such as cyanobacteria (Ludwig et al., 2007), actinomycetes (Klausen et al., 2005) and myxobacterial species (Dickschat et al., 2005) can produce these off-flavour compounds. Recently, several studies reported problems of off-flavour for artic charr (Salvelinus alpinus) and rainbow trout (Oncorhynchus mykiss) raised in RAS (Guttman and van Rijn, 2008; Schrader and Summerfelt, 2010; Schrader et al., 2010; Houle et al., 2011; Auffret et al., 2011). Several solutions have been suggested but none has completely resolved the problem of off-flavour. Conventional treatments including coagulation/sedimentation/filtration (Guttman and van Rijn, 2009; Ando, 1992), sonication (Song, 2007), activated carbon (Newcombe, 1997; Cook, 2001) and ozonation (Schrader et al., 2010) have all been studied as means of off-flavour compound removal in RAS. However these technologies are either too expensive, not effective enough or not widely applicable in commercial aquaculture systems. To date, most of the research to resolve off-flavour problems revolves around efforts to find solutions to remove the off-flavour compounds from water. An alternative approach would seek to control the proliferation of micro-organisms by altering water parameters. In this study we hypothesized that the type of diet fed to fish raised in RAS impacts the water parameters and thus may impact the proliferation of off-flavour-producing microorganisms.
The objective of our study was to compare the influence of two different diets on the appearance of off-flavour and to identify physicochemical parameters that are correlated to the proliferation of geosmin and MIB in RAS.
25
2. Materials and Methods
2.1 Experimental system
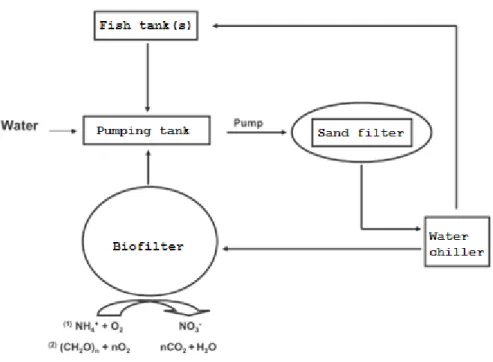
The indoor RAS Units were located in the Laboratoire Régional des Sciences Aquatiques (LARSA, Université Laval, QC, Canada have been previously described ( Auffret et al. 2011)). The two identical systems included four fish tanks per Unit for a total water volume of 1.5 m3 (Figure 2.1). The flow of makeup water was fixed at 20 L/h for a retention time of 3.5 days. The makeup water was from a municipal source, dechlorinated and filtered (45 μm). Mechanical filtration and UV treatment were applied to remove organic matter and to eliminate pathogenic strains. The oxygen concentration (90-100% saturation) and water temperature (15.0°C ± 0.4°C) were monitored in real-time for all the experiment. The pH (7.4 ± 0.4) was measured once daily and sodium carbonate was added to maintain pH. Prior to the innoculation of a denitrifying bacterial consortium to the trickling biofilter or the introduction of fish, the RAS Units were sterilised by adding calcium hypochlorite to the water system to remove organic matter and to eliminate existing bacterial populations. Sodium thiosulfate was then introduced to deactivate sodium hypochlorite, and the system water was flushed. The biofilter (3m height) was composed of an expanded polystyrene support as a biofilm media and was obtained directly from the manufacturer (Aquabiotech, Coaticook, QC, Canada) and was inoculated with one liter of a commercial nitrification/denitrification/mineralization bacterial consortium (Bacta-Pur® N3000, IET-Aquarecherche Ltée, North Hatley QC, Canada). Following establishment of stable biofilter bacterial population, 100 rainbow trout (Oncorhynchus mykiss) per tank were introduced to the RAS; fish biomass in RAS Units was maintained at 25 kg/m3 by harvesting excess fish every 28 days.
26
Figure 2.1. Schematic representation of the RAS. Solid arrows indicate the direction of the water flow. The chemical reactions for nitrification and mineralisation in the biofilter compartment are indicated. Not drawn to scale.
The fish were fed with two commercial feeds. 4-mm feed size was used from day 0 to day 42 in both Units and 6-mm feed size was used from day 42 to day 252. Four tanks received feed type #1 in Unit 1 and the other four received feed type # 2 in Unit 2. The composition of these diets is described in the Table 2.1. Fish were fed with automatic feeder 5 days per week, except Friday and Saturday, with the same amount of feed in both Units. System sand filters were backwashed five times per week to remove the accumulated solids and were scheduled on the days that followed the fish feeding.
27 Table 2.1 : Chemical composition of experimental diets
Commercial feed # 1 Commercial feed # 2
4 mm 6 mm 4 mm 6 mm Dry matter (%) 94,55 ± 0,14 93,23 ± 1,88 93,63 ± 0,20 93,5 ± 0,81 Protein (% DM) 60,38 ± 1,01 49,73 ± 0,24 47,03 ± 0,43 47,02 ± 0,11 Lipid (%) 20,68 ± 0,1 23,26 ± 0,28 18,49 ± 0,02 20,53 ± 0,76 Ash (%) ** 4,71 ± 0,33 5,37 ± 0,23 6,82 ± 0,19 6,94 ± 0,06 Energy (KJ/g) * 25,7 ± 0,0 25,3 ± 0,1 23,4 ± 0,1 23,6 ± 0,0 K (% DM) * 0,38 ± 0,02 0,41 ± 0,04 0,67 ± 0,03 0,74 ± 0,04 Mg (% DM) ** 0,12 ± 0,00 0,12 ± 0,01 0,19 ± 0,01 0,19 ± 0,00 P (% DM) * 0,76 ± 0,01 0,88 ± 0,06 0,96 ± 0,06 1,04 ± 0,01 SO4 (%) 0,29 ± 0,03 0,34 ± 0,02 0,48 ± 0,01 0,42 ± 0,03 Na (% DM) * 0,45 ± 0,02 0,35 ± 0,05 0,48 ± 0,04 0,42 ± 0,03 Ca (% DM) 1,01 ± 0,02 1,30 ± 0,15 1,31 ± 0,10 1,30 ± 0,01 Cu (%) 0,0010 ± 0,0002 0,0011 ± 0,0004 0,0007 ± 0,0002 0,0013 ± 0,0003 Mn (%) * 0,007 ± 0,007 0,003 ± 0,000 0,011 ± 0,003 0,010 ± 0,001 Fe (%) 0,026 ± 0,005 0,018 ± 0,004 0,021 ± 0,004 0,023 ± 0,002 Zn (%) * 0,015 ± 0,003 0,010 ± 0,001 0,012 ± 0,002 0,015 ± 0,001
Fish from Unit 1 were fed with feed #1 and fish from Unit 2 with feed #2. The 4-mm feed size was given from T=0 to T=42 in both Units. The 6-mm feed size was given from T=43 to T=252.
* represent significant difference with p-value < 0.05 ** represent significant difference with p-value < 0.01
Differences are between 6-mm commercial feed #1 and 6-mm commercial feed #2 because we used these diets for the important part of the experiment.
28
2.2 Measured growth parameters
The specific growth rate (SGR) was calculated as follows: SGR = 100 (ln wf – ln wi ) number of days-1
with wi and wf as the initial and final mean body weight of fish, respectively.
The thermal-unit growth coefficient (TGC) was calculated as follows (Koko et al., 2010): TGC = 100 (wf1/3 – wi1/3) (sum degree day) -1
with wi and wf as the initial and final mean body weight of fish, respectively. Also, the sum degree day is the multiplication between the average temperature and the numbers of day. For example, 10 days at 30°C is 300.
The Fulton condition factor (K) was calculated as follows (Koko et al., 2010): K = W L-3
with W and L as the mean body weight and mean body length, respectively.
The feed conversion ratio (FCR) was calculated as follows: FCR = total feed consumed / total weight gain