Université de Montréal
CARACTÉRISATION DE
PAA,UN NOUVEAU FACTEUR DE VIRULENCE CHEZ ESCHERJ
CHIA COU
par
SÉBAsTIEN LEcLERc
Département de pathologie et microbiologie
Faculté de médecine vétérinaire
Mémoire présenté à la Faculté des études supérieures
en vue de l’obtention du grade de
Maître ès sciences (M.Sc.)
en sciences vétérinaires
option microbiologie
Décembre, 2005
cfl
V
oDirection des bibliothèques
AVIS
L’auteur a autonsé l’Université de Montréal à reproduire et diffuser, en totalité ou en partie, par quelque moyen que ce soit et sur quelque support que ce
soit, et exclusivement à des fins non lucratives d’enseignement et de recherche, des copies de ce mémoire ou de cette thèse.
L’auteur et les coauteurs le cas échéant conservent la propriété du droit d’auteur et des droits moraux qui protègent ce document. Ni la thèse ou le mémoire, ni des extraits substantiels de ce document, ne doivent être imprimés ou autrement reproduits sans l’autorisation de l’auteur.
Afin de se conformer à la Loi canadienne sur la protection des renseignements personnels, quelques formulaires secondaires, coordonnées ou signatures intégrées au texte ont pu être enlevés de ce document. Bien que cela ait pu affecter la pagination, il n’y a aucun contenu manquant.
NOTICE
The authot of this thesis or dissertation has granted a nonexclusive license allowing Université de Montréal to reproduce and publish the document, in part or in whole, and in any format, solely for noncommercial educational and research purposes.
The author and co-authors if applicable retain copyright ownership and moral rights in this document. Neither the whole thesis or dissertation, not substantial extracts from it, may be printed or otherwise reproduced without the author’s permission.
In compliance with the Canadian Privacy Act some supporting forms, contact information or signatures may have been removed from the document. While this may affect the document page count, it does not represent any Ioss of content from the document.
Faculté des études supérieures
Ce mémoire intitulé
Caractérisation de Paa, un nouveau facteur de virulence chez Escherichia cou
Présenté par
$ébastien Leclerc
a été évalué par un jury composé des personnes suivantes
Michael Mourez, président rapporteur Josée Harel, directrice de recherche
J. Daniel Dubreuil, codirecteur Patrick Boerlin, membre du jury
Résumé
Le gène pua, pour porcine uttaching effacing associated, aété montré nécessaire dans la formation des lésions AE dans un modèle ex vivo pour la souche PEPEC 045 ECI100I. Une étude de la distribution de pua chez E. colla montré qu’il est présent chez les PEPEC, les ETEC, les REPEC (rabbit EPEC) et chez les EHEC 0157. Le gène pua encode pour une protéine de 27.6 kDa identique à Paa chez les souches EHEC 0157:H7 (EDL933 et Sakai), et est homologue à 51,8 et 49 % avec PEB3 chez Campvlobacter jejuni et AcfC chez Vibrio cho/erae, respectivement. Dans la première partie de ce mémoire, l’association de paa avec d’autres facteurs de virulence spécifiques des ETEC, sa conservation génétique ainsi que son expression ont été étudiées chez une collection de souches ETEC 0149 pou-positives. Les 37 souches de cette étude possèdent estB, cli. asiA et /aeG et plus de la moitié des souches possèdent estA, définissant deux pathotypes principaux: pua, estB, eÏt, astA, faeG, estA et pcia, estB, elt, astA,faeG. La majorité des souches possèdent tetA, tetB (les gènes impliqués dans la résistance à la tétracycline) ou les deux. Le gène pua est porté sur plasmides de haut poids moléculaire de 3$ à 204 en association avec estA encodant pour l’entérotoxine STa, sepA encodant pour une protéine autotransporteur et moins fréquemment avec tetA. De plus, Paa, une protéine de 30 kDa est très conservée et exprimée chez les souches ETEC testées. La présence de vestige de séquence d’insertion dans la séquence de pua ETEC et celle de PEPEC et EHEC, suggère que ta séquence de pua dériverait d’un ancêtre conimun. Toutes ces observations suggèrent un rôle plus large dans la virulence pour pua que celui observé précédemment. Dans la deuxième partie de ce mémoire, le but était de déterminer la localisation de la protéine Paa. Nos résultats montrent que Paa se localise principalement dans le périplasme. Deux techniques différentes ont montré que Paa était dans le périplasme, confirmant sa localisation prédite par bioinformatique (PSORTb) et la prédiction d’un peptide signal Sec-dépendant. De plus, nos résultats montrent que Paa est impliquée dans la régulation de l’expression des effecteurs dépendant du système de sécrétion de type trois (SSTT), EspA et EspB, et Tir chez deux souches EPEC de porc et de lapin.
Mots clés: EscÏierichia cou entéropathogêne, Escherichia cou entérotoxigène, facteurs de virulence, antibiotiques. Locus of enterocyte effacement. effecteurs, porcs.
Abstract
paa for porcine attaching effacing associated was shown to be required for A/E lesions formation ex vivo in 045 PEPEC strain EcilOOl. A study ofthe distribution ofpaa has shown that it is found in PEPEC, REPEC (rabbit EPEC), ETEC as weII as in ail EKEC 0157 strains tested. paa open reading frame encodes a 27.6-kDa protein which is identical to Paa ofenterohemorrhagic E. cou 0157:H7 strains (EDL933 and Sakai), and shares 51.8% and 49% hornology with PEB3, a major antigen of CampvÏobacter jejuni and AcfC, a gene product of the Vibrio choÏerae accessory colonization factor, respectively. In the first part ofthis work, the association ofpaa with other ETEC virulence genes, its conservation and expression were investigated in the 0149 ETEC collection. Ah 37paa-positive strains possessed estB, cl,’, astA and faeG and more than haif also carried the estA gene, defining two main virotypes: estA and esiA. Most strains carried tetA, tetB, or both.The gene paa is carried on high molecular weight plasmids of 32 to 204 kb in association with estA gene for heat-stable enterotoxin, sepA gene for an autotransporter protein and, less frequently, with tetA for tetracycline resistance. In addition, Paa, a 30-kDa protein is highly conserved and expressed in these strains. Moreover, paaETEC and PEPEC/EHEC contain IS signatures suggesting that paa could be derived from a common ancestor. Ahi these observations suggest a broader rohe than previously assessed in virulence for paa. In the second partof this work, the aim was to determine the localization of Paa. Previous studies have shown that PEB3 is acid extractable in C. jejuni and that AcfC is secreted by V choÏerae indicating that they localized at the celi surface. Our resuits show that most of Paa is localized in the bacteriai peliet and that only few Paa molecules are observed in culture supernatant. Two different techniques permit the isolation of Paa from the periplasm, confirming its bioinformatics localization prediction. This study also shows that Paa is implicated in regulation of TTSS dependent secreted effectors EspA and EspB in two EPEC strains as they are produced in smahler amount in paa mutant strains than in their wild type strains.
Keywords: Enteropathogenic Escherichia cou, Enterotoxigenic Escherichia cou,
Table des matières
Résunié iii
Abstract y
Table des matières vii
Liste des tableaux x
Liste des figures xi
Liste des sigLes et abréviations xii
Remerciements xv
Section I- Introduction 1
Problématique 2
Objectifs 3
Section II- Recension de littérature 4
1 Escherichia cou 5
1.1 E. COLIENTÈROTOXINOGÈNES(ETEC) 5
1.2 E. COLIENTÈROPATHOGÈNES(EPEC) 6
1.3 E. COLJENTÉROHÉMORRAGIQUES(EHEC) 7
1.4 E.COL]ENTÉROAGREGATIFS (EAGGEC) 8
1.5 E. COL!ENTÉROFNVASIFS(EIEC) $
1.6 E. COLIÀADHÉRENCE DIFFUSE(DAEC) $
2 E. cou entérotoxinogènes 9 2.1 GÉNÉRALITÉs 9 2.2 FACTEuRs DE VIRULENCE 9 2.2.1 Fimbriae 9 2.2.2 Toxines 15 2.2.3 Curli 19
2.2.4 Autres facteurs de virulence 19
2.3 ETECO149 20
3 E. cou de type attachant effaçant (AEEC) 21
3.1 GÉNÉRALITÉs 21
3.2 LDHÉRENCE LOCALISÉE 22
3.3 SÉCRÉTIoNDE PROTÉINES 23
3.4 ATTACI-IEMENT INTIME ET RÉARRANGEMENT DU CYTOSQUELETTE 24
3.1.1 Formationdu piédestal 24
3.1.2 Transduction desig1aux etdiarrhée 25
3.5 FACTEuRs DE VIRULENCE 27
3.5.2 EJfrcteurs . 3]
3.5.3 EspC et îlot de pathogénicité espC 32
3.5.4 $higa- like toxines 33
3.5.5 p0]57 34
3.5.6 Plasmide EAF (EPEC Adherence Factor) 35
3.6 E. GOLf ENTÉROPATHOGÈNE PORCIN(PEPEC) 045 36
4 Projetpaa 37
4.1 DÉCOUVERTEDEpaa 37
4.1.1 PEB3 38
4.].2 AcJC 38
4.2 EPIDÈIvUOLOGIE DEpuaCHEZ LES SOUCHESE. GOLf 39
4.3 LOCALIsATIoNGÉNÉTIQUE 39
4.4 LOCALISATION CELLULAIRE ET ANALYSE DE LA PROTÉINE 40
Section 1H- Méthodologie et Résultats 42
Article # 1: 43
Implication de l’auteur dans cet article 44
Paa, originally identified in attaching and effacing E. cou, is also associated with
porcine 0149 enterotoxigenic E. coli 45
Abstract 47
Introduction 4$
Materials and rnethods 50
Results 53
Discussion 5$
Acknowledgements 61
Legends 62
Tables and figures 63
References 71
Article #2: 74
Implication de l’auteur dans cet article 75
Paa localization in diarrheagenic Escherichia coli 76
Abstract 7$
Introduction 79
Materials and methods $0
Results 83
Acknowledgements .90
Legends 91
Figures 92
References 94
Section
W-Discussion
97I Localisation géllétiqzle et association avec des facteurs de virulence chez les
ETEC 98
2 Consen’atiol7 de paa chez les ETEC 100
3 Détection de ?aa chez les ETEC 101
4 Localisation cellulaire de Paa chez les E. coli entériques 101
5 Motjf de liaison ausulfate 105
6 Impact de Paa sur les protéines sécrétées par le système de sécrétion de type
trois ($STT) 105
Section V- Conclusion
10$
Perspectives 110
1 Rôle de Paa dans la pathogénie des EPEC et des ETEC 110
2 Vérifier comme17t Faa influence la production des protéines TTS$ dépendantes
110
3 Rôle global de Paa 110
Liste des tableaux
Section II: Méthodologie et résultats Article # I
TABLE I PCR primers for amplification ofpaa and flanking sequences 63
TABLE II Virulence and antimicrobial resistance genes of37paa 0149 ETEC strains 64
TABLE lii paaconservation in 370149 ETEC strains 65
TABLE IV Association of ETEC virulence genes andpaa on tetplasmids ofTett
Liste des figures
Section I- Introduction
Figure I: Pathotypes de E. cou selon Kaper et Nataro (2004) 6
Figure 2 : Organisation génétique de trois opérons encodatit des fimbriae retrouvés chez les
ETEC 11
figure 3: Facteurs de colonisation de E. cou 14
Figtire 4: Mécanismes d’action classiques des toxines des ETEC 1 6
Figure 5: Modèle dinfection des E. cou attachant effaçant 26
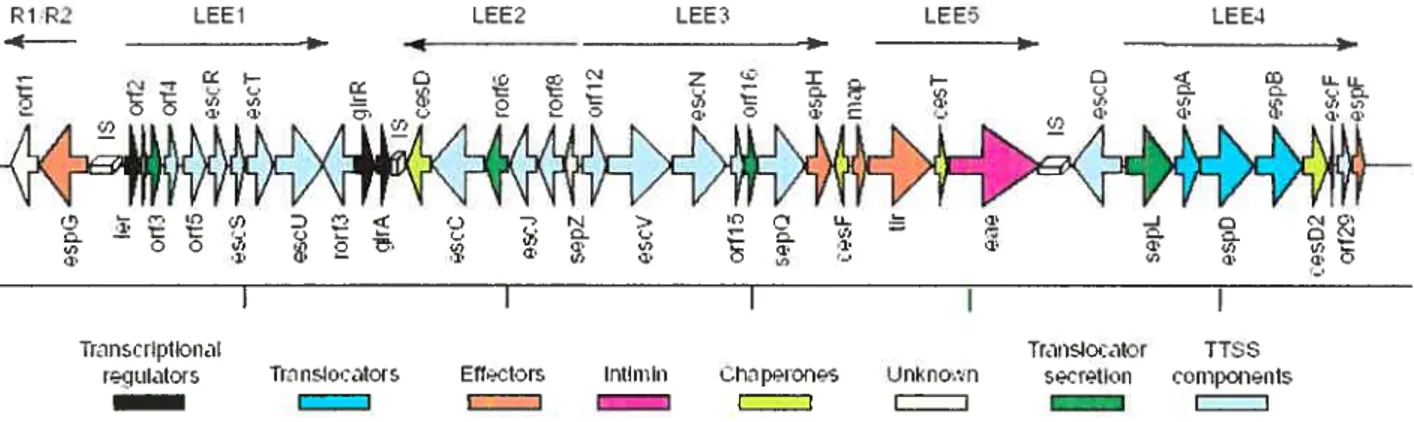
Figure 6: Schéma représentant les gènes du locus ofenterocyte effacement (LEE) 2$
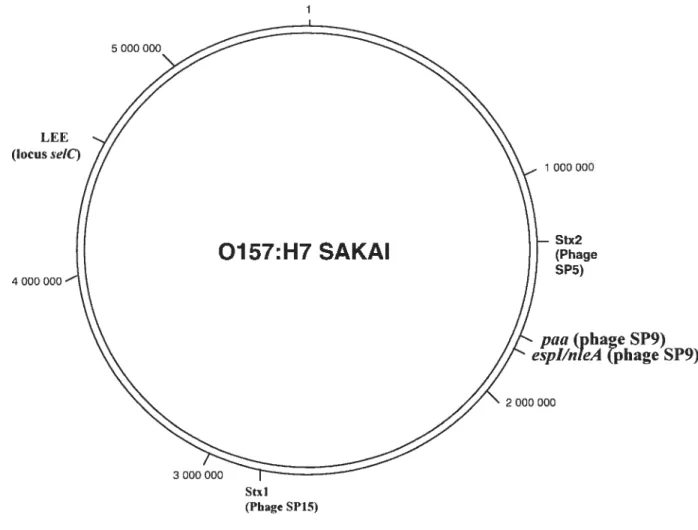
Figure 7: Génome de E. co110157:H7 Sakai 30
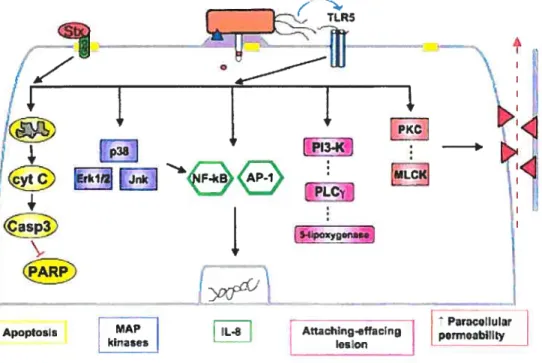
Figure 8 : Signalisation cellulaire suite à l’infection des EPEC/E1-IEC 34
Figure 9: Séquence de Paa chez les AEEC 40
Figure 10 : Environement génétique depaa chez les sottches EHEC 0157 :H7 Sakai et
EDL933 41
Section 11- Méthodologie et résultats Article # I
figure 1. Sequence ofpaa ofthe ETEC plasmid pTENT2 67
Figure 2. Conservation ofPaa sequence among ETEC strains 6$
Figure 3. paa is found on plasmids, associated with other virulence genes 69
figure 4. Presence ofPaa in periplasmic extracts ofETEC 70
Article # 2
Figure 1. Purification ofPaa 92
Figure 2. Bacterial fractionation ofthe strain M155c 92
Figure 3. Osmotic shock extraction ofdifferent E. cou strains 92
Figure 4. SDS-PAGE of secreted proteins of wild type, Paa mutant and complemented strains of
two AEEC strains 93
Figure 5. Western blot for IlS S-dependant secreted proteins 93
Section III- Discussion
figure 11: Schéma représentant l’inversion du génome chez 0157:H7 EDL933 par rapport à la
souche Sakai 99
Figure 12 : Alignement de PaaPEPEC avec SBP de Salmonella par le programme ClustalW...106
Liste des sigles et abréviations
ADN ou DNA Acide désoxyribonucléique: Desoxvribonz,cÏeic acid
AE Attachant et effaçant: Attaching ami effacing
AEEC E. cou attachant et effaçant: Attaching and effacing
E. cou
Acf facteur de colonisation accessoire: Accessorv
colonizationfactor
AIDA Adhésine impliquée dans l’adhérence diffuse:
Adhesin invoÏved in dffiise adherence
ARN-t Acide ribonucléique de transfert
Arp2/3 Complexe de protéines reliées à l’actine: Actin
related protein complex
ATP Adhenosine triphosphate
BFP Bundie-forming pilus
cAMP Adhenosine monophosphate cyclique
CfA Facteur de colonisation: Colonisation factor
CfTR Régulateur de la conductance transmembranaire de la
fibrose kistique: Çvsticflbrosis transmembrane conductance regitiator
Cm’ Résistanceau chlorarnphénicol
CS Antigène de surface de E. cou: Cou stuface antigen
CT Toxine du choléra
DAEC E. cou à adhérence diffuse: Dffitsely adhering E.
coli
DR Répétition directe: Direct repeat
E. cou Escherichia cou
EAF facteur adhésif des EPEC: EPEC adhesiffactor
EaggEC E. cou enteroaggregatif: Enteroaggregative E. cou
EASTÎ Entérotoxine thermostable des E. cou
entéroaggrégatif: Enteroaggregative heat-stable enterotoxin
EHEC E. cou entérohérnorrhagique: Enterohemorrhagic E.
cou
EIEC E. cou entéroinvasif: EnteroinvasjfE. cou
ERK1/2 Extracellular signal-regulated kinases
EPEC E. coli entéropathogène: Enteropathogenic E. cou
Esp Protéines sécrétées des EPEC: EPEC secreted
prote in
ETEC E. coli entérotoxinogène: Enterotoxigenic E. cou
FC facteur de colonisation
GC-G Guanylyl cyclase C
GTcNAc N-Acetylglucosamine
H-NS Protéine de type histone de structure du nucléoide:
Histone—Like NucÏeoid Strztcturil7g prote 117
Ris6 Queue poly-histidines: Ris-tag
HU S Syndrôme hémolytique urémique
1g Immunoglobuline
IHF Facteur d’intégration à l’hôte: Jntegration Host
Factor
IL Interleukine
1P3 Inositol triphosphate
IR Répétition inversée: hiveriedrepeat
IS Séquence d’insertion: Insertionsequence
kb Kilobase
kDa KitoDalton
LB Milieu L uria-Bertani: Luria-Bertw7i media
LEE Locus d’effacement des entérocytes: Locus of
enterocvtes ejjacement
Ler LEE-encoded regulator
LPS Lipopolysaccharide
LT Entérotoxine thermolabile: Heat-labile enterotoxin
Lrp Protéine répondant à la leucine: Leucil7e-responsive
protein
MDa MégaDalton
NF-kB Nctclear factor kappa B
N-WASP Wiskott-Aldrich syndrome protein
OD ou DO Densité optique: Optical densiti’:
0m
Durée d’une nuit: Oi’er tiightORF Cadre de lacture ouvert: Open readingframe
Paa Porcine aftaching effacing associated protein
PAGE Electrophorèse de gel d’acrytamide: Polvacrvlamide
gel electrophoresis
PCR Polymerase chain reaction
PBS Phosphate bzffer saline
PCR Polymerase chain reaction: réaction de
polymérisation en chaîne
Per Plasmid-encoded regulator
PhoA Phosphatase alkaline
pi Point isoélectrique
PKC Protéine kinase C: Protein kinase C
PMN Lymphocyte polymorphonucléés
rprn Révolution par minute
SBA Soy-bean aggiutinin
Sbp Sulfate binding protein
SDS Sodium dodecyl sulfate
SSTT Système de sécrétion de type trois: Tjpe three
secretion svsteni
STEC E. cou produisant La toxine Shiga: Shiga-like toxin
prodiicingE. cou
STxI Shiga-like toxin I
STx2 Shiga-like toxin 2
TCA Acide trichioroacétique: Trichioroacetic acid
TcR Résistance à la tétracycline
Tcp Toxin-corregulatedpi Ius
TMB Tetramethyl-benzidine
TnPhoA Transposon contenant le gène de la phosphatase
aikaline
INT Tris-Nacl-TWEEN
VASP Vasodilator-stirnulated phosphoprotein
Remerciements
Merci à:
- Dr Josée Harel qui m’a permis de réaliser ma maîtrise dans son laboratoire. Votre disponibilité, votre dévouement pour vos étudiants et votre recherche, votre grande connaissance scientifique ainsi que votre souci du détail sont des qualités que l’on reconnaît chez votts et qui font de vous une directrice exceptionnelle.
- Mon co-directeur, Dr Daniel Dubreuil, pour l’aide et la supervision toutau long des deux dernières années. C’est toujours enrichissant de discuter de science avec vous. Vous êtes aussi une source d’anecdotes inépuisable.
- Dr Michael Mourez pour ses judicieux conseils scientifiques et techniques. Ne lâchez pas, la prise!
- Dr John M. fairbrother pour l’aide et pour les souches sans lesquelles le projet
n ‘existerait pas.
- A nos collaborateurs, les Drs Patrick Boerlin et Carlton L. Gyles.
- Pour leur aide à un moment ou un autre du projet : Donald Tremblay, Francis
Girard, Josée Labrie, Isabelle Gaucher, Geneviève Dugas, Guillaume Bruant, Cécile Crost, Frédérick Berthiaume, Clarisse Desautels.
- A mon partenaire de lab, Martin Larnarche, pour tes conseils et tes opinions. - A ma douce Patricia pour son soutien, son aide et sa capacité de persuasion (C’est
grâce à toi si j’ai poursuivi mes études).
- A ma famille pour leur support, leur encouragement et leur compréhension.
- A Jacques et Claudelle pour leur encouragement et leur aide dans les différentes étapes de mes études.
Problématique
Chez les souches ETEC 0149 isolées des cas de diarrhée chez le porc, uiie analyse de l’évolution des virotypes et de la résistance aux antibiotiques de 197$ à 2000 a révélée une augmentation du nombre de souches multirésistantes (en particulier à la tétracycline) et Fapparition de nouveaux facteurs de virulence (Nadeau et al., en préparation, (64)). Un des facteurs de virulence le plus fréquement observé chez les ETEC depuis 1980 est paa, pour porcine attaching effacing associated gene. Ce gène a été trotivé conrnie étant impliqué dans l’adhésion de souches produisant les lésions de type AE dans un modèle ex vivo chez le porc (8)). Cependant, aucune expérience n’a été faite pour déterminer quel est l’impact de Paa sur la production des autres facteurs de virulence connus des souches AE. Une étude de la distribution de paa chez divers groupes de E. cou causant la diarrhée a révélé la présence de paa chez toutes les souches humaines d’E. cou 0157:H7, chez des souches animales EPEC et chez les souches porcines ETEC 0149 (2). Puisque les souches ETEC ne causent pas les lésions AE, la découverte de paa chez ces souches est surprenante puisque paa a été trouvé comme étant impliqué dans la production des lésions AE chez les PEPEC. Ceci soulève la question de son rôle chez les ETEC. De plus, paa a été découvert sur un plasrnid d’une sotiche ETEC de l’Ontario en association avec le gène de l’entérotoxine Sta (estA), le gène de SepA (sepA), une protéine autotransporteur chez Shigella et le gène tetA, impliqué dans la résistance à la tétracycline (P. Boerlin et C.L. Gyles, Abstract pour le 104e «General Meeting» de I’ «American Society for Microbiology», abstr. B-355, 2004). Sa présence sur plasmide est surprenante, puisque paa est présent dans le chromosome chez les souches 0157:H7 séquençées et chez la souche PEPEC ECLÏOOI (8). De plus, aucune donné n’est diponible concernant la conservation du gène paa entre les différents pathotypes de E. cou. Le gène encode une protéine de 252 acides aminés pour 27,6 kDa étant identique chez les EHEC 0157:H7 EDL933 et Sakai et partageant 51,8% et49 % d’homologie avec PEB3 de Campylobacterjejuni et AcfC de Vibrio choÏerae, respectivement($). Les homologues de Paa ont été retrouvés à la surface bactérienne, ptiisque PEB3 a été montrée comme étant extractable à l’acide chez C. jejilni (162) et AcfC a été trouvée
dans le surnageant de culture de Vibrio choÏerae (166). Ceci est en acord avec une étude précédente qui a montré que Paa se retrouvait à la surface bactérienne par microscopie électronique aux billes d’or (8). Cependant, la protéine possède un peptide signal prédit par bioinformatique, tout comme AcfC et PEB3, et sa localisation putative est périplasmique. La localisation finale de Paa n’est donc pas claire. De plus, une des protéines homologues à Paa, Sbp (sulfate binding protein), est une protéine périplasmique servant de transporteur pour le sulfate vers l’intérieur de la bactérie, dont la structure tridimentionelle est connue (167). La relation entre la structure et la fonction de Sbp et celles de Paa reste à être investiguée.
Objectifs
Dans la première étude, les objectifs sont de vérifier la localisation du gène paa (chromosomique ou plasmidique) et de vérifier s’il est associé à d’autres facteurs de virulence des ETEC comme il a été trouvé chez les ETEC de l’Ontario. De plus, la conservation dti gène sera investiguée par séquençage afin de comparer les séquences ETEC du Québec avec celle de l’Ontario et avec celle de paaPEPEC. Dans la deuxième étude, le but était de localiser précisément la protéine Paa chez la souche ECL100Ï mutante pour paa et complémentée et de vérifier l’impact de l’absence de paa sur la sécrétion des protéines effectrices du LEE dont la sécrétion est dépendante
1 Escherichia cou
Les souches de E. cou sont en majorité inoffensives et font partie de la flore
intestinale normale chez les mammifères et les oiseaux. Cependant, une trentaine de sérotypes de E. cou sont considérés comme pathogènes (52). Les souches pathogènes peuvent causer une variété de symptômes dont: l’infection urinaire, la septicémie, la
pneumonie, la méningite et la diarrhée (41).
Les souches causant la diarrhée sont divisées en pathotypes selon leur mécanisme de pathogénicité. Les principales classes sont : 1) E. cou Entérotoxinogène (ETEC), 2) E. cou Entéropathogène (EPEC), 3) E. cou Entérohérnorragique (EHEC), 4) E. cou Entéroagrégatif (EaggEC), 5) E. cou Enteroinvasif (EIEC), 6) E. cou à adhérence diffuse (DAEC) (116, 155).
1.1 E. cou entérotoxinogènes (ETEC)
Les ETEC humains sont responsables de diarrhée surtoutchez les enfants dans les pays en voie de développement, mais sont aussi responsables de la diarrhée du voyageur qui survient chez les personnes qui se déplacent pour la première fois vers une région endémique. Les principaux sérogroupes retrouvés sont: 06, 0$, 07$, 0128, 0153, 025 et 027, mais d’autres sérogroupes sont aussi retrouvés dans quelques cas (210).
Le nombre de cas de diarrhées causées par les ETEC s’élève à 600 millions par année dans le monde avec $00 000 morts environ chez les enfants de moins de 5 ans. Chez les animaux, les ETEC sont responsables de diarrhée néonatale chez le veau, l’agneau et le porc et de diarrhée chez le porc en post-sevrage et le poulet, causant de la morbidité et de la mortalité, ce qui entraîne de grandes pertes économiques pourles éleveurs (52, 160).
Ces souches adhèrent aux cellules de la muqueuse intestinale via des fimbriae. Elles sont aussi reconnues pour produire au moins une toxine (Heat-stable toxin: ST et EAST1 et/ou Heat-labile toxin: LT) qui est sécrétée à la suite de l’attachement de la bactérie à la muqueuse. L’action intracellulaire des toxines entraîne une réponse
cellulaire laqueLle provoque la perte d’électrolytes, caractéristiqtie ta diarrhée (Fig. 1 c). GD1b .FM J — I
II
ETEC d BrBm n3cr t’4 cAFs Tr 1F J r11 L
Otcoicsarid rtGxns (1rv)JctnO SPE.Fr FASflPe)EAEC
--j
t\r
f
:1c;oo -a1lcrinI EECNature R,vewsjMicrobioftg.w
Figure 1: Pathotypes de E. cou selon Kaper et Nataro (2004). a) les E. cou entéropathogênes possédant le locus d’effacement des entérocytes (LEF) qui cause les lésions attachant effaçant (AE). h) Les E. cou entérohémorragiques (EHEC) causent aussi les lésions AE (LEE+). mais ils possèdent en plus la Shiga-like toxine (Stx) causant le syndrome urémique et hémolytique (HUS). c) Les E. cou entérotoxinogènes (ETEC) causent la diarrhée aqueuse chez l’homme et les animaux par la production de toxines suite à l’adhésion bactérieirne médiée par les fimbriae. d) Les E. cou entéroagrégatifs ressemblent aux ETEC. mais elles ne causent aucun changement histologique au niveau du petit intestin, e) Les E. cou entéroinvasifs (EJEC) se caractérisent par la production de diarrhée et la capacité d’entrer dans les cellules hôtes pour s’y multiplier, f’) Les E. cou à adhérence diffuse sont caractérisés par l’absence de facteurs de virtilence retrouvés chez les autres pathotypes de E. cou.
1.2 E. cou entéropathogènes (EPEC)
Les souches EPEC causent de sévères diarrhées, parfois mortelles, chez les enfants
b a EPEC
I’
-z Srruzab rjBzn --EHEC e t 14 j. —r
L
-H
DAECautres pathotypes par la formation de lésions de type AE sans toutefois produire aucune toxine. Les souches EPEC appartiennent surtout aux sérogroupes suivants 026, 055, 0111, 0119. 0125, 0126, 0127, 0128. Lattachement des EPEC à la cellule hôte se fait en trois principaLes étapes : 1) attachement initial de la bactérie à la cellule hôte, 2) transduction de signaux par la bactérie entraînant une réponse de la cellule hôte qui se traduit par la formation «un complexe «actine à la surface de la cellule appelé piédestal et à l’effacement de la bordure en brosse de l’intestin grêle (31) (Fig la). Ce phénotype d’attachement et effacement (lésion AE) est causé, entre autre, par les protéines encodés par les gènes du LEE (Locus of Enterocyte
Effacement), un îlot de pathogénicité de 35 Kb comportant les gènes nécessaires au phénotype (143).
1.3 E. cou entérohémorragiques (f HEC)
Les souches EHEC présentent le même phénotype AE que les EPEC, possédant elles aussi le LEE. Ce qui est propre aux EHEC est la production de toxine, la Shiga like toxin (Stxl ou Stx2) causant le syndrome urémique hémolytique qui peut être fatal (fig. lb). Ces souches sont une catise importante de diarrhée chez les enfants dans les pays en voie de développement (66). La souche EHEC la plus connue est la souche E. cou 0157:H7 causant la maladie du « hamburger ». Elle est associée à des
cas très graves de diarrhées et de coliques hémorragiques chez l’homme causant de nombreux décès (75). Dans plusieurs cas de contamination alimentaire, parfois fatals, on retrouvait la bactérie dans de la viande, le jus, le lait cru, la laitue et l’eau. Il y a deux classes de toxines: Stxl et Stx2. Les deux toxines sont antigéniquement différentes, mais partagent les mêmes fonctions biologiques. Ces toxines ont la même
morphologie que la LT des ETEC, comportant 5 unités B ainsi que les sous-unités Al et A2.
1.4 E. cou entéroagregatifs (EaggEC)
Ces souches de E. cou ressemblent aux ETEC puisqu’elles s’attachent à la paroi de l’intestin grèle, ne sont pas invasives et elles ne provoquent pas de changement histologique de la cellule hôte. Elles se distinguent des ETEC puisqu’elles tendent à adhérer à l’intestin en formant de petits agrégats (Fig. ld). Les souches EAggEC produisent une toxine (EAST-l) semblable à la toxine ST des ETEC et produisent une hémolysine (50).
1.5 E. cou entéroinvasïfs (EIEC)
Les EIEC sont caractérisées par leur capacité à induire la diarrhée, pénétrer dans la cellule de la paroi intestinale pour s’y multiplier et provoquer l’éclatement de la cellule pour libérer les cellules bactériennes filles qui iront infecter d’autres cellules eucaryotes (Fig. le). Les EIEC contiennent un plasmide de virulence leur conférant la capacité d’invasion. Les plasmides trouvés à ce jour présentent beaucoup d’homologie de séquence entre eux suggérant l’existence d’un ancêtre commun (50).
1.6 E. cou à adhérence diffuse (DAE C)
Nous n’avons que peu de connaissance de ce groupe de E. cou pour lequel aucune épidémie n’a été documentée (fig. 1f). Ces souches forment un groupe hétérogène (156). Cependant, le fait que ces souches cause la diarrhée est toujours très controversé. Ce pathotype est définie par trois aspects 1) l’adhérence diffuse lors de l’infection, 2) la présence de l’adhésine du grotipe AfaJDr (comme f1845) ou de l’adhésine de AIDA et 3) l’absence de marqueurs de virulence présents chez d’autres pathotypes de E. cou (50).
2
E. cou
entérotoxinogènes
2.1 Généralités
L’infection se produit suite à l’adhérence des bactéries aux entérocytes via l’action des fimbriaes et la production de toxines qui entraînent une réponse cellulaire. Cette réponse entraîne la sécrétion des électrolytes et d’eau par osmose dans la lumière de l’intestin prodtiisant la diarrhée.
Les gènes encodant les facteurs de virulence des ETEC sont souvent présents sur des plasmides et associés à des éléments génétiques mobiles comme des transposons et des séquences d’insertion (IS). Par exemple, le gène de la toxine EASTI (146), le gène de la toxine STb (127), le gène de la toxine STa (43), les gènes encodant le fimbria 987P (184) ont été retrouvés associés à des transposons.
Les ETEC possèdent plusieurs facteurs de colonisation (FC); les facteurs de colonisation antigéniqties (CFA), les antigènes de surface d’E. cou (CS) et les facteurs de colonisation putatifs (pCF). Ces structures fimbriaires sont, le plus souvent, de 2 à 7 nrn de diamètre, rigides et composés, dans la plupart des cas, d’une seule sous-unité répétée arrangée de façon hélicoïdal. Les CF petivent être classés sous deux types: fimbriae ou fibrilles. Les fimbriae sont filamenteux, rigides et en forme de bâtonnet tandis que les fibrilles sont plus minces, flexibles et comportes moins de sous-unités par tour d’hélice. Une liste des structures fimbriaires connues chez les ETEC est présentée dans les paragraphes suivants.
2.2 Facteurs de virulence 2.2.1 Fimbriae
Les ETEC humains possèdent au moins 21 FC, dont le CSI, CS2, CS3 (Fig. 3d), CS4, CS5, CS6, CS7, CS8 ou CFAIII (Fig. 3a), CS12, CS17, les CFA I (Fig. 3b), II et IV. Cependant, des souches possédant des CF inconnus ont été identifiées, ce qtti pourrait augmenter le nombre de CF. Les CFAI, II et IV ont été caractérisés génétiquement et biochimiquement (30). Les gènes structuraux ainsi que les gènes servant à la synthèse, au transport et à l’assemblage des sous-unités sont organisés en
opéron, généralement de 4 gènes pour les ETEC humains, sur plasmides et sont
flanqués par des éléments IS ou flanqués de transposons ou font partie de
transposons. Ces CF humains peuvent être classées en cinq gtoupes selon leurs homologie génétique et structurale: Le groupe CFA\I, le groupe CS5, le groupe CS15, le groupe « bundle forming » et le groupe non-homologue (6$). Le groupe CfA\1 est
composé dune sous-unité majeure et des protéines servant Fassemblage. Ces protéines sont très homologues entre les fimbriae de ce groupe. Le groupe CS5 comprend des CF très homologues entre eux, mais sont aussi homologues au fimbria
F4 (K8$), F41 et F6 (9$7P) retrouvés chez les ETEC animaux. Le groupe «btindle forming» est relié au fimbria de type IV des EPEC. Le groupe CSÏ5 est relié au
fimbria SEF 14 chez Saïnionella.
Les ETEC animaux portent principalement $ types de fimbriae: F4 (K$$) (chez le porcelet seulement), F5 (K99) (porcelet, veau et agneau), F6 (9$7P) (porcelet), F41 (porcelet, agneau et bovin), F42 (porcelet), F17 (ruminants), F18 (porcelet) et F165 (porcelet, veau et humain) (59, 1 54). Les gènes de structure, transport et d’assemblage des fimbriae des ETEC animaux sont disposés en opérons de $ 11 gènes localisés sur plasmides (50).
2.2.1.1 F4 (K88)
Le fimbria F4 (connue précédemment comme K$$) est associé aux E. cou causant la diarrhée post-sevrage chez le porcelet, plus particulièrement, au sérotype 0149
(203). Trois variants antigéniques existent: K$$ab, K$8ac, K88ad (34). Chaque variant est composée de deux régions antigéniques: Une région conservée entre les trois, nommée a, et une région variable spécifique de chaque variant, nommée b, c et d pour K$8ab, K$$ac, K$$ad (63). Les gènes structuraux, de transport et d’assemblage du fimbria f4 sont habituellement organisés en opéron (Fig. 2) sur un plasmide non-conjugatif. Six gènes (faeC à faeJ-J codent pour les protéines structurales du fimbria. FaeC est une protéine mineure localisée ati bout du fimbria, f aeD est une protéine de membrane externe impliquée dans la translocation des sous-unités du fimbria, FaeE est une chaperone périplasmique prévenant la dégradation des sous-unités par DegP, faeF et FaeH sont des sous-unités mineures du fimbria et FaeG
11
est la sous-unité majeure. FaeI et FaeJ sont des sous—unités mineures du fimbria et semble n’être pas requises pour la synthèse de ce dernier (6). Le récepteur de K8$ est un hydrate de carbone semblable pour chaque variant, ce qui fait du fimbria une
lectine.
K88
O
YAV/>1
facA faeBfrjtrC tàefl fief faeF faeG faeH fael faeJ
K99
flfl
fanA fanB fanC fonD fanE fanE JonC fanfl
987P
f:z.2_z1 t
JasA fosz fasC fasD fasf fasF fasG fasH
I
regulation - major subunits usher‘jminor subunit - chaperone
Figure 2 : Organisation génétique de trois opérons encodant des fimbriae
retrouvés chez les ETEC. F4 ou K88 Présent chez les ETEC 0149 causant la diarrhée chez le porcelet. F5 ou K99 t Présent chez les ETEC causant la diarrhéechez le veau. le porcelet et l’agneau.
F6 ou 9$7P : Présent chez les ETEC causant la diarrhée chez le porcelet. Adaptée de Mol et Otidega (150).
2.2.1.2 F5 (K99)
La synthèse de ce fimbria nécessite 2 gènes codant des protéines régulatrices, FanA et FanB, (175) et 6 gènes encodant des protéines structurales du fimbria, fanC à FanH, (174, 175, 187) (Fig 2). Ces gènes sont retrouvés sur tin plasmide non conjugatif de $8 kb (104). La synthèse est médiée par la chaperone périplasmique FanE et la protéine d’ancrage fanD. FanE possède une structure semblable aux immttnoglobulines ce qui est fréquent chez les chaperones périplasmiques (comme
PapD du fimbria de type P), dont la structure tridimensionnelle est connue (97). FanE, contrairement à la chaperone FaeE du fimbria F4 (K88), est retrouvé sous
FanG et fanH sont présumérnent impliquées dans l’assemblage et l’élongation du fimbria (186, 187). Le récepteur de K99 est l’acide N-glycolylneuraminic GM3 (NeuGc-GM3) (44).
2.2.1.3 F6 (987P)
Huit gènes sont nécessaires à la production du fimbria 9$7P qui est spécifique du porcelet fasA à fasI-J (Fig 2). Ils encodent pour les sous-unités majeure (FasA) et mineure (fasf), l’adhésine (FasG), la protéine d’ancrage (FasD), la chaperone périplasmique (FasB) la protéine régulatrice (f asH) et les protéines servant au transport et l’assemblage du fimbria (121, 123). Ce fimbria permet la colonisation des bactéries entraînant la diarrhée chez des porcelets néonataux (de moins de six jours), mais pas chez des porcelets plus vietix (46). Des homologues de ce fimbria ont été trocivés chez des isolats humains (98, 205). Le fimbria 9$7P est capable de lier le sulfatide et le lactosylcéramide retrouvés dans le mucus de porcs infectés, des glycolipides pouvant servir de récepteur du fimbria (45).
2.2.1.4 F41
Ce fimbria, que l’on retrouve chez l’agneau, le porcelet et le bétail, est similaire à f4 au niveau des gènes encodant les protéines servant à la biosynthèse du fimbria (4, 153). Il a été associé avec les sérotypes 09 et 0101 possédant aussi le fimbria f5. Les gènes encodant f41 sont chromosomiques.
2.2.1.5 F42
Ce fimbria a été détecté chez des isolats provenant de porcelets souffrant de diarrhée néonatale (214). Une grande homologie entre F42, F41 et F5 (K99) a été démontrée (191). Le gène encodant f42 est localisé sur un plasmide non-conjugatif de 21,1 MDa encodant STa. La sous-unité de f42 a un poids de 31 kDa et un pi de 3,2 et le
récepteur potentiel de F42 est le N-acetyl-galactosamine (12$). Une étude récente a montré qtie F42 est associé avec ta présence des toxines STa et STb (163).
2.2.1.6 F17
Le pili F17 est flexible, a un diamètre de 3 nm et est encodé par 4 gènes organisée en opéron sur le chromosome (132). Il est composé d’une sous-unité majeure (F 17-A) qui expose la sous-unité mineure f 17-G à l’extrémité du pili (133). L’adhésine F17-G est le facteur essentiel à l’attachement atix microvillis intestinaux, menant à la septicémie ou la diarrhée chez les ruminants (23). F 17-C est proposée comme étant la protéine d’ancrage nécessaire à la translocation des sous-unités à l’extérieur de la membrane externe (132). Pour ce qui est de F17-D, elle est homologue à PapD du firnbria de type P, elle est donc considérée comme la protéine chaperone (101, 124). Le récepteur de ce fimbria est le N-acétylglucosamine (GlcNAc) (23).
2.2.1.7 F18
Ce fimbria est présent en dettx variants antigéniques (172). Le variant F1$ab est exprimé par les souches de sérotype 0139 produisant la toxine Stx dans les cas de maladie de l’eodème chez le porc (11) et le variant FI 8ac est exprimé par des souches de sérotypes 0141 ou 0157 exprimant des entérotoxines (STa ou STb) dans des cas de diarrhée post-sevrage (11, 151). Le fimbria est encodé par 5 gènes localisés en opéron, ftdABCEF (189). Il est composé d’une sous-unité majeure, FedA qui a un poids de 15,1 kDa (102) et qui n’est pas capable de reconnaître le récepteur de FIS. Les sous-unité mineures fedE et FedF, de 15,9 et 30,1 kDa respectivement, sont impliquées dans l’adhésion du fimbria (103). On sait de plus que les acides aminés 60 à 109 de FedF sont nécessaires à l’adhésion du fimbria (131). fedB encode une protéine de 86 kDa qui sert à l’ancrage du fimbria etfedC encode une protéine de 23,4 kDa qui est la chaperone du fimbria (189). Les sous-unités du fimbria F18 (sauf
FedF) sont homologues avec certaines sous-unités du fimbria AF/R1 présent chez les REPEC (103).
Figure 3: Facteurs de colonisation de E. cou. E. cou produit une variété de factetirs de colonisation, plusieurs ayant une structure rappelant un cheveu et de morphologie variée appelé fimbriae (ou pili) ou fibrille. a: facteur de colonisation fimbriaire CFAIII des ETEC. b: Fimbria CFA/I. long et droit(5—7 nm) des ETEC faisant contrasteavec le moins long mais plus large flagelle. e: Mince (2—5 nm), enroulés et agrégatifs fibres curlis produit par une variété de E. cou pathogènes et non-pathogènes. d: Mince (2—3 nm) et flexible fibrille CS3 produit par les ETEC. e: Bundle-forming pilus” (BfP) des EPEC. un membre des puis de type IV. s’agrège latéralement pour former une structurelarge. figure adaptée de Kaper et al.(116).
2.2.1.8 F165
Le fimbria F165 est retrouvé chez les isolats de E. cou causant la diarrhée ou la septicémie chez le porcelet et le veau et causant la septicémie chez l’humain (35, 59). Ce fimbria est plus rarement retrouvé chez les ETEC que les autres fimbriae (90). Deux types différents de F165 au niveau sérologique et génétique existent : F1651 et f1652 ($9, 91). Le fimbria F1651 est retrouvé chez les E. cou causant la septicémie chez les jeunes porcelets et il est encodé par l’opéronfoo, un homologue de l’opéron pap encodant le fimbria de type P (92). La région régulatrice de foo encode deux protéines régulatrices, Fool et FooB qui ont leurs homologues chez l’opéron pap (15, $8). La région intergéniqcte entre fool et JoB contient deux sites GATC pour la méthylation séparés par 102 pb (17). La régulation de l’expression du fimbria est complexe, impliquant: La méthylation par la Dam méthylase des deux sites GATC, la Leucine-responsive regulatory protein (Lrp), Fool et FooB, homologues de PapI et PapB respectivement (42). La présence de Lrp est requise pour l’expression de F1651 comme pour le fimbria de type P (16$) et la présence de leucine ou d’alanine agit comme antagoniste de Lrp chez F1651, mais pas chez le fimbria de type P (42). Le fimbria F1652 est un homologue du fimbria F 1C produit chez les EXPEC dans des cas de septicémie, d’infection du tractus urinaire et de méningite du nouveau-né et est encodé par l’opéronfot trouvé sur le chromosome de la souche 4787 0115 (92).
2.2.2 Entérotoxines
Cinq types de toxines petivent être retrouvées chez les ETEC; STa, STb, LT-I, LT
11 et EAST1. STb est retrouvé surtout dans les cas de diarrhée chez le porc tandis que STa est associée à la diarrhée chez l’humain et les animaux. LT-I est retrouvée chez les souches ETEC spécifiques à l’humain tandis que LT-I1 se retrouve chez les souches humaines et animales. EAST1 est retrouvée chez des souches humaines (159) et animales (160).
A
figure 4: Mécanismes d’action classiques des toxines des ETE C.(A) LI-IetLI-II. La toxine LT qui consiste en une sous-unité A et cinq sous-unités B est intemalisée par endocytose par les entérocytes. La sous-unité catalytique A1 est transloquée via la membrane vacuolaire et passeà travers l’appareil de Golgi par transport rétrograde. La sous-unité AI catalyse l’ADP ribosylation de l’arginine 201 de la sous-unité ct des protéines G qui. elles, activent l’adenylate cyclase produisant le cAiVIP. Le cAMP est un messager important dans plusieurs fonctions celltdaires. dont le transport membranaire au niveau des entérocytes et le remodelage du cytosquelefte. L’activation des
transporteurs membranaires entraîne la sécrétion de C1 et la réduction de l’absorption de Na et C1. (B) STa. La toxine STa se Lie à son récepteur (guanylyl cyclase C (GC-C) pour STb) ce qui résulte en la production de cGIvIP. Le cGMP agit sur les transporteurs membranaires causant l’augmentation de la secretion de Cl et la reduction deI absorption de Na et Cl parI action de la kinase cGMP dependante ou cAMP-dépendante. Figure adaptée de Nataro et Kaper(155).
2.2.2.1 LT-I et LT-II
LT-I est un hétérodimère de $8 KDa composé d’une sous-unité A de 30 kDa et d’un pentamère de la sous-unité B (11,5 kDa chacune) formant un armeau. La sous-unité A est synthétisée en un polypeptide, mais elle est clivée par la suite pour former les sous-unités Al et A2 qui restent liées entre elles par un pont disulfure. Le dirnère A1-A2 est inséré dans l’anneau formé par le pentamère qui dorme la toxine mature. LT-I1 est aussi un hétérodirnère dont la masse et la structure quaternaire sont très
similaires à LT-l. Les sous-unités A de LT-I et LT-I1 ont 57 % de similarité tandis que les sous-unités B n’ont aucune similarité entre elles permettant la spécificité d ‘hôte.
Les toxines LT sont fonctionnellement et structurellement similaires à la toxine du choléra (CT) de Vibrio choÏerae. Différentes hypothèses ont été formulées quant au
mécanisme de sécrétion de LT: Les conditions dans l’intestin, le relâchement de la toxine par la lyse de la bactérie, la formation de vésicule par la membrane externe et l’utilisation d’un système de sécrétion. Une équipe a démontré un système de sécrétion très conservé chez les ETEC et spécifique à la sécrétion de la toxine LT (19$). Cependant, une autre équipe a découvert que la toxine LT se retrouve dans les vésicules de membrane externe (blebs) pour être ensuite internalisée dans les cellules hôtes (120).
La toxine LT est internalisée par endocytose par les entérocytes. La sous-unité catalytique A1 est transloquée via la membrane vacuolaire et passe à travers l’appareil de Golgi par transport rétrograde (Fig. 4). La sous-unité Al catalyse l’ADP ribosylation de l’arginine 201 de la sous-unité a des protéines G qui elles activent l’adenylate cyclase produisant le cAMP. Le cATV[P est un messager important dans plusieurs fonctions cellulaires, dont le transport membranaire au niveau des entérocytes et le remodelage du cytosquelette. L’activation des transpotetirs membranaires entrafne la sécrétion de CF et la réduction de l’absorption de Na et CF suivit de sécrétion d’eau.
2.2.2.2 STa et STb
STa et STb sont des toxines de faible poids moléculaire qui contiennent plusieurs cystéines formant des ponts disulfures essentiels à la stabilité de la toxine et à son activité biologique. Leurs séquences en acides aminés sont différentes ainsi que leurs modes d’action. STa est synthétisée sous forme de précurseur de 72 acides aminés. Ce précurseur est acheminé dans le périplasme par le système sec, clivant le peptide signal. La protéine est alors composée de 53 résidus. Cette molécule est clivée de nouveau en toxine mature de I $ ou 19 résidus diffusée à travers la membrane externe.
Le mécanisme d’action de STa implique le « cystic fibrosis transmembrane conductance regulator» (CFTR) à la surface de la cellule hôte. La production de cGMP par l’action de la toxine STa active des protéines kinase, dont la protéine kinase C qui semble jouer un rôle dans le mécanisme d’action de STa ($1) (Fig. 4). La protéine kinase A (cAMP-dépendante) et la protéine kinase cGKIJ (cGMP dependante) phosphorylent le CFTR entraînant la sécrétion de fluide par les entérocytes (74).
La toxine STb mature contient 4$ résidus dont 4 cystéines. Elle est synthétisée en un précurseur de 71 résidus dont les 23 premiers constituant le peptide signal sont clivés par le système de sécrétion sec-dépendant lors du passage de la protéine vers le périplasme. Le récepteur de STb, la guanylyl cyclase C (GC-C), est localisé à la bordure en brosse de l’intestin (71). Son mécanisme d’action fait intervenir une protéine régulatrice liant le GTP qui cause l’augmentation de la concentration de calcium intracellulaire. Ceci provoquerait l’ouverture de canaux ioniques et attssi l’activation des phospholipases C et A2 qui entraîneraient la production d’acide arachidonique, dont l’action résulte en la sécrétion d’électrolytes (125).
Les ETEC peuvent stimuler la production d’IL-8 via la présence de la toxine thermostable (Sta ou b) et fait intervenir le TolI like receptor 5 (TLR5) (99). L’IL-$ entraîne la réponse inflammatoire par le recrutement des polymorphonucléaires et des lymphocytes T chez les patients souffrant de diarrhée aux ETEC.
2.2.2.3 EAST1
L’entérotoxine EAST1 a été décrite d’abord chez les EAggEC, mais est aussi retrouvée chez d’autres pathotypes de E. cou causant la diarrhée chez l’humain et les animaux ainsi que chez d’autres pathogènes entériques comme SahnonelÏa (182). EAST1 est une entérotoxine insensible à la chaleur (heat-stable) de 3$ acides aminés (4,1 kDa) (148, 180) et est encodée par le gène astA de 117 pb qui est retrouvé sur plasmide ou porté par le chromosome bactérien ou les deux, en une ou pitisieurs
copies (148). EASTI contient 4 cystéines qui sont impliquées dans la formation de 2 ponts dissulfures (14$) et elle est homologue à 50 % au niveau du domaine entérotoxique avec STa, avec qui elle est souvent comparée (1 8 1).
2.2.3 Curli
La présence de structure mince de type curli a été démontrée chez les ETEC (fig. 3c). Le curli ne semble pas être imptiqué dans la virulence, mais pourrait servir à ta survie des ETEC dans l’environnement (196). Le curli médie l’adhésion de la bactérie aux surfaces inertes (38, 196) et est peut-être impliqué dans la virulence par son implication dans l’invasion des cellules eucaryotes (78). Le curli est beaucoup mieux exprimé à 30 oc (196). Les gènes encodant pour le curli sont compris dans detix opérons, csgBAc et csgDEFG (86), chez E. cou MC4100. Le curli est retrouvé chez les E. cou pathogènes et non-pathogènes et les gènes sont bien conservés chez les bactéries entériques (173).
csgD
encode un régulateur de la famille LysR possédant un motif de liaison à l’ADN et fonctionne comme un activateur des deux opérons csg (7$) et est aussi impliquée dans l’induction de la production de biofilm (1$). La production des biofilm est régulé par des réseaux complexes de régulation (170). csgA est polymérisée spontanément sur le nucléateur de surface, CsgB ($7). La lipoprotéine localisée à la membrane externe CsgG sert à la protection de csgA et csgB de la dégradation (135). CsgE est impliquée dans la liaison du curli à la fibronectine et est semblable à une chaperone et Csgf est impliquée dans la nucléation de csgA (33).2.2.4 Autres facteurs de virulence 2.2.4.1 Tia
La protéine Tia (enterotoxigenic invasion protein A) est une protéine de la membrane externe de 25 kDa, dont le gène est dans un îlot de pathogénicité de 46 kb de la souche ETEC H10407 (62). Tia est impliquée dans l’adhésion et l’invasion de
cellules intestinales en culture. Sa fonction d’adhésine a été caractérisée (61. 140). L’adhésion par Tia se fait par l’interaction de celle-ci avec des protéoglycans sulfatés de la surface des cellules hôtes, d’où interviendraient des protéines liant l’héparine (60).
2.2.4.2 LeoA
Le gène IeoA est porté par le même îlot de pathogénicité que tia chez la souche H10407. Il encode pour une protéine de 578 acides aminés n’ayant aucune fonction connue. Cependant, elle possède certains motifs connus chez des systèmes de sécrétion, dont un site de liaison au GTP/ATP et un second motif retrouvé chez une protéine de translocation de l’hémolysine. Il est requis pour la sécrétion maximale de la toxine LI (62).
2.2.4.3 Iib
Le locus tib a été identifié chez la souche ETEC H10407 comme étant impliqué dans l’adhésion et l’invasion de cette souche (57). Ce locus encode 4 protéines, TibA D. TibA est synthétisée sous la forme d’un précurseur de 100 kDa et semble être le facteur d’adhésionlinvasion des cellules épithéliales intestinales humaines (129). TibA est homologue à AIDA-I, une adhésine chez les E. cou à adhérence diffuse (DAEC) (130). La forme active de TibA est obtenue par l’addition de sucres, semblables à ceux retrouvés sur AIDA-I, par l’action de TibC (152).
2.3 ETEC 0149
Les souches de E. cou du sérogroupe 0149 sont associées à la diarrhée du nouveau-né et après sevrage chez le porc (160). Chez des souches récentes ETEC 0149 de l’Ontario, on a montré qu’elles portaient le fimbria K$8ac (F4), mais aucun des autres fimbriae associés à la diarrhée chez le porc: Fis, F6 et F41 (160). Ces
souches portaient aussi les gènes encodant les entérotoxines SIb, LI et EAST1 et 92 % des isolats récents possèdent le gène de I’entérotoxine STa (160).
Des isolats 0149 ETEC récents étaient â 95 % résistants à la tétracycline et à $0 % à la streptomycine, mais étaient sensibles à l’enrofloxacine. De plus, la plupart des isolats récents possèdent la résistance à plus d’un antibiotique (142). La résistance aux tétracyclines et atix sulfonamides chez ces souches ETEC 0149 «est pas surprenante, puisque ces antibiotiqties ont été utilisés et sont toujours inclus dans la composition de promoteur de croissance au Canada et aux Étas-Unis. Le gène letA, encodant la résistance à la tétracycline, est associé aux souches récentes (1995 à 2000), tandis que le gène tetB est associé aux souches isolées avant 1995 (142). Les gènes de résistances, dont tetA, sont généralement associés à des plasmides, des transposons et des intégrons ce qui facilitent leur dissémination (105, 142).
L’analyse du profil plasmidique de ces souches démontre qu’elles possèdent de trois à cinq plasmides de 90 à 150 kb et qu’elles possèdent toutes un plasmide de 5,1 kb qui est absent chez 40 % des anciens isolats (160). Un plasmide de 5,1 kb a été séquencé. Il est associé au plasmides Co1EI et est homologue au plasmide Coljs de ShigelÏafiexneri (188). Les gènes encodant la LI et la SIb sont souvent retrouvés sur le même plasmide, dont le poids varie de 67 à 105 kb (67. 83). Les gènes encodant pour le fimbria F4 sont retrouvés sur des plasmides variant de 75 à 177 kb (10, 185). II est donc difficile d’associer un facteur de virulence avec une taille de plasmide.
3 E.
cou
de type attachant effaçant (AEEC)3.1 Généralités
Parmi les bactéries responsables des lésions de type AE, on compte les Eseherichia cou EPEC et EHEC. Ces deux pathotypes de E. cou comprennent plusieurs sérotypes différents qui causent les lésions chez l’homme, mais aussi chez le porc, le mouton, le veau et le chien (106).
Les lésions de type AE se caractérisent par l’attachement intime de la bactérie aux entérocytes de Fhôte, à l’effacement de la bordure en brosse de Fintestin et à la
formation d’un piédestal suite au réarrangement du cytosquelette de la cellule infectée (66). D’autres espèces bactériennes causent les lésions AE comme : Citrobacter rodentiun, qui cause lhyperplasie du colon chez la souris et Ha!fiia alvei qui cause la diarrhée chez thumain.
La production des lésions AE nécessite la présence de l’îlot de pathogénicité appelé le LEE pour locus d’effacement des entérocytes (143). Le LEE possède toutes les caractéristiques d’un îlot de pathogénicité i) il est absent des souches commensale de E. cou, ii) il a un pourcentage G+C de 3$ ¾ ce qtii est significativement plus bas que celui dci génome de E. cou qui est de 50 % environ, iii) il est inséré dans un gène d’ARNt ce qui est fréquent chez les flots de pathogénicité (seiC chez E234$69), iv) le LEE est un grand segment d’ADN de 35,5 kb chez E234$69 et y) il comporte des gènes associés à la virulence des EPEC et des EHEC.
Les AEEC utilisent aussi des toxines pour produire leur infection. Chez les EHEC, la toxine Six est nécessaire à la production du syndrome urémique et hémolytique (NUS) et est considéré comme le principal facteur de virulence chez les EFOEC. Pocir ce qui est des EPEC, ces souches utilisent EspC. une protéine autotransporteur, absente chez les EHEC, qui a une activité sérine protéase connue chez d’autres autotransporteurs comme SepA (Shigella), EspP (enterobactérie), Sat et Pet (EaggEC). Bien que le site actif de EspC soit identique à celui chez Pet, EspC a une activité toxique différente de Pet, produisant des dommages cellulaires en agissant aci niveau dci cytosquelefte (157).
Trois étapes principales ont été identifiés dans la formation des lésions de type AE chez les EPEC : L’adhérence localisée, la sécrétion de protéines et l’attachement intime de la bactérie à la cellule hôte (51).
3.2 L’adhérence localisée
Cette étape consiste en l’attachement de la bactérie à l’épithélium de l’entérocyte en formant des colonies denses. L’attachement initial de la bactérie se fait grâce au BFP (bundle forming pilus), un fimbria de type IV (Fig. 3e) encodé par le plasmide EAf (EPEC Adherence f actor) qui contient 14 gènes pour un total de 11,5 Kb (66).
Lorsque ce plasmide est muté chez la souche sauvage, le mutant perd la capacité de former des microcolonies sur l’épithélium intestinal tout en conservant sa capacité
d’adhérer, mais il cause moins de lésions de type AE (204). Contrairement aux EPEC, les EHEC ne possèdent pas le BFP et ils ne présentent pas d’adhérence localisée (155). La molécule majeure encodée par le plasmide EAF est la bundline,
une protéine polyrnorphique encodée par le gène bA contenu dans l’opéron bfp. Le plasmide EAF encode aussi la protéine Bfpf qui a une action lors de Fagrégation de la bactérie. Un mutant pour le gène bijiFpeut toujours synthétiser le pili et s’attacher à l’épithélium en microcolonies, mais ce mutant a une capacité très réduite à causer la diarrhée (52). Cependant, le fait que ce pilus soit une adhésine permettant à la bactérie d’adhérer à la cellule hôte reste à prouver. En effet, plusieurs groupes ont rapporté que le BFP chez des EPEC interagirait avec des oligosaccharides, mais aucune étude, présentant le BfP purifié avec son récepteur spécifique venant de la cellule hôte, n’a été présentée (161).
3.3 Sécrétion de protéines
Plusieurs facteurs de virulence sont sécrétés chez les EPEC/EHEC par le système
de sécrétion de type III et interviennent dans le développement des lésions AE. EspA, EspB et EspD (25, 34 et 39 kDa) encodées par l’opéron LEE4 ont été les premières protéines sécrétées à être identifiées (119). Ces protéines sont en fait les constituants de la seringue du système de sécrétion, EspB et EspD étant les protéines membranaires et EspA formant l’aiguille. EspB est aussi impliquée dans la signalisation cellulaire, plus spécifiquement dans le réarrangement du cytosquelette et la redistribution de l’actine dans la cellule hôte (199, 200). Une quatrième protéine de
7$ kDa nommé Tir (Translocated intimin receptor) agit comme récepteur de l’intimine, une protéine de la membrane externe qui est t’adhésine des EPEC et des EHEC impliquée dans l’adhérence intime.
3.4 Attachement intime et réarrangement du cytosquelette
L’adhérence intime des EPEC est réalisée par une protéine de la membrane
externe de 94 97 Kda, l’intimine (109). Le gène eae est présent dans toutes les
souches capables de produire le phénotype AE (EPEC, EHEC, C. rodentiun; et H. alvei), mais est absent des souches de E. cou de la flore normale de l’intestin et des ETEC (155). L’intirnine se lie à son récepteur Tir (Fig. 5) qui n’est pas une protéine de l’épithélium intestinal, mais plutôt une protéine que la bactérie injecte dans la membrane de la cellule hôte à l’aide de son système de sécrétion de type 111. Ceci est le premier exemple d’un pathogène injectant son propre récepteur dans la membrane d’une cellule de mammifère (204). L’utilisation de son propre récepteur permet à la bactérie d’infecter presque tous les mammifères puisqu’elle n’est pas dépendante de la présence d’un récepteur spécifique sur la cellule hôte. La liaison de l’intimine à Tir entraîne la phosphorylation de cette dernière (195) et la formation du piédestal suite au réarrangement du cytosquelette de la cellule hôte. L’effacement de la bordure en brosse de l’intestin vient ensuite via des signaux intracellulaires.
3.4.1 Formation du piédestal
L’attribut principal des lésions AE est la disparition de la bordure en brosse de l’épithélium intestinal ainsi que la formation d’une structure riche en actine, le piédestal (Fig. 5) (31). Le rôle de cette structure reste toujours à préciser, mais certaines hypothèses ont été émises. Le piédestal pourrait servir à garder la bactérie à l’extérieur des cellules.
Suite à son entrée dans la cellule hôte, Tir est phosphorylée stir deux résidus sérine par la phosphokinase A (207) et par une kinase inconnue sur le résidu tyrosine 474 (176). Le résidu tyrosine phosphorylé permet la liaison de Nck, une protéine d’adaptation de l’hôte (25). Nck va alors se lier ou recruter le N-WASP (neural Wiskott-Aldrich syndrome protein) impliqué dans le réarengement du cytosquelette (31). N-WASP va à son tour recruter un nouveau complexe, Arp2/3 (Actin related protein 2 and 3), qui va se lier avec les molécules déjà en place (112). Arp2/3
contrôle la polymérisation de l’actine à la membrane plasmique des ceiltiles eucaryotes. N-WASP est absolument nécessaire à la formation de piédestal puisqu’un mutant potir cette molécule est résistant à la polymérisation de l’actine (136). Ce recrutement provoque finalement l’effacement des microvillis et la polymérisation de l’actine (77). D’autres molécules sont recrutées au site d’interaction et qui lient l’extrémité N-terminale de Tir dont: L’alpha-actinine (protéine du cytosquelette), l’ezrine (constituant des jonctions serrée), la vinculine, la cortactine et la taline (protéine cytoplasmique liant les récepteurs intégrines) (2$, 77, 100). La taline et la cortactine semblent être nécessaires à la formation de piédestal (2$, 29).
On croit que leur fonction principale serait de servir d’ancrage permettant aux EPEC de s’accrocher au cytosquelette de la cellule hôte (26). De plus, la cofiline (le factettr dépolymérisant de l’actine), la gelsoline et le VASP (vasodilator-stimulated phosphoprotein) sont accumulés lors de la formation de piédestal.
On a localisé aussi, au site de formation du piédestal, un complexe Tir-indépendant: l’annexine 2 et son ligand protéique (S100AIO) sotts la bactérie adhérée. L’annexine 2 est une protéine membranaire qui est régulée par le Ca2 et qui se lie au filament d’actine. Sa fonction est de réguler et stabiliser les contacts entre la membrane plasmique et le cytosquelette.
La structure du piédestal est dynamique : il change de longueur, de grosseur et de position dans le temps. Même la position de la bactérie peut changer par glissement sur la membrane plasmique de la cellule. Ces observations font croire que les EPEC induisent plusieurs changements du cytosquelette tout en étant à l’extérieur de la cellule (161).
3.4.2 Transduction de signaux et diarrhée
Il a été démontré que la concentration cellulaire de calcium augmente suite à l’infection par les EPEC (7). L’inositol (1,4,5)-triphosphate (1P3) augmente aussi lors de l’infection par les EPEC et cette augmentation requiert la présence du système de sécrétion de type 111 (65). Les EPEC provoquent l’activation de la phospholipase C ‘y1 (Fig. 8) qui dégrade les phospholipides menant à la libération d’1P3 (76) et aussi
menant à la sortie du calcium de son réservoir lui permettant de se lier à des protéines dépendantes du calcium pour provoquer l’effacement des microvillis (31). Cependant,
une autre étude a trouvé qu’aucune élévation de Ca2 n’était observée suite à l’infection par des EPEC (5).
ta) ESPB3T__EspA tatsp EspU’N
f
/Ttirinnwii
U
__A EspF EspB ,, 4 EspGQ
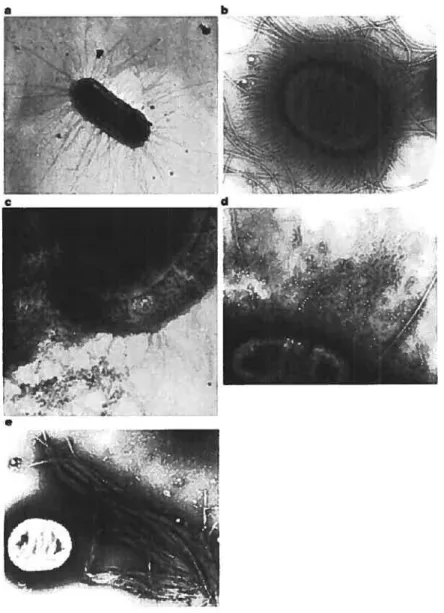
0:hor pfftnrsfigure 5: Modè]e d’infection des E. cou attachant effaçant. A) Le système de sécrétion de type III encodé par le locus d’effacement des entérocytes (LEE) permet la sécrétion de plusieurs
molécules effectrices, dont Tir le récepteur de t’intimine. B) L’intéraction entre l’intimine et Tir entraîne l’attachement intime de la bactérie à la cellule hôte, l’envoie de signaux cellulaires via la phosphorylation de Tir, ces signaux entraînent le réarrangement du cytosquelette pour finalement former le piédestal (en jaune). Modifiée de Campellone et Leong (26).
(b) ntrnin Tir N yIubke prit P€dcst Hosi cet
L’augmentation de l’activité de la protéine kinase C (PKC) ainsi que de son association à la membrane ont été observées pouvant mener à tine plus grande perméabilité entre les cellules intestinales (40) (fig. 8). Suite à l’infection, on a observé aussi l’activation du facteur nucléaire NF-kB qui est activé suite à la phosphorylation rapide de ERKI/2 (extracellular signal-regulated kinase). La cascade de réaction qui suit celle phosphorylation active des enzymes qui vont directement activer Nf-kB (183). NF- kB va ensuite induire la transcription de gènes spécifiques
suite à sa translocation dans le noyau, notemment celui de l’IL-8.
Plusieurs laboratoires ont tenté d’élucider les mécanismes de signalisation qui
mènent à la diarrhée, mais ces mécanismes sont toujours inconnus. Il n’est pas clair si la diarrhée est une conséquence de la sécrétion des effecteurs des EPEC ou si c’est une réaction de l’hôte visant à contrer l’adhésion bactérienne (204). Une équipe a démontré que l’infection par les EPEC induit la phosphorylation de la chaîne légère de la myosine conduisant au bris des jonctions serrées (217). La disparition de la bordure en brosse de l’intestin peut aussi provoquer une perte de surface pour l’absorption ce qui causerait l’augmentation de liquide dans l’intestin. D’autres facteurs peuvent être impliqués comme le recrutement des neutrophiles et des lymphocytes polynucléés (PMN) au site de l’infection. Ces PMN pourraient migrer
au site d’infection suite à la production de l’IL-$ qui elle est induite par la production de NF-kB aussi présent lors de l’infection (204) (fig. 8).
3.5 Facteurs de virulence
3.5.1 Le LEE (Locus of enterocyte effacement)
La plupart des gènes nécessaires à la formation des lésions de type AE chez les EPEC sont compris dans un îlot de pathogénicité chromosomique appelé le LEE (Locus ofenterocytes effacement) (143). En effet, lorsque l’on introduit le LEE chez la soucheE. cou K-12 (souche de laboratoire non-pathogène), celle souche acquiert la capacité de produire des lésions de type AE. Ceci indique que le LEE est nécessaire et surtout suffisant à la production du phénotype AE (144). On retrouve le LEE chez
28
plusieurs Enterobacteriaceae comme les EHEC, les REPEC (Rabbit EPEC), les PEPEC (Porcine EPEC), H atvei et C. rodentium (155).
R1R2 LEEI LEE! LEE3 LEE5 LEE1
-( -- -4 -,_ I.
— - û ,,:c’J Z I j-. lJ LLLL
L L —
TraIisrI:ttci1iI TransIoator TTSS
I €-:IIJlato’s TrinsVators Etf?ctors Intiiliin C1apI.cns IJIknr.II s.rtion ccInponeilts
I j I I I I I I I I
Figure 6 : Schéma représentant les gènes du locus of enterocyte effacement
(LEE). Le LEEest un îlot de pathogénicité essentiel à la production du système de sécrétion de type
III et au développement des lésions AE à la surface de la cellule hôte. Le LEE comprend 5opérons
(LEE1-5 plus R1R2) et 41 gènes, dont la fonction est connue pourlamajorité et aétéclassée en groupements fonctionnels qui sont montrés par différentes couleurs. Une grande partie des gènes sont responsables de la formation du système de sécrétion, d’autres encodent des effecteurs, des chaperones et des protéines régulatrices. La figure est adaptée de Dean etaL (47).
C’est chez la souche EPEC E234$/69 (0127:H6) que le LEE a été identifié pour la première fois. (143). Les 41 gènes du LEE (Fig. 6) sont organisés en cinq opérons polycistroniques: LEE1, LEE2, LEE3, Tir et LEE4 (55, 19$). Ces gènes encodent plusieurs composants, dont: 1) les composants d’un système de sécrétion de type III (107); 2) les protéines sécrétées par ce système, les Esp (E. cou secreted proteins) (66); 3) une protéine de la membrane externe de 94 Kda , l’intimine, qui est une
adhésine encodée par le gène eae (109); 4) Le récepteur de l’intimine, Tir, qui est transloquéepar le système de sécrétion de type III dans la membrane de la cellule hôte pour ensuite servir de récepteur pour l’intimine (117); 5) CesT, une protéine chaperone de Tir (1); 6) Ler, un membre de la famille des activateurs transcriptionnel H-NS qui régule la transcription de plusieurs gènes du LEE et même des gènes ne faisant pas partie du LEE (54). Le système de sécrétion de type III et Ler sont encodés par LEE1, LEE2 et LEE3. L’opéron LEE5 encode l’intimine, Tir et CesT et l’opéron LEE4 encode EspA, EspB, EspD et Espf (1, 56, 119, 145). Certains gènes du LEE commerorjl et rorJ2/EspG sont localisés à l’extérieur des cinq opérons.
Le LEE de l’EPEC E234$/69 est inséré à $2 min. par rapport au chromosome de
E. cou K-12 (souche de référence) dans le locus seiC codant pour l’ARN-t de la sélénocystéine (155). Ce site semble être privilégié pour l’insertion de séquences d’ADN étrangères puisque l’intégration dci phage R73 et de PAl-1 (un flot de pathogénicité de 70 Kpb retrouvé chez les E. cou ciropathogènes) se fait aussi dans le locus selC (164). On a aussi démontré la présence du LEE dans d’autres locus des ARN-t. Les EPEC de sérotypes 026 :H11, 0111 :H2, 0119 :1-16, 012$ :H2 et les EHEC de sérotypes 026 :1111, 0111 :H-, 0111 :H$ ont tous le LEE inséré dans le locus de l’ARN-t pheU à 94 min. du chromosome de E. cou K-12 (192, 20$).
Récemment, le locus pheV à 67 min. du chromosome de E. cou K-12 a aussi été rapporté comme étant un site d’insertion du LEE chez la souche EHEC 0103 :H2 (111). Pour les souches 0157:H7 Sakai, le LEE est inséré dans le gène d’ARNt seiC
(Fig. 7). Ces différents sites d’insertion du LEE chez des souches EPEC et EFIEC indiquent que le LEE pourrait avoir été acquis chez ces deux groupes à plus d’une reprise et à des moment différents dans leur évolution (52, 20$). Il est aussi possible que le LEE se soit mobilisé et réintégré dans la même souche (19$). De plus, on s’est aperçu que le LEE fait partie d’un plus gros flot de pathogénicité lorsqu’il est inséré dans les locus pheU ou pheV tandis que lorsqu’il est inséré dans le locus seiC, il est présent comme étant un élément autonome, n’étant associé à aucun élément mobile (transposon par exemple) pouvant suggérer une hypothèse sur le mécanisme de son insertion (17$). Ces divergences des séquences bordant le LEE pourraient s’expliquer par la théorie de Hacker et Kaper (1999) selon laquelle les séquence des jonctions entre l’ADN inséré et l’ADN de l’hôte subissent des mutations et des délétions qui stabilisent le segment inséré. Ainsi, lors de l’insertion du LEE chez les EPEC et les EHEC, différents événements de mutation et de délétion sont survenus pour chaque souche, ce qui expliqueraient les différences entre les séquences bordant le LEE entre les souches.
(Iocus seiC) 4 000 1 000 000 Stx2 (Phage SP5) paa (phacie SP9) espl/nteA phage SP9)
Figure 7 : Génome de E. coti 0157:H7 Sakai. La position de certains gènes impliquées dans la virulence et associés â des séquences phagiques est indiquée. Le Loctis d’effacement des entérocytes (LEE) est inséré dans le locus seiC. paa et espisont encodés par l’îlot SP9 contenant des séquences de phage. Les gênes des toxines Std et Stxll sont aussi portés par des phages, SP15 et SP5 respectivement. Figure modifiée de Hayashi et aÏ.(93).
La région du LEE chez l’EPEC 0127 :H6 souche E2348/69, chez l’EHEC 0157:H7 souche EDL933, chez C. rodentiim, et chez la souche RDEC-1 de lapin (0115 :H-) a été séquencée (48, 55, 164, 218). L’homologie de séquences pour les gènes et les protéines encodées par ces gènes est très élevée, ce qui laisse croire que ces séquences auraient un ancêtre commun (48). Le LEE de C. rodentium présente une différence majeure quant à la position de roij2 (EspG) et ro,fl puisqu’ils sont situés à côté du LEE4 contrairement aux autres LEE (dont on connaît la séquence) où ces ORF sont situés à l’autre extrémité du LEE, devant LEE1 (Deng et al., 2001). La taille du LEE est variable chez les espèces étudiées. Le LEE chez EPEC, EHEC et
StxI



![figure 5: Modè]e d’infection des E. cou attachant effaçant. A) Le système de sécrétion de type III encodé par le locus d’effacement des entérocytes (LEE) permet la sécrétion de plusieurs molécules effectrices, dont Tir le récepteur de t’intimine](https://thumb-eu.123doks.com/thumbv2/123doknet/7493027.224613/43.918.233.734.252.875/infection-sécrétion-effacement-entérocytes-sécrétion-molécules-effectrices-récepteur.webp)