356 m/s n° 4, vol. 28, avril 2012 DOI : 10.1051/medsci/2012284007
NOUVELLE
Un facteur de transcription
se fait complice du VIH-1
pour détruire les défenses
cellulaires
Roland Marquet, Santiago Guerrero, Serena Bernacchi, Sophie Pernot, Julien Batisse, Jean-Christophe Paillart
Architecture et réactivité de l’ARN, Université de Strasbourg, CNRS,
Institut de biologie moléculaire et cellulaire, 15, rue René Descartes,
67084 Strasbourg cedex, France. r.marquet@ibmc-cnrs.unistra.fr
> Les éléments génétiques mobiles représentent une fraction considérable de notre génome et les mammifères ont développé plusieurs facteurs cellulaires restreignant l’expansion des trans-posons, rétrotransposons et rétrovi-rus. Plusieurs facteurs de restriction inhibant la réplication des rétrovirus, dont les virus de l’immunodéficience humaine de types 1 et 2 (VIH-1, VIH-2), ont ainsi été identifiés : TRIM5
(tri-partite motif-containing protein 5),
la téthérine, SAMHD1 (SAM domain and
HD domain 1), et plusieurs membres de
la famille des cytidines désaminases APOBEC-3 (apolipoprotein B
mRNA-editing, enzyme-catalytic, polypep-tide-like 3) [1-3]. Parmi ces derniers, A-3G et A-3F, qui sont exprimés dans les cellules cibles naturelles des VIH-1 et VIH-2, sont les plus importants [1, 3]. Les rétrovirus ont cependant acquis la capacité de contourner ces facteurs de restriction. Certains ont développé des protéines dites acces-soires dans ce seul but : c’est le cas du facteur d’infectiosité viral (Vif) et de la protéine virale U (Vpu) des VIH-1 et VIH-2, ainsi que de la protéine virale X (Vpx) du VIH-2, qui contrecarrent respectivement A-3C/3DE/3F/3G/3H [1, 3], la téthérine [1] et SAMHD1 [2]. La neutralisation des facteurs de res-triction par les rétrovirus implique très souvent le détournement de la voie de dégradation des protéines cellulaires par le protéasome en réponse à leur polyubiquitination.
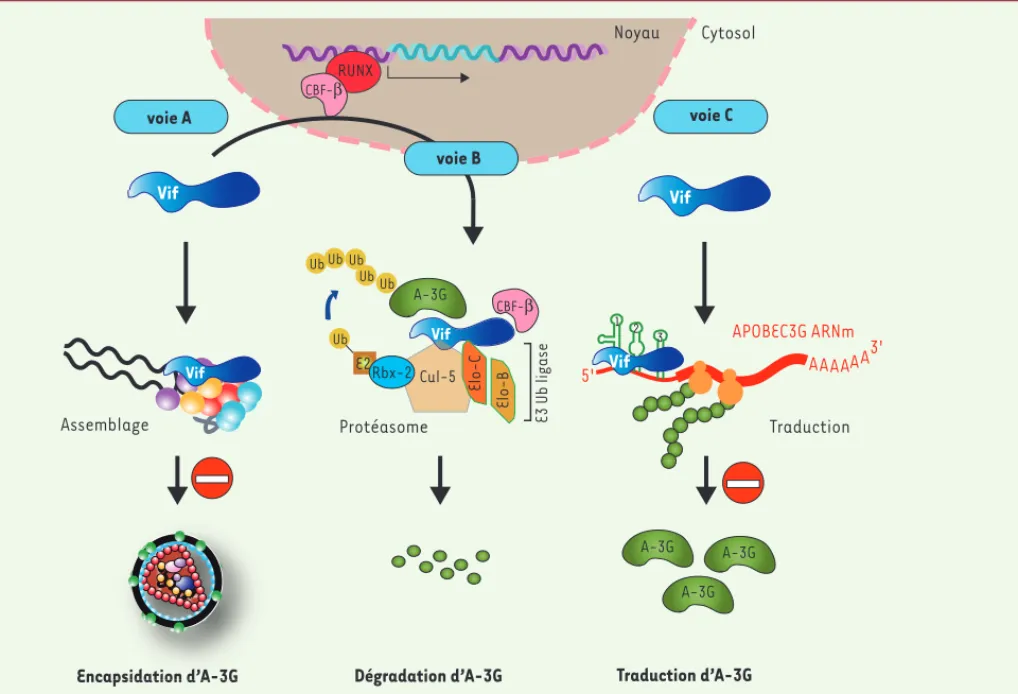
Ubiquitinylation des facteurs
de restriction par la protéine virale Vif L’ubiquitinylation des protéines euca-ryotes fait tout d’abord intervenir une des deux enzymes activatrices, E1, qui transfère l’ubiquitine à l’une des enzymes de conjugaison, E2 ; enfin, une ubiquitine ligase (E3, il en existe plu-sieurs centaines), transfère l’ubiquitine aux substrats spécifiques. Trois pro-téines accessoires du VIH-1, Vif, Vpu et Vpr sont connues pour détourner trois ubiquitine ligases E3 différentes appar-tenant à la famille des cullin-RING E3 ligases. La protéine Vif du VIH-1 possède en son centre un motif HCCH liant le zinc et une boîte culline qui permettent le recrutement de la culline 5 (Cul-5), Cul-5 étant capable de lier Rbx-2, une protéine possédant un domaine RING. Vif possède en outre dans sa région carboxy-terminale un motif appelé SOCS (suppressor of cytokine signaling)
box qui recrute l’élongine C (Elo-C) qui
forme un hétérodimère avec l’élongine B (Elo-B) (Figure 1, voie B). Le complexe Cul-5/Rbx2/Elo-B/Elo-C ainsi recruté par la protéine Vif permet l’ubiquiti-nylation d’A-3G/A-3F, orientant ainsi ces protéines vers la dégradation par le protéasome (Figure 1, voie B).
CBF-b : un nouveau ligand de Vif
impliqué dans l’infectiosité des VIH/VIS chez les primates
Deux articles publiés récemment dans la revue Nature [4, 5] ont identifié un nouveau ligand de Vif impliqué dans la
dégradation d’A-3G, qui fait également l’objet d’une publication récente dans
Journal of Virology [6]. En effet, Krogan
et al. [7] ont entrepris
l’identifica-tion systématique des ligands des pro-téines du VIH-1, dont Vif, en combinant purification d’affinité et spectrométrie de masse. Chacune des protéines du VIH-1 a été exprimée avec deux éti-quettes différentes (Strep ou Flag) soit par transfection transitoire de cellules humaines d’épithélium rénal embryon-naire (HEK-293), soit par expression stable et inductible à partir de cellules lymphoïdes Jurkat. Les auteurs se sont focalisés sur les protéines identifiées indépendamment du type cellulaire et de l’étiquette utilisée pour la purifi-cation [5, 7]. Par cette approche, sept protéines humaines ont été identifiées comme des ligands directs ou indirects de Vif dans les deux types cellulaires : l’une intervient dans l’autophagie (MARA1), cinq sont les constituants de l’ubiquitine ligase E3 (Elo-B, Elo-C, 5, Rbx-2, et 2 qui interagit avec Cul-5) et la dernière est CBF- (core binding
factor-). Zhang et al. [4] ont, quant à eux, employé Vif munie d’une éti-quette HA (hémaglutinine) pour immu-noprécipiter ses partenaires dans les cellules H9, une lignée cellulaire T. Ils ont ensuite identifié par spectrométrie de masse Cul-5, Elo-B, Elo-C et CBF-. L’interaction entre Vif et CBF- a été validée par des études de colocalisation et de transfert d’énergie de fluores-cence (FRET) dans des cellules HEK 293T transfectées [4].
Nouvelles_Avril12.indd 356
m/s n° 4, vol. 28, avril 2012
NOUVELLES
MAGAZINE
357 CBF- n’affecte pas l’infectiosité virale en l’absence d’A-3G. L’étude de Hulquist et al. étend la portée de ces résultats, puisqu’elle les généralise aux deux isoformes de CBF-, à un grand nombre d’isolats du VIH-1 de sous-types différents et à l’ensemble des cytidines désaminases de la famille APOBEC-3 sensibles à la dégradation induite par Vif (A-3C/3DE/3F/3G/3H) [6]. De façon similaire, CBF- lie la protéine Vif du virus d’immunodéfi-cience des macaques rhésus (VISmac), favorisant la dégradation des APO-BEC-3 sensibles à Vif chez cet ani-mal et leur exclusion des particules virales dont elle augmente l’infectio-sité [4-6]. Cependant, la dégradation de l’unique protéine APOBEC-3 bovine induite par Vif du virus de l’immu-nodéficience bovine (VIB) n’est pas affectée par CBF- [4], suggérant que général des Cul-5 E3 ubiquitine ligases
[4, 5]. Vif forme un complexe soluble et monodisperse avec CBF-, Elo-B et Elo-C qui lie A-3G et s’associe à Cul-5/ Rxb-2 [5], CBF- facilitant le recrute-ment de Cul-5 [4]. La réciproque n’est cependant pas vraie : Cul-5 n’influence pas la fixation de CBF- à Vif [4]. En outre, Jäger et al. ont démontré que le complexe Cul-5/Rxb-2/Elo-B/Elo-C/Vif/ CBF- reconstitué in vitro à partir de protéines recombinantes est capable de polyubiquitiner A-3G [5].
Les deux études [4, 5] ont démontré également que lorsque l’expression de CBF- est diminuée par l’utilisation de siARN ou de shARN, la concentration intracellulaire d’A-3G et son incor-poration dans les particules virales - nécessaire à son activité de restriction - augmentent, tandis que l’infectiosité du VIH-1 diminue. Comme attendu, CBF- est un cofacteur de
transcrip-tion impliqué dans le développement et la différenciation de plusieurs types cellulaires, dont les lymphocytes T. Il ne lie pas l’ADN mais interagit avec les pro-téines de la famille RUNX (Runt-related
transcription factor 1), dont il module
le repliement et les propriétés de fixa-tion à l’ADN (Figure 1). Zhang et al. ont déterminé que la région amino-termi-nale de Vif est cruciale pour sa liaison à CBF- et que cette liaison n’entre pas en compétition avec le recrutement des protéines RUNX dont Vif n’affecte pas l’activité transcriptionnelle [4]. Les deux publications parues dans Nature [4, 5] démontrent que CBF- fait par-tie du complexe E3 ubiquitine ligase comprenant la Cul-5, Rbx2, Elo-C et Elo-B. Cependant, la fixation de CBF- à ce complexe requiert Vif, ce qui indique que CBF- n’est pas un constituant
Figure 1. Mécanismes d’action de Vif. Vif contrecarre le facteur de restriction A3-G par au moins trois mécanismes distincts : (1) compétition avec A-3G lors de l’assemblage viral (voie A), (2) induction de sa dégradation par le protéasome (voie B), et (3) inhibition de sa traduction (voie C).
Vif Traduction d’A-3G Assemblage Cytosol APOBEC3G ARNm 5' AAAAAA 3' Noyau Dégradation d’A-3G Vif Encapsidation d’A-3G Vif Cul-5 Ub E2 Ub Ub Elo-C Elo-B Ub Ub Ub E3 Ub ligase A-3G Rbx-2 3 2 1 Vif Protéasome Vif apsidation d’A-3G Traduction voie A voie B voie C RUNX CBF-β CBF-β A-3G A-3G A-3G Nouvelles_Avril12.indd 357 Nouvelles_Avril12.indd 357 4/16/2012 1:37:36 PM4/16/2012 1:37:36 PM
358 m/s n° 4, vol. 28, avril 2012 DOI : 10.1051/medsci/2012284008
RÉFÉRENCES
1. Strebel K, Luban J, Jeang KT. Human cellular
restriction factors that target HIV-1 repli cation. BMC
Med 2009 ; 7 : 48.
2. Laguette N, Sobhian B, Casartelli N, et al. SAMHD1 is the
dendritic- and myeloid-cell-sp ecific HIV-1 restriction factor counteracted by Vpx. Nature 2011 ; 474 : 654-7.
3. Henriet S, Mercenne G, Bernacchi S, et al. Tumultuous
relationship between the human imm unodeficiency virus type 1 viral infectivity factor (Vif) and the human APOBEC-3G and APOBEC-3F restriction factors.
Microbiol Mol Biol Rev 2009 ; 73 : 211-32.
4. Zhang W, Du J, Evans SL, et al. T-cell differentiation
factor CBF-beta regulates HIV-1 V if-mediated evasion of host restriction. Nature 2012 ; 481 : 376-9.
5. Jager S, Kim DY, Hultquist JF, et al. Vif hijacks
CBF-beta to degrade APOBEC3G and promo te HIV-1 infection. Nature 2012 ; 481 : 371-5.
6. Hultquist JF, Binka M, LaRue RS, et al. Vif proteins
of human and simian immunodeficienc y viruses require cellular CBF- to degrade APOBEC3 restriction factors. J Virol 2012 ; 86 : 2874-7.
7. Jager S, Cimermancic P, Gulbahce N, et al. Global
landscape of HIV-human protein complexes . Nature 2012 ; 481 : 365-70.
8. Mercenne G, Bernacchi S, Richer D, et al. HIV-1 Vif
binds to APOBEC3G mRNA and inhibits it s translation.
Nucleic Acids Res 2010 ; 38 : 633-46.
le criblage à haut flux d’inhibiteurs ou leur conception rationnelle lorsque la structure cristallographique de ces complexes aura été obtenue. La dégradation d’A-3G par la voie du pro-téasome n’est pas le seul mécanisme par lequel Vif contrecarre ce facteur de restriction : Vif réduit également l’expression d’A-3G en inhibant sa tra-duction [8](Figure 1, voie C) et agit de façon directe pour inhiber son incorpo-ration dans les particules virales, sans doute par compétition [3] (Figure 1,
voie A). Ces deux derniers mécanismes
restent encore mal connus et pour-raient, eux-aussi, déboucher sur de nouvelles stratégies d’inhibition du VIH-1. ◊
A transcription factor acts as a HIV-1 accomplice to destroy the cellular defences
l’implication de cette protéine dans la dégradation des protéines de la famille APOBEC-3 se limite aux primates. Perspectives thérapeutiques antivirales
L’identification d’un facteur humain intervenant spécifiquement dans la dégradation des protéines de la famille APOBEC-3 ouvre la voie à de nouvelles stratégies antivirales dirigées contre les VIH-1 et 2. En effet, des molécules perturbant l’interaction entre Vif et CBF- devraient inhiber la dégrada-tion de ces facteurs de résistance sans perturber la fonction des autres ubi-quitine ligases. La mise en évidence du complexe stable et soluble CBF- /Vif/Elo-C/Elo-B et la reconstitution
in vitro d’un complexe E3 ubiquitine
ligase actif [5] permettent d’envisager
Gladstone Institute of Virology and Immunology, University of California at San Francisco, San Francisco, CA 94158, États-Unis.
nroan@gladstone.ucsf.edu
> Comme en témoignent les 34 millions de personnes infectées en 2010, le VIH/ Sida demeure un problème de santé publique majeur [1]. Une grande partie des infections mondiales se concentrent en Afrique sub-saharienne où la trans-mission lors de rapports hétérosexuels est le mode de propagation le plus cou-rant. Comme cette transmission se pro-duit quasiment toujours en présence de sperme, il est essentiel d’élucider l’effet du sperme sur la transmission du virus. Le sperme, un facteur facilitateur de l’infection VIH
Loin d’être un véhicule passif pour le VIH, le sperme peut grandement augmen-ter l’infection par le VIH in vitro. Plu-sieurs groupes ont publié que la présence de sperme augmente dramatiquement
l’infection de lignées cellulaires et de cellules primaires par le VIH [2-6]. Quels sont les facteurs présents dans le sperme responsables de cet effet ? Un certain nombre de composants du liquide sémi-nal, dont la fonction physiologique est de protéger les spermatozoïdes lors de leur voyage vers l’ovule, peuvent proté-ger également les virions. C’est le cas des amines basiques comme la spermine, la spermidine, putrescine, cadavérine, etc., qui évitent la dénaturation des sper-matozoïdes dans l’environnement acide de l’appareil vaginal et qui, malheureu-sement, empêchent aussi l’inactivation du virus [7-9]. D’autres composants du sperme, plus récemment identifiés par Munch et al. forment des fibrilles amy-loïdes capables d’augmenter l’infectivité du VIH [2]. Ces fibrilles ont été nommées
SEVI pour semen-derived enhancer of
viral infection. L’augmentation du
pou-voir infectieux du VIH conférée par SEVI est plus marquée lorsque l’inoculum viral est limité, une situation qui semble sur-venir lors de la transmission du VIH. Des expériences de dilution limite du virus ont montré que les fibrilles de SEVI peuvent augmenter l’infection par un facteur de 100 000 [2]. Une dose de VIH qui serait donc insuffisante pour être infectieuse pourrait devenir, dans ce contexte, hautement infectieuse. Les fibrilles amyloïdes du sperme Les fibrilles amyloïdes sont des poly-mères de feuillets et ont été déjà associées à des maladies neurologiques, maladies d’Alzheimer et de Huntington par exemple. SEVI est constitué de
Rôle des fibrilles amyloïdes
dans la transmission du VIH
Na dia R. Roan, Marielle Cavrois, Warner C. Greene
NOUVELLE
Nouvelles_Avril12.indd 358