CARACTÉRISATION D’UNE LIGNÉE DE SOURIS ENTPD8
-/-; ÉVIDENCE D’UN RÔLE DANS LA
FIBROSE HÉPATIQUE
Mémoire
Patrick LUYINDULA
Maîtrise en microbiologie-Immunologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Patrick LUYINDULA, 2014
III
Résumé
Les cellules de l’organisme réagissent au danger en relâchant des substances dont les nucléotides, qui sont à l’origine de l’inflammation et/ou fibrose notamment au niveau du foie. Ceux-ci activent leurs récepteurs P2 disséminés sur la plupart des cellules de l’organisme. Il existe des enzymes parmi lesquelles les NTPDases, habilitées à hydrolyser ces nucléotides, limitant ainsi leur activité proinflammatoire. Notre laboratoire a identifié, cloné et localisé la NTPDase8, au niveau des canalicules biliaires du foie. Predisant une fonction dans l’inflammation hépato-biliaire in vivo, nous avons généré une lignée de souris déficiente en cette enzyme et des anticorps dirigés contre celle-ci.
Durant ma maitrise, j’ai confirmé la déficience de l’enzyme (ADN, ARN et protéine) dans cette lignée de souris Entpd8-/-. Les souris déficientes se sont révélées plus inflammées sans
traitement, mais moins atteintes par l’inflammation et la fibrose que les souris sauvages à la suite de deux modèles distincts de fibrose hépatique
V
Abstract
Body cells react, to danger signals by releasing in the external environment, substances such as nucleotides that are responsible for inflammation and/or fibrosis. Nucleotids activate their P2 receptors spread throughout the body. There are enzymes such as the NTPDases, which are empowered to hydrolyze these nucleotides thus limiting their P2 receptor-induced activation. Our laboratory has identified, cloned and located one of those enzymes referred as NTPDase8 at the level of the liver bile canaliculi. This location may lead to a particular function in liver inflammatory attacks. So, we generated NTPdase8 knock-out mice and antibodies against this protein. During my Master degree, I characterized NTPDase8-deficient mice to the level of DNA, RNA and protein. I then developed two models of liver fibrosis to assess the role of this enzyme in vivo. The knock-out mice which started more inflamed were found little less inflamed and fibrotic after the experiments than wild-type mice.
VII
Table des matières
Résumé ... III Abstract ... V Table des matières ... VII Liste des tableaux ... IX Liste des figures ... XI Liste des abréviations... XIII Remerciements ... XVII
Chapître 1. Introduction générale ... 1
1.1. Les nucléotides extracellulaires ... 1
1.1.1. Origine et mécanismes de relâche ... 1
1.1.2. Mécanismes de recaptage cellulaire des nucléosides ... 3
1.2. Les récepteurs de nucléotides et de l’adénosine ... 3
1.2.1. Les récepteurs de l’adénosine ou récepteurs P1 ... 4
1.2.2. Les récepteurs de nucléotides ou récepteurs P2 ... 5
1.3. Enzymes de régulation de l’activité des nucléotides extracellulaires ... 7
1.3.1. Les nucléosides triphosphates diphosphohydrolases (NTPDases) ... 7
1.3.2. L’ecto-5’-nucléotidase (CD73) ... 9
1.3.3. Les phosphatases alcalines (PALs) et acides (PACs) ... 9
1.3.4. Les ecto-nucléotides pyrophosphatases/phosphodiestérases (E-NPPs) ... 10
1.3.5. Les ecto-kinases ... 10
1.4. Signalisation purinergique et fibrose hépatique ... 10
1.5. Hypothèse et objectifs du projet ... 16
1.6. Méthodologie du projet ... 16
1.6.1. Production de la souris Entpd8
-/-... 16
1.6.2. Production d’anticorps anti-NTPDase8 ... 17
1.6.3. Transfection et préparation des protéines recombinantes ... 17
1.6.4. Western blot, ELISA et PCR ... 17
1.6.5. Immunohistochimie et activité enzymatique in situ ... 18
1.6.6. Fibrose hépatique ... 19
Chapître 2. Résultats ... 21
VIII
2.2. La NTPDase8 dans la fibrose hépatique précoce ... 25
2.2.1. Histopathologie comparée dans la fibrose au CCl
4... 25
2.2.2. Évaluation de la prolifération cellulaire ... 27
2.2.3. Évaluation de l’infiltration leucocytaire ... 28
2.2.4. Quantification des myofibroblastes ... 29
2.2.5. Évaluation de l’expression tissulaire des cytokines ... 30
2.3. Discussion ... 31
Conclusion et perspectives... 35 Bibliographie ... 37 Annexes ... 49Annexe 1. ... 49
Annexe2. ... 49
IX
Liste des tableaux
Tableau 1: Les récepteurs de l’adénosine ... 5 Tableau 2 : Les récepteurs P2Xs ... 6 Tableau 3 : Les récepteurs P2Ys ... 7
XI
Liste des figures
Figure 1: Structure et nomenclature de nucléotides ... 2
Figure 2: Mécanismes de relâche de nucléotides extracellulaires ... 3
Figure 3: Structure des NTPDases ... 9
Figure 4: Localisation du foie ... 11
Figure 5: Organisation interne du foie. ... 12
Figure 6: Caracteristiques lésionnelles dans la fibrose du foie ... 13
Figure 7: Mécanisme d’activation de la cellule étoilée (HSC) ... 14
Figure 8: Formes physio-pathogéniques de la fibrose hépatique ... 15
Figure 9: Design des blastocystes Entpd8+/- ... 17
Figure 10: Modèle expérimental d’intoxication des souris au CCl4 ... 19
Figure 11: Modèle expérimental de ligature du canal biliaire commun des souris ... 20
Figure 12: Caractérisation génomique de la souris Entpd8-/- ... 22
Figure 13: Caractérisation protéique de la souris Entpd8-/-... 24
Figure 14: Lésions hepatocellulaires par intoxication au CCl4 ... 27
Figure 15: La prolifération cellulaire dans la fibrose hépatique. ... 28
Figure 16: Infiltration des macrophages dans la fibrose hépatique ... 29
Figure 17: Quantification des myofibroblastes dans la fibrose hépatique ... 30
XIII
Liste des abréviations
ABC Cassette de liaison à l’ATP (« ATP binding cassette »)
ACR Région conservée des apyrases (« apyrase conserved region »)
ADN Acide désoxyribonucléique
ADNc ADN complémentaire
ADP Adénosine 5’-diphosphate
AMP Adénosine 5’-monophosphate
AMPc Adénosine 3’5’-monophosphate cyclique
ARN Acide ribonucléique
ATP Adénosine 5’-triphosphate
ATPase Adénosine 5’-triphosphatase
ATPDase Adénosine 5’-triphosphate diphosphohydrolase
Ca2+ Cation calcium (2+)
CCPA Conseil Canadien de Protection des Animaux
CCl4 Tetrachlorure de carbone
CHA N6-cyclohexyladénosine
CNT Transporteur de nucléosides concentrant (« concentrative nucleoside
transporter »)
CPA N6-cyclopentyladénosine
CPAUL Comité de Protection des Animaux de l’Université Laval
CTP Cytidine triphosphate
Da Dalton
E-NPP Ecto-nucléotide pyrophosphatases/phosphodiestérases
ENT Transporteur aux nucléosides équilibrant (« equilibrative nucleoside
transporter »)
E-NTPDase Ecto-nucléoside 5’-triphosphates diphosphohydrolase
gDNA ADN génomique (« genomic DNA»)
GPI Glycosylphosphatidyl inositol
KC Chimiokine dérivé des kératinocytes (CXCL1)
XIV
MCP-1 Protéine chimio-attractante monocytique-1 (“Monocyte Chemotractant
Protein-1”)
MIP-2 Protéine inflammatoire des macrophages-2 (“Macrophage
Inflammatory Protein-2”) Mg2+ Cation magnésium (2+) Na+ Cation sodium (1+) NECA 5'-N-éthylcarboxamidoadenosine Ph Potentiel hydrogène PLC Phospholipase C PMSF 3-Phénylméthanesulfonyle fluorure Pi Phosphate inorganique PPADS Pyridoxalphosphate-6-azophenyl-2',4'-disulfonic
RT-PCR Réaction de polymérisation en chaîne en transcription inverse (« reverse
transcriptase-polymerase chain reaction »)
Tris Tris (hydrolxyméthyl) aminométhane
U Unité
UDP Uridine 5’-diphosphate
UDPase Uridine 5’-diphosphatase
UMP Uridine 5’-monophosphate
UTP Uridine 5’-triphosphate
XV
À toi Rebecca BILONDA mon épouse, et à nos fils Emmanuel, Jean-Marc, Junior et Alexandre, pour avoir fait de moi, « Un homme comblé de bonheur ».
XVII
Remerciements
« La vie, c’est comme une bicyclette, Il faut avancer pour ne pas perdre l’équilibre » disait Albert Einstein. L’accomplissement de cette maitrise au Centre de recherche du CHU de Québec dans le programme de microbiologie et immunologie de l’Université Laval marque d’une touche particulière, mon parcours professionnel de médecin-clinicien.
En tout premier lieu, je tiens à remercier mon directeur de recherche, le Dr Jean Sévigny : Il m’a accepté dans son laboratoire et m’a transmis la passion pour la recherche que je considère désormais comme étant la partie submergée de ce grand iceberg qu’est «La bonne santé ». Grâce à lui, j’ai non seulement consolidé la conviction selon laquelle, la recherche justifie la pratique médicale, mais j’ai surtout appris la démarche en recherche fondamentale et l’usage des certains outils y associés.
Je remercie tous les membres de l’équipe : Dr Filip Kukulski, Dr Johanna Lecka, Dr Cherifa Ayari, Julie Pelletier, Alain Tremblay, Mabrouka Salem, Elahe Hajmirbaba, Andréa Cardoso et Mariam Mikhail, pour le soutien moral, scientifique et technique qu’ils m’ont offert durant mon séjour au laboratoire.
Je remercie le Gouvernement du Canada à travers l’ACDI et le PCBF, qui ont rendu possible mon arrivée au canada ainsi qu’une partie de mon séjour aux études.
1
Chapître 1.
Introduction générale
L’organisme fonctionne grâce à une interaction intercellulaire quasi permanente, qui est possible par le biais notamment de substances qualifiées de « médiateurs biologiques ». Ceux-ci parmi lesquelles on retrouve les nucléotides, sont à la base de phénomènes vitaux très variés aussi bien physiologiques que pathologiques. La découverte dans le foie de récepteurs [1] de nucléotides ainsi que des enzymes [2] qui les hydrolysent à la surface de membranes cellulaires, a conduit à une meilleure compréhension de la signalisation purinergique dans cet organe.
1.1. Les nucléotides extracellulaires
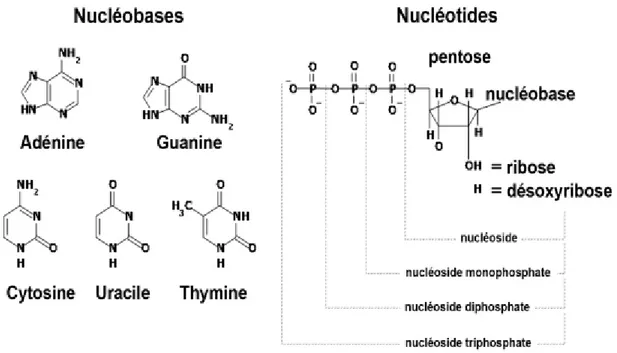
C’est au début des années 1970 que la signalisation purinergique a été reconnue comme moyen de communication intercellulaire [3]. Le rôle joué par les nucléotides (ATP, ADP, ATP et UDP) à l’intérieur de cellules a été bien décrit (source d’énergie [4], matrice des acides nucléiques, transduction de la signalisation kinase-dépendante [5, 6]…) par de nombreux travaux. Il est aussi évident de nos jours, que les nucléotides relâchés à l’extérieur de la cellule participent à l’homéostasie de plusieurs organes vitaux dont le foie [7-10].Ils sont constitués d’une base azotée (purique ou pyrimidique), d’un sucre (ribose ou désoxyribose) et d’un à trois groupements phosphates lié(s) au sucre. Le terme « nucléoside » désigne un nucléotide qui a perdu toute liaison au groupement phosphate. C’est le cas de l’adénosine.
1.1.1. Origine et mécanismes de relâche
Dans les situations normales, les nucléotides sont fortement concentrés dans le compartiment cellulaire [11] à des taux d’ATP pouvant avoisiner le 5 mM pour les hépatocytes [12].
2
Figure 1: Structure et nomenclature de nucléotides
Les nucléotides sont relâchés dans le milieu extracellulaire soit de façon non contrôlée (bris de membrane cellulaire, nécrose ou apoptose), soit de façon règlementée lorsque la cellule est lésée ou soumis à un stress [13-15], via notamment les vésicules d’exocytose et les transporteurs passifs tels que les ABC, les hemicanaux (Pannexines et connexines).
Une partie des nucléotides extracellulaires est produite localement par clivage des dinucleotides polyphosphates (NpnN) ou des molécules similaires[16]. Les ecto-kinases peuvent aussi interconvertir les nucléotides déjà présents dans le milieu.
3
Figure 2: Mécanismes de relâche de nucléotides extracellulaires1.1.2. Mécanismes de recaptage cellulaire des nucléosides
Les nucléotides extracellulaires en activant leurs récepteurs à la surface des cellules, jouent un rôle important dans plusieurs processus vitaux. Dans le milieu extracellulaire, se passe également le processus de leur métabolisation par des enzymes appelées « ecto-nucléotidases » [10, 17]. L’action de ces dernières est importante non seulement pour le contrôle de l’activation de récepteurs P2, mais aussi pour la production d’éléments simples (nucléosides)[18] appelés à être repris par les cellules pour une synthèse ultérieure de nucléotides. Le recaptage est assuré par des transporteurs membranaires spécifiques et ubiquitaires dits Equilibrateurs (ENT) ou Concentrateurs (CNT).[19-22]
Les transporteurs Equilibrateurs existent au nombre de quatre et favorisent le mouvement passif transmembranaire des nucléosides suivant leur gradient de concentration, contrairement aux transporteurs Concentrateurs qui réalisent un transport actif unidirectionnel [21, 23].
1.2. Les récepteurs de nucléotides et de l’adénosine
Tout comme les hormones, les cytokines, et beaucoup d’autres substances biologiques, les nucléotides relâchés dans le milieu extracellulaires constituent des médiateurs importants de processus biologiques [24]. L’action des nucléotides extracellulaires débute par l’activation des
(Tiré de Holger K. Eltzschig., N ENG J MED, 2012)
4
récepteurs métabotropes (P2Y)[25] et ionotropes (P2X)[26] disséminés dans la quasi-totalité des membranes cellulaires. On dénombre à ce jour 8 variétés de récepteurs P2Y (1, 2, 4, 6,11-14) et 7 récepteurs P2X (1-7). Les récepteurs de l’adénosine ou récepteurs P1, sont également exprimés à la surface de cellules.
1.2.1. Les récepteurs de l’adénosine ou récepteurs P1
Il existe quatre types de récepteurs P1 connus à savoir A1, A2a, A2b, et A3. Ce sont des
récepteurs metabotropes à 7 domaines transmembranaires. Tandis que les trois premiers furent connus avant même leur clonage par des travaux de pharmacologie fonctionnelle [27], le récepteur A3 a été découvert en 1992 à la suite d’un clonage de gêne [28]. La réponse de ces récepteurs
diffère selon le type de sous-unité (« s » activatrice ou « i » inhibitrice) couplée à la protéine G [29, 30]. C’est ainsi que l’activation des récepteurs A1 et A3 provoque une diminution intracellulaire
d’AMP cyclique tandis que l’inverse est observé en cas d’activation de récepteurs A2a et A2b [31]. Il
a été démontré que A2b était plus activé dans les conditions pathologiques [32, 33] et pouvait
induire une signalisation via la phospholipase C (PLC), la phosphatidylinositol-3-kinase (PI3K) et les « mitogen activated protein kinases » (MAPK) [34]
5
Tableau 1: Les récepteurs de l’adénosine
Agonistes Antagonistes Signalisation
A1 Adénosine,CHA, CPA, R-PIA CTP,Methylxanthine, SLV320, WRC-0571 Inhibition de la production d’AMPc A2a Adénosine,CVT-3146 KW-6002, MSX-3, MRS1093 Augmentation de la production d’AMPc
A2b Adénosine, NECA MRS1754, MRS1706 Augmentation de la
production d’AMPc A3 Adénosine,VT160, IB-MECA, NECA MRS1334, MRE3010F20, Inhibition de la production d’AMPc
Documents de référence= [32, 35-38]
1.2.2. Les récepteurs de nucléotides ou récepteurs P2
Les nucléotides extracellulaires (ATP, ADP, UTP, UDP) influencent l’activité cellulaire en activant des récepteurs P2 localisés à la surface de cellules [9, 39-41]. On regroupe ces récepteurs en deux catégories à savoir : P2X et P2Y [42-44]
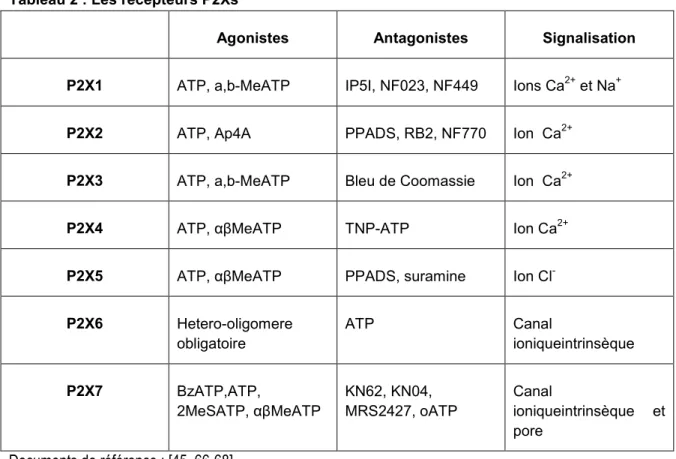
Les récepteurs P2Xs sont des protéines à deux passages transmembranaires dont les extrémités C- et N- terminales sont intracellulaires [45, 46]. La boucle extracellulaire constitue le site de fixation de nucléotides. On dénombre à ce jour chez les mammifères 7 représentants de ces récepteurs P2Xs (P2X1 à P2X7) qui peuvent s’assembler de façon homo-oligomerique (mêmes sous-unités) ou hétéro-oligomerique (différentes sous-unités) [47, 48] pour constituer des canaux ioniques perméables au Na+, K+, et Ca2+. Ce pouvoir d’homo ou d’hétéro-oligomerisation diffère d’un récepteur à un autre et débouche sur des propriétés fonctionnelles divergentes[47]. Alors que les récepteurs P2Xs répondent essentiellement à l’ATP, le recepteur P2X7 reconnu pour sa faible affinité vis-à-vis de l’ATP [49], peut être activé par l’AMP et l’ADP dans certaines circonstances [50]. Bien que possédant des propriétés pharmacologiques [51-53] et structurales [54] communes, les récepteurs P2Xs peuvent se différencier aussi bien par leur affinité aux agonistes, leur conditions de désensibilisation [55-62] que leur sélectivité à divers antagonistes [63-65] répertoriés sur le marché
6
Tableau 2 : Les récepteurs P2Xs
Agonistes Antagonistes Signalisation
P2X1 ATP, a,b-MeATP IP5I, NF023, NF449 Ions Ca2+ et Na+
P2X2 ATP, Ap4A PPADS, RB2, NF770 Ion Ca2+
P2X3 ATP, a,b-MeATP Bleu de Coomassie Ion Ca2+
P2X4 ATP, αβMeATP TNP-ATP Ion Ca2+
P2X5 ATP, αβMeATP PPADS, suramine Ion Cl-
P2X6 Hetero-oligomere obligatoire ATP Canal ioniqueintrinsèque P2X7 BzATP,ATP, 2MeSATP, αβMeATP KN62, KN04, MRS2427, oATP Canal ioniqueintrinsèque et pore
Documents de référence : [45, 66-68]
Les récepteurs P2Ys sont des protéines transmembranaires couplées à la protéine G [69]. On en dénombre quinze actuellement dont 8 (P2Y1,2,4,6 et P2Y11-14) identifiés chez les mammifères,
répondent spécifiquement aux nucléotides adényliques (ATP, ADP) et/ou uridyliques (UTP, UDP). Se basant sur la disparité d’affinité vis-à-vis de leurs agonistes naturels, on regroupe ces récepteurs en quatre catégories distinctes : a) les récepteurs à grande affinité pour l’ATP ou l’ADP où l’on trouve P2Y1 et P2Y11-13, b) les récepteurs à grande affinité pour l’UTP ou l’UDP où l’on
trouve P2Y4 et P2Y6, c) les récepteurs à affinité partagée représenté par P2Y2 (activé aussi bien
par l’ATP que par l’UTP), et d) les récepteurs pouvant lier UDP-glucose, UDP-galactose et des monosaccharides nucléotidiques.
En dépit de leur homologie structurale, les récepteurs P2Ys sont associés à deux voies de signalisation intracellulaires distinctes [42, 70, 71] : L’activation de la phospholipase C avec mobilisation du calcium intracellulaire, et l’inhibition de l’adenylate cyclase avec diminution du taux d’AMPc intracellulaire. Ces deux modalités d’action s’appliquent respectivement aux récepteurs P2Y1, 2, 4, 6,11 et P2Y12-14. De façon inhabituelle, P2Y11 peut activer l’adenylate cyclase à qui il est
couplé [72]. Notons également que l’activité biologique de ces récepteurs peut être affectée par une glycosylation ou une phosphorylation post-traductionnelle [73, 74].
7
Tableau 3 : Les récepteurs P2YsAgoniste Antagoniste Signalisation
P2Y1 ADP, ATPγS, Ap3A PPDAS, RB2 Activation PLC
P2Y2 ATP, UTPγS, UTP Suramine, RB2 Activation PLC
P2Y4 UTP, UTPγS , ITP PPADS, RB2, Activation PLC
P2Y6 UDP, UTP, ATP MRS2578, RB2 Activation PLC
P2Y11 ATP, ARC67085 NF157, NF340 Activation de PLC ou activation de AC
P2Y12 ADP, LTE4, ATPγS CS-747,RB-2 Inhibition de AC
P2Y13 ATP, 2-MeSATP MRS2211, PPADS Activation de PLC ou Inhibition de AC
P2Y14 UDP-galactose UDP-glucose UDP Activation PLC
Documents de référence : [75-79]
1.3. Enzymes de régulation de l’activité des nucléotides
extracellulaires
L’action des nucléotides extracellulaires aussi bien dans l’homéostasie du milieu intérieur que dans le dysfonctionnement de ce dernier, implique l’activation des récepteurs P2 auxquels ils se fixent. Il existe cependant, un mécanisme de régulation enzymatique incarné par une série de protéines distinctes qui sont soit localisées à proximité de ces récepteurs, soit solubles dans le milieu interstitiel. Ces enzymes sont appelées « Ecto-nucléotidases ». Elles hydrolysent les nucléotides extracellulaires et limitent ainsi l’activation des récepteurs P2. On les regroupe en cinq familles à savoir : Les ecto-nucléosides triphosphates diphosphohydrolases (NTPDases), l’ecto-5’-nucléotidase, les phosphatases alcalines (ALP), les phosphatases acides (AP), et les nucléotides pyrophosphatases/phosphodiestérases (NPPs).
1.3.1. Les nucléosides triphosphates diphosphohydrolases (NTPDases)
Les NTPDases constituent le groupe le plus important des ectonucléotidases qui hydrolysent les nucléotides à pH physiologique [80]. Leurs membres au nombre de 8 (NTPDase1 à -8), partagent en commun une homologie structurale de séquence d’acides aminés constituée par cinq régions conservées «Apyrase Conserved Regions» (ACR1-5) impliquées dans leur cycle
8
catalytique [81]. De plus, l’activité enzymatique de ces protéines est différentielle [82] et requiert la présence d’ions divalents (Ca2+, Mn2+, Zn2+ ou Mg2+) et elle est optimale du pH 5 à 10 [82, 83].
En fonction de leur localisation cellulaire, les NTPDases se subdivisent en deux groupes : Les ecto-NTPDases en référence aux NTPDases1,-2,-3 et -8 qui sont intimement ancrées dans la membrane plasmique [84] et possèdent un site catalytique tourné vers le milieu extracellulaire.Les NTPDases4-7 sont ancrées à des membranes des compartiments intracellulaires (appareil de Golgi, réticulum endoplasmique et lysosomes) et possèdent un site catalytique cytoplasmique. Ces dernières seraient efficaces dans l’hydrolyse des nucléotides intracellulaires [85]. Les NTPDase5 et -6 peuvent être rendues solubles par clivage de leur attache membranaire (Figure 3).
La contribution de ces enzymes dans les processus physiologiques des mammifères a fait l’objet de nombreuses découvertes ces dernières années. La NTPDase1 (ou CD39) intervient notamment dans l’atténuation de lésions d’ischémie-reperfusion rénale [86], l’angiogenèse et le chimiotactisme des leucocytes [87, 88], la thrombo-régulation [89-93], l’atténuation des lésions et la diminution de la susceptibilité aux maladies inflammatoires chroniques de l’intestin [94]. La NTPDase2 contribuerait entre autres, dans le développement du système nerveux [95-98] et l’atténuation de lésions de cirrhose biliaire [99, 100]. Un rôle important de la NTPDase3 a été suggéré dans l’insulino-sécretion [101, 102] à cause de sa localisation dans les ilots de Langerhans chez plusieurs espèces de mammifères. Cette dernière protégerait également contre certaines atteintes acoustiques de l’oreille interne [103]. La NTPDase8 qui est l’enzyme qui nous interesse dans ce travail a été récemment découverte et caractérisée par notre laboratoire.Elle est supposée jouer un rôle important au niveau de structures qui l’abritent à savoir le colon, le rein et le foie.
Ces trois localisations de la NTPDase8 constituent des voies d’élimination de substances excrétées par l’organisme et plusieurs pathologies aussi bien infectieuses que non infectieuses y trouvent leur point de départ. Sa présence à ce niveau pourrait ainsi jouer un rôle important dans l’hydrolyse de nucléotides et donc dans la réponse inflammatoire.
La NTPDase8 humaine est une protéine de 54 kDa traduite depuis 1485 nucléotides et qui possède un point isoélectrique situé autour de 5,19. On lui décrit 7 sites de N-glycosylation, un nombre varié de site de phosphorylation à la base de modifications post-traductionnelles, et 5 régions conservées d’apyrase « ACRs » qu’elle partage en commun avec les autres NTPDases. L’analyse du génome humain, localise le gène ENTPD8 au niveau du chromosome 9q34. Son ADN complementaire contient 3.631 paires de base organisées en 9 exons. Cette organisation est similaire à celle de la NTPDase8 de la souris. La NTPDase8 requiert la présence d’ions Ca2+ et Mg2+ pour une activité optimale. Tout en ayant une préférence pour le Ca2+, cette enzyme hydrolyse mieux les triphosphonucléosides (ATP et UTP). Contrairement à la NTPDase1, la NTPDase8 résiste en présence de l’azide [104, 105].
9
Figure 3: Structure des NTPDases1.3.2. L’ecto-5’-nucléotidase (CD73)
Cette enzyme appartient à une famille composée de six autres, et est la seule qui est exprimée à la surface de cellules [106]. Son activité a été initialement décrite dans les cardiomyocytes de lapin, grenouille et rat. C’est vers les années 1960 que l’identité de l’ecto-5’-nucléotidase a vu le jour avec le clonage de son ADNc. Cette enzyme hydrolyse spécifiquement l’AMP en adénosine [107], permettant ainsi l’activation des récepteurs P1. L’adénosine via certains de ses récepteurs, possède des propriétés anti-inflammatoires [108-111]. Plus récemment, notre laboratoire a démontré que les différentes NTPDase1,-2 et -8 du foie co-localisent avec l’ecto-5’-nucléotidase [2]. Ce qui suggère une régulation de la production d’adénosine selon les compartiments du foie. Cette activité du tandem NTPDase-CD73 s’est montré bénéfique dans bon nombre de cas dont les pneumonies bactériennes [112], les maladies auto-immunes et transplantations d’organes [113], et même dans les troubles de thromboregulation [114].
L’ecto-5’-nucléotidase ou CD73, est une protéine attachée à la membrane plasmique grâce à un groupement glycosylphosphatidylinositol (GPI) [115, 116] pouvant être clivé par une attaque enzymatique des phospholipases [117]. Son activité optimale se déroule à pH physiologique et nécessite la présence de cations divalents précédemment décrits pour les NTPDases [118-120].
1.3.3. Les phosphatases alcalines (PALs) et acides (PACs)
Les PALs regroupent un certain nombre d’enzymes que l’on retrouve dans presque tous les tissus de l’organisme et qui sont capables d’hydrolyser la plupart de composés organiques disposant des groupements phosphorylés comme les nucléosides phosphates (ATP, ADP, AMP)
10
[121, 122], avec libération d’un groupement phosphate inorganique (Pi) [123, 124]. Ces enzymes sont actifs à pH alcalin comme leur nom l’indique [125-127]. Le rôle de ces enzymes dans l’hydrolyse de nucléotides en condition physiologique demeure à élucider. Néanmoins, quatre isoenzymes de cette famille sont les mieux étudiés : GCALP (cellule germinale), PLALP (placenta), TNAP/ALPL (non spécifique du tissu ; foie, os, rein), et IALP (intestin).
La famille des PACs comprend cinq isoformes nommées selon leur origine en PAP (prostate) [128], MAP (macrophages), LAP (lysosomes), EAP (érythrocytes) et OcAP (ostéoclastes). Ils sont tous actifs en milieu acide et requièrent la présence du Fe2+ dans le milieu [129].
1.3.4. Les ecto-nucléotides pyrophosphatases/phosphodiestérases
(E-NPPs)
C’est le deuxième plus grand groupe des ectonucleotidases en nombre [130]. Ses membres au nombre de sept (E-NPP1-7) sont des protéines à un seul passage transmembranaire et dont le site catalytique se trouve dans le milieu extracellulaire [131]. Toutefois, on a pu décrire des variantes solubles de certains de leurs membres. Leur dénomination découle de leur propension à hydrolyser les liaisons pyrophosphates et/ou phosphodiesters de différents substrats et composés naturels. Seules les NPP1 (ouPC1), NPP2(ou autaxine ou PD1-Iα) et NPP3 (PD-Iβ, B10, gp130RB13-6) sont reputées capables d’hydrolyser divers nucléotides extracellulaires [132].
L’activité enzymatique de ces protéines est optimale à pH alcalin et requiert aussi la présence des cations divalents comme les phosphatases alcalines [127]. Nos trois NPPs d’intérêt sont tous exprimés au niveau du foie [133] et leur rôle dans l’homéostasie intérieure est de mieux en mieux compris [134-136].
1.3.5. Les ecto-kinases
Pour maintenir l’équilibre ou le contrôle de l’activation des récepteurs P2, il n’y a pas que l’hydrolyse des nucléotides par les ectonucleotidases qui a lieu. A l’inverse, il existe aussi à la surface des cellules, des enzymes capables de générer les nucléotides par ajout d’un groupement phosphates. Ces enzymes ont donc une activité ecto-kinase. C’est ainsi que l’ecto-adénylate kinase (ecto-AK) génère deux molécules d’ADP à partir d’un ATP et un AMP [106], L’ecto-nucléoside diphosphokinase (ecto-NDP kinase ou protéine NM23) transfert un groupement phosphate entre un nucléoside di et un triphosphate.
1.4. Signalisation purinergique et fibrose hépatique
Le foie (Figure 4) est un organe complexe tant du point de vue structural que physiologique. En effet, il constitue le viscère le plus volumineux de l’abdomen (1,2 à 1,6 kg chez l’adulte) soit 2 à
11
3% du poids corporel [137]. Il est localisé directement en dessous et à droite du diaphragme. On lui décrit deux lobes principaux subdivisés en lobules et recouverts d’une capsule fibreuse par où viennent se fixer ses divers ligaments suspenseurs. C’est le seul organe capable de recevoir à lui seul, près de 25% du débit cardiaque à travers l’artère hépatique (25-30%) et la veine porte (70-75%) [138]. Il constitue le carrefour métabolique de la quasi-totalité des substances ingérées par l’organisme [139]. A l’heure actuelle, on lui décrit près de cinq cents fonctions dont les plus importantes sont entre autres : la synthèse de la plupart des protéines solubles du sang (inflammatoires, facteurs de coagulation [140]), le métabolisme de l’urée, la détoxication, la synthèse et l’excrétion de la bile, ainsi que la glycorégulation [141].
Figure 4: Localisation du foie
En dehors des cellules parenchymateuses (hépatocytes, cellules endothéliales, cholangiocytes), on y trouve aussi les cellules de Kupfer (macrophages), des fibroblastes ainsi que des cellules étoilées (ou HSC) dont il sera question dans la suite.
Malgré cette double complexité, les hépatocytes organisées dans une structure fonctionnelle appelée « lobule hépatique »[142], remplissent la totalité des fonctions métaboliques de l’organe (Figure 5A). Un lobule hépatique est composé d’hépatocytes disposées en cordons et en rayons de roux autour d’une veine centrale. Dans cette disposition, chaque hépatocyte possède une face dite « vasculaire » séparée du capillaire sinusoïde par l’espace de DISSE, et une face dite « biliaire » aussi appelée « canalicule biliaire » [143], par où elle déverse la bile vers le tube digestif [144, 145] (Figure 5B).
12
Figure 5: Organisation interne du foie.
La fibrose hépatique constitue l’aboutissement de toutes les atteintes inflammatoires chroniques du foie [146]. D’étiologie diverse, elle peut être infectieuse [147], métabolique [148] ou toxique [146]. Elle se caractérise par l’installation d’une désorganisation architecturale [149, 150] et d’une insuffisance hépatocellulaire généralement irréversibles [151, 152].
(A) le lobule hépatique (B) Excrétion biliaire (Tiré de Serges Erlinger., 2012)
A
13
Figure 6: Caracteristiques lésionnelles dans la fibrose du foieL’insuffisance hépatocellulaire qui évolue vers une cirrhose et/ou un cancer du foie, se traduit par des complications de divers ordres traduisant une réduction des fonctions homéostatiques exercées par le foie. La découverte d’un nombre croissant de cas de réversibilité de fibrose hépatique [153-156] a ouvert la porte à de nombreux travaux visant à élucider les mécanismes modulateurs de cette entité.
L’organisation Mondiale de la Santé (OMS) a dénombré en 2008 plus de 695 000 cas de décès liés au cancer du foie. Dans le même sens, la Société Canadienne du Cancer rapporte une incidence de 5% au Canada pour l’année 2012. Plus de 300 transplantations de foie sont réalisées chaque année au Canada selon la Fondation Canadienne du Foie.
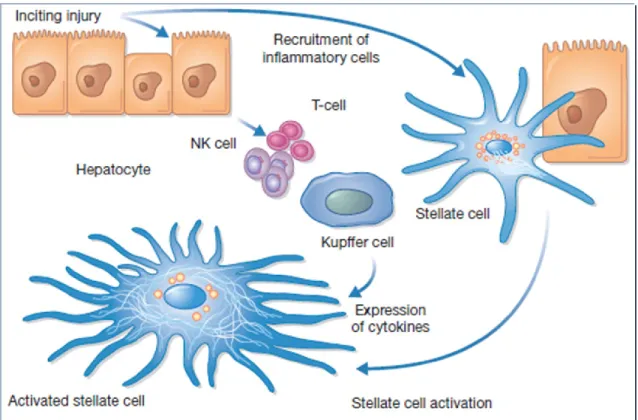
Les hépatocytes [157], les cellules de Kupffer [158], les cellules étoilées [159] et même les cholangiocytes [160, 161] réagissent à l’agression en relâchant des signaux de danger dont les cytokines [162, 163] et des nucléotides [164]. Ces médiateurs amplifient la réponse inflammatoire et entrainent une activation des cellules étoilées (ou HSC) et/ou des fibroblastes en myofibroblastes [165-167] qui sont responsables de l’installation de la fibrose en produisant la matrice extracellulaire et des inhibiteurs tissulaires des métallopotéinases [168].
(Tiré de Don C. Rockey et Scott L. Friedman., 2006)
14
Figure 7: Mécanisme d’activation de la cellule étoilée (HSC)
Il est une évidence de nos jours, que la fibrose hépatique biliaire diffère de la non biliaire par sa rapidité d’installation et par les mécanismes cellulaires associés [169, 170]. A l’origine de l’installation d’une fibrose biliaire, se trouve un défaut intrinsèque [171] ou mécanique [172, 173] d’excrétion de la bile. Les acides biliaires contenus dans cette dernière, vont irriter les cholangiocytes qui bordent les voies biliaires [174]. Les cholangiocytes vont relâcher des signaux de dangers dont les nucléotides et les cytokines comme l’Il-6 [175, 176] qui vont réguler l’inflammation et la fibrogénèse rétrogrades à point de départ biliaire [177]. Dans la fibrose non biliaire, les hépatocytes directement lésés relâchent des médiateurs inflammatoires et sont également phagocytées par les cellules de Kupffer. Ces dernières sont grâce à leur activation et aux cytokines qu’elles secrètent dont notamment le TGFβ à la base de l’activation et de la métamorphose de cellules étoilées en un phénotype fibrogène appelé « myofibroblaste ». Les myofibroblastes peuvent provenir de différentes cellules. Dans la fibrose non biliaire, les myofibroblastes dérivent de la différenciation des cellules étoilées activées, alors que dans la fibrose biliaire ils dérivent plutôt des fibroblastes périportaux (périductulaires) [178-180]. Les fibroblastes périportaux envoient plusieurs prolongements dendritiques jusqu’à la face basolatérale des cholangiocytes et sont régulés par des médiateurs inflammatoires relâchés par celles-ci [181, 182]. A titre illustratif, le blocage des récepteurs P2Y par le Pyridoxal-Phosphate-6-Azophenyl-2,4-Disulfonate (PPADS) prévient la fibrose hépatique non-biliaire mais ne possède aucun effet dans la forme biliaire [183].
Tiré de Don C.Rockey et Scott L. Friedman., 2006
15
Figure 8: Formes physio-pathogéniques de la fibrose hépatiqueLes récepteurs de nucléotides ainsi que les enzymes qui les hydrolysent sont exprimés sur les différents types cellulaires du foie [10, 116, 184-188]. L’expression de ces proteines est de plus modulée en période inflammatoire [189, 190]. C’est ainsi que les nucléotides sont impliqués dans plusieurs fonctions essentielles du foie dont la glycorégulation [9, 191-193], la sécrétion biliaire[194, 195], la prolifération cellulaire [100, 196, 197], le métabolisme du cholestérol[198] et celui de l’urée [199].
Les NTPDases sont toutes exprimées dans les structures du foie et diffèrent par leurs localisations : les NTPDase1,-2 et -8 sont à la surface cellulaire tandis que les NTPDase4-7 n’y sont détectées qu’au niveau transcriptionnel [68]. Les données de notre laboratoire sur le rat et le porc, révèlent que les NTPDase8, -1 et -2 sont, dans cet ordre, les plus exprimées dans le foie et aussi responsables de l’essentiel de l’activité ATPasique dans cet organe. L’AMP produit par l’hydrolyse des nucléotides est transformé en adénosine par l’ecto-5’-nucléotidase. L’adénosine, via certains de ses récepteurs, possède des propriétés anti-inflammatoires [200-203]. Grace aux anticorps contre les NTPDases developpés dans notre laboratoire, nous avons localisé la NTPDase1 au niveau de l’endothéluim des vaisseaux et sur les cellules de Kupffer, la NTPDase2 au niveau subendothélial et des fibroblastes portaux [204]. La NTPDase8 qui se trouve dans les canalicules biliaires du foie, y co-localise avec le CD73 [2]. L’expression de la NTPDase2 se trouve du reste regulé à la hausse de même que celle de la CD73, dans les cellules HSC activées [189, 205].
16
1.5. Hypothèse et objectifs du projet
Ce travail se justifie d’une part, par la grande difficulté qui existe dans l’élaboration des inhibiteurs spécifiques des ectonucleotidases en vue d’en cerner le rôle, et aussi et surtout par l’avancée scientifique majeure réalisée dans notre laboratoire à savoir, la découverte de la NTPDase majeure du foie (NTPDase8).
Nous émettons l’hypothèse que la NTPDase8 a un effet protecteur dans la fibrose du foie en hydrolysant les agents proinflammatoires que sont les nucléotides extracellulaires relâchés au cours des hépatites chroniques et aussi en favorisant la formation de la molécule anti-inflammatoire adénosine. Pour vérifier cette hypothèse, mon objectif a été de déterminer l’impact de cette enzyme dans la fibrose hépatique en utilisant les souris déficientes en NTPDase8. Comme premier objectif il fallait donc produire cette lignée de souris et aussi produire des anticorps spécifiques pour faciliter son étude.
1.6. Méthodologie du projet
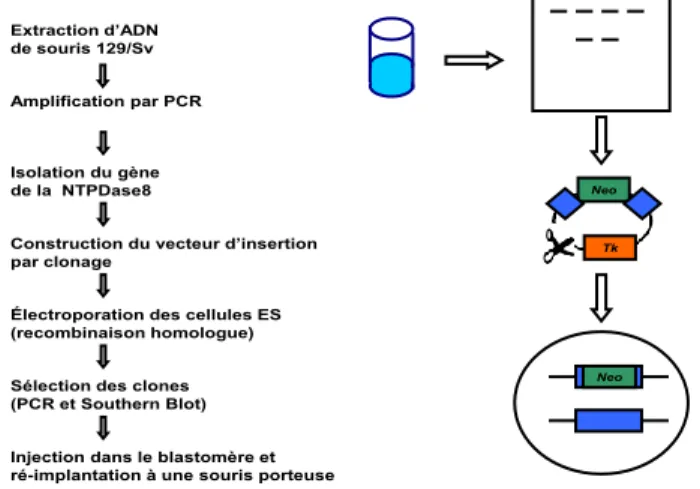
1.6.1. Production de la souris Entpd8
-/-Des cellules souches embryonnaires de souris déficientes pour le gène complet codant pour la NTPDase8 fournies par le service KOMP de l’université de Californie, ont été injectées dans des blastocystes de souris B6(Cg)-Tyrc-2j/J par la plateforme de transgénèse de l’Institut de Recherche en Immunologie et Cancérologie de Montréal. Les chimères obtenues ont été rétro-croisées dans notre laboratoire pendant 7 générations avec des souris C57/BL6 en sélectionnant les souris
17
Lignée de souris Entpd8
-/-Extraction d’ADN de souris 129/Sv Amplification par PCR
Isolation du gène de la NTPDase8
Construction du vecteur d’insertion par clonage
Électroporation des cellules ES (recombinaison homologue)
Sélection des clones (PCR et Southern Blot)
Neo
Blastocyste(s) Entpd8
+/-Injection dans le blastomère et ré-implantation à une souris porteuse
Neo
Tk
Figure 9: Design des blastocystes Entp8+/-
1.6.2. Production d’anticorps anti-NTPDase8
Les anticorps polyclonaux contre la NTPDase8 de souris ont été obtenus en immunisant des cochons d’Inde à l’aide d’un vecteur d’expression encodant le gène d’intérêt. Les animaux ont été injectés par voie intra-dermique et intra-musculaire aux semaines 0, 2, 4, 12 et 20 avec 200 µg de plasmide. Le sang a été prélevé 2 semaines après les injections à partir de la troisième injection.
1.6.3. Transfection et préparation des protéines recombinantes
Les cellules COS-7 ont été transfectées avec les plasmides d’intérêt par la méthode utilisant la lipofectamine. Après 3 lavages avec du tampon tris-saline à 4°C, les cellules ont été suspendues dans un tampon 95 mM NaCl, 0.1 mM PMSF, 45 mM Tris, pH 7.5 puis centrifugées 2 fois à 300 g pendant 10 minutes à 4°C. Le culot a ensuite été resuspendu dans le même tampon additionné de 10 µg/ml d’aprotinine, soniqué puis centrifugé de nouveau (3000 RPM pendant 5 min à 4°C). Le surnageant qui contenait les protéines recombinantes a été conservé à -80°C.
1.6.4. Western blot, ELISA et PCR
L’électrophorèse des protéines du foie total a été faite sur SDS-PAGE en conditions non réductrice et le transfert sur une membrane d’Immunoblon-P. Après incubation avec le premier anticorps, la visualisation s’est réalisée grâce au second anticorps couplé à la peroxydase de Raifort (HRP) et à un réactif chimiluminescent.
L’apoptose des hépatocytes [206] et des macrophages [207] étant à la base de la production des médiateurs de fibrogènese [208], nous avons dosé la cytokine TGFβ (tissulaire) qui se trouve être
18
le médiateur principal de la fibrogenese, par ELISA. Pour ce faire, le foie a été homogeneisé suivi d’une étape d’activation acide (HCl 1N) et de neutralisation (1,2N NaOH/0,5M HEPES) du TGFβ latent conformément aux spécifications du fabricant du Kit. Les échantillons de dilution 1/100 dans du PBS 1X ainsi que les standards ont été analysés en triplicata. La densité optique de chaque puit a été determinée à 450nm de longueur d’onde grace à un lecteur de plaque.
Les PCR réalisées dans mon projet l’ont été en utilisant 50 à 100 mg de tissu (Pavillon de l’oreille ou Foie) collecté dans une solution de RNA later. En effet pour le genotypage, 50 ng d’ADN génomique extrait de l’oreille des souris a été amplifié par PCR avec la Taq Polymérase et des
amorces spécifiques à la NTPDase8 (F: TGT AAGGGCCAGAAGGATTG; R:
GTACAGACCCGAGGCACAGT) ou celles de la néomycine (F: TCATTCTCAGTATTGTTTTGCC; R: CAGGCATCTAGGATCTGCTC) en 34 cycles de PCR. Pour la RT-PCR, l’extraction de l’ARN total du tissu hépatique a été faite par la méthode utilisant le Trizol. 1 µg d’ARN a servi à la synthèse du cDNA en utilisant le Superscript IIIRT. L’amplification de 1 µl de solution de cDNA a eu lieu dans un volume final de 25 µl de solution contenant 10 pMol de chaque amorce de la NTPDase8 en 28 cycles de PCR . La séparation du produit faite sur gel d’agarose et la visualisation par la technique du Redsafe.
1.6.5. Immunohistochimie et activité enzymatique in situ
Pour l’immunohistochimie, le foie fraichement collecté a été recouvert de gel OCT (Optimum Cutting Temperature), rapidement congelé par immersion dans l’isopentane froid et conservé à -80°C. Des cryosections de 6 µm ont ensuite été étalées sur lame, fixées par le mélange formaline 10%-acétone froid, puis incubées avec les anticorps spécifiques de détection. La rate et le colon ont été utilisés comme tissus contrôles selon les cas.
La prolifération constitue un mécanisme de survie du foie notamment dans les cholestases
obstructives [194] et dans les hépatites. Elle a été évaluée par marquage du Ki67 qui est une protéine présente uniquement dans les noyaux de cellules en cycle cellulaire et ce, quelque soit la phase.
L’infiltration leucocytaire a été focalisée sur les macrophages qui sont et constituent une source
première de TGFβ essentiel à la tranformation des cellules étoilées et à la fibrogenèse hépatique, par marquage au F4/80.
Le contenu en myofibroblastes qui sont des cellules étoilées transformées par l’activation, a été
mise au point par le marquage de l’actine de muscles lisses (α-SMA) qu’elles expriment.
La localisation de l’activité enzymatique in situ a été fait selon la méthode de Braun et al. [209]. Les
cryosections ont été à cet effet, incubées avec les divers nucléotides comme substrats en présence du
lévamisole pour inhiber l’activité de la phosphatase alkaline tissulaire.
19
1.6.6. Fibrose hépatique
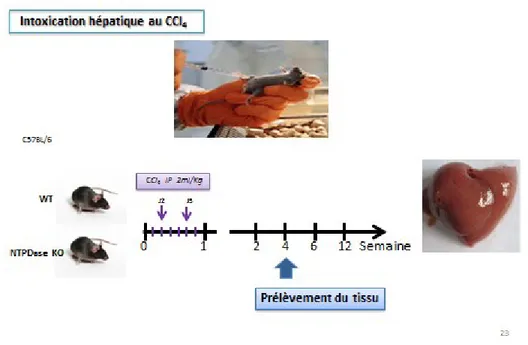
1.6.6.1. Fibrose hépatique non biliaire
Pour induire la fibrose non biliaire, les souris mâles de 2 à 3 mois ont été injectées avec 2 ml/kg de CCl4 (15% v/v dans l’huile minérale) deux fois par semaine en intra-péritonéal tandis que
les souris contrôles ne recevaient que de l’huile minérale. Les tissus ont été prélevés 4 semaines plutard pour analyse (Figure 10).
Figure 10: Modèle expérimental d’intoxication des souris au CCl4
La lésion hépatique a été évaluée par les colorations Hématoxyline-Éosine, Trichrome-Masson, et Sirius Red sur des cryosections de 6µm de tissu préalablement fixé à la formaline 10%-PBS1X puis enrobé dans la paraffine.
20
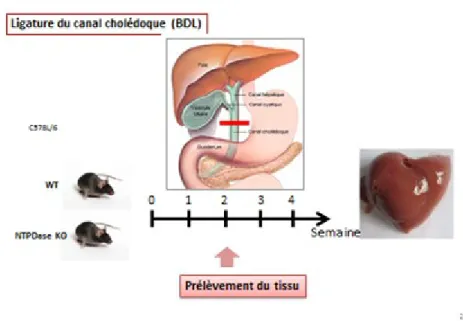
1.6.6.2. Fibrose hépatique biliaire
Pour induire la fibrose biliaire, une laparotomie a été effectuée sous anesthésie à l'isoflurane selon les principes opératoires standards. Après rasage et désinfection de la paroi abdominale sous-xiphoïdienne, une incision médiane a été effectuée sur la parois abdominale antérieure. Les lobes du foie ont été délicatement écartés pour exposer les voies biliaires [210]. Le canal cholédoque a été isolé et ligaturé à l'aide de deux fils de suture (Figure 11). Les souris contrôles ont aussi été opérées mais sans ligaturer le cholédoque (SHAM). L'incision abdominale a été suturée en deux plans à la fin du modèle. Les souris furent sacrifiées à 2 semaines post-opératoire pour le prélèvement et analyse tissulaire, conformément au schéma évolutif de la fibrose dans l’espèce [211].
Figure 11: Modèle expérimental de ligature du canal biliaire commun des souris
La lésion hépatique a été évaluée par les colorations Hématoxyline-Éosine, Trichrome-Masson, et Sirius Red sur des cryosections de 6 µm de tissu préalablement fixé à la formaline 10%-PBS1X puis enrobé dans la paraffine.
21
Chapître 2.
Résultats
2.1. Production et caractérisation de la souris Entpd8
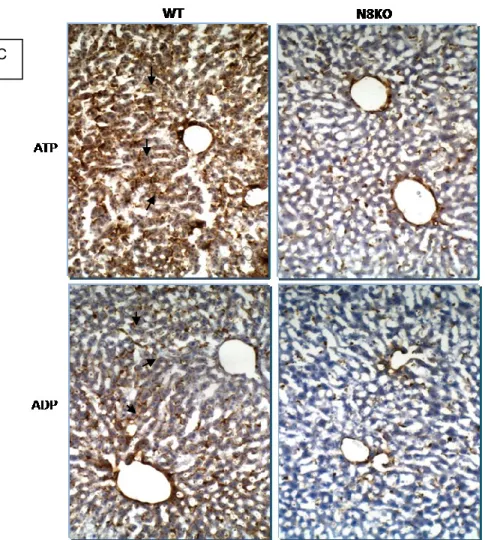
-/-La NTPDase8, qui est le dernier membre de la famille des E-NTPDases, contribue pour l’essentiel de l’activité ATPasique du foie. Dans le but d’élucider le rôle de cette enzyme récemment découverte, nous avons généré une lignée de souris qui n’exprime pas cette enzyme, soit des souris Entpd8-/-, dans le fond génétique C57/BL6. La délétion du gène encodant la NTPDase8 chez nos souris mutantes a été vérifiée par PCR au niveau de l’ADN génomique (figure 12A) et de l’ARN (figure 12B). L’absence de signal (figure 12A, puits 3&4) confirme le succès de la delétion du gène. L’absence de transcrits d’ARN a été vérifiée par RT-PCR en utilisant un extrait total du foie et qui a été retranscrit en ADNc par SuperScript-III. On a pu donc confirmer à ce stade également, l’absence de trace de transcripts de la NTPDase8 (figure 12B, puit 5) chez la souris deficiente en cette enzyme. L’absence de la protéine a été confirmée par immunobuvardage et immunohistochimie avec un anticorps contre la NTPDase8 de souris que nous avons généré au laboratoire. La spécificité de l’anticorps a été validée par immunobuverdage, sur des extraits de protéines recombinantes de cellules COS-7 transfectées avec un vecteur exprimant le gène de la NTPDase8, où l’anticorps détecte la NTPDase8 seulement dans les cellules COS-7 tranfectées et dans l’homogénat du foie WT (figure 13A). En immunohistochimie, Les canalicules biliaires ont été marqués en brun par l’anticorps spécifique de la NTPDase8 seulement chez la souris sauvage (figure 13B) alors que la souris KO ne montre aucun signal. La mesure de l’activité enzymatique (ATP et ADPasique) in situ a mis en évidence une absence totale d’hydrolyse des nucléotides ATP & ADP au niveau des canalicules biliaires de la souris NTPDase8-/- (figure 13C).
Comme la déficience du gène, de l’ARN, de la protéine et de l’activité de la NTPDase8 a été confirmée ci-dessus nous avons ensuite utilisé ces souris Entpd8-/- dans un modèle de fibrose hépatique afin d’élucider le rôle de cette enzyme dans l’inflammation du foie.
1. Souris WT
2. Blanc
3. Souris Entpd8 KO1
4. Souris Entpd8 KO2
A
22
Figure 12: Caractérisation génomique de la souris Entpd8-/-. (A) Genotypage des souris Entpd8-/-.
50 ng d’ADN génomique extrait de l’oreille des souris ont été amplifiés par PCR avec la Taq Polymérase et des amorces spécifiques à la NTPDase8 (F: TGT AAGGGCCAGAAGGATTG; R: GTACAGACCCGAGGCACAGT) ou celles de la néomycine (F: TCATTCTCAGTATTGTTTTGCC; R: CAGGCATCTAGGATCTGCTC) en 34 cycles de PCR. On note une absence du gène encodant la NTPDase8 dans le puit 5. (B) RT-PCR de la Entpd8 dans le foie de souris. 1 µg d’ARN extrait du foie a été retranscrit en ADNc par SuperScript-III. L’amplification de 1 µl de la solution du cDNA s’est fait dans un volume total de 25 µl contenant 10 pMol de chaque amorce de la NTPDase8 en 28 cycles de PCR. La séparation des produits obtenus a été effectuée sur gel d’agarose 1,8% suivie de la visualisation par la technique Redsafe. On note une absence de transcrit d’ARNm au niveau du foie de la souris Entpd8-/- (position 5)
23
24
Figure 13: Caractérisation protéique de la souris Entpd8
-/-(A) Western blot de la NTPDase8. Un homogénat de foie (30 µg), de cellules COS-7 (6µg) transfectées de façon transitoire avec un vecteur codant pour la NTPDase8 de souris, et de cellules COS-7 non transfectées (ctrl négatif), ont été chargés sur des gels Bis-Tris 4 - 12% NuPAGE ® Novex ® dans des conditions non réductrices, transférés sur une membrane Immobilon-P, incubés avec le sérum de cochon d’inde généré contre la NTPDase8 de souris puis visualisés. L’anticorps détecte la NTPDase8 seulement dans les cellules COS-7tranfectées avec un vecteur d’expression encodant la NTPDase8 et dans l’homogénat du foie WT. (B) Immunohistochimie. On note un marquage brun (flèches) au niveau des canalicules biliaires du foie chez la souris sauvage (WT) et
son absence chez la souris Entpd8-/-. (C) Activité ATPasique et ADPasique. Il y a un marquage
brun (flèches) au niveau des canalicules biliaires du foie WT aussi bien pour l’ATP que pour l’ADP qui sont les substrats de tous les ectonucléotidases présentes dans le foie. Ce marquage est absent au niveau des canalicules biliares et sensiblement réduit sur le reste du tissu chez la souris
Entpd8-/-.
25
2.2. La NTPDase8 dans la fibrose hépatique précoce
Puisqu’il est admis à ce jour que les mécanismes cellulaires de la fibrose biliaire se distinguent de ceux de la non biliaire [212], et que les deux modèles s’appliquent aux hépatites chroniques humaines, j’ai développé les deux modèles chez la souris C57BL/6 : La fibrose toxique (non biliaire) par intoxication des souris au tétrachlorure de carbone (CCl4) et la fibrose biliaire par ligature
complète du canal cholédoque. Pour chaque modèle, les souris ont été réparties en deux groupes (Contrôle et Traitées) selon le génotype (sauvage ou déficient en NTPDase8) et hébergées selon les recommandations du Conseil Canadien de Protection des Animaux (CCPA) et du Comité de Protection des Animaux de l’Université Laval (CPAUL). Elles ont eu accès à l’eau et à une diète pour rongeurs à volonté. Nous avons respecté un rythme circadien de 12 heures de lumière suivi de 12 heures d’obscurité, et les animaux ont été sacrifiés selon un chronogramme issu de phases d’installation de la fibrose (précoce, en pont et tardive) suivant le modèle en cours. Dans ce mémoire, nous nous somme limités à évaluer la fibrose précoce soit à 2 et 4 semaines respectivement pour la fibrose biliaire et non biliaire. En plus d’un suivi comportemental et de poids, plusieurs facteurs reliés à la maladie ont été évalués à l’aide des techniques et instruments dont la plupart étaient disponibles et perfectionnés dans notre laboratoire.
Considérant que les nucléotides extracellulaires en se fixant aux récepteurs P2 induisent la production des cytokines pro-inflammatoires [213, 214], nous avions posé l’hypothèse que les souris déficientes en NTPDase8 soient plus malades et que le profil de la maladie diffère suivant le type de fibrose.
2.2.1. Histopathologie comparée dans la fibrose au CCl
4La lésion hépatique a été analysée par la coloration à l’Hématoxyline & Eosine (pour l’évaluation de la structure des cellules, du noyau, du cytoplasme et des rapports cellulaires) et celles de Trichrome-Masson et de Sirius Red pour la visualisation du collagène.
En Hématoxilline-Éosine, Le compte des zones de nécrose et d’infiltrats inflammatoires a été réalisé sur 10 champs microscopiques aléatoires par coupe et par animal, au grossissement 20X (n=3). On a pu constater quelques foyers inflammatoires chez les souris NTPDase8-/- contrôles contrairement aux souris sauvages qui se sont revelées intactes au point de vue lésionnel. A la suite d’un traitement au CCl4, on a contaté une plus grande tendance lésionnelle comparativement
aux souris NTPDase8-/-(Figure 14A).
Au Trichrome-Masson (TM) ou Sirius red (SR), les zones de fibrose ont été colorées en bleu-vert ou en rouge respectivement. Le pourcentage des zones colorées par champs microscopique a été calculé en recourant au logiciel Image-J, pour 10 champs microscopiques aléatoires par coupe et
26
par animal, au grossissement 20X (n=3). Au SR, les souris déficientes traitées à l’huile minérale ont présenté plus de zones de fibrose que les souris sauvages (0,24% et 0,17% respectivement) alors que l’inverse a été constaté lorsque les souris ont été soumises au CCl4 (0,32% et 0,34%
respectivement; p=0,0847; figure 14B). De même au TM, les souris déficientes traitées à l’huile minérale ont présenté plus de zones de fibrose que les souris sauvages (0,22% et 0,10% respectivement) alors que l’inverse a été constaté lorsque les souris ont été soumis au CCl4 (1,12%
et 1,48% respectivement; p=0,4776) Figure 14C.
A
27
Figure 14: Lésions hepatocellulaires par intoxication au CCl4Les souris Entpd8-/- (N8KO) et les souris sauvages (WT) ont été traitées au CCl
4 pendant 4
semaines puis sacrifiées. Les cryosections de foie enrobées dans la paraffine ont été colorées à (A) l’Hématoxyline-éosine (Foyers inflammatoires sur flèches), au (B) rouge de Sirius ( Fibrose
en rouge) et au (C) trichrome de Masson (Fibrose en bleu). Dans les trois cas, on aperçoit que les
souris Entpd8-/- ont tendance à présenter moins de lésions après intoxication au CCl4. P-value
0,0847 (B) et 0,4776 (C)
2.2.2. Évaluation de la prolifération cellulaire
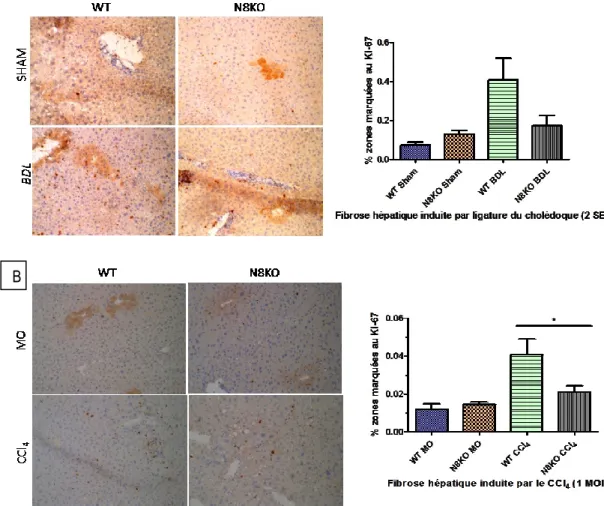
La prolifération cellulaire est un signe qui traduit la phase de recupération ou de réparation d’une attenite lésionnelle d’un organe. A ce titre, elle traduit le dégré d’atteinte tissulaire. Pour évaluer ce paramètre, des cryosections de foie de souris ont été marquées en immunohistochimie, par l’anticorps anti-Ki-67. Ce dernier marque en brun indistictinctement de leur phase, tous les noyaux en cycle cellulaire. Le pourcentage des zones marquées par champs microscopique a été calculé en recourant au logiciel Image-J, pour 10 champs microscopiques aléatoires par coupe et par animal, et au grossissement 20X (n=5).
Considérant le modèle de ligature du canal cholédoque (BDL), les souris déficientes SHAM ont présenté plus de zones de marquage brun que les souris sauvages (0,17% et 0,09% respectivement) alors que l’inverse a été constaté lorsque les souris ont été soumis au protocole
BDL (0,19% et 0,41% respectivement); p=0,1364; figure 15A. Quant au modèle toxique au CCl4, la
même tendance a été remarquée mais d’uen façon plus marquée. En effet, les souris déficientes traitées à l’huile minérale ont présenté plus de zones de marquage brun que les souris sauvages (0,015% et 0,012% respectivement) alors que l’inverse a été constaté lorsque les souris ont été
soumis au CCl4 (0,022% et 0,043% respectivement; p=0,0234) Figure 15B.
C
D
28
Figure 15: La prolifération cellulaire dans la fibrose hépatique.
Les souris Entpd8-/- (N8KO) et les souris sauvages (WT) ont fait l’objet d’une chirurgie de ligature du canal biliaire commun (A) ou traitées au CCl4 (B) puis sacrifiées respectivement à 2 et 4
semaines. Les cryosections de 6 μ ont été marquées en IHC avec l’anti-Ki67.On constate une proliferation(petits points bruns) plus importante chez les souris WT traitées par rapport aux souris N8KO dans les mêmes conditions. P-value 0,1364 (A) et 0,0234 (B)
2.2.3. Évaluation de l’infiltration leucocytaire
Les leucocytes ou globules blancs sont essentiels dans le phenomène inflammatoire à la base de l’hépatite chronique menant à la fibrose. Les macrophages résidents ou cellules de Kuppfer ont été ciblés pour analyser l’infiltration leucocytaire dans ce travail. En immunohistochimie, nous avons marqués les macrophages en brun en recourant à l’anti-F4/80. Les souris Entpd8-/- (N8KO) et les souris sauvages (WT) ont été traitées au CCl4 puis sacrifiées à 4 semaines. Les membranes
cellulaires de macrophages ont été teintées en brun en immunohistochimie, sur des cryosectons de foie. Le pourcentage des zones marquées par champs microscopique a été calculé en recourant au
29
logiciel Image-J, 10 champs microscopiques aléatoires par coupe et par animal, et au grossissement 20X (n=3). Les souris déficientes traitées à l’huile minérale ont présenté plus de zones marquées (macrophages) que les souris sauvages (0,026% et 0,01% respectivement) alors que l’inverse a été constaté lorsque les souris ont été soumis au CCl4 (0,096% et 0,121%
respectivement; p=0,7762; figure 16).
Figure 16: Infiltration des macrophages dans la fibrose hépatique
Les souris Entpd8-/- (N8KO) et les souris sauvages (WT) ont été traitées au CCl4 puis sacrifiées à 4
semaines. Les cryosections de 6 μ ont été marquées en IHC avec l’anti-F4/80. On constate une infiltration à tendance plus importante des macrophages chez les souris WT traitées par rapport aux souris N8KO dans les mêmes conditions. P-value 0,7762
2.2.4. Quantification des myofibroblastes
A la base de la fibrose hépatique se trouvent les des cellules capables de secreter les élements de la matrice extracellulaire. Ces cellules ont été identifiées possédant des propriétés contractiles grace aux filaments d’actine qu’elles expriment au même titre que les cellules musculaires lisses. L’acquisition de la contractilité de cellules étoilées est le résultat de leur activation par les stimuli inflammatoires et les cytokines du milieu. Elles deviennent ainsi des myofibroblastes que nous avons quantifiés en les marquant en immunohistochimie, par l’anti-actine de muscles lisses (α-SMA). Les souris Entpd8-/- (N8KO) et les souris sauvages (WT) ont été traitées au CCl4 puis
sacrifiées à 4 semaines. Les filaments d’actine cellulaires de myofibroblastes ont été teintés en bruns en immunohistochimie, sur des cryosectons de foie. Le pourcentage des zones marquées par champs microscopique a été calculé avec le logiciel Image-J, pour 10 champs microscopiques aléatoires par coupe et par animal, et au grossissement 20X (n=3). Les souris déficientes traitées à l’huile minérale ont présenté quelques zones marquées (myofibroblastes) alors que les souris sauvages se sont revelées indemnes. Lorsque les souris ont été soumises au CCl4, les souris
30
deficientes ont presenté moins de zones marquées que les souris sauvages soit 0,022% et 0,038% respectivement (p=0,2088; Figure 17).
Figure 17: Infiltration des myofibroblastes dans la fibrose hépatique
Les souris Entpd8-/- (N8KO) et les souris sauvages (WT) ont été traitées au CCl4 puis sacrifiées à 4
semaines. Les cryosections de 6μ ont été marquées en IHC avec un anti-αSMA. On constate une présence à tendance plus importante de myofibroblastes chez les souris WT traitées par rapport aux souris N8KO. P-value 0,2088
2.2.5. Évaluation de l’expression tissulaire des cytokines
Les cytokines impliquées dans l’inflammation et la fibrose au niveau du foie, sont nombreuses. Le TGFβ est particulièrement important pour la transformation myofibroblastique des cellules étoilées. Nous l’avons dosé par la technique d’immunocapture, sur des homogénats d’extraits totaux du foie des souris. Les souris Entpd8-/- (N8KO) et les souris sauvages (WT) ont été traitées au CCl4 puis
sacrifiées à 4 semaines. Les tissus hépatiques ont été homogénéisés mécaniquement puis centrifugé et le surnageant collecté a été utilisé pour determiner le contenu en TGFβ par ELISA. Les souris (n=3) Entpd8-/- ont tendance à présenter des taux faibles après traitement (181 pg/ml) comparé aux souris sauvages (234 pg/ml) Figure 18. L’inverse est constaté sans traitement. Mais les souris WT (n=6) traitées au CCl4 présentent un taux de TGFβ significativement plus élevé
31
Figure 18: Quantification du TGFβ dans la fibrose hépatique au CCl4Les tissus hépatiques ont été homogénéisés mécaniquement puis centrifugé et le surnageant collecté a été utilisé pour determiner le contenu en TGFβ par ELISA. Les souris (n=3) Entpd8-/- ont tendance à présenter des taux faibles après traitement comparé aux souris sauvages. L’inverse est constaté sans traitement. Mais les souris WT traitées au CCl4 présentent un taux de TGFβ très
significativement plus élevé (p=0.0042) lorsque la fibrose évolue depuis 3 mois (Phase non abordée dans ce mémoire).
2.3. Discussion
Jusqu’à ce jour, il a été rapporté que la NTPDase8 est responsable de la majeure partie de l’hydrolyse des nucléotides extracellulaires dans le foie de rat [215]. L’enzyme a été découverte par notre laboratoire qui l’a ensuite cloné et caractérisé biochimiquement. Cependant, les outils pouvant permettre l’étude de l’impact de cette enzyme in vivo viennent à peine d’être mis au point avec ce travail.
La souris Entpd8-/- obtenue à la suite du processus de délétion et rétrocroisement est
viable. De même, l’anticorps polyclonal généré par immunisation des animaux, reconnait en western blot sur les cellules COS7 transfectées et sur un homogénat de foie de souris sauvage, spécifiquement la protéine de 75 kD qui correspond à notre enzyme (Figure 13A). Le marquage de la protéine par le même anticorps en immunohistochimie sur une cryosection de foie de souris
32
sauvage et l’absence de ce marquage chez la souris déficiente confirme à la fois le succès de la délétion ainsi que la spécificité de l’anticorps que nous avons généré (Figure 13B).
La fibrose hépatique constitue la complication commune des hépatites chroniques. Elle implique un dépôt des protéines de la matrice extracellulaire (fibres collagènes, élastiques…), une activation de cellules capables de secréter des médiateurs inflammatoires (cytokines, nucléotides…) et un remodelage tissulaire. Nous avons montré que la ligature biliaire et l’intoxication des souris au CCl4 induisent une inflammation et une fibrose hépatique précoce à
tendance différentielle selon que la souris soit sauvage ou Entpd8-/-, à 2 et 4 semaines comme le
témoignent les zones de nécrose, la présence des cellules littorales et fibreuses ainsi que les foyers inflammatoires.
Les colorations Hématoxyline & Éosine, Sirius red et Trichrome-Masson, pour évaluer l’architecture générale du tissue pour la première et la distribution de la fibrose pour les autres, nous permettent d’affirmer que les souris Entpd8-/- sont à la base plus inflamées et fibrotiques comparativement aux souris sauvages. Parallèlement, ces souris présentent moins d’atteintes aussi bien après le modèle chimique que mécanique d’induction de fibrose hépatique que nous avons utilisés.
Les hépatocytes constituant à plus de 80% le parenchyme hépatique sont des cellules douées d’un grand pouvoir de régénération à la suite des lésions aussi bien aigues que chroniques [216]. Cette propension accrue à proliférer constitue aussi une forme d’adaptation en vue du remplacement de cellules devenues non fonctionnelles à la suite de l’agression. Bien qu’étant souvent associée à un pronostic meilleur [217], la régénération hépatique est parfois source de transformation maligne. Nous avons pu constater qu’à la suite du maquage de la protéine nucléaire Ki-67 par son anticorps spécifique, les souris Entpd8-/- présentent un faible pourcentage prolifératif lorsqu’elles sont traitées au CCl4 comparativement aux souris sauvages (Figure 15 A&B). Ce qui semble soutenir la thèse
qu’elles sont moins lesées que les souris sauvages.
Les macrophages constituent le gage de l’immunité cellulaire locale. Ces cellules sont les premières à entrer au contact de l’agresseur en vue d’initier et d’amplifier la réponse immunitaire ciblée. Lorsque les hépatocytes sont agressées ou détruites, elles libèrent des médiateurs inflammatoires qui vont activer les macrophages. Ceux-ci vont secréter des cytokines à la base de l’activation de la transformation des cellules étoilées en myofibroblastes. En évaluant la quantité de macrophages dans la fibrose hépatique, il en ressort que l’infiltration de ces cellules tend à être plus marquée chez les souris sauvages traitées au CCl4 ou à la ligature du canal biliaire commun
comparativement aux souris sauvages (Figure 16).
Quelque soit son étiologie, l’hépatite chronique débouche sur la fibrose qui est le résultat d’un processus de cicatrisation anormal [218]. Il s’y accumule une quantité importante de protéines fibreuses comme le collagène type I produites par les myofibroblastes [219]. Ces derniers proviennent de l’activation et de la transformation des cellules étoilées (HSCs) et expriment à leur