UNIVERSITE DE PICARDIE JULES VERNE
UFR DE PHARMACIE
THÈSE
Pour le diplôme d’état deDOCTEUR EN PHARMACIE
Soutenue publiquement le 21 septembre 2017 parAxel HENRY - CHEBIRI
Efficacité de la rifampicine associée à une
fluoroquinolone dans le traitement de relais
des endocardites à Staphylococcus aureus
sensible à la méticilline
Thèse dirigée par le Dr EL SAMAD Youssef
JURY :
Présidente : Docteur Isabelle SIX, chercheur au CURS, INSERM U1088
Membres : Docteur Youssef EL SAMAD, infectiologue, CHU d’Amiens-Picardie Docteur Jean-Philippe LANOIX, infectiologue, CHU d’Amiens-Picardie Docteur Christine VANTYGHEM, pharmacienne, CHU d’Amiens-Picardie
1
Remerciements
Je tenais à remercier :Le Docteur Youssef EL SAMAD, pour avoir accepté d’être mon directeur de thèse, pour
m’avoir aidé dans la concrétisation de l’étude et sa rédaction ainsi que pour son soutien et tous les conseils prodigués.
Le Professeur Jean-Luc SCHMIT, pour avoir secondé le Dr EL SAMAD pendant son absence et
avoir pris le temps de m’accompagner dans la méthodologie et la rédaction de cette étude ainsi que pour ses enseignements au cours de mes 4ème, 5ème et 6ème années de pharmacie. Le professeur TRIBOUILLOY, Cardiologue au CHU d’Amiens-Picardie, pour avoir accepté de
partager avec moi une partie de sa base de données.
M. Momar DIOUF, biostatisticien au CHU d’Amiens-Picardie, qui m’a apporté une aide
précieuse dans les analyses des données statistiques.
Le Docteur Isabelle SIX, chercheur au CURS, INSERM U1088, pour ses enseignements
enrichissants au cours des 3ème et 4ème années de pharmacie et pour le goût de la recherche
qu’elle a su me transmettre.
Le Docteur Christine VANTYGHEM, pour sa sympathie, ses encouragements et sa
participation en tant que jury.
Le Docteur Jean-Philippe LANOIX, pour avoir accepté de juger ce travail et pour me faire
l’honneur de sa présence.
L’ensemble du corps enseignant de l’UFR de pharmacie pour son implication, sa motivation
ainsi que les connaissances et les savoirs transmis.
Amélie DUPONT, ma compagne, pour son appui indéfectible au cours de la rédaction de
cette thèse. Je la remercie particulièrement pour tous ses conseils avisés et pour le travail qu’elle a effectué lors de la relecture. Qu’elle soit assurée de toute ma reconnaissance et de mon amour
Ma maman, pour son soutien et sa patience
Ma tante Fabienne et mon oncle Pierre (TGP) pour le gite, le couvert ainsi que leur soutien
au cours de mes 9 années d’études et la confiance qu’ils m’ont témoignée.
Mon frère jumeau, mes sœurs, Ambre, Agnès et Yvan
Mes beaux-parents pour le gite et le couvert, pour leur soutien et leurs encouragements Les pharmaciens et les médecins du CHU d’Amiens-Picardie et surtout Mme VACHER pour
2
L’ensemble des internes (dont Rémi, Ilan, Emilie, Fabien(s), Flavien, Younes, Myriam, Inès et bien d’autres) que j’ai croisés au cours de ma 5ème année hospitalo-universitaire, pour leur
accueil, leur gentillesse et leurs encouragements pour la suite
Lucie, Marie-Anne, Audrey, Pauline pour les moments passés ensemble, pour être
présentes lorsque j’ai besoin de vous et pour votre amitié
3
Serment de Galien
Je jure, en présence des maîtres de la faculté, des conseillers de l’ordre des
pharmaciens et de mes condisciples :
- D’honorer ceux qui m’ont instruit dans les préceptes de mon art et de
leur témoigner ma reconnaissance en restant fidèle à leur
enseignement ;
- D’exercer, dans l’intérêt de la santé publique, ma profession avec
conscience et de respecter non seulement la législation en vigueur,
mais aussi les règles de l’honneur, de la probité et du
désintéressement ;
- De ne jamais oublier ma responsabilité et mes devoirs envers le
malade et sa dignité humaine.
En aucun cas, je ne consentirai à utiliser mes connaissances et mon état pour
corrompre
les
mœurs
et
favoriser
des
actes
criminels.
Que les hommes m’accordent leur estime si je suis fidèle à mes promesses.
Que je sois couvert d’opprobre et méprisé de mes confrères si j’y manque.
4
Table des matières
Liste des abréviations ... 8
Généralités ... 12
Introduction ... 12
1. Endocardite infectieuse ... 13
1.1 Définition ... 13
1.1.1 EI communautaire ... 13
1.1.2 EI liée aux soins ... 13
1.1.3 EI liée à une toxicomanie intraveineuse ... 13
1.2 Epidémiologie des EI ... 14
1.3 Microbiologie des EI ... 14
1.4 Portes d’entrée ... 16
1.5 Outils diagnostiques de l’EI ... 19
1.5.1 Association terrain et symptômes ... 19
1.5.2 L’imagerie médicale ... 20
1.5.2.1 L’écho-cardiographie ... 20
1.5.2.2 La tomodensitométrie ... 21
1.5.2.3 L’imagerie par résonnance magnétique ... 21
1.5.2.4 L’imagerie nucléaire... 21
1.5.3 Examen biologique et bactériologique ... 22
1.5.3.1 Marqueurs de l’inflammation ... 22
1.5.3.2 La recherche bactériologique ... 23
1.5.3.2.1 Les hémocultures et la mise en culture ... 23
1.5.3.2.2 L’antibiogramme ... 24
1.5.4 Critères de Duke modifiés par Li ... 24
1.6 Complications ... 25 1.7 Co-morbidités ... 26 1.8 Pronostic ... 27 2. Staphylococcus aureus ... 28 2.1 Caractères morphologiques ... 28 2.1.1 Morphologie de la bactérie ... 28
2.1.2 Morphologie des colonies ... 28
2.3 Caractéristiques biochimiques ... 29
5
2.3.2 Catalase ... 30
2.3.3 Fermentation des sucres ... 30
2.3.3.1 Fermentation du mannitol ... 30 2.3.3.2 Fermentation du glucose ... 31 2.3.4 DNAse ... 31 2.3.5 Hémolysine alfa ... 31 2.4 Génome ... 32 2.5 Facteurs de pathogénicité ... 33 2.5.1 Capsule ... 33 2.5.2 Protéines de surface ... 34 2.5.2.1 Protéine A ... 34
2.5.2.2 Adhésines associées au peptidoglycane : MSCRAMM ... 35
2.5.2.3 Adhésines secrétées : SERAM ... 35
2.5.3 Toxines ... 36 2.5.3.1 Hémolysine ... 36 2.5.3.2 Staphylokinase ... 36 2.5.3.3 Sérine-protéase ... 36 2.5.3.4 Leucocidine de Panton-Valentine ... 36 2.5.3.5 FAME ... 37 2.5.3.6 Exfoliatine ... 38
2.5.3.7 Toxine du choc staphylococcique ... 38
2.5.3.8 Entérotoxines ... 38
2.5.3.9 ACME (Arginine Catabolic Mobile Element) ... 38
2.5.3.10 Bilan ... 38
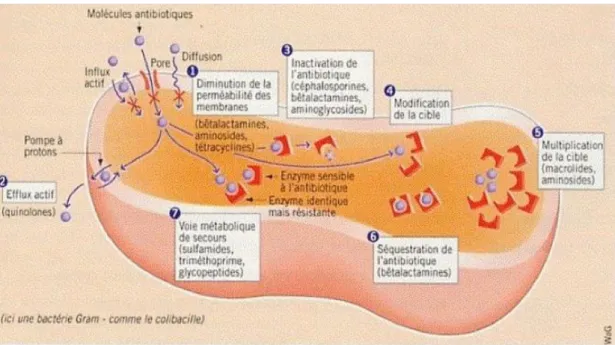
2.6 Résistance aux antibiotiques ... 39
2.6.1 Généralités ... 39
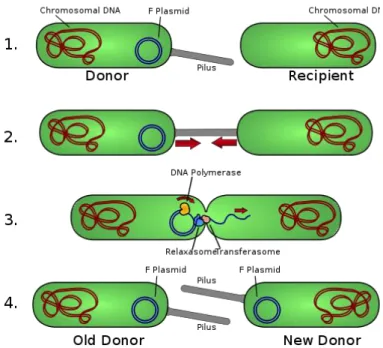
2.6.2 Mode d’acquisition ... 41
2.6.3 Mécanismes de résistance de S. aureus ... 42
2.6.3.1 Résistance aux béta-lactamines ... 42
2.6.3.1.1 Résistance aux pénicillines ... 42
2.6.3.1.2 Résistance à la méticilline ... 43
2.6.3.1.3 Résistance aux aminosides ... 44
2.6.3.1.4 Résistance aux fluoroquinolones ... 44
2.6.3.1.5 Résistance à la rifampicine ... 45
2.6.3.1.6 Résistance aux glycopeptides ... 45
6
2.6.3.1.8 Autres résistances ... 46
3. Traitement des endocardites à Staphylococcus aureus sensibles à la méticilline ... 48
3.1 Schéma thérapeutique et recommandations actuelles ... 48
3.2 Aminoside : Gentamicine ... 50
3.2.1 Mécanisme d'action ... 50
3.2.2 Spectre d’activité antibactérien ... 50
3.2.3 Pharmacocinétique ... 51
3.2.4 Posologie et adaptation... 52
3.2.5 Effets indésirables et contre-indications ... 53
3.3 Pénicillines du groupe M : oxacilline et cloxacilline ... 53
3.3.1 Mécanisme d’action ... 54
3.3.2 Spectre d'action ... 55
3.3.3 Pharmacocinétique ... 55
3.3.4 Posologie et adaptation... 55
3.3.5 Effets indésirables et contre-indications ... 56
3.3.6 Intérêts de l’association pénicilline-aminoside ... 56
3.4 Fluoroquinolones ... 57
3.4.1 Mécanisme d’action ... 58
3.4.2 Spectre d’action ... 59
3.4.3 Pharmacocinétique ... 60
3.4.4 Posologie et adaptation... 61
3.4.5 Effets secondaires et contre-indications ... 62
3.5 Rifampicine ... 62
3.5.1 Mécanisme d’action ... 62
3.5.2 Spectre d’action ... 63
3.5.3 Pharmacocinétique ... 63
3.5.4 Posologie et adaptation... 64
3.5.5 Effets indésirables et contre-indications ... 65
3.5.6 Intérêts de l’association FQ-rifampicine ... 67
Travail personnel ... 68
4. Etude de l’efficacité et de la tolérance de l’association fluoroquinolone-rifampicine en traitement de relais dans les endocardites à Staphylococcus aureus sensible à la méticilline ... 68
4.1 Introduction ... 68
4.2 Patients et méthodes... 69
4.2.1 Patients ... 69
7
4.2.3 Suivi ... 70
4.2.4 Recueil de données ... 71
4.2.5 Analyse statistique ... 71
4.3 Résultats ... 71
4.3.1 Caractéristiques des patients ... 71
4.3.2 Localisations des endocardites ... 73
4.3.3 Comparaison des traitements ... 74
4.3.3.1 Evolution ... 74
4.3.3.2 Tolérance ... 75
4.3.3.3 Rechute et décès ... 75
4.3.4 Description du groupe FQ-rifampicine ... 75
4.3.4.1 Diagnostic ... 75 4.3.4.2 Chirurgie ... 77 4.3.4.3 Antibiothérapie ... 78 4.3.4.4 Tolérance biologique ... 78 4.3.4.5 Rechutes et décès ... 79 4.4 Discussion ... 79 4.4.1 Etude ... 79 4.4.2 Description de la population ... 80
4.4.3 Comparaison des deux groupes ... 80
4.4.3.1 Survie et rechute ... 80
4.4.3.2 Taux de chirurgie ... 80
4.4.3.3 Antibiothérapie ... 81
4.4.3.4 Tolérance ... 82
4.4.4 Endocardites traitées par FQ-rifampicine ... 82
4.4.4.1 Diagnostic ... 82
4.4.4.2 Taux de chirurgie ... 83
4.4.4.3 Traitement ... 84
8
Liste des abréviations
18F-FDG : fluorodésoxyglucose
ADN : acide désoxyribonucléique AEG : altération de l’état général AHA : American Heart Association ALAT : ALanine Amino Transférases ARN : acide ribonucléique
ASAT : ASpartate Amino Transférases
BORSA : Borderline Oxacillin Staphyloccoccus aureus CHU : Centre Hospitalier Universitaire
CIA : communication inter-auriculaire Clr : clairance de la créatinine
Clf : clumping factor
CLIN : Comité de Lutte contre les Infections Nosocomiales
Cmin : concentration minimale
Cmax : concentration maximale
CMH : complexe majeur d’histocompatibilité CMI : concentration minimale inhibitrice Cna : protéine de fixation au collagène CRP : protéine C-réactive
CYP : cytochrome
DCI : dispositif cardiaque implantable EI : endocardite infectieuse
ESC : European Society of Cardiology ETT : échographie trans-thoracique ETO : échographie trans-œsophagienne
EUCAST : European Committee on Antimicrobial Susceptibility Testing FAME : Fatty Acid Modifying Enzyme
FnBP : protéines de liaison à la fibronectine FQ : fluoroquinolone
9 HACEK ou HACCEK : Haemophilus, Actinobacillus, Actinomycetemcomitans, Cardiobacterium
hominis, Eikenella corrodens, Kingella
HAS : Haute Autorité de Santé IM : imagerie médicale
INNTI : inhibiteur non nucléosidique de la transcriptase inverse INVS : Institut National de Veille Sanitaire
IP : inhibiteur de protéase
IRM : imagerie par résonance magnétique IV : intraveineuse
LPV : leucocidine de Panton-Valentine
MSCRAMM : Microbial Surface Components Recognizing Adhesive Matrix Molecules MODSA : Modified St aphylococcus aureus
NFS : numération formule sanguine PAL : phosphatases alcalines
pb : paires de bases PCT : procalcitonine PE : porte d’entrée
PLP : protéine liant les pénicillines
RCP : résumé des caractéristiques du produit
S. aureus : Staphylococcus aureus
SASM : Staphylococcus aureus sensible à la méticilline SARM : Staphylococcus aureus résistant à la méticilline SCN : Staphylococcus à coagulase négative
SE : entérotoxines staphylococciques
SERAM : Secretable Expanded Repertoire Adhesive Molecules SpA : protéine A
TEP : tomographie par émission de positons TSST1 : Toxic Shock Syndrome Toxin-1
10
Liste des Tableaux
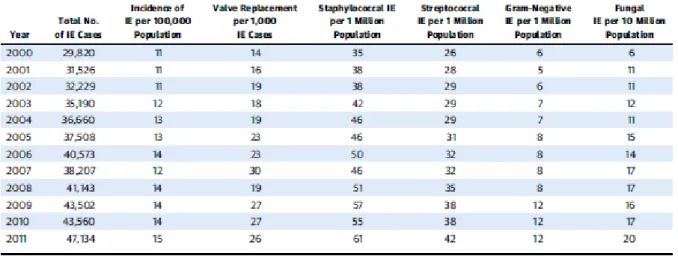
Tableau 1 : Epidémiologie des EI aux Etats-Unis entre 2000 et 2011
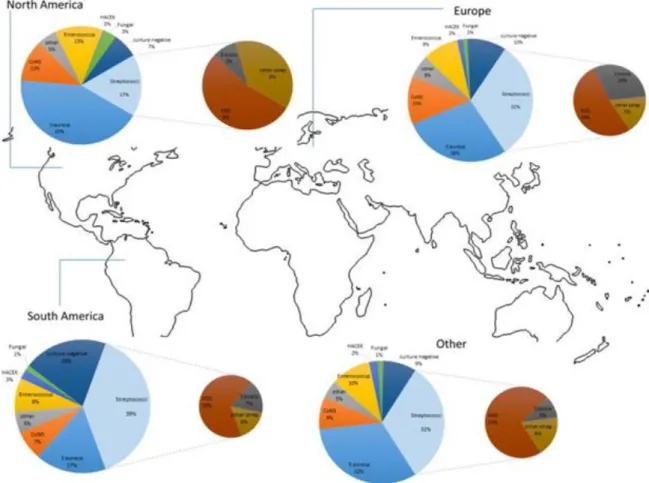
Tableau 2 : Proportion des bactéries responsables d’EI dans différents pays
Tableau 3 : Localisation habituelle et PE des principaux micro-organismes responsables d’EI Tableau 4 : Classification de Duke modifiée
Tableau 5 : Diagnostic d’EI
Tableau 6 : Fréquence des résistances aux aminosides chez les SASM et SARM en 2011
(données CHU Grenoble)
Tableau 7 : Résistances aux macrolides en fonction du phénotype de MLSb
Tableau 8 : Recommandations de traitement des EI dues à Staphylococcus spp. chez l’adulte
( (d’après l’ESC – 2009)
Tableau 9 : Recommandations de traitement des EI dues à Staphylococcus spp. chez l'adulte
(d’après l’ESC – 2015)
Tableau 10 : Espèces bactériennes habituellement sensibles, inconstamment sensibles, et
naturellement résistantes à la gentamicine
Tableau 11 : Adaptation posologique de l’ofloxacine à la fonction rénale Tableau 12 : Adaptation posologique de la ciprofloxacine à la fonction rénale
Tableau 13 : Principales interactions médicamenteuses impliquant la rifampicine et conduite
à tenir
Tableau 1’ : Caractéristiques de base des patients étudiés
Tableau 2’ : Antibiothérapie, focalisation sur quatre types d’antibiotiques Tableau 3’ : Décès et rechute dans les groupes 1 et 2
Tableau 4’ : Patients remplissant les critères majeurs de Duke Tableau 5’ : Patients remplissant les critères mineurs de Duke Tableau 6’ : Diagnostic d’EI selon les critères de Duke
11
Liste des Figures
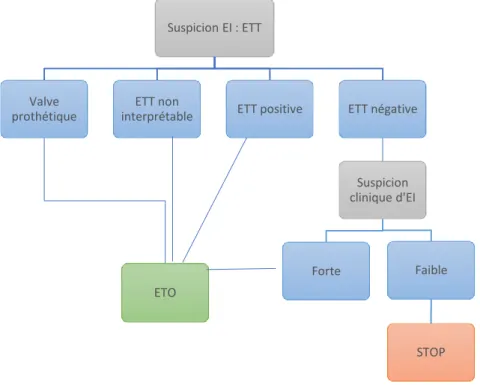
Figure 1 : Répartition géographique des bactéries responsables d’EI à l’échelle mondiale Figure 2 : ETO et ETT : diagramme décisionnel
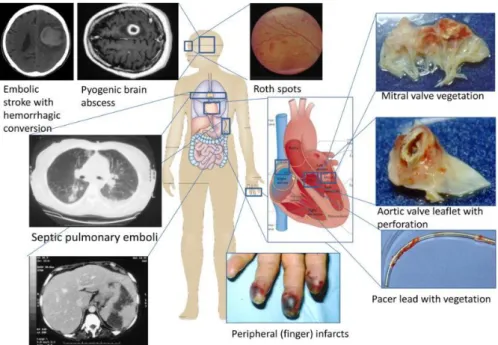
Figure 3 : Principales complications de l’EI
Figure 4 a : Observation après coloration de Gram de colonies de S. aureus (hémoculture)
(microscope optique x1000)
Figure 4 b : Observation d’un amas de S. aureus (hémoculture) (microscope électronique
x20000)
Figure 5 : Observation à l’œil nu de colonies de S. aureus sur gélose au sang frais Figure 6 : Représentation circulaire du génome de S. aureus
Figure 7 : Mécanisme d’action de la protéine A de S. aureus Figure 8 : Mécanisme d’action de la LPV de S. aureus
Figure 9 : Toxines, enzymes et protéines de surface responsables de la virulence de S. aureus Figure 10 : Mécanismes de résistance bactérienne aux antibiotiques
Figure 11 : Mécanisme de conjugaison bactérienne
Figure 12 : Réaction d’hydrolyse du cycle béta-lactame par une béta-lactamase Figure 13 : Structure de la gentamicine
Figure 14 : Structure de base des pénicillines
Figure 15 : Mécanisme d’action des antibiotiques de la famille des pénicillines Figure 16 : Structure de base des quinolones
Figure 17 : Structure de l'ADN gyrase complexée à l'ADN et à deux molécules de ciprofloxacine
Figure 18 : Mécanisme d'action des quinolones Figure 19 : Structure de la rifampicine
Figure 1’ : Flow-chart de l’étude
Figure 2’ : Répartition des EI en fonction de leur localisation dans les deux groupes en
12
Généralités
Introduction
Une endocardite infectieuse (EI) se définit comme une infection par un agent pathogène de l’endocarde qui peut s’étendre aux valves et aux différents tissus cardiaques périphériques ainsi qu’aux dispositifs cardiaques implantables (DCI)1 (valves prothétiques,
pacemaker, etc.).
L’EI est une pathologie rare dont l’incidence augmente depuis quelques années, en lien avec une augmentation de l’espérance de vie ainsi qu’une adaptation des agents microbiens face à la pression des anti-infectieux et la mauvaise utilisation de ces derniers. Ainsi, une étude réalisée par Erichsen P. & al sur l’évolution de l’incidence des EI au Danemark montre une augmentation de leur incidence2, passant de 3,93 pour 100 000
habitants (1994-1996) à 7,55 pour 100 000 habitants (2009-2011). Face à l’ascension de l’incidence d’une maladie dont le taux de mortalité avoisine les 20%, des spécialistes se réunissent afin de mettre à jour et améliorer la méthodologie de diagnostic, les protocoles de traitement ainsi que les modalités de suivi de l’EI. L’European Society of Cardiology (ESC) a publié en 2015 une mise à jour du guide de prise en charge des EI (version précédente datant de 2009) qui apporte des précisions sur l’utilisation de l’imagerie dans la recherche des complications thrombotiques de l’EI et des modifications thérapeutiques comme l’arrêt de l’utilisation de la gentamicine dans les EI à Staphylococcus aureus sensible à la méticilline (SASM).
L’objectif de l’étude qui suit est de rechercher l’efficacité de l’association de la rifampicine à l’ofloxacine dans le traitement de relais des endocardites à SASM, ce qui constituerait une alternative thérapeutique à l’utilisation de la cloxacilline par voie injectable intraveineuse. Pour cette étude, les données biologiques, épidémiologiques et cliniques de soixante-sept cas d’EI à SASM observés entre 2005 et 2015 au Centre Hospitalier Universitaire (CHU) d’Amiens-Picardie ont été exploitées de manière rétrospective.
13
1. Endocardite infectieuse
1.1 Définition
L’endocardite infectieuse (EI) se définit comme une infection par un micro-organisme de l’endocarde et des structures périphériques associées. On peut différentier trois types d’endocardites en fonction de leur mode d’acquisition.
1.1.1 EI communautaire
Les EI communautaires3 correspondent à des EI dont les symptômes sont apparus
avant une hospitalisation ou moins de 48 heures après, et dont l’origine n’est pas due à des soins (soins dentaires exclus). Elles représentent 67,4% des cas, dont 21% seraient liés à Staphylococcus aureus4 (S. aureus).
1.1.2 EI liée aux soins
Les EI liées aux soins se subdivisent en deux groupes :
- les EI nosocomiales3 sont des EI dont les symptômes ont débuté au moins 48 heures après
une hospitalisation ou 30 jours hospitalisation. Le délai de survenue post-hospitalisation peut être étendu à 1 an en cas de pose d’une prothèse valvulaire et à 3 ans en cas d’EI à Staphylococcus à coagulase négative (SCN) après implantation d’un DCI ;
- les EI non nosocomiales3 comprennent l’ensemble des EI dont l’acquisition est liée aux
soins et dont les critères ne correspondent pas à la définition d’infection nosocomiale. On peut donc citer à titre d’exemple les EI acquises en Etablissement d’Hébergement pour Personnes Agées Dépendantes (EHPAD) ou en centre spécialisé, mais également les EI liées aux soins à domicile (soins infirmiers ou réalisés par le patient lui-même).
Les EI liées aux soins4représentent 24,5% des endocardites, dont 33% à S. aureus.
1.1.3 EI liée à une toxicomanie intraveineuse
Les EI liées à une toxicomanie intraveineuse (IV) sont des EI retrouvées chez les consommateurs actifs de drogue par voie IV sans aucune autre étiologie possible.
14
1.2 Epidémiologie des EI
On constate une augmentation de l’incidence des EI dans les pays industrialisés au cours des dernières années.
Une étude épidémiologique réalisée entre 2000 et 2011 aux Etats-Unis5 (Pant S & al.)
a montré une augmentation du nombre total d’EI – dont le taux a été multiplié par plus de 1,5 entre 2000 et 2011 (augmentation de l’incidence des EI pour 100 000 habitants de 11 en 2000 à 15 en 2011) (Tab. 1).
Tableau 1 : Epidémiologie des EI aux Etats-Unis entre 2000 et 2011
1.3 Microbiologie des EI
Deux types de microorganismes sont responsables des EI :
- les bactéries, retrouvées dans plus de 99% des cas ; au sein des endocardites bactériennes, trois groupes peuvent être différenciés :
o les EI à Streptococcus spp. ; o les EI à Staphylococcus spp. ;
o les EI liées à d’autres bactéries (Chlamydia spp., Coxiella spp., Bartonella spp., etc.) ;
- les champignons, en cause dans moins de 1% des cas (majoritairement Candida spp. et Aspergillus spp.).
15
Concernant les EI bactériennes, la répartition étiologique varie selon les pays. Dans les pays développés, les bactéries les plus retrouvées dans ce type d’infection sont Streptococcus spp. et Staphylococcus spp., qui représentent 65 à 85% des EI. On peut aussi remarquer une différence étiologique entre les pays en voie de développement et les pays développés, comme le montrent le tableau (Tab. 2) et la figure (Fig. 1) ci-dessous.
Etats-Unis5 (2011) Espagne6* (1986-2006) France7 (Rennes 2015) Thaïlande7 (Khon Kaen 2015) Staphylococcus spp. 40% 35,4% 29,4% 11,4% Streptococcus spp. 27% 36,4% 52,9% 54,3% Autres bactéries 8,2% (Gram négatifs) 18,6% 17,6% 34,3%
Tableau 2 : Proportion des bactéries responsables d’EI dans différents pays
* pourcentage calculé sur la base de 3 cohortes en Espagne (1986-2006) : Fernandez-Hidalgo & al. (2000-2011); Nunez-Aragon & al. (2003-2010); Galvez-Acebal & al. (1984-2006)
16
1.4 Portes d’entrée
On distingue cinq types de portes d’entrées (PE) du germe responsable de l’EI :
- la PE digestive, que l’on retrouve surtout chez les personnes âgées, avec des germes de la flore digestive (Streptococcus bovis et Enterococcus spp.) ;
- la PE bucco pharyngée, qui est liée le plus souvent à des soins dentaires hémorragiques n’ayant pas reçu une antibioprophylaxie, mais aussi à des plaies bucco pharyngées. Les germes retrouvés sont dans la majeure partie des bactéries de la flore bucco pharyngée dont Streptococcus spp. ;
- la PE cutanée, suite à des surinfections de plaies (lésions de grattage, ulcérations ou infections cutanées type furoncle, etc.). Les bactéries les plus fréquemment retrouvées appartiennent au genre Staphylococcus, espèces aureus et epidermitis ;
- la PE urinaire, en majorité suite à des actes chirurgicaux. Les entérobactéries sont les bactéries les plus retrouvées dans les EI à PE urinaire ;
- l’origine iatrogène en lien avec un dispositif médical implanté (cathéter, pacemaker, valves mécaniques, etc.) ainsi que les injections de produits non stériles (toxicomanie).
Les habitats des principaux microorganismes responsables d’EI ainsi que leur PEsont référencésdans le tableau ci-dessous (Tab. 3)9.
Microorganisme Habitat Porte d’entrée
Streptococci Streptococci oraux Groupe mitis/salivarius
(S. sanguis, sanguinis,
parasanguinis, gordonii, mitis, oralis, mutans, salivarius)
Plaque dentaire, langue,
muqueuse orale, oropharynx Affections bucco-dentaires
Groupe milleri
(S. intermedius, constellatus,
anginosus)
Oropharynx, plaque subgingivale, tractus gastro-intestinal, vagin
(S. anginosus)
Affections bucco-dentaires, gastro-intestinales, infection vaginale (rare) Streptococci groupe D
Groupe S. bovis (dont
S. gallolyticus) Tractus gastro-intestinal
Adénome and adénocarcinome colorectal (S. gallolyticus), tractus biliaire et gastro-intestinal
17
Enterococcus faecalis, Enterococcus faecium
Tractus gastro-intestinal et tractus urinaire
Procédures invasives au niveau du tractus urinaire (dont cystoscopie, lithotripsie, prostatectomie, césarienne, curettage) Streptococci groupe B
S. agalactiae
Muqueuse orale, tractus gastro-intestinal, vagin, urètre antérieur
Tumeurs coliques, translocations bactériennes à partir du tractus gastro-intestinal, infections des tissus mous, infections urinaires, toxicomanie IV Streptococci groupe C
S. dysgalactiae, S. equi, S. equisimilis,
S. zooepidemicus
Nasopharynx, peau, tractus urinaire
Infections cutanées, infections respiratoires, infections urinaires du péri-partum
Streptococci groupe A
S. pyogenes Oropharynx, peau Infections de la peau et des tissus mous,
pharyngite, endométrite Autres Streptococci
Streptococcus pneumoniae Nasopharynx Pneumonie, otite moyenne
Streptococci déficients (Granulicatella [Abiotrophia]
defectiva)
Flore orale, plaque dentaire Toxicomanie IV, péri-odontite
Streptobacillus moniliformis
Cavité buccale de certains rongeurs (rats, gerbilles, souris)
Morsures ou griffures Staphylococci
S. aureus
Principaux sites : fosses nasales antérieures, pharynx, région périnéale Autres sites : peau, intestins
Infections liées aux soins de santé,
toxicomanie IV, infections de la peau et des tissus mous
Staphylococci à coagulase-négative (SCN)
S. saprophyticus Région périnéale Infections urinaires
S. epidermidis, capitis, haemolyticus, hominis, saprophyticus, schleiferi, lugdunensis, among others
Peau Infections cutanées, infections liées aux soins
de santé HACCEK Haemophilus spp., Aggregatibacter (Actinobacillus) Actinomycetemcomitans, Capnocytophaga spp., Cardiobacterium hominis, Eikenella corrodens, Kingella kingae
Oropharynx Péri-odontite, affections dentaires et
buccales, toxicomanie IV Bactéries intracellulaires Coxiella burnetii Mammifères (animaux de la ferme, particulièrement femelles parturientes), oiseaux, arthropodes (tiques)
Inhalation ou passage transcutané de fluides contaminés, ingestion de lait cru, morsures de tiques
Bartonella henselae Chats Griffure ou morsure de chat, morsure
d’arthropode
Bartonella quintana Réservoir inconnu hors
humains Pou de corps
Tropheryma whipplei Tractus gastro-intestinal
humain Inconnu
Legionella Eau, particulièrement eau
18
Brucella (B. melitensis, B. abortus, B. suis)
Mammifères (bétail, bisons, chèvres, moutons,
chameaux)
Ingestion de lait cru, contact cutané, inhalation de fluides contaminés Enterobactéries
E. coli, Salmonella spp., Enterobacter spp.
Tractus gastro-intestinal, région périnéale
Infections liées aux soins de santé translocations bactériennes à partir du tractus gastro-intestinal, toxicomanie IV, infections du tractus urinaire (E. coli) Bactéries diverses Corynebacterium diphteriae, C. jeikeium, C. striatum Environnement, commensale de la peau et des muqueuses
Infections liées aux soins de santé (infections sur cathéter, chirurgie, etc.), toxicomanie IV
Pseudomonas spp. Environnement (eau) Toxicomanie IV, infections liées aux soins de
santé
Peptostreptococcus spp.
Oropharynx, lésions
cutanées chroniques, tractus gastro-intestinal, tractus urinaire
Péri-odontite, gingivite, pied diabétique
Listeria spp. Environnement (sol, eau) Ingestion d’aliments contaminés
Propionibacterium spp. Oropharynx, skin Infections liées aux soins de santé (chirurgie
cardio-thoracique, infections sur cathéter) Mycobactéries atypiques
(M. chelonae, M. fortuitum,
M. chimaera)
Environnement (eau, sol, plantes, animaux, surfaces inertes)
Infections liées aux soins de santé (chirurgie cardio-thoracique), prothèses contaminées Champignons et levures
Aspergillus Environnement Inhalation, chirurgie cardio-thoracique
Candida Peau, tractus
gastro-intestinal
Infections liées aux soins de santé (infections sur cathéter, chirurgie), toxicomanie IV, mycose cutanée, infection urinaire Tableau 3 : Localisation habituelle et PE des principaux micro-organismes responsables d’EI
Une étude de Delahaye & al.9 a étudié la proportion d’EI en fonction de la PE. Sur 238
patients dont la PE de l’EI a été identifiée, 40% (93) des cas d’EI sont d’origine cutanée, 29% (69) sont liés à une PE bucco pharyngée, 23% (55) ont une origine digestive et 4% (10) sont rapportés à une PE gynécologique.
Pour la PE cutanée, sur 93 patients, 47,9% (39) sont liés aux soins, 35,5% (33) sont d’origine communautaire et 22,6% (21) sont liés à une toxicomanie IV active. Parmi les EI liées aux soins, on retrouve majoritairement le groupe Staphylococcus spp. (87,2% (34) des cas dont 38,5% sont dus à l’espèce aureus et 8,8% sont des SARM) ; parmi les EI communautaires, 91% sont liées à Staphylococcus spp. et parmi les EI liées à une toxicomanie IV, 52% (11) sont dues à Staphylococcus spp.
19
Concernant la PE bucco pharyngée, sur 68 patients, on retrouve dans 69% (47) des cas un streptocoque oral. Pour la PE digestive (56), on retrouve de manière prédominante Streptococcus groupe bovis 50% (28) et Enterococcus faecalis 29% (16).
1.5 Outils diagnostiques de l’EI
1.5.1 Association terrain et symptômes
L’EI est une pathologie systémique dont les manifestations cliniques sont très variées. Les signes les plus évocateurs associent des troubles cardiaques à un syndrome infectieux. Plus de 90 % des patients présentent une hyperthermie10 qui peut être associée à
des frissons, une perte de poids ou une fatigue générale (l’hyperthermie peut être spontanée ou d’apparition progressive). Plus de 85% des patients présentent un souffle cardiaque10. Plus de 25 % des patients présentent une complication embolique10.
La suspicion d’EI est renforcée en cas de présence d’au moins deux de ces symptômes, ou bien l’association d’un de ces symptômes avec des antécédents de cardiopathie, de toxicomanie IV, de soins dentaires récents, d’une prothèse valvulaire ou bien de la pose d’un DCI.
Des signes extra-cardiaques11 peuvent également survenir :
- cutanés : présents dans 5 à 15% des cas, ils se manifestent par un purpura pétéchial ou nodosité Osler (« faux panaris »);
- pulmonaires : toux témoignant d’une insuffisance cardiaque ou d’une dyspnée (complication emboligène pulmonaire) ;
- ophtalmiques : purpura conjonctival ;
- rhumatologiques : lombalgie, arthralgie, myalgie pouvant faire penser à une spondylodiscite (foyer secondaire) ;
- neurologiques : liés aux abcès, anévrismes artériels, emboles et hémorragies cérébrales pouvant faire évoquer une méningite ;
- rénaux : protéinurie ou hématurie isolée mais aussi insuffisance rénale par atteinte glomérulaire.
20
1.5.2 L’imagerie médicale
L’imagerie médicale (IM) est un atout majeur dans le diagnostic de l’EI, mais aussi dans le suivi de son évolution ainsi que dans l’évaluation de ses complications. Parmi l’ensemble des techniques d’imagerie, quatre sont retenues.
1.5.2.1 L’écho-cardiographie
Le diagnostic d’EI repose sur deux piliers : l’échocardiographie et les hémocultures. Deux techniques échographiques sont utilisées :
- l’échographie trans-thoracique (ETT) qui est la plus simple à pratiquer (IM de première intention dans le diagnostic de l’EI) mais la moins sensible (sensibilités sur valve native et prothétique sont respectivement 70% et 50% vs. 96% et 92% pour l’échographie trans-œsophagienne12, 13) ;
- l’échographie trans-œsophagienne (ETO) qui est la technique échographique de choix dans le diagnostic et le suivi de l’EI si l’ETT est négative. En cas d’ininterprétabilité ou de négativité de l’ETT et de l’ETO avec forte suspicion d’EI, il est recommandé de renouveler les deux examens échographiques après 5 à 7 jours (Fig. 2).
Figure 2 : ETO et ETT : diagramme décisionnel10 Suspicion EI : ETT
Valve prothétique
ETO ETT non
interprétable ETT positive ETT négative
Suspicion clinique d'EI
Forte Faible
21
1.5.2.2 La tomodensitométrie
Les dernières recommandations de l’ESC10 préconisent l’utilisation en première
intention de la tomodensitométrie (ou scanner) pour la recherche des complications thromboemboliques de l’EI, mais aussi en seconde intention dans le diagnostic de l’EI, en particulier en cas d’antécédent de valvulopathie ayant nécessité la pose d’une prothèse valvulaire.
1.5.2.3 L’imagerie par résonnance magnétique
L’imagerie par résonnance magnétique10 (IRM) est indiquée dans la recherche des
complications de l’EI comme les microbleeds (micro-accidents hémorragiques cérébraux) et les accidents thromboemboliques cérébraux que l’on retrouve dans 50 à 60% des cas14.
Cette technique est aussi utilisée en cas de forte suspicion d’EI et en absence de symptômes neurologiques pour apporter un argument supplémentaire au diagnostic. Dans une étude14,
il a été montré que l’IRM cérébrale permettait d’ajouter un critère mineur de Duke et ainsi augmenter de 25% le nombre de patients diagnostiqués n’ayant pas été initialement étiquetés EI.
1.5.2.4 L’imagerie nucléaire
Deux techniques d’imagerie nucléaire10 sont retenues pour appuyer et/ou bilanter
une EI :
- la première consiste en l’utilisation d’un analogue radio-pharmaceutique du glucose, le fluorodésoxyglucose (18F-FDG), tracé par tomographie par émission de positons (TEP scan).
Le 18F-FDG est métabolisé prioritairement par les cellules très consommatrices de glucose –
notamment les sites infectés et inflammatoires – en fluorodésoxyglucose-6-phosphate, forme sous laquelle il ne peut plus quitter la cellule. Ainsi, la fixation du 18F-FDG observée
par TEP donne une image fidèle de la façon dont est distribuée dans l'organisme l'absorption et la phosphorylation du glucose. Les inconvénients de cette technique viennent de sa non-spécificité, marquant de manière indifférenciée les métastases, les infections et les zones inflammatoires, mais aussi les zones de forte consommation de glucose comme le cerveau, ne permettant pas de rechercher les complications vasculaires cérébrales de l’EI ;
22
- la seconde est la scintigraphie à leucocytes marqués. Il s’agit d’une méthode plus spécifique que la révélation de 18F-FDG par TEP scan, car elle permet de fixer plus
spécifiquement les sites infectieux. En revanche, elle présente le désavantage d’une longue préparation au préalable15 (prélèvement de leucocytes CD
4+ qui seront marqués avant d’être
réinjectés avant l’examen).
1.5.3 Examen biologique et bactériologique
1.5.3.1 Marqueurs de l’inflammation
Face à une infection – qu’elle soit chronique ou aigue – et en l’absence de tout traitement, le système immunitaire met en place plusieurs mécanismes de défense permettant de lutter et de limiter l’extension de cette infection. Cette réponse se caractérise en deux temps : une réponse rapide dite « innée » via les cellules phagocytaires et le complément et une réponse plus tardive dite « adaptative » médiée par les lymphocytes et anticorps qui permettent une action plus ciblée et spécifique. La mise en place des mécanismes immunitaires laisse des traces qui peuvent être de différentes natures : débris organiques liés à la phagocytose, médiateurs de l’inflammation, modifications de la numération formule sanguine (NFS), etc.
En cas de suspicion d’EI, la recherche de signes d’inflammation ne permet pas de poser un diagnostic mais contribue à orienter celui-ci. Ainsi il sera réalisé devant une suspicion d’EI :
- NFS, montrant une hyperleucocytose pouvant être associée à une lymphocytose ;
- vitesse de sédimentation (VS) qui est dans la majorité des cas augmentée (liée à la présence de médiateurs de l’inflammation dans le sang) ;
- protéine-C réactive (CRP) : protéine synthétisée par le foie et les tissus graisseux, secrétée en cas d’infection pour intervenir dans le processus inflammatoire en activant le système du complément. La CRP est un marqueur sensible mais peu spécifique, augmentant dans les infections bactériennes16 ;
- procalcitonine (PCT) : précurseur de la synthèse de la calcitonine, la PCT est synthétisée par les cellules para-folliculaires de la thyroïde puis stockée dans les granules de
23
sécrétion de l’ensemble des cellules de l’organisme. Lors d’une infection aigue ou d’un sepsis sévère, la PCT est libérée sous l’influence d’endotoxines bactériennes ou de cytokines pro-inflammatoires (interleukine 1, facteur de nécrose tumorale α). A l’heure actuelle, son rôle dans l’inflammation demeure mal déterminé. Certaines études16, 17
semblent indiquer que la PCT est un bon marqueur de diagnostic précoce de l’infection bactérienne, mais son taux est utilisé à des fins pronostiques. En revanche, la PCT n’a aucune valeur dans les infections virales et fongiques.
1.5.3.2 La recherche bactériologique
1.5.3.2.1 Les hémocultures et la mise en culture
L’hémoculture est un test bactériologique consistant en la mise en culture d’un prélèvement sanguin veineux afin d’y rechercher des micro-organismes. Cet examen doit être réalisé devant toute suspicion de septicémie, choc septique ou fièvre prolongée à étiologie non déterminée, chez les patients avec facteurs de risque (abcès dentaire, port de matériel type chambre implantable ou voie centrale périphérique, etc.) présentant une hyperthermie (température corporelle > 38,5°C) ou une hypothermie (température corporelle < 36,5°C), maladie d’Osler, ou des signes de complications18 (marbrures, frissons).
L’hémoculture doit être faite dès la survenue d’un pic fébrile et en amont de toute antibiothérapie. Deux à trois paires d’hémocultures contenant chacune un flacon pour une culture en anaérobie et un flacon pour une culture en aérobie sont à réaliser. Elles permettront par la suite la détermination de l’espèce afin d’adapter le traitement.
Pour identifier la PE d’une endocardite, divers prélèvements sont réalisés en fonction de la clinique (pathologie préexistante) et du patient (présence ou non de facteurs de risque : antécédent de pyélonéphrite, chirurgie orthopédique, toxicomanie IV, etc.). Chez les patients porteurs de matériel médical, il est possible de prélever conjointement à l’hémoculture le matériel médical suspecté afin de vérifier l’origine de la PE ; s’il existe une différence de cinétique de croissance des colonies bactériennes, alors celui qui a la cinétique la plusrapide sera celui qui aura la charge bactérienne de départ la plus élevée et sera donc la PE la plus probable.
24 1.5.3.2.2 L’antibiogramme
L’antibiogramme est la seconde étape après l’identification de la bactérie. L’identification bactérienne permet de passer d’un traitement probabiliste à un traitement spécifique de l’espèce en cause. Cependant, l’espèce bactérienne identifiée peut être sauvage ou présenter des résistances acquises. L’antibiogramme est alors une étape clé dans le traitement, car il permet d’adapter l’antibiothérapie à la bactérie incriminée, ce qui permet à court terme de proposer un traitement adapté et à long terme de lutter contre les résistances bactériennes.
1.5.4 Critères de Duke modifiés par Li
Le diagnostic des EI repose le plus souvent sur un faisceau d’arguments cliniques, écho-cardiographiques, biologiques et microbiologiques (hémoculture) regroupés en critères majeurs et mineurs dans une classification créée en 1994 par l’université de Duke.
Ces critères ont été modifiés en 2000 et sont actuellement adaptés sous le nom de critères de Duke modifiés19 (Tab. 4).
Critères majeurs Critères mineurs
Hémocultures positives
- pour un micro-organisme typique d’EI (streptocoques oraux,
Streptococcus gallolyticus, entérocoque, S. aureus, bactérie du groupe
HACEK) : 2 séries séparées positives suffisent
- pour un micro-organisme possiblement responsable d’EI : au moins 2 séries positives prélevées à 12 heures d’intervalle ou positivité d’au moins 3 séries à condition que l’intervalle entre la première et la dernière série soit d’au moins 1 heure
- pour Coxiella burnetii : positivité d’une hémoculture ou titre d’IgG de phase I > 1/800 en immunofluorescence
Image écho-cardiographique typique d’endocardite*
- masse intracardiaque oscillante (végétation) appendue sur une valve ou l’appareil valvulaire ou sur le trajet d’un jet de régurgitation ou sur du matériel implanté (en l’absence d’autre explication anatomique) - abcès
- désinsertion prothétique récente
* la mise en évidence d’un nouveau souffle de régurgitation valvulaire est considérée comme un critère majeur qui doit être confirmé par écho-cardiographie
- Facteur de risque (valvulopathie ou cardiopathie à risque ou toxicomanie IV)
- Fièvre > 38 °C
- Phénomène vasculaire (emboles septiques, anévrismes mycosiques, hémorragies intracrâniennes ou conjonctivales, érythème de Janeway)
- Phénomène immunologique (facteur rhumatoïde, nodules d’Osler glomérulonéphrite, , tache de Roth au fond d’œil)
- Argument microbiologique (hémoculture et/ou sérologie positives ne satisfaisant pas un critère majeur)
25
Selon le nombre de critères retrouvés, le diagnostic d’endocardite est considéré comme certain, possible ou rejeté (Tab. 5).
Diagnostic certain 2 critères majeurs ou
1 critère majeur et 3 critères mineurs ou 5 critères mineurs
Diagnostic possible
1 critère majeur et 1 critère mineur ou 3 critères mineurs
Diagnostic rejeté
autres combinaisons de critères ou
disparition des manifestations d’endocardite avec ≤ 4 jours d’un traitement anti-infectieux ou absence de preuve histologique postopératoire (ou à l’autopsie) ou
diagnostic alternatif confirmé Tableau 5 : Diagnostic d’EI19, 20
1.6 Complications
Nombreuses et fréquentes, les complications de l’EI contribuent à la gravité de la pathologie. Les plus vues sont l’insuffisance cardiaque et les troubles vasculaires (Fig. 3).
L’insuffisance cardiaque est la première cause de mortalité de l’EI à la phase aigüe. Elle est la conséquence de la détérioration valvulaire secondaire à la colonisation par un agent pathogène de la valve concernée. Les atteintes valvulaires peuvent être de plusieurs types : désinsertions (18,3%), perforations4 (18,1%), prolapsus, calcifications21 (50-60%). La
présence de calcifications donnera lieu à un suivi cardiologique voire parfois à une chirurgie reconstructrice ou à un remplacement valvulaire (pendant ou à distance de l’épisode d’EI).
Les complications vasculaires sont présentes chez 20 à 25% des patients, avec une proportion plus importante chez les patients atteints d’EI sur valve mitrale22. On retrouve
des emboles, majoritairement au niveau cérébral, chez 15% des patients21, pouvant être
responsables d’abcès cérébraux21 (3-4%). Des anévrismes mycotiques sont également
observés dans 10 à 15% des cas21.
D’autres complications23, moins fréquentes, peuvent être retrouvées :
26
- cardiaques : lésions péri-annulaires (10-15%), troubles de la conduction auriculo-ventriculaire (5-10%), abcès métastatiques (1-2%), péricardites, myocardites, infarctus du myocarde, fistules intracardiaques.
Figure 3 : Principales complications de l’EI8
1.7 Co-morbidités
Certaines situations physiopathologiques favorisent la survenue de l’EI voire de ses complications. Les données de l’ESC mentionnent qu’une insuffisance cardiaque préexistante augmenterait le risque de décès par EI (facteur 2,88). On note d’autres facteurs de risque de décès par EI parmi lesquels les antécédents d’accident vasculaire cérébral (facteur 2,31), la présence de prothèses valvulaires avant EI (facteur 1,82), le diabète (facteur 1,43), l’âge supérieur à 60 ans au moment du diagnostic (facteur 1,02), une atteinte rénale et/ou pulmonaire10 et de manière plus générale le score de Charlson (Chirouze & al.
CMI 2013).
Néanmoins, contrairement à la tendance observée pour l’ensemble des micro-organismes étudiés, l’incidence des EI à S. aureus serait plus importante chez les patients ne présentant pas de cardiopathie sous-jacente par rapport aux patients avec valvulopathie native déjà connue.
27
1.8 Pronostic
La survie globale après un épisode d’EI est de 75% à 6 mois et de 57% à 5 ans. L’incidence annuelle des récidives est comprise entre 0,3 et 2,5%, avec une probabilité de survenue plus importante chez les patients opérés. Concernant la mortalité, le taux de mortalité global de l’EI est compris entre 15 et 20%25.
En milieu hospitalier, le taux de mortalité est de 17%, mais de fortes disparités sont observées en fonction du germe en cause ; ainsi, il atteint 34% chez les patients présentant une EI à S. aureus contre 10% chez les patients ayant une EI à un autre germe26 (p < 0,001).
On observe également des différences marquées selon la nature de la valve. La mortalité des endocardites sur prothèse est élevée et peut atteindre 24% malgré un traitement chirurgical27.
Le taux de mortalité chez les patients ayant une EI à S. aureus sur valve prothétique est très supérieur à celui relevé pour les EI à autres micro-organismes (respectivement 75% et 15%), faisant de S. aureus un facteur prédictif de décès chez les patients présentant une EI sur valve prothétique.
28
2. Staphylococcus aureus
S. aureus est une bactérie appartenant au genre Staphylococcus, lequel regroupe cinquante espèces différentes29. L’espèce aureus est divisée en deux sous-espèces : S. aureus
subsp. anaerobius et S. aureus subsp. aureus30.
2.1 Caractères morphologiques
2.1.1 Morphologie de la bactérie
D’un point de vue morphologique, S. aureus se présente comme un coccus immobile et colorable au test de Gram (Fig. 3a). Sa taille varie entre 0,5 et 1 µm. Lors de leur multiplication (en milieu solide ou liquide), S. aureus se regroupent en amas dit « en grappe de raisin » (Fig. 4b) ; ce phénomène est à l’origine du nom du genre bactérien (staphyle signifie « grappe » en grec).
Figure 4 :
a : Observation après coloration de Gram de colonies de S. aureus (hémoculture) (microscope optique x1000)31
b : Observation d’un amas de S. aureus (hémoculture) (microscope électronique x20000)32
2.1.2 Morphologie des colonies
Après mise en culture sur milieu solide, S. aureus se regroupent en petites colonies isolées dont la taille moyenne33 est de 1 à 3 mm. A l’œil nu, les colonies de S. aureus
apparaissent comme de petites masses hémisphériques d’aspect lisse et brillant33 (Fig. 5).
L’origine du nom de l’espèce aureus provient du fait que la bactérie synthétise un pigment de couleur jaune or qui donne une couleur jaune aux colonies.
29 Figure 5 : Observation à l’œil nu de colonies de S. aureus sur gélose au sang frais34
2.2 Culture bactériologique
S. aureus est une bactérie à croissance aérobie anaérobie facultative, à multiplication rapide en aérobiose33. Il s’agit d’une bactérie mésophile (dont la croissance est optimale à
37°C), neutrophile (dont la croissance est optimale à pH = 7) et halophile33 (qui se développe
à de fortes concentrations de chlorure de sodium NaCl).
Cette dernière caractéristique est utilisée pour isoler S. aureus, en utilisant le milieu de Chapman, gélose hypersaline (75 g de NaCl par litre) adaptée à la croissance des bactéries halophiles. Un autre milieu sélectif est utilisé pour isoler S. aureus : la gélose de Baird Parker. Cette dernière est enrichie avec 2 inhibiteurs (tellurite de potassium K2O3Te et chlorure de
litium LiCl). En présence de S. aureus, on observe de petites colonies rondes à bords lisses de couleur noire avec un halo périphérique translucide33.
Peu exigeante, S. aureus peut également être isolée sur des milieux non sélectifs, notamment la gélose nutritive ordinaire, la gélose Trypticase soja (TS) ou la gélose Bromo Crésol Pourpre (BCP).
2.3 Caractéristiques biochimiques
Les bactéries du genre Staphylococcus présentent une morphologie, des caractères génétiques et biochimiques communs. La distinction des espèces et ainsi l’identification de la bactérie repose sur la mise en évidence des critères génétiques et biochimiques33. En
routine, il existe des galeries qui permettent une identification rapide du genre et de l’espèce.
30
2.3.1 Staphylocoagulase
La staphylocoagulase est une protéine synthétisée à partir du gène coa et appartient à la famille des SERAM (Secretable Expanded Repertoire Adhesive Molecules)35. Elle se fixe à
la partie N-terminale de la prothrombine pour former un complexe appelé staphylothrombine. Une fois formé, ce complexe induit la transformation du fibrinogène en fibrine, ce qui sera à l’origine de la formation de thrombus36.
En pratique, la recherche de cette coagulase libre permet en partie de différentier S. aureus (présente la coagulase : coagulase +) des autres Staphylococcus. La souche à tester est mise en présence de plasma frais de lapin ; s’il s’agit d’une bactérie coagulase +, on observe la formation d’un thrombus après incubation à 37°C pendant 4 à 24 heures.
2.3.2 Catalase
La catalase est une enzyme retrouvée chez l’ensemble des espèces bactériennes du genre Staphylococcus33. Il s’agit d’une oxydoréductase héminique (atome de fer) qui permet la dismutation du peroxyde d'hydrogène H2O2 en eau H2O et dioxygène O2 :
H2O2 + Fe(III)-E → H2O + O=Fe(IV)-E
H2O2 + O=Fe(IV)-E → H2O + O2 + Fe(III)-E
Cette catalase est mise en évidence en mettant en présence de la souche à tester une solution d’eau oxygénée ; si un dégagement est observé, alors le test est positif (bactérie présentant une catalase : catalase +).
2.3.3 Fermentation des sucres
La capacité d’une bactérie à fermenter des sucres complexes est communément utilisée dans l’identification d’une souche bactérienne. Dans le cas de S. aureus, on recherche la capacité à fermenter le mannitol (mannitol +) et le glucose (glucose +)33.
2.3.3.1 Fermentation du mannitol
Pour la recherche de la dégradation du mannitol, les bactéries sont ensemencées sur une gélose au mannitol contenant un indicateur coloré, le rouge de phénol. Si la bactérie
31
dégrade le mannitol, des ions H+ sont produits et entraînent une acidification du milieu.
Cette modification de pH est révélée après incubation pendant 24 heures à 37°C par une modification de la couleur de la gélose qui vire du rouge au jaune.
Pour isoler plus spécifiquement S. aureus, on utilise une gélose de Chapman enrichie en mannitol33.
2.3.3.2 Fermentation du glucose
La recherche de la dégradation du glucose (présence d’une béta-glucosidase) fait intervenir le même principe mais le test se fait en milieu liquide. S. aureus à la capacité de fermenter le glucose sans dégagement de gaz33.
2.3.4 DNAse
La DNAse est une enzyme de la famille des endonucléases. Elle entraine la dégradation de l’acide désoxyribonucléique (ADN) par hydrolyse des liaisons phospho-diestérases, aboutissant à la formation de petites chaines de poly-nucléotides. La DNAse est thermostable, c’est-à-dire qu’elle résiste à une température de 100°C pendant 15 minutes.
La mise en évidence de cette enzyme se fait à l’aide d’une gélose enrichie en bleu de toluidine. Si la bactérie possède une DNAse (DNAse +), comme c’est le cas pour S. aureus, la gélose vire du bleu au rose.
2.3.5 Hémolysine alfa
L’hémolysine est une enzyme thermolabile susceptible de causer une hémolyse, à savoir une dégradation des globules rouges. S. aureus possède une hémolysine de type alfa (hémolysine α +), responsable d’une hémolyse totale (à la différence de l’hémolysine bêta qui entraine une hémolyse partielle).
La mise en évidence de l’hémolysine de S. aureus repose sur l’ensemencement d’une gélose au sang frais qui est ensuite incubée à 37°C en anaérobiose. Après 12 à 24 heures d’incubation, l’hémolysine alfa de S. aureus sera révélée par le développement d’un halo jaune au niveau de la zone d’ensemencement.
32
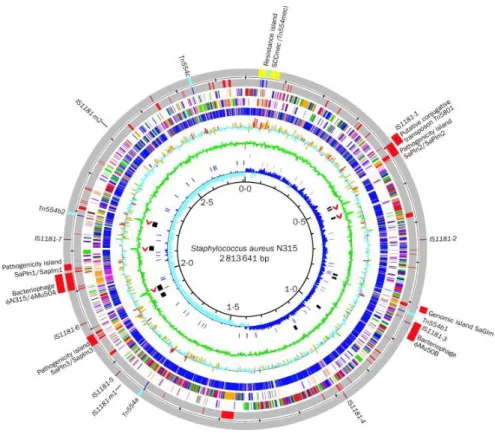
2.4 Génome
Les bactéries sont des organismes vivants dits procaryotes, c’est-à-direne possédant pas de noyau. Leur ADN est contenu dans le cytoplasme de la cellule Le support de cet ADN peut être chromosomique ou extra-chromosomique.
L’ADN chromosomique de S. aureus est composé d’un seul chromosome circulaire constitué de 2,7 à 2,8 millions de paires de bases37 (pb). Il comprend l’information génétique
vitale de la bactérie, à savoir l’ensemble du matériel nécessaire à sa reproduction et à sa survie. Il se présente comme une double hélice surenroulée (grâce aux topoisomérases).
L’ADN extra-chromosomique – ADN le plus variable – de S. aureus code pour de nombreux mécanismes de résistance et facteurs de virulence. Ces éléments génétiques mobiles sont susceptibles de subir des transferts d’une bactérie à une autre. L’ADN extra-chromosomique peut se trouver sous plusieurs formes : plasmide, transposon, ilot pathogénique et cassette chromosomique. La présence des transposons, ilots pathogéniques et cassettes chromosomiques est transitoirement extra-chromosomique avant d’être intégrée au plasmide ou au chromosome.
33
L’ADN plasmidique correspond à un élément génétique extra-chromosomique constitué de 800 à 18 000 pb37. Il porte les informations codant pour des mécanismes de
résistance aux antibactériens et évolue au cours du temps38. Le plasmide peut comporter
des séquences permettant d’apporter des facteurs de virulence supplémentaires comme des exfoliatines39.
Le transposon comprend du matériel génétique de taille variable qui peut être présent en un ou plusieurs exemplaire(s) au sein de la bactérie. Il code le plus souvent pour des résistances40 comme le gène MLSb. Les transposons peuvent s’intégrer dans l’ADN
chromosomique ou plasmidique.
Les ilots de pathogénie sont composés d’ADN bactérien de 14000 à 17000 pb. Il s’agit d’une famille de gènes bactériens qui s’intègrent au chromosome bactérien. En 2007, 16 ilots de pathogénie intégrés sur 6 sites chromosomiques différents étaient décrits41.Cet ADN
code pour des toxines comme la Toxic Shock Syndrome Toxin-1 (TSST1)42.
La cassette chromosomique correspond à un grand fragment d’ADN inséré dans le gène orfX (chromosome bactérien). Cet ADN code pour des résistances aux anti-infectieux comme la cassette SSSmec (résistance à la méticilline) ou pour des facteurs de virulence comme le polysaccharide 1 de capsule dont l’action est d’inhiber la phagocytose43.
2.5 Facteurs de pathogénicité
Le pouvoir pathogène de S. aureus est en grande partie lié à la multiplicité des facteurs de pathogénicité que possède la bactérie.
2.5.1 Capsule
La capsule est retrouvée chez plus de 90% des souches de S. aureus. Disparaissant la plupart du temps lors de la mise en culture et peu visible au microscope optique, la capsule de S. aureus est appeléemicrocapsule45.
S. aureus présente des capsules de différents sérotypes avec une prévalence plus élevée pour les sérotypes 5 et 8. La capsule est composée de polysaccharides et pour
34
certaines souches d’exo-polysaccharides (glycocalix) favorisant l’encrage de celui-ci. Elle est classée dans les facteurs de virulence de par son aspect protecteur vis-à-vis des phénomènes d’opsonisation par les phagocytes et les polynucléaires neutrophiles46.
2.5.2 Protéines de surface
Lorsque la capsule est dégradée, la paroi bactérienne devient la seconde barrière de protection de la bactérie. La paroi est composée en grande partie de peptidoglycanes et d’acide teichoïque (sert de point d’ancrage à la membrane plasmique). Des protéines sont fixées de manière covalente aux peptidoglycanes : les protéines A, les MSCRAMM (Microbial Surface Components Recognizing Adhesive Matrix Molecules) et les SERAM (Secretable Expanded Repertoire Adhesive Molecules).
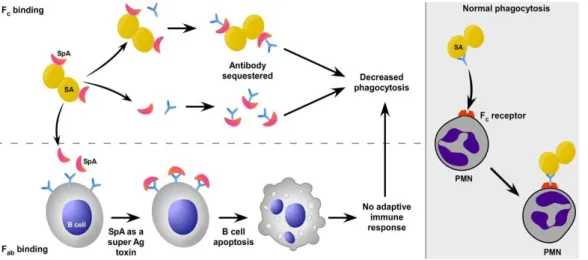
2.5.2.1 Protéine A
Petite protéine de 40 à 60 kDa, la protéine A (SpA) existe sous forme associée à la paroi bactérienne ou secrétée. Elle possède une affinité importante pour la fraction constante (Fc) des anticorps monoclonaux. Spa se fixe aux anticorps circulants et à la surface des lymphocytes B (de type IgG), diminuant leur fixation au niveau de la paroi bactérienne (Fig. 7). La liaison de SpA aux lymphocytes peut – pour des concentrations bactériennes élevées – induire l’apoptose des lymphocytes B fixés47. Fixés dans la mauvaise orientation,
les anticorps ne peuvent plus exercer leur rôle dans la phagocytose et la bactérie est alors « cachée » du système immunitaire.
35
2.5.2.2 Adhésines associées au peptidoglycane : MSCRAMM
Associées au peptidoglycane par des liaisons covalentes, les protéines MSCRAMM partagent des caractéristiques structurales communes.
- les protéines de liaison à la fibronectine (FnBP) : elles contribuent à l’adhésion de la bactérie aux cellules de l’hôte au niveau des caillots plasmatiques constitués de fibronectine49 (glycoprotéine présente dans le sang et le plasma). Les FnBP seraient
également impliquées dans l’adhésion de S. aureus sur les biomatériaux tels que les cathéters et valves mécaniques49 ;
- les protéines de liaison au fibrinogène ou clumping factor (Clf) : ces protéines adhérent au fibrinogène, glycoprotéine présente dans le sang et le plasma qui intervient dans le processus de cicatrisation et permet la formation de la fibrine sous l’action de la thrombine. Le Clf permet donc un meilleur ancrage de S. aureus lors de la cicatrisation, facilitant la colonisation du site et l’infection cutanée ;
- la protéine de fixation au collagène (Cna) : le collagène, protéine retrouvée au niveau cellulaire et dans la matrice extracellulaire, favorise l’ancrage de S. aureus, particulièrement au niveau des sites riches en collagène (os). La Cna expliquerait pour partie les localisations des complications d’une endocardite à S. aureus : arthrite septique, spondylodiscite, ostéite.
2.5.2.3 Adhésines secrétées : SERAM
Les SERAM (Eap/Map/P70 et Emp) sont des protéines facilitant l’ancrage aux tissus de S. aureus. Les SERAM ont la particularité d’être secrétées et fixées de manière non covalente à la paroi de la bactérie. Ces petites protéines de 60 à 72 kDa jouent un rôle dans les infections endovasculaires comme les endocardites50 par leur faculté à se fixer au
fibrinogène, à la fibronectine, à la prothrombine, au collagène, à la laminine, aux sialoprotéines, à l’élastine et à la vitronectine.
La coagulase est rattachée à la classe des SERAM de par sa structure moléculaire. Elle entraîne la formation de thrombus par polymérisation du fibrinogène en fibrine suite à la formation d’un complexe coagulase-prothrombine appelé staphylothrombine. Il s’agit d’un
36
facteur primordial dans le pouvoir pathogène de S. aureus en coagulant le plasma autour des bactéries et en les protégeant de la phagocytose.
2.5.3 Toxines
S. aureus est capable de synthétiser des toxines impliquées dans la virulence de la souche bactérienne par l’aggravation de la pathologie mais aussi l’extension du foyer infectieux (fréquemment retrouvé dans les endocardites).
2.5.3.1 Hémolysine
Les hémolysines de S. aureus sont de trois types : α, β et δ, codées respectivement par les gènes HIa, Hlb et Hlg. Elles induisent la formation de pores dans la membrane des hématies, plaquettes, leucocytes et lymphocytes. Cela entraine des échanges d’ions et de liquide entre la cellule et le milieu extra-cellulaire, provoquant l’éclatement de la cellule par perturbation de son osmolarité.
2.5.3.2 Staphylokinase
La staphylokinase est une enzyme qui fixe le plasminogène et induit l’activation de ce dernier en plasmine52. La plasmine entraine la dissolution des caillots constitués de fibrine et
des emboles septiques (caillots renfermant la bactérie), responsables de la dissémination de S. aureus. En outre, la staphylokinase a la propriété d’inhiber la phagocytose par inactivation du complément (fraction C3b) et des anticorps de type IGg53.
2.5.3.3 Sérine-protéase
Les sérine-protéases sont des enzymes capables de cliver des protéines ou peptides en hydrolysant des liaisons peptidiques. Elles faciliteraient l’ancrage de la bactérie et favoriseraient l’extension du foyer infectieux initial54.
2.5.3.4 Leucocidine de Panton-Valentine
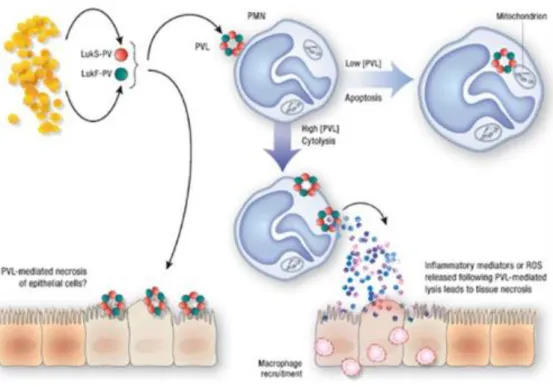
La leucocidine de Panton-Valentine (LPV) est une exotoxine dite
37
majoritairement des SARM communautaires55. La LPV est formée de deux sous-unités :
LukS-PV et LukF-LukS-PV possédant respectivement 284 et 301 acides aminés qui présentent séparément une faible toxicité. LukS-PV et LukF-PV se fixent sur des récepteurs membranaires distincts. La fixation des deux sous-unités de la LPV sur leurs récepteurs entraine une modification de la conformation de la membrane56 (octomérisation : 4 LukS-PV
et 4 LukF-PV) avec formation d’un pore aboutissant à une cytolyse (Fig. 8).
Figure 8: Mécanisme d’action de la LPV de S. aureus56
La LPV est responsable de l’aggravation des infections à S. aureus car elle détruit les phagocytes, les polynucléaires ainsi que les monocytes par le même mécanisme que cité précédemment. Cette toxine est à l’origine d’infections dermo-nécrotiques et de pneumopathies nécrosantes hémorragiques.
2.5.3.5 FAME
La FAME (Fatty Acid Modifying Enzyme) est une enzyme qui permet l’estérification des triglycérides et du cholestérol en association aux lipases. Elle a pour but de faciliter la pénétration du germe au sein des différents tissus. Plus de 80% des S. aureus possédant une lipase présentent également la FAME57.