FACULTE DE MEDECINE
A L'ECOLE DES GRADUES
POUR L'OBTENTION
DU GRADE DE MAITRE ES SCIENCES (M.Sc.)
PAR
ANDRE BOULET
BACHELIER ES SCIENCES
EN BIOLOGIE MEDICALE
UNIVERSITE DU QUEBEC A TROIS-RIVIERES THESE
PRESENTEE
H S 5
PRODUCTION D'ANTICORPS MONOCLONAUX POUR LE DEPISTAGE DE L'ANTIGENE HBsAg ASSOCIE AU VIRUS DE L'HEPATITE B.
AVANT-PROPOS
Je remercie tout spécialement le Dr Normand Marceau, mon directeur, ainsi que le Dr Jean-Paul Valet pour son aide et son enthousiasme soutenu tout au long de ce projet. Je remercie aussi le Dr Jacques Hébert pour les facilités matérielles qu'il a mises à ma disposition pour la production des anticorps monoclonaux, les techniciens et techniciennes du laboratoire d1 hématologie spéciale pour les encouragements de tous les jours ainsi que le Centre de Transfusion Sanguine de la Croix-Rouge (Québec) qui a spontanément collaboré avec nous.
ii
RESUME
Université Laval - Février 1985
Titre: Production d1 anticorps monoclonaux pour le dépistage de 11 antigène HBsAg associé au virus de 11 hépatite B.
Des anticorps monoclonaux, dirigés contre 11 antigène de surface du virus de 1'hépatite B (HBsAg) ont été obtenus par fusion de lymphocytes de souris immunisées avec de 11 antigène purifié par chromatographie d1 affinité et des cellules de myélome de souris (Sp2/0) maintenues en culture exponentielle. Le dépistage des clones sécréteurs a été effectué par RIA en phase liquide. Pour chaque fusion, nous avons obtenu entre 10 et 20% de clones sécréteurs. La sélection a été effectuée d'après le titre de 11 anticorps sécrété dans le surnageant de culture. Les hydrides intéressants ont été clonés par dilution limite. Parmi le souches obtenues, deux ont été sélectionnées comme composantes d'une trousse de dépistage. Ces anticorps sont dirigés contre le déterminant commun "a" de 1'HBsAg. Le seuil de sensibilité de cette trousse, indépendamment du sous- type ("ad" et "ay") est de 0.06 ng./ml de sérum. Tous les échantillons trouvés positifs lors de 1'utilisation de réactifs commerciaux l'ont été aussi avec cette trousse. Par contre, nous avons trouvé parmi 1114 donneurs de sang un faux positif dû à la présence d'anticorps
anti-ill
immunoglobulines de souris. Cette reaction a pu être neutralisée par addition d1 immunoglobulines de souris a 11 anticorps révélateur. Des essais complémentaires sur les échantillons du "College of American Pathologist", démontrent que la trousse, mise au point avec des anticorps monoclonaux, est supérieure à celles utilisées dans les laboratoires inscrits à ce service.
André Boulet(B.Sc.) Jean-Paul Valet (Ph.D.)
iv
TABLE DES MATIERES
Page
AVANT-PROPOS... ... ... . . i
RESUME »eo.'»eee«> 1 Î TABLE DES MATIERES... ... .... . . --- iv
LISTE DES ABREVIATIONS... . vii
LISTE DES TABLEAUX... ... . . . viii
LISTE DES FIGURES... ... ... . . . . x
INTRODUCTION... ... 1
I. Les hépatites... ... . 1
II. L 1 hépatite de type B... 1
A. Généralités... 1
B. Description du virus de 1'hépatite B... 2
C. Les marqueurs sérologiques... 5
D. Evolution sérologique... 6
E. Modes de transmission... 9
F. Distribution géographique de 11 hépatite B... ... 10
G. Importance du diagnostic... 10
H. Problématique des porteurs chroniques... 11
I. La vaccination... 12
III. Les méthodes de dépistage... ... 12
IV. Apports des anticorps monoclonaux... 16
V. But du présent travail... . 17
MATERIELS ET METHODES... 20
I. Purification de l'HBsAg... 21
A. Source de l'HBsAg... 21
B. Sous-typage et titration... 21
C. Purification par chromatographie d ' affinité... 22
II. Production d ' hybridomes... 24
A. Matériels et milieux... 24
V
2 . Milieux. .. ... 24
i. Le sérum de veau foetal... 24
ii. Les solutions de travail... 24
B. Protocole d'immunisation... 27
C. Choix des cellules de myélome... 28
D. Fusion cellulaire. ... ... 28
1. Préparation des cellules no u 11 s s x c je o s... 2 8 2. Préparation des Sp2/0... 30
3. Splénectomie... 31
4. Fusion. ... 32
5. Dépistage... 33
i. Production de 11 antisérum anti-immunoglobulines de souris... 33
ii. Marquage de 11 antigène... 34
iii. Epreuve radio-immunologique... 34
iv. Sélection des hybrides ... 35
6. Clonage... 35
7. Cryopréservation... 36
E. Difficultés de la fusion cellulaire... 37
1. Les contaminations... 37
2. Perte de production... 3 8 3. Diminution de la croissance... 38
4. Non-sélection du milieu HAT... 39
III. Production et caractérisation des anticorps monoclonaux... 39
A. Identification du type d1 immunoglobulines sécrétées... ... . . 39
B. Production d 1 ascites... 40
C. Purification des anticorps... 42
1 . Protéine A-Sépharose... 42
2. Le Séphacryl 300... 45
D. Couplage des anticorps sur la matrice... 46
1 . Choix de la matrice... 46
2. Couplage des anticorps... 47
E. Marquage des anticorps à 1'Iode-125... 47
F. Détermination des composants de la trousse... 50 1 . Procédures d 1 incubation... 50 2. Détermination de 11 anticorps de la matrice... 50 3. Détermination de 11 anticorps révélateur... 51
vi
4. Pairage des anticorps ... ... 51
5. Détermination de la sensibilité.«... 52
6. Détermination de la stabilité... 52
RESULTATS... 53
I. Purification de l'HBsAg... 54
II. Résultats des fusions cellulaires... 54
III. Essais des divers anticorps... 58
A. Essais sur matrice... 58
B. Es sais de marguage... 58
C. Pairage des anticorps... 61
IV. Essais de sensibilité de la trousse... 61
V. Essais cliniques... 62
VI. Essais de stabilité... 70
DISCUSSION... 71
I. Résultats des fusions... 72
II. La trousse... 73
CONCLUSION... 75
LISTE DES ABREVIATIONS AEC : AFI : CEP : cm : CPM : DMSO : D.O. : g : g : i. p. : i. v. : mCi : Min. : mg. : ml. : mm. : mM. : M nm. : N : PBS : PEG : RPM : s. c . : S VF :
Adjuvant de Freund complet Adjuvant de Freund incomplet Contre-électrophorèse
Centimètre
Compte par minute Dimethyl sulfoxide Densité optique Gramme Unité de gravité Intrapéritonéal Intraveineux Milli-Curie Minute Milligramme Millilitre Millimètre Millimole Mole Nanomètre Normale
Tampon phosphate salin Polyéthylène glycol Rotation par minute Sous-cutané
viii
LISTE DES TABLEAUX
Page
TABLEAU I : Sous-types de l'HBsAg... 4
TABLEAU II : Méthodes de dépistage de
1 antigene HB s... *14
TABLEAU III : Expression des immunoglobulines
chez quelques myélomes de souris... 29
TABLEAU IV : Absorption des anticorps à
divers pH... 48
TABLEAU V : Résultats des fusions cellulaires... 56
TABLEAU VI : Clones conservés pour essais... 59
TABLEAU VII : Essais sur matrice des divers
anticorps... 60
TABLEAU VIII: Essais de marquage à 11Iode-125
des divers anticorps ... 63
TABLEAU IX : Clones sélectionnés comme composants
ix
TABLEAU X : Pairage des divers anticorps... . . . .. 65
TABLEAU XI : Detection de 1'HBsAg purifié (ad)... 66
TABLEAU XII : Detection de 11HBsAg purifié (ay)... 67
TABLEAU XIII: Dépistage de 1'HBsAg sur 1114
donneurs de sang... ... ... 68
TABLEAU XIV : Comparaison de la performance de la trousse monoclonale aux autres trousses commerciales sur le panel d'échantillons fournis par le
LISTE DES FIGURES FIGURE 1 FIGURE 2 FIGURE 3 FIGURE 4 FIGURE 5 FIGURE 6 FIGURE 7 Page
: Structure du virus de 11 hépatite B... 3
: Schéma typique de 11 évolution des marqueurs sérologiques chez les malades présentant une hépatite B
aiguë ... ... . 7
: Profil sérologique d'un porteur d'HBsAg chronique: pas de
séroconversion... ... 8
: Profil sérologique d'un porteur d'HBsAg chronique: séroconversion
tardive... 8
: Représentation schématique d'une
épreuve radio-immunologique... 15
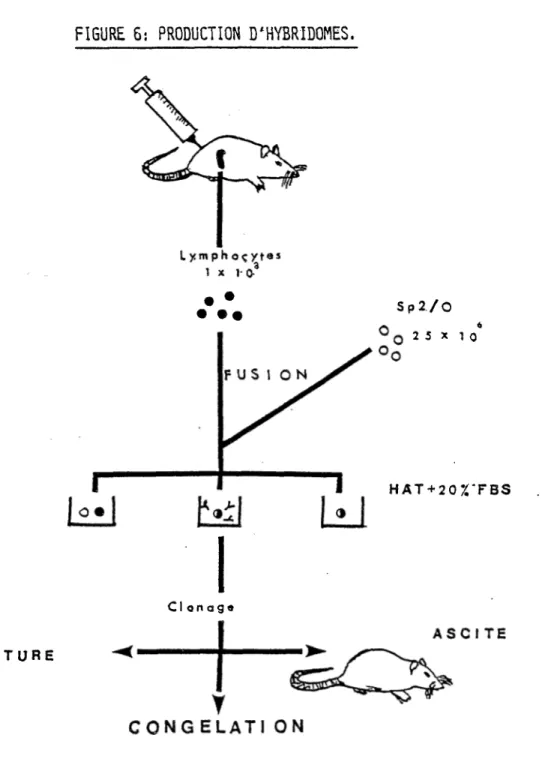
: Production d ' hybridomes... 19
: Immunodiffusion double
xi
FIGURE 8 : Elution d1 immunoglobulines, d'une souris immunisée, sur Protéine A-
Sépharose... ... 43
FIGURE 9 : Purification d'un anticorps
monoclonal (IgGl) par élution sur
Protéine A-Sépharose... »... 44
FIGURE 10 : Tamisage de l'HBsAg sur Sépharose
INTRODUCTION
I - Les hépatites.
Les hépatites virales frappent des centaines de millions de personnes dans le monde. L1 Organisation Mondiale de la Santé (O.M.S.) les considère comme un problème majeur à la santé publique (1). En 1976, elles étaient responsables de plus de 30,000 cas d1 hépatites post- transfusionnelles aux Etats-Unis (2).
On distingue trois types d1 hépatites virales provoquées par différents agents. L1 hépatite A ou "infectieuse" est causée par un virus à ARN. L1 hépatite B ou "sérique", la plus grave, d'après les séquelles souvent engendrées, est causée par un virus à ADN. Enfin, 11 hépatite Non A-Non B dont, on ne connaît pas l'agent infectieux mais qui est responsable, depuis que le dépistage de l'HBsAg est effectué, de 90% des hépatites post-transfusionnelles (1).
II - L'hépatite de type B A- Généralités.
L'hépatite B est la plus grave des hépatites virales ; il n'y a pas de traitement efficace connu et le taux de mortalité peut atteindre 5% (3). Cette maladie est caractérisée par une atteinte hépatique plus ou moins aiguë et la présence du virus dans le sang du malade. La période d'incubation varie entre 6 à 26 semaines (4). Après cette période, les principaux signes cliniques apparaissent
2
(fièvre, perte d'appétit, nausées, fatigue, etc.) suivis de 11 ictère.
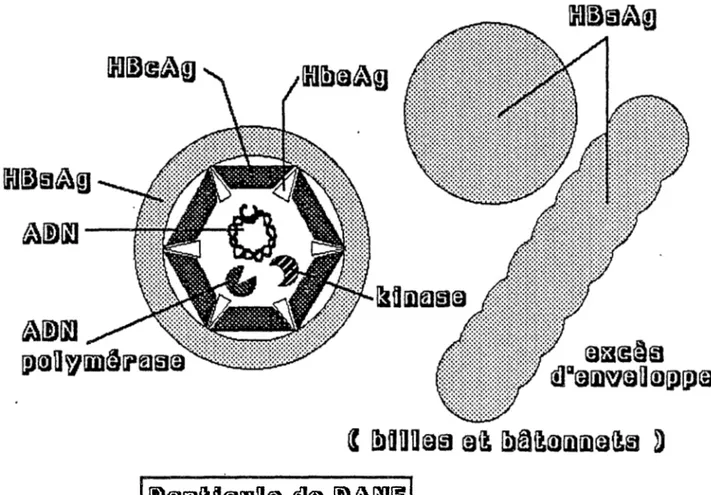
B- Description du virus de 1'hépatite B.
Le virus de 11 hépatite B possède une structure complexe. Le virion (Particule de Dane) qui a un diamètre de 42 à 45 cm est composé d'une enveloppe et d'une capside (Figure 1). L'enveloppe, de nature lipoprotéique, a 7 nm d'épaisseur et entoure la capside de 28 nm (4). Elle constitue 1'antigène de surface du virus (HBsAg). Cette enveloppe peut être libérée de la particule entière par des détergents et ainsi permettre l'étude de ses composants. Elle est composée, en grande majorité, de deux polypeptides : PI dont le poids moléculaire (P.M.) se situe entre 22 et 24,000 daltons; et P2 de poids moléculaire de 29,500 daltons (5).
Sur 1'antigène de surface, on retrouve le déterminant antigénique commun "a" auquel sont associés les déterminants, mutuellement exclusifs, d/y et w/r. Il y a donc possibilité de quatre sous-types majeurs de 1'HBsAg: adw, ayw, adr et ayr (Tableau I). La division du déterminant "a" en "al", "a2", "a3", et autres spécificités intermédiaires permet de classifier 1'HBsAg en dix autres catégories (7). Ces sous-types n1 ont de 1'importance que lors d'études épidémiologiques (Section F) et du développement de trousses de dépistage.
TABLEAU I: SOUS-TYPES DE L'HB
s
A
g
,
5
contient un ADN bicaténaire circulaire associé à une ADN polymérase qui assure la multiplication virale (6). Elle est composée, majoritairement, d'un polypeptide (HBcAg) de 19,000 daltons (7).
Par ailleurs, une particule antigénique "e" (HBeAg), thermolabile et dont la nature n'est pas encore déterminée, pourrait correspondre à une partie de 1'HBcAg transformée par une kinase associée à cette dernière (8).
C- Les marqueurs sérologiques de 11 hépatite B.
Il existe cinq marqueurs sérologiques permettant de suivre 11 évolution d'une hépatite de type B: l'HBsAg, les anticorps diriges contre l'HBsAg (Anti-HBs), les anticorps dirigés contre 1'HBcAg (Anti-HBc), 1'HBeAg et les anticorps dirigés contre 1'HBeAg (Ati-HBe).
L'HBsAg se retrouve dans les sérums des patients sous forme de petites sphères dont le diamètre est de 20 à 22 nm et sous forme de bâtonnets de diamètre semblable mais dont la longueur varie de 40 à 400 nm (Figure 1 ) (9). Il est 1'indicateur le plus précoce de la présence d'une infection aiguë ou chronique. L'apparition d'anticorps correspondants (Anti-HBs) indique la guérison clinique ainsi que 1'immunité contre le virus.
Les anticorps anti-HBs traduisent, soit une infection active en phase aiguë ou bien une infection active en phase chronique. La détection des anticorps de classe
6
IgM, spécifiques à l'HBcAg, aide à différencier ces deux cas : lors d'une infection aiguë, on retrouve un niveau élevé de ces anticorps (Type IgM) contrairement à 1'infection chronique où ces derniers sont détectés à un bas niveau. Il est à noter que l'HBcAg n1 est pas un marqueur sérologique puisqu'il ne peut être détecté dans le sang circulant, étant masqué à 1'intérieur des particules de Dane. On ne le retrouve qu'au niveau des noyaux des hépatocytes.
L'HBeAg est 1'indicateur d'une infection aiguë représentant la période la plus contagieuse. Les anticorps anti-HBe indiquent la guérison. En 1'absence d'HBsAg et des anticorps correspondant à ce dernier, les anticorps anti-HBe indiquent la convalescence et persistent entre 1 à 2 ans (10). La détection de ces anticorps permet d'identifier les individus qui deviennent porteurs chroniques.
D- Evolution sérologique.
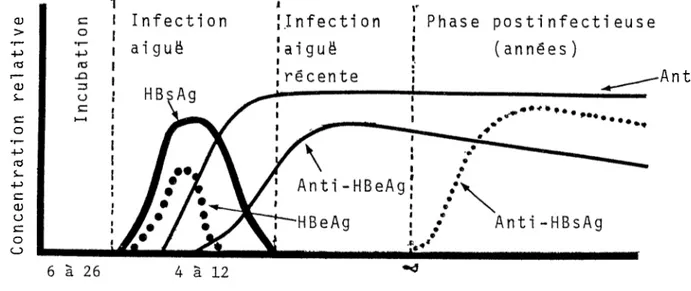
Les marqueurs sérologiques sont présents à différents moments de la maladie et permettent ainsi de suivre 1'évolution de cette dernière.
L'HBsAg apparaît après la période d1 incubation qui varie entre 6 à 26 semaines. Peu après 11 apparition des symptômes, il atteint son maximum et disparaît généralement après 1 à 3 mois (Figure 2). Les anticorps anti-HBs n'apparaissent que de 2 à 16 semaines
C
o
n
c
e
n
t
r
a
t
i
o
n
r
e
l
a
t
i
v
e
7Figure 2: Schema typique de 11 evolution des marqueurs sérologiques chez les malades présentant une hépatite B aiguë.
Infection
Infecti on
Phase postinfectieuse
aiguë
aiguë
(années)
récente
HBsAg
Anti-HBeAg
HBeAg
Anti-HBsAg
6 à 26 4 à 12Anti-HBeAg
Temps (semaines)C
o
n
c
e
n
t
r
a
t
i
o
n
r
e
l
a
t
i
v
e
C
o
n
c
e
n
t
r
a
t
i
o
n
r
e
l
a
t
i
v
e
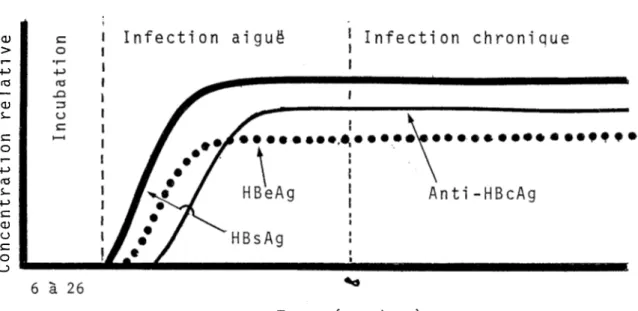
8Figure 3: Profil sérologique d'un porteur d'HBsAG chronique: pas de séroconversion
| Infection chronique
aiguë
Infection
HBeAg
Anti-HBcAg
HBsAg
6 à 26 Temps (semaines)Figure 4: Profil sérologique d'un porteur d'HBsAG chronique: séroconversion tardive
Infection aiguë
ction chronique
HBsAg
* » * *
HBeAg
Anti-HBeAg
6 à 26
9
après la disparition de l'HBsAg. Il y a donc une période où l'on ne peut détecter ces deux marqueurs et où il est important d1 utiliser les autres marqueurs.
Les anticorps anti-HBc apparaissent en même temps que les symptômes et persistent toute la vie. Etant présents à tous les stades de 11 infection, ils représentent 11 indicateur le plus fiable de la maladie ou de l'état de porteur chronique.
L'HBeAg apparaît en même temps que l'HBsAg et disparaît peut de temps avant ce dernier. Il est le signe de la réplication virale donc de la phase infectieuse. Peu de temps avant sa disparition, les anticorps anti-HBe apparaissent indiquant la séroconversion.
Le profil sérologique présenté n'est pas le seul possible (Figures 3 et 4). Des études ont démontré 1'existence de divers autres profils sérologiques (11).
E- Modes de transmission.
La transmission de 1'hépatite B semble, pour la plus large part, associée au sang et à ses dérivés
I
(Transfusions sanguines ou injections de dérivés sanguins). Cependant, d'autres liquides biologiques sont soupçonnés de jouer un certain rôle dans la transmission de 1'infection: la salive, le liquide vaginal, le sperme, le liquide amniotique, le colostrum, le lait et le sang menstruel (1, 2). La transmission se fait généralement par des biais divers : acupuncture, tatouage, injections diverses,tatouage, inj ections
percutanée (via de petites blessures) et par le contact sexuel.
F- Distribution géographique de 11 hépatite B
L1 hépatite B ne frappe pas également dans tous les pays du monde. Des études épidémiologiques démontrent que dans les pays où le niveau de vie est élevé, il n1 existe que peu de porteurs chroniques (0.1 à 1 %) comparativement aux zones plus défavorisées (Afrique équatoriale, Asie) où le taux peut atteindre 20% (1).
Des études sur la dispersion géographique des quatre principaux sous-types de l'HBsAg montrent que le sous-type "adw" est prédominant en Amérique du Nord et dans le Nord-Ouest de 11 Europe; que 11"ayw" se retrouve en Méditerranée et en Afrique; que 1'"adr" est retrouvé presque exclusivement en Extrême Orient et que 11"ayr" est confiné dans la région du Pacifique (14).
G- Importance du diagnostic.
Les raisons justifiant la recherche de la présence du virus de 1'hépatite B sont nombreuses et ne doivent pas être prises à la légère.
-Un test positif pour l'HBsAg implique le rejet du sang donné pour fins de transfusion.
précautions afin d1 éviter la contamination d'autres patients ou du personnel médical lors de la manipulation de prélèvements sanguins ou lors d1 interventions chirurgicales.
-Les porteurs chroniques doivent être identifiés car ils peuvent représenter un danger pour les personnes qui les côtoient.
-Le dépistage systématique des porteurs chez les donneurs de sang du Québec a permis de situer son incidence à 39 cas sur 10,000 (12, 13).
-Le contrôle des hépatites de type B pourrait permettre d1 abaisser 11 incidence du cancer du foie car des études ont démontré que 11 hépatite B serait à 11 origine des cancers primitifs du foie (1, 16). Cela revêt une grande importance dans les pays d'Afrique et d'Asie où la proportion de porteurs chroniques peut atteindre 20%.
H- Problématique des porteurs chroniques.
En 1976, la population mondiale des porteurs chroniques était évaluée à environ 112 millions (2). Il a été observé que les hommes deviennent plus facilement porteurs que les femmes. Cependant, d1 autres facteurs semblent amener à la chronicité: une infection contractée en bas âge, un déficit immunitaire congénital ou acquis, et semble-t-il, certaines causes d'ordre génétique (2).
Il est clair que les porteurs chroniques constituent un problème universel pour les transfusions sanguines et autres soins médicaux. Ils représentent une
source constante de transmission de 11 hépatite B qui ne peut être négligée. Il est donc nécessaire de les identifier afin d'éviter toute transmission ultérieure.
I- La vaccination.
En 1983, Merck Sharp and Dome a introduit, sur le marché Nord-Américain, un vaccin contre l'hépatite B. La mise au point d'un tel vaccin s'est heurtée à l'impossibilité de cultiver le virus. Il est donc nécessaire de purifier l'HBsAg du sérum de porteurs chroniques, de l'inactiver et d'y ajouter un adjuvant (hydroxide d'alumine). Cependant, la production d'HBsAg, par le génie génétique, figure parmi les autres sources possibles de vaccin. Certains gènes viraux ont déjà été clonés chez la bactérie et permettent d'espérer, pour bientôt, l'utilisation d'un vaccin "synthétique".
La mise au point du vaccin contre l'hépatite B permet un certain contrôle de cette infection dans les laboratoires d'hôpitaux.
III - Les méthodes de dépistage.
Depuis qu'il est obligatoire qu'un test de détection de l'hépatite B soit effectué sur tous les dons de sang (et de ses dérivés) pour fins thérapeutiques, l'incidence des hépatites post-transfusionnelles a diminué d'environ un tiers (17). Le test de dépistage, généralement
utilisé, est la détection de 1'antigène de surface du virus (HBsAg).
Il existe diverses méthodes de dépistage, de 1'HBsAg, de qualité et de sensibilités variables (Tableau II). L1 épreuve radio-immunologique est reconnue comme étant la plus sensible pour le dépistage de 1'HBsAg (14). L1 épreuve immuno-enzymatique, à peu près aussi sensible, est cependant très intéressante puisqu'elle évite la manipulation de produits radioactifs et fournit des réactifs plus stables (3 mois vs 4 semaines). Le principe de ces deux épreuves est similaire. Dans le cas de 1'épreuve radio-immunologique (RIA), un premier anticorps anti-HBs couplé à la matrice (tubes ou billes de plastique) permet de fixer la particule antigénique (HBsAg) dont la présence est confirmée par 1'addition d'un second anticorps (Anti-HBs) marqué à l'Iode- 125 (Figure 5). Pour ce qui est de 1'épreuve immuno enzymatique (EIA), le principe demeure le même mais dans ce cas, le second anticorps (Anti-HBs) est couplé à un enzyme et c'est la capacité de ce dernier à dégrader un substrat qui nous permet de détecter la présence de 1'HBsAg. Généralement, les deux anticorps utilisés sont d'origines animales différentes.
La plupart des trousses, présentement sur le marché, utilisent l'une de ces deux méthodes. Ces trousses sont composées d'anticorps polyclonaux de diverses sources (cobaye, chèvre) (18). Une seule trousse, utilisant des anticorps monoclonaux, est actuellement sur le marché Nord Américain (N.M.L. Laboratories, U.S.A.).
14
TABLEAU II:
METHODES DE DEPISTAGE DE
L'ANTIGENE
HBs
METHODES
SENSIBILITE .
1) DIFFUSION DOUBLE
1
2) CONTRE ELECTROPHORESE
5
3) TEST AU LATEX
5
4) INHIBITION D'HEMAGGLUTINATION
PASSIVE
10 A 20
5) FIXATION DU COMPLEMENT
10 A 20
6) HEMAGGLUTINATION PASSIVE (RCA)
5 A 100
7) TEST RADIOIMMUNOLOGIQUE
(PHASE SOLIDE)
500 A 1000
.5
FIGURE 5:
REPRESENTATION SCHEMATIQUE D'UNE EPREUVE RADIO-IITUNOLOGIQUE
a
) P
hase
solide
:
matrice
et
anticorps
spécifiques
b
) A
ntigène
du
sérum
c)
A
ntigène
fixé
sur
la
phase
solide
d
) A
nticorps
radioactif
IV - Apports des anticorps monoclonaux.
Les antisérums conventionnels présentent des inconvénients qui ne sont pas négligeables. Leur production demande une purification continuelle d'antigène. La spécificité des antisérums peut être compromise par une réactivité naturelle ou à la suite d'une immunisation avec un antigène qui n'est pas absolument pur d'où la nécessité de les absorber. La proportion des immunoglobulines spécifiques, dans un antisérum, est faible par rapport aux autres immunoglobulines et exige d'autres étapes de concentration et de purification. Le titre et 11 affinité ne sont pas constants d'un lot à un autre puisque la réponse immunitaire, pour un même antigène, varie d'un animal à un autre.
La technologie des hybridomes, producteurs d'anticorps monoclonaux, développée en 1975 par Milstein et Kohler (19) est aujourd'hui bien établie (20, 21) et trouve une multitude d'applications. Les anticorps monoclonaux remédient aux inconvénients des antisérums conventionnels et sont à la base d'une véritable révolution technologique (22, 23, 24, 25, 26).
La préparation d'anticorps monoclonaux ne requiert pas un antigène pur ni de nouvelles immunications à moins que l'on désire d'autres clones sécréteurs. L'antigène purifié n'est nécessaire que lors du dépistage des clones sécréteurs. Une fois produit, 1'anticorps monoclonal peut
1 7
servir à purifier 11 antigène à un très haut degré de pureté. La spécificité et l'affinité des anticorps monoclonaux sont constants puisqu'un clone ne sécrète qu'un type d'immunoglobulines. Lorsqu'un clone est établi, l'anticorps sécrété peut être obtenu en grandes quantités par le passage du clone à la souris.
Les anticorps monoclonaux ne présentent pas que des avantages; puisqu'ils ne reconnaissent qu'un site antigénique, ils ne peuvent être utilisés dans les essais de précipitation tels que l'immunodiffusion radiale, 1'immuno électrophorèses , etc. Dans les essais de cytotoxicité
(fixation du complément), il peut arriver que l'anticorps sécrété ne fixe pas le complément et que l'on soit obligé de générer d'autres clones dans l'espoir de trouver l'anticorps désiré.
Il n'en reste pas moins que la technique des hybridomes demeure le chef de file de la biotechnologie.
V - But du présent travail.
Notre but est de développer une trousse de détection de l'HBsAg utilisant la technologie des anticorps monoclonaux. Les lignées d'hybridomes seront développées lors de fusions de cellules spléniques, provenant de souris BALB/c immunisées avec de l'HBsAg (ad ou ay), et des cellules de lignée myéloïde (Sp2/0) (Figure 6). Ils seront sélectionnés selon leur stabilité, la spécificité et l'affinité des anticorps qu'ils produisent. Des essais de fixation sur matrice et de marquage à l'iode-125 seront
18
effectués sur les divers anticorps sélectionnés afin de trouver ceux pouvant composer la trousse. Par la suite, des essais de pairages seront effectués, entre les anticorps sélectionnés, afin de trouver la meilleure combinaison. La sensibilité de la trousse sera déterminée comparativement à la trousse maison du laboratoire ainsi qu'au test AUSRIA II (Abbott Laboratories, U.S.A.); ce dernier étant reconnu comme le meilleur dans sa catégorie (polyclonaux) (17). Ensuite, la trousse servira d'outil de dépistage sur un volume minimal de 1000 sérums et cela, parallèlement a la trousse AUSRIA II. De façon générale, nous désirons développer une trousse, de sensibilité et spécificité accrues, qui servira d'outil de dépistage dans le laboratoire clinique.
19
CULTURE
FIGURE 6: PRODUCTION D'HYBRIDOMES.
#
• ••
F U S I ON S p 2 / O 2 5 x 1 O« HAT + 20%'FBS Clonage ASCITECONG ELATI ON
\ . X. ' !21
I - Purification de 1'HBsAg. A- Source de 11HBsAg.
Des plasmas de porteurs asymptomatiques ont été fournis par le Centre de Transfusion Sanguine (C.T.S.) de Québec qui effectue le dépistage (HBsAg) sur tous les dons de sang par une méthode radioimmunologique très sensible. Parmi ces plasmas, nous avons sélectionné les plus riches en antigène pour purification ultérieure.
B- Sous-typage et titration.
La titration et le sous-typage des plasmas positifs sont effectués par contre-électrophorèse (C.E.P.) sur plaque d'agarose 0.8% (Bio-Rad, U.S.A) dans du tampon barbitral 0.05M pH 8.6. Les dilutions des plasmas sont mises à migrer contre 11 anticorps anti-HBsAg pendant 30 minutes sous une tension de 250 volts. Un arc de précipitation entre les puits (anticorps-plasmas) traduit une réaction positive. L1 inverse de la dilution maximale donnant un précipité indique le titre (0 à 1/256). Seuls les sacs de sang dont le titre est supérieur à 1/16 sont conservés pour purification ultérieure. Le sous-typage est effectué par la même méthode mais sur une seule dilution de 11 antigène (titre 1/2 à 1/16).
Les réactifs de titration et de sous-typage ont été préparés au laboratoire par immunisation de lapins avec de 11 antigène purifié. Des antigènes ("ad" et "ay") et
22
des anticorps de références fournis par le N.I.H. (Bethesda, U.S.A.) ont permis de standardiser nos antisérums de sous- typage. En bref, des lapins ont été immunisés avec 1 à 2 mg. d1 antigène ("ad" ou "ay") en adjuvant de Freund complet
(Difco Laboratories, U.S.A) suivi d'une seconde injection (21 jours plus tard) en adjuvant incomplet (Difco Laboratories, U.S.A.). Dix jours après la seconde injection, les lapins ont été saignés à blanc. Les antisérums anti-"ad" ont été saturés avec de 11HBsAg-"ay" (prépurifié et concentré à un titre de 1/1000 en C.E.P.) jusqu'à ce que 1'anticorps ne reconnaisse que les antigènes de sous-type "ad". De la même manière, les antisérums anti-"ay" ont été saturés avec de 11 antigène HBsAg-"ad". Nous avons ainsi obtenu des antisérums spécifiques à chaque sous-type d'HBsAg.
C- Purification par chromatographie d'affinité
Du serum de mouton anti-HBsAg, préparé antérieurement au laboratoire, est précipité au sulfate d'ammonium à 50% de saturation. La fraction d'immunoglobulines obtenue est dialysée extensivement contre du tampon phosphate salin pH 7.4. Les anticorps anti-HBsAg sont couplés à 30 ml. de Sépharose CL 4B (Pharmacia, Suède) fraîchement activé avec du bromure de cyanogène (27) à raison de 20 mg. de protéine par ml de gel. Le couplage est effectué à pH de 7.4 afin de conserver 1'intégrité de 1'anticorps. L'immunoabsorbant obtenu est lavé avec du PBS,
23
puis sature avec une solution de glycine 1M (pH: 8.0) et finalement vidé dans une colonne de 25 X 60 cm (Pharmacia, Suède). Après un cycle de lavage à haut et bas pH, 1'immunoabsorbant est placé en tampon PBS pH 7.5, 50 nM citrate de sodium.
Des "pools" de plasmas positifs HBsAg-ad et HBsAg-ay (Titre 1/16 à 1/64), sont passés successivement sur la colonne d'immunoabsorbant jusqu’à saturation de 11 anticorps. Après lavage du gel avec du tampon phosphate 0.5M NaCl (pH 7.4), 1'antigène HBsAg est élué avec une solution de Nal 5M, 50 mM Tris-HCl, pH 6.5. L1élution de 11 antigène est suivie par la lecture de 11 absorbance à 280 nm (D.O. 3.4 = 1 mg./ml). Les fractions contenant 11 antigène sont réunies et dialysées une nuit à 4°C contre de la saline (NaCl 0.85%) puis concentrées par ultrafiltration sur membrane XM 50 (Amicon, U.S.A.).
La solution obtenue (8 ml) est appliquée sur une colonne de Sépharose 6B (5X60 cm, Pharmacia, Suède) équilibrée avec du tampon phosphate salin; 11 antigène sort peu après le volume mort de la colonne et les fractions correspondant au pic d1 absorption (280 nm) sont réunies et concentrées par ultrafiltration.
A ce stade, 11 antigène est assez purifié pour servir aux immunisations et aux dosages radio-immunologiques.
24
II - Production d'hybridomes. A- Matériels et milieux.
1) Equipement
Pour les fusions cellulaires, trois items sont essentiels : une hotte à flux laminaire (Canadian Cabinet, Canada), un incubateur à atmosphère contrôlée (Forma Scientific, U.S.A.) et un système pour cryopréservation à azote liquide (Linde, U.S.A.). Les autres fournitures requises pour cette technique sont celles retrouvées dans un laboratoire de culture cellulaire.
2) Milieux
i) Le sérum de veau fêtai (SVF).
Ce ne sont pas tous les lots de SVF qui peuvent être utilisés lors de fusions cellulaires. Il est donc nécessaire de "tester" différents lots, en effectuant une fusion, afin de trouver celui donnant un haut rendement d1 hybrides. Un bon sérum permet de voir des clones de 10 à 30 cellules quatre jours après la fusion et cela, dans 50 à 60% des puits.
ii) Les solutions de travail.
Toutes les solutions de travail doivent être stérilisées sur filtre 0.22 microns (u).
25
- Milieu standard
Pour la culture des cellules tumorales et des hybrides établis, le milieu Iscove's Modified Dulbecco's Medium (IMDM) (Gibco, U.S.A.) est utilisé. Il est alors supplémenté de 5% SVF, de 0.05% 2- Mercaptoéthanol (0.1M), de pénicilline (10 unités internationales/ml) et de streptomycine (0.1 mg./ml) (Gibco, U.S.A.). Le milieu peut être conservé à 4°C pour une période maximale d'un mois.
- Milieu sélectif HAT
Les ingrédients du milieu HAT sont préparés en solutions concentrées 100X. Dans un ballon de 100 ml, 1.8 mg. d1 aminoptérine (Sigma, U.S.A.) est ajouté à de l'eau déionisée et dissous par 1'addition de NaOH 1N. Le pH de la solution est ensuite ajusté à 7,8 et la solution est complétée à 100 ml. Des aliquots sont préparés et congelés à -20 °C.
L'hypoxanthine et la thymidine peuvent être préparés en une seule solution. Dans un ballon de 100 ml, 136 mg. d'hypoxanthine (Sigma, U.S.A.) sont dissous dans de l'eau déionisée, par 1'addition de NaOH 1 N. Puis, 76 mg. de thymidine (Sigma, U.S.A.) sont ajoutés ; le pH est réajusté à 9,5 avec de l'acide acétique et le volume complété à 100 ml. La solution est aliquotée et conversée à -20°C.
26
"HAT" requiert le milieu standard (IMDM) préparé tel que décrit précédemment. Cependant, la concentration de SVF est portée à 20% et les ingrédients "HAT" sont ajoutés à raison de 1%. Le milieu sélectif ne doit être préparé que 24 à 48 heures avant la fusion.
- Milieu "HT"
Le milieu "HT" est préparé de la même manière que le milieu sélectif mais en omettant 11 aminoptérine. Il est conversé à 4°C pour une période n1 excédant pas deux semaines.
- Tampon salin (PBS)
Le tampon PBS, utilisé lors de la production des hybridomes, est composé des éléments suivants: NaCl 0.15 M, KC1 0.005 M, Na2HP04 .01 M, NaH2P04 0.005 M, dextrose 0.2% et rouge de phénol (Sigma, U.S.A.) à 0.001%. Il peut être conservé à 4°C pour une période d'un mois.
- Solution de dénombrement des lymphocytes.
Afin d1 évaluer le nombre de lymphocytes obtenus de la rate, il est très efficace d'effectuer une dilution dans une solution qui provoque la lyse des globules rouges. Une telle solution est composée d'acide acétique glacial (Fisher Scientific, U.S.A.) à 3% et
27
- Agent fusionnant
L'agent fusionnant utilisé est le Polyéthylène Glycol (PEG). Fazekas (21) a étudié l'effet des divers types de PEG en association avec diverses concentrations de Diméthyl Sulfoxide (DMSO). Ces études ont révélé que le meilleur milieu fusionnant est celui composé de PEG 4000 (Merck, Allemagne) à 50% 'et de DMSO à 5% final. Les deux éléments sont dissous dans du tampon PBS (pour hybridomes) à 45°C. La solution est stérilisée et conservée à 37°C. Il est à noter que cette solution n'est préparée que le jour de la fusion.
- Milieu de congélation
Le milieu utilisé pour la cryopréservation des cellules est composé de milieu standard (IMDM) supplémenté de 20% SVF et de 10% DMSO. Ce milieu ne peut être conservé que 14 jours à 4°C.
B- Protocole d'immunisation.
Il existe une multitude de protocoles d'immunisation qui varient selon 1'auteur et le type d'antigène (29). Nous utilisons, pour l'HBsAg, un protocole standard utilisant des souris BALB/c (Jackson Laboratories, U.S.A.) âgées de 6 à 8 semaines (18-20 g.) et qui se décrit comme suit :
28
- Jour 21: 0.05 nung. d'HBsAg : i.v. - Jour 22: 0.05 mg. d'HBsAg : i.v. - Jour 25: FUSION.
C- Choix des cellules de myélome.
Le choix de la lignée de cellules tumorales est d'une grande importance. De nombreuses lignées ont été développées avec chacune leurs propres caractéristiques (Tableau III). Il est plus avantageux de sélectionner une lignée qui ne synthétise ni ne sécrète de chaînes légères. La lignée Sp2/0-Ag14, un hybride de la P3/X63-Ag8, répond à ce critère. Cette lignée étant la plus utilisée, il nous a été facile de nous la procurer.
La Sp2/0 est cultivée dans des boîtes de culture de 80 cm2 (Nunc, Danemark) en présence de milieu standard à 5% SVF (15 ml) dans un incubateur à atmosphère contrôlée (37°C, 5% Co2 et 95% humidité).
D- Fusion cellulaire.
1) Préparation des cellules nourrissières.
L'apport des cellules nourrissières, pour la production d'hybridomes, a déjà été démontré (20, 21). L'utilisation de ces dernières aide à la croissance et à la survie des hybrides. Les macrophages péritonéaux entrent dans cette catégorie et sont facilement disponibles.
TABLEAU III: EXPRESSION DES IMMUNOGLOBULINES CHEZ
QUELQUES MYELOMES DE SOURIS.
S
ynthese
S
ecretion
P326BU4
K
appa
K
appa
45,6, TGI,7
K
appa
K
appa
P3/NS1/1-A
g
4-1
_____ _____S
p
2/0-A
g
14 °
_____P3/X63-AG8
K
appa
K
appa
H
ybride
de
P3/
x
63-A
g
8//P3/
x
65-A
g
8
30
Normalement, on les retrouve en nombre peu élevé d'où la nécessité de stimuler leur migration à l'aide d'une solution stérile d'amidon à 2% (saline). Cette stimulation est effectuée sur 2 à 3 souris BALB/c (1 ml/souris), 2 jours avant la fusion.
Le jour précédant la fusion (jour 24), les souris "stimulées" sont sacrifiées. On injecte, dans la cavité péritonéale, une solution stérile de PBS-sucrose 11.6% à raison de 10 ml par souris. Après un massage délicat de 1'abdomen, le liquide est recueilli et déposé dans un tube de 50 ml stérile (Corning, U.S.A.). Le volume est complété avec du PBS (pour hybridome) et le tube est centrifugé 10 minutes à 200 X g. Puis, le surnageant est décanté et le culot est resuspendu dans un volume minimal de PBS afin d'en effectuer le décompte cellulaire (hémacytomètre). La solution-mère est, de nouveau, lavée avec du PBS et le culot resuspendu dans du milieu sélectif HAT afin d1 obtenir une concentration de 15,000 macrophages/ml.
A l'aide d'une pipette multiple (Dynatech, U.S.A.), 0.1 ml de la solution de macrophages est déposé dans chaque puits d'une plaque à culture de 96 puits (Nunc, Danemark). Pour une fusion (1 rate), 16 plaques sont ainsi préparées puis placées en atmosphère contrôlée.
2) Préparation des Sp2/0.
31
recommandé que les cellules tumorales soient en phase de croissance exponentielle» Dans ce but, la journée précédant la fusion, les cellules sont repiquées (1/2) dans du milieu standard supplémenté de 20% SVF.
La journée de la fusion, les cellules sont récupérées, centrifugées (200 X g, 10 minutes) et resuspendues dans un volume minimal de PBS (10 ml). Les cellules sont dénombrées, lavées de nouveau puis resuspendues dans du PBS afin d'obtenir une concentration finale de 10 millions de cellules par ml de milieu. Pour une fusion, le minimum de cellules tumorales requises est de 20 millions.
3) Splénectomie.
La souris immunisée est sacrifiée et le sérum de cette dernière est conservé pour être utilisé, comme témoins positif, lors du dépistage des clones sécréteurs. La rate est prélevée aseptiquement et déposée dans un plat de pétri stérile de 100 X 15 mm (Fisher Scientific, U.S.A.) contenant 5 ml de PBS stérile. En grattant la capsule avec une pipette stérile, les cellules sont récupérées puis lavées dans 50 ml de PBS stérile (200 X g, 10 min.). Elles sont resuspendues dans un volume minimal de PBS et dénombrées par une dilution (1:10) de la solution-mère dans la solution pour décompte lymphocytaire. Les cellules sont, de nouveau, lavées puis resuspendues dans du PBS afin d'obtenir une
32
concentration finale de 10 millions de lymphocytes par ml de tampon.
4) Fusion.
Dans un tube de 50 ml stérile (Corning, U.S.A.), 20 millions de Sp2/0 (2 ml) sont combinés à 100 millions de lymphocytes (10 ml). Le volume est complété avec du PBS et le tube est centrifugé à 200 X g pendant 10 minutes. La solution est décantée et le culot est dissocié par 11 application de chiquenaudes sur le tube.
Sous agitation constante, 1 ml de la solution de PEG (37°C) est ajouté au culot sur une période de 1 minute. Puis, le tube est fermé et, en agitant, plongé dans un bain-marie (Haakes, U.S.A.) à 37°C pendant 90 secondes. On arrête la fusion par 11 addition de 20 ml de PBS dans les temps suivants:
T (sec.) Quantité (ml) 30 30 60 1 3 1 6
Le volume est complété avec du PBS et la solution est laissée au repos pour environ cinq minutes. Les cellules sont centrifugées (200 X g, 10 min), lavées une seconde fois, avec du milieu IMDM pur et resuspendues dans 160 ml de milieu sélectif HAT.
A l'aide de la pipette multiple, les cellules sont distribuées dans les 16 plaques (96 puits) à
33
raison de 0„1 ml par puits. Les plaques de culture sont replacées dans l'incubateur à atmosphère contrôlée.
5) Dépistage.
Après environ dix jours, les plaques sont inspectées et le milieu HAT est remplacé par du milieu frais. Deux jours plus tard, le dépistage est effectué. Plusieurs méthodes de dépistage ont été décrites par divers auteurs (20, 21) et tous estiment que la méthode choisie doit être rapide et reproductible. Notre choix s'est arrêté sur le RIA en phase liquide. i)
i) Production de l'antisérum anti- immunoglobulines de souris.
Des IgG de souris sont purifiés par passage du sérum de souris normale sur Sépharose-Protéine A (Pharmacia, Suède) suivi d'un tamisage sur Séphacryl 300 (Pharmacia, Suède) (voir section III, C). La concentration des immunobulines est évaluée au spectrophotomètre à 280 nm (D.O.:1.5 = 1 mg./ml) et la solution est dialysée contre de la saline (NaCl 0,.9%) pendant une nuit à 4°C.
Quatre lapins "Nouvelle zélande" sont immunisés selon le protocole suivant:
- Jour 0: 2 mg. d'immunoglobulines + ACF : s.c.
34
- Jour 21: 2 mg. + AIF : s.c (1/2) et i.m. (1/2).
- Jour 31: Prélèvement par 11 oreille. Chaque antisérum est dilué (1/2, 1/4, 1/8,1/10 et 1/16) afin d1 évaluer sa capacité à précipiter les immunoglobulines d'un sérum, de souris normale, dilué 1/100. La dernière dilution où il se produit de la floculation est celle qui sera utilisée lors du dépistage. Elle est habituellement de l'ordre de 1/10.
ii) Marquage de 1'antigène.
L'HBsAg est marqué à 1'iode-125 suivant la méthode utilisant 1'Iodo-Gen (Pierce Chemical, U.S.A.) (Voir section III, E). Une fois marqué, il est dilué dans un tampon PBS-BSA (0.5%) de manière à obtenir 20,000 CPM par 0.1 ml.
iii) Epreuve radio-immunologique.
Pour chaque puits où il y a croissance de cellules, 0.1 ml de surnageant est prélevé et déposé dans un tube de verre 12 X 75 mm (Quélab, Canada) contenant 0.1 ml d'HBsAg marqué (20,000 CPM) auquel a été ajouté du sérum de souris normale (1%). Après une heure d'incubation à la température de la pièce, 0.1 ml d'antisérum, dilué dans du PBS-BSA (0.5%) est ajouté au mélange. Après une heure à la température ambiante, 1 ml de saline froide (NaCl 0.85%) est ajouté à chaque tube. Les tubes sont centrifugés dans une centrifugeuse Centra 7 (I.E.C., U.S.A.) à 3,000 RPM pendant
35
30 minutes (4°C). Le liquide est alors décanté et les tubes sont comptés dans un compteur gamma (Abbott Laboratories, U.S.A.).
iv) Sélection des hybrides.
Les hybrides, trouvés positifs lors du dépistage, sont évalués selon la capacité de chacun à précipiter l'HBsAg marqué. Les surnageants sont dilués dans du PBS-BSA (0.5%), de 1000 à 1 million de fois. Un RIA (phase liquide) est effectué sur chaque dilution et seuls les hybrides, précipitant au moins 25% de 11 antigène et à une dilution minimale de 100,000, sont conservés. La capacité à précipiter est évaluée face aux deux sous-types "ad" et "ay". Les hybrides à haute capacité seront renourris avec 0.1 ml de milieu HT et les plaques (96 puits) sont replacées en atmosphère contrôlée. Le lendemain, les hybrides sélectionnés sont repiqués dans des plaques à culture de 24 puits (Nunc, Danemark) contenant 1.5 ml de milieu HT par puits. Les plaques sont placées dans les conditions habituelles pour environ une semaine.
6) Clonage.
Lorsque les cellules forment une couronne dans les puits, les surnageants sont "testés" afin de s'assurer que les hybrides sécrètent toujours. Si 11 épreuve est positive, le milieu HT est remplacé par 1.5 ml
36
de milieu standard supplémenté de 20% SVF et les plaques sont retournées à 11 incubateur pour une nuit.
Le lendemain, chaque hybride est cloné, par dilution limite, dans du milieu standard supplémenté de 20% SVF. Trois plaques à culture de 96 puits sont "ensemencées" avec des dilutions respectives de 3 , 1.5 et 0.5 cellules par puits et cela, pour chaque hybride sélectionné. Les plaques, ainsi préparées, sont placées dans les conditions de culture habituelles.
Après 12 à 14 jours, les surnageants des puits où il y a croissance, sont "testés" (RIA liquide). Pour la plus forte dilution cellulaire (0.5) , si tous les puits sont positifs, le clone peut être repiqué dans une boîte à culture de 25 cm2 (Nunc, Danemark) contenant 6 ml de milieu standard supplémenté de 20% SVF. Par la suite, le clone sera passé graduellement à du milieu standard contenant 5% de SVF.
Dans le cas contraire, 11 hybride doit être recloné jusqu'à 11 obtention d'un clonage positif à 100%.
7) Cryopréservation.
Tous les clones doivent être congelés, le plus rapidement possible, afin d'éviter la contamination de ces derniers. Soixante millions de cellules sont récupérées et centrifugées à 200 X g pendant 10 minutes. Le surnageant est décanté et le culot est resuspendu dans 6 ml de milieu à congélation froid (4°C). Six cupules à
37
congélation de 1 ml (Sarstedt, Allemagne) sont remplies puis placées dans un congélateur à -80 °C (Forma Scientific, U» S.A.) pour la nuit. Le lendemain, les cupules sont transférées dans un récipient à azote liquide (Linde, U.S.A.).
Quelques jours plus tard, une cupule est décongelée afin de vérifier la stérilité et la viabilité cellulaire. La cupule est placée dans un bain-marie à 37°C, jusqu'à ce que le milieu soit complètement dégelé. Les cellules sont lavées une fois, dans du PBS puis transférées dans une boîte de culture contenant le milieu standard (5% SVF); cette dernière est ensuite placée dans 11 incubateur à atmosphère contrôlée.
E- Difficultés de la fusion cellulaire.
La fusion cellulaire est une technique délicate qui demande des attentions particulières. Les difficultés rencontrées lors de la production d'hybridomes peuvent être prévenues par une bonne planification. La vérification de la stérilité des milieux ainsi qu'une bonne méthode de dépistage sont essentielles avant d'effectuer toute fusion.
1) Les contaminations.
38
peut y avoir contamination de certains puits. Une méthode efficace, pour circonscrire la contamination, est de laver les puits contaminés avec une solution de NaOH 10N et de les assécher.
Un clone établi, qui est contaminé, peut être sauvé par le passage de ce dernier chez la souris (BALB/c). Cinq à sept jours après l'injection du clone, les cellules sont récupérées aseptiquement puis remises en culture.
2) Perte de production.
Les hybrides ont tendance à perdre leur chromosomes et ainsi cesser de sécréter. Il est important de suivre 11 évolution des clones, de la fusion à la congélation. Certaines précautions doivent être prises afin d1 éviter de perdre des clones :
- Vérifier périodiquement la croissance des clones, car un milieu appauvri en éléments nutritifs favorise la perte de chromosomes.
- Eviter les passages multiples en culture ou en ascite sans reclonages périodiques.
- Lors de la décongélation d'un clone, toujours recloner ce dernier.
3) Diminution de la croissance.
39
"11 environnement" et certains facteurs doivent être surveillés afin d'éviter la perte de clones:
Le PEG doit être l'objet d'une attention particulière car certains lots sont toxiques.
La qualité du SVF doit être de premier ordre.
4) Non-sélection du milieu HAT.
La non-sélection du milieu HAT provient soit de la mutation des cellules tumorales (peu fréquent), soit de la dégradation de l'aminoptérine. Ce dernier cas peut être évité par l'essai périodique, sur des cellules tumorales, du milieu HAT.
III - Production et caractérisation des anticorps monoclonaux.
A- Identification du type d'immunoglobulines sécrétées.
L'identification, du type d'immunoglobulines sécrétées, est effectuée par immunodiffusion double d'Ouchterlony (30) sur des surnageants de cultures à confluence.
Une solution de PBS-Agarose (0.8%) est chauffée jusqu'à dissolution complète de 1'agarose. Lorsque la température est redescendue à environ 55°C, la gélose est coulée sur des lames de microscopes (Fisher Scientific,
40
U.S.A.) fixées à un support (Gelman, U.S.A.). Lorsque la gélose est solidifiée, on la perfore avec une matrice à 7 puits de 3 mm (Gelman, U.S.A.).
Les surnageants sont déposés dans les puits périphériques en ayant soin d'ajouter un standard. L'antisérum spécifique (Miles Laboratories, U.S.A.) est déposé dans le puit central. L1 opération est répétée avec divers antisérums (IgG1, IgG2a, IgG2b, IgG3, IgM, IgA et IgE) (Figure 7). La plaque est incubée, dans une chambre humide pour la nuit à la température de la pièce. Le lendemain, la plaque est lue à l'aide d'une source lumineuse.
B- Production d'ascites.
La production d'anticorps monoclonaux peut s'effectuer de deux manières : la culture, en milieu synthétique, est une méthode qui permet de récolter entre 0.05 et 0.10 mg. d'anticorps par ml comparativement à la production sous forme d'ascites qui donne entre 1 et 10 mg. par ml. Cette dernière méthode est très avantageuse lorsque de grandes quantités d'anticorps sont requises.
La production de liquide ascitique est facilitée par le traitement des souris (BALB/c) avec une injection intrapéritonéale de 0.5 ml de pristane (Aldrich Chemicals, U.S.A.) (2, 6, 10, 14-Tétraméthylpentadécane) 8 à 10 jours avant l'injection des cellules. Après ce temps, 2 millions de cellules, contenues dans du milieu IMDM pur, sont
41
FIGURE 7î IMMUNODIFFUSION DOUBLE D'OUCHTERLONY,
ANTISERUM SPECIFIQUE
® STANDARD
42
injectées intrapéritonêalement à chaque souris„ Après 12 a 14 jours, le liquide est récolté en perforant 11 abdomen avec une aiguille 18G (Becton Dickinson, Canada). Les souris peuvent ainsi être prélevées plusieurs fois et donnent généralement entre 5 à 10 ml de liquide par souris. Le liquide est aussitôt centrifugé et congelé à -80°C.
C- Purification des anticorps. 1) Protéine A-Sépharose.
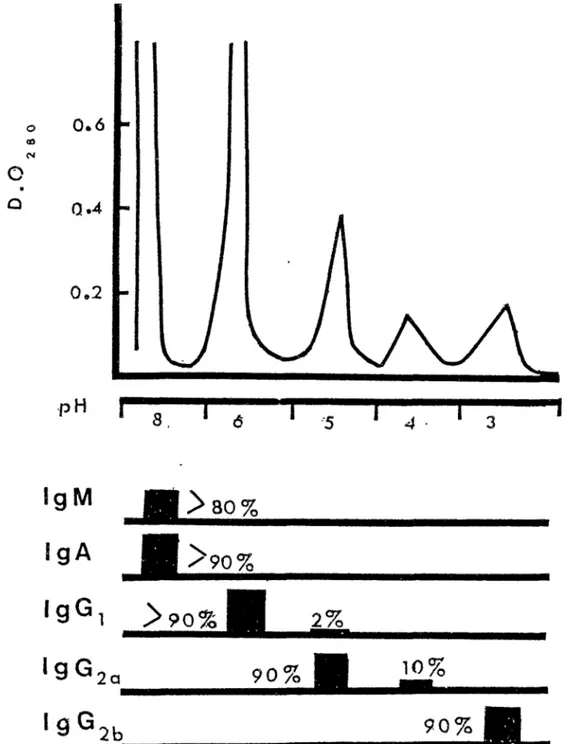
Les anticorps de type IgG peuvent être purifiés selon une technique simple et rapide: la chromatographie d1 affinité sur Protéine A-Sépharose (31). L'affinité de la protéine A pour la portion Fc des IgG dépend du sous-type de 11 immunoglobuline. Par des variations de pH, on peut purifier chaque sous-type d'IgG (Figure 8). A pH 8.0, les IgM et les IgA sont éluées alors que les IgG sont retenues. En abaissant le pH, les sous-types sont élués séparément et sont ainsi purifiés. Cette technique peut s'appliquer à des sérums, des surnageants de culture, aux liquides ascitiques ou à tout autre liquide biologique.
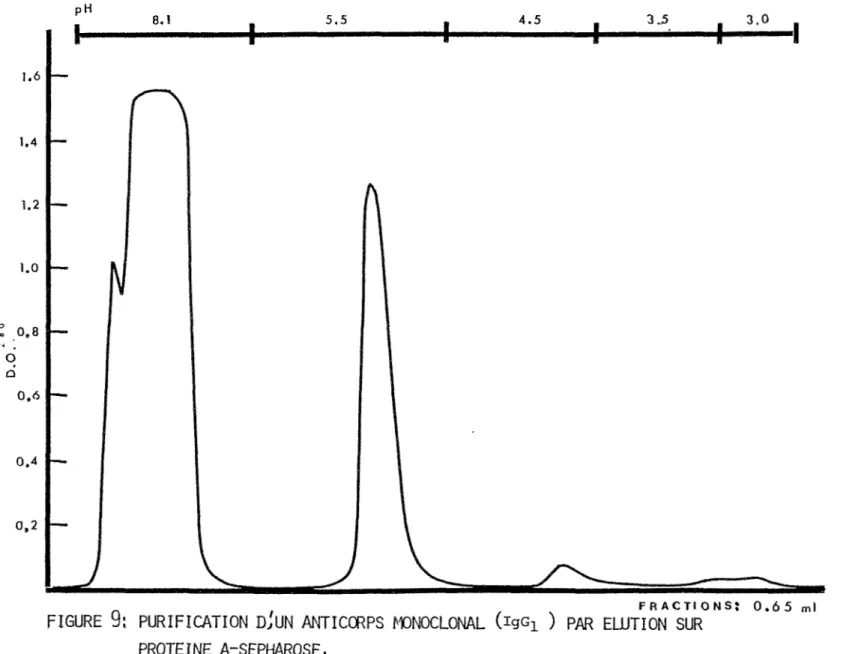
Un volume de 5 ml de protéine A- Sépharose (Pharmacia, Suède), contenu dans une colonne de 0.9 X 60 cm (Pharmacia, Suède), est équilibré avec du tampon phosphate 0.1 M (pH: 8.1). Le liquide ascitique (5 ml), dont le pH a été ajusté à 8.1 avec une solution de K2HP04 (1 M, pH: 8.8), est passé sur la colonne et collecté à raison de 3.6 ml par tube. Du tampon phosphate 0.1 M (pH: 8.1) est
43
FIGURE 8:ELUTION DES IMMUNOGLOBULINES, D'UNE SOURIS
IMMUNISEE, SUR PROTEINE A-SEPHAROSE
(31)-D . O .
pH
h
8.1t
5.5t
4.5I
1.6 FRACTIONS: 0.65 mlFIGURE
9:
PURIFICATION D,'UN ANTICORPS MONOCLONAL (igGi ) PAR ELUTION SUR
45
ajouté sur la colonne jusqu'à ce que la D.O. à 280 nm soit égale à 0 (Figure 9). On procède alors à 11élution avec un tampon citrate de plus bas pH. La même procédure est suivie avec les autres tampons citrate à divers pH (4.5, 3.5 et 3.0). Le pH des fractions désirées doit être ajusté à 7.5 en ajoutant du K2HP04 1M (pH: 8.8). Ces fractions sont réunies et dialysées, contre du tampon PBS-azide de sodium (0.1%), toute la nuit à 4°C. La D.O. est alors prise et 11 anticorps est congelé à -80°C.
Il est à noter que le dernier tampon citrate (pH: 3.0) nettoie la colonne et que cette dernière peut alors être remisée en présence de PBS-azide, à 4°C.
Malheureusement, la protéine A ne résout pas tous les problèmes car certains IgG ne se fixent pas à cette dernière. Dans ce cas. il est nécessaire de purifier 11 anticorps par une autre méthode.
2) Le Séphacryl-300.
Lorsque la purification sur protéine A ne peut s'appliquer, la filtration sur Séphacryl S-300 donne d'excellents résultats. A un volume de 5 ml de liquide ascitique, on ajoute, sous agitation, 5 ml d'une solution saturée de sulfate d'ammonium (final = 50%). On laisse reposer 30 minutes et on centrifuge à 6,000 X g pendant 10 minutes. Le surnageant est alors décanté et le précipité est
46
repris dans un volume minimal (2 ml) de tampon PBS-azide de sodium.
La solution est appliquée sur une colonne de 1.5 X 90 cm contenant 450 ml de Sephacryl S-300 équilibré dans du PBS-azide de sodium. Les fractions sont collectées à raison de 4 ml par tube et la D.O. à 280 nm est prise pour chacune d'elles. Les protéines éluées se présentent dans l'ordre suivant: IgM, IgA, IgG et albumine. Les fractions désirées sont réunies et concentrées à 1 mg./ml par précipitation au sulfate d'ammonium (50%). Le concentré est dialysé toute la nuit (4°C) contre du tampon PBS-azide puis congelé à -80°C.
D- Couplage des anticorps sur la matrice. 1) Choix de la matrice.
Il existe plusieurs types de matrices, de qualité variable, pouvant être utilisées dans une épreuve radio-immunologique. Il importe de choisir une matrice dont la capacité d'absorption des anticorps est la même d'un lot à un autre, qui maximise la probabilité de contact entre l'antigêne et la phase solide, et dont le coût est peu élevé. Les plaques Immulon I (Dynatech, U.S.A.) répondent à ces critères et sont, d'ailleurs, recommandées pour les protéines de poids moléculaires supérieurs à 30,000.
47
2) Couplage des anticorps.
Les anticorps, à une concentration de 0.001 à 0.01 mg. par ml, se couplent très facilement à une matrice de polystyrène lorsqu'ils sont dilues dans du tampon carbonate-bicarbonate à pH de 9.6 (32). L1 absorption des anticorps est maximale après 24 heures à 4°C (33). Cependant, l'étude de 1'absorption de divers anticorps en fonction du pH nous a démontré que certains anticorps sont absorbés à un plus haut niveau à des pH inférieurs à 9.5
(Tableau IV). Les anticorps monoclonaux, purifiés (1 mg./ml), sont dilués mille fois dans du tampon PBS (pH: 7.0), dans du tampon Tris (10mM, pH : 8.2) et dans du tampon carbonate-bicarbonate (0.1M, pH: 9.6). Chaque solution est distribuée à raison de 0.3 ml par puits, dans une plaque Immulon qui est ensuite placée à 4°C pour la nuit. Le lendemain, un RIA (phase solide) est effectué afin de trouver le pH idéal d'absorption.
Une fois le pH déterminé, d'autres plaques sont préparées puis saturées avec une solution de PBS- BSA 0.5%-azide de sodium (0.1%) (1 nuit à 4°C). Elles peuvent être conservées ainsi ou lyophillisées.
E- Marquage des anticorps à 1'Iode-125.
La chloramine T et la lactoperoxydase sont les agents les plus utilisés pour ioder des protéines.
48
TABLEAU IV; ABSORPTION DES ANTICORPS A DIVERS
p
H.
anticorps
X
pH
7,0
(
p/
n)
8,2
(
p/
n)
9,5
(
p/
n)
1
c9
296,3
534,7
551,1
3p3
534,7
473,2
509,6
]2o8
483,0
552,5
551,7
49
Cependant, 11Iodo-Gen (Pierce Chemical, U.S.A.) s'est révélé supérieur à ces derniers (34).
Puisque 11Iodo-Gen est insoluble dans les milieux aqueux, on se doit de le fixer à une matrice en verre. Il est donc dissous dans du chloroforme de manière à obtenir une concentration finale de 0.008 mg. par ml. La solution est distribuée dans des tubes de verre 12X75 mm, à raison de 0.05 ml par tube. A l'aide d'un jet d'azote, les tubes sont séchés et conservés dans un dessicateur à -20°C. L'Iodo-Gen étant d'une grande stabilité, les tubes peuvent être conservés pour une période d'environ 6 mois.
Le marquage des protéines, par 1'Iodo-Gen, est d'une très grande rapidité. Dans un tube (traité), on dépose 0.01 ml de PBS, 0.01 mg. de protéines contenues dans du PBS et 1 mCi d'iode-125 (Energie Atomique du Canada). La solution est légèrement agitée puis laissée au repos pour 12 minutes.
La réaction est arrêtée par 1'addition de 0.5 ml de PBS. Le mélange est déposée sur une colonne de Séphadex G-50 (Pharmacia, Suède) saturé avec une solution de PBS-BSA 0.5%, et collecté à raison de 1 ml par tube.
La protéine marquée (premier pic) est .conservée à 4°C dans un tube de polystyrène déposé dans une gaine de plomb. La colonne est lavée avec du PBS-azide puis remisée à 4°C.
50
F„ Détermination des composants de la trousse. 1) Procédures d'incubation.
Lors du dépistage de l'HBsAg, deux protocoles d'incubation sont utilisés et cela, en fonction des besoins du laboratoire.
Le premier protocole donne les résultats rapidement. Les sérums sont incubés, à raison de 0.2 ml/puits, à 45°C pendant deux heures. Les puits sont ensuite lavés cinq fois avec du PBS et l'anticorps révélateur est ajouté à raison de 160,000 CPM/0.2 ml/puits. Les plaques sont incubées pendant 1 heure à 45°C et sont ensuite lavées 10 fois avec du tampon PBS. Chaque puits est alors détaché de la plaque et déposé dans un tube de polystyrène 12 X 75 mm (Simport, Canada). Les tubes sont comptés dans le compteur gamma.
Le second protocole diffère du premier en un seul point: les sérums sont incubés une nuit à la température de la pièce. Les autres manipulations demeurent les mêmes que dans le premier protocole. Cette méthode est habituellement plus sensible que la première.
2) Détermination de l'anticorps de la matrice.
Afin de déterminer les anticorps à rendement supérieur sur la phase solide, chacun d'eux est
51
évalué selon sa capacité à fixer 11 antigène, comparativement à 11 anticorps polyclonal.
Tous les anticorps sélectionnés sont fixés sur la matrice puis "testés" en présence de sérums négatifs à l'HBsAg ainsi qu'en présence du témoin positif de la trousse ALJSRIA II (Abbott Laboratories, U.S.A.) et cela, selon la procédure d'incubation courte révélée avec l'anticorps polyclonal marqué. Les rapports positifs/ négatifs (P/N) sont calculés et comparés à celui du polyclonal.
3) Détermination de l'anticorps révélateur.
Pour la détermination de l'anticorps révélateur, des plaques Immulon I sont préparées avec de l'anticorps polyclonal. Elle sont incubées avec des témoins négatifs et positifs selon la procédure courte. Tous les anticorps sélectionnés sont marqués puis "testés" pour leur capacité à révéler comparativement au polyclonal. La encore, les rapports P/N sont calculés et comparés à celui du polyclonal.
4) Pairage des anticorps.
Selon le même protocole d'incubation, chaque anticorps, sélectionné comme composant matriciel, est révélé avec chacun des anticorps sélectionnés comme
52
révélateur. Le pairage donnant le rapport P/N le plus élevé sera celui utilisé dans la trousse.
5) Détermination de la sensibilité.
La sensibilité de la trousse est déterminée face aux deux sous-types ("ad" et "ay"), dilués dans une solution de saline-sérum de boeuf (50%) à des concentrations variant entre 10 et 0.04 ng./ml, incubés selon les deux protocoles déjà décrits.
6) Détermination de la stabilité.
La stabilité des composants est évaluée sur une période d'un mois. L'anticorps, couplé à la matrice, est conservé sous forme lyophillisée à 4°C. L1 anticorps marqué est conservé dans les mêmes conditions mais sous forme liquide.
54
I - Purification de 1'HBsAg.
Des résultats similaires ont été obtenus lors de la purification des deux sous-types "ad" et "ay". Un volume de 350 ml de plasmas ("ad" et "ay") de titre 1/64 (C.E.P.) a été passé sur la colonne de chromatographie d'affinité. Nous avons récupéré 17 ml (titre de 1024) que nous avons, par la suite, tamisés sur Sépharose S-6B (Figure 10). Les tubes, dont la D.O. est supérieure à 0.6, ont été réunis puis concentrés sur une membrane Amicon (XM 50). Nous avons ainsi obtenu 20 ml d1HBsAg purifié de titre 1024 et de densité optique de 7.0 (40 mg.). Le spectre d1élution sur Sépharose S-6B (Figure 10) nous montre que 1'HBsAg, obtenu après la chromatographie d1 affinité, ne contient pas ou peu de contaminants.
II - Résultats des fusions cellulaires.
Huit fusions cellulaires ont été effectuées (Tableau V) dont six utilisant des souris immunisées avec de 1'HBsAg de sous-type "ad" (A, B, C, D, E, F, H) et deux utilisant des souris immunisées avec le sous-type "ay" (D et G). Quatre fusions (A, C, D, E) ont été effectuées en accord avec le protocole d1 immunisation déjà décrit. Les anticorps obtenus lors de ces fusions étaient des IgG1 (80%) ou des IgG2 (20%). Deux fusions (B, F) ont été effectuées après de
' £ 8 0 n m Volume mort : 270 ml .
y
i—i—r
i—i—r
Tubes (8 ml )figure
10;
Tamisage de l'HBsAg sur sepharose s-Gb.
Ln Ln
56
TABLEAU V:
RESULTATS DES FUSIONS CELLULAIRES
FUSION
CLONES TESTES
CLONES (+)
CLONES SELECTIONNES
A
596
118 (19,8%)
45
B
476
57 (12,0%)
6
C
510
103 (20,2%)
30
D
578
104 (18,0%)
42
E
498
95 (19,0%)
.36
F
533
63 (11,8%)
9
G
396
73 (18,4%)
29
H
522
98 (18,8%)
35
57
courtes immunisations (jours 1 et 2: injection i.v., jour 5: fusion) où 100% des anticorps sécrétés étaient de classe IgM. Pour les deux dernières fusions (G et H), nous avons utilisé le protocole suivant: - Jour 0: - Jour 24: - Jour 150 - Jour 1 51 - Jour 154 0.1 mg. + ACF : i.p, 0.1 mg. + AIF : i.p. 0.05 mg. : i.v. 0.05 mg. : i.v. FUSION.
Par ce protocole, nous espérions obtenir des clones sécrétant des anticorps de plus forte affinité que ceux obtenus auparavant. Dans ce dernier cas, 84% des anticorps sécrétés étaient des IgG1 et 26% des IgG2.
En moyenne, 17.2% des clones dépistés se sont révélés positifs. La sélection, basée sur la capacité de précipitation des surnageants, a mis en évidence 13 clones réagissant avec le déterminant commun "A" et ayant un pouvoir de précipitation élevé (Tableau VI). Les autres clones se sont révélés comme ayant un pouvoir précipitant inférieur à
100,000, ou comme étant spécifiques à l'un des sous-types (2.8%). Ces derniers ont été conservés comme outil possible dans le sous-typage des sérums positifs à l'HBsAg.
Les 13 hybrides, ainsi sélectionnés, ont été clonés, typés, puis injectés à des souris pour la production de liquide ascitique. Les anticorps ont été purifiés, du liquide ascitique, soit par élution de la protéine A- Sépharose, soit par tamisage sur S-300 selon le type d1 immunoglobuline sécrétée (Tableau VI). La quantité
58
d1 anticorps purifies, pour les différents clones, variait entre 4 et 9 mg. par ml de liquide d1 ascite.
Un seul clone a cessé de sécréter après la décongélation, le B-7B5. Meme en le redonant plusieurs fois, il nous a été impossible de le sauver. Nous avons, quand même, effectué quelques essais avec 11 anticorps obtenu du liquide d'ascite.
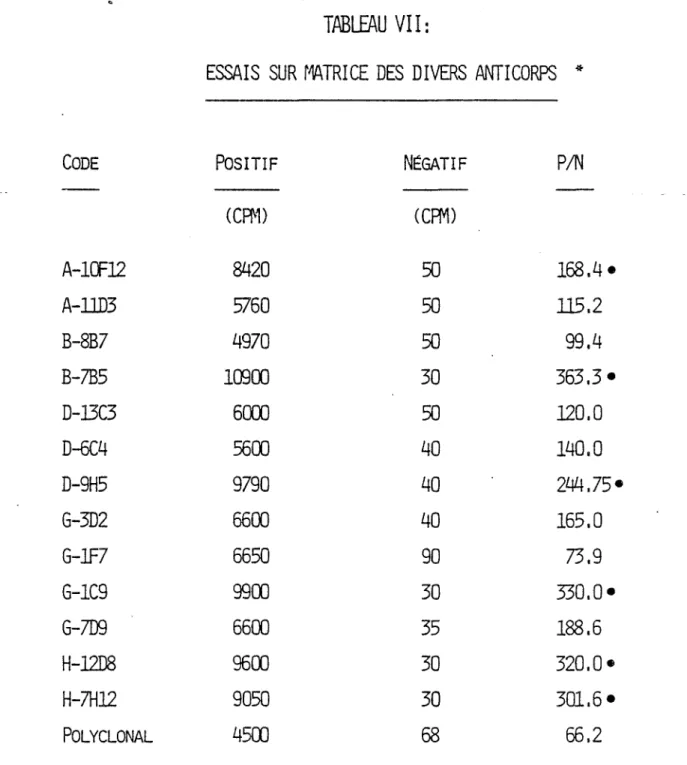
III- Essais des divers anticorps. A- Essais sur matrice.
Les essais de couplage à la phase solide des anticorps monoclonaux comparativement à 11 anticorps polyclonal, démontrent que six clones sécrètent des anticorps dont 11 affinité est supérieure, une fois couplés à la matrice, au polyclonal (Tableau VII). L1 utilisation de ces six monoclonaux augmente le rapport positif/négatif (P/N) de 2 à 4 fois comparativement à celui de 11 anticorps polyclonal. Les six clones sélectionnés, comme éléments possibles sur la matrice, sont A-10F12, B-7B5, D-9H5, G-1C9, H-12D8 et H-7H12.
B- Essais de marquage.
Les essais de marquage des anticorps à 11iode-125 démontrent que cinq d'entre eux peuvent être marqués de manière à augmenter la ratio P/N comparativement au polyclonal (Tableau VIII). Les cinq clones sélectionnés