HOMEOSTASIE DES COFACTEURS METALLIQUES DE LA NITROGENASE (MOLYBDÈNE ET VANADIUM) CHEZ AZOTOBACTER VINELANDII EN
PRÉSENCE DE MATIÈRES ORGANIQUE ET MINÉRALE
par
Christelle Jouogo Noumsi
thèse présentée au Département de biologie en vue de l'obtention du grade de docteur ès sciences (Ph.D.)
FACULTÉ DES SCIENCES UNIVERSITÉ DE SHERBROOKE
Le 09 Décembre 2016
le jury a accepté la thèse de madame Christelle Jouogo Noumsi dans sa version finale
Membres du jury
Professeur Jean-Philippe Bellenger Directeur de recherche
Département de chimie, Université de Sherbrooke
Professeur Vincent Burrus Co-directeur de recherche
Département de biologie, Université de Sherbrooke
Professeur Marc Amyot Évaluateur externe
Département de sciences biologiques, Université de Montréal
Professeur Pascale Beauregard Évaluateur interne
Département de biologie, Université de Sherbrooke
Professeur Sébastien Rodrigue Président-rapporteur
SOMMAIRE
La fixation biologique du diazote (N2) constitue une étape importante du cycle biogéochimique de l’azote (N). Cette réaction permet la réduction du N2 atmosphérique, non biodisponible, en ammonium (NH3) bioassimilable par tous les organismes vivants. Cette réaction est limitée par différents facteurs, menant à une limitation de la production primaire dans de nombreux écosystèmes, particulièrement nordiques. En effet, la fixation biologique d’azote dans tous les écosystèmes dépend d’un nombre réduit de procaryotes appelés diazotrophes qui sont capables de rompre la triple liaison N-N pour former l’ammoniac. Cette réaction qui est catalysée pas une métalloenzyme, la nitrogénase, requiert beaucoup d’énergie sous forme d’ATP, compte tenue de l’énergie de liaison liant les atomes d’azote. La nitrogénase existe sous trois isoformes, que l’on différencie principalement par la nature du métal cofacteur du site actif : les nitrogénases au molybdène (Mo), au vanadium (V) et au fer (Fe). La répartition des isoformes de la nitrogénase n’est pas homogène chez les diazotrophes. Alors que tous possèdent la nitrogénase au Mo, seulement quelques-uns ont en supplément la nitrogénase au V et/ou celle au Fe. De plus, les isoformes de la nitrogénase ne sont pas équivalentes en termes d’efficacité de réduction de N2. La Mo-nitrogénase est la plus efficace à température ambiante car elle utilise le moins d’ATP pour réduire une mole de diazote. Elle est suivie de l’isoforme au V, et enfin celle au Fe. Chez les diazotrophes possédant plus d’une nitrogénase (ex. Azotobacter vinelandii), l’utilisation de celles-ci suit une hiérarchie reflétant ces efficacités relatives; la Mo-nitrogénase est exprimée par défaut, la V-nitrogénase est exprimée en absence de Mo et celle au Fer en absence de Mo et de V. Du fait de leur moindre efficacité, de leur présence chez seulement certains diazotrophes, en supplément de la Mo-nitrogénase, et de leur régulation sous contrôle du Mo, la fixation d’azote est considérée comme dépendant principalement du Mo. Pourtant depuis quelques années, plusieurs évidences remettent en cause cette prédominance de la Mo-nitrogénase: (i) la conservation des nitrogénases alternatives au fil de l’évolution suggère qu’elles ont un rôle important; (ii) la limitation de la fixation par le Mo de nombreux écosystèmes; (iii) l’omniprésence des gènes des nitrogénases alternatives dans de
nombreux écosystèmes, limités en Mo ou non. Malgré leur importance potentielle, notre compréhension de la contribution des nitrogénases alternatives à la fixation biologique de diazote en milieu naturel reste très limitée.
Plusieurs facteurs peuvent influencer l’utilisation des nitrogénases, tels que la température et l’accès aux métaux essentiels. L’acquisition des métaux cofacteurs constitue un paramètre d’intérêt majeur, car l’activation des gènes des nitrogénases est fortement dépendante de la disponibilité en métaux cofacteurs. Dans les sols le molybdène et le vanadium, présents essentiellement sous forme de molybdate (MoO42-) et vanadate (VO43-), sont fortement complexés à la matrice (matière organique et oxydes) ce qui peut limiter leur disponibilité pour les fixateurs d’azote. Chez certains diazotrophes (ex. Azotobacter vinelandii) il a été démontré que l’acquisition des métaux cofacteurs (Fe, Mo et V) est assurée par des métallophores, petits ligands organiques produits par les êtres vivants pour chélater les métaux. Leur grande affinité pour les métaux permet aux diazotrophes de pouvoir acquérir sélectivement les métaux pour la fixation biologique d’azote. En milieu naturel les interactions entre complexes naturels (matière organique, oxydes) et métallophores jouent sans doute un rôle important dans la biodisponibilité des métaux cofacteurs de la nitrogénase et donc leur utilisation. Cependant, les études sur l’acquisition des métaux et leur utilisation pour la fixation d’azote restent souvent limitées à des conditions de laboratoire peu représentatives de la réalité (métaux cofacteurs non complexés).
L’hypothèse de ce projet doctoral était que la présence d’agents naturels complexant les métaux cofacteurs de la nitrogénase (Mo et V) pouvait influencer significativement la stratégie d’acquisition et d’utilisation de ceux-ci, menant à une contribution accrue des nitrogénases alternatives. Cette hypothèse a été testée en conditions de laboratoire en utilisant Azotobacter vinelandii comme bactérie modèle ainsi que l’acide tannique et des oxydes de fer comme agents complexants naturels modèles.
Ces travaux ont montré que la présence d’agents complexants (acide tannique et oxydes de fer) entraîne des changements majeurs dans la gestion des métaux cofacteurs (Mo et
V) chez A. vinelandii. Les stratégies d’acquisition des métaux cofacteurs sont fortement modifiées en présence de complexants naturels avec (i) un changement important de la quantité des metallophores produits ainsi que (ii) une acquisition simultanée de Mo et V dans des conditions traditionnellement considérée comme non limitantes en Mo. Ceci se traduit par un changement important dans l’utilisation des nitrogénases; les niveaux de transcrits élevés des gènes nifD et vnfD, spécifiques des nitrogénases au Mo et au V respectivement, suggèrent une utilisation simultanée de ces isoenzymes pour assurer la fixation d’azote. Ce projet a permis de mettre en évidence que face à un stress métallique, l’utilisation des isoformes de la nitrogénase par A. vinelandii est un processus plus versatile que précédemment décrit et que le coût d’acquisition des métaux dans ces conditions serait un facteur important de la régulation de l’activité des nitrogénases. Ces travaux démontrent que la hiérarchie des nitrogénases établie sur la base d’expériences de laboratoire ne s’applique sans doute pas aux milieux naturels. Ceci suggère que les nitrogénases alternatives pourraient contribuer à la fixation d’azote de manière plus importante que présentement admis.
Mots clés : fixation biologique d’azote, nitrogénase, métaux essentiels, métallophores, homéostasie, dynamique d’acquisition et d’utilisation, Azotobacter vinelandii
REMERCIEMENTS
J’aimerais tout d’abord remercier grandement Jean-Philippe et Vincent pour avoir permis que tout ce travail soit possible. Grâce à eux j’ai beaucoup appris durant ces quatre années, et j’ai aussi appris à apprendre. Ce fût un véritable challenge et j’ai eu un accompagnement des plus formidables. Rigueur, persévérance, autonomie, éthique, sont les maîtres mots qui décrivent le mieux l’encadrement qu’ils m’ont apporté. Je ne pouvais espérer mieux.
Je remercie toutes les sources de financement ayant permis ce doctorat (les chaires de recherche du Canada détenues par JPB et VB et le soutien facultaire au recrutement aux études supérieures).
Les membres de mon comité de conseillers Ryszard, Pascale et Sébastien, je vous remercie pour l’encadrement administratif et pour les conseils que vous m’avez donné durant mon doctorat.
Mes partenaires de laboratoire, présents et passés. J’ai eu la chance de faire partie de deux équipes aussi différentes que formidables. Ce fût tellement agréable de travailler avec vous, j’ai beaucoup appris grâce à votre aide. J’ai en plus eu la chance de trouver en vous de fantastiques amis avec qui la vie continuait hors laboratoire. Nicolas, Dominic, Geneviève, Éric, (Mireille), Nina, Romain Da., Marion, Lorène, Jefferson, Augustin, Romain Du., Fanny, je n’ai pas assez de place ici pour vous exprimer toute ma gratitude, mais vous le savez, je n’en pense pas moins.
À mes amis (formidablement géniaux), Suzy, Nil, Sarah (choupinette), Liliane, Thomas, Hugo, Svilena, Hervé, Loïc, pour ne citer qu’eux, un énorme merci pour le soutien quotidien.
Ma famille, loin des yeux, près du cœur. Vous m’accompagnez depuis le début, merci pour le soutien, merci pour l’amour dont vous m’abreuvez. À ma maman. À ma sœur Mireille. À mon frère Guy Alain...
TABLE DES MATIÈRES
SOMMAIRE ... iv
REMERCIEMENTS ... vii
LISTE DES ABRÉVIATIONS ... xi
LISTE DES TABLEAUX ...xiii
LISTE DES FIGURES ... xiv
CHAPITRE 1 ... 16
INTRODUCTION GÉNÉRALE ... 16
1.1. Cycles biogéochimiques des éléments ... 16
1.2. Cycle de l’azote ... 17
1.3. La fixation biologique d’azote ... 19
1.4. Les acteurs de la fixation ... 20
1.5. La nitrogénase : structure et fonctionnement ... 21
1.5.1. La nitrogénase au molybdène ... 22
1.5.2. Les nitrogénases alternatives ... 23
1.6. Les gènes impliqués dans la fixation biologique d’azote... 25
1.6.1. Gènes structurels ... 26
1.6.2. Les autres gènes des clusters nif, vnf et anf ... 26
1.7. Importance des micronutriments pour la fixation biologique d’azote ... 27
1.7.1. Les métaux essentiels des isoformes des nitrogénases ... 28
1.7.2. Spéciation et stratégies d’acquisition des métaux cofacteurs de la nitrogénase ... 29
1.8. Organisme d’étude : Azotobacter vinelandii ... 31
1.9. Hypothèse générale et objectifs ... 34
CHAPITRE 2 ... 36
RÉSULTATS... 36
2.1. Effet de la matière organique sur l’homéostasie des métaux cofacteurs de la nitrogénase pour la fixation d’azote chez A. vinelandii ... 36
2.1.1. Présentation de l’article ... 36
2.1.2 Contribution à l’article ... 37
2.1.3. Page titre... 39
2.1.5. Introduction ... 40
2.1.6. Result and Discussion ... 42
2.1.7. Conclusion ... 51
2.1.8. Experimental procedures ... 52
2.1.8.1. Bacterial strain, Culture medium and growth conditions ... 52
2.1.8.2. Growth curves and growth rates ... 52
2.1.8.3. Metallophores quantification ... 53
2.1.8.4. RNA isolation, cDNA synthesis and quantitative PCR assays ... 53
2.1.8.5. Statistics and curve fitting ... 54
2.1.9. Acknowledgments ... 54
2.1.10. References ... 55
2.1.11. Supporting information ... 71
2.2. Les oxydes de fer modulent l’acquisition et l’utilisation des métaux essentiels pour la croissance diazotrophe d’Azotobacter vinelandii... 84
2.2.1. Présentation de l’article ... 84
2.2.2 Contribution à l’article ... 86
2.2.3. Page titre... 87
2.2.4. Summary ... 88
2.2.5. Introduction ... 88
2.2.6. Result and Discussion ... 91
2.2.7. Conclusion ... 101
2.2.8. Experimental procedure ... 102
2.2.8.1. Bacterial strain, Culture medium and growth conditions ... 102
2.2.8.2. Growth curves and growth rates ... 102
2.2.8.3. Cellular metal quotas ... 103
2.2.8.4. Quantification of metallophores ... 103
2.2.8.5. RNA isolation and cDNA synthesis ... 104
2.2.8.6. Quantitative PCR assays ... 104
2.2.8.7. Statistics and curve fitting ... 105
2.2.9. Acknowledgments ... 105
2.2.10. References ... 106
CHAPITRE 3 ... 127
DISCUSSION GÉNÉRALE ET CONCLUSION ... 127
3.1. Perspectives d’amélioration du projet de recherche : présence et activité des nitrogénases ... 128
3.2. La nitrogénase au vanadium : véritable avantage? ... 129
3.3. La hiérarchie des nitrogénases : un concept révolu? ... 129
3.4. Les métallophores : clef de voute de la régulation de l’utilisation des nitrogénases en milieu naturel?... 131
3.4.1. Les métallophores, système d’acquisition versatile de contrôle du stress métallique 131 3.4.2. Le coût d’acquisition des métaux ... 133
3.5. La régulation des nitrogénases : un consortium multifactoriel ... 135
3.6. Répartition des isoformes des nitrogénases chez les diazotrophes ... 136
ANNEXE ... 138
LISTE DES ABRÉVIATIONS
ADN : acide désoxyribonucléique ADP : adénosine diphosphate ARN : acide ribonucléique ATP: adénosine triphosphate C: carbone
cDNA : complementary DNA Da: daltons
DNase: deoxyribonuclease FBA: fixation biologique d’azote Fe: fer/iron
HLB:hydrophilic lipophilic balanced
ICP-MS : inductively coupled plasma mass spectrometry ISARA: isotopic acetylene reduction assay
LC: liquid chromatography MeOH: methanol
Mg : magnésium
Mo: molybdène/molybdenum mRNA : messenger RNA MS: mass spectrometry N: azote
N2 : diazote/dinitrogen
Nase: nitrogénase/nitrogenase NH3 : ammoniac
OD: optical density
qRT-PCR: quantitative reverse transcriptase polymerase chain reaction UHPLC: ultra-high performance liquid chromatography
LISTE DES TABLEAUX
Chapitre 1
Tableau 1. Concentrations clés en métaux essentiels molybdène, vanadium et fer lors de la
croissance diazotrophe d’Azotobacter vinelandii. ... 31
Chapitre 2 1er article
Table S1: Statistics analysesa of cellular metal quotas ratio Mo:V = 1:1 ... 78
Table S2: Statistics analysesa of cellular metal quotas ratio Mo:V = 1:4 ... 78
Table S3: primers used in quantitative PCR (5’-3’) ... 81
2ème article
Table 1 Molybdenum and vanadium remaining in solution after addition of 55 µM and 505 µM
FeCl3. ... 92
LISTE DES FIGURES
Chapitre 1
Figure 1. Représentation schématique des cycles biogéochimiques des éléments. ... 17
Figure 2. Cycle de l’azote. ... 18
Figure 3. Évolution des apports anthropiques en azote dans les écosystèmes terrestres. ... 20
Figure 4. Structure cristallographique de la nitrogénase au molybdène ... 23
Figure 5. Organisation des clusters nif, vnf et anf de la fixation biologique d’azote chez A. vinelandii ... 25
Figure 6. Groupements fonctionnels des métallophores ... 30
Figure 7. Structure chimique des métallophores produits par A. vinelandii ... 32
Chapitre 2 1er article Figure 1: Growth curves of Azotobacter vinelandii. ... 43
Figure 2: Metallophores production by Azotobacter vinelandii along the growth. ... 44
Figure 3: Evolution of cellular metal to phosphorus quotas in A. vinelandii... 46
Figure 4: Relative expression of nifD, vnfD and anfD during the exponential growth phase. ... 48
Figure 5: Summary of the effects of the presence of tannic acids on nitrogenase metal cofactors management by A. vinelandii. ... 50
Figure S1: Growth curves of Azotobacter vinelandii. ... 73
Figure S2: Metallophores production by Azotobacter vinelandii along the growth... 74
Figure S3: Evolution of cellular metal to phosphorus quotas in Azotobacter vinelandii. ... 75
Figure S4: Relative expression of nifD, vnfD and anfD during the exponential growth phase. ... 76
Figure S5: A. Tannic acid-molybdenum complexation spectra, B. Tannic acid-vanadium complexation spectra. ... 77
Figure S6: Vanadium uptake rates between sampling times. ... 79
Figure S7: ARA (left axis) and instantaneous growth rates (right axis) along the exponential phase ... 80
2ème article Figure 1. Growth curves of A. vinelandii... 93
Figure 2. Evolution of cellular metal to phosphorus quotas in A. vinelandii. ... 95
Figure 3. Metallophore production by A. vinelandii during growth. ... 97
Figure 4. Relative expression of nifD and vnfD in control conditions during the exponential growth phase. ... 99
Figure 5. Relative expression of nifD and vnfD during the exponential growth phase. ... 100
Figure S1. Growth curves of A. vinelandii at two pH values. ... 123
Figure S2. Vanadium uptake rates between sampling times... 124
CHAPITRE 1
INTRODUCTION GÉNÉRALE
1.1. Cycles biogéochimiques des éléments
A l’échelle de la planète Terre, le cycle biogéochimique d’un élément représente les différentes voies et différents moyens menant à la transformation et aux transferts de cet élément au travers des principaux réservoirs; atmosphère, hydrosphère, lithosphère et biosphère. Ces procédés sont des réactions d’ordre physique (ex. transport, convection), chimique (ex. hydrolyse, oxydo-réduction) et biologique (ex. photosynthèse, respiration). Le fonctionnement et le devenir des écosystèmes est directement dépendant des interactions complexes au sein et entre les cycles biogéochimiques des éléments. Il est donc particulièrement pertinent, notamment dans les circonstances actuelles de changements climatiques, d’approfondir nos connaissances sur ces cycles, afin de mieux prédire le devenir de notre environnement. Un intérêt particulier est porté à l’étude des cycles des éléments indispensables à la vie, car la biosphère constitue un point commun à tous les grands réservoirs. La biosphère est souvent représentée au centre des réservoirs pour illustrer son implication dans tous les cycles biogéochimiques (figure 1). Les cycles des éléments majeurs carbone, hydrogène, azote, oxygène, phosphore et souffre (CHNOPS) ont donc fait l’objet d’intenses travaux au fil des années (Mackenzie et al., 2013). Les flux de ces éléments (sous diverses formes) à travers les réservoirs sont assez bien connus à ce jour, et les procédés permettant ces flux peu à peu élucidés.
Figure 1. Représentation schématique des cycles biogéochimiques des éléments.
Les flèches indiquent les flux des éléments au travers des grands réservoirs.
La complexité du cycle d’un élément peut provenir de diverses sources : (i) les formes et les propriétés que peuvent adopter cet élément vont influencer sa présence et son abondance dans les grands réservoirs, (ii) l’impact de facteurs biotiques et abiotiques sur sa transformation et sa circulation à travers ces réservoirs et, (iii) l’interaction avec d’autres cycles biogéochimiques.
1.2. Cycle de l’azote
L’azote est un élément indispensable à la vie, qui entre dans la composition des acides aminés, des bases azotées des acides nucléiques. De nombreux travaux ont montré que le taux de productivité primaire nette dans divers écosystèmes terrestres et aquatiques est
limité par l’azote (Vitousek and Howarth, 1991; Hooper and Johnson, 1999; LeBauer and Treseder, 2008). Le taux de productivité primaire étant la quantité de matière organique produite par unité de temps à partir de matière minérale et d’énergie. L’azote semble donc conditionner l’expansion de la vie dans de nombreux écosystèmes. Le cycle de l’azote est subdivisé en cinq étapes principales que sont la fixation d’azote, l’assimilation, la minéralisation (ou ammonification), la nitrification et la dénitrification ; et tous les niveaux trophiques y participent (figure 2).
Figure 2. Cycle de l’azote. Transformations et flux des composés azotés par les voies
1.3. La fixation biologique d’azote
L’atmosphère est le principal réservoir naturel de l’azote, dont il représente environ 78% de la composition. Le diazote de l’air étant une forme peu utilisable par la biosphère, la fixation d’azote (N2 NH3) est considérée comme une étape clé du cycle de cet élément. Cette étape constitue d’ailleurs la principale source d’azote biodisponible dans les écosystèmes ne subissant pas ou peu d’influence anthropique. La fixation biologique d’azote (FBA) est évaluée à 175×106 tonnes d’azote fixé par an (Cech, 2010; Burns and Hardy, 2012). La réaction de réduction de N2, catalysée par l’enzyme nitrogénase, est particulièrement couteuse en énergie (équation 1.1) (Rees et al., 2005). En effet, l’énergie (ΔG) de la triple liaison N-N est d’environ 226 kcal/mole, comparé par exemple à une liaison N-H de 96 kcal/mole (Schlesinger and Bernhardt, 2013).
N2 + (6+2n)H+ + (6+2n)e- + p(6+2n)ATP → 2NH3+ nH2 + p(6+2n)ADP + p(6+2n)Pi (equation 1.1)
Si la FBA subit des contraintes affectant la production de NH3, toute la biosphère qui en dépend peut être limitée en azote. La limitation en azote attribuable à un déficit de la FBA est d’ailleurs une problématique retrouvée dans de nombreux écosystèmes naturels (Vitousek and Howarth, 1991).
Avec la révolution industrielle et l’accroissement des besoins agricoles, l’apport en composés azotés par l’Homme sur la planète n’a cessé de croitre depuis un siècle pour atteindre 192 × 106 tonnes d’azote fixé par an en 2008 (Gu et al., 2013) (Figure 3). Ceci fait de l’Homme la première source d’azote réduit de la planète. Les sources d’azote réduit d’origine anthropiques sont multiples (Figure 3).
Figure 3. Évolution des apports anthropiques en azote dans les écosystèmes terrestres. Sources et teneurs d’azote fixé par l’activité humaine : agriculture, carburants fossiles, production industrielle, fertilisants. En comparaison à la fixation naturelle (zone entre les traits interrompus). Tiré de Gu et al 2013.
Malgré cet apport anthropique considérable d’azote fixé, la FBA demeure la principale voie d’entrée de cet élément dans les écosystèmes terrestres et aquatiques ne subissant pas ou peu de perturbations anthropiques (ex. écosystèmes boréaux et subarctiques). Élucider les mécanismes contrôlant la FBA reste donc d’un intérêt majeur pour mieux comprendre le fonctionnement et l’évolution de nos écosystèmes.
1.4. Les acteurs de la fixation
Les fixateurs d’azote ou diazotrophes sont exclusivement des procaryotes, que l’on retrouve dispersés au sein des bactéries, cyanobactéries et archées. Cette capacité à réduire le N2 n’est pas spécifique à des branches particulières du vivant, il arrive donc
qu’au sein d’un même genre, seulement quelques espèces soient en mesure d’effectuer la réaction. Les bactéries et les cyanobactéries peuvent former des associations avec des eucaryotes, au sein desquelles l’un de leur rôle est de fournir de l’azote biodisponible pour tous les partenaires impliqués. Dans ces cas, la fixation d’azote se fait dans des structures spécialisées que sont les nodules racinaires (symbiose bactéries / plantes supérieures) ou les saccules (symbiose lichénique). Ces structures permettent de maintenir des conditions microaérophiles requises pour la réaction de FBA. Les diazotrophes libres quant à eux, autotrophes ou hétérotrophes, peuvent être anaérobies, microaérophiles ou aérobies. Les diazotrophes couvrent donc une très grande diversité de métabolismes de vie et d’environnements.
1.5. La nitrogénase : structure et fonctionnement
L’enzyme catalysant la FBA est la nitrogénase (Nase). Il s’agit d’une métalloprotéine, dont la nature du métal co-facteur situé au niveau du site actif diffère selon l’isoforme de l’enzyme. Trois isoformes sont connus à ce jour, la Mo, la V- et la Fe-Nases (Bishop et al., 1980, 1982; Hales et al., 1986; Robson et al., 1986; Chisnell et al., 1988; Joerger, Jacobson, Premakumar, et al., 1989). L’isoforme au Mo est la plus étudiée et sera présentée en détail. Seules les spécificités des deux autres formes seront détaillées ensuite. Etant donné qu’il existe des petites différences de structure entre les mêmes isoformes de différents diazotrophes, seulement les caractéristiques des Nases de l’organisme étudié au cours de ce doctorat (Azotobacter vinelandii) seront présentées ici.
1.5.1. La nitrogénase au molybdène
La Nase au Mo est en quelque sorte l’isoforme universelle car elle est présente chez tous les diazotrophes connus à ce jour. En théorie, elle est aussi la plus efficace, car c’est celle qui nécessite le moins d’énergie pour réduire 1 mole de N2 (équation 1.2).
N2 + 8H+ + 8e- + 16ATP → 2NH3 + H2 + 16ADP + 16Pi (équation 1.2)
Elle se présente sous forme d’un assemblage de trois sous-unités réparties en deux principaux ensembles, la dinitrogénase réductase et la dinitrogénase, fonctionnant en tandem.
La dinitrogénase réductase ou Fe-protéine, est un homodimère d’environ 64 kDaltons de la sous-unité γ (figure 4). Elle sert d’accepteur d’électrons, de la ferrédoxine ou de la flavodoxine, qu’elle transfère à la deuxième composante de la Nase. Un cluster fer-soufre [4Fe-4S] relie les sous-unités γ entre elles. C’est ce cluster qui assure le transfert d’électrons. Chaque sous-unité γ lie une molécule de Mg-ATP, qui fournit l’énergie nécessaire au transfert d’électrons (Howard and Rees, 2006; Seefeldt et al., 2009).
La dinitrogénase ou MoFe-protéine est un tétramère des sous-unités α et β avec la stœchiométrie α2β2, d’environ 230 kDaltons (figure 4). Elle contient deux types de métallo-clusters : un P-cluster et un FeMo-cofacteur (Kirn and Rees, 1992). Le P-cluster, situé à l’interface de chaque paire de sous-unités α et β, comporte deux clusters fer-soufre ([4Fe-4S] et [4Fe-3S]). Le P-cluster reçoit les électrons provenant de la Fe-protéine et les transfère au cluster FeMo-cofacteur (Peters et al., 1995). Ce deuxième métallo-cluster est formé de 7Fe-9S-Mo-homocitrate et d’un atome central X (C, N ou O) (Seefeldt et al., 2009; Lancaster et al., 2011; Einsle, 2014). Le FeMo-cofacteur est situé au sein de chaque sous-unité α et constitue le site catalytique de l’enzyme. Lors de l’assemblage de tous les composants de la Nase, l’incorporation du FeMo-cofacteur constitue l’étape finale, la
maturation de l’enzyme qui l’amène à sa forme active. À ce site peuvent se fixer différents substrats tels que le diazote (N2), des protons (H+), ou encore de l’acétylène (C2H2) pour la réaction de réduction.
Figure 4. Structure cristallographique de la nitrogénase au molybdène. (Gauche)
Les unités γ de la dinitrogénase réductase (Fe-protéine) sont représentées en gris. Les sous-unités α et β de la dinitrogénase (MoFe-protéine) sont représentées en violet et rouge respectivement. (Droite) Positions du MgADP et des métalloclusters impliqués dans le transfert d’électrons pour la réduction de N2. Tiré de Hu and Ribbe, 2011.
1.5.2. Les nitrogénases alternatives
Les isoformes de la Nase au V et au Fe sont parfois retrouvées en plus de la Mo-Nase, et ce, chez certains diazotrophes seulement. C’est l’une des raisons qui leur a valu le qualificatif d’alternatives. En plus d’être des formes supplémentaires, elles sont
théoriquement moins efficaces dans l’activité de réduction de N2, parce qu’elles nécessitent plus d’énergie pour réduire 1 mole de N2 (équations 1.3 et 1.4) (Masepohl et al., 2002; Bothe et al., 2010).
V-Nase: N2 + 12H+ + 12e- + 24ATP → 2NH3 + 3H2 + 24ADP + 24Pi (équation 1.3) Fe-Nase: N2 + 21H+ + 21e− + 42ATP → 2NH3 + 7.5H2 + 42ADP + 42Pi (équation 1.4) En termes de structure, les Nases alternatives sont très semblables entre elles, et diffèrent légèrement de l’isoforme au Mo. La Fe-protéine possède les mêmes structure et fonction pour les trois types de Nase (Howard and Rees, 1996). C’est au niveau de la composante dinitrogénase que l’on observe des différences majeures entre la Mo-Nase et les Nases alternatives. Nous avons bien évidemment le changement du métal cofacteur Mo par V ou Fe ; mais surtout, une sous-unité δ supplémentaire est présente en plus des sous-unités α et β. Celle-ci semble impliquée dans la maturation de l’enzyme (insertion des FeV- et FeFe-cofacteurs dans la dinitrogénase immature), et reste associée à la Nase fonctionnelle. La stœchiométrie de ces sous-unités est variable selon les fixateurs, et même au sein d’un même organisme, conduisant à des assemblages différents : αβ2, α2β2δ2 ou α2β2δ4. Chez A. vinelandii la stœchiométrie menant à une V-Nase au meilleur de son activité est une dinitrogénase en hétérooctamère des sous-unités α2β2δ4 faisant environ 270 kDa (Lee et al., 2009). La FeFe-protéine quant à elle semble être constituée d’un mélange des formes trimériques, tétramériques et hexamériques αβ2, α2β2 et α2β2δ2 (Masepohl et al., 2002). La Fe-Nase reste toujours l’isoforme pour laquelle il y a moins d’études permettant de cerner la structure et le fonctionnement spécifiques (Hinnemann and Nørskov, 2004).
Malgré ces différences de structure, les trois isoenzymes ont le même fonctionnement global (même cheminement des électrons via les clusters), réduisent les mêmes substrats mais avec une efficacité de réduction du N2 décroissante, allant de la Mo-Nase à la V-Nase puis la Fe-V-Nase (Masepohl et al., 2002; Lee et al., 2009; Bothe et al., 2010).
1.6. Les gènes impliqués dans la fixation biologique d’azote
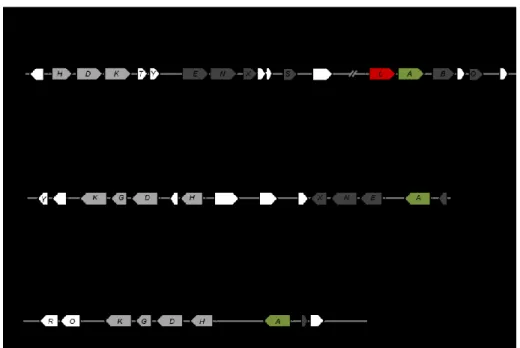
Une nomenclature a été mise en place pour distinguer les gènes des 3 types de Nases : (i) nif (« nitrogen fixation ») pour les gènes de la Mo-Nase, (ii) vnf (« vanadium nitrogen fixation ») pour les gènes de la V-Nase et (iii) anf (« alternative nitrogen fixation ») pour ceux de la Fe-Nase (Joerger et al., 1989). De façon générale, les gènes impliqués dans la fixation d’azote sont organisés en 7-8 opérons, organisés de manière assez semblable pour les trois isoformes de la Nase (figure 5). Bien que certains gènes des clusters nif, vnf et anf restent sans fonction connue ni prédite, la fonction de la plupart d’entre eux a été caractérisée, surtout pour l’isoforme au Mo. Les détails sur les fonctions des gènes présentés ici sont spécifiques à A. vinelandii, mais sont généralement similaires chez d’autres fixateurs.
Figure 5. Organisation des clusters nif, vnf et anf de la fixation biologique d’azote chez A. vinelandii. Les gènes structurels sont représentés en gris clair, ceux impliqués dans l’assemblage des clusters [Fe-S] en gris foncé, ceux impliqués dans la régulation en vert (activateurs) et rouge (répresseur), et les autres gènes en blanc. Adapté de (Dos Santos and Dean, 2014).
1.6.1. Gènes structurels
Cette catégorie regroupe les gènes qui codent les protéines constitutives des Nases, les protéines du squelette. Les sous-unités γ formant la composante dinitrogénase réductase sont codées par les gènes nifH, vnfH et anfH pour les isoformes Mo-, V- et Fe-Nases respectivement. Pour ce qui est de la composante dinitrogénase, les sous-unités α sont codées par les gènes nifD, vnfD et anfD, tandis que les sous-unités β sont codées par les gènes nifK, vnfK et anfK (Brigle et al., 1985). Les sous-unités δ spécifiques des Nases alternatives sont codées par les gènes vnfG et anfG (Joerger et al., 1989; Joerger et al., 1990). Les gènes H, D, K et G (lorsque présent) sont regroupés dans le même opéron, sauf pour la V-Nase dont le gène H est situé dans un autre opéron avec le gène Fd (codant un potentiel donneur d’électron ferrédoxine pour la Nase) (figure 5). De par cet arrangement, les gènes structurels des Nases font donc quasiment tous partie du même transcrit.
1.6.2. Les autres gènes des clusters nif, vnf et anf
De nombreux gènes des clusters nif, vnf et anf ont des rôles dits accessoires, bien que ces gènes soient indispensables à la fixation d’azote. Ils sont impliqués dans les mécanismes de conformation, de maturation et d’activation menant à des Nases actives capables de lier et réduire leurs substrats (figure 5). D’autres gènes sont spécifiquement dédiés à la régulation de la fixation d’azote. Les gènes nifA et nifL codent l’activateur et le répresseur du cluster nif, respectivement. Les homologues de nifA ont été retrouvés dans les clusters vnf et anf (vnfA et anfA) et assurent l’activation de l’expression des gènes vnf et anf (Bennett et al., 1988; Joerger et al., 1989; Walmsley et al., 1994). Pour les Nases alternatives, aucun homologue de nifL n’a été retrouvé (Joerger et al., 1989), suggérant
l’action de NifL dans la répression des Nases alternatives ou encore un mécanisme de répression différent.
La formation, l’activité et la régulation d’une isoforme requiert donc la contribution d’un grand nombre de gènes. La Mo-Nase nécessite la contribution des gènes du cluster nif, tandis que les Nases alternatives requièrent à la fois les clusters vnf ou anf, ainsi que certains gènes du cluster nif (Kennedy and Dean, 1992; Drummond et al., 1996).
1.7. Importance des micronutriments pour la fixation biologique d’azote
Malgré leur caractère essentiel à plusieurs activités biologiques, la dynamique des micronutriments (métaux) a reçu moins d’attention que celle des macronutriments. Pourtant cette dynamique influence les flux de macronutriments dans les grands réservoirs en conditionnant fortement les activités biologiques (Stevenson and Cole, 1999; Hänsch and Mendel, 2009). L’intérêt pour les cycles biogéochimiques des micronutriments a augmenté ces dernières années et il est certain qu’élucider ces cycles nous permettra de mieux comprendre nos écosystèmes.
La FBA est un bon exemple de réaction faisant intervenir le cycle des micronutriments dans celui d’un élément majeur. L’enzyme responsable de la FBA est une métalloenzyme, donc complètement dépendante des métaux cofacteurs requis. La FBA est donc étroitement liée aux cycles des éléments Mo, V et Fe. L’importance de ces métaux pour la FBA a par exemple été mise en évidence dans des études portant sur le Mo dans les sols de la forêt tropicale du Panama, ceux de l’Est Canadien (Barron et al., 2009; Jean et al., 2013) ou encore en milieux aquatiques (Glass et al., 2012). Dans ces écosystèmes, la FBA est limitée par la disponibilité du Mo (associée à une limitation par le P dans l’Est Canadien).
1.7.1. Les métaux essentiels des isoformes des nitrogénases
L’ubiquité de la Mo-Nase ainsi que son efficacité supérieure à réduire le diazote suggère une forte dépendance de la FBA à ce métal. La présence aléatoire des Nases alternatives ainsi que leur plus faible efficacité à réduire le diazote suggèrent que celles-ci seraient principalement utilisées dans des conditions limitantes quantitativement en Mo. Des cultures pures de diazotrophes montrent effectivement une utilisation des Nases alternatives seulement en absence ou en limitation en Mo (Schneider et al., 1991; Jacobitz and Bishop, 1992; Thiel and Pratte, 2013), de même que des échantillons de terrain de la symbiose diazotrophe Peltigera aphtosa (Darnajoux et al., 2016). Cependant de nombreux travaux en laboratoire sont effectués dans des conditions peu réalistes où les métaux cofacteurs sont fournis sous forme biodisponible (non complexée). Les diazotrophes investissent alors préférentiellement dans l’acquisition du Mo qui a un rendement de fixation d’azote plus avantageux. L’acquisition et l’utilisation de V commence seulement lorsque le Mo devient limitant (quantitativement), établissant ainsi une hiérarchie. La régulation de l’expression de la Nase au V par Mo, et de la Nase au Fe par Mo et V (Jacobson et al., 1986; Walmsley and Kennedy, 1991; Premakumar et al., 1998), semble supporter l’existence d’une hiérarchie dans l’activation des isoformes de la Nase reflétant l’efficacité relative des isoformes et le contrôle par la disponibilité des métaux cofacteurs.
Cependant, la mise en évidence de la limitation de la FBA par le Mo dans de nombreux écosystèmes ainsi que l’omniprésence des gènes des Nases alternatives suggèrent que les Nases alternatives pourraient être mises à contribution de manière récurrente en milieu naturel afin de pallier à un manque de disponibilité du Mo (Silvester, 1989; Loveless et al., 1999; Betancourt et al., 2008; Barron et al., 2009; Jean et al., 2013; Darnajoux et al., 2014). Outre le facteur abondance qui influence la disponibilité du Mo et conduit à la limitation en termes de quantité, il est important de prendre en compte le facteur biodisponibilité du Mo et des autres métaux cofacteurs afin de mieux comprendre leur utilisation.
La biodisponibilité des métaux constitue donc un paramètre important de notre compréhension de la contribution des isoformes de la Nase à la FBA. Ce paramètre dépend non seulement de la spéciation des métaux (selon les conditions physico-chimiques), mais aussi des stratégies mises en œuvre par les diazotrophes pour les acquérir.
1.7.2. Spéciation et stratégies d’acquisition des métaux cofacteurs de la nitrogénase
Le Mo est l’un des métaux d’intérêt biologique le moins abondant de l’écorce terrestre et des sols puisqu’il est présent à environ 1 ppm (53ème position). Le V est en moyenne 50 à 200 fois plus abondant, en moyenne 98 ppm (20ème position) (Wedepohl, 1995). Ils sont majoritairement présents dans les sols sous formes d’oxoanions, molybdate (MoO4 2-(Mo(VI)) et vanadate (VO43-(V)), très solubles donc théoriquement très biodisponibles et mobiles (Alloway, 2013). Cependant, ces oxoanions sont complexés à la matrice du sol par la matière organique et minérale (Branca et al., 1990; Peacock and Sherman, 2004; Xu et al., 2006; Wichard et al., 2009b; Alloway, 2013; Marks et al., 2015). Cette complexation permet de limiter le lessivage de ces composés ce qui peut être bénéfique aux fixateurs d’azote, mais peut à l’inverse induire des problèmes de disponibilité pour les organismes vivants.
Divers diazotrophes, comme d’autres organismes, ont développé des stratégies d’acquisition de métaux leur permettant d’accéder à ces sources de métaux cofacteurs. Ces stratégies reposent sur la production de ligands de haute affinité pour Fe, Mo et V, les métallophores. Les métallophores sont des ligands de faible poids moléculaire (200 – 2000 Da) répartis en trois grandes familles selon les groupements fonctionnels permettant de chélater les métaux : les hydroxamates, les catécholates et les carboxylates (Bellenger et al., 2007; Ahmed and Holmström, 2014; Kraemer et al., 2015) (figure 6). Ces groupements leur confèrent la capacité de complexer divers métaux avec plus ou moins d’affinité.
Figure 6. Groupements fonctionnels des métallophores. A) groupement hydroxamate. B) groupement catéchol. C) groupement carboxylate.
Diverses études ont démontré l’importance des métallophores, notamment catécholates, dans l’homéostasie des métaux essentiels (Fe, Mo et V) pour la FBA chez le diazotrophe modèle A. vinelandii (Duhme et al., 1996, 1997, 1998; Bellenger et al., 2007; J. P. Bellenger et al., 2008; Kraepiel et al., 2009).
En milieu naturel, l’utilisation des divers isoformes de la Nase est sans doute fortement dépendante de la capacité de l’organisme fixateur d’azote à acquérir les métaux essentiels. Cette biodisponibilité est le résultat d’interactions complexes entre le milieu (spéciation) et les systèmes d’acquisition des diazotrophes (métallophores). Ces interactions jouent sans doute un rôle d’autant plus important que la disponibilité abiotique de Fe, Mo et V est très faible. Cependant, la majorité de nos connaissances sur l’acquisition des métaux et leur utilisation pour la FBA repose sur des expériences de laboratoire dans lesquelles les métaux sont généralement fournis sous forme facilement biodisponible (Fe-EDTA, Molybdate et vanadate non complexés). Ces conditions, très peu stressantes du point de vue de l’acquisition des métaux, sont peu représentatives des conditions naturelles. Il est ainsi pertinent de s’interroger sur la validité de nos conceptions actuelles de l’utilisation et la relation des Nases (hiérarchie et activation en cascade).
1.8. Organisme d’étude : Azotobacter vinelandii
Azotobacter vinelandii est une Gammaprotéobactérie à Gram négatif, aérobie stricte, possédant les 3 isoformes de la Nase (Bishop et al., 1980, 1982; Hales et al., 1986; Chisnell et al., 1988; Joerger et al., 1989). C’est une bactérie ubiquiste se retrouvant dans des horizons organiques (litière) et minéraux (rhizosphère). Elle réside dans les sols où elle est exposée à un mélange de matières organique et minérale. Le génome d’A. vinelandii OP utilisé pour les projets de ce doctorat a été entièrement séquencé en 2013 (Noar and Bruno-Bárcena, 2013). Cet organisme a fait l’objet de nombreuses études sur la diazotrophie. L’homéostasie des métaux essentiels Fe, Mo et V en conditions diazotrophes a été bien caractérisée dans des expériences de laboratoire ou les métaux ont été fournis sous forme biodisponible (Fe-EDTA, molyddate et vanadate) (Bellenger et al., 2011) (Tableau 1).
Tableau 1. Concentrations clés en métaux essentiels molybdène, vanadium et fer lors de la croissance diazotrophe d’Azotobacter vinelandii.
Concentration extracellulaire (M) Concentration limitante (M) Quota cellulaire limitant (molmétal/molP) Concentration toxique (M) Mo 1 × 10-7 - 1 × 10-6 ≤ 3 × 10-8 2,6 × 10-4 ≥ 1 × 10-5 V 5 × 10-7 - 1 × 10-6 ≤ 10-7 N.D. ≥ 10-5 Fe 5 × 10-6 ≤ 10-6 ~ 8 × 10-3 ˃ 5 × 10-5 N.D. : donnée Non Disponible
Le processus d’acquisition de ces métaux a également été bien élucidé. Le chélome (les métallophores et leurs voies de synthèse) d’A. vinelandii a récemment été publié par Baars et al., (2016). Six métallophores servent à assurer l’acquisition des métaux, des catécholamides: acide 2,3-dihydroxybenzoique (monocatéchol), aminochéline
(monocatéchol), azotochéline (bis-catéchol), protochéline (tris-catéchol), un carboxylate : vibrioferrine, et une pyoverdine : azotobactine (Cornish and Page, 1995; Duhme et al., 1996; Baars et al., 2016) (figure 7).
Figure 7. Structure chimique des métallophores produits par A. vinelandii. (Haut)
DHBA : acide 2,3-dihydroxybenzoique, protochéline et vibrioferrine. (Bas) Aminochéline, azotochéline et azotobactine.
La nature et l’abondance des ligands secrétés par la bactérie sont principalement fonction du niveau de fer biodisponible, mais aussi d’autres métaux tels que Mo, V et tungstène (W). Ceci est particulièrement vrai pour le DHBA et l’azotobactine, qui sont produits abondamment dans des conditions de carence élevée en fer (Page and von Tigerstrom, 1982; Tindale et al., 2000). La production des autres espèces de métallophores est aussi fer-dépendante, mais il a été démontré que d’autres métaux tels que le Mo, le tungstène (W) et le V pouvaient moduler la production de certains ligands (Cornish and Page, 1995; Duhme et al., 1996, 1998; Bellenger et al., 2007; Bellenger et al., 2008a; Bellenger et al.,
2008b; Wichard et al., 2009a; Duhme-Klair, 2009; Kraepiel et al., 2009; Wichard et al., 2009b; Deicke et al., 2014).
Les métaux sont internalisés par A. vinelandii via des systèmes de transport de haute affinité de type ABC pour Fe et Mo, tandis que celui pour le V reste à identifier (Page and Huyer, 1984; Luque et al., 1993; Mouncey et al., 1995; Imperial et al., 1998; Stintzi et al., 2000; Self et al., 2001). Par analogie avec les transporteurs ABC de haute affinité pour le V identifiés chez Anabaena variabilis (Pratte and Thiel, 2006), le transport du V chez A. vinelandii pourrait également dépendre d’un système de type ABC. L’utilisation des isoformes des Nases par A. vinelandii pour la fixation d’azote en conditions de laboratoires optimales (température > 15˚C, métaux essentiels sous forme biodisponibles) suit une hiérarchie qui rappelle celle de l’efficacité théorique des isoformes : Mo-Nase, V-Nase et enfin Fe-Nase (Masepohl et al., 2002; Bellenger et al., 2011). A. vinelandii constitue donc un modèle idéal pour l’étude de l’acquisition et l’utilisation des métaux cofacteurs à la diazotrophie.
1.9. Hypothèse générale et objectifs
L’hypothèse générale du projet de doctorat est que la présence d’agents complexants va influencer la stratégie d’acquisition et d’utilisation des métaux essentiels à la diazotrophie chez A. vinelandii et que les Nases alternatives, notamment au V, contribueront de manière accrue à la FBA en conditions stressantes d’acquisition des métaux cofacteurs (Mo et V).
Cette hypothèse a été testée en utilisant des agents complexants représentatifs des habitats naturels de ce diazotrophe. L’acide tannique est représentatif de la matière organique dissoute du sol, composée majoritairement de tannins dans la litière (Hättenschwiler and Vitousek, 2000; Slabbert, 2012). Quant aux oxydes de Fe, ils constituent une composante importante de la matière minérale des couches plus profondes du sol (Cornell and Schwertmann, 2006; Robin et al., 2008).
Afin de tester l’hypothèse formulée précédemment, l’organisme modèle A. vinelandii a été soumis à des stress abiotiques simulant les conditions environnementales, et sa réponse a été suivie dans le cadre des sous-objectifs suivants :
Étudier l’effet de la présence de matière organique dissoute (Objectif 1) et d’oxydes de Fe (Objectif 2) sur
- la croissance bactérienne diazotrophe par spectrophotométrie UV
- l’acquisition des métaux cofacteurs des Nases en suivant l’évolution du contenu intracellulaire en métaux essentiels par analyse élémentaire (ICP-MS)
- la quantité et qualité des métallophores libérés dans le milieu extracellulaire par spectrométrie de masse
- l’expression des gènes spécifiques aux différentes isoformes des Nases par RT-qPCR.
CHAPITRE 2 RÉSULTATS
Les résultats obtenus au cours du doctorat sont pour la majorité contenus dans deux articles scientifiques. L’un a été publié et l’autre a été soumis, tous deux dans des journaux avec comité de lecture. Ce chapitre présente ces deux articles qui répondent aux objectifs mentionnés dans la section précédente.
2.1. Effet de la matière organique sur l’homéostasie des métaux cofacteurs de la nitrogénase pour la fixation d’azote chez A. vinelandii
2.1.1. Présentation de l’article
L’objectif de cette première étude était d’étudier la gestion des métaux essentiels pour la fixation d’azote par A. vinelandii en présence de matière organique. En effet depuis quelques années, plusieurs études remettent en question la prédominance de l’utilisation du molybdène (Mo) sur le vanadium (V) et le fer (Fe) comme métaux cofacteurs pour la diazotrophie. Ce questionnement s’appuie sur des données telles que l’abondance relative des métaux cofacteurs essentiels ou encore la présence des gènes des Nases alternatives dans plusieurs écosystèmes. Cependant aucune étude, à notre connaissance, n’a réellement montré pourquoi et dans quelles conditions cette hiérarchie ne s’applique plus, ou au moins dans quelles conditions la participation des autres métaux essentiels devient significative.
Afin de se rapprocher des conditions environnementales d’A. vinelandii, nous avons choisi comme facteur de stress l’ajout d’acide tannique. Cette molécule représente la
matière organique dissoute du sol, qui caractérise litière et rhizosphère, habitats naturels de la bactérie diazotrophe. Nous avons vérifié dans un premier temps que l’acide tannique complexe bien Mo et V dans nos conditions de culture. Nous avons ainsi pu montrer qu’afin de conserver un taux de croissance optimal dans ces conditions, A. vinelandii modifie sa stratégie d’acquisition des métaux, notamment en produisant (ou secrétant) plus de métallophores protochéline et azotochéline. Elle se détourne alors d’une acquisition préférentielle de Mo telle que connue jusqu’à lors, pour adopter une acquisition simultanée de Mo et V. Cette stratégie a conduit à une internalisation simultanée de Mo et V. Pour ce qui est de la contribution des différentes Nases à la fixation d’azote, en suivant l’évolution des niveaux de transcrits des gènes nifD, vnfD et anfD, spécifiques des isoformes au Mo, V et Fe respectivement, nous avons observé une diminution du niveau de transcrits de nifD tandis que celui de vnfD augmente. Ce profil suggère une contribution de la V-Nase à la fixation d’azote. Nous avons donc démontré qu’en présence de matière organique, A. vinelandii tire profit de la diversité de ses Nases pour assurer une croissance diazotrophe optimale en modifiant l’homéostasie des métaux essentiels. Ceci suggère que dans l’horizon O (couche organique du sol, constitué de litière et de matière organique en décomposition) des sols riche en matière organique, le V pourrait contribuer de manière plus significative à la fixation d’azote.
Les résultats de cette étude sont présentés dans l’article qui suit :
Jouogo Noumsi C.1,2, Pourhassan N.1, Darnajoux R.1, Deicke M.3, Wichard T.3, Burrus V.2, Bellenger JP.1 (2016). Effect of organic matter on nitrogenase metal cofactors homeostasis in Azotobacter vinelandii under diazotrophic conditions. Environ. Microbiol. Rep. 8(1): 76–84. doi:10.1111/1758-2229.12353
L’approche expérimentale a été définie avec Jean-Philippe Bellenger et Vincent Burrus. J’ai réalisé les expériences de culture, analysé l’expression des gènes. L’analyse du contenu intracellulaire en métaux par ICP-MS a été faite conjointement avec Romain Darnajoux. La méthode de dosage des métallophores par UPLC-MS a été développée par Nina Pourhassan, Michael Deicke et Thomas Wichard. L’analyse de ces métallophores a été effectuée conjointement avec Nina Pourhassan. J’ai rédigé le manuscrit et généré les figures, et tout cela a été révisé par tous les co-auteurs.
2.1.3. Page titre
Effect of organic matter on nitrogenase metal cofactors homeostasis in Azotobacter vinelandii under diazotrophic conditions
Christelle Jouogo Noumsi 1,2, Nina Pourhassan1, Romain Darnajoux1, Michael Deicke3, Thomas Wichard3, Vincent Burrus2, Jean-Philippe Bellenger1.
1Département de chimie, Faculté des sciences, Université de Sherbrooke;
2Laboratory of bacterial molecular genetics, Département de biologie, Faculté des sciences, Université de Sherbrooke, Sherbrooke (Québec), Canada.
3Friedrich Schiller University Jena, Institute for Inorganic and Analytical Chemistry, Jena School for Microbial Communication, Lessingstr. 8, 07743 Jena, Germany.
Corresponding author: Jean-Philippe Bellenger
2500 Boulevard de l’université, J1K 2R1, Sherbrooke (Québec), Canada Phone number: 819 821-7014. Fax number: 819 821-8017
Jean-Philippe.Bellenger@usherbrooke.ca
2.1.4. Summary
Biological nitrogen fixation can be catalyzed by three isozymes of nitrogenase: Mo-nitrogenase, V-nitrogenase and Fe-nitrogenase. The activity of these isozymes strongly depends on their metal cofactors, Mo, V and Fe, and their bioavailability in ecosystems. Here, we show how metal bioavailability can be affected by the presence of tannic acid (organic matter), and the subsequent consequences on diazotrophic growth of the soil bacterium Azotobacter vinelandii. In the presence of tannic acids, A. vinelandii produces a higher amount of metallophores, which coincides with an active, regulated and concomitant acquisition of Mo and V under cellular conditions that are usually considered not Mo limiting. The associated nitrogenase genes exhibit decreased nifD expression and increased vnfD expression. Thus, in limiting bioavailable metal conditions, A. vinelandii takes advantage of its nitrogenase diversity to ensure optimal diazotrophic growth.
Keywords: Azotobacter vinelandii, nitrogen fixation, metallophores, tannic acid
2.1.5. Introduction
Biological nitrogen fixation, the reaction that converts atmospheric dinitrogen (N2) into bioavailable ammonia, is the main source of new nitrogen (N) in unmanaged ecosystems. This reaction is key to the understanding of the N cycle and has been shown to limit net primary production in many ecosystems (Galloway et al., 2004). Nitrogen fixers use the enzyme nitrogenase, a metalloprotein, to catalyze the reaction. Three nitrogenase isoforms have been described to date and classified based on the metal present in the cofactor: the molybdenum nitrogenase (Mo-Nase), the vanadium nitrogenase (V-Nase) and the iron-only nitrogenase (Fe-Nase) (Bishop et al., 1980, 1982; Hales et al., 1986; Robson et al., 1986; Chisnell et al., 1988; Schneider et al., 1991; Rehder, 2000; Masukawa et al., 2009). The canonical Mo-Nase is the most efficient isozyme at ambient
temperature and is found in all diazotrophs. The less efficient V-Nase and Fe-Nase, also called alternative nitrogenases, are present in only few N2 fixers and have never been reported in microorganisms living in symbiotic associations with higher plants (Loveless and Bishop, 1999; Boyd et al., 2011). Thus, the Mo-Nase is considered as the predominant isozyme responsible for N2 fixation worldwide. However, recent evidence questions this paradigm. Several studies have reported that Mo is limiting biological N fixation in many aquatic and terrestrial ecosystems (Silvester, 1989; Barron et al., 2009; Glass et al., 2012; Jean et al., 2013). The presence of alternative nitrogenases has also been reported in diverse aquatic and terrestrial ecosystems (Loveless et al., 1999; Betancourt et al., 2008; Hodkinson et al., 2014). While the importance of alternative nitrogenases to biological nitrogen fixation is becoming increasingly evident (Reed et al., 2011), our understanding of the conditions under which alternative nitrogenases come into play in natural habitats remains incomplete. Temperature could influence nitrogenases use as the alternative V-Nase reduces N2 more efficiently than the Mo-Nase under low temperature (< 15˚C) (Miller and Eady, 1988). Moreover, soils contain on average 50-200 times more V than Mo (Wedepohl, 1995; Kabata-Pendias, 2010). The relative availability of Mo and V could thus promote the use of alternative Nases.
In the environment, Mo and V are mostly found as oxoanions in aqueous solution and can form complexes with plant-derived tannins and tannin-like compounds in the topsoil ((Abdel-Gawad and Issa, 1986)Branca et al., 1990; Kiboku and Yoshimura, 1958; Reddy and Gloss, 1993; Poledniok, 2003; Wichard et al., 2009a). Tannins are among the most abundant biomolecules in terrestrial biomass especially in litters (Hättenschwiler and Vitousek, 2000; Slabbert, 2012). Therefore, binding of Mo and V to natural organic matter (i.e. tannin like compounds) reduces leaching of essential trace metals, and is thus a critical process supporting biological N fixation (Wichard et al., 2009a).
Organisms have developed efficient strategies to retrieve metals from their environment by producing small organic ligands, known as metallophores, to impact metal speciation in the extracellular environment and better control metal acquisition (Kraemer et al., 2015). Metallophores produced by the non-symbiotic N2 fixer Azotobacter vinelandii
exhibit high affinity for several metals, including Fe, Mo and V, and are involved in a specific and highly regulated uptake system for the acquisition of nitrogenase metal cofactors (Duhme et al., 1996, 1998; Bellenger et al., 2007; Kraepiel et al., 2009; Wichard et al., 2009b) . The efficiency of bacterial metallophores to compete with natural metal-complexes is key to recruit Mo and likely V from natural sources, such as the leaf litter and O-horizon of soils, both very rich in organic matter. Complex interactions between metallophores and tannic acid complexes might significantly affect nitrogenase metal cofactors (Fe, Mo, V) acquisition a use that remains to be determined.
To get a comprehensive view of the impact of natural organic matter on metal acquisition and use by A. vinelandii, we evaluated the effect of the supplementation of growth media with tannic acids, used as a model substance for dissolved organic matter, on: (1) bacterial growth, (2) cellular Fe, V and Mo quotas, (3) production of metallophores, and (4) relative expression of three target genes nifD, vnfD and anfD encoding the subunits of Mo-Nase, V-Nase, and Fe-Nase, respectively (Rubio and Ludden, 2005). Experiments were conducted in the presence of equimolar concentrations of Mo and V ([Mo] = [V] = 10-7 M, results are presented in Sup. Inf.), and in the presence of an excess of V ([Mo] = 5×10-8 M; [V] = 2×10-7 M) to mimic the relative abundance of these metals in natural leaf litters (Jean et al., unpublished data).
2.1.6. Result and Discussion
The exponential growth rates of A. vinelandii were not significantly affected by the presence of tannic acids (see the inset of Fig. 1 and Sup. Inf. 1 Fig. S1). The only observable effect of the presence of tannic acids was a delay at the beginning of the exponential growth phase (~ 1.5 and 3 hours for 1×10-5 M and 5×10-5 M tannic acids, respectively). However, our data show that the presence of tannic acids has a significant
effect on both the strategy of metal acquisition by A. vinelandii and the activation of its three nitrogenase isoforms.
Figure 1: Growth curves of Azotobacter vinelandii. Absorbance at 620 nm was plotted versus
time for the three tested conditions. The inset shows curve fitting of growth by a nonlinear regression (exponential growth) and the growth rate values obtained for each condition at the exponential phase. Values represent the mean ± SD; n = 3. Ctrl: control. TA: tannic acid.
In common artificial growth media, bacteria have access to readily bioavailable Mo and V sources: un-complexed molybdate and vanadate (Duhme et al., 1998; Bellenger et al., 2011). Our data confirm that tannic acids efficiently complexed Mo and V (Sup. Inf. 2 Fig S5) which strongly reduces their bioavailability.
This stress on metal acquisition affected metallophore production; in the presence of tannic acid the amount of metallophores released by A. vinelandii (i.e. protochelin and azotochelin) was up to 28-fold higher than in untreated culture, especially during the late exponential phase (Fig. 2 and Sup. Inf. 1 Fig. S2). Complexes of Mo or V with
azotochelin and protochelin possess higher stability constants than those with tannic acids indicating that protochelin and azotochelin can retrieve Mo and V from tannic acids (Abdel-Gawad and Issa, 1986; Bellenger et al., 2008a). The release of elevated amounts of metallophores can thus improve the efficiency of metal recruitment from tannate complexes. We conclude that the delayed growth observed during lag phase compared to the control culture without tannic acid supplementation was due to an enhanced production of metallophores necessary to gather the metals from the tannate complex to support diazotrophic exponential growth.
Figure 2: Metallophores production by Azotobacter vinelandii along the growth. A.
Protochelin and B. Azotochelin concentrations in supernatants of A. vinelandii cultures at OD 0.05, 0.1, 0.2, 0.4, 0.6 and 0.8. Ctrl: control. TA: tannic acid. Values represent the mean ± SE; n = 3. A two-way ANOVA with a Tukey’s multiple comparisons test was used to compare each metallophore concentrationsper andbetween conditions along the growth and at each OD. Similar letters indicate no significant difference (P > 0.05).
The presence of tannic acids did not simply impact metallophore amount; it also had significant effects on the metal acquisition strategy used by the bacterium. Fe cellular quotas (QFe) were not affected by growth phase nor the presence of tannic acids (Fig. 3A and Sup. Inf. 1 Fig S3A). The QFe measured in this study were within the range required to sustain diazotrophic growth= (31 ± 16) × QFe – 0.2, Bellenger et al., 2011). This was expected since Fe was supplied as Fe-EDTA, a strong complex (stability constant log = 25.7) (Martell and Smith, 1989). Taking the relatively weak stability constant of ferrous-tannate complexes into account, the presence of tannic acids likely did not affect Fe equilibrium or the ability of A. vinelandii to acquire iron. As observed for Fe, the presence of tannic acids had no significant effect on Mo cellular quotas (QMo) as compared to the
control (Fig. 3B and Sup. Inf. 1 Fig S3B). In the lag phase (until OD620 = 0.1), QMo were high in all cultures (~1-5×10-3 molMo molP-1). Then, QMo decreased with cell division, until OD620 0.2/0.4 was reached. For OD620 > 0.4, the decrease in QMo was decoupled from cell division. At the end of the exponential phase, QMo remained within or higher than the optimum range of QMo required to sustain diazotrophic growth in A. vinelandii = (607 ± 188) × QMo, Bellenger et al., 2011). Under such conditions, V is not required for diazotrophic growth and is not expected to be actively taken up by the bacterium. This assumption was confirmed by the control cultures where cellular V quotas (Qv) decreased with cell division during growth suggesting limited or no acquisition of new V from the medium (V ≤ 10-23 molV cell-1 min-1) (Fig. 3C and Sup. Inf. 1 Fig S3C, Sup Inf. 4 Fig S6). Moreover, we argue that the intracellular V pool at the early stage of growth likely resulted from the acquisition of free vanadate through low affinity uptake systems or passive diffusion.
Figure 3: Evolution of cellular metal to phosphorus quotas in A. vinelandii. Metals content
was measured at OD = 0.05, 0.1, 0.2, 0.4, 0.6 and 0.8. Iron A, molybdenum B and vanadium C cellular quotas. Zones between grey lines represent the range of optimum metal (i.e. Fe, Mo, V) cellular quota required to sustain diazotrophic growth with our cultures’ instantaneous growth rates (Bellenger et al., 2011). Opened circles represent control conditions, opened and closed triangles represent tannic acids at 1×10-5 M and tannic acids at 5×10-5 M, respectively. Ctrl:
control. TA: tannic acid. Values represent the mean ± SD; n = 3. A two-way ANOVA with a Tukey’s multiple comparisons test was used to compare the metal quotas between conditions (Results of statistical tests are presented in table S2 of supporting information).
The significance of these mechanisms was strongly reduced after production of metallophores complexing Mo and V in the growth medium. Once complexed by metallophores, V acquisition is tightly regulated (Bellenger et al., 2008b). In the presence of tannic acids, acquisition of V started, and was actively controlled, earlier in the growth phase than in the absence of tannic acids. From OD ~ 0.2, Qv was maintained constant despite active cell division showing an acquisition of V from the medium at rates 2 to 96 times higher than in control cultures (~ 10-22 - 10-21 molV cell-1 min-1) (Fig. 3C and Sup. Inf. 1 Fig S3C, Sup Inf. 4 Fig S6). This increase unlikely resulted from V acquisition through low affinity uptake systems because (i) a large fraction of V was complexed to tannic acids (Sup. Inf. 2, Fig. S5) and (ii) at OD = 0.2 enough metallophores (at least ~ 10-7 M) had been released to complex any V (and Mo). It is noteworthy that in the presence of tannic acids, at OD > 0.2 both cellular V quotas (Qv) and V uptake rates (V) reached optimum Qv and V (3×10-21 molV cell-1 min-1) required to sustain diazotrophic growth at = 0.15 OD h-1 using V-Nase alone (V = (521 ± 94) × QV, Bellenger et al., 2011) (Fig. 3C and Sup. Inf. 1 Fig S3A, Sup. Info. 2 Fig. S6).
Finally, the presence of tannic acids also impacted Nase expression since vnfD was significantly more expressed in the presence of tannic acids than in untreated control. Briefly, nifD expression decreased along the exponential growth under all conditions (up to 5 fold difference with 5×10-5 M tannic acids). During the early log phase, the presence of tannic acids (1×10-5 M) led to a twofold decrease of nifD as compared to the control (Fig. 4A and Sup. Inf. 1 Fig S4A). This difference vanished at mid and end-log phase. vnfD expression was strongly induced during growth with and without tannic acids (up to 382 fold) (Fig. 4B and Sup. Inf. 1 Fig S4B). The effect of tannic acids appeared at mid-log phase with a twofold increase of vnfD expression in the presence of tannic acids (5×10-5 M) which was statistically significant in the Mo:V = 1:1 (10-7 M) experiments (Sup. Inf. 1 Fig S4B). The expression of anfD remained relatively stable during the log phase and under all conditions (Fig. 4C and Sup. Inf. 1 Fig S4C). The decrease of nifD
mRNA levels suggests that the levels of Mo-Nase could decrease, and be compensated by boosted vnfD expression.
Figure 4: Relative expression of nifD, vnfD and anfD during the exponential growth phase.
Gene expression was measured by RT-qPCR. Ctrl: control. TA: tannic acid. Values represent the mean ± SD; n = 3 or 4. A two-way ANOVA with a Tukey’s multiple comparisons test was used to compare the mRNA levels between conditions and along the growth. Asterisks indicate significant differences between the same genes in different conditions (* = P < 0.05, ** = P< 0.01, *** = P < 0.001).