© Stéphanie LeBlanc, 2019
Caractérisation de l'athérosclérose carotidienne par
imagerie par résonance magnétique : interactions
complexes avec les marqueurs/médiateurs
cardiométaboliques
Thèse
Stéphanie LeBlanc
Doctorat en médecine expérimentale
Philosophiæ doctor (Ph. D.)
Caractérisation de l’athérosclérose carotidienne par
imagerie par résonance magnétique :
interactions complexes avec les marqueurs/médiateurs
cardiométaboliques
Thèse
Stéphanie LeBlanc
Sous la direction de :
Eric Larose, directeur de recherche
Jean-Pierre Després, codirecteur de recherche
RÉSUMÉ
La maladie coronarienne est l’une des principales causes de mortalité dans le monde, la manifestation la plus connue étant l’infarctus du myocarde. Plus de 80 % des infarctus sont causés par la formation d’un thrombus occlusif dans une artère coronaire, découlant de la déstabilisation d’une plaque d’athérosclérose. Bien que la présence de facteurs de risque traditionnels majeurs (hypertension, diabète, dyslipidémie, tabagisme) augmente le risque coronarien, plus de 85 % des infarctus sont inexpliqués par ceux-ci. L’athérosclérose, le mécanisme sous-jacent à la majorité des évènements coronariens, se caractérise par des dépôts de calcium, de tissu fibreux, ainsi que de lipides et de débris nécrotiques, lesquels s’agglomèrent pour former un noyau nécrotique riche en lipides (LRNC) dans la paroi artérielle. Le LRNC est un déterminant majeur de la vulnérabilité de l’athérosclérose étant associé à la survenue d’évènements coronariens. Les lipoprotéines athérogènes sont très impliquées dans le développement du LRNC et sont influencées par plusieurs éléments, dont l’adiposité viscérale. L’activité physique réduirait cette adiposité et pourrait également ralentir la progression de l’athérosclérose. Or, la relation entre l’athérosclérose et ces marqueurs cardiométaboliques est à clarifier. L’étude des artères coronaires nécessite des méthodes d’imagerie invasives, peu applicables chez des sujets sains. Puisqu’il est suggéré que l’athérosclérose est une maladie systémique, l’artère carotide représenterait un témoin facilement accessible à l’imagerie par résonance magnétique, non invasive, et permettrait d’étudier ces relations. Les objectifs généraux de cette thèse sont de déterminer si les mesures volumétriques du fardeau et des caractéristiques tissulaires de l’athérosclérose carotidienne sont associées au risque coronarien et de vérifier leurs relations avec le gras viscéral, les lipoprotéines athérogènes et l’activité physique. D’abord, nous avons éclairci la relation entre l’athérosclérose carotidienne et coronarienne, montrant que les mesures volumétriques de l’athérosclérose carotidienne faisaient état du risque coronarien. Ensuite, nous avons montré que les mesures cliniques de l’adiposité abdominale et des lipoprotéines athérogènes, informant sur l’excès de gras viscéral, amélioraient l’évaluation du risque en clinique et que l’inactivité physique et la progression du gras viscéral étaient associées à l’évolution du LRNC dans les carotides. Enfin, nous avons établi que l’amélioration de la condition cardiorespiratoire était inversement associée à la progression de la proportion du LRNC dans les carotides. Nos travaux montrent donc que l’adiposité viscérale abdominale et la sédentarité affectent l’évolution de l’athérosclérose vulnérable, offrant des avenues de prévention très prometteuses pour réduire l’incidence de la maladie coronarienne.
ABSTRACT
Coronary artery disease is one of the leading causes of mortality worldwide, myocardial infarction being the most common clinical manifestation. More than 80% of myocardial infarctions are caused by an occlusive thrombus in a coronary artery, resulting from the destabilization of an atherosclerotic plaque. Although the presence of traditional risk factors such as hypertension, diabetes, dyslipidemia and smoking increases the risk of coronary artery disease, more than 85% of myocardial infarction events remain unexplained by those risk factors. Atherosclerosis is characterized by an accumulation of calcium and fibrous tissue as well as necrotic and lipids debris, aggregated in a lipid-rich necrotic core (LRNC) within the artery wall. LRNC is a major determinant of atherosclerosis vulnerability, being associated with the occurrence of coronary events. Atherogenic lipoproteins are closely involved in the LRNC development, and are mediated through several mechanisms, but especially by visceral adiposity. Physical activity reduces the amount of visceral fat and the level of atherogenic lipoproteins, and may also slow atherosclerosis progression. However, the relationship between atherosclerosis characteristics and those cardiometabolic markers remains to be clarified. Imaging of coronary arteries requires invasive techniques, which are difficult to apply in otherwise healthy individuals. The carotid artery is easily accessible to magnetic resonance imaging, which is non-invasive, and may be used to study those relationships. The general objectives of this thesis are to determine whether volumetric measurements of carotid atherosclerosis burden and tissue features are associated with coronary risk, and if they are related to visceral adiposity, atherogenic lipoproteins and physical activity. First, we clarified the relationship between carotid and coronary atherosclerosis, and demonstrated that volumetric measurements of carotid atherosclerosis were good indicators of the clinical coronary risk. Then, we established that clinical measurements of visceral abdominal adiposity and atherogenic lipoproteins may improve risk evaluations by identifying individuals with high-risk atherosclerosis. We also demonstrated that physical inactivity and visceral abdominal adiposity progression are associated with the progression of the LRNC in the carotid artery. Finally, we observed that the improvement of cardiorespiratory fitness, generated by regular physical activity, is inversely associated with the change of LRNC proportion in the carotid artery. Our work therefore shows that physical inactivity and visceral abdominal adiposity are associated with the progression of high-risk atherosclerosis features, offering promising avenues to reduce the incidence of coronary artery disease.
TABLE DES MATIÈRES
RÉSUMÉ ... iii
ABSTRACT ... iv
TABLE DES MATIÈRES ... v
LISTE DES TABLEAUX ... x
LISTE DES FIGURES ... xii
LISTE DES ABRÉVIATIONS ... xiv
REMERCIEMENTS ... xvi
AVANT-PROPOS ... xix
INTRODUCTION ... 1
1.1
Maladie cardiovasculaire : définition et étiologie ... 1
1.2
Morphologie et physiologie artérielle ... 3
1.2.1 Structure artérielle ... 3
1.2.1.1 Tunique interne – intima ... 3
1.2.1.2 Tunique moyenne – média ... 4
1.2.1.3 Tunique externe – adventice ... 5
1.2.2 Artères élastiques et artères musculaires ... 5
1.3
Épaississement de la paroi artérielle : de l’adaptatif au pathologique ... 6
1.3.1 Contraintes hémodynamiques ... 7
1.3.1.1 Contraintes de cisaillement et remodelage adaptatif ... 8
1.3.2 Initiation et évolution de l’athérosclérose ... 10
1.3.2.1 Hypothèse de « Response-to-Retention » ... 10
1.3.2.2 Initiation et progression de l’athérosclérose ... 12
1.3.2.3 Déstabilisation de la plaque d’athérosclérose ... 14
1.3.3 Progression silencieuse de l’athérosclérose ... 16
1.4
Maladie coronarienne athérosclérotique ... 19
1.4.1 Facteurs de risque traditionnels de la maladie coronarienne et athérosclérose ... 21 1.4.1.1 Âge ... 22 1.4.1.2 Sexe ... 23 1.4.1.3 Histoire familiale ... 24 1.4.1.4 Tabagisme ... 24 1.4.1.5 Hypertension ... 25 1.4.1.6 Hyperglycémie et diabète ... 25
1.4.1.7 Dyslipidémie et lipoprotéines athérogènes ... 26
1.4.1.8 Obésité ... 31
1.4.2 Scores de risque traditionnels et athérosclérose ... 32
1.4.2.1 Scores de risque de la maladie cardiovasculaire ... 32
1.4.2.2 Pathobiological Determinants of Atherosclerosis in Youth (PDAY) ... 33
1.4.3 Adiposité abdominale et viscérale : facteur de risque de l’athérosclérose . 34 1.4.3.1 Mesures cliniques de l’adiposité/obésité abdominale ... 36
1.4.4 Activité physique et athérosclérose ... 39
1.4.4.1 Terminologies ... 39
1.4.4.2 Modulation du risque cardiovasculaire et athérosclérotique ... 39
1.5
Imagerie de l’athérosclérose coronarienne ... 43
1.5.1 Angiographie par rayons X ... 43
1.5.3 Ultrasons intravasculaires (IVUS) et histologie virtuelle ... 44
1.5.4 Imagerie par résonance magnétique (IRM) ... 45
1.5.4.1 IRM pour l’étude de l’athérosclérose coronarienne ... 49
1.5.5 Tomographie par émission de positrons (TEP) ... 52
1.5.6 Tomodensitométrie ... 53
1.5.7 Limites et perspectives ... 53
1.6
Rôle de l’artère carotide dans l’évaluation du risque coronarien ... 55
1.6.1 Athérosclérose et ultrasons non invasifs ... 55
1.6.2 Athérosclérose et IRM non invasive ... 56
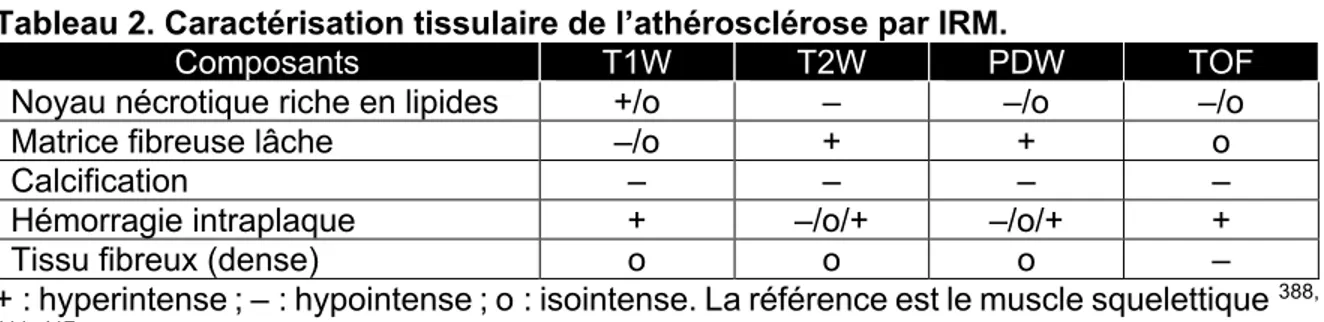
1.6.2.1 Athérosclérose et caractéristiques tissulaires : définitions et mesures ... 57
OBJECTIFS ET HYPOTHÈSES ... 60
CHAPITRE 1 : Carotid versus Coronary Atherosclerosis Burdens in Acute Compared with Chronic Symptomatic Coronary Artery Disease ... 64
Résumé ... 65
Abstract ... 66
Introduction ... 67
Methods ... 68
Coronary Atherosclerosis ... 69 Carotid Atherosclerosis ... 70 Data Analysis ... 71 Results ... 71
Population Characteristics ... 71
Coronary Atherosclerosis Burden ... 72
Carotid Atherosclerosis Presence and Burden ... 72
Carotid and Coronary Atherosclerosis Burdens ... 73
Reliability of Carotid Parameters ... 74
Discussion ... 74
Coronary Atherosclerosis Burden ... 74
Carotid Atherosclerosis Presence ... 74
Carotid Atherosclerosis Burden ... 75
Carotid Atherosclerosis, a Potential Risk Marker ... 76
Prevention and Carotid Atherosclerosis Burden ... 77
Limitations ... 78
Conclusions ... 79
Sources of Funding ... 79
Tables ... 80
Figures ... 85
CHAPITRE 2 : Carotid Atherosclerosis Burden by Magnetic Resonance Discriminates Clinical Coronary Artery Disease Risk ... 87
Résumé ... 88
Abstract ... 89
Introduction ... 90
Methods ... 91
Study Population ... 91 Clinical Data ... 92
Carotid MRI Protocol ... 92
Statistical Analyses ... 93
Results ... 93
Carotid Atherosclerosis Prevalence and Burden ... 94
Associations with Cardiovascular Risk Markers ... 95
Associations with the Presence of Clinical CAD ... 95
Discriminating the Presence of Clinical CAD ... 96
Discussion ... 97
Sources of Funding ... 99
Tables ... 101
Figures ... 104
Supplemental Material ... 110
CHAPITRE 3 : Carotid Artery Atherosclerosis Composition by Magnetic Resonance Imaging and Coronary Artery Disease Risk ... 113
Résumé ... 114
Abstract ... 115
Introduction ... 116
Methods ... 117
Characteristics of the Populations ... 117
Clinical Risk Markers Evaluations ... 117
Carotid Artery Evaluation ... 118
Statistical Analyses ... 119
Results ... 119
Characteristics of the Populations ... 119
Carotid Atherosclerosis Composition ... 120
Carotid Atherosclerosis Composition and the Presence of Clinical CAD ... 121
Discussion ... 122
Study Limitations ... 125 Conclusions ... 125 Sources of Funding ... 125
Tables ... 127
Figures ... 129
Supplemental Material ... 131
CHAPITRE 4 : Hypertriglyceridemic Waist: A Simple Marker of High-Risk Atherosclerosis Features Associated with Excess Visceral Adiposity/Ectopic Fat 137
Résumé ... 138
Abstract ... 139
Introduction ... 140
Methods ... 141
Study Population ... 141
Risk Factors Evaluation ... 142
MRI Protocol and Image Analysis ... 143
Adipose Tissue Evaluation ... 143
Carotid Artery Evaluation ... 143
Statistical Analyses ... 145
Results ... 146
Population Characteristics ... 146
Carotid Atherosclerosis Features ... 147
Hypertriglyceridemic Waist and Clinical Markers ... 148
Hypertriglyceridemic Waist and Carotid Atherosclerosis Features ... 148
Net Reclassification Improvement ... 149
Discussion ... 150
Hypertriglyceridemic Waist and Carotid Atherosclerosis Burden ... 152
Hypertriglyceridemic Waist and High-Risk Carotid Atherosclerosis Features ... 152
Study Limitations ... 154 Conclusions ... 155 Sources of Funding ... 155
Disclosures ... 155
Tables ... 156
Figures ... 163
Supplemental Material ... 166
CHAPITRE 5 : Visceral Adiposity, a Key Factor in Differences of Atherosclerosis Burden and Composition Between Women and Men. Evidence from a Magnetic Resonance/Cardiometabolic Risk Study ... 168
Résumé ... 169
Abstract ... 170
Introduction ... 171
Methods ... 172
Study Populations ... 172 MRI Protocol ... 173
Adipose Tissue Evaluation ... 173
Carotid Artery Evaluation ... 173
Statistical Methods ... 174
Results ... 175
Clinical Characteristics ... 175
Carotid Atherosclerosis Characteristics ... 176
Carotid Atherosclerosis Characteristics and Clinical and Adiposity Markers ... 176
Sex Interactions on Carotid Atherosclerosis Tissue Features ... 177
Predictors of Carotid Atherosclerosis and LRNC According to Sex ... 178
Discussion ... 180
Sex-Related Differences in Atherosclerosis Characteristics ... 180
Mediators of Sex-Related Differences in Atherosclerosis Characteristics ... 182
Study Limitations ... 183 Conclusions ... 184 Sources of Funding ... 184
Tables ... 185
Figures ... 190
Supplemental Material ... 191
CHAPITRE 6 : The Natural Process of Carotid Atherosclerosis Progression in Asymptomatic Young Men and Women: 3-Year Follow-Up Study ... 194
Résumé ... 195
Abstract ... 196
Introduction ... 197
Methods ... 197
Population Characteristics ... 197
MRI Protocol for Adipose Tissue Evaluations ... 198
Carotid Artery MRI Protocol ... 199
Statistical Analysis ... 200
Results ... 200
Population Characteristics ... 200
Carotid Atherosclerosis Burden and Features ... 201
Abdominal Adiposity and Carotid LRNC Progression ... 203
Discussion ... 204
Atherosclerosis Tissue Features and Clinical Markers ... 204
Progression of Carotid Atherosclerosis Tissue Features ... 205
Inactivity, Visceral Adiposity, Lipoproteins Markers and Atherosclerosis Progression ... 206 Study Limitations ... 207 Conclusions ... 207 Sources of Funding ... 208
Tables ... 209
Figures ... 215
Supplemental Material ... 217
CHAPITRE 7 : Regular Physical Activity and Carotid Atherosclerosis Tissue Features of Coronary Men: 1-Year Interventional Study ... 218
Résumé ... 219
Abstract ... 220
Introduction ... 221
Methods ... 221
Population Characteristics ... 221 MRI Protocol ... 222 Adiposity Evaluation ... 222
Carotid Artery Evaluation ... 223
Physical Activity Intervention ... 224
Statistical Analyses ... 224
Results ... 225
Population Characteristics ... 225
VO2max and Atherosclerosis Tissue Feature Progressions ... 226
Discussion ... 226
Physical Activity and Cardiovascular Risk ... 227
Physical Activity and Carotid Atherosclerosis ... 228
Common versus Internal Carotid Segments ... 229
Study Limitations ... 230 Conclusions ... 230 Sources of Funding ... 231
Tables ... 232
Figures ... 235
CONCLUSIONS ... 238
BIBLIOGRAPHIE ... 253
LISTE DES TABLEAUX Introduction
Tableau 1. Seuils de circonférence de taille identifiant l’obésité abdominale. ... 37
Tableau 2. Caractérisation tissulaire de l’athérosclérose par IRM. ... 57
Chapitre 1 Table 1.1. Clinical Characteristics of the STEMI and CSA Cohorts. ... 80
Table 1.2. Coronary Artery Disease Distribution. ... 81
Table 1.3. Carotid Artery Characteristics in STEMI and CSA Cohorts. ... 82
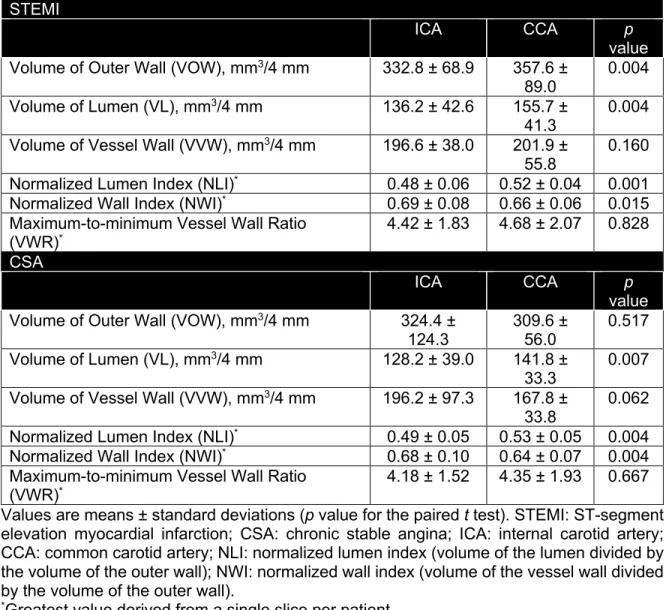
Table 1.4. Comparison of the Common versus the Internal Carotid Artery Segments. ... 83
Table 1.5. Associations Between the Modified CASS-50 Score and the Carotid Artery Characteristics in STEMI versus CSA. ... 84
Chapitre 2 Table 2.1. Characteristics of the Groups. ... 101
Table 2.2. Carotid Atherosclerosis Presence and Burden. ... 103
Table S2.1. Carotid Atherosclerosis Presence and Burden in the CAD-free and CAD Groups. ... 110
Table S2.2. Carotid Atherosclerosis Presence and Burden in the Internal and Common Carotid Arteries. ... 111
Table S2.3. Atherosclerosis Presence and Burden in the Internal and Common Carotid Arteries in the CAD-free and CAD Groups. ... 112
Chapitre 3 Table 3.1. Clinical Risk Markers in the 3 Groups Presenting Graded Clinical Coronary Risk. ... 127
Table 3.2. Atherosclerosis Tissue Features in the Total Carotid Artery. ... 128
Table S3.1. Carotid Artery LRNC Volume and Clinical Markers. ... 131
Table S3.2. Carotid Artery Calcification Volume and Clinical Markers. ... 133
Table S3.3. Carotid Artery Loose Matrix Volume and Clinical Markers. ... 135
Chapitre 4 Table 4.1. Characteristics of Hypertriglyceridemic Waist Phenotype Groups. ... 156
Table 4.2. Carotid Atherosclerosis Features of Hypertriglyceridemic Waist Phenotype Groups. ... 158
Table 4.3. Associations Between the Hypertriglyceridemic Waist and Clinical Risk Markers. ... 159
Table 4.4. Associations Between Atherosclerosis Features and the Hypertriglyceridemic Waist. ... 161
Table 4.5. NRI of Hypertriglyderidemic Waist versus Waist Circumference Combined to FRS and PDAY Risk Score for Carotid Artery Atherosclerosis and LRNC. ... 162
Table S4.1. Characteristics of the Population. ... 166
Table S4.2. Atherosclerosis Features of the Carotid Artery*. ... 167
Chapitre 5 Table 5.1. Characteristics of Study Participants. ... 185
Table 5.2. Carotid Artery Characteristics According to Sex. ... 186
Table 5.4. Carotid LRNC and Clinical and Adiposity Markers. ... 188
Table 5.5. Carotid Calcification and Clinical and Adiposity Markers. ... 189
Table S5.1. Characteristics of Study Subgroups. ... 191
Table S5.2. Carotid Artery Characteristics of Study Subgroups. ... 193
Chapitre 6 Table 6.1. Characteristics of the Population. ... 209
Table 6.2. Carotid Artery Atherosclerosis Burden and Tissue Features. ... 211
Table 6.3. Associations Between the Progression of Atherosclerosis Burden and Clinical Markers. ... 212
Table 6.4. Associations Between Carotid Artery LRNC Volume Progression and Baseline Clinical Markers. ... 213
Table 6.5. Associations Between the Progression of Carotid Artery LRNC Volume and Clinical Markers. ... 214
Table S6.1. Receiver-Operating Characteristic Analyses in Predicting Carotid Artery LRNC Progression. ... 217
Chapitre 7 Table 7.1. Characteristics of the Population According to VO2max Progression. ... 232
LISTE DES FIGURES Introduction
Figure 1. Morphologie de la paroi artérielle. ... 3
Figure 2. Effets des forces hémodynamiques sur les fonctions endothéliales. ... 7
Figure 3. Initiation de l’athérosclérose. ... 9
Figure 4. Épaississement pathologique de l’intima. ... 12
Figure 5. Lésion fibroathéromateuse. ... 13
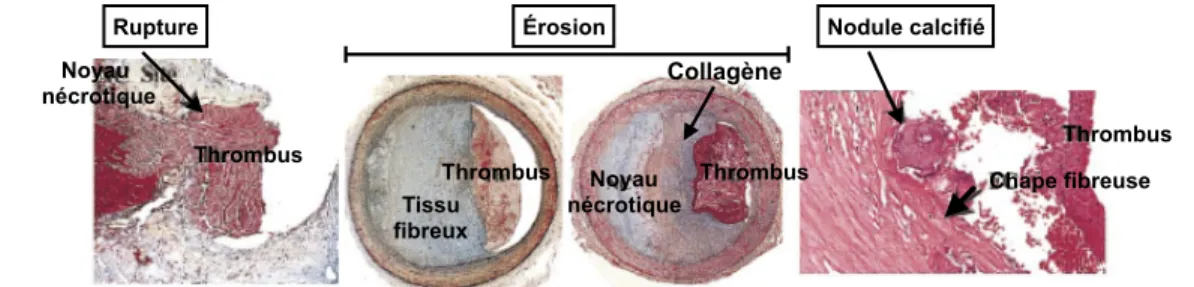
Figure 6. Déstabilisation de la plaque d’athérosclérose. ... 14
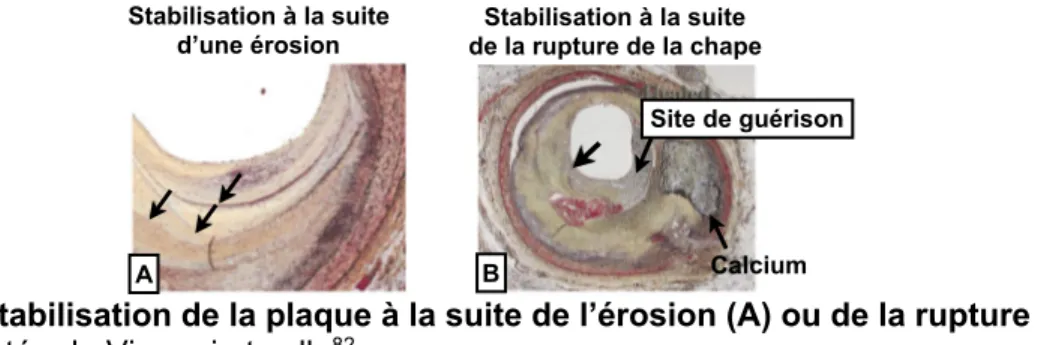
Figure 7. Stabilisation de la plaque à la suite de l’érosion (A) ou de la rupture (B). ... 17
Figure 8. Remodelage positif de la paroi artérielle – phénomène de Glagov. ... 18
Figure 9. Impacts hémodynamiques de la sténose sur la progression de la lésion. ... 19
Figure 10. Lipoprotéines athérogènes. ... 28
Figure 11. Lipoprotéines plasmatiques. ... 29
Figure 12. Adiposité abdominale évaluée par IRM. ... 36
Figure 13. Gras cardiaque évalué par IRM. ... 36
Figure 14. Activité physique et composition corporelle. ... 40
Figure 15. Angiographie coronarienne. ... 43
Figure 16. Tomographie par cohérence optique de l’artère coronaire gauche. ... 44
Figure 17. IVUS avec histologie virtuelle d’une artère coronaire. ... 45
Figure 18. L’effet de B0 sur l’orientation des spins des 1H. ... 46
Figure 19. L’effet de B1 sur la magnétisation. ... 46
Figure 20. Effets du temps d’écho et du temps de répétition sur le signal d’IRM. ... 48
Figure 21. Formation des contrastes à l’IRM. ... 48
Figure 22. Validation de l’IRM intravasculaire au niveau de l’artère iliaque. ... 50
Figure 23. Appareil d’IRM non invasive. ... 51
Figure 24. Exemple d’une plaque d’athérosclérose coronarienne rompue à l’IRM. ... 52
Figure 25. Plaque coronarienne rompue à la tomodensitométrie combinée à la TEP. ... 52
Figure 26. Épaisseur de l’intima média de l’artère carotide. ... 55
Figure 27. Caractérisation tissulaire de l’artère carotide par IRM. ... 57
Chapitre 1 Figure 1.1. Schematic Diagram of the Carotid Artery Coverage by Magnetic Resonance Imaging. ... 85
Figure 1.2. (a) Number of ST-Segment Elevation Myocardial Infarction (STEMI) Participants in Each Category of the Modified Coronary Artery Surgery Study (CASS)-50 Score; (b) Number of Chronic Stable Angina (CSA) Participants in Each Category of the Modified CASS-50 Score. ... 86
Chapitre 2 Figure 2.1. Schema of the Carotid Artery Coverage by the Magnetic Resonance Imaging Protocol. ... 104
Figure 2.2. Prevalence of Carotid Atherosclerosis Across 4 Groups of Men Exhibiting Graded Clinical CAD Risk, in the Total (A); Common (B); and Internal (C) Carotid Segments. ... 105
Figure 2.3. Maximum Wall Thickness Across 4 Groups of Men Exhibiting Graded Clinical CAD Risk, in the Total (A); Common (B); and Internal (C) Carotid Segments. ... 106
Figure 2.4. Carotid Wall Volume Across 4 Groups of Men Exhibiting Graded Clinical CAD Risk, in the Total (A); Common (B); and Internal (C) Carotid Segments. ... 107
Figure 2.5. Normalized Wall Index Across 4 Groups of Men Exhibiting Graded Clinical CAD Risk, in the Total (A); Common (B); and Internal (C) Carotid Segments. ... 108
Figure 2.6. Receiver-Operating Characteristic Curves for Carotid Atherosclerosis Burden Markers in the Identification of Clinical Chronic CAD (A); Acute CAD (B); and Global CAD (Chronic or Acute) (C). ... 109
Chapitre 3
Figure 3.1. Examples of Carotid Atherosclerosis Tissue Features Analysis. ... 129 Figure 3.2. Carotid Lipid-Rich Necrotic Core (LRNC) Volume According to Clinical
Coronary Risk. ... 129 Figure 3.3. Associations Between the Presence of Clinical Coronary Artery Disease and Carotid Atherosclerosis Features. ... 130
Chapitre 4
Figure 4.1. Schematic Diagram of Carotid Coverage by Magnetic Resonance Imaging. 163 Figure 4.2. Associations Between the Hypertriglyceridemic Waist and Cardiovascular Risk Factors (A) or Adipose Tissues (B). ... 164 Figure 4.3. Association Between the Hypertriglyceridemic Waist and Carotid
Atherosclerosis or Coronary Artery Disease. ... 165
Chapitre 5
Figure 5.1. Adipose Tissue Measurements by Magnetic Resonance Imaging. ... 190 Figure 5.2. Example of Carotid Artery Lipid-Rich Necrotic Core. ... 190
Chapitre 6
Figure 6.1. The Progression of the Carotid Artery Wall Volume (A), Lumen Volume (B), Normalized Wall Index (C), Lipid-Rich Necrotic Core (LRNC) Volume (D), Loose Fibrous Matrix (LMX) Volume (E), and Calcification Volume (F) According to Physical Activity Status. ... 215 Figure 6.2. Progression of Carotid Artery LRNC Volume According to Physical Activity Status and VAT Progression. ... 216
Chapitre 7
Figure 7.1. Example of the Burden of the Lipid-Rich Necrotic Core (Yellow) and the Fibrous Tissue (Purple) in the Common Carotid Artery Before and After 1 Year of Regular Physical Activity. ... 235 Figure 7.2. VO2max Progression According to Tertiles of VO2max Progression. ... 235
Figure 7.3. Associations Between VO2max Progression and the Change of the Proportion
of Atherosclerosis Tissue Features in the Common Carotid, When Adjusted for Baseline Traditional Risk Factors: (A) Percentage of LRNC; (B) Percentage of Loose Fibrous
Matrix; and (C) Percentage of Calcification. ... 236 Figure 7.4. Associations Between VO2max Progression and the Change of the Proportion
of Atherosclerosis Tissue Features in the Internal Carotid, When Adjusted for Baseline Traditional Risk Factors: (A) Percentage of LRNC; (B) Percentage of Loose Fibrous
LISTE DES ABRÉVIATIONS
ACC : American College of Cardiology
ACE : Enzyme de conversion de l’angiotensine (Angiotensin-converting enzyme) AHA : American Heart Association
Apo : Apolipoprotéine
ARB : Antagonistes des récepteurs de l’angiotensine II (Angiotensin II receptor blockers) AUC : Aire sous la courbe (Area under the curve)
AVC : Accident vasculaire cérébral B0 : Champ magnétique principal
B1 : Impulsion de radiofréquence
BB : Sang noir (Black blood)
BP : Pression artérielle (Blood pressure) C : Cholestérol
CABG : Pontage aorto-coronarien (Coronary artery bypass graft) CAC : Score calcique coronarien (Coronary artery calcium score) CAD : Maladie coronarienne (Coronary artery disease)
CAS : Carotid Atherosclerosis Score CASS : Coronary Artery Surgery Study
CCA : Artère carotide commune (Common carotid artery) CE : Ester de cholestérol (Cholesterol ester)
CETP : Protéine de transfert du cholestérol estérifié (Cholesteryl ester transfert protein) CI : Intervalle de confiance (Confidence interval)
CIMT : Épaisseur de l’intima média de la carotide (Carotid intima-media thickness) CSA : Angine chronique stable (Chronic stable angina)
CT : Tomodensitométrie (Computerized tomography) CVD : Maladie cardiovasculaire (Cardiovascular disease) D : Dimension
ECA : Carotide externe (External carotid artery) ECG : Électrocardiogramme
eNOS : Oxyde nitrique synthase de l’endothélium (Endothelial nitric oxide synthase) FRS : Score de risque de Framingham (Framingham Risk Score)
FRQS : Fonds de recherche du Québec – Santé
HDL : Lipoprotéine à haute densité (High-density lipoprotein) HMG-CoA : Hydroxyméthylglutaryl-CoA réductase
HTGL : Triglycéride lipase hépatique (Hepatic triglyceride lipase) HTGW : Taille hypertriglycéridémiante (Hypertriglyceridemic waist) HU : Unité Hounsfield (Hounsfield unit)
ICA : Artère carotide interne (Internal carotid artery)
ICAM-1 : Molécule d’adhésion intercellulaire-1 (Intercellular adhesion molecule-1) IDL : Lipoprotéine intermédiaire (Intermediate density lipoprotein)
IMC (BMI) : Indice de masse corporelle (Body mass index) IPH : Hémorragie intraplaque (Intraplaque hemorrhage) IQR : Étendue interquartile (Interquartile range)
IRM (MRI) : Imagerie par résonance magnétique (Magnetic resonance imaging) IVUS : Ultrasons intravasculaires (Intravascular ultrasounds)
JV : Veine jugulaire (Jugular vein)
LAD : Coronaire antérieure gauche descendante (Left anterior descending artery) LCx : Coronaire circonflexe (Left circumflex)
LDL : Lipoprotéine à faible densité (Low-density lipoprotein) LICA : Laboratoire d’imagerie cardiovasculaire avancée LMCA : Coronaire gauche (Left main coronary artery)
LMX : Matrice fibreuse lâche (Loose fibrous matrix) Lp(a) : Lipoprotéine (a)
LPL : Lipoprotéine lipase
LRNC : Noyau nécrotique riche en lipides (Lipid-rich necrotic core) METs : Équivalents métaboliques (Metabolic equivalents)
MCP-1 : Protéine chimioattractante des monocytes-1 (Monocyte chemoattractant protein-1)
MMP : Métalloprotéinase matricielle (Matrix metalloproteinase)
NF-κB : Facteur de transcription nucléaire kappa B (Nuclear factor-kappa B) NLI : Index de lumière normalisé (Normalized lumen index)
NO : Oxyde nitrique (Nitric oxide)
NPV : Valeur prédictive négative (Negative predictive value) NRI : Index de reclassification net (Net reclassification index)
NSTEMI : Infarctus du myocarde sans élévation du segment ST (Non-ST-segment elevation myocardial infarction)
NWI : Index de paroi normalisé (Normalized wall index) OR : Odds ratio
PDA : Coronaire postérieure descendante (Posterior descending artery) PDAY : Pathobiological Determinants of Atherosclerosis in Youth
PDGF : Facteur de croissance dérivé des plaquettes (Platelet-derived growth factor) PDW : Séquence pondérée en densité protonique (Proton density weighted)
PL : Coronaire postéro latérale (Posterolateral)
PPV : Valeur prédictive positive (Positive predictive value) PROCAM : Prospective Cardiovascular Münster Heart Study RCA : Coronaire droite (Right coronary artery)
RF : Facteurs de risque (Risk factors)
ROC : Caractéristique de fonctionnement du récepteur (Receiver operating characteristic) ROS : Dérivés réactifs de l’oxygène (Reactive oxygen species)
SAT : Gras sous-cutané abdominal (Subcutaneous abdominal adipose tissue) SCORE : Systematic COronary Risk Evaluation
STEMI : Infarctus du myocarde avec élévation du segment ST (ST-segment elevation myocardial infarction)
TC : Cholestérol total (Total cholesterol) TE : Temps d’écho
TEP : Tomographie par émission de positrons TG : Triglycérides
TGF-β : Facteur de croissance transformant bêta (Transforming growth factor beta) TOF : Séquence temps de vol (Time-of-flight)
TR : Temps de répétition TSE : Turbo spin echo
T1W : Séquence pondérée en T1 (T1-weighted) T2W : Séquence pondérée en T2 (T2-weighted)
VAT : Gras abdominal viscéral (Visceral abdominal adipose tissue)
VCAM-1 : Molécule d’adhésion cellulaire vasculaire-1 (Vascular cell adhesion molecule-1) VEGF : Facteur de croissance endothélial vasculaire (Vascular endothelial growth factor) VL : Volume de la lumière (Lumen volume)
VLDL : Lipoprotéine à très faible densité (Very low-density lipoprotein) VOW : Volume du vaisseau (Volume of the outer wall)
VVW : Volume de la paroi (Volume of the vessel wall)
REMERCIEMENTS
Mes premières pensées vont à mon directeur de recherche, le Dr Eric Larose. Il y a près de 4 ans, je contactais le Dr Larose pour lui témoigner mon intérêt à réaliser des études graduées dans son laboratoire ; 60 minutes plus tard, c’était pour moi une importante collaboration qui débutait. La réalisation de ma maîtrise et de mon doctorat dans son laboratoire est une expérience très enrichissante. Le Dr Larose est un exemple de rigueur et ses réflexions m’ont toujours amenée à me dépasser et m’ont permis de comprendre l’importance « de polir chaque papier comme un diamant ». Je le remercie sincèrement de croire en moi et de m’appuyer dans mes projets.
Mes travaux de doctorat n’auraient pu être réalisés sans l’importante collaboration de mon codirecteur, le Dr Jean-Pierre Després. J’admire la passion qu’il témoigne pour la recherche, mais surtout sa profonde détermination à améliorer la santé de notre population. Sa vision et ses commentaires réfléchis ont permis d’éclairer les zones grises de mes travaux et je lui suis réellement reconnaissante.
Je tiens à souligner l’importante implication de Karine Bibeau, sans qui la réalisation de cette thèse n’aurait pas été possible. Sa rigueur, son dévouement et sa disponibilité pour les étudiants sont des atouts très précieux pour le laboratoire. Je tiens aussi à remercier le Dr Philippe Pibarot et le Dr Olivier F. Bertrand pour leurs conseils et leur franchise scientifique qui ont su améliorer la qualité de mes travaux et m’ont permis d’améliorer mon autocritique. Merci au Dr Benoit Arsenault pour ses précieux conseils et sa grande collaboration ; sa passion pour la recherche est contagieuse. Je souhaite également remercier le Dr Richard Larivière pour la confiance qu’il m’a accordée en me permettant de réaliser un passage accéléré devancé de la maîtrise au doctorat, ainsi qu’au directeur de programme, le Dr Jacques Couët. Merci au Centre de recherche de l’Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval, et à son directeur, le Dr Denis Richard, de permettre aux étudiants de travailler dans un milieu aussi stimulant. Je suis également très reconnaissante envers les Fonds de recherche du Québec – Santé (FRQS) et la Faculté de médecine de l’Université Laval pour leurs financements continus tout au long de mes études graduées.
Merci à tous les membres des équipes du Dr Larose et du Dr Després : François Coulombe, Nathalie Mercier, Michèle Cyr, Julie Carange, Nadya Fortier, Valérie Lévesque, Véronic Tremblay, Natalie Alméras, Denise Huppé, ainsi qu’aux professionnels de recherche et aux technologues d’imagerie qui ont rendu possible la réalisation des projets intégrés dans cette thèse. Je remercie aussi les participants qui se sont portés volontaires pour participer aux projets de recherche et qui ont rendu possible la réalisation de cette thèse.
Un gros merci à ma famille – Janique, Marc, Daniel, Raphaëlle, Éric, Zita, Francine, France et Marius – de m’avoir toujours appuyée et encouragée dans mes projets et d’avoir été là pour moi, de près ou de loin. Merci à mes amis – Gab, Jacinthe et toute la gang de Sherbrooke – votre soutien n’a tout simplement pas de prix ! Enfin, merci à mon conjoint Jessy de m’encourager sans relâche dans mes projets et d’être présent depuis le début de mon aventure universitaire, laquelle est loin d’être terminée!
Nothing really changes; it is only our perspective of things that changes. Raymond Y. Kwong
À Marius
AVANT-PROPOS
Cette thèse de doctorat présente les travaux de recherche que j’ai réalisés sous la direction du Dr Eric Larose et du Dr Jean-Pierre Després. Elle est présentée à la Faculté des études supérieures de l’Université Laval sous la forme d’insertion d’articles.
Dans un premier temps, l’introduction décrit la problématique de la maladie cardiovasculaire, ainsi que l’important fardeau de la maladie coronarienne. La morphologie de la paroi artérielle et les fonctions de ses constituants sont présentées, suivies du processus de développement de l’athérosclérose, avant de s’intéresser à la survenue des évènements coronariens et aux principaux facteurs de risque traditionnels et non traditionnels. Les différentes méthodes d’imagerie permettant l’évaluation de l’athérosclérose coronarienne sont ensuite abordées, et conduisent à l’importance de l’artère carotide dans l’évaluation du risque coronarien. Les chapitres 1 à 7 présentent le fruit de mes travaux de doctorat sous la forme de manuscrits originaux rédigés en anglais dont je suis l’auteure principale. Ces manuscrits sont présentés tels que publiés ou soumis dans des revues scientifiques avec comité de révision par les pairs. Cette thèse se termine par une discussion des principaux résultats, situant la pertinence de ces travaux dans l’étude et la prévention de la maladie athérosclérotique.
Les manuscrits inclus dans cette thèse présentent les résultats d’études cliniques dirigées par mon directeur de recherche, le Dr Eric Larose, et par mon codirecteur, le Dr Jean-Pierre Després. Le Dr Larose et le Dr Després sont les chercheurs principaux de chacune des études présentées, et sont responsables de l’élaboration et de la conduite de ces projets de recherche. Ils ont été étroitement impliqués dans l’analyse statistique, la rédaction, la révision et l’approbation finale de chacun des manuscrits présentés. Les contributions respectives des autres coauteurs sont précisées pour chacun des articles.
Le chapitre 1 reproduit l’intégral de l’article « Carotid versus Coronary Atherosclerosis Burdens in Acute Compared with Chronic Symptomatic Coronary Artery Disease » par
Stéphanie LeBlanc, Karine Bibeau, Olivier F. Bertrand, Valérie Lévesque, Béatrice
Deschênes Saint-Pierre, Philippe Pibarot, Jean-Pierre Després et Eric Larose. Cet article a été publié le 8 mai 2017, dans le Canadian Journal of Physiology and Pharmacology (doi : dx.doi.org/10.1139/cjpp-2016-0588). Karine Bibeau et moi-même avons réalisé les
analyses statistiques et interprété les résultats. J’ai rédigé le manuscrit et assuré la révision des versions ultérieures. Olivier F. Bertrand et Philippe Pibarot ont contribué aux choix des analyses statistiques, à l’interprétation des résultats et à la révision du manuscrit. Valérie Lévesque et Béatrice Deschênes Saint-Pierre ont contribué à la révision du manuscrit.
Le chapitre 2 reproduit l’intégral de l’article « Carotid Atherosclerosis Burden by Magnetic Resonance Discriminates Clinical Coronary Artery Disease Risk » par Stéphanie LeBlanc, Karine Bibeau, François Coulombe, Olivier F. Bertrand, Philippe Pibarot, Jean-Pierre Després et Eric Larose. Cet article est en révision dans le European Heart Journal — Cardiovascular Imaging, ayant été soumis le 27 février 2018. J’ai réalisé les analyses statistiques, interprété les résultats, rédigé le manuscrit et assuré la révision des versions ultérieures. François Coulombe, Karine Bibeau, Olivier F. Bertrand et Philippe Pibarot ont contribué aux choix des analyses statistiques, à l’interprétation des résultats et à la révision du manuscrit.
Le chapitre 3 reproduit l’intégral de l’article « Carotid Artery Atherosclerosis Composition by Magnetic Resonance Imaging and Coronary Artery Disease Risk » par Stéphanie LeBlanc, François Coulombe, Karine Bibeau, Olivier F. Bertrand, Philippe Pibarot, Jean-Pierre Després et Eric Larose. Cet article est en révision dans le journal Atherosclerosis, ayant été soumis le 22 mai 2018. J’ai procédé aux analyses statistiques, interprété les résultats, rédigé le manuscrit et assuré la révision des versions ultérieures. François Coulombe, Karine Bibeau, Olivier F. Bertrand et Philippe Pibarot ont contribué aux choix des analyses statistiques, à l’interprétation des résultats et à la révision du manuscrit.
Le chapitre 4 reproduit l’intégral de l’article « Hypertriglyceridemic Waist: A Simple Marker of High-Risk Atherosclerosis Features Associated with Excess Visceral Adiposity/Ectopic Fat » par Stéphanie LeBlanc, François Coulombe, Olivier F. Bertrand, Karine Bibeau, Philippe Pibarot, André Marette, Natalie Alméras, Isabelle Lemieux, Jean-Pierre Després et Eric Larose. Cet article est publié dans le Journal of the American Heart Association (doi : 10.1161/JAHA.117.008139), ayant été accepté le 22 mars 2018. J’ai réalisé les analyses statistiques, interprété les résultats, rédigé le manuscrit et assuré la révision des versions ultérieures. François Coulombe, Karine Bibeau, Olivier F. Bertrand, Philippe Pibarot,
André Marette, Natalie Alméras et Isabelle Lemieux ont contribué aux choix des analyses statistiques, à l’interprétation des résultats et à la révision du manuscrit.
Le chapitre 5 reproduit l’intégral de l’article « Visceral Adiposity, a Key Factor in Differences of Atherosclerosis Burden and Composition Between Women and Men. Evidence from a Magnetic Resonance/Cardiometabolic Risk Study » par Stéphanie LeBlanc, François Coulombe, Karine Bibeau, Olivier F. Bertrand, Philippe Pibarot, Jean-Pierre Després et Eric Larose. Cet article est en révision par les coauteurs. J’ai exécuté les analyses statistiques, interprété les résultats, rédigé le manuscrit et assuré la révision des versions ultérieures. François Coulombe, Karine Bibeau, Olivier F. Bertrand et Philippe Pibarot ont contribué aux choix des analyses statistiques, à l’interprétation des résultats et à la révision du manuscrit.
Le chapitre 6 reproduit l’intégral de l’article « The Natural Process of Carotid Atherosclerosis Progression in Asymptomatic Young Men and Women: 3-Year Follow-Up Study » par
Stéphanie LeBlanc, François Coulombe, Karine Bibeau, Olivier F. Bertrand,
Philippe Pibarot, Jean-Pierre Després et Eric Larose. Cet article est en révision par les coauteurs. J’ai réalisé les analyses statistiques et François Coulombe et moi-même avons interprété les résultats. J’ai ensuite rédigé le manuscrit et assuré la révision des versions ultérieures. Karine Bibeau, Olivier F. Bertrand et Philippe Pibarot ont contribué aux choix des analyses statistiques, à l’interprétation des résultats et à la révision du manuscrit.
Le chapitre 7 reproduit l’intégral de l’article « Regular Physical Activity and Carotid Atherosclerosis Tissue Features of Coronary Men: 1-Year Interventional Study » par
Stéphanie LeBlanc, François Coulombe, Valérie Lévesque, Karine Bibeau, Olivier F.
Bertrand, Philippe Pibarot, Jean-Pierre Després et Eric Larose. Cet article est en révision par les coauteurs. J’ai réalisé les analyses statistiques, interprété les résultats, rédigé le manuscrit et assuré la révision des versions ultérieures. Karine Bibeau, Olivier F. Bertrand et Philippe Pibarot ont contribué aux choix des analyses statistiques, à l’interprétation des résultats et à la révision du manuscrit. François Coulombe et Valérie Lévesque ont contribué à la révision du manuscrit.
INTRODUCTION
1.1 Maladie cardiovasculaire : définition et étiologie
La maladie cardiovasculaire demeure au premier rang des maladies les plus mortelles à l’échelle mondiale depuis plusieurs décennies 1, 2. Au Canada, elle représente le tiers de
l’ensemble des décès 3. L’importante prévalence de la maladie cardiovasculaire observée
aujourd’hui est en partie causée par les changements de notre mode de vie au cours des dernières décennies, découlant de l’industrialisation, de l’urbanisation et de la transition économique 4. Ces changements ont favorisé l’augmentation de la sédentarité et l’arrivée
de produits alimentaires transformés, en plus d’être associés à un taux croissant de tabagisme 2. Diverses campagnes ont été mises en place afin d’améliorer les habitudes de
vie de la population et la cessation tabagique a été le point de mire des agences de santé publique durant les dernières années. Entre 2005 et 2015, la prévalence du tabagisme est passée de 20,9 à 15,1 % aux États-Unis, ce qui représente une nette amélioration 5. On ne
peut toutefois pas en dire autant pour les habitudes alimentaires et le niveau d’activité physique. La proportion d’Américains ayant une saine alimentation peine à dépasser 1 % 6.
D’un autre côté, bien que la pratique d’activité physique rapportée par la population ait augmenté durant les dernières années (la proportion d’individus se disant actifs frôle maintenant 50 % 6, 7), la mesure objective de cette activité physique révèle que seulement
15 % des Canadiens sont suffisamment actifs, réalisant au minimum 150 minutes par semaine d’activité physique à une intensité modérée 7. Ces faits ne sont pas sans
conséquence. Au Canada, la prévalence de l’obésité, définie par un indice de masse corporelle (IMC) ≥ 30 kg/m2, se situait à 9,5 % en 1975, alors qu’en 2016, elle a franchi le
cap du 31 % ; une proportion deux fois plus importante que la moyenne mondiale 8. Qui plus
est, entre 1960 et 2000, l’obésité abdominale, définie par un tour de taille ≥ 102 cm chez les hommes et ≥ 88 cm chez les femmes, a triplé chez les Américains, passant de 12,7 à 38,3 % chez les hommes et de 19,4 à 59,9 % chez les femmes, ce qui représente une augmentation moyenne du tour de taille de 10 cm chez les hommes et de près de 20 cm chez les femmes 9. L’obésité, et l’obésité abdominale en particulier, augmente le risque de souffrir
d’une maladie cardiovasculaire 10. Ainsi, ces bouleversements se sont traduits par une
augmentation de 40 % des décès liés à la maladie cardiovasculaire entre 1990 et 2013 11,
générant des conséquences majeures sur le système de santé. Associées à un lourd fardeau socioéconomique, la morbidité et les hospitalisations liées à la maladie cardiovasculaire ont coûté en 2009 plus de 22,2 milliards de dollars au Canada 3, soulignant
La maladie cardiovasculaire se caractérise par une affection du cœur et des vaisseaux sanguins, générant diverses manifestations cliniques, les plus courantes étant celles causées par l’athérosclérose 6. L’athérosclérose se caractérise par un épaississement
asymétrique de la paroi artérielle, découlant d’une accumulation de lipides, de débris nécrotiques, de calcium, d’hémorragie et de tissu fibreux 12. Dans les artères qui irriguent le
cerveau, l’athérosclérose est responsable d’ischémies cérébrales transitoires et d’accidents vasculaires cérébraux (AVC), alors que dans les artères coronaires, elle demeure la principale cause des infarctus du myocarde et de l’angine de poitrine 13, 14. Parmi l’ensemble
des maladies cardiovasculaires, les affections cérébrovasculaires et coronariennes demeurent de loin les plus préjudiciables 6. Au Canada, la maladie cérébrovasculaire est
responsable de 6,5 % de la mortalité, générant des coûts annuels de plus de 3 milliards de dollars 3. Or, bien que cette prévalence soit élevée, elle demeure largement inférieure à
l’important fardeau associé à la maladie coronarienne, laquelle est responsable de 17,3 % de l’ensemble des décès, générant des coûts annuels surpassant les 8 milliards de dollars 3.
Ainsi, la maladie coronarienne demeure la première cause de mortalité chez les hommes et chez les femmes 6. Puisque l’athérosclérose se développe silencieusement durant plusieurs
années, il n’est pas rare que sa première manifestation clinique soit l’infarctus du myocarde ou la mort subite 15. Dans les années 1950, la communauté scientifique a été surprise
d’observer une prévalence d’athérosclérose coronarienne dépassant 70 % chez les soldats américains décédés lors de la guerre de Corée, pour qui l’athérosclérose était jusqu’alors inconnue 16. Dans les années 1970, on a rapporté que près de la moitié des soldats décédés
lors de la guerre du Vietnam présentait une sténose coronarienne, alors que le tiers avait de l’athérosclérose dans plus d’un vaisseau 17. Dans les années 1990, on a observé une
prévalence d’athérosclérose coronarienne de 78 % chez de jeunes adultes décédés de causes d’origines non cardiaques 18. Bien que les populations étudiées et les méthodes
d’investigation puissent être à l’origine de cette variabilité quant à la prévalence rapportée, il n’en demeure pas moins que le problème est très préoccupant. Une étude récente réalisée in vivo rapporte une prévalence de l’athérosclérose de plus de 60 % chez une population de moins de 55 ans, malgré l’absence de signes cliniques 19. Afin de prévenir
l’athérosclérose, il est nécessaire de comprendre son étiologie. Les prochaines sections font le survol de la morphologie artérielle et des fonctions de ses constituants, pour ensuite traiter du développement de l’athérosclérose.
1.2 Morphologie et physiologie artérielle
Les premières études du système cardiovasculaire datent du 1er siècle, lorsque Galen
rapporta que les artères et les veines étaient distinctes 20. En 1628, William Harvey publiait
ses travaux sur la circulation sanguine et par la suite, plusieurs scientifiques documentèrent les connexions entre les artères, les veines et les capillaires 20. Ce n’est qu’en 1839 que
Theodor Schwann décrivit la présence d’une mince membrane dans les capillaires séparant le sang des tissus, que Wilhelm His nomma endothélium vasculaire en 1865 14, 20. Grâce
aux nombreux travaux cumulés jusqu’à aujourd’hui, il est maintenant bien connu que le système cardiovasculaire est composé de plusieurs vaisseaux, lesquels sont structurés de façon à favoriser l’homéostasie de l’organisme et répondre rapidement aux changements auxquels celui-ci doit faire face. Ayant pour origine le cœur, les artères sont les vaisseaux qui ont l’important rôle de distribuer le sang dans tout le corps. Ainsi, les artères élastiques émergeant du cœur se divisent en artères musculaires afin d’irriguer les différentes régions de l’organisme 21. Comme l’illustre la Figure 1, l’artère se compose de trois couches : 1)
l’intima, constituée de cellules endothéliales, de tissu subendothélial et de la limitante élastique interne ; 2) la média, formée de cellules musculaires lisses et de la limitante élastique externe ; et 3) l’adventice, composée de tissu conjonctif, intercalé de fibroblastes et de cellules musculaires lisses 22-24. Ces constituants occupent des rôles essentiels dans
le maintien de l’homéostasie vasculaire.
Figure 1. Morphologie de la paroi artérielle.
Figure adaptée de Libby, Ridker et Hansson 25. La figure n’est pas à l’échelle.
1.2.1 Structure artérielle
1.2.1.1 Tunique interne – intima
L’intima est la couche interne de l’artère, en contact direct avec le flux sanguin. Elle est composée d’une monocouche de cellules endothéliales (endothélium), d’une membrane
basale (tissu subendothélial) et d’une couche de tissu élastique (limitante élastique interne) 21, 23, 24. L’endothélium tapisse la face interne du système cardiovasculaire, étant
normalement le seul tissu en contact avec le sang 21. De ce fait, il est grandement impliqué
dans l’homéostasie vasculaire 21. Par conséquent, l’endothélium présente une perméabilité
sélective, en plus de participer au maintien de l’équilibre entre les éléments vasodilatateurs, dont l’oxyde nitrique (NO), et les éléments vasoconstricteurs, dont l’endothéline 26, grâce à
la transduction des signaux biomécaniques. En effet, les forces hémodynamiques agissant sur la surface interne de la paroi sont détectées par les cellules endothéliales et transmises aux autres composants de la paroi, permettant une réponse rapide aux changements du milieu 21, 27, 28. Les cellules endothéliales sécrètent également plusieurs composants de la
matrice extracellulaire, laquelle forme la structure du vaisseau, dont le collagène, les protéoglycanes et l’élastine 22, 23, 29, 30. De plus, l’endothélium contribue à la régulation de
l’angiogenèse, à la croissance cellulaire et à la prolifération des cellules musculaires lisses vasculaires 30. Il est aussi impliqué dans les mécanismes de défense immunitaire, ayant la
capacité de libérer des cytokines et des chémokines 26, 27. Enfin, cette structure participe
aux réponses procoagulantes et prothrombotiques, en plus d’influencer l’équilibre entre les inhibiteurs et les activateurs plaquettaires, permettant de prévenir, dans une certaine mesure, la formation d’un thrombus occlusif 27. La présence d’une dysfonction endothéliale
peut donc avoir d’importantes répercussions sur le système vasculaire. La couche sous-jacente à l’endothélium, composée du tissu subendothélial et de la limitante élastique interne, a été beaucoup moins étudiée. Cette couche est plus épaisse que l’endothélium et est constituée d’une couche musculo-élastique, composée de cellules musculaires lisses, de fibres élastiques et de collagène 23, 25. Globalement, l’intima est mince, étant 10 fois plus
mince que sa voisine la média 23.
1.2.1.2 Tunique moyenne – média
La média est composée de cellules musculaires lisses, intégrées dans une matrice extracellulaire, et de la limitante élastique externe, laquelle est composée de tissu élastique 22, 25. Les cellules musculaires lisses demeurent la principale composante de la
média et leurs cycles de contraction/relaxation permettent de contrôler la pression artérielle et le flux sanguin 26. La configuration de la média favorise une régulation efficace de la
vasodilatation et de la vasoconstriction du vaisseau. En effet, les fibres élastiques et le tissu musculaire lisse de la média sont organisés en anneaux autour de la lumière artérielle 21.
vaisseau, sont orientés dans la même direction que la force de tension induite sur la paroi 31.
Les neurones du système nerveux autonome sympathique innervent les cellules musculaires lisses de la média. Ainsi, lors d’une diminution de la stimulation sympathique, ou encore en présence de certaines substances chimiques dont le NO, les cellules musculaires lisses se relâchent et le diamètre du vaisseau augmente, entraînant une vasodilatation 21. Au contraire, lors d’une augmentation de la stimulation sympathique, elles
se contractent, générant une vasoconstriction 21. Enfin, les cellules musculaires lisses
participent également à l’élaboration de la matrice extracellulaire, sécrétant une grande proportion de ses composants 26, 32. Néanmoins, dans certaines conditions pathologiques,
dont l’athérosclérose, les cellules musculaires lisses de la paroi vasculaire peuvent évoluer d’un phénotype contractile à un phénotype synthétique et l’on observe alors une production excessive de la matrice extracellulaire, contribuant au remodelage artériel 26, 32.
1.2.1.3 Tunique externe – adventice
L’adventice est la couche externe de l’artère. Elle est composée de tissu conjonctif et inclut des fibres de collagène, des mastocytes et des fibroblastes, de même que des cellules musculaires lisses, des cellules inflammatoires, des terminaisons nerveuses et des
vasa-vasorum 22, 25, 33, 34. Les vasa-vasorum sont des microvaisseaux, constituant une structure
vasculaire complète, qui ont pour fonction d’irriguer la paroi externe du vaisseau et la média 26, 33. Néanmoins, les fibroblastes demeurent le principal constituant de l’adventice,
jouant un rôle essentiel dans le maintien de la structure artérielle, notamment par la synthèse de collagène 32, 34. En présence d’un stress ou d’une lésion vasculaire, les cellules
de l’adventice seraient les premières activées afin d’influencer le tonus du vaisseau, initier et maintenir l’inflammation vasculaire et stimuler l’expansion des vasa-vasorum et la prolifération cellulaire 34. Ainsi, l’adventice est impliquée dans la structure, mais aussi dans
l’homéostasie artérielle.
1.2.2 Artères élastiques et artères musculaires
Bien que toutes les artères possèdent une intima, une média et une adventice, la proportion occupée par ces différentes couches varie, permettant de distinguer trois types d’artères : les artères élastiques, musculaires et transitoires 32. Les artères élastiques présentent un
grand diamètre (> 1 cm) puisque leur média est composée d’une grande proportion de fibres élastiques (p. ex. aorte, carotide commune) 21. Ces artères ont une paroi assez mince par
rapport à leur diamètre total, puisque la limitante élastique interne est fenestrée et la limitante élastique externe est mince 21, 26. La média des artères élastiques présente des
couches cylindriques de tissu élastique en alternance avec des anneaux de cellules musculaires lisses, favorisant la propulsion du sang lorsque les ventricules cardiaques se relâchent 21, 26. Les artères musculaires sont de taille moyenne et présentent un diamètre
variant de 0,1 à 10 mm (p. ex. artères coronaires, artères cérébrales) 21. En comparaison
aux artères élastiques, la média des artères musculaires contient plus de cellules musculaires lisses et moins de fibres élastiques 21. Les artères musculaires présentent donc
une plus grande capacité de vasoconstriction et de vasodilatation 21. Enfin, les artères
transitoires démontrent à la fois des caractéristiques des artères musculaires et des artères élastiques (p. ex. artère carotide externe) 32.
En somme, les artères sont dotées d’une configuration qui favorise une modulation efficace de la vasoconstriction et de la vasodilatation, permettant de remplir leur rôle premier qui est de distribuer le sang en provenance du cœur dans tout l’organisme. La prochaine section présente les mécanismes d’adaptation que présente la paroi artérielle et qui lui permettent de faire face aux altérations des contraintes hémodynamiques. Cette section mettra en lumière l’importance de cette dynamique sur le risque de dysfonction endothéliale et ultimement, le développement de l’athérosclérose.
1.3 Épaississement de la paroi artérielle : de l’adaptatif au pathologique
La pression artérielle et le flux sanguin pulsatile, c’est-à-dire variant selon les pulsations cardiaques, soumettent l’endothélium à plusieurs contraintes hémodynamiques, parmi lesquelles on compte la pression hydrostatique, l’étirement cyclique et les forces de cisaillement 14, 35. Les cellules endothéliales et les cellules musculaires lisses constituant la
paroi vasculaire présentent des récepteurs permettant de détecter et de répondre à ces contraintes (Figure 2) 36. De plus, les jonctions cellulaires et les composants de la matrice
extracellulaire participent à la transmission des forces hémodynamiques 14, 36-38. Cette
Figure 2. Effets des forces hémodynamiques sur les fonctions endothéliales.
ROS : dérivés réactifs de l’oxygène ; eNOS : oxyde nitrique synthase de l’endothélium. Figure adaptée de Creager, Beckman et Loscalzo 14.
1.3.1 Contraintes hémodynamiques
Pression hydrostatique. La pression hydrostatique est la pression que le sang exerce sur la paroi des vaisseaux. Étant proportionnel au diamètre artériel, le gradient de pression pulsatile se situe entre 120 et 100 mmHg dans l’aorte et entre 0 et 30 mmHg dans la microcirculation 14, 35. Cette force agit sur la structure artérielle puisque son augmentation
engendre l’hypertrophie des cellules musculaires lisses, en plus d’être associée à l’augmentation de la quantité de la matrice extracellulaire composant la paroi du vaisseau 36.
Ainsi, l’augmentation de la pression hydrostatique engendre ultimement l’épaississement de la paroi 23, 39-42. Puisque le stress exercé sur la paroi est le résultat de sa tension divisée
par son épaisseur, un épaississement de la paroi permet effectivement de réduire le stress subit par celle-ci 43. L’épaississement généré est donc un processus adaptatif et
l’hypertrophie des cellules musculaires lisses se développe lorsque la tension atteint un seuil critique, n’étant pas la cause de l’hypertension, mais sa conséquence 36.
Étirement cyclique. L’étirement cyclique est une force perpendiculaire à la paroi artérielle, se caractérisant par la déformation circonférentielle de la paroi, associée à la distension et la relaxation de celle-ci au cours du cycle cardiaque 14, 35, 44. La contrainte cyclique est
d’environ 2 % dans l’aorte et peut dépasser 30 % en présence d’hypertension 14, 35. Alors
d’étirement, une déformation trop importante amène celles-ci à s’orienter parallèlement à cette force, réduisant la résistance mécanique de l’endothélium 14, 45. De plus, des
contraintes cycliques élevées augmentent l’expression de la matrice métalloprotéinase (MMP), une enzyme protéolytique qui dégrade la membrane basale et interstitielle, et sont donc impliquées dans le processus de remodelage artériel 44.
Forces de cisaillement. Les forces de cisaillement sont les contraintes de friction exercées par le flux sanguin sur les cellules endothéliales, le niveau optimal se situant entre 10 et 25 dynes/cm214, 46. Considérant la viscosité sanguine constante, les forces de cisaillement
sont surtout régulées par le flux sanguin et le diamètre de la lumière artérielle 47, 48. Une
modification des forces de cisaillement induites sur la paroi artérielle influence la balance entre la synthèse de la matrice extracellulaire par les cellules musculaires lisses et sa dégradation par la MMP 37, 49, 50. Ainsi, alors que des forces de cisaillement élevées induisent
un élargissement de la lumière artérielle – un processus qualifié de remodelage positif 46, 50
– de faibles forces de cisaillement favorisent l’épaississement de la paroi artérielle et la diminution de la lumière artérielle – un remodelage dit négatif 51, 52. Les forces de
cisaillement sont donc grandement impliquées dans le remodelage artériel et éventuellement dans le développement de l’athérosclérose.
1.3.1.1 Contraintes de cisaillement et remodelage adaptatif
Les forces hémodynamiques induites sur les cellules de la paroi vasculaire influencent plusieurs activités cellulaires. Notamment, la diminution des contraintes de cisaillement est associée à la réduction de la production de NO et à l’augmentation de la production d’endothéline-1, du facteur de croissance endothéliale vasculaire (VEGF) et du facteur de croissance dérivé des plaquettes (PDGF), lesquels favorisent la migration, la différenciation et la prolifération des cellules musculaires lisses vasculaires 26, 32, 49, 53, 54. Ainsi, la réduction
des forces de cisaillement peut amorcer l’épaississement artériel via un changement dans la distribution et la fonction des cellulaires musculaires lisses vasculaires. Toutefois, ce changement hémodynamique n’affecte pas seulement les cellules musculaires lisses. En présence de faibles forces de cisaillement, une augmentation de l’agrégation plaquettaire est également observée 50 et dans cet environnement, les cellules endothéliales deviennent
dysfonctionnelles et apoptotiques, favorisant l’infiltration de lipoprotéines à faible densité (LDL) – des macromolécules transportant les lipides dans le plasma sanguin 50, 55, 56.
Lorsque les particules LDL ont franchi la couche de cellules endothéliales, elles sont sujettes à l’oxydation, stimulant davantage la prolifération des cellules musculaires lisses et la synthèse de la matrice extracellulaire, dont la production de protéoglycanes 50, 57-59. Cet
environnement favorise l’instauration d’un milieu inflammatoire, notamment à cause de l’activation du facteur de transcription nucléaire kappa B (NF-kB) 53, 54. En effet, le NF-kB
régule l’expression des molécules inflammatoires et des molécules d’adhésion, dont la protéine chimioattractante des monocypes-1 (MCP-1) et la molécule d’adhésion cellulaire vasculaire-1 (VCAM-1) 53, 54. Ces molécules favorisent alors le recrutement de leucocytes
mononucléaires, dont les monocytes et les lymphocytes T, lesquels migrent ensuite dans l’intima 32, 60-62. Lorsqu’ils sont dans l’intima, les leucocytes évoluent en macrophages 60 et
l’ingestion de particules LDL oxydées les transforme en cellules spumeuses (Figure 3) 25, 60. Ces dernières sont grandement impliquées dans le développement de l’athérosclérose.
Figure 3. Initiation de l’athérosclérose.
VCAM-1 : molécule d’adhésion cellulaire vasculaire-1 ; LDL : lipoprotéine à faible densité ; oxLDL : LDL oxydée. Figure adaptée de Libby, Ridker et Hansson 25, Arsenault, Bourgeois
et Mathieu 63 et McLaren et coll. 64. La figure n’est pas à l’échelle.
Lors du processus d’épaississement adaptatif, les cellules musculaires lisses peuvent augmenter en nombre (hyperplasie) ou en grosseur (hypertrophie) 32. L’hyperplasie se
caractérise par l’augmentation de la division cellulaire menant à l’accumulation uniforme de cellules ayant des caractéristiques de cellules musculaires lisses ou de microfibroblastes, en l’absence d’accumulation lipidique 31. À l’inverse, l’hypertrophie fibromusculaire se
caractérise par une augmentation de la grosseur des cellules musculaires lisses, pouvant être accompagnée d’une petite accumulation de lipides 31. L’épaississement adaptatif de
l’intima peut se présenter sous une forme diffuse ou excentrique 24. L’épaississement diffus