16. Takeda S, Elefteriou F, Levasseur R, et al. Leptin regulates bone formation via the sympathetic nervous system. Cell 2002 ; 111 : 305-17.
17. Rhee SH, Pothoulakis C, Mayer EA. Principles and clinical implications of the brain-gut-enteric microbiota axis. Nat Rev Gastroenterol Hepatol 2009 ; 6 : 306-14.
18. Obradovic MMS, Hamelin B, Manevski N, et al. Glucocorticoids promote breast cancer metastasis. Nature 2019 ; 567 : 540-4.
10. Venkataramani V, Tanev DI, Strahle C, et al. Glutamatergic synaptic input to glioma cells drives brain tumour progression. Nature 2019 ; 573 : 532-8. 11. Zeng Q, Michael IP, Zhang P, et al. Synaptic proximity
enables NMDAR signalling to promote brain metastasis. Nature 2019 ; 573 : 526-31. 12. Venkatesh HS, Morishita W, Geraghty AC, et al.
Electrical and synaptic integration of glioma into neural circuits. Nature 2019 ; 573 : 539-45. 13. Mauffrey P, Tchitchek N, Barroca V, et al. Progenitors
from the central nervous system drive neurogenesis in cancer. Nature 2019 ; 569 : 672-8.
14. Ming GL, Song H. Adult neurogenesis in the mammalian brain: significant answers and significant questions. Neuron 2011 ; 70 : 687-702.
15. Engblom C, Pfirschke C, Zilionis R, et al. Osteoblasts remotely supply lung tumors with cancer-promoting SiglecFhigh neutrophils. Science 2017 ; 358 :
doi:10.1126/science.aal5081. RÉFÉRENCES
6. Peterson SC, Eberl M, Vagnozzi AN, et al. Basal cell carcinoma preferentially arises from stem cells within hair follicle and mechanosensory niches. Cell Stem Cell 2015 ; 16 : 400-12.
7. Hayakawa Y, Sakitani K, Konishi M, et al. Nerve growth factor promotes gastrictumorigenesis through aberrant cholinergic signaling. Cancer Cell 2017 ; 31 : 21-34.
8. Stopczynski RE, Normolle DP, Hartman DJ, et al. Neuroplastic changes occur early in the development of pancreatic ductal adenocarcinoma. Cancer Res 2014 ; 74 : 1718-27.
9. Shao JX, Wang B, Yao YN, et al. Autonomic nervous infiltration positively correlates with pathological risk grading and poor prognosis in patients with lung adenocarcinoma. Thorac Cancer 2016 ; 7 : 588-98.
Inserm U932, section recherche, Institut Curie, 26 rue d’Ulm, 75005 Paris, France.
marine.gros@curie.fr marianne.burbage@curie.fr Réponses anti-tumorales et stratégies
actuelles d’immunothérapie
Si elle repose sur des intuitions scien-tifiques anciennes, l’immunothérapie s’impose depuis une dizaine d’années comme un changement majeur de para-digme dans le traitement des cancers. Contrairement aux approches de radio-thérapie et chimioradio-thérapie tradition-nellement employées, elle ne repose pas sur la destruction directe des cel-lules cancéreuses, mais sur la poten-tialisation des réponses immunitaires dirigées contre la tumeur. Un nombre important de médicaments immuno-thérapeutiques actuellement mis sur le marché vise à lever les « freins molécu-laires » (« checkpoints » PD-1, PD-L1 ou CTLA-4) exercés par les tumeurs sur les lymphocytes T CD8+,et à restaurer ainsi la capacité cytotoxique de ces
cellules effectrices
de l’immunité [1]
(➜).
L’acquisition des
propriétés anti-tumorales de ces lympho-cytes résulte de la reconnaissance, à la surface des cellules dendritiques (den-dritic cells, DC), d’un complexe molécu-laire constitué de peptides antigéniques enchâssés dans des molécules du com-plexe majeur d’histocompatibilité (CMH) de classe I. Dans le cas d’antigènes tumo-raux, d’origine exogène puisqu’issus des cellules cancéreuses, la formation d’un tel complexe découle d’un processus intracel-lulaire fondamental, appelé présentation croisée1, spécifique d’une sous-population
1 La présentation croisée (cross-presentation) désigne une
voie d’apprêtement (processing) des antigènes internalisés, propre aux cellules dendritiques, qui permet leur dégradation, leur transport, et leur assemblage avec les molécules du CMH-I.
de cellules dendritiques, les cellules cDC1 (conventional type 1 dendritic cells).
La présentation croisée de l’antigène comme support de l’immunité anti-tumorale
L’utilisation de souris dépourvues de cDC1 ou porteuses de cDC1 incapables de réali-ser la présentation croisée des antigènes a démontré l’importance de ces cellules dans l’initiation de réponses anti-tumo-rales protectrices [2, 3]. Dans cette sous-population spécialisée de cellules dendri-tiques, la présentation croisée s’effectue exclusivement selon la voie intracellulaire dite « cytosolique » [4] : à la suite de leur endocytose, les antigènes tumoraux internalisés sont exportés dans le cytosol où ils sont dégradés par le protéasome. Les peptides ainsi générés sont ensuite importés dans différents compartiments
La méthylation des ARNm,
une nouvelle modalité
de régulation de la présentation
croisée des antigènes
de cellules tumorales
Marine Gros, Marianne BurbageNOUVELLE
(➜) Voir la Synthèse de M. Dubois et al., m/s n° 12, décembre 2019, page 937
m/s n° 5, vol. 36, mai 2020
NOUVELLES
MAGAZINE
443
gènes par ces protéases et promeut par conséquent la présentation croisée de l’antigène par ces cellules. Les cDC1 disposent également d’un riche arsenal moléculaire, dont la NADPH oxydase NOX2 constitue le fer de lance, en vue de contrôler l’activité des enzymes protéo-lytiques in situ. NOX2, qui est recrutée à la membrane de l’endo/phagosome par l’intermédiaire de la protéine Rac2 spécifiquement dans les cDC1, contribue au maintien d’un pH alcalin dans ce compartiment subcellulaire et y limite ainsi l’activation des protéases et la destruction des épitopes antigéniques
[6] (Figure 1). Récemment, les
tra-vaux de l’équipe dirigée par Chuan He ont enrichi notre compréhension de ce paramètre clé pour l’efficacité de la présentation croisée, en identifiant un mécanisme de contrôle traductionnel des protéases du lysosome, régulé par la protéine YTHDF13.
3 YTH N6-methyladenosine (m6A) RNA-binding protein 1. cellules immunitaires : les cellules
den-dritiques, spécialisées pour la présenta-tion croisée, et les macrophages, large-ment incompétents pour cette fonction. Dans les macrophages, l’abondance de protéases dans les lysosomes favorise la dégradation des microorganismes pathogènes, mais détruit également
certains épitopes antigéniques2. En
revanche, dans les cellules dendritiques et à plus forte raison dans les cDC1, une protéolyse modérée préserve les antigènes et facilite leur engagement ultérieur dans les voies de présenta-tion croisée [5]. Cette propriété des cDC1 est finement contrôlée à diffé-rents niveaux cellulaires et molécu-laires. Ainsi, la sous-expression du fac-teur de transcription TFEB (transcription factor EB) dans les cDC1 restreint la synthèse des protéases du lysosome, ce qui limite la dégradation des anti-2 L’épitope désigne le fragment de l’antigène reconnu par les
lymphocytes T au sein du complexe CMH-I/peptide.
(réticulum endoplasmique, endo/phago-somes), où ils s’associent aux molécules du CMH-I. Les complexes CMH-I/pep-tides sont enfin exportés à la membrane plasmique, lieu de leur interaction avec les lymphocytes T CD8+ cytotoxiques. Le déroulement de chacune des étapes de ce mécanisme intracellulaire complexe paraît être contrôlé par de nombreux paramètres. Si certains demeurent obs-curs, la dégradation ménagée des anti-gènes, opérée spécifiquement par les cDC1, semble constituer l’une des bases moléculaires de la capacité de présenta-tion croisée propre à ces cellules.
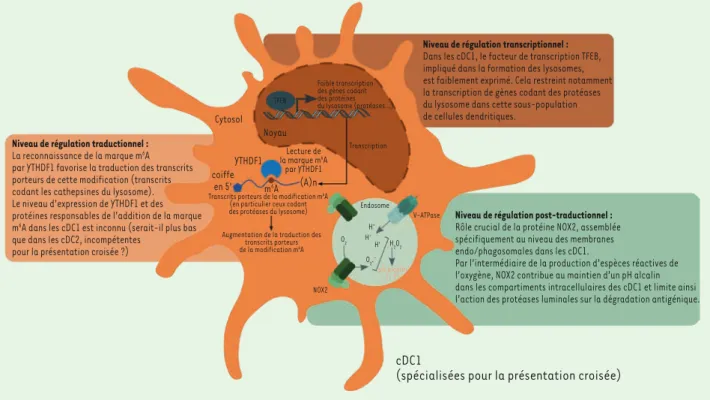
Limitation du potentiel de dégradation des compartiments intracellulaires dans les cDC1
L’existence d’un lien entre intensité de la protéolyse dans les compartiments intracellulaires et efficacité de la pré-sentation antigénique a été suggérée au début des années 2000, grâce à la comparaison de deux populations de
Niveau de régulation traductionnel : La reconnaissance de la marque m6A
par YTHDF1 favorise la traduction des transcrits porteurs de cette modification (transcrits codant les cathepsines du lysosome). Le niveau d’expression de YTHDF1 et des protéines responsables de l’addition de la marque m6A dans les cDC1 est inconnu (serait-il plus bas
que dans les cDC2, incompétentes pour la présentation croisée ?)
Niveau de régulation post-traductionnel : Rôle crucial de la protéine NOX2, assemblée spécifiquement au niveau des membranes endo/phagosomales dans les cDC1.
Par l’intermédiaire de la production d’espèces réactives de l’oxygène, NOX2 contribue au maintien d’un pH alcalin dans les compartiments intracellulaires des cDC1 et limite ainsi l’action des protéases luminales sur la dégradation antigénique.
cDC1
(spécialisées pour la présentation croisée) Niveau de régulation transcriptionnel :
Dans les cDC1, le facteur de transcription TFEB, impliqué dans la formation des lysosomes, est faiblement exprimé. Cela restreint notamment la transcription de gènes codant des protéases du lysosome dans cette sous-population de cellules dendritiques. Cytosol Noyau YTHDF1 coiffe en 5' m6A (A)n Lecture de la marque m6A par YTHDF1
Transcrits porteurs de la modification m6A
(en particulier ceux codant des protéases du lysosome) Augmentation de la traduction des
transcrits porteurs de la modification m6A V-ATPase Endosome O2 H+ H+ H+ H2O2 O2.– pH alcalin (= 7) NOX2 Transcription TFEB Faible transcription des gènes codant des protéines du lysosome (protéases…)
Figure 1. Niveaux de régulation du potentiel de dégradation des compartiments intracellulaires dans les cDC1. Les cDC1 limitent la dégradation des antigènes au sein des compartiments d’endocytose par le contrôle transcriptionnel, traductionnel et post-traductionnel de la synthèse et de l’activité des protéases du lysosome. A(n) : queue poly-A.
tion » ont commencé à éclairer l’importance de la méthylation des ARNm dans de nombreux pro-cessus physiologiques. L’une de ces études, menée par le groupe de Chuan He, a apporté un nouvel éclairage sur l’im-portance de la lecture de la méthylation des ARNm par YTHDF1 dans la régulation des réponses immunitaires anti-tumo-rales [11].
Pour commencer, les auteurs injectent à des souris des cellules de deux lignées tumorales murines connues (lignée de mélanome B16-OVA ou d’adénocarcinome du côlon MC38), suivent la croissance du volume tumoral au cours du temps, et constatent que cette croissance tumorale est moins rapide chez les ani-maux génétiquement déficients pour
YTHDF1 (souris Ythdf1-/-) que chez
les animaux témoins. En utilisant des anticorps induisant une déplétion de certaines populations immunitaires, ils montrent ensuite que cette amé-lioration dépend des lymphocytes T CD8+. Pour quantifier la réponse anti-tumorale, les auteurs s’appuient sur la lignée tumorale B16-OVA, dans laquelle l’antigène modèle ovalbumine est surexprimé. Les tumeurs des souris Ythdf1-/- contiennent plus de lympho-cytes T CD8+ spécifiques de l’ovalbu-mine que celles portées par des souris témoins. Pour tester à quel moment cette différence apparaît, les auteurs prélèvent le ganglion lymphatique drai-nant le site tumoral six jours après l’injection des cellules tumorales, soit avant que les tumeurs ne deviennent visibles, et y détectent, chez les souris Ythdf1-/-, une forte augmentation du fication, majoritairement près du codon
stop et dans la région 3’ non codante, participe au contrôle de la stabilité des ARNm et de l’efficacité de leur traduc-tion [8]. Cependant, malgré une grande homologie, les trois protéines lectrices YTHDF n’interprètent pas cette modifi-cation de la même manière et exercent des fonctions distinctes dans le contrôle de la traduction. En effet, la liaison de YTHDF1 à l’ARNm méthylé favorise la synthèse protéique grâce au recrute-ment des complexes de traduction [9], tandis qu’YTHDF2 diminue la stabilité des transcrits méthylés en adressant les ARNm vers des complexes de dégrada-tion [10] (Figure 2). Quant à la protéine YTHDF3, elle semble agir avec YTHDF1 ou YTHDF2 à des moments distincts en vue de la réalisation de l’une ou l’autre des fonctions précédemment citées. Plusieurs travaux récents fondés sur des approches du type « perte de
fonc-La méthylation de l’ARNm, une forme particulière de régulation post-transcriptionnelle
Tout comme l’ADN, l’ARN messager (ARNm) peut être la cible de diverses modifications de ses nucléotides consti-tutifs, permettant un contrôle très fin de l’expression des gènes et de la synthèse des protéines. Chez les mammifères, la modification la plus fréquente est l’ad-dition d’un groupement méthyle en posi-tion 6 des résidus adénosine (m6A), qui est observée sur environ 25 % des ARNm [7]. Effectuée au fur et à mesure de la transcription par des protéines dites « d’écriture » (comme METTL3 [methyl-transferase-like 3]), la méthylation des adénosines est interprétée par des protéines « lectrices » (comme YTHDF1, YTHDF2 et YTHDF3), et peut être suppri-mée par des protéines « d’effacement » (comme la déméthylase ALKHB5 [alkB homolog 5]). La présence de cette
modi-Cytosol Protéine « lectrice » YTHDF3 Protéine « lectrice » YTHDF1 coiffe en 5' coiffe en 5' m6A m6A (A)n (A)n
Recrutement des complexes eIF d’initiation de la traduction Augmentation de la traduction
des transcrits méthylés
Protéine « lectrice » YTHDF3 Protéine « lectrice » YTHDF2
Dégradation des transcrits méthylés
Noyau
Réticulum endoplasmique
Figure 2. Les protéines lectrices YTHDF1, YTHDF2 et YTHDF3 modulent la stabilité des ARNm porteurs de la modifi-cation m6A de manière différentielle.
m/s n° 5, vol. 36, mai 2020
NOUVELLES
MAGAZINE
445 Régulation de la présentation croisée
par la méthylation des ARNm
Afin d’identifier les sites de l’ARNm aux-quels YTHDF1 est lié, les auteurs réalisent ensuite des expériences de précipitation des ARNm suivies d’un séquençage à haut débit (RIP-seq). En parallèle, ils comparent les niveaux d’ARNm porteurs d’adénosines méthylées et l’efficacité de mesurer la présentation d’un peptide
dérivé de l’ovalbumine sur le CMH-I, et trouvent que les DC provenant des souris Ythdf1-/- présentent davantage de pep-tides à leur surface que les DC des souris témoins. Ces résultats indiquent que YTHDF1 module l’efficacité de la présen-tation croisée de l’antigène tumoral par les cellules dendritiques.
nombre de lymphocytes T CD8+ activés par un peptide dérivé de l’ovalbumine. Cette observation suggère l’existence d’une activation plus efficace des lym-phocytes T CD8+ en l’absence de YTHDF1, et conduit les auteurs à s’interroger sur la contribution de cette protéine à la présentation d’antigènes par les DC. Ils utilisent alors un anticorps permettant
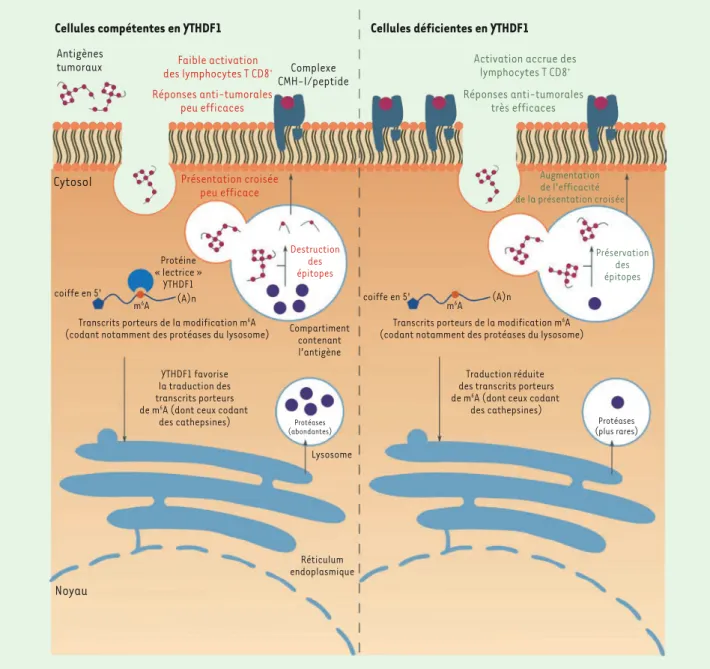
Cellules compétentes en YTHDF1 Cellules déficientes en YTHDF1 Antigènes
tumoraux des lymphocytes T CD8Faible activation +
Réponses anti-tumorales peu efficaces
Complexe CMH-I/peptide
Cytosol Présentation croisée
peu efficace Protéine « lectrice » YTHDF1 coiffe en 5' m6A (A)n Destruction des épitopes
Transcrits porteurs de la modification m6A
(codant notamment des protéases du lysosome) Compartimentcontenant l’antigène YTHDF1 favorise
la traduction des transcrits porteurs de m6A (dont ceux codant
des cathepsines) Lysosome Protéases (abondantes) Réticulum endoplasmique Noyau
Activation accrue des
lymphocytes T CD8+ Réponses anti-tumorales très efficaces Augmentation de l’efficacité de la présentation croisée Préservation des épitopes coiffe en 5' m6A (A)n
Transcrits porteurs de la modification m6A
(codant notamment des protéases du lysosome) Traduction réduite des transcrits porteurs de m6A (dont ceux codant
des cathepsines)
Protéases (plus rares)
Figure 3. La lecture de la modification m6A des ARNm par YTHDF1 module l’efficacité de la présentation antigénique croisée et des réponses
anti-tumorales. Après leur endocytose, les antigènes tumoraux sont partiellement dégradés au sein des compartiments intracellulaires des cellules dendritiques par les cathepsines. Dans les cellules dendritiques déficientes en YTHDF1, la traduction des transcrits codant ces cathepsines est réduite, ce qui conduit à une préservation des épitopes antigéniques. Ces épitopes sont alors présentés plus efficacement aux lymphocytes T CD8+
m/s n° 5, vol. 36, mai 2020
446
2. Hildner K, Edelson BT, Purtha WE, et al. Batf3 deficiency reveals a critical role for CD8α+ dendritic
cells in cytotoxic T cell immunity. Science 2008 ; 322 : 1097-100.
3. Alloatti A, Rookhuizen DC, Joannas L, et al. Critical role for Sec22b-dependent antigen cross-presentation in antitumor immunity. J Exp Med 2017 ; 214 : 2231-41.
4. Segura E, Albiston AL, Wicks IP, et al. Different cross-presentation pathways in steady-state and inflammatory dendritic cells. Proc Natl Acad Sci USA 2009 ; 106 : 20377-81.
5. Dudziak D, Kamphorst AO, Heidkamp GF, et al. Differential antigen processing by dendritic cell subsets in vivo. Science 2007 ; 315 : 107-11. 6. Savina A, Jancic C, Hugues S, et al. NOX2 controls
phagosomal pH to regulate antigen processing during crosspresentation by dendritic cells. Cell 2006 ; 126 : 205-18.
7. Zhang C, Fu J, Zhou Y. A review in research progress concerning m6A methylation and immunoregulation. Front Immunol 2019 ; 10 : 922.
8. Meyer KD, Jaffrey SR. Rethinking m6A readers,
writers, and erasers. Annu Rev Cell Dev Biol 2017 ; 33 : 319-42.
9. Wang X, Zhao BS, Roundtree IA, et al. N6-methyladenosine modulates messenger RNA
translation efficiency. Cell 2015 ; 161 : 1388-99. 10. Wang X, Lu Z, Gomez A, et al. N6
-methyladenosine-dependent regulation of messenger RNA stability. Nature 2014 ; 505 : 117-20.
11. Han D, Liu J, Chen C, et al. Anti-tumour immunity controlled through mRNA m6A methylation and
YTHDF1 in dendritic cells. Nature 2019 ; 566 : 270-4. cellulaires des cDC1 pourrait, au moins
en partie, s’expliquer par une expression réduite de YTHDF1, à l’origine d’une plus faible traduction des transcrits codant des protéases du lysosome. Par ailleurs, il est également envisageable que cette sous-population de DC exprime davan-tage YTHDF2 et dégrade donc plus active-ment ces transcrits. Si elles s’avèrent véri-fiées expérimentalement, ces hypothèses pourraient ouvrir la voie à un ciblage thérapeutique des protéines YTHDF1 et YTHDF2 afin d’améliorer la capacité des cellules dendritiques à déclencher les réponses anti-tumorales. ‡
mRNA methylation regulates cross-presentation of tumor-derived antigens
LIENS D’INTÉRÊT
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
RÉFÉRENCES
1. Dubois M, Ardin C, André F, et al. L’immunothérapie, une révolution en oncologie. Revue de l’efficacité des inhibiteurs de points de contrôle immunitaire. Med Sci (Paris) 2019 ; 35 : 937-45.
de leur traduction dans des DC de souris Ythdf1-/- et de souris témoins. En croisant les informations apportées par ces diffé-rentes approches, il apparaît que dans les DC, YTHDF1 promeut la traduction de divers ARNm, dont plusieurs codent des protéines du lysosome, en particulier des cathepsines. Ainsi, dans les DC privées de YTHDF1, les ARNm codant ces protéases sont moins traduits, ce qui rend les lyso-somes moins capables de dégradation protéique extensive. Les antigènes tumo-raux ainsi préservés sont présentés plus efficacement aux lymphocytes T CD8+, ce qui se traduit par une amélioration des réponses anti-tumorales (Figure 3). Ces résultats démontrent l’existence d’un niveau supplémentaire de contrôle de la présentation croisée des antigènes. À cet égard, l’analyse des niveaux d’expression de YTHDF1 et YTHDF2 dans les différentes populations de DC enrichirait certaine-ment notre compréhension des bases moléculaires de la spécialisation fonc-tionnelle des cDC1 pour la présentation croisée. En effet, la protéolyse modérée observée dans les compartiments
intra-m/s n° 4, vol. 36, avril 2020
NOUVELLES
MAGAZINE
335
LIENS D’INTÉ RÊT
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
RÉFÉRENCES
1. Krammer F, Smith GJD, Fouchier RAM, et al. Influenza. Nat Rev Dis Primers 2018 ; 4 : 3.
2. Organisation Mondiale de la Santé. 2018 ; https:// www.who.int/fr/news-room/fact-sheets/detail/ influenza-(seasonal)
3. Te Velthuis AJ, Fodor E. Influenza virus RNA polymerase: insights into the mechanisms of viral RNA synthesis. Nat Rev Microbiol 2016 ; 14 : 479-93.
4. Lowen AC. Constraints, drivers, and implications of influenza A virus reassortment. Annu Rev Virol 2017 ; 4 : 105-21.
5. White MC, Lowen AC. Implications of segment mismatch for influenza A virus evolution. J Gen Virol 2018 ; 99 : 3-16.
6. Chen KY, Santos Afonso ED, Enouf V, et al. Influenza virus polymerase subunits co-evolve to ensure proper levels of dimerization of the heterotrimer. PLoS Pathog 2019 ; 15 : e1008034.
7. Chang S, Sun D, Liang H, et al. Cryo-EM structure of influenza virus RNA polymerase complex at 4.3 Å resolution. Mol Cell 2015 ; 57 : 925-35.
8. Fan H, Walker AP, Carrique L, et al. Structures of influenza A virus RNA polymerase offer insight into viral genome replication. Nature 2019 ; 573 : 287-90.
9. Peng Q, Liu Y, Peng R, et al. Structural insight into RNA synthesis by influenza D polymerase. Nat Microbiol 2019 ; 4 : 1750-9.
10. Cassonnet P, Rolloy C, Neveu G, et al. Benchmarking a luciferase complementation assay for detecting protein complexes. Nat Methods 2011 ; 8 : 990-2. ment fonctionnel. Enfin, nos résultats
indiquent que les sous-unités de la polymérase grippale co-évoluent pour assurer un niveau approprié de diméri-sation entre hétérotrimères, et que ce niveau de dimérisation, s’il n’est pas optimal, est l’un des facteurs pouvant restreindre les possibilités de réassor-timent génétique entre virus influenza. Alors que l’arsenal thérapeutique dont nous disposons pour lutter contre les virus influenza reste très insuffisant, le dimère de polymérase apparaît donc comme une nouvelle cible intéressante pour le développement de nouveaux composés anti-viraux. ‡
Dimerisation, a novel feature of the influenza virus RNA polymerase
REMERCIEMENTS
Nous remercions E. Dos Santos Afonso et V. Enouf (Institut Pasteur) pour leur contribution, E. Fodor et J. Grimes (Université d’Oxford) pour leur aide précieuse, R. Fouchier (Erasmus MC) et G. Brownlee (Université d’Oxford), B. Delmas (INRA), S. Munier, S. Behillil, S. van der Werf (Institut Pasteur), et T. Crépin (IBS Grenoble), pour le partage de réactifs et les discussions scientifiques.
tés homologues du virus PR8 (Figure 3C). Les mutations de réversion situées à l’interface de dimérisation réduisent le niveau de dimérisation en-dessous de celui mesuré pour la polymérase
sau-vage (Figure 3C), selon une tendance
inverse à celle observée dans le système « mini-génome » (Figure 3A).
La polymérase des virus influenza est une machine moléculaire d’une grande complexité. Sa capacité à répliquer et transcrire le génome viral selon des mécanismes bien distincts repose à la fois sur la flexibilité conformationelle de l’hétérotrimère et sur sa capacité d’oligomérisation. Nos résultats sont les premiers à établir, dans le contexte infectieux, l’importance fonctionnelle d’une interface de dimérisation révélée par cristallographie, et confortent le modèle selon lequel la formation du dimère active l’étape de synthèse de l’ARNv à partir de l’ARNc. Ils révèlent que le taux de dimérisation optimal varie en fonction du contexte génétique, et qu’un niveau trop élevé peut abou-tir à une réplication virale inefficace, ce qui pourrait signifier que le dimère doit être transitoire pour être
pleine-Q
u’est-ce que la guérison ? Des réponses, il y en a. De toutes sortes et de tout temps. Chacun y va de son savoir,religieux, scientifique, médical... Et de quoi est-on supposé guérir ? D’un symptôme, d’une douleur, d’une maladie, d’une répétition mortifère, d’un destin mélancolique ? Pour la psychanalyse, la guérison s’insère dans un système imaginaire et a, comme point de mire, un idéal. « La guérison, c’est une demande... » précise Lacan. Les auteurs nous invitent ici à découvrir, au-delà du semblant et à partir de la clinique, les liens entre guérison et vérité du sujet.
Comité éditorial de l’Association Psychanalyse et Médecine (APM) : Martine Dombrosky, Sophie Dunoyer de Segonzac, Houchang Guilyardi, Josette Olier, Betty Testud
BON DE COMMANDE
✂
À retourner à EDP Sciences, 17, avenue du Hoggar, 91944 Les Ulis Cedex Tél. : 01 49 85 60 69 - Fax : 01 49 85 03 45 - E-mail : francois.fl ori@edpsciences.org
NOM : ... Prénom : ... Adresse : ... Code postal : ...Ville : ... Pays : ... Fonction : ... Je souhaite recevoir
Qu’est-ce que la guérison pour la psychanalyse ? : 24 € + 3 € de port = 27 € TTC en ... exemplaire, soit un total de ... € ❒ Par chèque, à l’ordre de EDP Sciences ❒ Par carte bancaire : ❒ Visa ❒ Eurocard/Mastercard Carte n° ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘ ❘