ةيبعشلا ةيطارقميدلا ةيرئازجلا ةيروهمجلا
République Algérienne démocratique et Populaire يملعلا ثحبلاو يلاعلا ميلعتلا ةرازو
Ministère de l'Enseignement Supérieur et de la Recherche Scientifique
رضخل همح ديهشلا ةعماج
-يداولا
Université Echahid Hamma Lakhdar - El OUED ةايحلاو ةعيبطلا مولع ةيلك
Faculté des Sciences de la Nature et de Vie ةيئيزجو ةيولخ ايجولويب مسق
Département de Biologie Cellulaire et Moléculaire
MEMOIRE DE FIN D’ETUDE
En vue de l’obtention du diplôme de Master Académique en Sciences Biologiques
Spécialité : Toxicologie
THEME
Présentés Par :
Kebsa Imane et Moherm Messaouda Imane
Devant le jury composé de :
Président : Mr. ALIA Zaid (MCB) Université d’El Oued
Examinateur : Mr. CHOUIKH Atef (MCA) Université d’El Oued. Promoteur : Mr. ACILA Smail (MCB) Université d’El Oued.
Année universitaire 2019/2020
Effets du stress de l’aluminium (Al
3+) sur la germination
et quelques marqueurs physiologique et biochimique
des plantules de blé dur (
Triticum durum
Desf.)
Tout est poison et rien n'est sans
poison ; la dose seule fait que
quelque chose n'est pas un poison.
Remerciement
Avant tous nous remercions ALLAH tout puissant et miséricordieux qui nous a donné la force et la patience
d’accomplir cette étude.
En second lieu, nous tenons à remercier notre encadreur Monsieur ACILA Smail qui n'a pas cessé de nous donner les conseils et les
bonnes orientations et nous prive pas de son temps.
Nos vifs remerciements vont également aux membres du jury Mr. Alia et Mr.Chouikh Pour l’intérêt qu’ils ont porté à notre recherche
en acceptant d’examiner notre travail et de l’enrichir par leurs propositions.
Nous exprimons nos vifs remerciements à Monsieur DEROUICHES enseignant à la Faculté des Sciences de la Nature et de la vie pour
son aide et ses conseils tout au long de la réalisation de ce travail. Nous exprimons nos remerciements aussi a Mme KEBSA et Mr.BENOUR pour aide nous à compléter Notre travail dans
l'institut nationale Amamra bachir.
En fin, à tous ceux qui ont contribué de près ou de loin à la réalisation De ce travail. Ainsi qu’a l’ensemble des enseignants qui ont contribué à Notre formation qu’ils trouvent ici l’expression de
Dédicace
A Dieu Tout Puissant, d’avoir été mon guide pendant toutes ces années. Ce mémoire représente l’aboutissement du soutien et l’encouragement que mes parents m’ont prodigué tout au long de ma scolarité. Cru en moi
et m’avoir aidé à arriver là ou j’en suis ;
Merci pout tout.
À mes frères: BADREDDINE, BOUBAKER et LAKHDHAR et mes sœurs: KHADIDJA, AMANI et INESS.
À mon grand-père, ma grand-mère et ma tante A mes amis: NOUR, IMANE, CHAHRAZAD et AMIRA
IKRAM et KHANSSA.
A mon oncle ZAKARIA DEMDOUM qui m'a toujours aidé .
À mon oncle OMER SMAIL SADALLAH qui m'a
soutenu pour terminer le travail pratique malgré la pandémie du Corona .
DÉDICACE
Je dédie ce ce travail :
A Dieu qui m’a donné la
patience et la force pour la
réalisation de ce travail.
A mon père pour le soutien et la
stimulation morale.
A ma mère source de gentillesse,
l’exemple de tendresse et
patience.
A mes chères sœurs, Safa,
Marwa, Aya et Faisa pour leur
aide, et compréhension, à mes
frères Abd Allah et Adnane.
A mes amies, Messaouda Imane,
Djalila, Fatima Zohra Merci
d’être présentes dans ma vie.
A tous mes amies de l'université
et de spécialité Toxicologie, à tous
les gens qui m'admirent, je dis
merci pour tous.
RESUME
Dans le but d’évaluer l’impact du stress métallique au stade précoce de développement du blé dur (Triticum durum Desf.), une expérience de germination a été menée in vitro, sur des graines de blé dur, variété CIRTA, soumises à des concentrations croissantes, de solution de chlorure d’aluminium (AlCl3) : 0, 100, 300 et 600 mg/L. L'expérience s'est déroulée en température de 25 C◦ et en obscurité totale. Des critères de germination, et quelques marqueurs physiologiques et biochimiques des plantules de blé dur ont été étudiés. Les résultats obtenus ont confirmé que le stress d’aluminium n'a aucun effet notable sur le taux de germination des graines de blé (PG%). Tandis que l'effet des ions d’aluminium (Al3+) était significatif sur l'indice de vigueur des graines (SVI), notamment sous l'influence de fortes concentrations (300 et 600 mg/L) du stress métallique. Les résultats obtenus ont montré aussi une diminution significative du matériel de semence respiré (SMR). Alors qu’il y a une augmentation non significative a été enregistrée pour l'efficience du métabolisme des graines de blé (SME), notamment sous l’effet de forte concentration en AlCl3 (600 mg/L) dans le milieu. Les résultats obtenus démontrent l'effet stressant du chlorure d'aluminium sur la longueur des plantules (TSL) de blé dur. En effet, les radicules (RTL) étaient plus sensibles que les plumules (SHL), sous l'influence toxique des ions aluminium Al3+. Des résultats importants, le stress d'aluminium (Al3+) provoque une stimulation de l'activité du catalase (CAT) et une augmentation de la teneur en malondialdéhyde (MDA) de plumule et de radicule de plantule de blé dur. À la lumière des résultats obtenus, nous pouvons confirmer que l'élément d’aluminium (Al) a des effets nocifs sur la germination et la croissance des plantules de blé dur (Triticum durum Desf.), et que la variété CIRTA est relativement sensible au facteur de stress (Al3+).
Mots clés : Blé dur (Triticum Durum Desf.) ; Aluminium (Al3+) ; Mobilisation des réserves ; Croissance ; Stress oxydatif.
Abstract
In order to assess the impact of metallic stress at the early stage of durum wheat (Triticum durum Desf.) development, in vitro germination experiment was carried out, on durum wheat seeds, CIRTA variety, subjected to increasing concentrations of aluminum chloride solution (AlCl3): 0, 100, 300 and 600 mg / L. The experiment took place in temperature of 25 C◦ and in total darkness. Germination criteria, and some physiological and biochemical markers of durum wheat seedlings were studied. The obtained results confirmed that aluminum stress has no significant effect on the wheat seeds germination rate (PG%). While the effect of aluminum ions (Al3+) was significant on the seed vigor index (SVI), especially under the influence of high concentrations (300 and 600 mg / L) of metal stress. The obtained results also showed a significant decrease in seed material respired (SMR). While there is, a non-significant increase was recorded for the wheat seed metabolism efficiency (SME), especially under the effect of AlCl3 high concentration (600 mg / L) in the medium. The obtained results demonstrate the stressful effect of aluminum chloride on durum wheat seedling length (TSL). Indeed, the radicles (RTL) were more sensitive than plumules (SHL), under the toxic effect of aluminum ions Al3+. As important results, aluminum (Al3+) stress causes stimulation of catalase (CAT) activity and increased malondialdehyde (MDA) content of durum wheat seedling (plumule and radicle). Based on the obtained results, we can confirm that the aluminum (Al) has harmful effects on the germination and the durum wheat seedlings growth, and that the CIRTA variety is relatively sensitive to aluminum (Al3+) stress.
Key words: Durum wheat (Triticum Durum Desf.); Aluminum (Al3+); Reserves mobilization; Growth; Oxidative stress.
صخلملا
داهجلأا ريثأت مييقت فدهب
بلصلا حمقلا يمانت نم ةركبم ةلحرم يف يندعملا
(Triticum durum L.) ،فنصلا ،بلصلا حمقلا روذب ىلع ،ايربخم تابنلاا ةبرجت تيرجأ
CIRTAزيكارتب اهتلماعم تمت ،
موينمللأا ديرولك ليلاحم نم ةديازتم
) 3 (AlCl ( 0 ، 100 ، 300 و 600 .)ل/غلمةجرد يف ةبرجتلا تيرجأ
ةرارح
25
م
◦
تاردابل ةيئايميكويبلاو ةيجولويسفلا تارشؤملا ضعبو ،تابنلاا صئاصخ .مات ملاظ يفو
.اهتسارد مت بلصلا حمقلا
ىلع ركذي ريثأت يأ هل سيل موينمللأا داهجأ نأ ،اهيلع لصحتملا جئاتنلا تدكأ
حمقلا روذب تابنا ةبسن
(PG%) .موينمللأا تانويلأ نأ نيح يف
3+ Alرشؤم ىلع يونعم ريثأت
روذبلا ةوق
(
SVI)
ةيلاعلا زيكارتلا ريثأت تحت اصوصخ ،
( 300 و 600 )ل/غلم.يندعملا داهجلإل
جئاتنلا ترهظأ
ةذفنتسملا ةيرذبلا ةداملا ةيمك يونعم صقانت اضيأ اهيلع لصحتملا
(SMR)ةيونعم ريغ ةدايز كانه امنيب .
حمقلا روذب ضيأ ةءافك يف اهليجست مت
(SME) ،نم ىلعلأا زيكرتلا ريثأت تحت اصوصخ
3 AlCl ( 600 )ل/غلم.طسولا يف
لوط ىلع موينمللأا ديرولكل دهجملا ريثأتلا اضيأ ترهظأ اهيلع لصحتملا جئاتنلا
بلصلا حمقلا تارداب
(TSL) .تاريذجلا نأ امك
(RTL)تاقيوسلا نم ةيساسح رثكأ تناك
(SHL)
تحت ،
موينمللأا تانويلأ ماسلا ريثأتلا
3+ Al.
جئاتنك
،ةمهم
نا
داهجا
موينمللأا
) 3+ (Alثدحي
زيفحت
طاشنل
catalase (CAT)نم ىوتحملا يف ةدايزو
malondialdéhyde (MDA)تاقيوس يف
اريذجو
تارداب
.بلصلا حمقلا
موينمللأا رصنعل نأ دكأن نأ نكمي ،اهيلع لصحتملا جئاتنلا ءوض ىلع
(
Al)
ةراض راثآ
بلصلا حمقلا تارداب ومنو تابنا ىلع
(Triticum durum Desf.) ،
فنصلا نأو
CIRTAايبسن ساسح
داهجلاا لماعل
3+Al
.
:ةيحاتفملا تاملكلا
بلصلا حمقلا
Desf.) Triticum Durum ( ؛موينمللأا
) 3+ (Al؛تارخدملا ةيكرح ؛
.يدسكأتلا داهجلاا ؛ومنلا
Table des matières
Remerciement
Dédicaces
Liste des figures
Liste des tableaux
Liste des Abréviations
INTRODUCTION GENERALE
PARTIE I.: RAPPEL BIBLIOGRAPHIQUES
CHAPITRE I : PRESENTATION DE PLANTE ETUDIEE
I. Généralités sur le blé
05
I.1. Historique et l'origine génétique
05
I.2.Classification botanique
05
I.3. Description générale de la plante
06
I.4.cycle de développement du blé
06
I.5. Composition biochimique du blé dur
07
CHAPITRE II : LES ELEMENT TRASCE METALIQUE ET LES
VEGETAUX
II.1. Généralité sur les métaux lourds
10
II.2. Origine et phytodisponibilité des ETM
10
II.2.1. Origine
10
II.2.2. Phytodisponibilité
10
II.3. Toxicité des ETM sur les plantes
11
II.3.1. Les principaux effets des ETM sur les plantes
11
II.4. Le stress oxydatif
12
II.4.1. Les Espèces Réactives de l’Oxygène
13
II.4.1.2. Sources des espèces réactives de l'oxygène
14
II.4.1.3. Les conséquences moléculaires du stress oxydatif
15
II.4.1.3.1. L’oxydation des protéines
15
II.4.1.3.3. Les acides nucléique
16
II.4.2. Les antioxydants
17
II.4.2 .1. Antioxydants enzymatiques
17
II.4.2.1.1. Les superoxydes dismutases (SOD)
18
II.4.2.1.2. Les catalase (CAT)
19
II.4.2.1.3. Les peroxydases (GPx)
19
II.4.2.1.4. Le système thiorédoxine
19
II.4.2.2. Antioxydants non enzymatiques
20
II.4.2.2.1. L’ascorbate et L’α-tocopherol
20
II.4.2.2.2. Le glutathion
20
II.4.2.2.3. Les flavonoïdes
20
PARTIE II: ETUDE EXPERIMENTAL
Chapiter I: MATERIEL ET METHODES
I.1. Matériels
24
I.1.1.Matériel végétal
24
I.1.2.Conduite de l’essai
24
I.2. Méthodes d’étude
24
I.2.1. Paramètres de germination
24
I.2.1.1. Taux moyen de germination des graines (PG%)
24
I.2.1.2. Indice de vigueur des semences (SVI)
25
I.2.1.3. Pourcentage d'inhibition de germination et la vigueur des
semences
25
I.2.2. Mobilisation des réserves et l’efficience du métabolisme des
graines
25
I.2.3. Paramètres de croissance
26
I.2.3. 1. Longueur et poids sec de plumule, radicule et plantule
26
I.2.3.2. Pourcentage de Phytotoxicité sur la longueur de plumule,
radicule et plantule
26
I.2.4. Quelques caractéristiques biochimiques de plumule et
radicule
26
I.2.4.1. Dosage des activités enzymatiques
27
I.2.4.1.1. Préparation de l’extrait enzymatique
27
I.2.4.1.2. Dosage de l'activité de la catalase (CAT)
27
I.2.4.2. Détermination des indicateurs du stress oxydatif
28
I.2.4.2.1. Dosage du malondialdéhyde (MDA)
28
I.3. Analyse statistique
29
Chapitre II : RESULTATS ET DISCUSSTIONS
II.1. Résultats
31
II.1.1. Paramètres de germination
31
II.1.1.1. Taux moyen de germination des graines (PG%)
31
II.1.1.2. Indice de vigueur des semences (SVI)
32
II.1.1.3. Pourcentage d'inhibition de germination et la vigueur des
semences
32
II.1.2. Mobilisation des réserves et l’efficience du métabolisme des
graines
33
II.1.2.1. Matériel de semence respiré (SMR)
33
II.1.2.2. Efficience du métabolisme des graines (SME)
34
II.1.3. Paramètres de croissance
35
II.1.3. 1. Longueur de plumule, radicule et plantule de blé dur
35
II.1.3.2. Pourcentage de Phytotoxicité de chlorure d’aluminium
(AlCl
3) sur la longueur de plumule, de radicule et de plantule
36
II.1.4. Quelques caractéristiques biochimiques de plumule et
radicule de plantule de blé dur
37
II.1.4.1. Effet du chlorure d’aluminium (AlCl
3) sur l’activité du
catalase (CAT)
37
II.1.4.2. Effet du chlorure d’aluminium (AlCl
3) sur la teneur en
malondialdéhyde (MDA)
38
II.2. Discussions
40
II.2.1. Effets du stress de l’aluminium (Al
3+) sur les critères de
germination des graines de blé dur (Triticum durum Desf.)
40
II.2.2. Effet du stress de l’aluminium (Al
3+) sur la mobilisation des
réserves et l’efficience du métabolisme des graines de blé dur
(Triticum durum Desf.)
41
II.2.3. Effet du stress de l’aluminium (Al
3+) sur la croissance des
plantules de blé dur (Triticum durum Desf.)
42
II.2.4. Effet du stress de l’aluminium (Al
3+) sur quelques marqueurs
biochimiques des plantules de blé (Triticum durum L.)
43
II.2.4. 1. Effet de l’aluminium (Al
3+) sur l’activité du catalase (CAT)
43
II.2.4.2. Effet de l’aluminium (Al
3+) sur la teneur en malondialdéhyde
(MDA)
44
CONCLUSION GENERALE
46
RÉFÉRENCES BIBLIOGRAPHIQUES 49
ANNEXES 63
Liste des figures
Liste de figures
Page Titre Figure07
Cycle de développement du blé Figure 0113
Schématisation de la balance entre les ERO et les antioxydants
Figure 02
14
Sites de production intra-organites des formes réactives de l’oxygène (ROS) dans la cellule
végétale Figure 03
15
Modifications des chaînes latérales d’acides aminés après attaque radicalaire Figure 04
16
Mécanisme en chaîne de la peroxydation des acides gras polyinsaturés et nature des produits
terminaux formé Figure 05
17
Lésions de l’ADN formées suite à un stress oxydant
Figure 06
18
Enlèvement de différentes espèces réactives d’oxygène par enzymes antioxydants Figure 07
29
Taux moyen de germination de graines de blé dur (Triticum durum Desf.) après 7 jours, en
fonction des concentrations croissantes de ). 3 chlorure d’aluminium (AlCl Figure 8
30
Indice de vigueur des semences de blé dur (Triticum durum Desf.), après 7 jours, en fonction des concentrations croissantes de
). 3 chlorure d’aluminium (AlCl Figure 9
31
Pourcentage d'inhibition de germination PI(GP%) et la vigueur des semences PI(SVI) du blé dur (Triticum durum Desf.), après 7 jours, en
fonction des concentrations de chlorure ).
3 d’aluminium (AlCl Figure 10
32
Efficience métabolique des semences (SME) et la quantité de matériel de semence respiré (SMR) de blé dur (Triticum durum Desf.) exposé
pendant 7 jours à des concentrations croissantes ).
3 de chlorure d’aluminium (AlCl Figure 11
34
Longueur de plumule (SHL), de la radicule (RTL) et la longueur totale de la plantule (TSL) de blé dur (Triticum durum Desf.), après 7 jours de germination, en fonction des concentrations
). 3 croissantes de chlorure d’aluminium (AlCl Figure 12
35
: Pourcentage de phytotoxicité de chlorure ) sur la longueur de plumule 3
d’aluminium (AlCl
(SHP%) et la radicule (RTP%) et la totalité de Figure 13
Liste des figures
plantule (TSP%) de blé dur (Triticum durum Desf.), après 7 jours de germination sous
traitement.
36
Activité de la catalase (CAT) des plumules et des radicules des plantules du blé dur (Triticum
durum Desf.), après 7 jours de germination en présence des concentrations croissantes de
). 3 chlorure d’aluminium (AlCl Figure 14
37
Teneur en malondialdéhyde (MDA) des plumules et des radicules des plantules du blé
dur (Triticum durum Desf.), après 7 jours de germination en présence des concentrations
). 3 croissantes de chlorure d’aluminium (AlCl Figure 15
Liste des abréviation
Liste des tableaux
Page Titre
Tableau
05 Classification systématique du blé dur
Tableau 01
13 Espèces réactives de l’oxygene
Liste des abréviation
Liste des abréviation
% : Pourcentage Ph : Le potentiel hydrogène u : uma chlorure d'aluminium : 3 Alcl ° C : degré Celsius ml : Milliliter mg : Milligram g : gram CAT : catalase Peroxyde d’hydrogène : 2 O 2 H MDA : malondialdéhyde
CEC : capacité d’échange cationique ETM : élément trace métallique ERO : espèces réactives à l’oxygène CTE : Les chaines de transport d’électrons ADN : Acide désoxyribonucléique
PSI : Photosystème I
GPX : glutathion peroxydase ROS : reactive oxygen species. SOD : superoxyde dismutase
FeSOD: superoxydes dismutases à fer
MnSOD: superoxydes dismutases à manganèse CuZnSOD: superoxyde dismutases à cuivre-zinc GPX : Glutathion peroxydase
trxR : thiorédoxines réductases trx : thiorédoxines
Liste des abréviation
NADPH : Nicotinamide Adénine Dinucléotide Phosphate réduit GR : Glutathion Reductase
GSH : Glutathion
GSSG : le disulfure de glutathion
PG% : Taux moyen de germination des graines SVI : Indice de vigueur des semences
PI(GP%) : Pourcentage d'inhibition de germination PI(SVI) : vigueur des semences
SME : Seed metabolic efficiency SMR : seed material respired SHL : la longueur de plumules RTL : la longueur de radicules TSL : la longueur totale des plantules Al : aluminium Pb : plomb Cd : Cadmium As : arsenic Cu : cuivre NO : l’oxyde nitrique Oxygène moléculaire : 2 O Anion superoxyde : -· 2 O Hydroxyde : -OH Radical hydroxyle : · OH
Introduction
Introduction
De nos jours, le grand développement du secteur agricole, notamment en ce qui concerne la production végétale, l'utilisation excessive et continue d'engrais et de pesticides est l'une des principales causes de contamination des sols et de l'eau par des ions métalliques.
Dans les écosystèmes pollués, les plantes sont directement exposées à ces éléments dont le potentiel toxique est indéniable (Kabata-Pendias et al., 2007).
L’aluminium (Al) est parmi les polluants métalliques le plus fréquemment rencontrés dans les sols (Gratão et al., 2006) et l’un des principaux facteurs qui limitent la croissance des plantes par son phytotoxicité (Poozesh, 2007).
La toxicité des métaux lourds est étroitement liée à leurs propriétés oxydo-réductrices et à la production d’espèces réactives de l’oxygène (ROS) au niveau cellulaire, tels que l’anion superoxyde ou le radical hydroxyle, qui possèdent un électron non apparié (Mesnoua, 2017).
Pour faire face aux dommages oxydatifs causés par des biomolécules toxiques (ROS), les plantes ont développé un mécanisme de défense antioxydant qui est à la fois composé de systèmes enzymatiques (catalase, superoxyde dismutase, peroxydase, glutathion réductase, glutathion S-transferase, glutathion peroxydase, etc…), ainsi que de systèmes non-enzymatiques (vitamines C et E, caroténoïdes, glutathion, etc…). Cela permet le maintien d'une capacité antioxydante élevée dans les cellules et l’augmentation de la tolérance au stress (Shahid et al., 2014).
Dans cette étude, nous avons choisi une plante modèle, comme le blé dur (Triticum durum Desf.), qui est l'une des céréales les plus consommées dans les pays du Maghreb, et il est très apprécié en Algérie (Boulal et al., 2007).
Ainsi, notre objectif est de mieux comprendre les réponses de graines et plantules de blé dur (Triticum durum Desf.) aux stress causés par la présence d’aluminium (Al3+), comme un élément métallique, au cours des phases précoces de développement du blé ; pour cela on a posé le problème suivant :
Introduction
- Quelle sont les effets toxiques d’aluminium sur quelques marqueurs physiologiques et biochimiques des plantules de blé dur.
Ce travail est divisé en deux parties :
La première partie est consacrée à la synthèse bibliographique qui comporte deux chapitres. Le premier chapitre concernant l’étude de la biologie du blé dur, le deuxième chapitre concernant en générale les éléments traces métalliques (ETM) et les végétaux.
La deuxième partie est consacrée à la partie expérimentale, qui contient le chapitre de matériels et méthodes utilisées durant ce travail et le chapitre des résultats et discussion qui montrent les résultats obtenus et leur interprétation.
CHAPITRE I PRESENTATION DE PLANTE ETUDIEE
5
I. Généralités sur le blé
I.1. Historique et l'origine génétique
Trois céréales blé, riz et maïs constituent la base alimentaire des populations du globe. Durant le développement de la civilisation indo-européenne, le blé est devenu la principale céréale des peuples occidentaux sous climat tempéré (Henry et De Buyser, 2001).
Le blé est l’une de ces céréales connues depuis l’antiquité (Ruel, 2006). Sa culture remontée au mésolithique vers 7000 avant Jésus-Christ (Anonymel, 1981). Le blé dur provient des territoires de la Turquie, de la Syrie, de l'Iraq et de l'Iran (Boutigny, 2007).
D’après Cook et al. (1991), certains des premiers blés cultivés (primitifs) étaient des diploïdes, l’engrain Triticum monococcum (2n = 14), le tétraploïde Triticum turgidum var. dicoccum (2n = 28 ; amidonnier) et l’hexaploïde l’épautre (T. aestivum var. spelta).
I
.2.Classification botanique
Le blé est une plante herbacée, monocotylédone appelé aussi céréale à paille appartient à la famille des Graminées, genre Triticum. Cette famille comprend 600 genres et plus de 5000 espèces (Feillet, 2000). Une classification détaillée de blé dur est donnée ci- dessous :
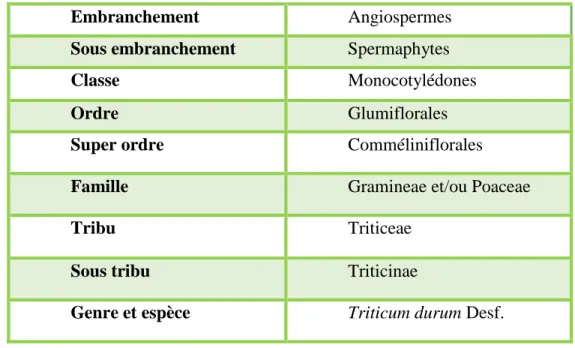
Tableau 01 : Classification systématique du blé dur d’après Feillet (2000) Angiospermes Embranchement Spermaphytes Sous embranchement Monocotylédones Classe Glumiflorales Ordre Comméliniflorales Super ordre
Gramineae et/ou Poaceae Famille
Triticeae Tribu
Triticinae Sous tribu
Triticum durum Desf.
CHAPITRE I PRESENTATION DE PLANTE ETUDIEE
6 I.3. Description générale de la plante
Le blé dur est une graminée annuelle de hauteur moyenne (Bozzini, 1988). La plante
mûre se compose des parties suivantes : - Racines : le blé dur dispose de deux systèmes radiculaires successifs. Un système
racinaire primaire ou séminal, fonctionnel dès la germination (Monneveux, 1992), et d’un système racinaire secondaire ou racines adventices, de type fasciculé, (Boulal et al., 2007).
- Tige : sur la partie aérienne, on distingue une tige principale appelée le maître brun cylindrique, lisse, plus ou moins creuse et des tiges secondaires appelées talles qui naissent à la base de la plante (Soltner, 2005).
- Feuilles : alternes, distiques, simples et entières, avec une gaine arrondie (Belay, 2006). La feuille du blé se compose de quatre parties : la gaine, les stipules ou oreillettes, la ligule et le limbe (Soltner, 2005).
L’appareil reproducteur (l’inflorescence) est un épi muni d’un rachis portant des épillets séparés par de courts entre-nœuds (Bozzini, 1988). Chaque épillet est une petite grappe d’une à cinq fleurs bisexuées, et chaque fleur peut produire un fruit à une seule graine (Boulal et al., 2007).
Le grain de blé dur est le plus dur de tous les blés, fruit sec et indéhiscent (caryopse), Il a un aspect ovoïde et allongé, muni d’un sillon central sur l’une des faces (Belay, 2006).
I.4. Cycle de développement du blé
Dans ce cycle annuel une série d'étapes séparées par des stades repères, permettent de diviser la vie des céréales en deux grandes périodes : la période végétative et la période reproductrice (Zeitoune, 2011). Les différentes phases du cycle de développement de plante du blé sont regroupées dans la figure suivante :
CHAPITRE I PRESENTATION DE PLANTE ETUDIEE
7
Figure 01. Cycle de développement du blé (Henry et al., 2000)
I.5. Composition biochimique de graine du blé dur
Le cotylédon du blé représente 82 % à 85 % du grain. Il accumule toutes les substancesnutritives nécessaires qui sont les glucides, les protéines, les lipides, les substances minérales et les vitamines (Cretois, 1985). Ces substances sont principalement des métabolites qui assurent la nutrition de la plantule lors de la germination.
Selon Fredot (2005), les réserves des graines comprennent essentiellement les composés suivants :
• 70 % à 80 % de glucides, essentiellement de l’amidon, du gluten associé à l’amidon, des hémicelluloses (des parois cellulaires), des sucres solubles et des protides.
CHAPITRE I PRESENTATION DE PLANTE ETUDIEE
8
• 1,5 à 2 % de lipides dont 60% sont des lipides libres apolaires et 40% des lipides polaires.
• Les enzymes dont les principales sont l'α et la β amylases, des protéases ainsi que des lipases et des lipoxygénases.
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES (ETM) ET LES VÉGÉTAUX
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
10
I.1. Généralité sur les métaux lourds
Les éléments en traces (ou éléments traces) sont les 80 éléments chimiques dont la concentration moyenne dans la croûte terrestre continentale est inférieure à 0,1 % pour chacun (Baize et Daniau, 2007). Cependant, la classification en métaux lourds est souvent discutée car certains métaux toxiques ne sont pas particulièrement « lourds » (par exemple le zinc), tandis que certains éléments toxiques ne sont pas des métaux (c’est le cas de l'arsenic qui est un métalloïde). Ce terme générique désigne donc indistinctement des métaux et métalloïdes réputés toxiques. Pour ces différentes raisons, l'appellation « éléments traces métalliques » -ETM- ou par extension « éléments traces » est préférable à celle de métaux lourds (Burnol et al., 2006).
II.2. Origine et phytodisponibilité des ETM
II.2.1. Origine des ETM
Les ETM sont diffusés vers l’atmosphère lors de processus naturels comme l’érosion éolienne, les activités volcaniques, les embruns marins et les feux de forêts (Lamprea, 2009). Cependant, la majorité des ETM retrouvés dans l’environnement est d’origine anthropique. Ces deux derniers siècles, les activités humaines ont largement contribué à l’enrichissement des sols en ETM. Les principales sources de contamination des sols sont l’épandage agricole, le trafic routier et surtout les activités industrielles (Muschitz, 2009).
II.2.2. Phytodisponibilité des ETM
Phytodisponibilité d’un ETM peut être définie comme la quantité d’élément qui peut être transférée (« prélevée ») dans la plante durant son développement. Elle est la résultante d’un ensemble de processus successifs qui contribuent au transfert de l’élément de la phase solide du sol à la solution du sol puis aux tissus de la plante (Tremel-Schaub et Feix, 2005). Le prélèvement des ETM par les racines est donc sous l’influence de facteurs liés au sol, à la faune du sol, à la plante, et aux interactions entre les éléments eux-mêmes.
Parmi les facteurs liés au sol, le pH, le potentiel d’oxydo-réduction et la capacité d’échange cationique (CEC) sont les plus importants. (Tremel-Schaub et Feix, 2005).
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
11
L’aluminium a une masse atomique de 26,9815 u (Segalen, 1973). Dans la solution du sol, il est solubilisé sous diverses formes en conditions acides ; La principale forme soluble entre pH 4.0 et 4.5 est l’ion mononucléaire [Al (H2O)6]3+ noté Al3+, Entre pH 4.2 et pH 4.5 une forme polynucléaire de Al à 13 atomes de Al, dénommée « Al 13 » a été supposée particulièrement toxique. Quand le pH augmente entre 4.5 et 5.5 les ions Al(OH)2+ puis Al(OH)2+ supposés moins toxiques sont formés (Poozesh, 2007).
II.3. Toxicité des ETM sur les plantes
L'action des ETM au niveau physiologique touche en particulier la photosynthèse, la nutrition, la transpiration et le bilan hydrique. Ils sont également à l'origine d'un stress oxydatif conduisant à la formation d'espèces réactives à l'oxygène (ERO) (Affholder, 2013).
II.3.1. Les principaux effets des ETM sur les plantes
La germination et les plantules sont plus sensibles à la pollution métallique en raison du manque de certains mécanismes de défense (Liu et al., 2012).
La germination peut être affectée par les métaux de deux manières : la toxicité directe et / ou l'inhibition de l'absorption d'eau. (Infante-Izquierdo, 2020)
L’effet toxique des ETM sur la germination sont les effets sur le rendement, la viabilité et l’imbibition des graines (Kranner et Colville, 2011).
Bon nombre des effets toxiques des métaux résultent de l'oxydant les dommages résultant de la génération ROS (Sharma et Dietz, 2009). ROS peut réagir avec les acides nucléiques, affectant le code génétique de l'embryon, et peut réagir avec des composés de stockage des graines tels que les protéines et les lipides. Par conséquent, Les ROS peuvent compromettre la germination et l'établissement des semis avec effets potentiellement mutagènes sur la prochaine génération de plantes. (Kranner et Colville, 2011).
L’effet toxique des ETM sur la croissance de la plante se manifeste par une réduction de la croissance des parties aériennes et des racines affectantes ainsi dramatiquement la production de la biomasse. Aussi l’équilibre de certaines hormones de croissance (Zorrig, 2011).
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
12
Pour l’aluminium, les principaux symptômes sont l'inhibition de la croissance, la diminution de sa biomasse, l’inhibition de l'élongation des racines associée à un arrêt de la division cellulaire et des déformations caractéristiques (Poschenrieder et al., 2008).
Ces effets s’accompagnent très souvent de nombreux autres indices de dysfonctionnement tel que la perturbation de la machinerie photosynthétique, notamment la structure des chloroplastes et la biosynthèse de la chlorophylle (He et al., 2008 ; Ran et al., 2014).
Certains ETM comme Pb et Cd sont des inhibiteurs du transfert d'électrons. Ils peuvent agir au niveau des photosystèmes (surtout le photosystème II)(Singh, 2005).
Selon Kochian et al. (2004), une exposition à long terme à l'aluminium cause de graves dommages aux systèmes racinaires, et par conséquent, réduit l’absorption de l’eau et des nutriments minéraux, limitant ainsi les rendements agricoles.
Aussi les symptômes foliaires ressemblent à ceux de l’insuffisance phosphorique (P). Dans certains cas, toxicité de l’aluminium apparaît comme une carence induite en fer (Fe) et calcium (Ca) (Clark, 1981 ; Furlani et Clark, 1981).
II.4. Le stress oxydatif
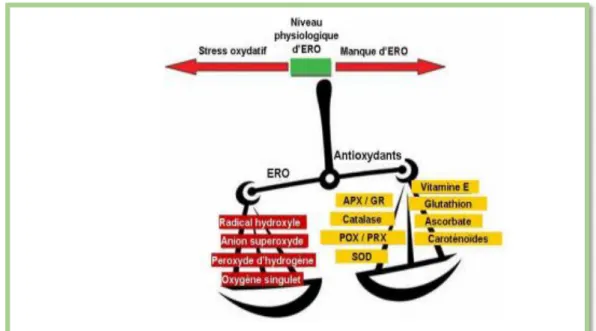
Le stress oxydatif (ou oxydant) a été défini par Sies (1997) comme une perturbation de la balance entre les prooxydants et les antioxydants (Figure 03), en faveur des premiers, conduisant à des dommages potentiels. Le stress oxydatif est la conséquence de :
- la diminution du niveau des antioxydants et/ ou
- l’augmentation de la production des molécules toxiques dérivées de l’oxygène (ROS)
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
13
Figure 02 : Schématisation de la balance entre les ERO et les antioxydants (Pourrut, 2008) Lorsque la quantité des ROS générée dépasse les capacités antioxydantes de l’organisme, la toxicité des ROS s’exprime par de nombreux aspects, et en particulier par la perturbation de nombreux processus physiologiques comme la photosynthèse (Pourrut, 2008 ; Sies, 1997).
II.4.1. Les Espèces Réactives de l’Oxygène
Les principales espèces réactives de l’oxygène radicalaire sont (Tableau 01): le radical superoxyde (O2*-), le radical hydroxyle (OH*), le monoxyde d’azote (NO*), et aussi certains dérivés oxygénés réactifs non radicalaires dont la toxicité est importante tels que le peroxyde d’hydrogène (H2O2) et le peroxynitrite (ONOO-) (Halliwell, 2006 ; Jacques et André, 2004).
Tableau 02 : Espèces réactives de l’oxygene (Kohen et Nyska, 2002).
Espèces radicalaires Espèces non radicalaires
Anion superoxyde O2* Peroxyde d’hydrogène H2O2
Radical hydroxy OH* Peroxyde organique ROOH Radical peroxyle ROO* Acide hypochlorique HOCL Radical alkoxyle RO* Oxygène singulet 1O
2
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
14
II.4.1.2. Sources des espèces réactives de l’oxygène dans la plante
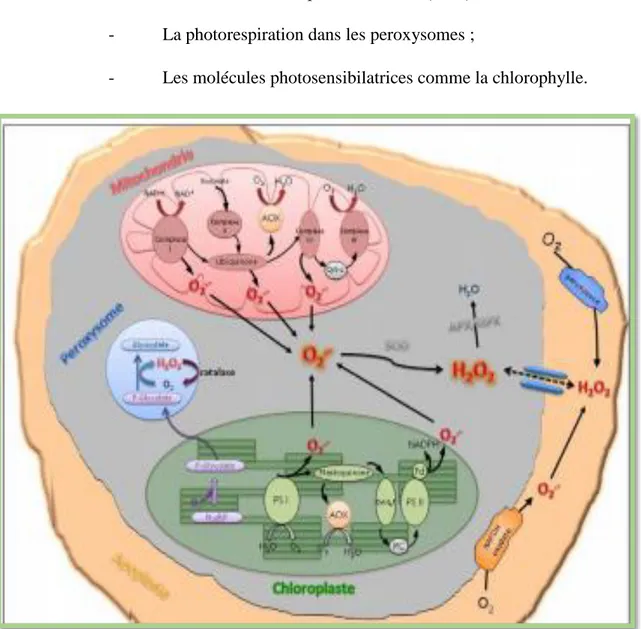
Selon Parent al. (2008), la production de formes réactives de l’oxygène est une réponse cellulaire commune à de nombreux stress chez les végétaux qui se localise au niveau de différentes sources (Figure 04) :- Les chaines de transport d’électrons (CTE) chloroplastes ; - Les chaines de transport d’électrons (CTE) des mitochondries ;
- La photorespiration dans les peroxysomes ; - Les molécules photosensibilatrices comme la chlorophylle.
Figure 03 : Sites de production intra-organites des formes réactives de l’oxygène (ROS) dans la cellule végétale (Parent al., 2008)
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
15
II.4.1.3. Les conséquences moléculaires du stress oxydatif
II.4.1.3.1. L’oxydation des protéines
Les protéines les plus touchées sont celles comportant un groupement thiol commec’est le cas pour de nombreuses enzymes et protéines de transport (Stadtman et Levine, 2000). L’oxydation des acides aminés induire des modifications structurales et la fragmentation des chaines, ce qui affecte leurs fonctionnements et leurs activités (Valko et al., 2007).
Permis ces modifications sont des cassures au niveau des liaisons peptidiques en modifiant la chaîne protéique, des modifications des peptides par l'addition de produits issus de la peroxydation lipidique et des insertions des radicaux libres directement sur les groupements d’acides aminés des protéines (Figure 05) (Shringarpure and Davies, 2002).
Figure 04 : Modifications des chaînes latérales d’acides aminés après attaque radicalaire (Favier, 2003).
II.4.1.3.2. Altération de la structure des lipides
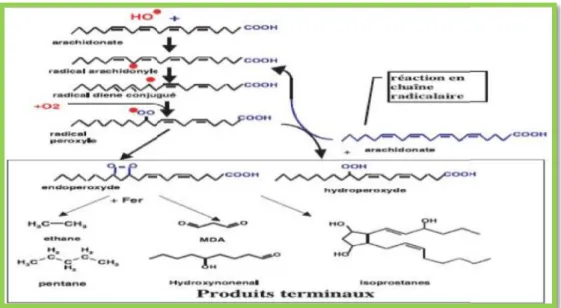
Les lipides et principalement leurs acides gras polyinsaturés sont la cible privilégiée de l'attaque par le radical hydroxyle capable d'arracher un hydrogène sur les carbones situés entre deux doubles liaisons, pour former un radical diène conjugué, oxydé en radical peroxyle (Figure 06). Cette réaction appelée peroxydation lipidique (Favier, 2003).
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
16
La peroxydation lipidique a des conséquences multiples sur les cellules des plantes. Selon Gill and Tuteja (2010), elle provoque :
- Des dommages aux protéines membranaires ; - Une diminution de la fluidité de la membrane ;
- Une augmentation de charge négative de la surface permettant aux phospholipides les échanges entre les deux moitiés de la bicouche lipidique.
Figure 05 : Mécanisme en chaîne de la peroxydation des acides gras polyinsaturés et nature des produits terminaux formés (Favier, 2003).
II.4.1.3.3. Les acides nucléiques
Les acides nucléiques sont très sensibles aux radicaux libres. Les altérations oxydatives causées par les ERO sont considérées comme la source majeure de dommages spontanés sur l’ADN (Beckman et Ames, 1997).
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
17
Ces dommages provoquent une réduction de la synthèse protéique ainsi qu’une destruction et une inactivation des protéines photosynthétiques. Ils peuvent aussi provoquer un arrêt ou induction de la transcription, une induction des voies de transduction du signal et des erreurs de réplication, une destruction de la membrane cellulaire et une instabilité génomique (Cooke et al., 2003).
Cinq classes principales de dommages oxydatifs provoqués par l'OH• peuvent être générées. Parmi elles, comme le montre la figure 06 : les bases oxydées, les sites abasiques, les adduits intra-caténaires, les cassures de brins et les pontages ADN-protéines.. (Niedernhofer et al., 2003).
igure 06 : Lésions de l’ADN formées suite à un stress oxydant (Favier, 2003).
II.4.2. Les antioxydants
Un antioxydant est «n’importe quel substance qui, lorsqu’il est présent à de faibles concentrations par rapport à celle d’un oxydable substrat, retarde considérablement ou inhibe l’oxydation de ce substrat » (Sies, 1996).
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
18
II.4.2.1. Antioxydants enzymatiques
Les antioxydants enzymatiques (la superoxyde dismutase, la catalase, la glutathion peroxydase et la glutathion réductase) sont considérés comme la première ligne de défense contre les ROS (Garait, 2006).
La figure suivante résume les rôles importants des enzymes antioxydants :
Figeur 07 : Enlèvement de différentes espèces réactives d’oxygène par enzymes antioxydants (Kunwar et Priyadarsini, 2011).
II.4.2.1.1.
Les superoxyde dismutases (SOD)
Métalloenzyme ubiquitaire (Jacquin-Porretlz, 1996), agissent comme la première ligne de défense contre ROS (Gratão et al., 2006). Il existe trois types de SOD chez les plantes : (FeSOD), (MnSOD) et (CuZnSOD). Toutes catalysent la dismutation de deux anions superoxydes en dioxygène et peroxyde d’hydrogène, comme le montre la réaction suivante (Arora et al., 2002) :
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
19
Au niveau cellulaire, les SOD se retrouvent à proximité des sites de production d’O2
-. Les MnSOD mitochondriale, les FeSOD se situent essentiellement dans le stroma des
chloroplastes. Les CuZnSOD se retrouvent sous forme libre dans le cytosol. Il existe, toutefois,
une CuZnSOD liée à la membrane du thylakoïde au niveau du PSI, directement au contact des anions superoxydes produits par la CTE chloroplastique (Pourrut, 2008).
II.4.2.1.2. Les catalases (CAT)
Un catalase (E.C. 1.11.1.6) est l’une des enzymes antioxydants les plus importantes (Nandi et al., 2019), qui est localisé dans les peroxysomes (Mishra et al.,1993). Elle agit en synergie avec les SODs puisque leur rôle est de catalyser la réduction du peroxyde d’hydrogène en eau et en oxygène moléculaire, selon la réaction suivante (Mesnoua, 2017) :
II.4.2.1.3. Les peroxydases (GPx)
La glutathion peroxydase (GSH-Px) est une enzyme à sélénium (Desmier, 2016) permettant également la décomposition du H2O2 (Benhama et Herroudj, 2016). Elle se retrouve dans les liquides extracellulaires ainsi que dans les cellules, au sein du cytosol et des mitochondries (Desmier, 2016).
Son activité principale est de permettre l’oxydation du glutathion par réaction de dimérisation avec la formation d’un pont disulfure. Cette réaction conduit à la génération de H2 pouvant réduire les espèces environnantes (Desmier, 2016).
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
20
II.4.2.1.4. Le système thiorédoxine
Selon Beillerot (2011), le système trx/trxR est un système antioxydant majeur qui permet de maintenir un redox intracellulaire équilibré. Il comprend les thiorédoxines réductases (trxR), les thiorédoxines (trx) et le NADPH + H+, comme le montre les réactions suivants (1) et (2) :
II.4.2.2. Antioxydants non enzymatiques
Les principaux antioxydants non enzymatiques sont l’ascorbate, les α-tocopherols, le glutathion et les flavonoides.
II.4.2.2.1. L’ascorbate et L’α-tocopherol
L’acide L-ascorbique ou vitamine C est un antioxydant omniprésent dans les plantes. Il piège le radical (O2 -.) par formation du radical semi dehydroascorbate qui est réduit par le glutathion (Ratnam et al., 2006).
L’α-tocopherol ou vitamine E est une vitamine localisé au niveau de la membrane des thylakoïdes des chloroplasts (Desel et al., 2007). Elle réduit la formation des radicaux libres tels que les lipoperoxydes et les radicaux d’oxygène (Gaté et al., 1999).
II.4.2.2.2. Le glutathion
Glutathion Reductase (GR) existe principalement dans le chloroplaste et réduit le disulfure de glutathion (GSSG) au glutathion (GSH) (Sahoo et al., 2017).
Le glutathion réduit (GSH), réduit le peroxyde d'hydrogène et/ou les peroxydes organiques grâce à la réaction catalysée par le glutathion peroxydase (GPx) (Sahoo et al., 2017).
II.4.2.2.3. Les flavonoïdes
Les flavonoïdes se trouvent généralement dans les feuilles, les parties florales et les pollens (Olsen et al., 2010).
CHAPITRE II LES ÉLEMENTS TRACES METALLIQUES ET LES VÉGÉTAUX
21
Les flavonoïdes inactivent et stabilisent les radicaux libres : radicaux hydroxyles (OH•), anions superoxydes (O2•-) et radicaux peroxylipidiques grâce à leur groupement hydroxyle (C3-OH) fortement réactif (Ghedira, 2005).
CHAPITRE I MATERIEL ET METHODES
24
I.1. Matériel végétal
et conduite de l’essai
I.1.1. Matériel végétal
Le matériel végétal utilisé est le blé dur (Triticum durum Desf.), variété : CIRTA.
C‘est une variété d’origine Italienne, à paille peu épaisse, et des grains moyens demi-allongés. Elle présente un pourcentage moyen de germination très élevé, et un rendement élevé (OAIC, 2012).
I.1.2. Conduite de l’essai
Les graines du blé sont sélectionnées et désinfectées à l‘eau de javel (10%) à
concentration de 12° pendant 10 min, puis rincées abondamment à l’eau distillée. Elles sont
ensuite mises à germer dans des boîtes de pétri de 9 cm de diamètre, dont le fond est recouvert d’une double couche de papier filtre imbibé avec l’eau distillée ou des solutions de concentration 100, 300, 600 mg / l en Chlorure d'Aluminium Hexa hydraté (AlCl3 6H2O, Sigma-Aldrich)à raison de 5 à 7 ml / boîte / jour, et le papier filtre a été remplacé toutes les 48 heures. La germination a été effectué à l’obscurité à une température de 25 C◦, pendant une période de sept (07) jours.
Chaque traitement comporte 20 graines par boîte, et quinze répétitions par traitement ont été réalisées, avec une répartition aléatoire.
I.2. Méthodes d’étude
À la fin de l'expérience (après 7 jours de germination), ont été faites toutes les mesures pour les différents paramètres étudiés :
I.2.1. Paramètres de germination
I.2.1.1. Taux moyen de germination des graines (PG%)
Le taux de germination correspond au nombre de graines germées après 7 jours divisé par le nombre de graines mises en germination. Une graine est considérée comme ayant germé, lorsque sa radicelle a au moins 2 mm de longueur (Lamhamdi et al., 2011).
PG% = (NG/NGG) x 100
CHAPITRE I MATERIEL ET METHODES
25
I.2.1.2. Indice de vigueur des semences (SVI)
L’indice de vigueur des semences (SVI) a été déterminé selon la formule donné par Abdul-Baki and Anderson (1973) :
SVI = (GP x TSL) / 100 Où, TSL : longueur totale de plantule (radicule + plumule)
I.2.1.3. Pourcentage d'inhibition de germination et la vigueur des
semences
D’après la méthodologie de Baruah et al. (2019), on peut calculer le pourcentage d'inhibition de la germination PI(PG%), et de la vigueur des semences PI(SVI), selon les formules suivantes :
PI(PG%) = 100-(PG%traitement / PG%control) x 100
PI(SVI) =100- (SVItraitement / SVIcontrol) x 100
I.2.2. Mobilisation des réserves et l’efficience du métabolisme des graines
Efficience métabolique des semences : Selon Rao and Sinha (1993), l'efficience métabolique des semences peut être définie comme la quantité de matière sèche de la plumule et de racines (g) produite à partir de 1 unité (g) de poids sec de semences qui a été respirée. Ainsi, la valeur de l’efficience métabolique des semences (SME) est élevée, plus l’efficience des semences est élevée car davantage de réserves de semences seraient utilisées pour produire des racines et des parties aériennes.
La quantité de matériel de semence respiré (SMR) a été calculée comme suite :
SMR = SDW- (SHW + RTW + RSW) Où : SDW : poids sec des graines avant germination
SHW : poids sec de la plumule RTW : poids sec de la racine
CHAPITRE I MATERIEL ET METHODES
26
L'efficience métabolique des semences (SME) a été calculé selon la formule suivante (Rao and Sinha, 1993) :
SME = (SHW + RTW) / SMR
I.2.3. Paramètres de croissance
I.2.3. 1. Longueur et poids sec de plumule, radicule et plantule
Pour les paramètres de la croissance, dix plantules sont prélevées pour chaque traitement. La longueur de la radicule principale (RTL) et de la plumule (SHL) a été mesurée à l’aide d’un papier millimétrique.
Le poids sec du matériel végétal est obtenu après dessiccation dans une étuve pendant 48 heures à 75 °C. Les échantillons ont été pesés après refroidissement, à l’aide d’une balance de 0,01 mg de précision.
I.2.3.2. Pourcentage de Phytotoxicité sur la longueur de plumule, radicule et plantule Selon El Rasafi et al. (2020), le pourcentage de phytotoxicité de la longueur de plumule
SHLP (%), radicule RTLP (%) et plantule TSLP (%) ont été déterminé selon les formules suivantes :
SHLP (%) = ((SHL control – SHL treatment) / SHL control) x 100
RTLP (%) = ((RTL control – RTL treatment) / RTL control) x 100
TSLP (%) = ((TSL control – TSL treatment) / TSL control) x 100
Où, TSL (longueur totale de plantule) = SHL + RTL
I.2.4. Quelques caractéristiques biochimiques de plumule et radicule
Après 07 jours de germination, les analyses biochimiques ont été effectués sur les deux parties (racines et parties aériennes) des plantules du blé dur (variété : CIRTA) obtenues à différents traitements métalliques au AlCl3 : 0. 100, 300, 600 (mg / L).
CHAPITRE I MATERIEL ET METHODES
27
I.2.4.1. Dosage des activités enzymatiques
I.2.4.1.1. Préparation de l’extrait enzymatique
La méthode utilisée afin d‘obtenir l’extrait enzymatique des racines et des parties aériennes des plantules de blé dur est celle de Loggini et al. (1999). L‘extrait sera utilisé pour la mesure de l’activité de la catalase (CAT).
Les échantillons fraiches (1g) ont été broyées à froid, à l’aide d‘un mortier, avec 5ml de tampon phosphate (50 mM phosphate, pH = 7,5) pour le CAT. L’homogénat a été centrifugé à 4 0C pendant 15 min à 12000 g. Le surnageant obtenu sera utilisé comme un extrait pour la détermination des différentes activités enzymatiques.
I.2.4.1.2. Dosage de l'activité de la catalase (CAT)
Le dosage de l'activité enzymatique de la catalase (CAT) a été appliqué selon la méthode de (Aebi , 1984) .La décroissance de l‘absorbance est enregistrée pendant une minute pour une longueur d‘onde de 560 nm. Le mélange réactionnel contient : 0.025 ml de l‘extrait enzymatique brut, 0.975 ml de peroxyde d’hydrogène H2O2 (0.091M) et 1ml de tampon phosphate (0.1M, pH = 7,2). L‘étalonnage de l’appareil se fait en l‘absence de l‘extrait enzymatique. La réaction est déclenchée par l‘addition de l’extrait enzymatique.
L’activité enzymatique de CAT est calculée en termes d’unité internationale par minute et par gramme de la matière fraîche des échantillons, selon la formule :
CAT (UI/g) =((2.3033/T) x (log A1/A2)) /g de MF Où, CAT (UI/g) : activité enzymatique en n UI /min /g de MF. A1 : Absorbance de la première minute.
A2 : Absorbance de la deuxième minute. T : Intervalle de temps en minute.
CHAPITRE I MATERIEL ET METHODES
28
I.2.4.2. Détermination des indicateurs du stress oxydatif
La peroxydation lipidique est une des plus importants effets connus des radicaux libres sur les systèmes membranaires, et le plus facile à mesurer. Le malondialdéhyde (MDA) est un marqueur de l’état oxydatif des membranes cellulaires, a été dosé selon la méthode de Velikova et al. (2000), légèrement modifiée.
I.2.4.2.1. Dosage du malondialdéhyde (MDA)
Les échantillons frais, 200 mg ont été broyés, à l’aide d’un mortier en porcelaine, avec 1 ml d’acide trichloracétique (TCA : 0.1 %). Le broyat a été centrifugé pendant 15 minutes à 15 000 g à 4 °C, ensuite, un volume de 0.5 ml de surnageant a été ajouté à un volume de 1 ml d’acide thiobarbiturique (TBA : 0.5 %) préparé dans du TCA 20 %. Le tout a été incubé pendant 30 minutes dans un bain-marie à 100 °C. D’apres la méthode de Velikova et al. (2000), dans ces conditions, les composés aldéhydiques, essentiellement le malondialdéhyde, vont réagir avec le TBA pour former le complexe TBA-MDA. La réaction a été arrêtée par un refroidissement immédiat dans de la glace pilée, pendant 10 min. Le surnageant a été récupéré pour le dosage des lipoperoxydes par colorimétrie. L’absorbance est lue à 532 et 600 nm contre un blanc contenant un mélange de TBA-TCA. Après soustraction de l’abondance non spécifique lue à 600 nm, la concentration du malondialdéhyde (exprimée en µmole g-1 MF) a été calculée à l’aide de son coefficient d’extinction (ε =155 mM-1.cm-1), selon l’équation suivante (Velikova et al., 2000) :
Où, V(cuve) : volume de la cuve = 1 ml
V(surnageant) : volume de l’extrait du surnageant en m
V(TBA+surnageant) : somme du volume de TBA et celui de l’extrait du surnageant en m MF : masse de la matière fraîche des échantillons en g
CHAPITRE I MATERIEL ET METHODES
29
I.3. Analyse statistique
Les résultats des tests statistiques effectués sont exprimés en moyenne ± standard de déviation (SD). La différence entre les moyennes est faite par le test d'ANOVA à un facteur (facteur de stress métallique (AlCl3)) et deux facteur (facteur de stress métallique (AlCl3) et facteur de l’organe végétale ) , les valeurs de P ≤ 0.05 sont considérées statistiquement significatives. La comparaison des moyennes a été déterminée par le test de Fisher (test de LSD) à l'aide du logiciel Minitab 17. Les courbes et les histogrammes sont tracés par le logiciel Excel de Microsoft Office 2010.
CHAPITRE II RESULTATS ET DISCUSSION
31
II.1. Résultats
II.1. 1. Paramètres de germination
II.1.1. 1.Taux moyen de germination des graines (PG%)
L’effets de Chlorure d’Aluminium (AlCl3) sur le taux de germination de graines de blé dur (Triticum durum Desf.) après 7 jours, exprimée en pourcentage du nombre totale des germinations des grains témoins, est présenté dans la figure 01.
Les résultats obtenus (Figure 08) montrent une différence non significative (p=0.827 ;Annexe 01 ,Tableau 01) du taux de germination des grains du blé traités par des concentrations croissantes d’AlCl3. Nous avons enregistré une augmentation non significative des taux de germination sous l'influence des deux concentrations 100 et 300 mg /L, par rapport aux grains témoins, mais il y a une baisse du taux de germination d’environ 2% chez les lots traités par la concentration élevée en AlCl3 (600 mg/L).
Figure 8 : Taux moyen de germination de graines de blé dur (Triticum durum Desf.) après 7 jours, en fonction des concentrations croissantes de chlorure d’aluminium
(AlCl3).
Les données sont présentées sous forme de moyenne de 15 expériences indépendante ± SD. Les moyennes ne partageant pas la même lettre sont significativement différentes à p ≤ 0,05
par le test LSD de Fisher.
A A A A 0 10 20 30 40 50 60 70 80 90 100 110 T(H2O) 100 300 600 G erm inati on (%) G P(% ) AlCl3(mg/L)
CHAPITRE II RESULTATS ET DISCUSSION
32
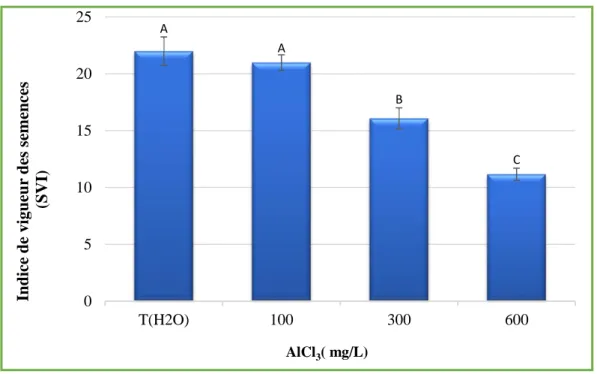
II.1.1.2. Indice de vigueur des semences (SVI)
L’effet de différentes concentrations de chlorure d’aluminium (AlCl3) sur l’indice de vigueur des semences (SVI) de blé dur est présenté dans la figure 09.
Les résultats obtenus (Figure 02) révèlent une diminution très hautement
significative (p=0.000 ; Annexe 01 ,Tableau 02 ) de l’indice des vigueurs des grains de blé sous l’influence des concentrations croissantes de chlorure d’aluminium (AlCl3).
Figure 9 : Indice de vigueur des semences de blé dur (Triticum durum Desf.), après 7 jours, en fonction des concentrations croissantes de chlorure d’aluminium (AlCl3). Les données sont présentées sous forme de moyenne de 15 expériences indépendante ± SD. Les moyennes ne partageant pas la même lettre sont significativement différentes à p ≤ 0,05
par le test LSD de Fisher.
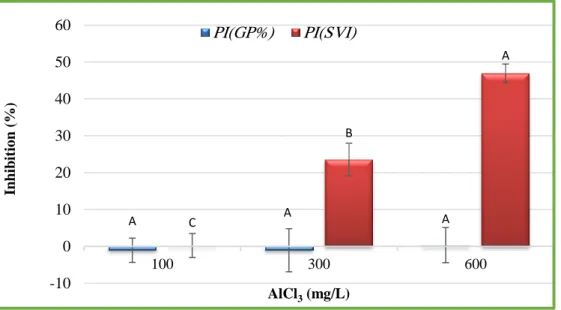
II.1.1.3. Pourcentage d'inhibition de germination et la vigueur des
semences
Pourcentage d'inhibition de germination PI(GP%) et de vigueur des semences PI(SVI) de blé dur (Triticum durum Desf.) après 7 jours, en fonction des concentrations croissantes de chlorure d’aluminium (AlCl3) est présenté dans la figure 10.
A A B C 0 5 10 15 20 25 T(H2O) 100 300 600 Indi ce de vi gueur des s em ence s (SV I) AlCl3( mg/L)
CHAPITRE II RESULTATS ET DISCUSSION
33
Les résultats obtenus (Figure 03) montrent une augmentation non significative (p=0.655 ; Annexe 01 , Tableau 03 ) du pourcentage d'inhibition de germination sous l’effet des concentrations croissantes d’AlCl3. Alor que nous enregistrons une augmentation très hautement significative (p =0.000; Annexe 01 , Tableau 04) du pourcentage d'inhibition de la vigueur des semences, où il atteint de taux le plus élèves (46,9 %) sous l’influence de forte concentration d’AlCl3 (600 mg /L).
Figure 10 : Pourcentage d'inhibition de germination PI(GP%) et la vigueur des semences PI(SVI) du blé dur (Triticum durum Desf.), après 7 jours, en fonction des
concentrations de chlorure d’aluminium (AlCl3).
Les données sont présentées sous forme de moyenne de 15 expériences indépendante ± SD. Les moyennes ne partageant pas la même lettre sont significativement différentes à p ≤ 0,05
par le test LSD de Fisher.
II.1.2. Mobilisation des réserves et l’efficience du métabolisme des graines
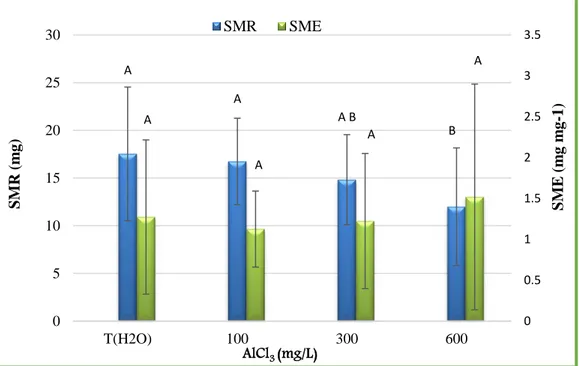
II.1.2.1. Matériel de semence respiré (SMR)
Les résultats concernant le SMR des graines du blé (Triticum durum Desf.) sous l’effet de chlorure d’aluminium (AlCl3) sont présentés dans la figure 11.
L’aluminium induit une légère diminution pour la quantité de matériel de semence respiré (SMR) sous l’effet de faible concentration (100 mg/L) d’AlCl3. Toutefois, son effet est plus remarquable sous des deux autres concentrations (300 et 600 mg/L). Cette
diminution de SMR chez les semences de blé est significative (p=0.048; Annexe 02 ,Tableau 02) A C A A B A -10 0 10 20 30 40 50 60 100 300 600 In h ib itio n ( %) AlCl3(mg/L) PI(GP%) PI(SVI)
CHAPITRE II RESULTATS ET DISCUSSION
34
II.1.2.2. Efficience du métabolisme des graines (SME)
Pour l’efficience métabolique des semences (SME) (Figure 04), les résultats de l’effet de l’aluminium sont non significatifs (p=0.714; Annexe 02 , Tableau 01). Les concentrations 100 et 300 mg/L d’AlCl3 ont entrainés une réduction de SME par rapport aux semences témoin de blé dur. Par ailleurs, il y a une augmentation remarquable de SME sous l’influence de forte concentration d’AlCl3 (600 mg/L) au milieu.
Figure 11 : Efficience métabolique des semences (SME) et la quantité de matériel de semence respiré (SMR) de blé dur (Triticum durum Desf.) exposé pendant 7 jours à des
concentrations croissantes de chlorure d’aluminium (AlCl3).
Les données sont présentées sous forme de moyenne de 15 expériences indépendante ± SD. Les moyennes ne partageant pas la même lettre sont significativement différentes à p ≤ 0,05
par le test LSD de Fisher.
A A A B B A A A A 0 0.5 1 1.5 2 2.5 3 3.5 0 5 10 15 20 25 30 T(H2O) 100 300 600 SME ( m g m g -1 ) SMR ( m g) AlCl3 (mg/L) SMR SME
CHAPITRE II RESULTATS ET DISCUSSION
35 II.1
.3. Paramètres de croissance
II.1.3. 1. Longueur de plumule, radicule et plantule de blé dur
L’effet de chlorure d’aluminium (AlCl3) sur la croissance des plantules de blé dur (Triticum durum Desf.) est présenté dans la figure 12.
Les mesures de la longueur des plumules, des radicules et des plantules sous des concentrations croissantes d’AlCl3, après sept jours de la germination sont montrées dans la figure 05.
La croissance en longueur des plumules s’est déroulée normalement dans les lots témoins (14.29 cm). En revanche, pour les lots traités (sous stress d’aluminium), les résultats sont différents. En effet, la concentration 100 mg/L d’AlCl3 a un effet positif sur l’allongement des plumules avec de valeur de 15.23 cm. Par ailleurs, le traitement des graines par des fortes concentrations en AlCl3, a réduit la croissance des plumules, d’une manière très hautement significative (p =0.000; Annexe 03 , Tableau 02).
Concernantl’effet de chlorure d’aluminium (AlCl3) sur la longueur des radicules, il a été constaté un effet inhibitif chez toutes les graines traitées aux différentes doses d’AlCl3, avec des différences très hautement significatives (p =0.000; Annexe 03 , Tableau 01).
Cet effet est inversement proportionnel à la concentration du milieu en aluminium, plus la concentrationest élevée plus la longueur des radicules est courte.
Pour la longueur totale de plantule du blé (TSL), les résultats obtenus montrent que sous l’effet de chlorure d’aluminium (AlCl3) au milieu, la longueur de plantule se varie de manière très hautement significative (p =0.000; Annexe 03 , Tableau 03).
La longueur des plantules du blé sous faible concentration (100 mg/L) d’AlCl3 est presque la même que chez plantules témoin. Tandis que sous des autres concentrations (300 et 600 mg/L), la croissance en longueur des plantules du blé se diminue considérablement, par rapport au témoin.
CHAPITRE II RESULTATS ET DISCUSSION
36
Figure 12 : Longueur de plumule (SHL), de la radicule (RTL) et la longueur totale de la plantule (TSL) de blé dur (Triticum durum Desf.), après 7 jours de germination, en fonction des concentrations croissantes de chlorure d’aluminium (AlCl3).
Les données sont présentées sous forme de moyenne de 15 expériences indépendante ± SD. Les moyennes ne partageant pas la même lettre sont significativement différentes à p≤ 0,05 par le test LSD de Fisher.
II.1.3.2. Pourcentage de Phytotoxicité de chlorure d’aluminium (AlCl
3) sur
la longueur de plumule, de radicule et de plantule
Les pourcentages de phytotoxicité d’AlCl3 sur la longueur de plumule SHP(%) et la radicule RTP(%) et de plantule totale TSP(%) de blé dur (Triticum durum Desf.) sont présenté dans la figure 13.
Les différents types des longueurs sont diminués de manières différentes (Figure 13). Le pourcentage de phytotoxicité chez les plantules du blé dur est plus élevé avec l'augmentation de la concentration métallique dans le milieu (Figure 13), et les variances statistiques sont très hautement significatives (p =0.000; Annexe 03), pour les différents types des longueurs, et les racines sont plus affectées par l'aluminium que les plumules.
A A B C A B C D A A B C 0 5 10 15 20 25 30 T(H2O) 100 300 600 L o ng ueur (cm ) AlCl3(mg/L) SHL(cm) RTL(cm) TSL(cm)