PRESERVATION DE LA FORME REDUITE DE
L'ACIDE L-5-MÉTHYLTÉTRAHYDROFOLIQUE
(L-5-MTHF) PAR L'AJOUT D'ANTIOXYDANTS
NATURELS COUPLÉ À UN TRAITEMENT
D'ÉLECTRORÉDUCTION
Mémoire présenté
à la Faculté des études supérieures et postdoctorale de l'Université Laval dans le cadre du programme de maîtrise en Sciences et Technologies des Aliments
pour l'obtention du grade de Maître es Sciences (M. Se.)
DEPARTEMENT DES SCIENCES DES ALIMENTS ET DE NUTRITION FACULTÉ DES SCIENCES DE L'AGRICULTURE ET DE L'ALIMENTATION
UNIVERSITÉ LAVAL QUÉBEC
2012
Résumé
L'acide L-5-méthyltétrahydrofolique (L-5-MTHF) est une forme réduite de l'acide folique qui est très susceptible à l'oxydation. Cette étude avait pour but de préserver le L-5-MTHF par l'ajout d'antioxydants naturels, couplé avec un traitement d'électroréduction. Il a été montré que l'ajout d'acide ascorbique (AA) et d'extraits enrichis en épigallocatéchine gallate (EGCGe) et en épigallocatéchine (EGCe) permettait la stabilité du L-5-MTHF pendant 12 h en présence d'air, par la méthode de voltampérométrie cyclique. Une hypothèse de réaction d'oxydation du L-5-MTHF a également été proposée. De plus, l'effet des catéchines serait dû à des interactions avec le L-5-MTHF par le biais de liaisons hydrogènes et la diminution du potentiel redox, permettant ainsi de limiter les réactions d'oxydation. De plus, l'utilisation d'un traitement d'électroréduction afin de diminuer davantage le potentiel redox d'un extrait d'EGCGe a permis de mettre en évidence la stabilité du L-5-MTHF pendant 32 jours à 4°C, avec ou sans l'ajout d'AA.
Abstract
The L-5-methyltetrahydrofolic acid (L-5-MTHF) is a reduced form of folic acid that is very susceptible to oxidation. This study aimed to preserve the L-5-MTHF by the addition of natural antioxidants, coupled with an electroreduction treatment. It was shown that the addition of ascorbic acid (AA) and green tea extracts enriched in epigallocatechin gallate (EGCGe) and epigallocatechin (EGCe) allowed the stability of L-5-MTHF for 12 h in air, by cyclic voltammetry. A hypothesis for the oxidation reaction of L-5-MTHF was also proposed. Moreover, the effect of catechins would be due to interactions with the L-5-MTHF through hydrogen bonds and the decrease of redox potential, limiting consequently the oxidation reactions. Furthermore, the use of an electroreduction treatment to further diminish the redox potential of an extract of EGCGe has allowed the stability of L-5-MTHF for 32 days at 4°C, with or without the addition of AA.
Ce mémoire est composé de cinq chapitres. Le premier chapitre est une revue de littérature traitant des défauts de fermeture du tube neural (NTDs), de l'acide folique et ses dérivés, de la forme naturelle de l'acide folique, soit l'acide L-5-méthyltétrahydrofolique (L-5-MTHF) et de ses modes de préservation, des mesures et modification de l'activité oxydoréductrice et enfin des problématiques découlant du sujet, de l'hypothèse formulée ainsi que des différents objectifs à atteindre afin de vérifier l'hypothèse. Les trois chapitres suivants, rédigés sous forme d'articles, décrivent l'ensemble des expérimentations et les résultats obtenus. Tous les travaux qui y sont présentés ont été effectués par l'auteure, parfois avec une assistance technique. Enfin, le dernier chapitre présentera une discussion et une conclusion générale.
Le deuxième chapitre a été accepté pour publication dans « Food Chemistry » sous le titre « The use of cyclic voltammetry to study the oxidation of L-5-methyltetrahydrofolate and its preservation by ascorbic acid ». Auteurs : Elodie Rozoy, Stephan Simard, Yahzeng Liu, David Kitts, Jean Lessard et Laurent Bazinet. Ce chapitre visait tout d'abord à comprendre les mécanismes d'oxydation du L-5-MTHF par la technique de voltampérométrie cyclique, ainsi que d'utiliser l'acide ascorbique comme antioxydant pour permettre une stabilité du L-5-MTHF.
Le troisième chapitre s'intitule «Redox properties of catechins and enriched tea extracts effectively preserve L-5-methyltetrahydrofolate: Assessment using cyclic voltammetry analysis» et les auteurs sont Elodie Rozoy, Monica Araya-Farias, Stephan Simard, David Kitts, Jean Lessard et Laurent Bazinet. Ces travaux visaient l'étude de la préservation du L-5-MTHF par l'ajout d'extraits de thé vert enrichis en épigallocatéchine gallate (EGCG) ou épigallocatéchine (EGC), ainsi qu'en catéchines pures. Ces résultats seront soumis au journal Food Chemistry.
Le quatrième chapitre s'intitule «Electrochemical modification of the redox potential of EGCG-enriched green tea for the preservation of L-5-methyltetrahydrofolate with or without ascorbic acid and its evolution during storage» et les auteurs sont Elodie Rozoy, Monica Araya-Farias et Laurent Bazinet. Ces travaux ont permis d'étudier l'impact de l'électroréduction d'une infusion de thé vert enrichie en EGCG, combiné ou non avec l'acide ascorbique, sur la préservation du L-5-MTHF contre l'oxydation pendant un entreposage à long terme sous réfrigération. Ces résultats seront soumis au journal Food Chemistry.
Remerciements
Je tiens tout d'abord à remercier le Dr. Laurent Bazinet, mon directeur de recherche pour m'avoir permis de réaliser ces deux années de maîtrise au sein de son équipe de recherche et pour m'avoir consacré énormément de son temps afin de répondre à mes questions, ainsi que corriger les articles faisant partie de ce mémoire. Je le remercie également pour son soutien continuel et ses admirables qualités humaines, dont il a fait preuve pendant ma maîtrise. J'aimerais également remercier mon co-superviseur, le Dr. David Kitts, pour son accueil et sa précieuse aide en ce qui concerne les révisions, notamment linguistiques, effectuées sur les différents articles. Je souhaite remercier le Dr. Stephan Simard pour m'avoir permis de réaliser mes travaux de voltampérométrie cyclique au sein de son laboratoire à l'Institut des Sciences de la Mer (ISMER) à Rimouski. Je souhaite également remercier le Dr. Jean Lessard pour ses précieuses connaissances en électrochimie et en chimie organique, qui ont permis une meilleure compréhension de certains résultats et ainsi une amélioration des articles. Je remercie également sincèrement Monica Araya-Farias pour ses conseils et son aide précieuse, tant sur le plan technique que personnel, depuis le début de ma maîtrise.
Je remercie également le Dr. Muriel Subirade pour avoir accepté d'évaluer ce mémoire.
Je souhaite particulièrement remercier le Dr. Linda Saucier, qui m'a accueillie à mon arrivée à Québec, il y a quatre années de cela, et qui a eu une grande influence sur la poursuite de mes études au Baccalauréat et à la Maîtrise, ainsi que sur la qualité de ma rédaction et réflexion scientifique.
Je tiens également à remercier Sophie Banville, pour sa bonne humeur et ses conseils avisés.
J'aimerais remercier particulièrement les personnes qui m'ont offert une aide considérable au laboratoire : Diane Gagnon, Alain Gaudreau, Mélanie Martineau et Gaétan Desnoyer. Un grand merci aussi à Catherine Perron-Fortin, qui a réalisé une partie de mes expériences de voltampérométrie cyclique et à Claire Mourgues qui a grandement aidé à ma compréhension des techniques électrochimiques, à Rimouski.
Je tiens également à remercier mes collègues étudiants et mes amis pour leur soutien, leurs conseils, leurs encouragements et leur aide précieuse au quotidien : Amélie, Olivier, Maryline, Alain, Jérémie, Christophe, Valérie, Cyril, Benoît, Allison, et tant d'autres.
Bien entendu je souhaite remercier ma famille : mes parents et mon frère qui m'ont supporté continuellement dans ce projet et mes grands parents pour qui la distance nous séparant n'est pas facile.
Enfin je voudrais remercier Laurent Bazinet, le Conseil de Recherche en Sciences Naturelles et en Génie du Canada (CRSNG) et le Réseau des aliments et des matériaux d'avant-garde (AFMNET) pour avoir rendu ce projet possible grâce à leur apport financier.
des pierres : mais une accumulation de faits n 'est pas plus une science qu 'un
tas de pierres n 'est une maison. »
Table des matières
Résumé iii Abstract iv Avant-Propos v Remerciements vii Table des matières xi Liste des tableaux xv Liste des Figures xvii Liste des abréviations utilisées xix
Introduction 1 Chapitre 1 5 Revue de Littérature 5
1. Les défauts de fermeture du tube neural (NTDs) 7
2. L'acide folique et ses dérivés 8 2.1. Structure de l'acide folique 8
2.2. Rôles métaboliques 9 2.3. Sources et besoins 10 2.4. Effets sur la santé 11 3. Forme naturelle de l'acide folique ou l'acide L-5-méthyltétrahydrofolique
(L-5-MTHF) 11 3.1. Structure et formes du L-5-MTHF 12
3.2. Rôles métaboliques du L-5-MTHF 13 3.3. Sensibilité et stabilité du L-5-MTHF 13 3.4. Méthodes de préservation du L-5-MTHF dans les aliments 14
3.4.1. Le taux d'humidité 14 3.4.2. La congélation 15 3.4.3. Traitements thermiques 15
3.4.4. Haute pression 15 3.4.5. Présence d'agents pro-oxydants et d'agents liants 16
3.4.6. Élimination du substrat sensible à l'oxydation 16 3.4.7. L'élimination de l'oxygène et de la lumière 16
3.4.8. Encapsulation 17 3.4.9. Les antioxydants 17
3.4.9.1. Définition et propriétés 17 3.4.9.2. Principaux types d'antioxydants et leurs modes d'action 18
3.4.9.2.1. Antioxydants secondaires 19 3.4.9.2.2. Antioxydants primaires 21 4. Mesures de l'activité oxydo-réductrice 24
4.1. Méthodes de dosage 25 4.2. Méthodes électrochimiques 25
4.2.2. La voltampérométrie linéaire 28 4.3. Le potentiel d'oxydo-réduction (ORP) 28
4.3.1. Définition 28 4.3.2. Méthodes de mesures de l'ORP 29
4.3.2.1. Indicateurs colorés 29 4.3.2.2. Électrodes combinées 30 4.3.3. Utilisation dans les aliments 30
5. Modifications de l'ORP 31 5.1. Contrôle chimique de l'ORP 31
5.2. Contrôle physique de l'ORP 32 5.3. Contrôle électrochimique de l'ORP 32
5.3.1. Principe de l'électrolyse 32
5.3.2. Électroréduction 33 5.3.3. Applications en industrie alimentaire 34
Hypothèse et Objectifs 36
Chapitre 2 37 The use of cyclic voltammetry to study the oxidation of L-5-methyltetrahydrofolate
and its preservation by ascorbic acid 37
Transition contextuelle 39
Résumé 41 Abstract 42
1. Introduction 43 2. Materials and methods 45
2.1. Chemicals 45 2.2. Methods 45
2.2.1. Cyclic voltammetry 45 2.2.2. L-5-MTHF and ascorbic acid chromatographic studies 47
2.2.3. Regeneration of L-5-MTHF thermal oxidation 48
2.2.4. Statistical analyses 48 3. Results and Discussion 49
4. Conclusion 60
Chapitre 3 61 Redox properties of catechins and enriched tea extracts effectively preserve
L-5-methyltetrahydrofolate: Assessment using cyclic voltammetry analysis 61
Transition contextuelle 63
Résumé 65 Abstract 66
1. Introduction 67 2. Materials and methods 68
2.1. Chemicals 68 2.2. Preparation ofthe green tea enriched extracts 69
2.3. Cyclic voltammetry study 69 2.4. Chromatographic study 70 2.5. LC-MS analysis of L-5-MTHF and catechins 71
2.6. Oxidation-reduction potential measurement (ORP) 72
2.7. Dissolved oxygen (DO) measurements 72
2.8. ORACFL measurements 73
2.9. Statistical analyses 74 3. Results and discussion 74
4. Conclusion 88
Chapitre 4 89 Electrochemical modification of the redox potential of EGCG-enriched green tea for
the preservation of L-5-methyltetrahydrofolate with or without ascorbic acid and its
evolution during storage 89 Transition contextuelle 91
Résumé 93 Abstract 94
1. Introduction 95 2. Materials and methods 96
2.1. Materials 96 2.1.1. Chemicals 96 2.1.2. Preparation of EGCG-enriched green tea (EGT) 97
2.1.3. Electroreduction system 98
2.2. Protocols 99 2.2.1. Treatments 99 2.2.2. Storage 100 2.3. Analyses 100
2.3.1. Oxidoreduction potential measurement 100
2.3.2. Dissolved oxygen (DO) 101
2.3.3. Conductivity 101
2.3.4. pH 101 2.3.5. Current intensity 101
2.3.6. L-5-MTHF and catechin contents 102
2.3.7. Statistical analyses 103
3. Results 103 3.1. Electroreduction treatment of EGT 103
3.2. Storage of electroreduced and non electroreduce EGT samples 105
3.2.1. Oxidoreduction potential (ORP) 105
3.2.2. Dissolved oxygen (DO) 106
3.2.3. pH 108 3.2.4. L-5-MTHF content 109
4. Discussion I l l 4.1. Electroreduction treatment of EGT I l l
4.2. Storage of electroreduced EGT samples and combination of L-5-MTHF
with or without AA 112 5. Conclusion 116
Chapitre 5 119 Discussion et conclusion générales 119
1. Discussion générale 121 2. Conclusion générale 124
Liste des tableaux
Table 2.1 : Percentage of remaining L-5-MTHF 1 mM and AA in presence of ascorbic acid at 1 mM, 10 mM and 100 mM in Britton-Robinson Buffer 0.04 M pH 5.5 after 6 h of
oxidation 57 Table 2.2 : Regeneration study of L-5-MTHF 1 mM after several treatments of AA
addition 58 Table 3.1 : L-5-methyltetrahydrofolic acid content (estimated area) following non
oxidative and oxidative conditions that included the combination of L-5-MTHF with
EGCGe or EGCe1 83
Table 3.2 : Content (estimated area, %) of 1 mM L-5-MTHF, and equimolar combination of L-5-MTHF and standards catechins in non oxidised and oxidised conditions 84 Tableau 3.3 : Oxidoreduction potential (ORP) and dissolved oxygen (DO) results of
Britton-Robinson Buffer, EGCGe 400 mg/L, EGCe 400 mg/L, L-5-MTHF 1 mM, a combination of EGCGe 400 mg/L and L-5-MTHF 1 mM and a combination of EGCe
400 mg/L and L-5-MTHF 1 mM* 87 Table 4.1 : Initial catechins and gallic acid composition (mg/L) of enriched green tea
extracts, mean of electroreduced and non electroreduced EGT 97 Table 4.2 : Content (estimated area, %) of the main peak of 1 mM L-5-MTHF with or
withour AA during a 32 days-storage at 4°C in electroreduced EGT (EGTe) or non
electroreduced EGT 110 Table 4.3 : Content (estimated area, %) of 9.3 min retention time peak during a 32
days-storage at 4°C in electroreduced EGT (EGTe) or non electroreduced EGT with or
Liste des Figures
Figure 1.1: Représentations du spina bifida et de l'anencéphalie, adaptés des sites des centres pour la prévention et le contrôle des maladies (www.cdc.gov/az/a.html) et
d'information sur l'anencéphalie (www.anencephalie-info.org) 7 Figure 1.2 : Structure chimique de l'acide folique (adapté de Locksmith et Duff., 1998)...9
Figure 1.3 : Structures de certaines formes métaboliques de l'acide folique 10 Figure 1.4 : Structure chimique du L-5-méthyltétrahydrofolate (A) et du
5-méthyldihydrofolate (B) (Wallin et Kuznesof, 2005) 13 Figure 1.5 : Schéma d'auto-oxydation des lipides (adapté de Dobarganes, 2011) 18
Figure 1.6 : Structure chimique de l'acide ascorbique et mécanisme d'oxydation par un radical libre (A) et par l'oxygène (B) (adapté de Best, 1990 et Liao et Seib, 1988)... 20
Figure 1.7 : Structure générale et structures spécifiques des catéchines 24 Figure 1.8 : Schéma d'une cellule de voltampérométrie cyclique 26 Figure 1.9 : Voltammogramme d'une réaction d'oxydoréduction obtenue par
voltampérométrie cyclique, adapté de Bontempelli et Toniolo (2009) 27 Figure 1.10 : Schéma d'une cellule d'électrolyse (adapté de Bolduc et al., 2006) 34 Figure 2.1 : Cyclic voltammogram of L-5-MTHF ImM in Britton-Robinson Buffer 0.04 M
pH 5.5 under air condition (A) and nitrogen condition (B), taken to 1.7 V at a scan rate of 50mV.s-l. The insert shows the degradation curve of L-5-MTHF under air
conditions (corrected without the blank, with standard deviations) 50 Figure 2.2 : Cyclic voltammogram of L-5-MTHF 1 mM in Britton-Robinson Buffer 0.04
M pH 5.5 under nitrogen with potentials from -1.5 to 1.7 V. The scan was stopped at
0.9 V and an agitation of 5 s was performed before the scan was continued 52 Figure 2.3: molecular structures of L-5-MTHF (A) and possible oxidation process of the
two peaks recording on CV 53 Figure 2.4 : Cyclic voltammogram of ascorbic acid ImM in Britton-Robinson Buffer
0.04 M pH 5.5 under air conditions (A) and nitrogen condition (B), taken to 1.7 V at a scan rate of 50 mV.s-1. The insert shows the degradation curve of ascorbic acid under
air conditions (corrected without the blank with standard deviation) 55 Figure 2.5 : Cyclic voltammogram of L-5-MTHF and ascorbic acid in combination at
ImM each in Britton-Robinson Buffer 0.04 M pH 5.5 under air conditions, taken to
1.7 V at a scan rate of 50 mV.s"1 56
Figure 2.6 : HPLC detection of L-5-MTHF and related oxidation products. A: Control, no AA and open incubation of L-5-MTHF for 6 h at room temperature; B: 6 h incubation of L-5-MTHF at room temperature, followed by addition of ImM AA; C: 6 h incubation of L-5-MTHF at room temperature, followed by the addition of 100 mM of AA. OX-1: oxidation product 1; OX-2: oxidation product 2; AA: sodium ascorbate. 59 Figure 3.1 : Cyclic voltammograms of 80 mg/L EGCGe (A) and 80 mg/L EGCe (B) during
Figure 3.2: Cyclic voltammograms of 1 mM L-5-MTHF added of different concentrations of EGCGe (A) and EGCe (B) under nitrogen (dash line). The insert shows the second peak decrease of L-5-MTHF as a function of green tea enriched extract addition 76 Figure 3.3: Cyclic voltammograms of EGCGe 80 mg/L (A) and 400 mg/L (B) under air
and EGCe 80 mg/L (C) and 400 mg/L (D) under air during 12 hours analysis 77 Figure 3.4: Cyclic voltammograms of 1 mM L-5-MTHF in combination with EGCGe
80 mg/L (A) and EGCGe 400 mg/L (B) under air and 1 mM L-5-MTHF in combination with EGCe 80 mg/L (C) and 400 mg/L (D) under air during 12 hours
analysis 78 Figure 3.5: Chromatograms of L-5-MTHF 1 mM in Britton-Robinson Buffer non oxidised
(A) and oxidised under air for 12 hours (B), EGCGe 400 mg/L non oxidised (C) and oxidised (D), combinations of L-5-MTHF 1 mM with EGCGe 400 mg/L non oxidised (E) and oxidised (F), EGCe 400 mg/L non oxidised (G) and oxidised (H), and combination of L-5-MTHF 1 mM with EGCe 400 mg/L non oxidised (I) and oxidised
(J) 82 Figure 3.6: Molecular structures of L-5-MTHF (A) and EGC (B) and EGCG (C) and
possible interaction between them (D) 85 Figure 4.1: Electroreduction cell configuration and theoretical water electrolysis reduction
reaction (adapted from Bazinet, Schreyer & Lessard, 2011). C+ cation, A" anion, e~
electron, H+ proton, OH~ hydroxide 99
Figure 4.2: Evolution of (A) current intensity (mA), (B) ORP (mV), (C) DO (mg/L), (D) pH and (E) conductivity (uS/cm) during electroreduction treatment of EGT (n = 3). 104 Figure 4.3 : Evolution in ORP (mV) of electroreduced (EGTe) and non electroreduced
EGT with or without 1 mM L-5-MTHF and 1 mM AA during 32 days storage at 4°C
(n=3) 106 Figure 4.4: Evolution in DO (mg/L) of electroreduced (EGTe) and non electroreduced
EGT with or without 1 mM L-5-MTHF and 1 mM AA during 32 days storage at 4°C
(n=3) 107 Figure 4.5: Evolution in pH of electroreduced (EGTe) and non electroreduced EGT with or
Liste des abréviations utilisées
5-MDHF : 5-méthyl-5,6-dihydrofolate AA : acide ascorbique
AAPH : 2'2-azobis-2-aminopropane dihydrochloride ABTS : acide 2,2'azinobis(3-éthylbenzthiazoline) AF : acide folique, en anglais « folic acid », AF ANOVA : analyse de la variance
Aw : de l'anglais « Activity of water » soit l'activité de l'eau
AWA : de l'anglais « acetone/water/acetic acid », soit acétone/eau/acide acétique BHA : hydroxyanisole butylé
BHT : hydroxytoluène butylé C : (+)-catéchine CAFF : caffeine
CG : (-)-catéchine gallate
DDT : dichlorodiphényltrichloroéthane DHAA : acide déhydroascorbique
DHF : acide dihydrofolique EC : (-)-épicatéchine ECG : (-)-épicatéchine gallate
EDTA : acide ethylene diamine tétra acétique EGC : épigallocatéchine
EGCe : extrait enrichi en épigallocatéchine EGCG : épigallocatéchine gallate
EGCGe : extrait enrichi en épigallocatéchine gallate
EGT : de l'anglais «enriched green tea extract» ou extrait de thé vert enrichi FRAP : de l'anglais « Ferrie Reducing/Antioxydant Power »
GCG : (-)-gallocatéchine gallate
GRAS : de l'anglais « Generally Recognize As Safe »
HPLC : de l'anglais « High Performance Liquid Chromatography », soit Chromatographic Liquide Haute Performance
L-5-MTHF : acide L-5-méthyltétrahydrofolique
LC-MS : de l'anglais « Liquid Chromatography with Mass Spectroscopy » ou Chromatographic Liquide à Spectrométrie de Masse
MANOVA : analyse de la variance avec mesures répétées ND : non détectable
NTDs : de l'anglais « Neural closure Tube Defects » soit défaut de fermeture du tube neural
OD: ORAC
oxygène dissous ou dissolved oxygen (DO) en anglais
de l'anglais « Oxygen Radical Absorbance Capacity », soit Capacité d'Absorbance de l'Oxygène Radicalaire
ORP : de l'anglais « oxido-reduction potential », soit potentiel d'oxydoréduction (ou redox, ou Eh)
PABA : acide para-aminobenzoïque
ROS : de l'anglais « Reactive Oxygen Species », soit espèces réactives à l'oxygène rpm : rotation par minute
Rt : de l'anglais « retention time », soit temps de rétention
TBARS : acide thiobarbiturique TBHQ : butylhydroquinone tertiaire
TE : de l'anglais « trolox equivalent », soit équivalent trolox UHT : Ultra Haute Température
UV : ultraviolet
Les défauts de fermeture du tube neural (Neural Tube closure Defects, NTDs) dont les formes les plus courantes sont l'anencéphalie et le spina bifida, sont une des classes les plus fréquentes de maladies infantiles, avec une prévalence de 1,58 cas pour 1000 naissances au Canada en 1996 (De Wals, Tairou, Van Allen, Uh, Lowry, Sibbald, Evans, Van den Hof, Zimmer, Crowley, Fernandez, Lee et Niyonsenga, 2007). Il a été démontré que les NTDs sont liées à un manque d'acide folique (vitamine B9) pendant le 1er mois de
la grossesse (Czeizel et Dudas, 1993; De Wals et al., 2007). En effet, la dose recommandée est de 400 pg par jour pour éviter le risque de NTDs (Chacko, Anding, Kozinetz, Grover et Smith, 2003). C'est pourquoi en mars 1996, la FDA rendait obligatoire l'ajout d'acide folique dans les farines à hauteur de 140 pg/100 g de farine aux États-Unis, afin d'augmenter de 30 à 70 % la consommation d'acide folique chez les femmes et réduire les risques de NTDs (De Wals et al., 2007). Le Canada a suivi avec une fortification de 150 pg/100 g de farine un an plus tard (Vidailhet, Bocquet, Bresson, Briend, Chouraqui, Dupont, Darmaun, Frelut, Ghisolfi, Girardet, Goulet, Putet, Rieu, Rigo et Turck, 2008).
Jusqu'à présent, les supplementations s'effectuent en utilisant la forme pharmaceutique des folates, soit l'acide folique (Mason, Dickstein, Jacques, Haggarty, Selhub, Dallai et Rosenberg, 2007). Cependant, certains scientifiques se sont inquiétés des conséquences d'une augmentation de la consommation d'acide folique dans la population, trouvant des associations entre cette surconsommation et l'augmentation des risques de cancers colorectaux (Van Guelpen, Hultdin, Johansson, Hallmans, Stenling, Riboli, Winkvist et Palmqvist, 2006), des risques de cancers de la prostate (Smith, Kim et Refsum, 2008), ainsi que de la prévalence de cancers du sein (Stolzenberg-Solomon, Chang, Leitzmann, Johnson, Johnson, Buys, Hoover et Ziegler, 2006).
(Smith et al., 2008). C'est pourquoi la forme de folate naturellement présente dans les aliments, soit l'acide L-5-méthyltetrahydrofolique (L-5-MTHF), est convoitée pour remplacer l'acide folique en supplementation alimentaire. Cette molécule est plus bioefficace que l'acide folique, c'est-à-dire que l'efficacité avec laquelle le L-5-MTHF est absorbé et converti dans sa forme bioactive est plus grande. Cependant, le L-5-MTHF est beaucoup plus sensible à l'oxydation par la lumière, la chaleur ou l'oxygène que l'acide folique, limitant les applications directes dans les aliments (Wallin et Kuznesof, 2005).
Le L-5-MTHF serait donc un bon substitut à l'acide folique, cependant des moyens de préservation de cette molécule doivent être trouvés. Un des procédés les plus usuels pour contrôler l'oxydation d'une molécule est l'ajout d'antioxydants dans la matrice étudiée afin d'inhiber ou retarder les réactions d'oxydations (Antolovich, Prenzler, Patsalides, McDonald et Robards, 2002). La tendance actuelle des consommateurs est de privilégier les substances naturelles, à l'instar des antioxydants chimiques (ex : BHA, BHT,...); ainsi, il est possible d'utiliser l'acide ascorbique (vitamine C) ou les catéchines du thé vert (Peschel, Sânchez-Rabaneda, Diekmann, Plescher, Gartzîa, Jiménez, Lamuela-Raventôs, Buxaderas et Codina, 2006), qui sont des antioxydants naturels. Le contrôle de l'oxydation peut également être effectué en modifiant le potentiel d'oxydoréduction (redox) du milieu. Le potentiel redox permet de déterminer si un système est globalement dans un état oxydant ou réducteur (Jacob, 1970). Plusieurs méthodes permettent de modifier le potentiel d'oxydoréduction (ORP) et donc de contrôler les réactions d'oxydoréduction. Parmi celles-ci, l'ajout d'additifs chimiques et le barbotage de solutions aux gaz inertes peuvent être utilisés (Alwazeer, Delbeau, Divies et Cachon, 2003; Dave et Shah, 1997). Cependant, ces méthodes sont très peu utilisées en alimentaire, dû à leur réglementation rigoureuse. Une autre méthode, de nature électrochimique, a elle aussi été utilisée récemment en alimentaire, l'électrolyse, comme moyen de contrôler le potentiel d'oxydoréduction. Ce procédé utilise l'énergie électrique pour forcer la formation de réactions d'oxydation (électrooxydation) et de réduction (électroréduction) à la surface d'une électrode en contact
espèces sensibles à l'oxydation, donc théoriquement d'augmenter la stabilité du produit. Ce procédé a notamment été utilisé pour des applications visant à améliorer la qualité microbiologique de l'eau (Kim, Hung et Brackett, 2000), à améliorer la stabilité des jus (Fustier, St-Germain, Lamarche et Mondor, 2011; Hekal, 1983) ou à diminuer l'ORP du lait et des produits du lait (Bolduc et al., 2006; Schreyer, Britten, Chapuzet, Lessard et Bazinet, 2008)
L'objectif de ce travail était d'évaluer l'utilisation d'antioxydants naturels comme moyen de préservation du L-5-MTHF et d'appliquer un traitement d'électroréduction, afin d'augmenter davantage sa stabilité. Cette augmentation de la stabilité du L-5-MTHF permettrait donc son utilisation en remplacement de l'acide folique de synthèse, utilisé actuellement en supplementation dans les farines.
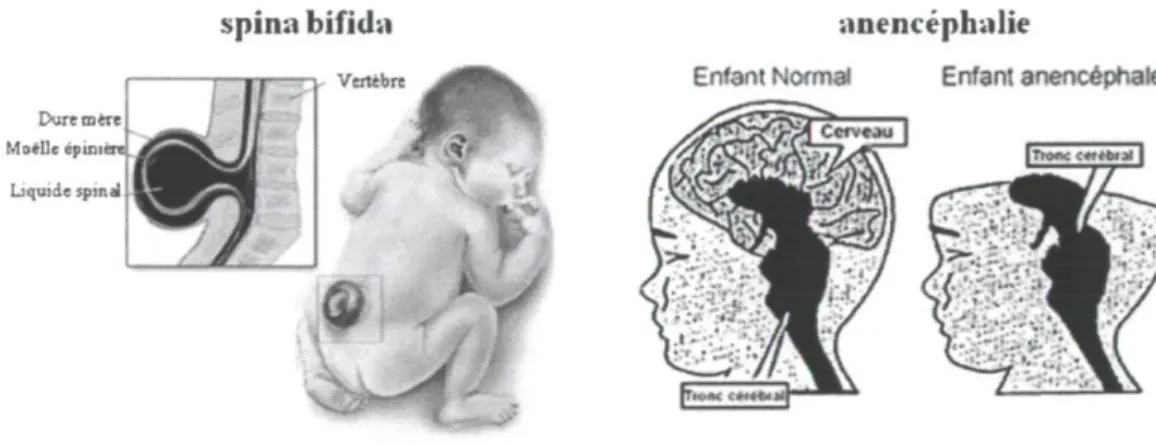
Les défauts de fermeture du tube neural (NTDs), tels que l'anencéphalie et le spina bifida (Fig. 1.1) se développent durant la grossesse. Les NTDs sont liés à un manque d'acide folique pendant le premier mois de la grossesse. Entre 50 et 70 % des NTDs peuvent être prévenus par un ajout d'acide folique et la dose minimale pour avoir un effet est un ajout de 100 pg/jour (Daly, Mills, Molloy, Conley, Lee, Kirke, Weir et Scott, 1997). Ainsi il est recommandé aux femmes enceintes ou voulant avoir un enfant de consommer quotidiennement 400 pg d'acide folique sous forme de multivitamines (Czeizel et Dudas,
1993).
spina bifid»
Vertèbre
Kr
«mencéphalie
Enfant Normal Enfant anencéphate
Figure 1.1: Représentations du spina bifida et de l'anencéphalie, adaptés des sites des centres pour la prévention et le contrôle des maladies (www.cdc.gov/az/a.html) et d'information sur l'anencéphalie (www.anencephalie-info.org)
Cependant, il a été remarqué que malgré la sensibilisation aux NTDs, il est difficile de convaincre plus de 50 % des femmes à prendre des suppléments de multivitamines (Oakley et Godfrey, 2008). De plus, environ 50 % de l'acide folique présent dans les aliments n'est pas biodisponible, ce qui veut dire que seulement 50 % de la quantité d'acide folique ingérée agit de façon effective (Chacko et al., 2003). C'est pourquoi en mars 1996,
États-Unis, afin d'augmenter de 30 à 70 % la consommation d'acide folique chez les femmes et réduire les risques de NTDs (De Wals et al., 2007). Ce niveau d'enrichissement a été choisi car il permet de ne pas masquer l'expression hématologique des carences en vitamine B12, avec le risque de lésions neurologiques irréversibles (Vidailhet et al., 2008). Le Canada a suivi avec une fortification de 150 pg/100 g de farine un an plus tard (Vidailhet et al., 2008).
Au Canada et aux États-Unis, la prévalence des NTDs est par conséquent passée de 1.58 pour 1000 naissances avant fortification, à 0.86 pour 1000 naissances après la fortification, soit une réduction de presque 50 % (De Wals et al., 2007; Mills et Signore, 2004). Le fait que certaines femmes n'atteignent pas la dose de 400 pg d'acide folique par jour même avec la supplementation, ainsi que d'autres facteurs (ethnique, génétique, pertes d'acide folique dans les procédés technologies, etc) expliquent que la totalité des NTDs n'ai pas été éliminée (Heseker, Mason, Selhub, Rosenberg et Jacques, 2009). Cependant, la fortification résulte en une plus grande consommation d'acide folique dans la population entière. Cette fortification généralisée pourrait, selon certaines études, avoir des effets négatifs sur la santé d'une partie de la population (Heseker et al., 2009). Par conséquent, il faut éventuellement envisager l'utilisation d'autres dérivés de l'acide folique pour limiter les NTDs.
2. L'acide folique et ses dérivés
2.1. Structure de l'acide folique
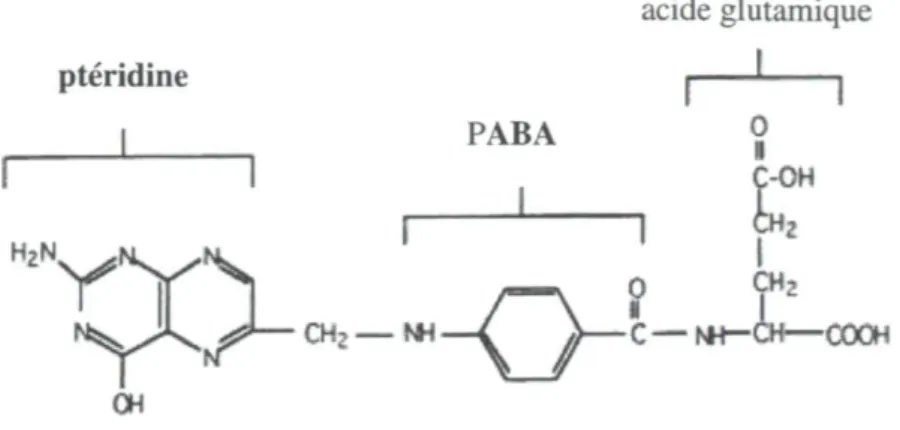
L'acide folique (acide ptéroylmonoglutamique ou vitamine B9) est une vitamine hydrosoluble et est la forme la plus stable des folates. L'acide folique consiste en une molécule d'acide para-aminobenzoïque (PABA) liée à un noyau ptéridine d'un côté et à une molécule d'acide glutamique de l'autre côté (Locksmith et Duff, 1998). La structure de
acide glutamique ptéridine j PABA 0
sr
r-m ~ , r-
i i l /~w
N S T S - j J ^ ^1 CHj W — V /> C — I 4 r - C H (XX OHFigure 1.2 : Structure chimique de l'acide folique (adapté de Locksmith et Duff., 1998)
2.2. Rôles métaboliques
L'acide folique est une vitamine essentielle à l'organisme et est impliquée dans de nombreux mécanismes, tels que la division cellulaire et la croissance. En effet, l'acide folique, comme la plupart des autres vitamines, est le précurseur d'un coenzyme impliqué dans des réactions enzymatiques (Stokstad et Koch, 1967). La fonction des coenzymes de folates est le transfert d'unités carbonées dans le métabolisme des acides aminés et nucléiques. Ce transfert rempli donc un rôle important dans le métabolisme des purines et des pyrimidines (Lucock, 2000; Pitkin, 2007). L'acide folique est également impliqué dans les processus de réparation de l'ADN (Smith et al., 2008) et dans la protection des maladies cardiovasculaires (Smith et al., 2008). Les formes métaboliquement actives de l'acide folique sont l'acide formyltétrahydrofolique (Fig. 1.3A), l'acide méthényltétrahydrofolique (Fig. 1.3B), l'acide formiminotétrahydrofolique (Fig. 1.3C) et l'acide L-5-méthyltétrahydrofolique (L-5-MTHF, Fig. 1.4A).
H
ÇHO n u CH n u C*NH
£ J f V V " JdA_^"
K~ „ AV^
H H
B
Figure 1.3 : Structures de certaines formes métaboliques de l'acide folique, soit l'acide formyltétrahydrofolique (A), l'acide méthényltétrahydrofolique (B) et l'acide formiminotétrahydrofolique (C)
2.3. Sources et besoins
Le corps humain ne peut synthétiser l'acide folique, par conséquent, nous sommes donc dépendant de la présence de cette vitamine dans notre alimentation (Lucock, 2000). Les meilleures sources alimentaires d'acide folique sont les lentilles, les haricots blancs, les asperges, les épinards, la salade, les pâtes alimentaires faites de farines enrichies, l'avocat, les graines de tournesol et le foie de veau, avec un apport de 140 à 400 pg/100g (Santé Canada, 2009). On retrouve également de l'acide folique dans les oranges, les carottes et le brocoli, mais à doses plus faibles (25 à 50 pg/100 g) (Rychlik, 2004). Cependant, comme ces aliments sont davantage consommés, leur importance est plus grande en termes de contribution en acide folique. Ainsi, le jus d'orange est la première source d'acide folique aux États-Unis (Scholl et Johnson, 2000). Le pain, les pommes de terre et les produits laitiers contribuent significativement à notre apport en acide folique, eux aussi de part leur large consommation (Lucock, 2000).
La recommandation en acide folique, pour les hommes et les femmes, est de 400 pg/jour (IOM, 1998). La dose supérieure limite pour la consommation d'acide folique n'est pas clairement élucidée, mais la limite conseillée de consommation est d'img/jour (Smith et al., 2008).
2.4. Effets sur la santé
Plusieurs recherches indiquent que les folates permettent d'éviter certains cancers. En effet, les folates et la vitamine B12 sont des coenzymes nécessaires pour régénérer la methionine à partir de 1'homocysteine. Les carences en acide folique diminuent la régénération de la methionine, altèrent la méthylation de l'ADN et augmentent l'accumulation de 1'homocysteine, ce qui peut augmenter la susceptibilité des gènes à muter, ou altérer l'expression des gènes, facteurs qui sont soupçonnés augmenter les risques de cancer (Stolzenberg-Solomon et al., 2006). L'apport en acide folique à teneur de 400 pg/jour permettrait une baisse significative de la mortalité par accident vasculaire cérébral (Yang, Botto, Erickson, Berry, Sambell, Johansen et Friedman, 2006).
En ce qui concerne l'augmentation des risques de développer certains cancers à cause d'une surconsommation d'acide folique, des contradictions existent entre les études effectuées ces dernières années. En effet, certaines études vont à l'encontre de cette affirmation, ne trouvant pas de relation significative entre la consommation accrue en acide folique depuis la supplementation de 1996 et la prédisposition à des cancers du sein subséquents à la ménopause (Ericson, Sonestedt, Gullberg, Olsson et Wirfalt, 2007; Stolzenberg-Solomon et al., 2006), alors que d'autres vont dans le sens contraire, stipulant qu'une consommation de suppléments en acide folique de 400 pg/jour augmente de 20 % le risque de cancer du sein (Vidailhet et al., 2008). De plus, une diminution de l'apport en acide folique diminuerait le risque de développer un cancer colorectal (Vidailhet et al., 2008). Enfin, l'acide folique peut masquer les symptômes de carence en vitamine B12 (Wallin et Kuznesof, 2005).
3. Forme naturelle de l'acide folique ou l'acide
L-5-méthyltétrahydrofolique(L-5-MTHF)
Le L5-MTHF est la forme naturelle de l'acide folique présente dans les aliments et cette forme a l'avantage de ne pas avoir d'effet sur la santé. Le L-5-MTHF est
généralement reconnu être sans danger pour la santé (GRAS). De plus, des tests effectués avec le L-5-MTHF montrent que sa bioactivité et sa biodisponibilité sont supérieures à celles de l'acide folique (Wallin et Kuznesof, 2005). Cependant, cette forme d'acide folique est très instable et sensible aux conditions environnantes. Afin d'assurer sa stabilité lors de son utilisation dans les aliments, les nombreuses méthodes potentiellement disponibles seront présentées.
3.1. Structure et formes du L-5-MTHF
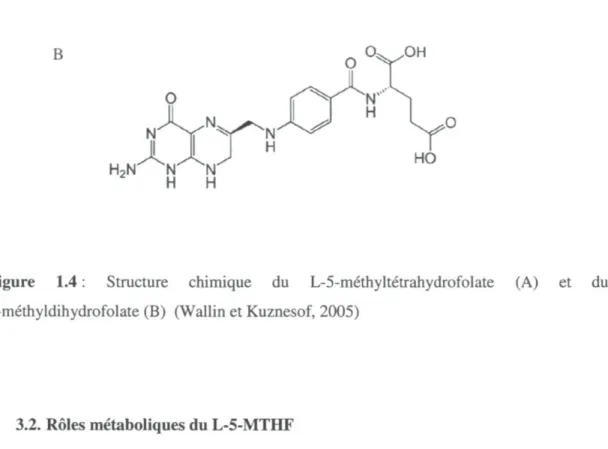
La forme naturelle des folates dans les aliments est l'acide L-méthyltétrahydrofolique (L-MTHF, Figure 1.4A), qui est rapidement oxydé en 5-méthyldihydrofolate (Figure 1.4B) (Gapski, Whiteley et Huennekens, 1971). Ce metabolite représente une grande proportion de notre apport en folates, mais est rapidement détruit en conditions acides, donc sensible à la digestion gastrique, alors que l'acide folique est relativement stable dans ces conditions (Stokstad et Koch, 1967). L'anneau ptéridine de l'acide folique peut facilement être réduit, chimiquement ou enzymatiquement pour donner des dérivés tétrahydro. Les folates qui jouent le rôle de coenzymes et de cofacteurs dans différents métabolismes sont tous sous la forme réduite (Smith et al., 2008). L'acide ascorbique sécrété dans le lumen gastrique peut réduire la forme oxydée du L-5-MTHF de nouveau en forme réduite et permettre une plus grande biodisponibilité des folates (Lucock, 2000).
B
HoN
Figure 1.4 : Structure chimique du L-5-méthyltétrahydrofolate (A) et du 5-méthyldihydrofolate (B) (Wallin et Kuznesof, 2005)
3.2. Rôles métaboliques du L-5-MTHF
Le L-5-MTHF, contrairement à l'acide folique, est un donneur de groupement méthylé (CH3) requis dans la conversion de l'homocystéine en methionine catalysée par la vitamine B12 (Wang et Fenech, 2003). La methionine est requise pour la division cellulaire; le L-5-MTHF pourrait donc être plus efficace pour réduire les dommages de l'ADN et améliorer la prolifération cellulaire que l'acide folique. De plus, le L-5-MTHF, à l'instar de l'acide folique, ne masque pas les symptômes de carence en vitamine B12 (Wallin et Kuznesof, 2005). L'acide folique doit d'abord être réduit en L-5-MTHF pour ensuite pouvoir donner un groupement méthylé (Banerjee, Solomon, Borel, Lewis et Stollar, 1973).
3.3. Sensibilité et stabilité du L-5-MTHF
Les facteurs qui jouent un rôle dans la dégradation des vitamines pendant la transformation alimentaire et le stockage sont la température, l'air ou l'oxygène, la lumière, le taux d'humidité, l'activité de l'eau (Aw), le pH, les enzymes et les traces de métaux,
particulièrement le fer et le cuivre (Bail, 2006). Le L-5-MTHF est rapidement oxydé par l'oxygène de l'air (Stokstad et Koch, 1967).
Le L-5-MTHF est susceptible à l'oxydation, il est donc moins stable que l'acide folique et, sa teneur dans les aliments peut diminuer rapidement à la cuisson (température ou lessivage), au contact avec l'oxygène, voir même pendant l'entreposage à température ambiante (Day et Gregory, 1983; Wallin et Kuznesof, 2005). En effet, Butz et al. ont montré des pertes de 10 à 30 % de L-5-MTHF pendant des traitements à 25 °C et 80°C pendant 25 min dans un jus d'orange (Butz, Serfert, Garcia, Dieterich, Lindauer, Bognar et Tauscher, 2004). Le L-5-MTHF est toutefois très stable pendant 12 mois à -60°C dans les fruits et légumes (Phillips, Wunderlich, Holden, Exler, Gebhardt, Haytowitz, Beecher et Doherty, 2005). Cependant, le L-5-MTHF est plus stable dans certains aliments complexes, qu'en solution aqueuse tamponnée, comme c'est le cas dans le lait (Jones et Nixon, 2002). Le L-5-MTHF apparait avoir la plus grande stabilité dans des gammes de pH de 4 à 7 (Hayashi, Kawamura, Nakasa et Okinaka, 1989).
3.4. Méthodes de préservation du L-5-MTHF dans les aliments
Différentes méthodes présentées ci-après sont utilisées pour préserver les vitamines des aliments et donc pourraient être utilisées pour préserver le L-5-MTHF. L'utilisation d'antioxydants comme moyen de préservation sera davantage décrite, puisque faisant l'objet du présent travail de maitrise.
3.4.1. Le taux d'humidité
Les techniques de déshydratation des produits alimentaires, lorsqu'ils n'exposent pas les aliments à l'air, permettent une bonne préservation des vitamines, dont la vitamine C (Bail, 2006). Lors de l'entreposage à long terme, ces aliments doivent donc être emballés
adéquatement pour éviter des contacts avec l'air, ce qui diminuerait leur teneur en vitamines.
3.4.2. La congélation
La congélation permet une bonne stabilité des vitamines, d'autant plus si elle est réalisée rapidement à très basse températures. De plus, une meilleure stabilité des aliments est effectuée en diminuant la surface de contact des aliments congelés avec l'air (Bail, 2006). L'importance de ce procédé est donc d'éviter le contact des aliments à l'oxygène.
3.4.3. Traitements thermiques
Les traitements thermiques qui appliquent de hautes températures pour un temps court (pasteurisation, Ultra Haute Température -UHT) permettent une bonne stabilité des vitamines. Par exemple, l'application de la pasteurisation au lait a très peu d'effet sur le contenu en vitamines hydrosolubles (dont le L-5-MTHF ou l'acide folique) (Bail, 2006).
3.4.4. Haute pression
Les traitements à haute pression sont des techniques prometteuses pour le remplacement de la pasteurisation. Une étude a montré que le traitement d'œufs de 588 à 784 MPa pendant 30 min à 25 °C a permis une rétention maximale en acide folique (Hayashi et al., 1989).
3.4.5. Présence d'agents pro-oxydants et d'agents liants
Les métaux, tels que le fer ou le cuivre, sont des agents qui favorisent l'oxydation, donc facilitent la dégradation des vitamines. La présence d'agents formant des liens avec le L-5-MTHF, comme les protéines liant les folates dans des matrices laitières diminuent l'accessibilité du L-5-MTHF. Une des façons de préserver le L-5-MTHF est donc de limiter la présence des métaux et des protéines liantes (Arkbâge, Verwei, Havenaar et Witthôft, 2003; DSM, 2011).
3.4.6. Élimination du substrat sensible à l'oxydation
Dans certains cas, une façon de protéger le produit est d'éliminer le substrat qui est sensible à l'oxydation. Par exemple, le fait de remplacer les huiles polyinsaturées par des huiles moins insaturées comme l'huile d'olive ou l'huile de palme, leur confère une meilleure stabilité (Pokorny, 1991).
3.4.7. L'élimination de l'oxygène et de la lumière
Les vitamines sont souvent sensibles à la lumière ainsi qu'à l'air (oxygène), puisque ce sont des promoteurs d'oxydation. La fait d'emballer les vitamines sous azote, sous vide ou avec un capteur d'oxygène (Pokorny, 1991) permet leur protection. De plus, l'entreposage des vitamines à l'abris de la lumière permet de préserver celles-ci de l'oxydation (Pokorny, 1991).
3.4.8. Encapsulation
Les vitamines hydrosolubles et liposolubles peuvent être encapsulées à l'aide de différentes matrices dont l'inclusion dans des liposomes, l'inclusion dans des cyclodextrines (Gibbs, Kermasha, Alli et Mulligan, 1999), l'extrusion ou la co-extrusion (ex : K-carraghénane ou agar) (de Vos, Faas, Spasojevic et Sikkema, 2010). L'encapsulation des vitamines permet alors de réduire les surfaces de contact avec l'air, limitant notamment l'oxydation par l'oxygène. Dans sa forme encapsulée, le L-5-MTHF apparaît être stable en présence de fortes concentrations d'antioxydant tels que l'acide ascorbique (Wallin et Kuznesof, 2005).
3.4.9. Les antioxydants
Parmi les méthodes de préservation du L-5-MTHF proposées, les antioxydants ont retenus notre attention. Les antioxydants naturels comme les polyphenols des plantes ou l'acide ascorbique, sont de plus en plus prisés comme agents de conservation dans les produits alimentaires, dû au développement très important ces dernières années d'un courant santé parmi les consommateurs (Antolovich et al., 2002).
3.4.9.1. Définition et propriétés
Un antioxydant est une substance qui, lorsqu'elle se retrouve en faible concentration par rapport à un substrat oxydable, peut retarder où inhiber, de façon significative, l'oxydation de ce substrat (Gutteridge, 1994). Dans les aliments, le rôle des antioxydants est de retarder ou de contrôler l'oxydation. En industrie alimentaire, les antioxydants sont utilisés pour prévenir la détérioration de la qualité des produits et maintenir leur valeur nutritionnelle (Shahidi, 2000). En effet, le processus d'auto-oxydation et de développement
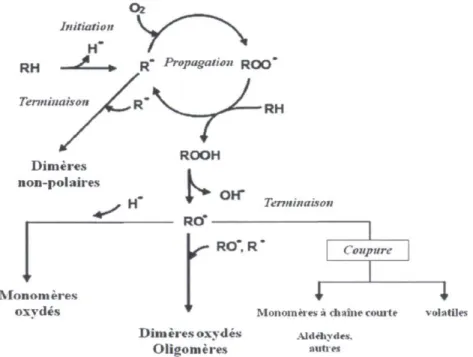
de rancidité dans les aliments implique un mécanisme de réactions libres en chaînes via les étapes d'initiation, de propagation et de terminaison (Fig. 1.5) (Dobarganes, 2011; Shahidi, 2000).
L'activité des antioxydants dépend des aliments dans lesquels ils sont ajoutés, de la concentration utilisée, de la quantité d'oxygène présent et de la présence de catalyseurs d'oxydation (ions métalliques tels que le fer et le cuivre), de la présence d'autres molécules synergiques (Pokorny, 1991), ainsi que de leur mode d'action.
Initiation H" RH JL » R" Propagation ROO* Terminaison R | Dimères non-polaires ROOH H
1-
OH- Terminaixoti RO* M o n o m è r e s oxydés RO". R ' CoupureMonomères à chaîne courte volatiles Dimères oxydés .Aldéhydes.
Oligomères ..««es
Figure 1.5 : Schéma d'auto-oxydation des lipides (adapté de Dobarganes, 2011)
3.4.9.2. Principaux types d'antioxydants et leurs modes d'action
Il existe deux types principaux d'antioxydants, les antioxydants secondaires et les antioxydants primaires, qui ont des modes d'action et des applications complètement différentes. Nous développerons le cas de l'acide ascorbique et des catéchines qui sont
représentatifs des deux groupes et modes d'actions et qui font l'objet du présent mémoire de maîtrise.
3.4.9.2.1. Antioxydants secondaires
a) Mode d'action :
Les antioxydants secondaires ou synergistes peuvent éliminer l'oxygène ou diminuer les concentrations en oxygène dissous, agir en tant qu'agents séquestrants pour diminuer l'effet des ions métalliques catalytiques, éliminer les espèces réactives à l'oxygène, tels que le radical superoxyde (O2) et le peroxyde d'hydrogène (H2O2), ainsi que réagir avec l'oxygène singulet (^2) (Gutteridge, 1994). On retrouve dans cette classe l'acide ascorbique, l'EDTA, les nitrites, la p-carotène,... (Hudson, 1990).
b) Acide ascorbique :
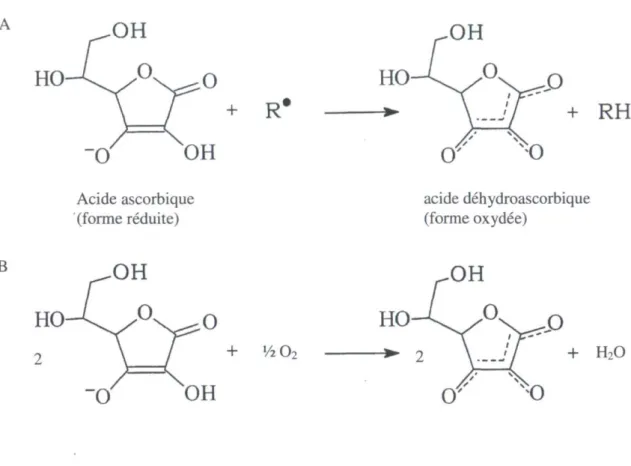
L'acide ascorbique (AA) -ou vitamine C- est un antioxydant secondaire hydrosoluble qui ne peut pas être synthétisé par l'organisme humain (Ren, Luo et Li, 2006). L'AA est un agent réducteur modérément fort. Ses produits stables sont sous formes de sels tels que l'ascorbate de sodium et l'ascorbate de calcium (Hudson, 1990). En solution aqueuse, l'AA est hautement sensible à l'oxygène, à la chaleur et à la lumière. Il est alors rapidement oxydé par un transfert de deux électrons pour donner l'acide déhydroascorbique (Fig. 1.6), par l'intermédiaire du radical libre d'ascorbate ou acide monodéhydroascorbique, une réaction qui est catalysée par les ions métalliques, un radical libre (Fig. 1.6A) ou de l'oxygène (Fig. 1.6B) (Best, 1990; Hudson, 1990; Liao et Seib, 1988). L'AA est un composé électrochimiquement oxydable, qui peut être mesuré par des méthodes électrochimiques.
B
OH
+ R*
Acide ascorbique (forme réduite) + Vi 02OH
+ RH
acide déhydroascorbique (forme oxydée)OH
+
H2OFigure 1.6 : Structure chimique de l'acide ascorbique et mécanisme d'oxydation par un radical libre (A) et par l'oxygène (B) (adapté de Best, 1990 et Liao et Seib, 1988).
Les effets multiples de l'AA comme antioxydant sont (Frankel, 1996; Liao et Seib, 1988):
- Le don d'hydrogène pour régénérer les antioxydants primaires. Par exemple, l'AA peut régénérer les antioxydants phénoliques en transmettant des atomes d'hydrogènes dans la réaction en chaîne de l'oxydation lipidique. Dans ce cas, l'antioxydant secondaire aide l'action de l'antioxydant primaire en le régénérant.
- Chelation des ions métalliques pour réduire le taux d'initiation des réactions d'oxydation par les métaux;
- La réduction des radicaux libres, terminant les réactions radicalaires et prévenant les dommages aux composés alimentaires (Fig. 1.6A);
- Réaction avec l'oxygène en s'oxydant sous la forme de radical libre d'ascorbate et donc en diminuant la concentration en oxygène (Fig. 1.6B).
L'AA est autorisé comme additif alimentaire au Canada et peut se retrouver à une teneur de 200 ppm dans la farine, 150 ppm dans la compote de pommes en conserve, 550 ppm dans les pêches en conserves et dans des concentrations relatives aux bonnes pratiques industrielles dans les autres aliments, y compris les huiles et graisses (ACIA, 2010).
L'AA a été reporté avoir un effet de préservation des folates dans certaines études. En effet, une étude réalisée sur les choux de Bruxelles avait montré que l'AA présent naturellement dans les choux s'oxydait plus rapidement que les folates, pendant un entreposage de 14 jours à -21°C (Malin, 1977). De plus, une étude sur la destruction thermique du L-5-MTHF a montré que l'ajout de d'acide ascorbique à une concentration dix fois supérieur au L-5-MTHF en solution à pH 7, permettait le réduction de seulement 20 % du L-5-MTHF après 3 h de chauffage à 100°C (Chen et Cooper, 1979). Une autre étude a montré que l'utilisation d'AA à 1% permettait une dégradation du L-5-MTHF (à 0,1 M) sept fois moins rapide que sans l'ajout d'AA dans une matrice modèle de jus de citron, chauffée à 88°C pendant 15 s (Matella, Braddock, Gregory et Goodrich, 2005). Oey et al. (2006) ont montré que l'AA était efficace pour protéger le L-5-MTHF, à condition qu'il y ait deux fois plus d'AA que de L-5-MTHF en termes de concentration.
3.4.9.2.2. Antioxydants primaires
a ) Mode d'action
Les antioxydants primaires communément utilisés en alimentaire ont soit deux groupements -OH ou un groupement -OR (Hudson, 1990). Ils sont efficaces à faible concentrations (< 0,01 %), mais peuvent devenir pro-oxydants à forte concentration.
Les antioxydants primaires (AH) peuvent inhiber les réactions d'initiation de l'oxydation en réagissant avec un radical, ou en inhibant la propagation par réaction avec
les radicaux peroxydes ou alkoxyles (Gutteridge, 1994). Les réactions sont les suivantes (Hudson, 1990):
Réaction entre un antioxydant et un radical libre : R* + AH —► RH + A*
ROO* + AH —► ROOH + A* RO* + AH —*► ROH + A*
Reaction de terminaison:
ROOH + A* —► [ROO*AH] qui est un produit non-radical A* + A* —«► AA
A* + R* — * R A A* +ROO* —► ROOA
Régénération de l'antioxydant primaire : A* +BH —► AH + B*
Où AH= antioxydant primaire ; A* = antioxydant oxydé ; R* = radical allyl insaturé ; RH = substrat oxydable; ROO* = radical peroxyde; ROOH = hydroperoxyde ; RO* = radical alkoxyle ; BH = antioxydant secondaire donneur d'hydrogène; B* = radical libre de l'antioxydant secondaire.
Les antioxydants primaires les plus utilisés dans les aliments sont d'origine synthétiques (BHT, BHA, TBHQ ou gallates), mais peuvent être aussi d'origine naturelle tels que les catéchines du thé vert.
b) Les catéchines du thé vert :
Les feuilles de thé sont composées de 25 à 35 % de polyphenols sur base sèche. Les polyphenols les plus importants du thé sont les flavanols, pour lesquels les catéchines
(flavan-3-ols) sont prédominants (Dufresne et Famworth, 2001). Les catéchines présentes dans les feuilles de thé sont divisés en deux groupes:
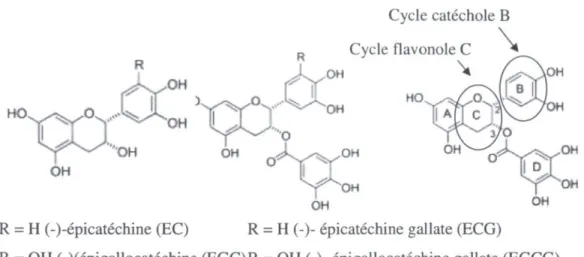
- les non gallatées : (+)-catéchine (C), (+)-gallocatéchine (GC), épicatéchine (EC) et (-)-épigallocatéchine (EGC);
- les catéchines contenant un acide gallique attaché à la position C-3 du flavonole (Figure 1.7), rapportées avoir les propriétés antioxydantes les plus importantes : (-)-épicatéchine gallate (ECG), épigallocatéchine gallate (EGCG), catéchine gallate (CG) et (-)-gallocatéchine gallate (GCG) (Novak, Seruga et Komorsky-Lovric, 2009).
L'EGCG est la plus abondante des catéchines (environ 50 % des catéchines sur base sèche), suivie de l'EGC (environ 20 %), de l'ECG (13 %) et l'EC (6%) (Hara, 2001).
Les catéchines sont des antioxydants primaires et leurs propriétés sont corrélées à leur propriété d'oxydo-réduction, ainsi qu'à leurs nombres et arrangements en groupements hydroxyles -OH, principalement sur le cycle B (Fig. 1.7), puisque le don d'hydrogène ou d'électrons permet l'inhibition des réactions d'oxydation (Janeiro et Oliveira Brett, 2004). L'activité antioxydante des catéchines est augmentée par la présence d'un groupement gallate sur certaines catéchines telles que l'EGCG ou l'ECG (Sang, Hou, Lambert et Yang, 2005). Les catéchines réagissent avec les espèces réactives à l'oxygène (ROS) comme le radical superoxyde, l'oxygène singulet ou encore le radical hydroxyle. L'EGCG est la catéchines la plus efficace pour réagir avec la plupart des ROS (Sang et al., 2005).
Les catéchines sont des composés électrochimiquement actifs qui peuvent être oxydés à la surface d'électrodes à caractère inerte (Makhotkina et Kilmartin, 2010), permettant ainsi la détermination de certaines catactéristiques à l'aide de méthodes électrochimiques utilisant ces électrodes. Il a été montré que dans les catéchines, le cycle catéchole B (Fig. 1.7) est plus facilement oxydable que le cycle résorcinol A (Novak et al., 2009).
Cycle catéchole B \ Cycle flavonole C
XCC
OHy
OH
R = H (-)-épicatéchine (EC) R = H (-)- épicatéchine gallate (ECG)
R = OH (-Xépigallocatéchine (EGC)R = OH (-)- épigallocatéchine gallate (EGCG)
Figure 1.7 : Structure générale et stmctures spécifiques des catéchines
4. Mesures de l'activité oxydo-réductrice
L'activité oxydo-réductrice d'une molécule correspond à son aptitude à être oxydée ou réduite, ou inversement sa capacité à oxyder ou réduire d'autres molécules. L'activité oxydo-réductrice ne peut pas être déterminée directement. Par contre différentes approches sont utilisées telles que la production de radicaux libres et la mesure de leur inhibition par les antioxydants, ou plus indirectement, la mesure de l'inhibition de différents intermédiaires ou de produits finaux de réactions d'oxydation (Antolovich et al., 2002). Il y a plusieurs façons de mesurer l'activité oxydo-réductrice, telles que des méthodes de dosages ou des méthodes électrochimiques comme la voltampérométrie cyclique, ou encore la mesure du potentiel d'oxydo-réduction (ORP).
4.1. Méthodes de dosage
Historiquement, la première technique utilisée pour la mesure de l'activité oxydo-réductrice d'aliments contenant de la matière grasse était l'indice de peroxyde, déterminée par titrage à l'iode (Antolovich et al., 2002). Mais elle a rapidement été secondée par la technique utilisant l'acide thiobarbiturique (TBARS), même si la réaction impliquée dans cette méthode est peu spécifique et que les conditions dans lesquelles s'effectuent cette réaction ont un effet significatif sur le développement de la couleur de la réaction (Antolovich et al., 2002; Raza et John, 2008). D'autres méthodes se basent sur la mesure de produits de dégradation de la matière grasse, tel que l'hexanal (Antolovich et al., 2002) ou sur la mesure de radicaux libres formés, tel que le dosage de l'ABTS (acide 2,2'azinobis(3-éthylbenzthiazoline)-6-sulfonique) (Erel, 2004; Salah, Miller, Paganga, Tijburg, Bolwell et Riceevans, 1995) ou le dosage d'hydroperoxydes (Frankel, Huang, Kanner et German,
1994).
L'activité oxydo-réductrice d'aliments ne contenant pas de matière grasse peut notamment être mesurée par la technique du FRAP (Ferrie Reducing/Antioxidant Power) (Benzie et Szeto, 1999), qui se base sur la réduction du fer ferrique Fe + en fer ferreux Fe2+.
Ces méthodes, ainsi que d'autres non mentionnées, sont utilisées en fonction du type d'aliment et de sa teneur en matière grasse et une combinaison de plusieurs de ces techniques permet une détermination plus juste de l'activité oxydo-réductrice (Schreyer, 2007).
4.2. Méthodes électrochimiques
La voltampérométrie cyclique et la voltampérométrie linéaire sont les deux techniques électrochimiques les plus utilisées pour étudier les réactions d'oxydoréduction d'espèces seules ou en mélange (Bontempelli et Toniolo, 2009). Ces deux méthodes permettent de déterminer l'état d'oxydation ou de réduction d'un mélange, mais également
d'élucider les réactions chimiques couplées avec des étapes de transfert de charge (intermédiaires d'oxydation ou de réduction).
4.2.1. La voltampérométrie cyclique (VC)
En VC (Fig. 1.8), une électrode de travail est placée dans une solution non agitée, contenant des electrolytes en excès pour que le transfert d'espèces électroactives à la surface de l'électrode se fasse uniquement par diffusion (Bontempelli et Toniolo, 2009). La différence de potentiel (AE) appliquée entre l'électrode de travail (W pour « working electrode ») et l'électrode de référence (R pour « reference ») varie de façon cyclique, favorisant des réactions électrochimiques à la surface des électrodes (Tallec, 1985). Le courant est mesuré entre la contre-électrode ou électrode auxiliaire (C pour « counter electrode ») et l'électrode de travail, à l'aide d'un voltmètre relié au potentiostat, ce qui donne comme réponse un voltampérogramme représentant la courbe de l'intensité en fonction du potentiel.
Espace de tête (air, azote, etc)
Solution à étudier
Figure 1.8 : Schéma d'une cellule de voltampérométrie cyclique
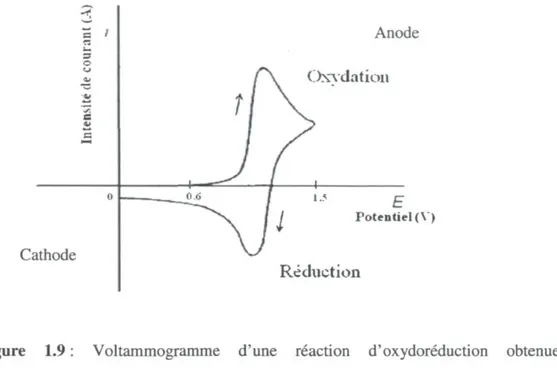
Un potentiel positif (à l'anode) force les réactions d'oxydation, alors qu'un potentiel négatif (à la cathode) force les réactions de réduction. La Figure 1.9 présente un
voltammogramme typique d'une réaction réversible d'électroréduction d'un composé (pic d'oxydation à l'anode et pic de réduction à la cathode) (Bontempelli et Toniolo, 2009).
Cathode Anode Oxydation E Potentiel (\ ) Réduction
Figure 1.9 : Voltammogramme d'une réaction d'oxydoréduction obtenue par voltampérométrie cyclique, adapté de Bontempelli et Toniolo (2009).
Cette méthode permet de donner des informations qualitatives et quantitatives sur des espèces éléctrochimiquement actives, ainsi que de montrer la réversibilité d'un système si les pics d'oxydation et de réduction sont de la même intensité (Bontempelli et Toniolo, 2009).
La VC n'a jusqu'à présent que très peu d'applications en industrie alimentaire étant donné que les aliments étudiés doivent obligatoirement être sous forme liquide. Les cas connus à ce jour sont la détermination du potentiel redox des composés du lait (Schreyer, 2007), l'estimation de la concentration en polyphenols et en acide ascorbique dans le vin (Makhotkina et Kilmartin, 2010); ainsi que la caractérisation des catéchines et autres polyphenols dans le thé (Kilmartin et Hsu, 2003). Il est également à noter qu'une des contraintes de la VC dans la détermination des polyphenols est que ceux-ci s'adsorbent facilement à la surface des électrodes, ce qui peut poser un problème lors des mesures (Martinez, Valek, Petrovic, Metikos-Hukovic et Piljac, 2005).
4.2.2. La voltampérométrie linéaire
La voltampérométrie linéaire consiste en l'application d'une variation de potentiel à très faible vitesse (contrairement à la VC) à l'électrode de travail et la mesure simultanée du courant, correspondant à la réponse de la substance électroactive en solution. L'appareillage est similaire à la voltampérométrie cyclique (voir 4.2.1) sauf que le potentiel de l'électrode de travail évolue de façon linéaire dans le temps du côté anodique ou cathodique. Ainsi, seules les réactions d'oxydation ou de réduction peuvent être visibles pendant la mesure (Bontempelli et Toniolo, 2009). Cela ne permet donc pas de connaître la réversibilité de la réaction d'oxydoréduction en une seule mesure et limite l'utilisation de cette technique.
4.3. Le potentiel d'oxydo-réduction (ORP)
4.3.1. Définition
Le potentiel d'oxydo-réduction ou potentiel redox (Eh) est un paramètre physicochimique qui détermine l'état oxydé ou réducteur d'un milieu et qui dépend des paramètres de composition d'un aliment tels que les acides aminés contenant le groupement thiol (-SH), les peptides, les protéines et les sucres réducteurs, le pH, la température, ainsi que la concentration en oxygène dissous (Alwazeer et al., 2003).
Ce paramètre détermine la capacité d'un système à céder ou capter des électrons. L'oxydation est un procédé dans lequel une substance donne des électrons. La réduction est un procédé, qui au contraire, permet à une substance de gagner des électrons (Jacob, 1970).
La réduction induit des changements électriques, qui peuvent être exprimés par la relation de Nernst (Stock et Orna, 1989):
Et, = Er, + R x T ln r oxydant! x [H+l n x F [réducteur]
Où Eh est le potentiel redox par rapport à l'électrode de référence, Eo est le potentiel redox du système, R est la constante des gaz parfaits, F est la constante de Faraday et n est le nombre d'électrons dans le système d'électroréduction. Le paramètre [oxydant] réfère à la concentration molaire de la forme oxydée, alors que le paramètre [réducteur] réfère à la concentration molaire de l'espèce réduite.
Le potentiel redox dépend donc de la composition du milieu, c'est-à-dire de la concentration en formes oxydées et réduites des espèces électroactives présentes (Jacob, 1970).
4.3.2. Méthodes de mesures de l'ORP
4.3.2.1. Indicateurs colorés
Les méthodes les plus anciennes de mesures d'ORP se faisaient à l'aide d'indicateurs colorés. Les indicateurs colorés étaient principalement des dérivés indigo ou indophénols, qui sont généralement colorés dans leur forme oxydée et non colorés dans leur forme réduite, un transfert d'hydrogène étant nécessaire pour la réduction (Jacob, 1970). C'est le cas notamment du bleu de méthylène. Puisque les indicateurs colorés utilisés couvrent toutes les plages de potentiel redox d'intérêt, ils donnent une indication visuelle rapide de l'ORP de la solution testée (Morris, 2000).
4.3.2.2. Électrodes combinées
Les mesures d'ORP peuvent également s'effectuer grâce aux électrodes combinées. L'électrode utilisée est inerte, donc elle ne prend pas part aux réactions d'oxydo-réduction du système et agit comme un conducteur d'électrons vers ou depuis le système (Jacob, 1970). L'appareillage utilisé est un système qui contient une électrode de référence, une électrode de détection (ou de travail) et un appareil à haute impédance avec un affichage en millivolts de 0,1 mV. L'électrode de référence communément employée est un système d'Ag/AgCl ou une électrode au calomel. L'électrode de détection est souvent un métal noble comme l'or ou le platine, qui sont stables contre les oxydations chimiques et peuvent accepter ou donner des électrons lorsque le potentiel d'ORP est établi à la surface de l'électrode. Le platine est le plus communément employé pour les systèmes aqueux (Anderson et Herdan, 1999).
L'ORP est dépendant de la température, comme le prouve l'équation de Nemst (voir le paragraphe 4.3.1 précédent), mais également de l'oxygène dissous, donc ces deux paramètres doivent être pris en compte (Chen, Chang, Chen, Lu, Cheng et Chen, 2007).
4.3.3. Utilisation dans les aliments
Les premières utilisations du potentiel redox étaient de déterminer l'état physiologique des cultures microbiennes, ce qui permettait le suivi de la croissance bactérienne dans les conserves (Montville et Conway, 1982). Par la suite, le redox a été utilisé pour effectuer des suivis de fermentation ou de vieillissement dans le vin ou la bière pour (Vivas, 1999). La mesure d'ORP voit également des applications dans la détermination des propriétés antioxydantes des polyphenols du thé (Sang et al., 2005).
À part les quelques applications alimentaires citées précédemment, la mesure de l'ORP est peu utilisée pour déterminer les propriétés antioxydantes d'une matrice alimentaire car elle connait plusieurs limitations (Nicoli, Toniolo et Anese, 2004). En
effet le potentiel redox ne donne pas d'information sur la capacité des molécules testées à donner des atomes d'hydrogène, ce qui n'aide pas à déterminer les structures des molécules impliquées dans les réactions d'oxydo-réduction. De plus, le potentiel standard des réactions d'oxydoréduction est généralement difficile à établir dans les matrices alimentaires complexes. Enfin, les procédés technologiques (pH ou ratio molaire des formes oxydées et réduites) peuvent modifier le potentiel redox. C'est notamment le cas pour les antioxydants induits par la chaleur (comme les produits de la réaction de Maillard), ainsi que les polyphenols oxydés (Nicoli et al., 2004).
5. Modifications de l'ORP
Comme démontré précédemment, les mesures de potentiel d'oxydo-réduction (redox ou ORP) ont suscités beaucoup d'intérêt pour la mesure de la capacité antioxydante des polyphenols, notamment dans le thé. Sachant que l'ORP détermine l'état oxydant ou réducteur d'un système, des recherches ont été effectuées afin de modifier cette valeur, dans le but d'augmenter la stabilité de l'aliment, par le biais de produits chimiques, de techniques physique ou également électrochimiques.
5.1. Contrôle chimique de l'ORP
Plusieurs produits existent pour changer le potentiel redox d'un milieu. En effet, des additifs chimiques incorporés aux liquides alimentaires, notamment des produits laitiers, permettent de contrôler l'ORP. Ainsi certains auteurs ont reporté l'ajout de cysteine (Dave et Shah, 1997; Dave et Shah, 1998; Rôdel et Liicke, 1990), de sulfite de sodium (Decker et Ashworth, 1951; Greenbank, 1940), d'acide ascorbique (Decker et Ashworth, 1951) ou de dichlorodiphényltrichloroéthane (DDT) (Gill, Cha, Jain, Rao et Bentley, 1998; Kwong, Randers et Rao, 1992).
5.2. Contrôle physique de l'ORP
L'ajout de gaz inerte, tel que le dihydrogène (H2) ou l'azote (N2), dans un milieu est également un bon moyen de réduire le potentiel d'oxydoréduction (Alwazeer et al., 2003). En effet, l'ajout d'azote en barbotage dans un milieu liquide par exemple, permet de réduire la concentration en oxygène dissous dans le milieu, voir même de faire évacuer tout l'oxygène dissous. Ceci a pour conséquence de réduire le potentiel redox du milieu, par l'inhibition du principal réactif des réactions. Dans la même voie, le contrôle de l'ORP peut se faire grâce à un contrôle de l'agitation et de l'aération, notamment dans un milieu de fermentation (Kwong et Rao, 1991).
Un autre moyen physique pour modifier l'ORP d'un liquide alimentaire est l'application d'un traitement thermique. En effet les traitements thermiques peuvent engendrer des produits de la réaction de Maillard, lorsque des sucres se trouvent en présence de protéines, libérant alors des groupements thiols, ce qui diminue notamment l'ORP dans le lait (Swanson et Sommer, 1940).
5.3. Contrôle électrochimique de l'ORP
L'électrolyse est également une technique de choix puisqu'elle permet de diminuer le potentiel d'oxydo-réduction d'un mélange liquide par des phénomènes électrochimiques (Schreyer et al., 2008).
5.3.1. Principe de l'électrolyse
L'électrolyse est un procédé qui utilise l'énergie électrique pour forcer des réactions d'oxydation ou de réduction d'espèces électrochimiquement actives à se produire à la surface d'une électrode inerte plongée dans la solution à traiter (Bolduc et al., 2006).
Lorsque cette réaction se produit à la surface de la cathode, il est alors possible de réduire les espèces (électroréduction), ce qui permet de diminuer le potentiel redox du produit ou de la solution traitée (Schreyer et al., 2008). L'électrooxydation, au contraire, se produit du côté anodique.
5.3.2. Électroréduction
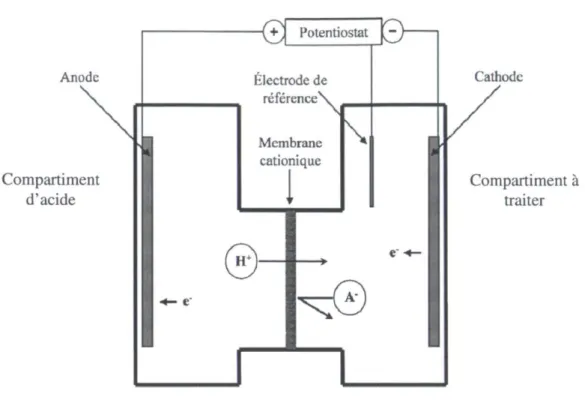
L'électroréduction se produit lorsque l'on applique un potentiel négatif à l'électrode de travail (cathode), ce qui fait que des électrons sont transférés du compartiment anodique au compartiment cathodique. Les molécules et les ions qui sont dans un état oxydé peuvent utiliser les électrons qui proviennent de la cathode pour effectuer une réduction. L'utilisation d'une membrane cationique qui est perméable aux cations et imperméable aux anions permet aux ions H+ de passer du compartiment qui contient l'acide (souvent l'acide
sulfurique H2SO4) au compartiment contenant la solution à traiter et de neutraliser les OH" générés par l'électroréduction de l'eau (Bazinet, Péricou et Araya-Farias, 2009a; Fustier et al., 2011).
La Figure 1.10 ci-dessous schématise les composantes d'une cellule d'électrolyse à membrane cationique. Le produit à traiter est placé dans le compartiment cathodique au contact de la cathode. Les électrodes (anode et cathode) sont reliées à une source électrique qui permet de forcer l'oxydation ou la réduction. La membrane cationique permet de faire passer les ions chargés positivement (cations) du compartiment anodique contenant la solution d'acide dans le compartiment cathodique contenant la solution à traiter. La membrane permet également de bloquer le passage des anions vers le compartiment anodique et d'empêcher la diffusion des substances neutres entre les deux compartiments. Le courant est maintenu constant, afin d'avoir un traitement uniforme.
Anode Compartiment d'acide >*— e" {V Potentiostat ^£) Électrode de référence\ Membrane cationique
0"
\^C
©
Cathode Compartiment à traiterFigure 1.10 : Schéma d'une cellule d'électrolyse (adapté de Bolduc et al., 2006)
5.3.3. Applications en industrie alimentaire
Certaines études ont trouvé des applications de l'électroréduction en alimentaire, menant quelques fois à des brevets. Une des premières études effectuées (Hekal, 1983) a permit de mettre en évidence que l'application d'un traitement d'électrochimique à un jus de fruit, permettait de réduire sa détérioration dans le temps en diminuant la teneur en dioxygène dissous (DO) lors du traitement. Cette étude a été approfondie par Fustier et al. (2011), qui ont démontré que l'électroréduction permettait une réduction des réactions enzymatiques dans les jus de fruits, ainsi que la limitation de la dégradation de l'acide ascorbique; alors qu'une électrooxydation détériorait davantage les jus. D'autres études se sont penchées sur le traitement de l'eau par électroréduction (Crandall, Mantz et Martz, 2001), apportant un meilleur goût à l'eau, notamment au Japon (Koseki, Nakagawa,