de
l'
I n. ei anement d.
l
a
Phy.ique , avec l'ai de de pr of eeeeure
exp' r i
-llentataure.
Il e'alit de l"
di t i on r'vi.ie
du premier document paru en
1974Il .et d'ordr e
~d a g'ue
.
Un
aut r e document exilte
,
d'info~~'ecienti
fi.q
f'LIRE
SPT
3~_
'di
donLes membres du Gro upe de Travail (Mme DUPONT, MM. SOUSSAN, BOURDON, VI OVY ) tiennent à remercier les profes seurs expérimentateurs de leur collaborat ion :
Mmes DAMOTTE Besançon MM. GIBERT Lyon
CASTAING Bordeaux CONVERSET Marseille
LACOSTE
"
MEYER"
GAUTHE Lyon BARTHELEMY Montpellier
DENTAU Nice NICOT
"
GUILLOTIN Orléans FABRE Nice
PARISIS
P
oitiers
ESCLEYNE"
LISSILOUR Rennes MARINELLI
"
VIVIER Maris MARMONTELLI
"
COULON Orléans CHARPENTIER Poitiers
FOURNEL Rennes
MM. MARCHAND Besançon PAUVERT Paris
BERGEY Bordeaux DEMERSSEMAN
"
"
DARGENCOURT"
BEROUARD
'Li l l e VASSILEVSKI
"
1,1 GENERALITES SUR LE MODULE POLYMERES
pr é s en t a tion de certains matériaux et du matériel de chimie
Essais à la flamme
Essais à diverses températures Essais aux solvants
Contrôle expérimental
Transformations physiques : molécules, macromolécules.
7ème leçon : Dépolym~risation du polymethacrylate de méthyle
Leçon 7 bis : Voscosité et polymérisation
8ème leçon Synthèse de quelques matières plastiques 9ème leçon Hydrolyse et synthèse de l'amidon
THEME l : 1ère Leçon 2ème leçon 3ème leçon 4ème leçon Sème leçon THEME II
..
6ème leçon II,23 II, 28 II,38 II, 14 II,1 II,2 1,16 1,33 1,40 1,48 1,9 1,10 III,I III , 2 III , 3 III,4 III,9 III, 19 THEME III : l - Objectifs générauxII - Conseils généraux pour le professeur III - Matières premières
IV - Procédés utilisables et outillage nécessaire V - Bibliographie
Ce documentelt le rêsultat d'une expérimentation menêe entre 1974 et 1976 dans des classea de quatri~me et troisième en remplacement partiel de l'enseignement de la tecbnologie(durée quatre mois environ l deux heures par semaine). Les principaux objectifl de cet enseignement sont précisés dans le chapitre "Généralitês". Cependant, hors de son contexte strict d'application dans une expérimentation, ce texte risque d'être mal interprété, c'est pourquoi noua pensons utile d'aJeuter quelques commentaires.
',,:'
Le module a été conçu pour
- Initier les élèves à la structure de la matière et aux réactions chimiques
- Connaître l'environnement technologique et montrer l'importance de la chimie dans la vie courante ;
- Montrer le caractère interdisciplinaire des sciences expérimentales.
Pour cela, l'enseignement comprenait un noyau chimique et physico-chimi~1l que avec une compolante biologique et technologique, une enquête et une partie
optionnelle technologique ou biologique. Ce document est constitué par le noyau, une présentation de l'enquite et des informationsSPr:l'option technologique. Par souci de simplification, et pour donner une idée du volume de connaillances, il est rédigé SOUI forme de "leçons", mais l'enchaînement des th~mes et des "leçon." n'était pas imposé, l'ordre de l'ouvrage n'est
d~nné
qu'A titre indicatif.1èr e leçon 2ème leçon 3ème leçon 4ème leçon Sème leç on THEME
r
.
_
-
-
- - -
_.
_
_
._---
-
-
- - -
-
- -
- - -
- - -
-
- - - -
- - - -
- -
-l - Pl a n du thème l
Ce thème l comprend c~nq leçons d'env i ron 2 heur es chaque présentation de certains matériaux et du matériel dp chi mi e Essais à la flamme
Essais à diverses températures Essais aux solvan ts
Contrôle expérimental et lancement de l'enquête
I I - Obje c ti f s généraux du thème l
- Se familiariser avec dive r s'IÜas tiques~' savoi r les identi fi er, les nommer .
- Etablir un fichier où Sc t cl a s s é es les diver s e s observations et me sur es.
- Savoir utiliser ce fichi er
- Acquérir des notions chimiques (fu si on, so lub i lité , saturat ion •.. ) Développer les qualités d'obs er va t i on , l ' ap titude à travai l l er en group e et à dé f end r e son point de vue au cours des discuss : ~ol le c tive s. (i l es t évident que ces derniers obje~ti!s sont valables pour l 'ensemble du
module~ mais plus particuli èrement dans
Z
R
pr emie r thème o~ certaines observations sont diversement per çues . Exemples: les odeurs , les coul eurs....)-- T - n
[ PREMIERE LEÇON
PRESENTATION DE 11ATERI AUX ET DU MATERIEL DE CHI~IE
Note pour le professeur :
- La leçon primitive a été raccourci e. On élague for t emen t le nombre d'objets présentés, on simpli f i e leur classement. On famil i ar i s e-ra l 'élève avec les techniques fondamental es. On commenc e de pr é fé r enc e par prendr e contact avec le matériel de chimie ce qui donne l'occ a si on de manipul er .
l - Obje c t i f s
-- révision ou acquisition de techni que s (chauf f a ge, uti -lisa t i on d'un papier indicateur ... )
- sensibilisation au problème de la sécurité - observation.
II - Maté r i e l nécessaire
- bec bunsen ou labogaz - feuille amiante
fil de fer ou de cu~vr e - tube à essa~
- papier pH
- vinaigre (incolore de préf é r ence)
- eau de Volvic ( la déboucher jus t e av an t l'expé r i enc e ) - jus de citron
- produit ammoniaqué util isé pour le nettoyage - solution d'ammoniac as sez conce n trée
- solution d'acide chlorhydr ique as s e z conc en t r é e - pince métallique
1) Utilis a t i on du bec bunsen (ou du laboga z ) a- présentation
- allumage
- réglage de la flamme - extinction
- dangers (ne pas re t ourner les labogaz at t ent i on aux pr oj e c t i ons S1 on chauffe un li qui de contenu dans un tube à essai , ne jamais chauffer à la flamme des liquides inflammable s... ).
b- manipulations possible s
- chauffage d'un tube à ess a1 conten ant de l 'eau
- détect ion ave c un fil de fer ou de cuivre des diverse s Z~ne s de tempé rat ur e de la flamme
- combustion éventue lle de certa i ne s poudres métalliques (fer, Al..)
Note : On pourra insist er sur l'aspect sécuri t é et commencer à fa ire remp l i r sur ce sujet une fiche qui sera comp l é t é e par l'élève au fur et à mesure des leçons .
2) Utilisation du papier pH
a) présentat ion
C'e s t un papier imprégné de cer t a i n es substances et qU1 se présent e généralement sous la forme d' un ruban.
Ce papier, moui ll é à l'eau de Vol v i c, prend la couleur verte repérée par le nombr e 7 appelé pH de l'eau de Volvic ; le nombr e pH
=
7 carac t ér i s e les milieux neu t res .( Le s couLeurs dépendent de La marque du papie~. Si ce papier humi de devi ent vert clair, jaune, orange ou rouge le milieu es t dit ac i dele pH est alors inf é rieur à 7. Plus le pH est faib l e, plus le milieu est acide fort (ex empl e : tester le jus de cit r on, le vinaigre).
Si ce papier humide devient vert foncé , violet, le mil i eu est dit basi que: le pH est alors supérieur à 7. Plus le pH est grand, plus le milieu est basique fort (exemple : te st er des solu t i ons de produits ammonia qué s pour ne ttoyage ) .
No te
b} Résul tat s .(voir tableau p. 113)
Nous 'pouv on s déjà regrouper dans le tableau les .quatre tests déjà réalisés .
Nous proposons certains miileux à tester, la liste n'e s t évidem-. ment donnée qu'à titre indicatif.
On opérera si possible sur plaque à godets avec des "conf e tt i s" de papier pH.
B) PRESENTATION DE=========================t~TERIAUX
1 - Obje c tif_~ . - de conna1ssances : disti nc tion objets - matériaux
acquisition de quelques noms de polymères. - de formation scientifique : observation
classification
II - Conn a issance à mémoriser
- noms (et orthographe) de quelques matières plastiques (polystyrène, cHbrure de polyvinyle, polyéthytène, polyméthacrylate de méthyle, mélamine,
nylon •. . ) et quelques utilisations de chaque matière. - matériau naturel, matériau synth é t i que
ca t eur basique
Eau de Volvic vert 7 neu tre
Jus de ci tr on Vina i gr e Produit CI F , AJ AX ammoniaqué , .. Eau du robine t Salive Eau sav onneus e etc ..•
[:"
8
qui s' échappe d'un flacon d'ammonia c (humi di f i e r le papie r à l'ea u de Volvic)raz
qui s'é chappe d'un flacon d'ac ide chlorhydri que (humi di -fier le papier ) .III - Matéri e l nécessaire
Chaque groupe d'élèves dispose d'un carton contenant pêle-mêle des obgets tr è s variés tels :
- un morceau de tube de cuivre - un morc e au de cornière en acier - un morceau de bois de sapin
- un mor ceau de cuir provenant d'une vie i l l e ceinture - de la laine car dée (vi eux matelas )
- du coton cardée (acceté chez le pharmacien) - un mor ceau de tissus de coton (vieux maillot) - un morceau de tiss us de S01e (nature l le)
- un morceau de feuill e CPV se r vant à couvrir les li vr e s - un morceau de tube él e c tr ique (CPV)
- une bouteille eau minérale (CPV) - un j~et en PE (pol yé t hyl ène
=
PE)- un bouchon de bouteil le eau minéra l e (PE) - un sac d'emballage (PE)
- un morceau de mousse polYuréthane
- un morc eau de glacière ou is olant en PS expansé
- un pot de peti t su iss e en PS norma l (PS
=
pol ys t yr ène)- unepl aque de PMM (PMM = polymé thacylate de méthyle connu aussi sous les noms plexiglass , altugl ass ... )
- un bloc de nylon
- un morceau de chambre à air en caout ch ouc
- un morceau de polyr ey (polyrey, formica sont de la mélamine) - du fil de pêche en nylon
- un morceau de tissus de nylon
- un morc eau de to il e de lin (drap) etc....
IV - Un exemple de prog ressio n
1) No tes pour le prof esse ur : - L'ob jec t if impo r tan t est de fa i r e dis-tinguer mat ériau et objet. On essa1e ra de prés en t e r plusieur s objets différ ent s en matéri a u ident i que pour ins i ster sur cette dist i nc t i on.
mettre ce s échantillons dans une boî t e "autre s plastiques". Cec i dans le bu t de montrer les limites de la liste des plastiques que nous étudieron s.
- Une bonne mét hode semb l e être de faire apporter par les élèves des obj et s que l 'on tente d'identifi e r en montrant que c'est souvent impossible par simple ob servation. Les essais que nous ferons ultérieur emen t nous aideront considé rablement .
- Il ne faut pas abuser des classif ications (te l l e s fibreux, non fi br eux etc .•.) nous ne re t iendrons que la classi fi cat i on natureqe ,synthétique. La dis tinction as s e z fine entre artific iel et synthétique ne sera pa s fai t e.
2\ !~~~!i~i~~!i~~_~~~_~~i~!~
- Ob s erve z un à un les ob je t s et notez leur nom sur une feuille de papier (La pLupar t des objets sont ainsi identifiés ~ sauf évent ueL Lement ceux
qui: ne pré sent ent pas une forme défini e)
- Donne z pour chaque objet des exemples d'utili s a t i on (ou de fonction)
3) !~~~!i~i~~!i~~_~~~_~!§Ei~~~
- Citez des objets qui peuven t être fab riqués dans des maté riaux différents (par exempl-e, un gobelet peut être fahriqué en "pl.aet -ique ", en verre3
en mét a l)
- Connai s se z vous les ma tériaux qUI con s tituent les objets que vous avez devant vous, notez le s en face de cha que objet. (On s'aperçoit souvent que Les éLèves connai s sent aus si ma l les matériaux nat ure ls que synt hét i ques) .
- Nous allons ensenilile vé r i fier vos répon s e s (pour ceLa on prend un objet3 on demande à chaque groupe sa réponse3 on peut ainsi confront er Les points de vue3 présenter Les matériaux nouveaux dont on écrit le nom au tabLeau)3 recti fi er les idées fausses3 préciser certaine s connaissances 3 ainsi à propos
du coton et de la soi e...)
4) Cla
-
- --- --- --- - - - ---- --- --- --- ---- --- --- -
ssement des materiaux en matériaux naturels ou-
- - -
-
- -
synthéti--- --- ---gues On pourra pos e r une question du type :- Trouve-t-on tous ces matériaux dan s la na ture? (on distinguer a
ainsi Les matériaux naturels: fer 3 bois3 laine3 soi e3 coton •• . des matériaux
synthét iques -nyLon3 PMM3 PS3 PE3 CPV3 méLarnine•.• - Notons que ceLa pose déjà
pour certains éLèves des difficultés: ainsi le fer que nous présentons n'est
pas trouvé sous cette forme dans la nature3 le coton a été teint. Le caoutchouc c - ~ -- ~..- - - - J - - - -- -- -- - r - - - -- - -- - -- -- - ,- - - -- - - -- --,
1 DEUXIEME LEÇON1
- Essais à la flamme
-l - Obj e c t i f s
1) de conna1s sances certa ines combu st ions son t tr ès dangereuses 2) de format ion sc ientif i que .
On développera sur t ou t au cou rs de cette leçon les qualit é s d'observation de cha que élève. On pour ra rencontre r des difficultés d'interpré t a ti on à prop os de :
- la coul eur de la fl amme ja une, Ja une or angé. oran ge, su i v an t les élèves il y aur a autan t de vi s i ons différent e s. On lai s s e r a une ce r t a i n e soupless e sur l'obser vat i on individuel l e des couleurs.
- l ' odeu r , il fa udr a éliminer les répon ses du type "ode ur de matière plastique" . "ça sent mauvai s " et solliciter des compar aisons qui n'appa r ai s s en t pas imméd iat eme n t : "odeur fru ité e de porrane" , "odeu r de bou gi e qui bruIe". "odeur de poul e t qu'on flambe"... On ne cherch e r a pa s à tou t pr ix à fa i r e identifier de s ode ur s non pe rçue s.
3) de for mation générale .
Ce t t e le ç on doit aussi sens ibiliser le s élèves : certaines matière s plastiques sont tr ès combust i b l es , en plus de l'e f f et de chaleur coexist en t des effet s beaucoup plus dangereux (gaz tox i que s, brûlures graves par le s plasti que s en fusion qui coll ent à la peau.• . ). Le s plastiqu es doi vent donc être utili s é s intelligemment.
II - Connais s a nce à mémorise r
Il n'est pas utile que l'élève retienne toutes le s observa ti on s carac tér istiques: son fichier doit lui servir d'aide mémoire. L'élèv e doit donc apprendr e à s' en se r v i r .
- Mélamine (formica•.•) - Nylon
- Bakélite - cot on - laine
- bec bunsen ou laboga z
plaque d'amiante pro t ec t r i ce (40 x 40 cm2 envi r on) - pince méta llique (2 par groupe)
- une bro s s e mé tal l i que (ca r de à lime pour le nettoya ge des pinces ) .
tournure de cuivre
- papier indi cateur unive rsel boîte d'allumettes (ne pas allumés en deh or s de l'util isation).
lai s s er le s labo gaz
Remarque: Le s becs se bouchent très faci l emen t (ex: ave c nyl on ) , il faut prévoir de s petits supports en fil de fer tordu pour main t en i r le s laboga z inc liné s , on peut aus s i util iser une pi nce et un support.
Dans le but d'éviter une pollution exagérée de la salle de classe il faut utili s e r de petits échanti llons et éviter de fa i re un tr op grand nombre de fois la même expérience. Il est cependant nécessaire que chaque élève pcisse voi r de près chacun de s essais à la flamme.
~ : Ne pa s oublier d'aérer en pe rmanence , ceci est d'ailleurs impos é lors-qu' on utilis e le gaz.
1) ~~~_~Ei!~E~~_~~~~~~E~~!i~~_
On donne aux élèves des échantillons dif f é ren ts d'un gr oupe à l'autre , inc onnus des él ève s . On fait rechercher et on dégage
en commun tou s les fai t s qui pour r on t être notés, c'est à dire le s divers critèr es d'observati on d'une combus t i on.
On ar rive r a ains i à montrer que pour chaque comb us tion il faudr a car ac té ri ser :
- l'infl ammabi li t é. On signale ra si la sub stance es t peu, mo yenne-men t ou très inflammabl e (à ti tre de réf ér ence prenons comme peu in f l ammab l e
le bois).
Il sera trè s int ére ssant de signaler si la comb u s t i on cont i nue en dehor s de la flamme du bec, si la flamme ne s'ent r e t ien t pas d'elle-même, on dit qu'ell e est auto-extinguib l e. {Refaire plusi eurs fois l 'e xpér i ence pour
mont r er que l'extinction n'es t pas due à une cause extéri eure : courant d'air
déplacement tr op rapide . L'extinction n'e st pas toujour s immé~iate, il faut
attendre parfois quelques dizai nes de secondes }.
- la couleur de la flamme. En particulier cer ta in es fl ammes ne sont pas régu liè rement colorée s (base, sommet ou bor ds de couleurs diffé ren t es ).
- la quantité et la coule ur des fumée s. On notera si la fumée est peu , moyennement ou très abondant e (ex : le bois sec donne une fumée peu abondant e ) . On préciser a aussi la couleur (noir e , cl a ire). On pourra uti l iser le tableau nO 2 pour coder ces inf ormat i ons .
- L'ap t it ude à fondr e et à goutt er .
On notera si la mati èr e se ramol lit ou ne se ramol li t pas. Si elle se ramolli t, el le peut donne r de s goutt e s. On préc is e ra alor s si les gout t es sont peu, moyenne-ment ou très abond antes , si elles sont filantes ou pas,
C E N T R E N A T I O N A l 0 E PRE VE N TIO N E T 0 E PRO TEe TION
Fich e -Synt hèse
C.N. P.P. Mars 1973 '
N° 91
I
D EN T IFICAT
IO N
R
A PIDE
PAR
L
E FEU D
ES PRINC
IPALES
MAT
IÈRES
PLASTIQUES
MATItRES
ET PRODUITS N 543-18
La plupart de ces produits peuvent être modifi és en vue d'améli orer leur comportement au
feu. En conséquenc e, dans quelques cas, l'identificat ion ne peut-être faite à l'aide de ce tabl eau.
PRODUITS NON MODIFIES
INFLAM-MABILITE
OUA NTITE APTITUDE
TCOULEUR A FONDRE ODEUR EN BRUIT EN
DES BRULA NT
FUMEES ET GOUTTE BRULANT DIVERS
POLYESTERS . ARMES
POLYSTY RENES EXPANSES POLY STYRENES
ACRYLO NITRILE -BUTADIENE - STYRENE
A.B.S. CARAM ELISENT CARAMELISENT ET FILENT CARAMELISENT RESID US CHARBO NNEUX RESIDUS CHARBQNNEUX CARBONISENT SANS FLA M M E FUMERONS.'NOIRS
FUMER ON S NOIRS
RESIDUS
.FIBRES DE VERRE
TRES DIFFIC ILEMENT
INFLAMMABLES
SE RETRACTENT DEVA NT LA FLAM ME
CASE BARREE:
Le produ it s'étein t seul.
CASE BARREE EN POIN TIL LE:
Certaines qualités s'éte igne nt seules. PHENOl CRESYL MAREE GAZ FLEUR DE SOUCIS AM A NDES ! CRE: PIlE NT AMERES , .
POMM E CREPITENT
CELERI POILS BRULES AMANDES AMERES ACIDt PIQUA NTE GA Z FLEUR DE SOUCIS ACID E PIQU A NTE
gouttes filantes gouttes enflammée s peu de gouttes
6
' " VIN AIGRE CREPITENT6
'
(J
""
.
.
-, ...,
:
6/j{6~
BOUGIE , , Epaisse fumée. noire . .mnooyenne fi re um.éeo
fumée blanche POLYOLEFINES (POLYETHYLENE • POL YPROPYLENE CELLU LOSIQUES PHENOPLASTES POLYAMIDES POLYMETHYL -METHAC RYLATES AMINOPLASTES MOUSSES SOUPLESPOLYURETHA NNES
MOUSSES RIGIDES P.v .C . SOUPLES POLYCH LO RURES DE VINYLE
P.V.C. RIGIDES ~ peu • infl ammables ... moy ennement • • inflammabl es • • ,
;~~I
~mmables
... flamme à extré-V
mi té bleue . ;./\ flamm e a basel.9I
bleue POLYMETHYL -METHACRYLATESGarde
-corps
POLYESTERS ARM ES
Toilures translucides
POLYMET HYL-METHACRYlATES AM I NO PLASTES CouVleau ris s e lles..•••.c..lai r e ss
o
:.'
.-
.
~
-_'P , .
~
~
FilS ,(\
~
(
1
1 1 " , \ de prote ctionI
I
r
i
\
Q
'
1
1 r: Il"
~4
~'~M;'
1 f ~ \ .l
i-L
-
o
POLYA M IDE SPlaque s isolantes
~
.
"
'.,Enlb8118ge/s0
a
;fft
)
~Hl
COUSSinSb4
Mat elasf
fi\
Êi
~
ac
c
ords
M
T~
SOUPLES Luminaires POLYSTYRENES SOUPLES POLY URETHANNES ~<,
RIGIDESPOLYSTYRENES EXPANSES
PO LYCHLORURES - -RIGIDES- - ....---~---
DE VINYLE PHENOPLASTES Couleurs sombre s PD .
~
p~
'
&JQJfià\
/!:j
1l'"-
'
T~
~CE
LlULOSIQU ES
',,
"'---/Ô~
1~
.
1 7C . : : : : ! ' M è .'-
'1
\
.
~"~
:~
=-:-
.
1·
n
·
.
.
·/.
~
1 1 ' i . l' . \[
i .' l , 1. \ <~ 1.~
~
. .~
~
L
·
Sacs SCi.1lJX Bassines Cuve ttes
••••
•
•
.
:
"
..
.
COM
M
I
SSIO
N F
EU
E
T
E
NVI RONN EME NT
SY
NDICAT DES FAB
RICANTS
DE MA
TI
ÈR E
S
P
L
ASTIOUES
9, AVENUE HOC HE - 75008 PA R IS TÉ L. 22 7. 6 3 . 9 4
- l'odeur et le dégagement gazeux.
On essa1era de comparer l'odeur éventuelle à des odeurs connues .
- le bruit éventuellement perçu.
- la description du résidu.
2) Comb us tion commune à tous les gr oupes
Les élève s effectuen t tous l'essai à la flamme d'un même
mat é r i au: le chlorure de polyv i ny le. Une discussion colle cti ve pe r met
une m1s e au point de la mé thode d'observat ion .
On fait remp li r aux élève s la fi che "essai à la flamme du P.V.C.".
3) Combust ion des autr es plastiques donn é s pa r le prof e s s eur.
Le s gr oupe s procèd ent'à la combust ion de trois échan til l on s divers ch o i s is de fa ço n à ce que les hu it combus t i on s proposées soien t eff e c t ué e s par la cla s se.
Un gr oupe doit lors de ses ess a i ~ , teste r sys témati quement au
pap1e r pH.
Une reprise des rés ul tats de l'ens emble de la cl asse permet de con t rôle r et d'établir au ne t les fich e s d'essais.
4) Conclusion: les dangers prés ent é s par ce r t ai n s pl astique s.
•
Certain e s combusti ons son t très dangereu se s , i l faut donc évite r de brûler n'impo rt e qùe l pla stique .
Ainsi le po l yur éthane, mati er e synthé tique qu i se renc on t r e soit sou s
forme de mous se s soup l es (cert a i n s mate l a s, coussins: :...), soit sous for me de mou sses ri gide s (flo tt eurs•..), soit sous forme compacte'(c i rés, cha us sure s de ski... ), est trè s dangereux à fa ire brûle r . En ef f e t " au cours de sa
combus t ion il se dégage de l'aci de cyan hydriqu e qui es t un pois on très violent,
(ex. : un kilo grannne de polyuréthane li bé re de ~5 à 30 litre s d'aci de cy
anhy-drique, la dose mort e l le est de 260 cm3 parm3 d'air !). Nous ne ferons donc
pa s cett e expé r ience en classe cependant il est in téress an t de connaître les
cara ct éri s tiques présen té e s par la combustion du pol yur ét ha ne.
"(Prés enter alors la fic he
POLYETHYLENE (P.E.)
Infl ammabi lité Inflammab l e,non aut o ex t i nguib le
Cou l e ur de la Flamme à base bl eue ave c sommet ja un e
flamme
Qua n t i té et Peu abondante et cla i r e
couleur des
fumée s
Apti tude à fon- Le poly é t hylène se ramo l l i t , fond et cou le
dre et à gout t e r goutte à gou t t e . Le s gouttes enflammées
arrivant sur une pla qu e de tôle fro ide se
resoli difi ent en une cire ou paraffine.
Si gn a l on s que ces gout t es adhè r en t peu à
la peau.
Odeur et dé- La combustion s'accompagne de la même
gagement odeur que celle dé ga gé e par une bougie
gazeux en train de brûler.
Descrip t i on Ci r e
du résidu
re s O l~a ~ r~e n c en une c~re ou pararr1ne.
Si gn a l on s que ces gout t es adhè r en t peu à
(c onnu sou s lesnoms plexiglass, altuglass •.•
Infl ammab ilit é Inflammable,non auto-extinguib l e
l
Coul eu r de la Flamme jaune orangé e à bas e bleue
flamme
Quan t i t é et Fumée claire peu abondante
cou leur des fumées
Aptitude à I l se ramollit, ne gout te pas
fondre et à
goutter
Odeur et Odeur fruitée rappelle celle de la ponnne
dégagement gazeux
Bruit Le morceau de PMM crépite en br ûl an t, de
petites bulles se forment à sa surfac e
Descri pt i on Le mor c eau brû le total emen t ne lai~s an t
du rés i du aucun résidu
.1.
2 6
POLYSTYRENE
Inflammabi l it é Tr è s inflammable, non auto extingu ib le (ci t on s que le PS exp ansé se ré tra c t e très for t eme n t , on essaie d' ob ten i r de s variétés de PS expansé moins inflammabl e pa r exempl e
le styropor F)
Coul eur de la Flamme Jaune orangée, lumeuse
flamme
Quantit é et La fl amme est fuligi n eus e ce qui sign i fie
couleur des que la fumée es t noire et épaisse et qu'il
fumée s volt i ge des fumerons noirs (pe t its morc eaux
de ca r bone )
Aptitude à Le PS (s ur t out la va r i é t é dit e PS expansé
fondre et à donn e des goutte s enflammé es.
gout te r
Odeur et L'odeur rappel le ce l le de s fleur s de souc is déga gement
gaze ux
Descri ption Rés i du élastique et charbonneux du résidu
Not e : Si les él èv e s conna i ssen t le ben zè ne , on pourra dire alors que ~'ode ur
ra ppel l e celle du benzène qui brûle (en fai re éventuell ement brûler un peu)
dégagement ga zeux
(connu sous les noms formica, polyrey .•• )
- - -.
-Inflanunabil itê con t i nue à brûler en dehors du bec : non auto extinguible
couleur de Flanune jaune orangée, lumi neu se
la flanune
Quantité et
Fumée très cai r e, blanc léger
couleur des fumées
Aptitude à
fondre et à Ne cou l e pas et ne se r amo11it pas
goutter
-Ode ur Ra ppe ll e celle du bois brûlé
Bru i t Crépite et craque comme du bois en trai n de brûler
Description Rési du ch a r bon neux , fri a b l e
du résidu
BAKELITE
Inflammab i li t é très difficile à enflammer, auto-extinguible
Couleur de la Jaune orange, base bleutée
flamme
Quantit é et Très légè re
coule.ur de s bleutée
fumé e s
Aptitude à Néant
fondr e et à goutter Odeur Bois brûlé Brui t La combustion s'accompagne de craquements Résidu Néant
1
Brui t La combustion s'accompagne de craquementsNYLON (fil de nylon)
Infl amnab i lit é La flamne est auto-extinguible
Couleur de la
Jaune orangée à base bleue flamne
Quan t i t é et
Peu de fumées (légères, blanches
couleur des ou
fumées même transparentes).
Aptitude à Coule en donnant une gomme , le s gouttes fondre et à sont légèrement filantes (cette gomne
gou t t e r adhère à la peau provoquant de graves brûlures)
Odeur Rappelle celle de la laine br û l é e .
Résidu Résidu caramélisé.
LAI N E
Inflammabi lit é La laine enflammée ~
de la fIamme re t1r ee
s'éte i n t d'elle-même , la fl anme est auto-ex tingu ible
_
.
_
.. Couleur de a flarrme Orangé-
-
_
._ - -
_
.
-Quantité et cou l e ur des La cou l e ur dépend du colorant fumées-
-Apti tude à fondre et à Ne fond, n1 ne gou t t e . goutterOde ur Odeur caractéristique de cheveux brûl é s.
r----
-Descri pt i on
de ré s i du Le ré s idu est charbonneux, friabl e.
C 0 T ON
r-
I
1Infl ammab ilité Le coton est tr è s nf l anunable, plus que 1
beauc oup de fibres synthé t iqu e s. On peut le traiter (ai n si avec un mélange 1 volume
d'acide borique + 2 volumes de borax + 1 vol ume d'e au ) 1"13 ti ssus s' en f l amnen t al or s
di fficil eme n t et la flanune s'é teint d'elle -même . Mal heureus:~ment ce traitement doit êtr e recommencé aprê s chaque lavage.
Couleur de la
Orangé
flamme rouge
Quantité et
couleur des Pe u nomb reus es et cl aires
fumées -,
Apti t ude à Ne fond pas, ne goutte pa:>.
fon dr e et à Les tis s u s de coton en brûlan t ne co ll e pas goutter à la peau ce qui fait qu'un tissu de coton
bi en que très inflanunable est parfois moins
dangereux qu'un tissu de nylon.
Odeu r Odeur rappelle ce l l e du papier brû l é .
Description
du résidu Résidu charbonneux
Not e doc ument po s s i b l e sur le s tissus "Que choisir" nO 58 d'Oc t obre 1971
1 gou tte r
POLYURETHANE
- Ne pas réalis e r cet t e expé rience qui es t dang e reuse.
- Cet te fiche est donnée à tit re de documentat ion
Inflammab ilité Les mousses soup l e s de polyuréthane
sont très inflammabl e s
La flamme n'e s t pa s aut o exti nguible
Couleu r de la Jaune orangé
flamme
Quanti t é et Fumée peu abondante, claire coul eur des
fumé e s
Aptitude à fondre Se ramollit, fond (les mous ses
et à gout ter souples peuvent gout t er légèrement )
Odeur et gaz Un gaz ayant une odeur d'amande amère
dé ga gé se dégage, ce gaz es t de l'aci de c
ya-nhydrique qui est un pois on trè s violent (il faut donc se méfier des
feux de matières plastiques parf oi s
plus dangereux par le s gaz dégagé s que
par la chaleur dé ga gée).
Brui t Les mousse s rigi de s crépit ent
Des cr i pt i on du Rési du car amél isé
ré sidu
Note : On peut poser comme que s t ion : "Quel pH le papi er indicateur humide plongé
dans les fumées indiquera it - il?" (pH
<
7)TROISIEME LECON
,
Essa i s à di verses températ ures
l - ,9bjecti f s
-- De connaissances
- Ret ou r sur les chan gements d'ét a t ;
- Thermopla stique, the rmodur cis sabl e .
- ~c.s.ui..si.ti.0E. È.e_t~c~ni.q~e~ ~xE.é~iE::.e~t~l!s: "mesure" de te
mpé-rature (par the rmomèt re, par po i nt s de fus ion, par crayotlSthermochr omes .. .)
II - No t e s pour le pro f esseu r
- Dan s la premi è r e partie de la leçon , on famili ari s era (ou
révis e r a ) la no ti on de changement d'é tat , on montrera l'e x i s tenc e de
tempéra tu r es fixes. Dans la phase intermédiaire (où les élèves n'ont
fait aucu n enseignement de chimie en 6e - Se) une gra nde liberté dan s
le contenu et le temps à pa ss er est lais s é e aux profes s eur s .
- Dan s la deuxième pa r t i e 1 on réa l i
-sera un gradient de temp é r a t ur e sur une pl aque mét a l lique . On ét al onnera
ce t te plaque en utilisant des cor p s de tempéra t ur e de fusion connue . On ét
u-dier a ensui t e le compor t emen t des matièr e s plas t i que s à ces diver s e s tempé -ra t ur e s. On not era en pa r t iculier
- le carac t è re irr év e r s i b le de la transf orma tion
- le ramollissemen t ou le non ramollissemen t
- la dégrada t i on de la matière (brun issement , carboni s a t i on ,
tran s for ma t i on en gaz .•.)
- Au cour s de la man i pu l a tion on mont r e ra que la dét e rmi na t i on
de la températ u r e est assez impréc i se mai s qu'e l l e donne un ord re de grandeur
tout à fait su f fisant pour l'étude des matiè r e s plas t i qu e s qui ne présentent pas de températures déterminées de changement d'état.
fait aucun enseignement de chimie en 6e - Se) une grande libe rt é dan s
111- Connais s an c e s à mémo r i s e r
-- certaines substances passent réversib l emen t d 'un état phys i que à
un autre , ce pa s s a ge se fait à un e tempéra t ur e dét ermin ée appelée tempé r a t ur e de ch angemen t d'é t at, c'est une propriété caract é r i s tique.
- signifi cation de s mots fus i on, solidif i c a ti on , dis solution.
- Différence s en tre thermodurcissable s et thermoplastiques.
Exempl e s.
TV - Opti on po ssible
Cette leçon es t longue , on pour r a répart ir les plastiqu e s à tester
entre le s groupes de faç on :
- que chaque groupe ait ét ud i é au mo~ns un th e rmop la st ique et un
th e rmodu r ci s s ab l e
- que chaque pla s t i que soit testé deu x fois pour l 'ensemble de la classe de fa ç on à perme t t r e une conf ront ation des résul tats.
v -
Un exemple de progre s sionA) Tempé rature. Tempér ature de cha ngemen t d' é tat
1) ~_t~r}~ l_ ~é~e~~aire. Th e r momè t re _ 10°C 150 °C
bé ch e r de 1 l contenan t 300 ml d'eau anneau ouvert pour maintenir le bécher tube à ess a i
tr ép i e d
toile amiantée na ph t a l ène
no i x, pince, support
1 pince mbo is pour tenir le tube à essai lab ogaz (ou bec buns e n et suppo rt)
all ume tte s
3) ~~ép~r~~~op_c9~1~~tiv~ _d~ _I~ ~xE~r~~n~~, (pendant le ch auf fa ge)
Par une série de que stions on précisera les connaissanc es déjà acquises et on définira ~e rt ain s mots souv ent mal util i sés dan s la vie courante.
- qua nd dit- on qu ' un soli de fond ? (la réponse n'es t pas toujours
i
mmédiate
et de
mande
la
part
icipation d
e plu
si eurs élèves
).
- Conna is s ez vous des corps qu~ fondent
?
1) ~_t~r}~ l_ ~é~e~~aire.
- Es t- i l correct àe dire "le sucre fond ans l' eau" ? (les réponses
sont tr ès partagées . Il y a mani fes t ement confusi on entr e fus ion et dis solution.
Le fai t qu' on obtienne~ dans l'un comme dans l 'aut re cas~ une seule phase liqui de
est évi demment à l 'or i gine de cette confusion. Il faudra préciser le vocabulair e ) .
- A quelle température la glace fond-elle? (répons e connue)
- Es t - ce par hasard que la glace fond à
oOe
(peu de réponses nettes~ il faut préci ser le choix du zéro Celsui s : températ ure d'un mélange glace et eau pures préparé depuis quel que temps)- Comment peut -on graduer un thermomètre ? (Repérer le niveau de l'i ndex dans un mélange eau-glace, noter al ors la tempéra ture OOC~ repérer le niveau dans la vapeur d' eau bouil l ant e, noter alors 100 °C. On ne pré ci ser a pas l'influence de la pression. Il faut ensui te séparer l'inte rval l e en 100
par t i es égal es) .
- Av e z-vou s un ordre de gra nde ur de la température de fusion de
l'é ta i n, du plomb, du cui v r e , de l'al uminium (donner les tempér atures de fus i on étain : 23 2°C~ Pl omb : 327°C, Al uminium : 66CoC, Cuivre: 10800C).
- Essayez d'expliquer l'expertise sui van t e : "a u cour s de l 'incendie la tempéra t ur e est montée à plus de llOO°C" (Les experts se sont aperçus que des objets en cui vre avaient fondu la températ ure étai t donc supérie ure à la te
m-parat ure de fUsion du cuivre ) .
- Les températures de fusion sont données dans les tables, ainsi mesurons la température de fusion du naphtalène et ensuit e conf r on t on s notre résultat avec celui indiqué.
4) !\l~i-9~-:~C?I)~.di-~ ~c:.a!~oE _d~_ !1~El.!t:.~I~~~
~ Faire un schéma de l 'appareil (bien expliquer qu'une coupe permet de noter les diverses substances cont enues dans les récipi ents) .
R Le bain marIe étant porté vers 85°C, on arrête le chauffage. On
plonge ded an s un tube à essai contenant une quantité suffisamment importante de naphtalène . Noter en fonction de la température l'état du naphtalène. (On
habituera le s él è ves à donner plutôt qu'une température un intervalle de
tem-pér atur e. Ex : entre 78°C et 79°C j'obs erve l 'apparition d'une gout te de liquide. Entre 79°C et 81°C i l y a du solide et du liquide... Ce s encadrement s ti enn ent
1,36
ainsi comp te des erreurs } . Lorsque le nap hta l è ne es t ent i èr eme nt liquide et est
à 83°C-84 °C par exemp l e , on le sor t du bain marie . La temp ér at ure diminue et on fai t ob s erv e r le reversibilité de l'expérienc e.
R Confronter le s résult at s à l' indica ti on de s tables
5) ~~~~!~~!~~
.
DAns une discussion collec tiv e on dégage :- le passage solide +---~ liquid e est réver sib le et se fa i t à une tempé ra t ur e de 80°C.
- cette tempé r atur e de fusi on solidif ication ac ra ctéris e le naphtalène.
~.oE.s~i.!.s_p.E.a!i.9.u~s :
- Pour le naphtalène, l 'emp l oi d' un disp os itif pl us comp l iqué est conseillé doubl e tube, agi ta teur en fil de fer enr oul é en hél i ce autour
du réservoir du th e r momè t r e ;
- On peut évent uellement faire trac e r la cour be représen t an t
la température en fonct ion du temps.
B - Comment se répartit la temp é r at ur e des poi n ts d'une plaque cha uf
-fée à l'une de ses extr émit és
Une plaque de tole d'ac ie r 8/10 mm 15 x 45 cm2 (repli e r à l'étau, avec 2 cales de bois, les deux bor d s , côté longueur, pour augmen t e r la rigidité)
Une pInce munie de 2 petits mor c e a ux d'amiante
une nOIX
Un support à pied
De s éch an t i l l on s de point de fusion connu + zinc
+ ét ai n Na ph t a lèn e
Une plaque d'amiante pr otec tr ice
Une spatu l e
+ éven t ue l leme n t toile émeri, tampon jex pour le net toya ge de la plaque
+ carde à lime pour nettoye r le s pinces
+ évent ue l l emen~ cray ons thermochr omes
2)
~E~E~E~~i~~_~~_!~~~E§Ei~~~~La plaque est maintenue horizont al ement à quelques centimètres au de s sus de l 'extr émi t é du bec bunsen. El le est chauf f ée ai n si quelques minutes
de fa çon à ce qu'un équilibre thermique s'établisse (I l faut
cho
isi r une bonne
hauteur de façon à ee que le chauf f age
ne
soit nitrop
fort~ ni trop faible).En attendan t que l'équilibre thermique s'é t ab lis se, on peu t préparer la mani pula t ion en posant quelques questions :
- Est- c e que la température de la plaque est partout la même
?
(Non~ la zone à haut e température es t voisine de A, Ver s B la température doi têtre plus fai ble) .
- Est- c e que le thermomètre permet de repérer la tempé rat ure d'un point de la plaque ? (Non pour deux rai sons: d'une par t le rés ervoir du thermomè t re doi t
être en étr oit contact avec le milieu dont
la température est à mesurer ce qui ne ser ait pas réa lisé
pa
r
le cont actther-des températures inféri eur es à 150V
C)
- Comment peu t on avoir une idée de la répa rtit ion de la tempé r a t ur e de la plaqu e? (l es élèves sensibil i sés
par
la discus si on du A,3 doivent trouverqu'il faut utilis er des subs t ance s de poi nt de fusi on connu) .
3)
~!~!~~~~B~_~~_!~_2!~g~~Cet étalonnage dure un quart d'heu re enV1ron.
Ave c une spatule on fait glisser de B vers A lent ement la substance cho i si e , par exemple l'étain qui fond à 232°C. En B l'ét a i n reste solide. A pa r t i r d' une cer t aine zone l'étain fond. Si nous ramenon s la goutte d'étain liqu i de lentement vers B à partir d'un certain moment elle se solidifie. On mon t re ainsi la réversibi l i té du passage étain solide~é t ai n fondu. On
détec te ai nsi sur la pl aq ue une zone de tempé rat ur e vo is i n e de 230 °C (on obtient
avec tes plaques d'acier de 8/ 10 t 'échette 80 °C-400 °C qui s'étate sur une
trentai ne de centimètres. Les résut tats sont trè s homogènes d' un groupe à
t'aut re).
REMARQUES
- Le naph talè n e permet de faire le lien av e c la temp érat u re de chan geme nt d'état "mesurée " précé demment au thermomè tre ;
- L'emp lo i du naphtalène (pour authen tifier les me sure s) et des crayons th e rmochr ornes es t vi v emen t conseillé ;
- En commençant par la Mélamine et la Bakél i te, on évi t e de salir excessivemen t la plaq ue ;
- Cer t a i n s pr o f e s s e ur s préfèrent soutenir la plaque par le
mi
li e
u ave
c
u
n
e
p
in
ce
ga
rni e d'amiante.
~et ètalonnage dure un quar t d'heu re enV1ron.
il s sont 1,38
C _. Compo r tement de s plastique s à diver s es température s
1) ~~!~Ei~1_~~EE1~~~~~~iE~_~~~~~~~iE~
+ fragments de PS, PMM, PE, CPV, mélamine , bakélite, nylon.
2
(or dr e de grandeur que l que s mm )
2) Ç2~~~il_EEat ig~~
La conduct i bi lité thermique des pl a stiques est in f érieure à celle des métaux, il faut donc les dépla c e r très lentemen t.
3) g~~~1!~!~
Au cour s d'une discuss i on coll e ctive, dégageons nos résultat s
a) Résulta t s généraux .
- Plon gé dire ct ement dan s la flamme la plast i que est porté à haute tempéra t u r e
et brûle ; dans ces expérie n c e s le plasti que es t port é à des tempér a tur e s
moyenn es (100 à 400°C)
- Les transfor mat i ons sont ir révers i bles : le br unissement ou la tran s f orma t i on en gaz correspondent à des tr ans formations pr of on de s. (Nous y reviendrons pour le PMM et le PS).
- Les phénomène s sont beaucoup mo~ n s net s qu'ave c le s mét aux (on a du mal à les
décri r e tant ils sont progr es si fs ).
- Une conc lu si on nett e se déga ge :
- cert a i ns plastiques se ramoli s sen t par cha uff a ge thermoplast i ques
- d'au tres ne se ramollissen t pas (au cont r ai re lors de leur
formation on les a chauf fés pour les faire durcir) ce sont des thermodurcis
-sabl es.
(Remarquons que cette notion a déj à pu être faite lor s des essai s à la fLamme).
b) Ré sultats part i cul ie r s à cha que matiè re plastique
- le Polystyrène - Le mor c e au col le cans le s zones moyennement chaude s , puis fond , puis disp araît à l 'é t at ga z eux èans les zones trè s chaudes.
- le polyethylène - Fond faci leme n t en un liquide épa is, ce liquide dev i e n t plus
fluide da ns les zone s ~us cha ud e s. Dans le s zones très chaude s , le li qui de se
dét ru it en donnant des fumé es abondan t es , il rest e un rési du de carbone.
- le chl orure de polyv inyle - Fond ass ez fac ilement, se décompos e dan s les zones à tempé ra ture élevé e en donnant un gaz malodor an t et un ré s i du de carbone.,
- la mélami ne rési st e bien aux tempé r a ture s modér ée s, commenc e à noirc i r à
teffi-pérature moyenne, noi rcit en crépit a n t dans la zone à haute température . Ne se
ramol li t pas.
- le polymé t ha c r yl at e de méthy l e colle pr è s de B, pu i s fond en cr épitant, dans
les zone s tr ès chaudes, il dis paraî t à l'état gazeux.
- le nylon ramolli t près de B (100°C à 110°C)
coll e vers 140 à 150°C
"fond" ver s 230°C noirçit, car amél i s e .
- la bakélite ternit dans les zones chaudes (250 à 300°C)
rougit près de A (400°C) laisse des cendres .
D) CON===========CLUSION
Il semble bon de revenir, pour effectuer la comparai s on, à
l'échelle de température de la flamme d'un bec bunsen (on es s a i e r a de faire
fond re un fil de cuivre•. . ). On se rendra ains i comp te que sur la plaque
les plastiques sont port és à des température s infé r i eure s à celler de
la zone chau de de la flamme , températ ur e qui entr a inai t l ' i nflammation.
~) PROLONGEMENT TECHNOLOGI QUE POS SI BLE
~~~--- --- --- - - -- ~ ~ ~~= ==;;==
Faire un essa i de pliage (voir thème III)
1,40
1 QUATRIEME LEÇON 1
Essai s aux solvants
l - Obj e ctifs
- Cette étude permet d'introdu ir e le s notions de sol ub i l ité ,
satur at i on et précipitation.
- Introduct i on à la méthode expérimentale logique et ri gour e u s e ,
on ét ablit la démar ch e suivante et on l'a ppl i que
~r i en ). insolubil ité ~ observation ~précipité ~o lubil i t é rien =:;>sol ubilité res te"...,.., ~quel que cho se=;:>dout e...~n sol ubi li té
_
___
________
____
__________
_
_---'
1
~ saturationl
essa~ de préci pi t at i onmise dans un solvant
_
>
obser v at ion du- Développe r or dre , soin et méthode : le s élèv e s manipul en t de nombreux tubes à essai, il est donc nécessaire de fair e un étiqueta ge fidèle,
il faut d' a ut re part placer les tubes avec logique dans le suppor t - t ub e s .
II - Connai s sanc e s à ~émo r i s e r
- Sign ification de solubilité,miscibilité , solvant , solut é, solution"
sat ur ation, précipi t a t i on.
- La so l ubilité est une propriété caractéristique
Retenir quelqu e s con séquenc e s pratiqu e s :
po s s i b il ité de nettoyer les pla s t i ques à l'eau et à l'a l c ool •
• att enti on à l'u sage de certai ns dé t a chan t s qui pe uvent dissoudre
les plastique s (ac é t one , trkhlo... . )
II I - Not e de sécuri té
Cert ains so l vants uti lisés sont tr ès inflammab les, il fau t donc
les mani pule r en l'absence de toute flamme. Le s becs (ou labogaz ) et les
allumet te s utilis és dans la pr emi è r e partie de la leçon seront retirés avan t de
fa ire la deuxième partie.
IV - Maté ri el nécessaire pour un groupe de 3 ou 4 élèves
-+ une solution très concen trée de chlorure de sodium (pre s que
satur ée - Il faut par f oi s la fillre r pou r qu'elle soit bien liqui de ) .
- un bec bunsen (ou labo ga z)
-+ allumettes
- alcool
- tubes à essais
(un cristall isoir pour con t eni r l'eau chaude)
(bain marie où l'on mettra certa ins tub e s à essa i s )
- 2 porte-tubes par groupe
- flacons à bec vers eur pour le s 4 solvants
- 1 pissette à eau
- 1 pis s e t t e à alcool
- 20 bouc hons liège pour tubes
-+ 20 étiquettes au to-c ollant e s ou marqueurs
- benz ène
- té t r a ch l or ur e de carbone
- tétrahydrofu ranne
- acétone
- alcool
-+ ch lor ure de polyvi nyle
-+ polys tyrè ne
-+ polyméthacrylate de mét h yl e
-+ pol yé t hy l ène
-+ nyl on
Les échantill ons de plast ique doivent êtr e de petit e s dimensions
(quelques mm2), on peut aussi uti liser de s râpures, des tour nur es•. .
Remarques - 1) Il faut une ré s e r ve importante d'e au chaude (ver s 40 °C) .
L'i déa l est bien sûr d'avoir de l 'eau chaude sous pr essi on ou d'avoir un chau ffe-eau électrique. s'il faut chau ffer l 'eau au gaz, le faire dans une autr e pièce. L' hi ver on peut me ttre la veille sur les radiat eur s de classe des cri s t a l li soi rs de ll. plei ns d'e au ...
2) Il Y a pour cet t e leçon une important e consommat i on de
tubes à es s ais dont le ne tt oyage est dif f ic i l e . Il faut donc prévoir
une "bonne vaissel le à faire".
- alCOOl
1,4 2
v
-
Or gan i sat ion de la cl a sse1) pour la première part ie de la le çon (durée 20 mn environ) .
Chaque groupe fa i t la man ipul a t ion avec l ' eau, le sel et l'a l cool . (2 tube s à essai par groupe son t nécessair e s) .
2) pour la d~uxième part ie•
• Si chaque g~oupe d'élèves devait fai r e toutes le s mani pu l a t i ons , voi c i la sér i e d'expériences qu'il aurait à faire:
PE PS PMM CPV NYLON
f
THF
1 2 3 4 5 Précipi ta t i on à l'eau 6 7 8 9 10 !Acétone 11 12 13 14 15 Pr é c ip i ta t i on à l'eau 16 17 18 19 20 JBenZène 21 22 23 24 25 Précipitat ion à l'al co ol 26 27 28 29 30l
CC1 4 31 32 33 34 35 Précipitat ion à l'a l c ool 36 37 38 39 40Il Y aurai t ainsi 40 expé r iences à fa ir e, soit 40 tubes à essais par groupe s d'élèves (et encore pour alléger nous n' avon s pas mis les essai s à l 'al co ol. De même nous n'avons pa s m~s la bakélite, le s
profe sseur s qui le désir ent pourront rempla cer l'un de~ 5 thèrmo-pla s t ique s
par la bakélite ins ol ubl e dan s les sol vants étudiés, ceux qui ne te s t eront
pas la sol ub i li t é de la bakéli t e pou r r ont fair e remar que r que les flacons
cont enant le s sol va nt s étudiés sont ou peuvent être bouchés avec des b
ou-chons en bakélite : preuve d'ins ol ub il i t é.)
Il est donc nécessair e de fa ire un choix, on peut ains i fa i re faire
- à la moi t i é des groupe s les 20 manipul a t i on s 1 à 10 et 21 à 30.
- à l 'aut r e moitié des gr oupe s les 20 manipula tions Il à 20 et 31 à 40.
De ce t t e façon chaque groupe aura Vu les deux types de solvant s
ceux miscibles à l'ea u et ceu xmiscibles à l'a l cool .
1 .L
VI - Un Exempl e de Pro gr es si on
La dissolut ion de s plastique s s'avérant pa r f ois lon gue , on pe ut commencer par fa ire prépa re r aux élèves les tubes de l 'essai au T H F et
à l'acétone en veil lant à la sécur i t é (les stocker , bouc hés, loin de s
fl ammes , ran ger le s flacons de solvant apr è s usage) .
A - INTRODUCTIONAL A LA METHODE
1) ~o!e~ ~o~r_l~ .E.r~f~s~e~r :
- On pour ra propo se r un autre exempl e de préc i p it a t i on (a l cool
camph r é + eau ) ;
- Le profess eur pour ra déve l opper plus ou m01ns cette partie
sui vant le s di vers e s que s ti on s posées par les élèves.
On vé r ifi e d'abord si le mot di ss olution est bien acqu i s en
posant quelques ques t ion s qui intr odu i ront en même temps du vocabu lai re
nouveau.
- Que se passe-t-i l quand on fait tombe r un morce au de suc r e dans un verre d'eau ?(le sucr e di spar ai t dans l'eau3 on dit qu'il se dissout ou qu'il est soluble dans l 'eau. L'eau est appelé le solvant3 le sucre es t le soluté3 l ' ensemble es t la solution.)
- Citez des produits sol uble s dan s l'eau fe l ~ café soluble ..• les
élèves pens ent rar ement aux liquides tels l 'alcool. Introduir e alor s le mot
miscible: l 'al cool estmisc&ble à l 'eau. En prof iter pour montrer aux élève s
que l 'a cétone est misuble à l'eau~ la THP aussi. On pour r a fai r e circu l er
les tubes éti que tés et bouchés cont enant ces mélanges ~
-Ci tez des pr odui t s solubles dans l'a l coo l~au bien sûr~ parfums~ camphre~iode... En prof it er pour montr er aux élèves que le benzène et le
tétrachlorure de carbone sont mise0 le s à l 'alcool et non misci bl es à l' eau 0
- Que se pa ss e-t-il quand on met beaucoup de suc re dans un ve rr e
d'ea u ? (à par ti r d'un cer t a i n stade le sucr e ne se dissout plus, on dit que la solutio n est saturée) (avoir en réser ve une solution sat ur ée de sucre ou
d
e s
e
l.
)
- Que se passe-t-il quan d on fait tombe r un mor ceau de suc r e dans un verre cl'eau ?[le sucre disvarait dans L'ROV. on d.i t: (71) '1: 7. .~P dL~ .~()llt ()JJ
1,44
Le professeur distribue aux élèves un peu de solut ion (concentrée) de chlor ure de sodium puis pose les questions :
- Comment pouvez-vous mettre en évidence que cet t e so l u t i on contient du sel ?
(les élèves proposent de chauffer pour chasser l'eau, d'autres de goût er ; leur
dire que c'est une mét hode dangereuse à éviter quand on ne connatt pas la
com-posi t i on d'une sol ut ion) .
- Réal i s e z l ' év apor a t i on de l'eau :
Prélevez environ 1 cm3 de soluti on qui a ét é dis tribuée , cha uf f e z la doucement, pour chas se r l ' ea u. Obs e r ve z l'apparition de cri s t a ux de sel.
- La méthode préc éd ent e est el le touj our s applicable? (non, il faut que le
soluté ne soit pas volatil, d'autre part les vapeurnde solvant qui s'échappent
peuvent être infl ammab l es ou toxiques )
- Nous allons vo i r une autre façon de fa ire réapparaître le sel. Pré l ev e r quel-que s cm3 de la solution qui a été distribuée . Ajouter de l'alcool à cette solution. Obs erver l 'apparition de cristaux de sel : c'est un EE~~iEi~§_~~_~~!~
- Le sel très soluble dans l'eau, l'est beaucoup moins dans l'alcool donc dans le mélange eau- a l cool. On dit que l'alcool a précipité le sel de la solution
a queuse , (à 20 °C on peut di s soudr e 360 g de chl or ur e de sodium dans 1 L d'eau
,-les tab l es indiquent que le sel est insoluble dans l'alcool) .
- Nous allons étudier la solubilité de quelques matière s plastiques.
B - PREMIERE SERIE D'ESSAIS
- Dans cett e première série on utilise ra comme solvants l'acéto ne et le THF solvan t s mis cib l e s à l'eau.
- Est- il utile de faire des essais de solubili té de s pla s t i que s dan s l'eau?
(non, les 5 pl astiques ét udiés sont uti lisés soit pour fabriquer des récipients
suscepti b l e s de cont enir de l'eau, soit pour fabriquer des tuyaux susceptibles
de condui r e l 'eau, soit pour se protéger de la pénétration de l'eau ••• : ces
- Plac er un peti t morc eau de chaque plas t i que à ét ud i er (P.E, PMM , PVC, PS, nylon)
dans un tube . Not e r le nom du plas t ique. Placer sur le porte tube.
Verser 3 cm3 du sol v ant con s idéré , noter le nom sur le tube EX : PMM-THF Boucher le s tubes . Agiter. Pl onge r les tubes dans le cr is t a l l i s oir con tenant
de l'eau cha ude (ve r s 40°C). Agite r de temps en temps . Obs er ve r après une quinzaine
de minut e s si le bain est à 35-40 °C, attendr e un peu pl us si la températ ur e est
plus basse. (Chaque groupe d'élève s réalise donc ainsi 5 mélanges. Pendant le
temps de contact solvant- plastique on peut mett r e au poi nt au cours d'une discussion
collective~ la démar c he expér i menta l e qui va êtr e utili sée) .
, •
.:
.:
~
p
r':f.y..,:t~
/ ('i'"5'
...
....
..
..
P'N J)f
LA
,'
:-~X'Ett.'&lf.E
»
ë
~lJ T PE'
1.'Exr
E"i
EN
c.
E'
1ère expérien c eSuppos ons que dans un sol vant S nous mettions un écha ntillon de plast i que P. Imaginons ensemble le s divers cas possibles et voyons ce qu'on
pourra conclure :
le plastique P disparaî t tot alement dans le solvant S,
P es t soluble dans S.
*
ca s nO2 : il re s te encore après un contact pr o longé S-P duplas-ti que P dans le tube. Il y a al or s deux possibilités: ou P est insolub le ou P est solub l e : la
2ème expérience 1,46
- Soi t un solvan t S' m~ilile à S et tel que P soi t insol uble dans S'. En pensant
à l'expé rienc e prél i mina ir e (eau, sel, alcool ) que doi t il se passe r si je ve rs e S' dans une parti e du liquide obtenu dans le ca s nO 1 (il doit y avoir précip
i-tat ion de P).
- Que ls sont les di f f éren ts ca s pos sib l e s si j 'a jout e S' à une pa rtie du liquide obtenu dan s le cas nO 2 ?
(Si nous obser vons la précipitati on de P (cas nO 2, 1), nous pourrons conclure que
P
s'est dissout dans S. Si nous observons aucune précipitati on deP
(cas nO2, 2) nous pour-rons conclure que P es t inso l ub l e dans S). Remarques
1) Il est évi den t que l'insolubilité tot al e n' ex i ste pas , ma1S à ce n1veau les
distinctions devi endr ai en t trop subt il e s.
2) Il est néce s s ai re de gar de r une part ie du li quide ob tenu à la fin de la première
expé ri en c e, en effet, les pr éc ipités sont plus ou moi ns nets al lant jus qu' au simple louche : il fa ut alors compar er à la transparen ce du tube témoin. 3) Il est parfo i s nécessaire d'a jouter aut ant de solvant S' que de S présent.
4) Résultat s de la premièr e sér ie d'essa i s
- .- - - - - - - - - -
- -
-
-
- ---- Quel liqui de pe ut on utiliser pour éve nt uell ement précipiter les plas tiq u~s d ll
THF ou de l'ac é t one? U 'eau.puisque d'une par t l 'eau es t mùeib l e au THF et à
l 'acétone, d'autre part parce que les 5 pl asti ques étudiés sont insolubles dans
l 'eau).
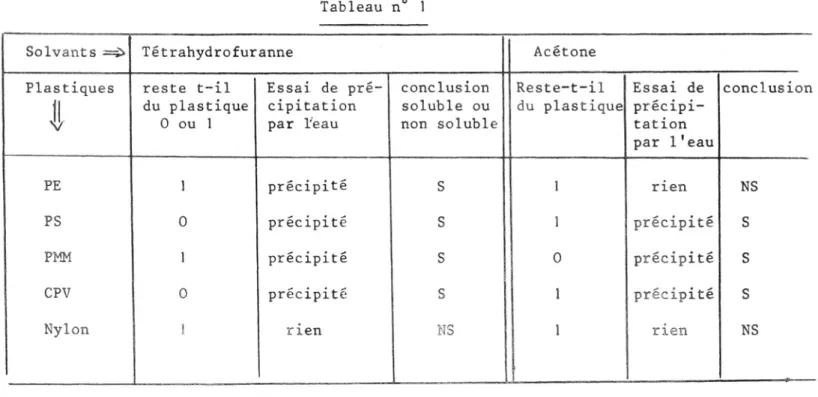
- Au fur et à me s ur e de vos essais remplir le tabl e au nO
Tableau nO
suivant.
Solvants ~ Tétrahydrofuranne Acétone
Plastiques re ste t-il Essai de pré- conc l usi on Re s te- t -il Essai de concl usi on
~
.
du pla stique cipi t a tion soluble ou du plasti que préc ipi-o
ou 1 par l'eau non solub le tationpar l ' e a u PE 1 pr écipi t é S 1 r1en NS PS 0 pr éci pité S 1 pr é cipité S PMM 1 pr éc ip it é S 0 préci pit é S CPV 0 pré ci p i té S 1 préci pi t é S Nyl on ! r1en NS 1 ri en NS
Not e Les ré su l tats 0 pour il ne reste plus de plastique pour il reste du pl asti que
peuven t l~ g~rernen' di ff€ r er d'un gr oupe à l' a ~tr e (c e l a dépend ~e 1~ Gr~(seur de
l'échanti ll on, de la quantité de solvan t . du temps de cont a cq .
le benzène et le
tétra-Reste-t-il\ Ess ai de pré-lconcluSion
du plasti- cipit ation . . " . , .,
C - DEUXIEME SERI E D'ESSAIS (en con trô l e la sé ance suivante)
J) Pr
-
--
és-
en t-
-
-
a t i on---
des solvants de cette série---
---
---
.Nou s allons maint en an t utiliser deux autres sol vants ch l orure de carb one.
Cherchons un li quide qu i pui s se joue r le même rô le que celui joué par l'eau dans
la premièr e séri e d'essais. Ce liquide doit être m~ibl e au ben zè ne et au té t r a
-chlor ure de carbone. Il doit d'aut r e part ne pas dis so ud re les plastiques étudiés . L'alcool convient (f ai r e trouver que des flacons en PE~ PS.. . peuvent contenir
des aZcoo ls~ des parfums. . . ce qui n'a de sens que si ces plas t i que s sont insolub l es dans l 'al cool. On peut bien sûr faire le s essai s mai s cela fait cinq manipulations de pl us . Quant à la mWc~i l ité de l 'alcoo l dans le benzène et
T
ee
el le a étédéjà introdui t e).
2) !!aE.i.E.ul.a!i~n~
Au fur et à me su r e de vos essais remplir le tabl eau N° 2
ta b l e a u nO 2
Solvants =5> benzène lTétrachlo rure de ca r bo n e
Pla t i ques Re s t e-t-il Essai de conclusion Reste-t-il Es sa i de pré- conclusion
J.l
duo
ouplastique précipi1 tion pata-r du plasti- cque pai p i tar l ' a lc oolti onl'alcool
PE 1 r1en KS 0 précip ité S
PS 0 précipité S 0 pr éc i pité S
PMM 0 précipi t é S 0 précip ité S
CPV ) r1en NS 0 préci pité S
Nyl on ) r1en NS 1 rien NS
VI I - Pr olon gements pos s i b le s
))
~aE ~e_PEoie~s~.uE- Dissoluti on d'un échan t ill on d'acétat e de cellul os e dans le
Dimethylf ormamide D MF, puis précipitation de ce l u i - c i dans l'eau. En
l'in-jectant av ec une sering ue en verre dans de l'eau on obtient un fil .
2) fa~ l.e~ ~l~v~s ; collage de morceaux de polystyrène trempés
dans l 'acét on e.
Pla ti ques 1
R
es t e-t-~l
1Es~a~ ~
e
\conclusionllJl
d~ pla~t1que p::ec1p1ta-1,48
1
C
INQ
U
IEME
L
EÇON
CONT ROLE Eh~ERlMENTAL
l - Obj ecti fs du con t rôl e
~ il es t néce ssaire à la fin de ce premier thème de fai re le poi nt
et de savoir si le s élèv e s ont bi en assimilés le s quat r e premi è re s le ç on s .
*
Ce cont rôle n'a pa s pou r objet de test er les con na issances acquisesmai s de saV01r S1 les élève s save nt :
- man ipu ler correct ement
- observer
- se ser V1r des fiches qu ' i ls on t rédigée s ains i IVi nté r ê t.
les élèv e s en déco uv rent
~ cert a ins pr o f e ss e u r s pend ant cette heure de contr ô l e font - un contr ôle indivi due l
- un con tr ôl e par équ i pe
En dé pouillant le résul t a t des con trô les le prof e s s e u r pourra alors
mont rer stati stiquemen t l ' intérê t du trava il en équipes, en effet, le pourcentage des ess ais ré~is es t touj ours supér i eur quand il y a eu col l a bo r a t i on entre dewç ou plus i eurs élèves.
II - Premi ère parti e : faire un essa i aux solvants d'un plastique . On
pos e des questions pour vo ir S1 la mé thod e est acquise. On fait l 'essai sans
fich e d'un pl a s t ique avec le benz è n e et le t~trachlorure de carb one .
Ranger les solv a nts apr è s cet es s a i.
III - Deux ième partie : Ess ai à la fl amme avec fiches (l'essai à la plaque
est lon g et est peu né c ess ai re pour l'iden tif ic ation).
On pour ra bien sû r varier le contrôle, donner aux élèves un questionnair e
polycopié etc . . ..
THEME II
ANALYSE - SYNTHESE - MODELES
l - Plan du Thème II
Ce thème comprend quatre leçons
6ème Leçon
7ème Le çon
8ème Leç n !ème Leçon
Transformations physiques. Molécules et Macromolécules.
Dépolymérisations du P M M et du P S Synthèses modèles.
Synthèse de quelques autres plastiques. Hydrolyse et synthèse de l'amidon. II - Obje ct i f s du thème II
- Montrer '.' e les polymères sont constitués de macromolécule~ ; - Réaliser 'a rupture de macromolécules en petites polécules :
dépolymér,s2tion ;
- Obtenir inve.·sem~nt, à partir de petites molécules des macro-molécules : polymérisation
- Introduire des m dèles.
II, 2
Si x i ème Leçon
TRANSFORMATIONS PHYSIQUES
1
MOLECULES - MACROMOLECULES- OBJECTIFS
1 - 1 Acquisi t ion (ou rappel) de connais s an ces
- La matiè r e peut pa ss e r réversib lement par les trois états : sol ide , liqu ide ou gazeux : cycle de transformations physiques ou chang ements
d'état ;
La matière quel que soit son ét at est constituée de par ticul es, en
par-ticul i er de molécules ;
- Un corps cons t i tué d'un ens emble de mo lpcul es t0ut e s identi que s entre elle s est appelé un co rps pur ou une E~pèce chi mi que ;
- Les molé cul e s ont des dimens ion s déterminées : on distingue d'apr è s le ur ta ill e les mol é cu l es et les maromo lécu l es
- Le s ma cr omo l é cu l e s en sol u t i on
ne
travers ent pa s certa ins fi ltre set donnen t l'e f f et TYNDALL ;
Remarque : les changement d'état auron t pu être vus en 6ème, la st
ruc-tur e mol écu l ai r e ainsi que l'ordre de grandeur des dimensions mol é
-culaires en Sème il semble cependant nécessaire de rappeler rapi
-dement ces notions pour bien compre ndre la suite , en parti cul i er la
dépoZymérisa tion du
P
.
M. M.2 - 2 Acqui s i t ion de méth odes expérimenta les
- Certai ns filtre s permettent de "trie r " les mol é cules d' après le ur
taille ;
- Les solution s macromoléculaires éclairées latéralement donnent l 'eff t TYNDALL .