Rôle des mesures biophysiques au 1
ertrimestre de la
grossesse dans la prédiction de la prééclampsie
Mémoire
Cédric Gasse
Maîtrise en Épidémiologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Cédric Gasse, 2017
Rôle des mesures biophysiques au 1
ertrimestre de la
grossesse dans la prédiction de la prééclampsie
Mémoire
Cédric Gasse
Sous la direction de :
Dr Emmanuel Bujold, directeur de recherche
Dre Suzanne Demers, codirectrice de recherche
RÉSUMÉ
Parmi les diverses complications de la grossesse, la prééclampsie (PE) représente encore à ce jour l’une des causes majeures de mortalité et morbidité maternelle et fœtale. Malheureusement, il n’existe toujours pas de traitement curatif efficace autre que l’accouchement et la délivrance du placenta. Par contre, la prise quotidienne d’aspirine chez les femmes à risque élevé, débutée avant 16 semaines de grossesse, constitue une méthode préventive efficace de la PE. Il devient impératif de trouver une façon d’identifier les femmes à risque de PE. Plusieurs méthodes ont été proposées, dont l’utilisation de mesures biophysiques. Les études sur ce sujet présentent des résultats variables qui peuvent être en partie attribuables à l’hétérogénéité des techniques de mesure et des méthodologies utilisées.
Nous avons réalisé une étude de cohorte prospective afin d’estimer la valeur prédictive de deux paramètres biophysiques. Ces deux paramètres sont l’indice de masse corporel (IMC) et la pression artérielle moyenne (PAM).
Nous avons observé que l’IMC, modélisé en tant que variable continue, et la PAM, prise à l’aide d’un appareil automatisé validé pour les femmes enceintes, des femmes au premier trimestre de la grossesse sont associés au risque de développer une PE. Ces marqueurs peuvent donc être utiles pour la prédiction précoce de la PE et devraient être considérés dans un modèle de prédiction de la PE à être utilisé en clinique.
ABSTRACT
Among the various complications of pregnancy, preeclampsia (PE) is one of the major causes of maternal and fetal mortality and morbidity to this day. Unfortunately, there is still no effective cure of PE other than the delivery of the placenta. However, daily aspirin have been shown to effectively prevent PE in high-risk women when started before 16 weeks of gestation. It is imperative to identify women at risk for PE early in gestation. Several methods have been proposed, including the use of biophysical measurements. Studies on this topic show varying results, which can be partly due to differences in measurement techniques and in methodology.
We conducted a prospective observational cohort study to estimate the performance of two biophysical parameters, measured with standardized techniques during the first trimester of pregnancy, for the prediction of PE. These two parameters are the body mass index (BMI) and the mean arterial blood pressure (MAP).
We observed that the BMI, modeled as a continuous variable, and the MAP, measured using an automated device validated for pregnant women, of women in the first trimester of pregnancy are associated with the risk of developing PE. Therefore, these markers appear to be useful for the early prediction of PE and should be considered in a predictive model of PE for clinical use.
TABLE DES MATIÈRES
RÉSUMÉ ... III ABSTRACT ... IV TABLE DES MATIÈRES ... V LISTE DES TABLEAUX ... VII LISTE DES FIGURES ... VIII LISTE DES ABRÉVIATIONS ... IX REMERCIEMENTS ... X AVANT-PROPOS ... XI INTRODUCTION ... 1 PRÉÉCLAMPSIE ... 3 CHAPITRE 1 -1.1 Définition ... 3 1.2 Épidémiologie ... 4 1.2.1 Prévalence ... 4 1.2.2 Facteurs de risque ... 4 1.3 Physiopathologie ... 4 1.3.1 Dysfonction placentaire ... 4
1.3.2 Dysfonction systémique endothéliale ... 5
1.3.3 Stress oxydatif ... 5
1.3.4 Inflammation ... 6
1.4 Traitement et prévention ... 6
PRÉDICTION AU 1er TRIMESTRE DE LA GROSSESSE ... 8
CHAPITRE 2 -2.1 Caractéristiques maternelles ... 8
2.2 Marqueurs biochimiques ... 9
2.2.1 Le PlGF (placental growth factor) et le sFlt-1 (soluble fms-like tyrosine kinase 1) ... 9
2.2.2 La PAPP-A (pregnancy-associated protein A) ... 10
2.3 Doppler des artères utérines ... 10
2.4 Modèle prédictif ... 11
MARQUEURS BIOPHYSIQUES ... 12
CHAPITRE 3 -3.1 Indice de masse corporel (IMC) ... 12
3.2 Pression artérielle ... 12
3.2.1 Mesure de la pression artérielle dans un contexte de prédiction de la prééclampsie .... 13
3.2.2 Pression artérielle et prédiction précoce de la prééclampsie ... 14
HYPOTHÈSE DE RECHERCHE ET OBJECTIFS : ... 15
CHAPITRE 4 -4.1 Premier article ... 15 4.1.1 Hypothèse ... 15 4.1.2 Objectifs ... 15 4.2 Deuxième article ... 15 4.2.1 Hypothèse ... 15 4.2.2 Objectifs ... 15
RÉSULTATS (PREMIER ARTICLE) ... 16
CHAPITRE 5 -5.1 INTRODUCTION ... 20
5.2 MATERIAL AND METHODS ... 20
5.3 RESULTS ... 22
5.4 DISCUSSION ... 23
RÉSULTATS (DEUXIÈME ARTICLE) ... 30
CHAPITRE 6 -6.1 INTRODUCTION ... 33
6.2 MATERIAL AND METHODS ... 34
6.3 RESULTS ... 35 6.4 DISCUSSION ... 36 6.5 ACKNOWLEDGEMENTS ... 37 DISCUSSION ... 44 CHAPITRE 7 -Références ... 49
Annexe 1. Formulaire de consentement ... 59
Annexe 2. Feuille de mesure - première visite ... 64
LISTE DES TABLEAUX
Premier article
Table 1. Characteristics of the study population ... 25
Table 2. Prediction of hypertensive disorders of pregnancy according to body mass index ... 26
Table 1. Maternal characteristics of our study sample ... 38
LISTE DES FIGURES
Premier article
Figure 1. Relation between body mass index and crown-rump length ... 27 Figure 2. First-trimester body mass index according to the subsequent development of hypertensive disorders of pregnancy ... 28 Figure 3. Incidence of hypertensive disorders of pregnancy by categories of body mass index ... 29 Figure 1. Relation between mean arterial blood pressure (MAP) and crown-rump length. ... 40 Figure 2. First-trimester mean arterial blood pressure according to the subsequent development of preeclampsia (PE). ... 41 Figure 3A. Receiver operating characteristics (ROC) curve for the prediction of term preeclampsia using mean arterial blood pressure (MAP) and maternal characteristics. ... 42 Figure 3B. Receiver operating characteristics (ROC) curve for the prediction of preterm preeclampsia using mean arterial blood pressure (MAP) and maternal characteristics. ... 43
LISTE DES ABRÉVIATIONS
ADN : Acide désoxyribonucléiqueALT : Alanine transaminase AST : Aspartate transaminase AUC : Area under the curve BMI : Body mass index CRL : Crown-lump lenght
DPPNI : Décollement prématuré du placenta normalement inséré DR : Detection rate
EO-PE : Early-onset preeclampsia FPR : False positive rate
GH : Gestational hypertension
HELLP : Hemolysis, Elevated Liver enzymes, Low Platelet count IMC: Indice de masse corporelle
LDH : Lactate déshydrogénase MAP : Mean arterial blood pressure MFIU : Mort foetale intra-utérine
MoM : Multiples de la médiane ou multiples of the median PAD : Pression artérielle diastolique
PAM : Pression artérielle moyenne
PAPP-A : Pregnancy-associated protein A PAS : Pression artérielle systolique PE : Prééclampsie
PlGF : Placental growth factor
RCIU : Retard de croissance intra-utérine ROC : Receivers operating characteristic sEng : Soluble endoglin
sFlt-1 : Soluble fms-like tyrosine kinase 1
SOGC : La Société des Obstétriciens et Gynécologues du Canada VEGF : Vascular endothelial growth factor
REMERCIEMENTS
Mon premier remerciement va tout d’abord au Professeur Emmanuel Bujold, mon directeur de maîtrise, pour son appui incroyable. Il a su m’encourager dans tous mes projets tant au niveau scolaire, que professionnel et personnel. Il m’a donné l’opportunité de vivre des expériences incroyables : M’offrir d’excellentes idées de recherche, diffuser mes résultats dans des congrès internationaux, publier dans des revues scientifiques, voyager et j’en passe.
Je souhaite également remercier tout le reste de l’équipe, incluant mes codirecteurs de maîtrise Dre Suzanne Demers et Dr Nils Chaillet, sans qui mes projets de recherche n’auraient jamais pu voir le jour. Vous avez été une équipe splendide, ce n’est pas pour rien que je continu au doctorat avec vous J
Un merci spécial à Dre Amélie Boutin qui m’a donné généreusement de son temps (et de sa patience) et qui m’a énormément appris durant la dernière année, en plus d’être d’excellente compagnie.
Merci aux filles de la maîtrise (Laurence, Mauranne et Marie-Pierre) avec qui j’ai probablement passé plus de temps à partager des fous rires qu‘à travailler. L’année dernière n’aurait pas été la même sans vous.
Merci à mes meilleures amies, Coralie et Natacha, qui sont toujours là pour me supporter et me changer les idées. Je me considère chanceux d’avoir des amies comme vous, sur qui je peux compter même dans les périodes les plus difficiles.
Un merci particulier au Starbucks St-Germain-des-Prés où j’ai passé une grande partie de mes journées (et soirées) pour étudier et travailler sur mes recherches. Pour moi, cet endroit a été le bureau principal de ma maîtrise. Malheureusement, une bonne partie de mes bourses y est restée… Je voudrais finalement dédier ce mémoire à ma famille qui, malgré la distance qui nous sépare, pense beaucoup à moi et m’encourage dans tous ce que j’entreprends. Merci de croire en moi, je vous aime !
AVANT-PROPOS
Les deux articles inclus dans ce mémoire, «Body mass index and the risk of preeclampsia : the Great Obstetrical Syndromes (GOS) study» et «First-trimester mean arterial blood pressure and the risk of preeclampsia: the Great Obstetrical Syndromes (GOS) study», ont été soumis pour publication. Dr Cédric Gasse est l’auteur principal de ces deux articles et a participé activement à la collecte, à la validation et à l’analyse des données, ainsi qu’à la rédaction des articles. Les manuscrits des articles inclus dans ce mémoire ont fait l’objet d’une révision critique de la part de l’ensemble des coauteurs.
INTRODUCTION
La grossesse est un phénomène important dans la vie de plusieurs femmes et d’hommes dans le monde. Par contre, celle-ci peut parfois se compliquer de l’un des problèmes du spectre des grands syndromes obstétricaux, complications de grossesse liées à des dysfonctions placentaires, dont font partie les troubles hypertensifs liés à la grossesse. Ces derniers représentent un problème médical fréquent durant la grossesse. Ils incluent la complication d’une d’hypertension chronique, l’hypertension gravidique, la prééclampsie et l’éclampsie.[1, 2] L’ensemble des troubles hypertensifs de la grossesse, et plus spécifiquement la prééclampsie, peut entraîner des conséquences graves sur la santé et constituent l’une des causes majeures de mortalité et morbidité maternelle et fœtale au Canada et à travers le monde.[3-5]
Bien que la prééclampsie soit une complication majeure de la grossesse, il n’existe actuellement aucun traitement efficace autre que l’accouchement.[6] Cependant, au cours des dernières années, il a été démontré que l’aspirine débutée tôt en grossesse permettait une réduction du risque de prééclampsie chez les femmes identifiées comme étant à risque élevé.[7-10] Ainsi, il existe maintenant un intérêt grandissant de repérer précocement les femmes à risque élevé, et ce, dès le premier trimestre de la grossesse. Bien que plusieurs facteurs de risque soient connus, aucun outil de prédiction efficace de la prééclampsie est actuellement utilisé en clinique. Les guides de pratique nationaux reposent sur la présence d’un facteur de risque majeur ou la combinaison de facteurs mineurs pour déterminer le niveau de risque (faible ou élevé) d’une femme enceinte.[2] Cette méthode de dépistage est très peu efficace.[11]
Nous avons donc voulu évaluer différentes mesures qui semblent être pertinentes dans l’identification des femmes à risque de prééclampsie dans notre population. Parmi celles-ci, les mesures biophysiques, soit l’indice de masse corporelle (IMC) et la pression artérielle moyenne (PAM), semblent prometteuses tant pour leur valeur prédictive que pour leur accessibilité.
Afin d’illustrer l’importance de cette complication de grossesse, le premier chapitre de ce mémoire se concentre sur la revue de la littérature de la prééclampsie, incluant sa définition, son épidémiologie, sa physiopathologie, ainsi que les approches thérapeutiques utilisées. Le deuxième chapitre fera un survol des connaissances sur la prédiction de la prééclampsie, tandis que le troisième chapitre
présentera plus en détail les problématiques actuelles non résolues quant à l’utilisation de mesures biophysiques dans la prédiction de la prééclampsie. La suite de ce mémoire présentera deux articles scientifiques découlant de mon projet de maîtrise portant sur le rôle des mesures biophysiques au premier trimestre dans la prédiction de la prééclampsie. Plus précisément, il s’agit d’un article sur le rôle de l’IMC et un deuxième sur celui de la PAM.
PRÉÉCLAMPSIE
CHAPITRE 1 -
1.1 Définition
La prééclampsie est une maladie multisystémique faisant partie des troubles hypertensifs de la grossesse.[2] Elle constitue une cause importante de mortalité et morbidité périnatale, causant plus de 50 000 décès maternels à travers le monde à chaque année.[12] Elle survient après 20 semaines de grossesse et se traduit cliniquement par l’apparition concomitante de protéines dans les urines (protéinurie) et d’une hypertension artérielle chez une femme précédemment normotendue ou d’une détérioration clinique d’une hypertension préexistante (chronique).[13, 14] Récemment, on a communément subdivisé la prééclampsie en fonction de l’âge gestationnel au diagnostic ou au moment où celle-ci est suffisamment sévère pour qu’un accouchement soit indiqué. La prééclampsie peut donc être à terme (« term preeclampsia » en anglais), pour celles après la 37e semaine de
grossesse; préterme (« preterm preeclampsia »), pour celles avant la 37e semaine; et finalement, les
précoces (« early-onset preeclampsia ») pour celles où un accouchement est effectué avant la 34e
semaine, en oppostion aux prééclampsies tardives («late onset preeclampsia») (à 34 semaines ou plus).[15, 16] Cette subdivision reflète des différences physiopathologiques, car certaines observations indiquent que la contribution placentaire au développement de la complication varierait avec l’âge gestationnel au diagnostic.[17-19] De plus, les prééclampsies prétermes et précoces sont associées à des issues de grossesse plus défavorables pour la mère et le fœtus.[20, 21] Le diagnostic s’établit par la présence d’hypertension artérielle, celle-ci est définie par une pression artérielle systolique (PAS) de 140 mmHg et plus et/ou d’une pression artérielle diastolique (PAD) de 90 mmHg et plus, ainsi que par la présence de protéinurie significative, soit ≥0,3 g protéines urinaires par jour.[2, 22] Le diagnostic de prééclampsie peut être énoncé en l’absence de protéinurie en présence d’une condition indésirable associée ou d’une complication grave. Ces conditions indésirables comprennent l'éclampsie (caractérisée par des convulsions), le syndrome de HELLP (anémie hémolytique, dysfonction hépatique, thrombocytopénie), une hypertension artérielle de plus de 160 mmHg de PAS ou de plus de 105 mmHg de PAD, les maux de tête et les symptômes visuels, la douleur épigastrique, la mort fœtale intra-utérine (MFIU), la restriction de croissance intra-utérine (RCIU), la prématurité, l'oligohydramnios (diminution du liquide amniotique), le décollement
placentaire (DPPNI) et/ou des valeurs de laboratoire anormales (AST ≥ 60 U / L, ALT ≥ 70 U / L, LDH ≥ 190 U / L, plaquette <100).
1.2 Épidémiologie
1.2.1 Prévalence
La prévalence de la prééclampsie à l’échelle mondiale est d’environ 4 à 5% de toutes les grossesses. Par contre, la fréquence varie beaucoup allant d’environ 1% pour la région méditerranéenne de l’Est jusqu’à 6% pour certaines régions d’Afrique. En Amérique du Nord, cette proportion se situe aux environs de 3,0%.[23]
1.2.2 Facteurs de risque
Plusieurs facteurs de risque de la prééclampsie ont été identifiés.[20, 24, 25] Parmi ceux-ci, les plus importants incluent la présence de certaines maladies chroniques (maladie rénale, hypertension, diabète, syndrome des antiphospholipides), l’obésité, la nulliparité, les grossesses multiples, l’âge maternel avancé (≥40 ans) et l’ethnicité (afro-américaine). Les femmes ayant l’une de ces caractéristiques ont un risque plus élevé de développer une prééclampsie, les prévalences atteignant jusqu’à 17,3% pour les femmes qui ont un syndrome des antiphospholipides.[26] Une prééclampsie lors d’une grossesse antérieure augmente considérablement le risque de récidive lors d’une prochaine grossesse, avec un risque relatif de 8,4.[26] De plus, en présence d’antécédent de prééclampsie précoce, des fréquences de récidive de 25 à 65% ont été rapportées dans la littérature.[27, 28] Le tabagisme a été associé à une réduction du risque de prééclampsie et est considéré comme un facteur protecteur.[29]
1.3 Physiopathologie
Bien que plusieurs facteurs de risque de la prééclampsie aient été identifiés, les mécanismes physiopathologiques de ce syndrome ne sont pas entièrement expliqués. Par contre, ce syndrome implique souvent une pathologie placentaire.[18, 19]
1.3.1 Dysfonction placentaire
Lors d’une grossesse normale, les cellules trophoblastiques du placenta vont migrer dans le myomètre pour envahir les artères spiralées maternelles. Cet envahissement trophoblastique entraine une transformation des cellules endothéliales des artères spiralées. Leur transformation va permettre une augmentation du calibre de la lumière des artères spiralées, ce qui va augmenter l’afflux sanguin de la mère vers le fœtus et, ainsi, permettre un meilleur transfert de l’oxygène et des nutriments.[30] Dans le cas de la prééclampsie, ce phénomène est souvent perturbé, menant à une remodélisation anormale des artères spiralées maternelles, créant une perturbation de la perfusion du placenta.[31, 32] Ce défaut de transformation des artères spiralées musculaires étroites en larges artères musculo-élastiques va résulter en une hypoperfusion et une ischémie relative du placenta. Ces complications vont s’accentuer au cours de la grossesse en raison de l’incapacité d’adaptation aux besoins croissants du placenta et du fœtus.[33, 34]
1.3.2 Dysfonction systémique endothéliale
Lors de la grossesse, le placenta requiert une importante angiogenèse (création et croissance de nouveaux vaisseaux sanguins). Pour y parvenir, le placenta sécrète des facteurs proangiogéniques (qui favorisent l’angiogenèse : VEGF [vascular endothelial growth factor] et PlGF [placental growth factor]) et anti-angiogéniques (qui inhibent l’angiogenèse : sFlt-1 [soluble fms-like tyrosine kinase 1] et sEng [soluble endoglin]) de façon équilibrée. Un dysfonctionnement placentaire engendrant une augmentation des facteurs anti-angiogéniques et/ou une diminution de ceux proangiogéniques crée un déséquilibre de ces facteurs dans le sang de la mère, qui entraine une dysfonction systémique de l’endothélium.[35-41] Ce déséquilibre semble être un mécanisme clé dans la physiopathologie de la prééclampsie. D’ailleurs, cette dysfonction systémique de l’endothélium explique plusieurs caractéristiques cliniques de la prééclampsie secondaires à une dysfonction endothéliale du contrôle du tonus vasculaire, d’une augmentation de la perméabilité vasculaire et d’une expression endothéliale de pro-coagulants.[42, 43] Ces troubles mènent à l’hypertension, une protéinurie, de l’œdème et une défaillance d’organes (cerveau, reins, foie et placenta). Par la suite, l’atteinte des organes va contribuer à amplifier ce phénomène, telle l’atteinte des glomérules rénaux qui va contribuer à l’hypertension.[44] Malheureusement, à ce jour, la cause exacte déclenchant cette production anormale des facteurs de l’angiogenèse reste inconnue, mais semble intimement liée à l’ischémie du placenta.[45]
1.3.3 Stress oxydatif
L’augmentation de sFlt-1 (facteur anti-angiogénique) chez les femmes qui vont développer une prééclampsie contribue à produire un stress oxydatif au niveau des vaisseaux sanguins maternels[44]. Ce stress oxydatif engendre une augmentation de la sensibilité des vaisseaux aux substances vasopressives, qui vont favoriser la constriction des vaisseaux et ainsi augmenter la pression dans ceux-ci. Ce phénomène pourrait expliquer que les femmes ayant des antécédents de maladies vasculaires sont plus à risque de prééclampsie en raison des dommages préalables au niveau de leur endothélium vasculaire, plus sensible au stress oxydatif.[46]
1.3.4 Inflammation
L’hypoxie du placenta augmente la mort cellulaire au niveau du tissu placentaire, ce qui augmente les débris syncytiotrophoblastiques dans la circulation sanguine maternelle[47]. Ce relargage de débris composés d’ADN fœtal augmente la réponse inflammatoire systémique maternelle secondaire à l’activation des macrophages.[48] L’inflammation va contribuer à augmenter la sensibilité vasculaire aux facteurs toxiques tels que les facteurs anti-angiogéniques. Ce phénomène pourrait expliquer en partie l’effet protecteur du tabagisme, par une diminution de la réponse inflammatoire.[49, 50]
Des causes immunologiques et génétiques ont également été proposées comme possibles contributeurs au développement de la prééclampsie.[51, 52] Par contre, les données probantes relatives à ces potentiels facteurs causals demeurent insuffisantes pour attester de leur implication et comprendre leurs contributions.
1.4 Traitement et prévention
Le seul traitement efficace de la prééclampsie est l’accouchement et la délivrance du placenta.[6] De ce fait, il n’y a pas de doute sur la conduite à suivre en présence d’une grossesse à terme (≥37 semaines de gestation), même si la prééclampsie est non compliquée (prééclampsie « légère »), car le déclenchement de l’accouchement diminue le risque de complications.[53] Par contre, la conduite à suivre est plus incertaine en présence d’un fœtus immature (<37semaines). Dans ce cas, la décision entre un déclenchement de l’accouchement ou un traitement expectatif dépendra de la sévérité de la maladie chez la femme, de l’état du fœtus et des ressources disponibles (ex. soins néonataux en centre tertiaire). Il s’agit d’évaluer la balance entre les risques pour la mère et l’enfant à
naitre de poursuivre la grossesse et les risques néonataux d’une naissance prématurée. En présence d’une prééclampsie sévère, en raison du risque de complications graves pouvant aller jusqu’au décès de la mère et/ou du fœtus, le déclenchement de l’accouchement sera habituellement indiqué, peu importe l’âge de la grossesse.[13] L’administration de corticostéroïdes (développement pulmonaire du fœtus) et de sulfate de magnésium (neuro-protection du fœtus) sont recommandées lorsque la grossesse est de moins de 34 semaines.[13, 54, 55] L’administration d’antihypertenseur peut également permettre de poursuivre l’approche expectative.[13, 14] De plus, l’utilisation de sulfate de magnésium intraveineux lors de l’accouchement a été démontrée efficace pour réduire les risques de convulsions (éclampsie) chez les prééclampsies sévères.[55]
De nombreuses recherches se concentrent sur des mesures préventives qui pourraient prévenir, sinon retarder, l’apparition de la prééclampsie chez les femmes à risque élevé. L’aspirine (acide acétylsalicylique) débutée tôt en grossesse (avant 16 semaines d’âge gestationnel), et la supplémentation de calcium chez les femmes avec une diète pauvre en calcium, ont été démontrées efficaces.[7-10, 56] Plusieurs sociétés savantes dans le domaine soutiennent donc ces mesures chez les femmes à risque (voir la section 2.1).[2, 14, 57-60] L’efficacité de l’aspirine est liée à son initiation dès le premier trimestre, l’identification des femmes à risque élevé pouvant bénéficier de cette prophylaxie tôt en grossesse revêt un intérêt majeur.
PRÉDICTION AU 1
erTRIMESTRE DE
CHAPITRE 2 -
LA GROSSESSE
La prédiction tôt en grossesse de la prééclampsie est très importante afin de débuter tôt des mesures préventives efficaces et d’assurer un suivi adéquat des patientes les plus à risque. Bien qu’il n’existe pas de test parfait pour dépister au premier trimestre les grossesses qui se compliqueront d’une prééclampsie, il est possible de distinguer les femmes à risque faible et élevé. Plusieurs chercheurs ont d’ailleurs étudié, dans les dernières années, les facteurs de risque et les marqueurs les plus pertinents afin d’identifier celles-ci.
2.1 Caractéristiques maternelles
En ce qui concerne la prédiction précoce de la prééclampsie, la majorité des associations cliniques qui s’intéressent à la santé maternelle basent leurs recommandations principalement sur l’utilisation des caractéristiques maternelles afin d’identifier les femmes à risque élevé de PE.[2, 14, 61] En ce qui concerne les lignes directrices canadiennes de la SOGC, les femmes considérées à risque élevé sont celles ayant un antécédent de prééclampsie, une grossesse multiple, un syndrome des anticorps anti-phospholipides, de l’hypertension, un diabète mellitus, une maladie rénale ou une protéinurie importante au premier trimestre.[2] Également, les femmes ayant deux ou plus des caractéristiques suivantes sont considérées à risque élevé : 40 ans et plus, histoire familiale de prééclampsie (mère ou sœur) ou de maladie cardio-vasculaire précoce, porteuse d’une thrombophilie héréditaire, non-fumeuse, utilisatrice de cocaïne ou de métamphétamine, augmentation des triglycérides pré-grossesse, antécédent d’accouchement préterme ou d’avortement avant 10 semaines avec le même partenaire, obèse, nullipare, nouveau partenaire ou courte durée de relation sexuelle avec le partenaire, utilisation de technologies reproductives, intervalle inter-grossesse de plus de 10 ans, saignement vaginal tôt en grossesse ou maladie trophoblastique gestationnelle.[2] Malheureusement, la considération de toutes ces caractéristiques comme facteurs de risque de prééclampsie rend cette méthode très peu spécifique. Lors d’une étude précédente chez une cohorte de femmes nullipares au sein de notre centre de recherche, nous avons constaté que l’utilisation des lignes directrices de la SOGC n’était pas discriminante pour la PE, combinant une sensibilité de 96% et une spécificité de 6%.[11] Lorsque les caractéristiques maternelles sont utilisées dans un modèle
prédictif de la PE, la performance en est améliorée, mais demeure tout de même faible[11]. Ceci en fait donc un outil de prédiction sous optimal lorsqu’utilisé seul.
2.2 Marqueurs biochimiques
Directement en lien avec la physiopathologie de la maladie, plusieurs marqueurs biochimiques sériques sont étudiés, seuls ou en combinaison, afin de déterminer leur apport potentiel dans la prédiction de la PE. Les principaux marqueurs à l’étude au premier trimestre pour la prédiction de la prééclampsie sont les niveaux des facteurs angiogéniques (proangiogéniques et anti-angiogéniques), dont le facteur de croissance placentaire (placental growth factor, PlGF) et le fms-like tyrosine kinase 1 soluble (soluble fms-fms-like tyrosine kinase-1, sFlt-1), ainsi que les niveaux de protéines placentaires, dont la protéine A plasmatique associée à la grossesse (plasma associated
protein A, PAPP-A).
2.2.1 Le PlGF (placental growth factor) et le sFlt-1 (soluble fms-like tyrosine
kinase 1)
Comme il en a été discuté précédemment dans la section «Physiopathologie», le dysfonctionnement au niveau du placenta rencontré dans la PE semble engendrer une augmentation des facteurs anti-angiogéniques, tel que le sFlt-1, et une diminution des facteurs proanti-angiogéniques, dont le PlGF. Dans cette optique, plusieurs se sont intéressés à ces biomarqueurs pour la prédiction précoce de la PE. Dans le cadre d’une méta-analyse réalisée en 2012, il a d’ailleurs été observé que les grossesses qui allaient subséquemment développer une prééclampsie ont des niveaux de PlGF inférieurs et des niveaux de sFlt-1 supérieurs avant 30 semaines de gestation en comparaison aux grossesses qui ne développeront pas cette complication. La prédiction de la PE grâce à ces deux facteurs reste cependant modeste avec des sensibilités de 32% et 26%, pour le PlGF et le sFlt-1 respectivement, à un taux de faux positif de 5%.[62] Les niveaux de PlGF semblent également inférieurs dès le premier trimestre de la grossesse[36, 63, 64] mais certaines études ont obtenu des résultats contradictoires.[65, 66] Bien que les niveaux de sFlt-1 soient plus élevés chez les femmes atteintes de prééclampsie en fin de grossesse, certaines études ont observé que la différence dans les niveaux de ce biomarqueur au premier trimestre de la grossesse ne semble pas statistiquement significative.[37, 63] Une méta-analyse réalisée en 2014 a observé l’effet de certains marqueurs sanguins, dont le PlGF et le sFlt-1, dans la prédiction de la prééclampsie au premier trimestre de la
grossesse. Il a été observé que le sFlt-1 était significativement associé avec la PE (RC 1,3; IC à 95% 1,02-1,65), mais pas avec les cas de PE précoce et que, à l’inverse, le PlGF était significativement associé avant les cas de PE précoce (RC 3,4; IC à 95% 1,6-7,2), mais pas avec tout les cas de PE.[67]
2.2.2 La PAPP-A (pregnancy-associated protein A)
La PAPP-A fait déjà partie des mesures utilisées par les cliniciens depuis plusieurs années pour le dépistage des aneuploidies foetales.[68] Il a été observé que, chez les fœtus présentant un caryotype normal, des niveaux abaissés de cette protéine au premier trimestre de la grossesse seraient associés à des issues de grossesse défavorables, dont la prééclampsie.[69-73] Par contre, lorsqu’utilisée seule, la PAPP-A ne permettrait de prédire qu’environ 15% des femmes qui feront une prééclampsie pour un taux de faux positif de 5%.[74] Une étude plus récente a obtenu une sensibilité supérieure, soit 31% à un taux de faux positif de 5%.[75]
Bien que certains marqueurs biochimiques semblent intéressants pour la prédiction précoce de la prééclampsie, lorsque ceux-ci sont utilisés individuellement, leur capacité prédictive reste trop basse pour pouvoir les considérer comme test prédictif à part entière.
2.3 Doppler des artères utérines
Il faut se souvenir que les femmes atteintes de prééclampsie souffrent habituellement d’une anomalie au niveau de l’implantation du placenta secondaire au défaut de l’envahissement des artères utérines spiralées par les cellules trophoblastiques. Cette déficience de la transformation des artères musculaires étroites et rigides va créer une résistance artérielle accrue lors de la croissance placentaire en comparaison à une grossesse normale. Plusieurs chercheurs se sont donc penchés sur l’hypothèse que les femmes qui développeront une PE présenteraient un index de pulsatilité des artères utérines supérieur à celui des femmes avec des grossesses sans complication. Plusieurs études sur le sujet ont été réalisées afin de valider cette hypothèse et d’établir la contribution de l’échographie Doppler dans la prédiction précoce de la PE. Les revues systématiques et méta-analyses résumant les résultats de ces études semblent démontrer que le Doppler des artères utérines permettrait d’identifier les femmes à risque élevé de PE, principalement celles qui développeront une PE sévère.[76-79] En combinant le Doppler des artères utérines aux
caractéristiques maternelles, O’Gorman et al.[75] ont identifié des sensibilités de 46% et 33% pour les prééclampsies prétermes et à termes, respectivement, à un taux de faux positif de 5%. Malheureusement, encore une fois, l’utilisation seule de ce test possède une sensibilité et une spécificité trop faible pour être utilisée en clinique chez une population générale.[80, 81]
2.4 Modèle prédictif
À l’heure actuelle, aucun test seul n’obtient des valeurs prédictives suffisamment élevées pour être un test prédictif à part entière applicable en clinique. De là vient l’importance de créer un modèle prédictif incluant plusieurs de ces caractéristiques afin d’obtenir les meilleures sensibilité et spécificité possibles. Bien que chacun des facteurs présentés précédemment (caractéristiques maternelles, marqueurs biochimiques, Doppler des artères utérines) possède une capacité prédictive limitée lorsqu’utilisé séparément, la combinaison de ceux-ci présente des résultats beaucoup plus intéressants.[82-86] L’algorithme utilisé dans l’étude ASPRE afin d’identifier les femmes à risque élevé de prééclampsie préterme inclut la combinaison de caractéristiques maternelles (âge, IMC, ethnicité, parité, antécédent personnel ou familial de prééclampsie et de petit pour l’âge gestationnel, intervalle de temps entre les grossesses, antécédents médicaux, tabac, méthode de conception), la PAM, le Doppler des artères utérines et des marqueurs biochimiques (PlGF et PAPP-A).[87] À l’aide de leur modèle mathématique, ils ont obtenu des valeurs prédictives de 77% et de 43% pour la prééclampsie préterme et à terme, respectivement, à un taux de faux positif de 9%.
La combinaison idéale de facteurs pour créer le meilleur modèle prédictif reste cependant à valider puisqu’il existe une grande variabilité dans les facteurs inclus entre chaque modèle, ainsi que dans la façon de mesurer et analyser chaque variable et ceci pour différente population. Par contre, la majorité inclut certaines caractéristiques maternelles, telles que l’IMC, combinée avec la mesure de la pression artérielle, de marqueurs biochimiques ainsi que le Doppler des artères utérines, comme c’est le cas dans l’étude ASPRE.
MARQUEURS BIOPHYSIQUES
CHAPITRE 3 -
Les marqueurs biophysiques, soit l’IMC et la pression artérielle, représentent des mesures simples, peu coûteuses et sécuritaires qui peuvent être prises facilement en clinique afin d’évaluer le risque de nos patientes. Ces derniers jouent un rôle important dans la prédiction de la PE au premier trimestre. Ils sont d’ailleurs inclus dans la majorité des modèles prédictifs actuels.
3.1 Indice de masse corporel (IMC)
L’IMC est une mesure anthropométrique utilisée comme indicateur de la corpulence d’une personne. Pour la calculer, il suffit de diviser le poids d’un individu en kilogramme par sa grandeur en mètre au carré (kg/m2). Selon l’Organisme Mondial de la Santé (OMS), chez l’adulte, un IMC entre 18,5 et 24,9
kg/m2 est considéré comme un poids santé, alors qu’un IMC entre 25 et 29,9 kg/m2 est considéré
comme un surplus de poids et qu’un IMC au-dessus de 30 kg/m2 est considéré comme de l’obésité.
Cet indice est généralement utilisé afin de déterminer le risque d’une personne de souffrir de différentes maladies reliées au surplus de poids ou à l’obésité, tels que le diabète de type 2 et l’hypertension artérielle. Les complications gestationnelles n’y font pas exception. Les femmes enceintes avec un surplus de poids sont plus à risque de développer des complications ainsi que leur nouveau-nés.[88-93] Des études menées chez différentes populations ont démontré que les femmes avec un IMC élevé ont un risque accru de développer une PE.[94-96] Les lignes directrices de la SOGC considèrent que les femmes combinant un obésité pré-grossesse (IMC>30 kg/m2) et un autre
facteur de risque de PE, telle la nulliparité, sont à risque élevé de PE.[2] La valeur prédictive de ce modèle de prédiction n’est pas clair et il est justifié de se questionner à savoir s’il s’agit de la meilleure manière de modéliser cette variable pour l’évaluation du risque dans notre population. La littérature demeure vague et les études contradictoires au sujet de la modélisation optimale (dichotomique ou continue) de l’IMC pour la prédiction de la PE.[94, 95, 97] Le choix du critère d’obésité, plus simple, ou de l’IMC en tant que variable continue, plus précis, dans l’identification les femmes à risque élevé de PE demeure à être déterminé.
3.2 Pression artérielle
La pression artérielle correspond à la pression exercée par le sang sur la paroi des artères et est mesurée en millimètre de mercure (mmHg). Elle possède deux composantes : la PAS (lors de la
contraction du muscle myocardique) et la PAD (lors de la phase de repos du muscle myocardique). La PAS est déterminée par le volume d’éjection sanguin ainsi que par la rigidité de l’aorte et des grosses artères.[98] Pour sa part, la PAD reflète principalement la résistance périphérique qui dépend essentiellement du tonus des petites artères et qui tend à diminuer avec l’augmentation de la rigidité de l’aorte.[99] Afin de tenir compte des deux composantes, la pression artérielle peut également être exprimée par un seul chiffre, soit la PAM. La PAM se calcule en additionnant la valeur de la PAS et deux fois la valeur de la PAD puis en divisant le tout par trois [(PAS + 2PAD)/3].
3.2.1 Mesure de la pression artérielle dans un contexte de prédiction de la prééclampsie
En accord avec les lignes directrices canadiennes de la SOGC, la pression artérielle chez les femmes enceintes devrait être mesurée en clinique pendant que la patiente est en position assise avec le bras à la hauteur du cœur. Il est important d’utiliser un brassard de grandeur approprié pour chaque patiente (la longueur de la chambre à air devrait être environ 80% de la circonférence du bras et sa largeur d’environ 40%). La mesure doit être prise à l’aide d’un sphygmomanomètre à mercure ou d’un appareil automatisé validé chez les femmes enceintes.[2] Par contre, malgré cette dernière recommandation, lors d’une étude précédente au sein de notre centre de recherche, nous avons démontré qu’il existe une différence significative entre la pression artérielle prise en clinique à l’aide d’un appareil manuel et celle prise avec un appareil automatisé validé. Dans un contexte de prédiction de la PE, l’utilisation d’un appareil automatisé validé avec une technique standardisée a démontré une efficacité nettement supérieure à celle d’un appareil manuel.[100] De plus, la pression artérielle devrait être mesurée aux deux bras puisqu’il a été décrit qu’une différence importante (>10mmHg) entre les deux bras survenait chez 8,3% des femmes enceintes, pour la PAS, et chez 2,3%, pour la PAD.[101] Ainsi, en n’utilisant qu’un seul bras, l’incidence d’hypertension au premier trimestre pourrait être sous-estimée jusqu’à une fois sur trois.[101] Également, la pression artérielle devrait être mesurée après que la patiente soit demeurée assise durant 5 minutes pour que la pression artérielle se stabilise. Une étude a démontré que ce délai chez les femmes enceintes était raisonnable puisqu’il existe une différence significative entre la pression mesurée à l’arrivée et celle à 5 minutes, mais qu’il n’y a pas de différente notable entre la mesure à 5 minutes et celle après 10 minutes.[102] Lors de l’évaluation de la pression artérielle d’une patiente, il est important de prendre en compte l’âge gestationnel puisqu’il a été démontré que la pression artérielle diminue au cours du
premier trimestre de la grossesse, ce qui peut influencer la mesure.[103] De plus, l’utilisation de la PAM plutôt que la valeur de la PAS ou de la PAD est habituellement d’usage puisqu’elle semble avoir un meilleur pouvoir prédictif.[104, 105]
3.2.2 Pression artérielle et prédiction précoce de la prééclampsie
Plusieurs études ont évalué l’utilisation de la mesure de la pression artérielle comme prédicteur de la PE et des désordres hypertensifs de la grossesse. Il a été démontré à plusieurs reprises que la pression artérielle mesurée durant les deux premiers trimestres de la grossesse est intimement associée au risque subséquent de développer ces pathologies gestationnelles.[104, 106-112] Par contre, la force de l’association est variable à travers les études. Selon la méta-analyse de Poon et al.[105], les valeurs prédictives diffèrent grandement entre les études, avec des sensibilités allant de 4,4% à 100,0% et des taux de faux positif allant de 0% à 66%. Cette variabilité semble être due à la grande hétérogénéité dans la technique de mesure entre les études et dans les «cut-off» de la PAM utilisés.[104, 105] Peu d’études sur la prédiction précoce de la PE au premier trimestre de la grossesse ont été réalisées avec une méthode standardisée rigoureuse. Il existe également une hétérogénéité dans les populations étudiées. Des études utilisant des techniques validées sont nécessaires afin de mieux décrire et valider la performance prédictive de la pression artérielle au premier trimestre de la grossesse pour la PE pour différentes populations.
HYPOTHÈSE DE RECHERCHE ET
CHAPITRE 4 -
OBJECTIFS :
4.1 Premier article : Valeur prédictive de l’IMC
4.1.1 Hypothèse
L’IMC au premier trimestre de la grossesse est associé au développement subséquent de troubles hypertensifs de la grossesse.
4.1.2 Objectifs
Primaire : Estimer la valeur prédictive de l’IMC calculé au 1er trimestre de la grossesse pour les
troubles hypertensifs de la grossesse chez les nullipares dans notre population.
Secondaires : Évaluer la meilleure modélisation de l’IMC (dichotomique (plus ou moins 30 kg/m2),
catégorielle ou en continue) pour la prédiction des troubles hypertensifs de la grossesse.
4.2 Deuxième article
4.2.1 Hypothèse
La PAM mesurée par un appareil automatisé au premier trimestre de la grossesse est associée au développement subséquent de troubles hypertensifs de la grossesse.
4.2.2 Objectifs
Primaire : Estimer la valeur prédictive de la PAM mesurée à l’aide d’un appareil automatisé, seule
ou en combinaison avec d’autres caractéristiques maternelles, au premier trimestre de la grossesse pour la PE chez les nullipares dans notre population.
Secondaire : Estimer la valeur prédictive de la PAM mesurée à l’aide d’un appareil automatisé,
seule ou en combinaison avec d’autres caractéristiques maternelles, au premier trimestre de la grossesse pour les autres troubles hypertensifs de la grossesse (l’hypertension gestationnelle sans PE, la PE préterme et la PE précoce) chez les nullipares dans notre population.
RÉSULTATS (PREMIER ARTICLE)
CHAPITRE 5 -
Body mass index and the risk of hypertensive disorders of
pregnancy: the Great Obstetrical Syndromes (GOS) study
Cédric Gasse MD,1 Amélie Boutin PhD,2 Suzanne Demers MD MSc,2,3 Nils Chaillet PhD,2,3Emmanuel Bujold MD MSc,2,3
1 Department of Social and Preventive Medicine, Faculty of Medicine, Université Laval, Quebec City,
Qc, Canada
2 CHU de Québec-Université Laval Research Center, Quebec City, Qc, Canada
3 Department of Obstetrics and Gynecology, Faculty of Medicine, Université Laval, Quebec City, Qc,
Canada
Corresponding author:
Emmanuel Bujold MD MSc
Professor, Department of Obstetrics and Gynecology, Faculty of Medicine, Université Laval,
2705 boulevard Laurier, Québec, QC, Canada, G1V 4G2; Email: emmanuel.bujold@crchudequebec.ulaval.ca
Word count: Abstract: 214 words; text (excluding references): 2310 words.
Key words: Pregnancy; Hypertensive disorders of pregnancy; Body-Mass Index, BMI; Obesity;
Prenatal screening
Conflict of interest: The authors declared no conflict of interest.
Funding: This study was funded by the Jean-Louis-Lévesque-Foundation, Montreal, Qc, Canada
and by the Jeanne-et-Jean-Louis-Lévesque Perinatal Research Chaire at Université Laval. Dr Emmanuel Bujold holds a Clinician Scientist Award from the Fonds de recherche du Quebec – Santé.
RÉSUMÉ
OBJECTIF: Estimer la valeur prédictive de l’indice de masse corporel (IMC) durant le premier
trimestre de la grossesse pour les troubles hypertensifs de la grossesse (THG).
MÉTHODES: Étude de cohorte prospective de femmes nullipares recrutées a 11-13 semaines de grossesse. La grandeur et le poids ont été mesurés et l’IMC a été rapporté en variables dichotomique (plus ou moins 30 kg/m2), catégorielle (classification de l’Organisation Mondiale de la Santé) et
continue. Les participantes ont été suivies pour le développement de THG, incluant la prééclampsie et la prééclampsie préterme. Des régressions logistiques multivariées ont été construites afin de développer un modèle prédictif combinant l’IMC et d’autres caractéristiques maternelles et des courbes ROC et leur aire sous la courbe (AUC) ont été utilisé afin d’évaluer les valeurs prédictives.
RÉSULTATS: 4683 femmes éligibles recrutées dont 645 (14%) sont affectées par l’obésité. L’obésité
était associé à un risque supérieur de THG (22.5% vs 8.5%, p<0.0001), de prééclampsie (10.2% vs 4.3%, p<0.0001) et de prééclampsie préterme (1.6% vs 0.6%, p=0.006). L’IMC en continu combiné avec d’autres caractéristiques maternelles (AUC: 0.76; IC95%: 0.69– 0.83) était un meilleur prédicteur de la prééclampsie préterme que l’IMC lorsque rapportée en variable catégorielle (AUC: 0.65; IC95%: 0.56– 0.74) et l’IMC en tant que variable binaire (AUC: 0.58; IC95%: 0.50– 0.66).
CONCLUSION: L’obésité et l’IMC mesurés entre 11 et 13 semaines de grossesse sont associés au
risque de tous les types de THG. La prédiction optimale de la prééclampsie préterme est obtenue par l’utilisation de l’IMC en tant que variable continue en combinaison avec d’autres caractéristiques maternelles.
ABSTRACT
OBJECTIVE: To estimate the predictive performance of first-trimester body mass index (BMI) for the
hypertensive disorders of pregnancy (HDP).
METHODS: A prospective cohort of nulliparous women recruited at 11-13 weeks. Height and weight
were measured and BMI was reported as binary (more or less than 30 kg/m2), categorical (World
Health Organization’ classification), and continuous variables. Participants were followed for development of any HDP, including preeclampsia and preterm preeclampsia. Multivariate logistic regressions were used to develop predictive models combining BMI with other maternal characteristics and receiver operating characteristic curves and their area under the curve (AUC) were used to assess predictive performance.
RESULTS: We recruited 4683 eligible participants including 645 (14%) affected by obesity. Obesity
was associated with greater risks of HDP (22.5% vs 8.5%, p<0.0001), preeclampsia (10.2% vs 4.3%, p<0.0001) and preterm preeclampsia (1.6% vs 0.6%, p=0.006). Continuous BMI combined with maternal characteristics (AUC: 0.76; 95%CI: 0.69– 0.83) was a better predictor of preterm preeclampsia than BMI categories (AUC: 0.65; 95%CI: 0.56– 0.74) and BMI as binary variable (AUC: 0.58; 95%CI: 0.50– 0.66).
CONCLUSION: Obesity and BMI measured between 11 and 13 weeks of pregnancy are associated
with the risk of all types of HDP. Optimal prediction of preterm preeclampsia is achieved by using BMI as a continuous variable combined with other maternal characteristics.
5.1 INTRODUCTION
Hypertensive disorders, including preeclampsia, affect 8 to 16% of all pregnancies around the world.[1, 14] Preeclampsia is characterized by a new-onset of hypertension after 20 weeks of gestation combined with proteinuria. It can lead to serious multi-organ disease and it is a significant cause of morbidity and mortality in pregnant women and their foetus.[1, 12] Currently, the only effective treatment of preeclampsia is the delivery of the placenta.[6] Preeclampsia requiring delivery before term are typically associated with deep placentation disorders and the worst pregnancy outcomes.[20, 113] Fortunately, recent advances showed that daily aspirin initiated in early pregnancy prevents most cases of preeclampsia, and especially the preterm forms of the disease.[7-10] This major finding has fostered a wide interest in the early identification of pregnant women at high risk of preterm preeclampsia.
The prevalence of obesity is constantly increasing in developed countries.[114] Overweight and obesity are risk factors for pregnancy complications such as gestational diabetes, fetal macrosomia, fetal anomalies and stillbirth.[88-93] Obesity is also an important risk factor for the hypertensive disorders of pregnancy (HDP), including preeclampsia.[94-96] Currently, the Society of Obstetricians and Gynecologists of Canada (SOGC) recommends that all nulliparous women (being pregnant for the first time is considered to be a risk factor for HDP) affected by obesity [body mass index (BMI) ≥ 30kg/m2] should take a daily aspirin.[2] However, the impact of such recommendation and the
predictive performance of BMI for HDP, preeclampsia and preterm preeclampsia in nulliparous population have not been clearly reported.
We aimed to estimate the performance of BMI measured in early-pregnancy for the prediction of HDP and particularly for preterm preeclampsia, which could be prevented by aspirin.
5.2 MATERIALS AND METHODS
We conducted a prospective cohort study composed of nulliparous women attending their 11-13 weeks ultrasound. Women outside the gestational age window (between 11 0/7 and 13 6/7 weeks) based on crown-rump length (CRL); those with multiple gestation; and those who underwent medical termination of pregnancy were excluded. The research ethics committee of the CHU de Québec – Université Laval (CHUL) approved the study. After written informed consent was obtained, we asked
each participant to complete a questionnaire on maternal characteristics and medical history. A trained research nurse measured weight and height at the initial visit for the calculation of BMI (weight in kilograms divided by the square of height in meters (kg/m2). The BMI was classified into six
different categories, in accordance with the classification of the World Health Organisation (WHO). Obesity was defined as a BMI of 30 kg/m2 and over.
Participants were followed until delivery and medical charts were reviewed. Outcomes included any HDP, gestational hypertension, preeclampsia and preterm preeclampsia (preeclampsia requiring a delivery before 37 weeks of gestation). Standard definitions based on the American College of Obstetricians and Gynaecologists (ACOG) and the Society of Obstetricians and Gynaecologists of Canada (SOGC) guidelines were used.[2, 22] Gestational hypertension is defined as a systolic blood pressure of 140 mmHg or more and/or a diastolic blood pressure of 90 mmHg or more on at least two occasions 4 hours apart occurring at/or after 20 weeks’ gestation in previously normotensive women. The diagnosis of preeclampsia was based on the presence of gestational hypertension with the presence of significant proteinuria and/or one or more adverse conditions and/or one or more severe complications. Proteinuria is defined as ≥ 0.3 g/d in a complete 24-hour urine collection or ≥ 30 mg/mmol urinary creatinine in a spot (random) urine sample or ≥ 1+ proteinuria on an urinary dipstick. Adverse conditions and severe complications include headache and visual symptoms, epigastric pain, fetal death, intra-uterine growth restriction, placental abruption, elevated liver enzyme, thrombocytopenia, and severe hypertension. A maternal-fetal medicine subspecialist blinded to all other research data reviewed all cases with an adverse pregnancy outcome to confirm the diagnosis.
We computed the multiples of the median (MoM) of BMI adjusted for gestational age. A graphical display of the relationship between CRL and BMI was produced. Logistic regression was used to develop predictive models for gestational hypertension, preeclampsia, and preterm preeclampsia including other maternal characteristics (age, ethnicity, smoking status, method of conception and chronic diseases, i.e. diabetes, hypertensive disorder, renal disease and connective tissue disease). Receivers operating characteristic (ROC) curve analyses were performed for 4 different variables related to the BMI (≥30kg/m2, WHO’s classification, BMI as a continuous variable adjusted for
gestational age and prediction models including BMI with maternal characteristics) and we estimated the predictive performance of each variable by calculating the area under the curve (AUC). The
predictive performances (ROC curves; AUC) were compared using ROC contrast test (DeLong et al. method).[115] Two-tailed P-values <0.05 were used to describe a statistically significant association for all analyses. The statistical software packages SAS (Version 9.3, SAS Institute Inc. Cary, NC, USA) was used for all data analyses.
5.3 RESULTS
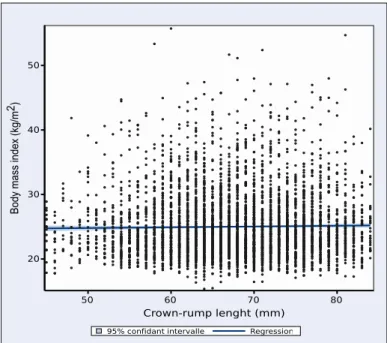
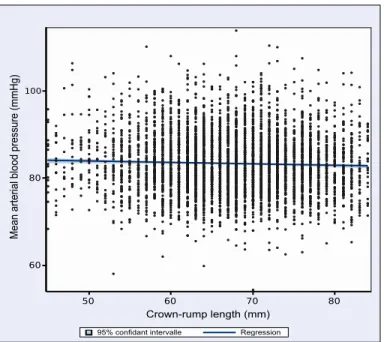
We recruited 5005 nulliparous women among which 4749 were eligible (Table 1). Exclusions were based on age < 18 years old (n=2), multiple gestations (n=29), medical termination of gestation (n=46) and baseline visit conducted out of the planned time-window (n=179). BMI was missing for 17 participants and 49 (1%) were lost to follow-up. Therefore, 4683 women (99%) remained available for the analyses. We observed that BMI tends to slightly increase between 110/7 and 136/7 weeks of
gestation, but this relation was not significant in our population (Figure 1). The prevalence of women with BMI ≥30 kg/m2 was 13.8% (n = 645). A total of 491 participants developed a HDP, including 250
(5.3%) women with gestational hypertension, 241 (5.1%) with preeclampsia and 33 (0.7%) who developed preterm preeclampsia.
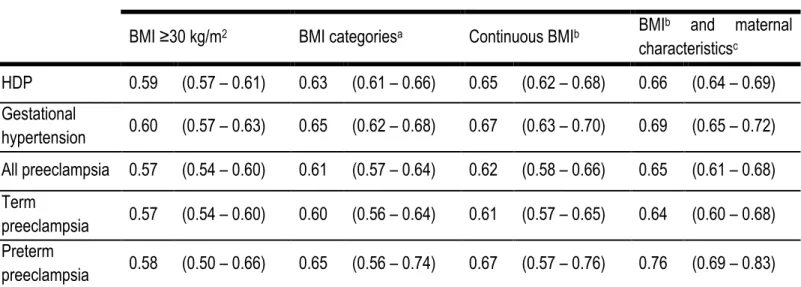
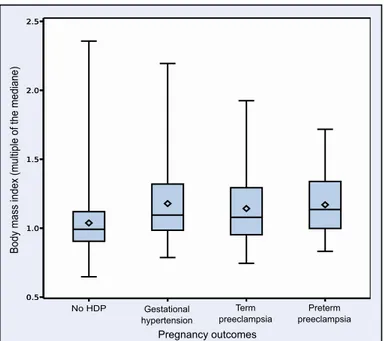
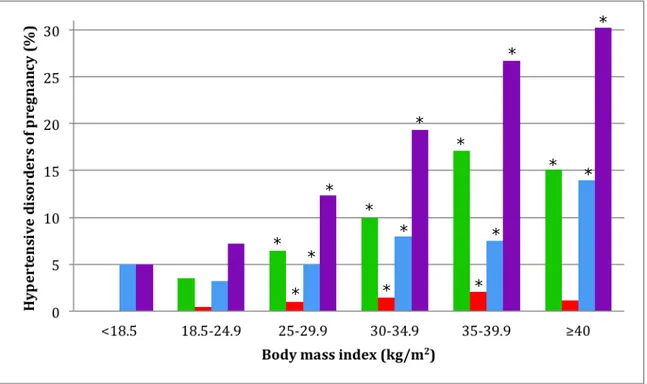
First-trimester BMI was higher in women who developed GH (p<0.0001), preeclampsia (p<0.0001) and preterm preeclampsia (p<0.0001) (Figure 2). Obesity was associated with greater risks of HDP (22.5% vs 8.5%, p<0.0001), preeclampsia (10.2% vs 4.3%, p<0.0001) and preterm preeclampsia (1.6% vs 0.6%, p=0.006). We observed a dose-response effect between BMI and all forms of HDP (Figure 3) (trend test p<0.0001). Table 2 reports the predictive performances of BMI for HDP using ROC curves. BMI reported as continuous variable was superior than using a binary variable (< or ≥30 kg/m2) for the prediction of gestational hypertension, preeclampsia and preterm preeclampsia
(p<0.0001, p=0.0005 and p=0.02, respectively). Continuous BMI combined with maternal characteristics was significantly superior to categories BMI and BMI reported as binary variable for the prediction of any HDP (categories BMI: all p<0.02, BMI ≥30 kg/m2: all p≤0.0002) and was
superior to continuous BMI alone for the prediction of preeclampsia and preterm preeclampsia (p=0.02 and p=0.01, respectively) but not for GH (p=0.06). At a false positive rate of 10%, we observed that first-trimester continuous BMI alone could have predicted 28% of gestational hypertension, 25% of preeclampsia, 30% of preterm preeclampsia. BMI reported as binary variable could have also predicted 30% of preterm preeclampsia, but with a 14% false positive rate. Finally,
76 (1.6%) participants reported having taking aspirin during pregnancy for several reasons. Excluding those participants did not influence significantly our results.
5.4 DISCUSSION
BMI measured in the first-trimester of pregnancy is a strong independent predictor of all HDP, including gestational hypertension, preeclampsia and preterm preeclampsia in nulliparous women. BMI as a continuous variable is superior than BMI as a binary variable for the prediction of HDP. Our findings are in agreement with studies reporting an association between pre-pregnancy BMI and the risk of preeclampsia, independently of the women’s parity.[94-96] A higher BMI measured at 110/7
– 136/7 weeks was also observed in women who developed gestational hypertension, preeclampsia
and early-onset preeclampsia compared to those who did not develop preeclampsia.[116] One prospective study that include nulliparous women specifically (N=893), also reported a significant association between HDP and maternal BMI measured at 11-13 weeks.[117] The current study allows estimating the predictive performance in nulliparous women who typically do not take aspirin prophylaxis for the prevention of term and preterm preeclampsia.
Currently, according to SOGC guidelines or to the NICE guidelines, a minimum of 14% of our participants should have received daily aspirin based only on the BMI greater than 30 kg/m2.[2, 61]
Only 22.5% of those women developed any HDP and only 1.6% developed preterm preeclampsia, which is typically prevented by daily aspirin. Therefore, while nulliparity and obesity are two risk factors for HDP and preterm preeclampsia, their combination remains associated with a low positive predictive value. Moreover, according to our data, the use of BMI as a continuous variable, combined with other maternal characteristics, would offer a better predictive performance than the obesity status alone.
Some authors have suggested that pre-pregnancy BMI should be used to evaluate the risk of preeclampsia.[118] We did not collect this information and we can’t compare it to the first-trimester BMI. The 11-14 weeks visit is commonly used for an accurate assessment of gestational age and for the measurement of nuchal translucency for the prediction of fetal aneuploidies.[119-121] Even if most women gain weight over the first-trimester, this gain is usually minimal and should not radically influence the BMI.[122] The weight and height measured by trained nurses avoided recall bias
associated with self-reported weight, errors due to variations of weights over time, missing values, and it provided a standard measurement for every woman.
We recruited mostly women of Caucasian origins (96%) and therefore it is possible that our findings do not apply to other populations, because ethnicity is a possible modifying factor. Furthermore, we did not collect information about family history of HDP, which is a characteristic that could have improved our prediction models.[123] On the other hand, our study has several strengths including its large size and power, a high (99%) follow-up rate, rigorous methodology, the evaluation of pregnancy outcomes by trained professionals blinded to first-trimester data and validated by a maternal-fetal medicine subspecialist.
In conclusion, our study confirms in our population that first-trimester BMI can be useful to identify nulliparous women at high-risk of HDP, including preterm preeclampsia. The current use of the obesity status as a discriminative binary variable in guidelines has a low predictive performance. BMI should be used as a continuous variable and combined with other maternal characteristics and potentially with other biomarkers such as mean arterial blood pressure, ultrasound markers, and serum biomarkers, to reach higher discriminative levels.
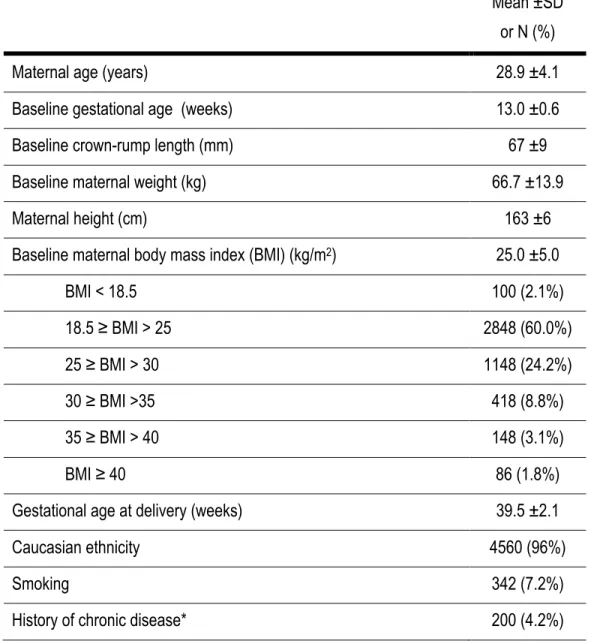
Table 1. Characteristics of the study population
Mean ±SD or N (%)
Maternal age (years) 28.9 ±4.1
Baseline gestational age (weeks) 13.0 ±0.6
Baseline crown-rump length (mm) 67 ±9
Baseline maternal weight (kg) 66.7 ±13.9
Maternal height (cm) 163 ±6
Baseline maternal body mass index (BMI) (kg/m2) 25.0 ±5.0
BMI < 18.5 100 (2.1%) 18.5 ≥ BMI > 25 2848 (60.0%) 25 ≥ BMI > 30 1148 (24.2%) 30 ≥ BMI >35 418 (8.8%) 35 ≥ BMI > 40 148 (3.1%) BMI ≥ 40 86 (1.8%)
Gestational age at delivery (weeks) 39.5 ±2.1
Caucasian ethnicity 4560 (96%)
Smoking 342 (7.2%)
History of chronic disease* 200 (4.2%)
Table 2. Prediction of hypertensive disorders of pregnancy according to body mass index
Body mass index (BMI) reported in different forms
BMI ≥30 kg/m2 BMI categoriesa Continuous BMIb BMIb and maternal
characteristicsc HDP 0.59 (0.57 – 0.61) 0.63 (0.61 – 0.66) 0.65 (0.62 – 0.68) 0.66 (0.64 – 0.69) Gestational hypertension 0.60 (0.57 – 0.63) 0.65 (0.62 – 0.68) 0.67 (0.63 – 0.70) 0.69 (0.65 – 0.72) All preeclampsia 0.57 (0.54 – 0.60) 0.61 (0.57 – 0.64) 0.62 (0.58 – 0.66) 0.65 (0.61 – 0.68) Term preeclampsia 0.57 (0.54 – 0.60) 0.60 (0.56 – 0.64) 0.61 (0.57 – 0.65) 0.64 (0.60 – 0.68) Preterm preeclampsia 0.58 (0.50 – 0.66) 0.65 (0.56 – 0.74) 0.67 (0.57 – 0.76) 0.76 (0.69 – 0.83) Results are reported in area under the curve of receiver operator characteristics curves with the 95%
confidence intervals.
HDP: Hypertensive disorders of pregnancy;
a Using the 6 categories of the classification of the World Health Organisation (WHO).
b Continuous BMI computed as multiples of median according to gestational age at measurement. c Maternal characteristics include age, ethnicity, smoking status, method of conception and chronic
Figure 1. Relation between body mass index and crown-rump length
We observed that the body mass index does not increase significantly (p=0.2) between 110/7 and
136/7 weeks of gestation. 50 60 70 80 Crown-rump lenght (mm) 20 30 40 50 B od y m as s in de x ( kg /m 2 ) Regression 95% confidant intervalle
Figure 2. First-trimester body mass index according to the subsequent development of hypertensive disorders of pregnancy
We observed that women who developed gestational hypertension (p<0.0001), term preeclampsia (p<0.0001) and preterm preeclampsia (p<0.0001) had a greater body mass index than women who did not develop any hypertensive disorders of pregnancy (HDP).
0.5 1.0 1.5 2.0 2.5 No HDP 0.5 1.0 1.5 2.0 2.5
Body mass index (multiple of the mediane)
Term preeclampsia Gestational hypertension Preterm preeclampsia Pregnancy outcomes
Figure 3. Incidence of hypertensive disorders of pregnancy by categories of body mass index
Incidence of gestational hypertension (green) term preeclampsia (blue), preterm preeclampsia (red) and all HDP (violet) are reported for each body mass index categories.
* Significantly different from reference group (18.5-24.9), p<0.05 * * * * * * * * * * * * * * *
RÉSULTATS (DEUXIÈME ARTICLE)
CHAPITRE 6 -
First-trimester mean arterial blood pressure and
the risk of preeclampsia: the Great Obstetrical
Syndromes (GOS) study
Cédric Gasse MD MSc candidate,1 Amélie Boutin PhD,2 Maxime Coté MD,3 Nils Chaillet PhD,2,3
Emmanuel Bujold MD MSc,2,3 Suzanne Demers MD MSc2,3
1 Department of Social and Preventive Medicine, Faculty of Medicine, Université Laval, Quebec City,
Qc, Canada
2 CHU de Québec-Université Laval Research Center, Quebec City, Qc, Canada
3 Department of Obstetrics and Gynecology, Faculty of Medicine, Université Laval, Quebec City, Qc,
Canada
Conflict of interest: The authors have no financial or other conflict of interest to disclose.
Corresponding author:
Suzanne Demers MD MSc
Assistant Professor, Department of Obstetrics and Gynecology, Faculty of Medicine, Université Laval,
2705 boulevard Laurier, Québec, QC, Canada, G1V 4G2; Email: suzanne.demers@crchudequebec.ulaval.ca
RÉSUMÉ
OBJECTIF: Estimer la valeur prédictive de la pression artérielle moyenne (PAM), seule ou en
combinaison avec les caractéristiques maternelles, au premier trimestre de la grossesse pour prédire la prééclampsie et les autres troubles hypertensifs de la grossesse (THG).
MÉTHODES: Étude de cohorte observationnelle prospective de femmes enceintes nullipares
recrutées entre 11 et 13 semaines de gestation. La PAM a été calculé à partir de la pression artérielle mesurée à l’aide d’un appareil automatisé validé pour les femmes enceintes, sur chaque bras simultanément et prenant une série de mesures jusqu’à obtention de la stabilité. Les participantes ont été suivies pour le développement de THG incluant l’hypertension gestationnelle (HG), la prééclampsie (PE), la PE préterme et la PE précoce. Nous avons calculé le multiple de la médiane de la PAM afin d’ajuster pour l’âge gestationnel lors de la mesure. L’aire sous la courbe (AUC) générées des courbes ROC a été utilisée pour estimer la valeur prédictive de la PAM pour les THG. Des régressions logistiques multivariées ont été construites afin de développer un modèle prédictif combinant la PAM et les caractéristiques maternelles.
RÉSULTATS: Nous avons obtenu un suivi complet chez 4700 (99%) des 4779 participantes
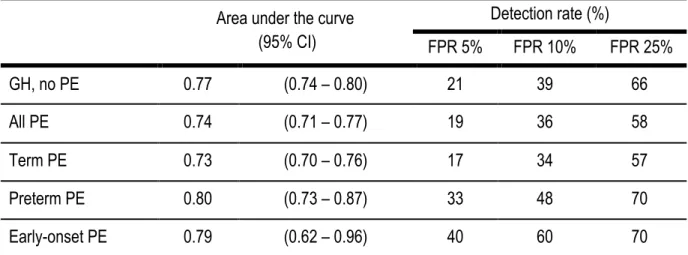
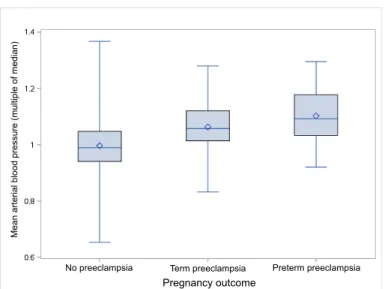
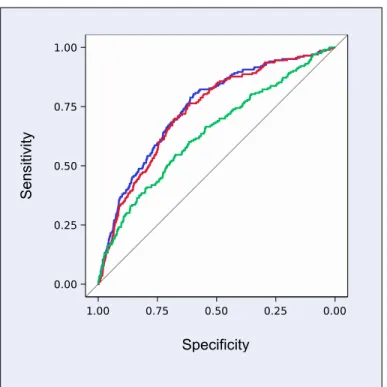
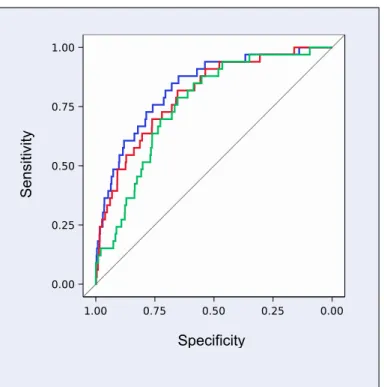
éligibles. Un THG a été observé chez 491 (10.3%) participantes, incluant 250 (5.3%) HG sans PE; 241 (5.1%) PE, incluant 33 (0.7%) PE préterme et 10 (0.2%) PE précoce. La PAM au premier trimestre était associée avec l’HG (AUC: 0.77; 95%CI: 0.74 – 0.80); la PE à terme (0.73; 95%CI: 0.70 – 0.76), la PE préterme (0.80; 95%CI: 0.73 – 0.87) et la PE précoce (0.79; 95%CI: 0.62 – 0.96). À un taux de faux positif de 10%, la PAM au premier trimestre pouvait prédire 39% des HG, 34% des PE à terme, 48% des PE prétermes et 60% des PE précoces. L’addition des caractéristiques maternelles, incluant l’IMC, a amélioré les valeurs prédictives (40%, 37%, 55% et 70%, respectivement).
CONCLUSION: La PAM mesurée entre 11 et 13 semaines de grossesse est un fort prédicteur des
THG chez les femmes nullipares.
Mots clés: Grossesse; prééclampsie; pression artérielle; hypertension; dépistage prénatal; premier