Université de Montréal
Les conséquences des commotions cérébrales sur la variabilité de la fréquence cardiaque durant le développement
par Julien Lépine
Département de Kinésiologie
Mémoire présenté en vue de l’obtention du grade de maîtrise en sciences de l’activité physique
Août 2016
Résumé
Ce projet de recherche avait pour but d’évaluer les conséquences à long terme des commotions cérébrales d’origine sportive (CCOS) subies durant le développement sur la fonction cardio-‐autonomique. Nous avons comparé la variabilité de la fréquence cardiaque (VFC) de joueurs de hockey adolescents avec un historique d’une ou deux CCOS (commotion ; n = 39) à la VFC de joueurs de hockey adolescents n’en ayant jamais subi (contrôle ; n = 52). Les athlètes du groupe commotion ont été testés 26 mois (±20) après leur dernière CCOS. L’électrocardiogramme des participants était mesuré durant, pendant et après un exercice sur ergocycle. La séance d’exercice consistait en un échauffement incrémenté de 6 minutes suivi de 20 minutes entre 60 et 70 % de la fréquence cardiaque maximale et finalement 2 minutes de retour au calme actif. Par la suite, un repos de 10 minutes était complété. Le logarithme naturel de l’écart-‐type des intervalles NN (lnETNN) et le logarithme naturel des basses fréquences (lnBF) étaient tous les deux plus élevés pour le groupe commotion que pour le groupe contrôle dans les trois conditions (repos, exercice et post-‐exercice) (ρ < 0,05). Cette différence était similaire pour toutes les conditions. Ces résultats suggèrent qu’une CCOS affecte la fonction cardio-‐autonomique différemment durant le développement qu’à l’âge adulte, renforçant la nécessité d’interventions post-‐commotion spécifiques durant développement.
Mots-‐clés : Commotion cérébrale d’origine sportive – variabilité de la fréquence cardiaque – développement – système nerveux autonome – exercice – adolescents
Abstract
This research project sought to evaluate long-‐term consequences of sport-‐related concussions (SRC) sustained during development on cardio-‐autonomic function. To do so, we compared the heart rate variability (HRV) of adolescents hockey players with a history of one or two sport-‐related concussion (HOC; n = 39) to the HRV of adolescents hockey players who never incurred a SRC (WHOC; n = 52). Athletes from the HOC group were 26 months (±20) away from their last injury. Participants’ electrocardiogram was measured at rest, during and after an exercise session on ergocycle. The exercise session consisted of a 6 minutes incremental warm-‐up followed by 20 minutes between 60 and 70 % of maximal heart rate and finally a 2 minutes active cooldown. Then, a post-‐ exercise rest of 10 minutes was completed. HRV linear and non-‐linear measures were calculated before, during and after the exercise session. Natural log of standard deviation of NN intervals (lnSDNN) and natural log of low frequencies (lnLF) were both higher for HOC group in the three conditions (rest, exercise, post-‐exercise) (ρ < 0.05). This difference was similar across all conditions. These results suggest that SRC might affect cardio-‐autonomic function differently during development than during adulthood thus reinforcing the need for specific post-‐concussion interventions for the developing population.
Keywords : Sport-‐related concussion – heart rate variability – development – autonomic nervous system – exercise – adolescents
Table des matières
Résumé ... ii
Abstract ... iii
Listes des figures ... vi
Listes des abréviations ... vii
Remerciements ... x
Introduction ... 1
1.1 Introduction générale ... 2
1.2 Définition de la commotion cérébrale ... 6
1.3 Biomécanique d’une CCOS ... 8
1.3.1 Mécanisme de la blessure ... 8
1.3.2 Fragilité accrue des enfants face aux commotions ... 9
1.4 Pathophysiologie de la CCOS ... 10
1.4.1 Perturbation membranaire : excitation excessive et désordre chimique ... 10
1.4.2 Hyperglycolyse et acidose ... 11
1.4.3 Crise énergétique et d’oxygène ... 12
1.4.4 Immunoexcitotoxicité ... 12
1.5 Dommages à long terme ... 13
1.5.1 Plasticité du cerveau ... 13
1.5.2 Plasticité du cerveau chez les enfants et les adolescents ... 14
1.5.3 L’effet de l’âge au moment d’une CCOS subie durant le développement ... 15
1.5.4 La nature des conséquences à long terme ... 15
1.6 La fonction cardio-‐autonomique ... 16
1.6.1 Le système nerveux autonome ... 16
1.6.2 L’interaction entre le système nerveux autonome et le cœur ... 17
1.6.3 Les outils de mesure de l’activité du SNA sur le cœur ... 19
1.7 La variabilité de la fréquence cardiaque ... 20
1.7.2 Histoire de la VFC et applications cliniques ... 20
1.7.3 Temps d’enregistrement pour l’analyse de la VFC ... 21
1.7.4 Prétraitement des données de VFC ... 22
1.7.5 Les mesures de la VFC ... 24
1.7.6 Transformation logarithmique des mesures de la VFC ... 29
1.7.7 Interaction entre la FC et la VFC ... 29
1.7.8 Interaction entre la fréquence respiratoire et la VFC ... 30
1.7.9 La VFC à l’exercice ... 31
1.7.10 La VFC en relation avec l’âge ... 32
1.8 La VFC et les blessures au cerveau ... 34
1.8.1 Les traumatismes crânio-‐cérébraux modérés et sévères ... 34
1.8.2 Les traumatismes crânio-‐cérébraux légers ... 35
1.8.3 Les CCOS ... 36
1.8.4 Plausibilité physiologique des conséquences d’une CCOS sur la fonction cardio-‐ autonomique ... 40
1.9 Objectifs/Hypothèses ... 42
1.9.1 Objectifs ... 42
1.9.2 Hypothèse ... 42
Méthodologie et résultats ... 44
2.1 Article ... 45
Discussion ... 66
3.1 Résultats ... 67
3.1.1 Théories explicatives ... 70
3.1.2 Réaction à l’exercice ... 74
3.1.3 L’effet de la fréquence respiratoire sur la VFC ... 74
3.1.4 Comparaison avec les TCCS ... 76
3.1.5 Signification physiologique des résultats ... 76
3.2 Limites ... 78
3.3 Implications cliniques et perspectives futures ... 79
Conclusion ... 80
Bibliographie ... 82
Annexes ... i
Formulaires de consentement ... ii
Annexe Ib – Formulaire d’information et de consentement (enfants moins de 14 ans) ... ii
Annexe Ib – Formulaire d’information et de consentement (enfant de plus de 14 ans) ... ix
Questionnaire de participation à l’étude ... xvi
Certificat d’éthique ... xix
Listes des figures
Figure 1 – Interaction entre la FC et la VFC
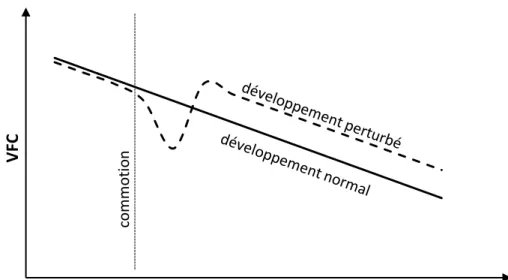
Figure 2a – Surcompensation ou adaptation stratégique Figure 2b – Développement retardé
Listes des abréviations
ARS : arythmie sinusale respiratoire ATP : adénosine triphosphate
BF : basse fréquence en puissance absolue BFnorm : basses fréquences en valeur normalisée BFrel : basses fréquences en valeur relative
BF/HF : basses fréquences en valeur absolue/hautes fréquences en valeur absolue Ca2+ : calcium
CIP : contraction isométrique en préhension CCOS : commotion cérébrale d’origine sportive ECG : électrocardiogramme
EnAp : entropie approximative ETNN : écart-‐type des intervalles NN FC : fréquence cardiaque
FC : moyenne de la fréquence cardiaque pour un segment donné FR : fréquence respiratoire
HF : hautes fréquences en puissance absolue HFnorm : hautes fréquences en valeur normalisée HFrel : hautes fréquences en valeur relative Hz : hertz
K+ : potassium Mg2+ : magnésium Na2+ : sodium
NN : moyenne des intervalles NN pour un segment donné NS : nœud sinusal
PT : puissance totale
RMCDS : racine carrée de la moyenne des carrés des différences entre deux intervalles NN successifs
RPM : rotation par minute
SNA : système nerveux autonome SBR : sensibilité des barorécepteurs SNC : système nerveux central
SNP : système nerveux parasympathique SNS : système nerveux sympathique TBF : très basses fréquences
TCC : traumatisme crânio-‐cérébral
TCCL : Traumatisme crânio-‐cérébral léger TCCM : traumatisme crânio-‐cérébral modéré TCCS : traumatisme crânio-‐cérébral sévère VFC : variabilité de la fréquence cardiaque
À mes parents Sophie et Vincent
Remerciements
La réalisation de ce projet n’aurait pas été possible sans l’importante aide dont j’ai bénéficié.
Merci à Mariève Blais de Hockey Québec et Georges Marien de la ligue Midget AAA pour l’aide avec le recrutement des participants. Merci à tous les jeunes qui ont participé à ce projet.
Merci à tous les étudiants du NeuroDEVlab qui ont d’une façon ou d’une autre contribué au projet. Merci à Alexandra Champagne pour sa contribution au recrutement, à la préparation du protocole, à la collecte de données et l’entrée des résultats dans les bases de données. Merci à Vincent Lamarre pour son aide et surtout sa patience dans l’analyse des électrocardiogrammes. Merci à Gabriel Caron et Milan Adrian pour la collecte de données ainsi que la construction et la vérification des bases de données. Merci à William Archambault, qui a également participé à la collecte de données, Véronik Sicard, William Sauvé, Christophe Alarie et Stéphanie Gravel pour leur écoute, leur support et leurs conseils.
Merci à Miguel Chagnon pour son aide au niveau des statistiques.
Merci à Joseph Patrick Abaji pour m’avoir enseigné les rudiments de la variabilité de la fréquence cardiaque et pour ces conseils techniques.
Merci à Davis Robert Moore pour ses connaissances, son souci des détails et son aide dans la formulation de rationnels scientifiques.
Un remerciement particulier à Dave Ellemberg pour sa patience, son écoute, son jugement, ses précieux conseils et la confiance qu’il a eue en moi tout au long du projet.
1.1 Introduction générale
La commotion cérébrale est une blessure au cœur des préoccupations en matière de santé dans le cadre de la pratique sportive. En effet, on assiste à une médiatisation croissante de ce phénomène et progressivement à une conscientisation des athlètes, entraîneurs et parents. Le nombre de commotions rapportées, la complexité de leur identification et de leur gestion ainsi que leurs conséquences justifient amplement l’attention qui leur est accordée.
Les commotions représentent entre 5 et 9% des blessures sportives (Gessel et al., 2007; Powell & Barber-‐Foss, 1999). Aux États-‐Unis, entre 1,6 et 3,8 millions de commotions cérébrales sont rapportées chaque année (Langlois, Rutland-‐Brown, & Wald, 2006). Ce nombre sous-‐estime fort probablement le nombre réel de commotions subies, car, selon une étude effectuée auprès de joueurs de football de niveau secondaire, dans 50% des cas, les joueurs ne rapportent pas leur commotion (McCrea et al., 2004). Cette proportion énorme de blessures qui passent inaperçues s’explique entre autres par le fait qu’on ne peut observer à l’œil nu la blessure au cerveau subie par l’athlète. Qui plus est, il est possible que l’athlète ne reconnaisse pas les symptômes qu’il ressent comme étant associés à la commotion ou encore que ces entraîneurs ou parents n’investiguent pas adéquatement pour identifier les symptômes de la commotion. En outre, il arrive que l’apparition des symptômes ne se fasse pas au moment de l’incident. De plus, environ deux fois sur trois, l’athlète n’est pas en mesure d’associer les symptômes à un événement précis (Duhaime et al., 2012). Par ailleurs les symptômes peuvent être cachés par un athlète qui veut éviter d’être retiré du jeu. En effet, les signes qui facilitent l’identification d’une commotion ne sont pas toujours présents. La perte de conscience, ne survient que dans 5 à 10% des cas (Guskiewicz, et al., 2000; Meehan, d’Hemecourt, & Comstock, 2010; Schulz et al., 2004) alors que que la perte de mémoire n’est rapportée que dans 24 à 28% des blessures (Guskiewicz et al., 2000; Meehan et al., 2010).
Les conséquences à long terme des CCOS sur le cerveau constituent certainement l’essence de toutes les préoccupations liées aux CCOS. En effet, si les CCOS n’étaient pas à l’origine d’effets persistants sur le cerveau, la gestion des CCOS serait beaucoup moins problématique. D’ailleurs, plusieurs ont longtemps cru que les effets d’une ou de plusieurs CCOS n’étaient en général que transitoires puisque les symptômes d’une commotion disparaissent généralement entre 7 et 10 jours après la blessure (McCrory et al., 2009). Cette idée reçue qu’il n’y a pas d’effets à long terme est également alimentée par le fait que, contrairement à des traumatismes crânio-‐cérébraux plus sévères, aucun dommage structurel n’est apparent à la suite d’une commotion avec les techniques d’imagerie médicales traditionnellement utilisées en médecine pour l’évaluation des dommages cérébraux (Bazarian, Blyth, & Cimpello, 2006), comme la tomodensitométrie cérébrale ou « scanner » cérébral. Or, d’autres méthodes d’imagerie cérébrale plus sensibles aux dommages liés aux commotions ont commencé à être davantage utilisées en recherche dans les dernières années telles que l’électroencéphalographie (EEG) et l’imagerie par résonnance magnétique (IRM), qui permettent de mesurer l’activité électrique du cerveau, ainsi que la tomographie d’émission monophotonique (TEMP), qui permet d’estimer la perfusion de différentes régions du cerveau. Grâce à ces nouvelles technologies, ainsi qu’à un intérêt accru en recherche pour une meilleure connaissance des effets à long terme des commotions, on a assisté dans les dernières années à une augmentation importante du nombre d’études soutenant que les commotions peuvent mener à des déficits persistants sur le cerveau (Bernstein, 2002; Broglio et al., 2009; Ellemberg et al., 2009; Pontifex et al., 2009; Baillargeon et al., 2012; Ellemberg et al., 2007; Gosselin et al., 2012; Moser, Schatz, & Jordan 2005; Kerr et al., 2012; Moore, Sauve, & Ellemberg, 2015).
Par ailleurs, il y a quelques décennies, les chercheurs étaient nombreux à penser que les enfants et adolescents bénéficiaient d’une protection face aux commotions et à leurs conséquences à long terme en raison de la plasticité importante de leur cerveau, c’est-‐ à-‐dire la capacité du cerveau à réorganiser son utilisation en fonction des demandes de
l’environnement. Les chercheurs sont dorénavant plutôt d’avis que les enfants et adolescents sont plus affectés à court (Field et al., 2003; Howell, Osternig, & Chou, 2015) et à long terme (Anderson, Spencer-‐Smith, & Wood, 2011; Choe et al., 2012; Giza & Prins, 2006; Kirkwood, Yeates, & Wilson, 2006; McCrory et al. 2004; Patel, Shivdasani, & Baker, 2005) les commotions que les adultes. Il semblerait que l’importante plasticité du cerveau immature, au lieu de protéger des dommages à long terme, pourrait en être à l’origine puisque le développement neuronal peut être altéré, interféré ou diminué par une commotion (Anderson et al., 2011; Daneshvar et al., 2011; Giza & Prins, 2006; Kirkwood et al., 2006).
En plus d’être peut-‐être plus affectés par les commotions, les enfants, les plus jeunes comme les adolescents, sont plus susceptibles d’en être victimes en raison d’un ratio tête/cou plus élevé, d’une anatomie du cerveau différente ainsi que d’axones qui ne sont pas complètement myélinisés et donc plus fragiles (Buzzini & Guskiewicz, 2006; Daneshvar et al., 2011; Kirkwood et al., 2006). De surcroît, les enfants constituent le groupe d’âge le plus exposé à des situations pouvant mener à une commotion. Au Canada, en comparaison avec les adultes, les jeunes enfants et les adolescents s’adonnent davantage à des activités sportives (Clark, 2008) et participent en plus grande proportion à des sports de contact-‐collision comme le soccer, le hockey sur glace, le football et le basketball (Gouvernement du Canada, 2013), des sports où le risque de subir une commotion est plus élevé (Marar et al., 2012). Aux États-‐Unis, on estime qu’environ 50% des CCOS sont subies entre 0 et 24 ans (Faul et al., 2010).
Les conséquences des commotions chez les enfants sont particulièrement importantes puisque ceux-‐ci sont dans une phase de développement cognitif substantiel et rapide : ils vivent constamment de nouvelles expériences et acquièrent rapidement, à l’école tout comme en dehors du cadre académique, de nouvelles aptitudes (Anderson et al., 2011; Kirkwood et al., 2006; Patel et al., 2005). Une commotion les force à s’absenter des bancs d’école pendant une période suffisante pour les retarder dans leur
apprentissage. De plus, les déficits cognitifs à court terme mais surtout à long terme associés à une commotion ou à l’accumulation de commotions, tels que les difficultés d’apprentissage, de concentration, d’attention et de mémoire, peuvent également ralentir leur développement (Patel et al., 2005). Certaines études suggèrent même que des déficits cognitifs, qui sont absents après avoir récupéré de la commotion, peuvent apparaître tardivement en raison d’un développement anormal, ou ralenti du cerveau (Anderson et al., 2011; Giza & Prins, 2006).
Les enfants constituent donc une population très affectée par les commotions mais aussi différemment affectée par celles-‐ci en raison du fait que leur cerveau est en phase de développement important. Mieux comprendre l’étendue des conséquences à long terme et leurs spécificités chez les enfants est essentiel pour guider la « prise de risque » en lien avec la décision du retour au jeu à la suite d’une commotion. Cette compréhension permet également d’orienter la décision d’arrêter ou non la pratique d’un sport à haut risque de commotion lorsqu’un athlète a déjà accumulé plusieurs commotions cérébrales afin d’éviter qu’il ait des séquelles importantes qui pourraient nuire à sa qualité de vie. De plus, en décortiquant les conséquences des commotions, on peut potentiellement identifier des cibles de traitement de la blessure, des symptômes qui y sont liés et des conséquences qui en découlent.
Quelques études ont observé des déficits persistants à la suite d’une commotion cérébrale au niveau de la fonction cardio-‐autonomique, c’est-‐à-‐dire au niveau du contrôle du rythme cardiaque par le système nerveux autonome. Cependant, aucune de ses études n’a été réalisée chez les enfants et une seule a étudié des sujets dans la phase chronique de la blessure. Dans ce contexte, le présent mémoire a comme objectif d’investiguer les conséquences à long terme des commotions cérébrales sur la fonction cardio-‐autonomique durant le développement.
1.2 Définition de la commotion cérébrale
Avant tout chose, il faut identifier la définition de commotion cérébrale qui sera utilisée dans le présent mémoire. Selon le 4e Consensus de Zurich (McCrory et al., 2013), qui regroupait plusieurs spécialistes des commotions cérébrales, la commotion cérébrale se définit comme étant un processus pathologique affectant le cerveau induit par des forces biomécaniques. Il y est décrit que chaque commotion possède les caractéristiques suivantes :
1-‐ La commotion est causée par un coup directement à la tête, au visage, au cou ou par un coup sur une autre partie du corps qui transmet une force impulsive à la tête ;
2-‐ La commotion résulte typiquement en l’apparition rapide et de courte durée de déficits neurologiques qui se résolvent spontanément. Cependant, dans certains cas, les signes et symptômes peuvent évoluer sur un certain nombre de minutes ou heures ;
3-‐ La commotion peut mener à des changements neuropathologiques, mais les symptômes cliniques aigus sont le reflet d’une perturbation fonctionnelle plutôt que d’une blessure structurale. De fait, aucune anormalité n’est visible dans les études de neuro-‐imagerie structurelle conventionnelle ;
4-‐ La commotion mène à un ensemble gradué de symptômes cliniques et cognitifs qui peut inclure ou non une perte de connaissance. La résorption des symptômes cliniques et cognitifs suit généralement un cours séquentiel.
Une petite précision doit être apportée pour mettre à jour cette définition échafaudée en 2012. En effet, il est important d’ajouter que les symptômes n’apparaissent pas toujours immédiatement après l’incident : dans 20% des cas de commotions, les symptômes n’apparaissent que quelques heures après l’incident (Duhaime et al., 2012).
Le terme commotion cérébrale est souvent utilisé de façon interchangeable avec le terme traumatisme crânio-‐cérébral léger (TCCL), mais ces termes ne sont pas toujours équivalents. Un TCCL est associé à au moins un des critères suivants (Carroll, Cassidy, Holm, Kraus, & Coronado, 2004) : une perte de conscience durant entre 0 et 30 minutes, une amnésie post-‐traumatique de 0 à 24 heures, une fracture du crâne, des lésions intracrâniennes ou des signes neurologiques focaux, c’est-‐à-‐dire un problème neurologique spécifique à une région du cerveau. Il est à noter, pour la perte de conscience et l’amnésie post-‐traumatique, que la valeur « 0 minute » ou « 0 heure », c’est-‐à-‐dire l’absence d’un signe, fait partie de l’intervalle de temps associé à un TCCL. Un TCCL est également associé, 30 minutes après l’incident ou lors de l’examen médical, à un score sur l’échelle de coma de Glasgow entre 13 et 15. La très grande majorité des commotions cérébrales sont des TCCL, puisque la perte de conscience et l’amnésie post-‐ traumatique sont souvent soient absentes ou de très courte durée. Dans de très rares cas, lorsque la perte de conscience dépasse 30 minutes ou que l’amnésie post-‐ traumatique dépasse 24 heures, la commotion est catégorisée comme étant un traumatisme cranîo-‐cérébral modéré. Les TCCL, quant à eux, sont loin d’être toujours des commotions cérébrales. Ce n’est pas le cas, par exemple, lorsqu’une fracture du crâne, une lésion structurelle du cerveau ou un problème neurologique spécifique est présent.
Dans le présent projet, ce sont spécifiquement des commotions cérébrales qui sont l’objet de l’étude. Le terme commotion cérébrale d’origine sportive (CCOS) sera utilisé étant donné que notre projet de recherche se limite aux commotions cérébrales subies dans un contexte sportif, dans le but d’avoir un échantillon de blessures au cerveau plus homogène. D’une part, les mécanismes des blessures subies durant la pratique sportive sont similaires entre eux mais se distinguent des blessures subies à l’extérieur d’un contexte sportif, comme un accident de voiture par exemple. D’autre part, les CCOS sont généralement suivies d’un retour au jeu dans les quelques semaines suivant l’incident, alors que l’athlète, quoi qu’asymptomatique, n’est pas complètement guéri
de sa blessure. Ce retour au jeu complet rapide peut ralentir la récupération du cerveau de l’athlète en plus de l’exposer à des impacts qui, même s’ils n’engendrent pas une CCOS, nuisent à la guérison du cerveau encore fragilisé.
1.3 Biomécanique d’une CCOS
1.3.1 Mécanisme de la blessure
Tel que mentionné plus haut, la CCOS peut succéder à un coup porté directement à la tête ou à un coup au corps qui fait accélérer la tête. En fait, ce n’est pas le coup qui provoque la CCOS, mais plutôt l’accélération importante ou l’arrêt brusque de la tête qui suit le coup. Le cerveau baigne à l’intérieur du crâne dans le liquide céphalo-‐ rachidien (LCR). Le LCR remplit la cavité subarachnoïdienne qui est l’espace entre le cerveau et l’arachnoïde, l’arachnoïde étant la couche la plus profonde du crâne. Lors d’un changement brusque de la vitesse de déplacement de la tête, soit par une accélération ou par une décélération importante, comme le cerveau et le LCR ont une densité différente, leur changement de vitesse pour une même accélération ou une décélération de la tête, est différent (Drew & Drew, 2004). Ce décalage entre la vitesse du cerveau et celle du LCR fait en sorte que le cerveau bouge à l’intérieur de la boîte crânienne.
Le changement de la vitesse de la tête peut se produire à la fois de façon linéaire et angulaire. Une accélération ou décélération linéaire de la tête peut se faire en ligne droite d’avant en arrière (p. ex. le front de l’athlète entre en contact avec un obstacle), de droite à gauche (p. ex. un athlète reçoit un coup au niveau de la tempe) ou de haut en bas (p. ex. l’athlète tombe violemment sur les fesses). Le cerveau, dans son déplacement, entre en contact contre l’une des parois du crâne, contact que l’on appelle le coup, puis rebondit vers la paroi opposée du crâne pour y subir un deuxième
impact appelé le contre-‐coup. Bien que le cerveau frappe les parois du crâne en deux endroits seulement, la CCOS endommage des neurones de l’ensemble du cerveau et non seulement spécifiquement aux sites d’impact. En effet, la compression du cerveau lors des deux impacts et son étirement après avoir rebondit à la suite du premier impact entraînent, dans toutes les régions du cerveau, d’importantes forces de cisaillement et d’étirement exercées sur les neurones, les dendrites, les cellules gliales et surtout les axones (Seifert & Shipman, 2015). L’accélération ou décélération angulaire de la tête, c’est-‐à-‐dire en rotation, peut se faire lorsqu’un coup est porté à la tête loin du centre de masse de la tête. Elle peut aussi se produire si un coup est porté au corps d’un individu en mouvement, par exemple à la poitrine. Cela freine le mouvement du corps et transfert la quantité de mouvement du corps à la tête qui, par conséquent, accélère. Ce changement de vitesse de la tête fait en sorte que le cerveau se tord sur lui-‐même et, tout comme pour une accélération ou décélération linéaire, de grandes forces de cisaillement et d’étirement sont exercées sur les structures du cerveau, particulièrement les axones, un peu partout dans le cerveau (Giza & Hovda, 2014; Pettus et al., 1994).
Bien que les accélérations linéaire et angulaire ont été présentées ici séparément, il faut prendre note que, en pratique, l’accélération ou la décélération qui suit un coup a toujours une composante linéaire et une composante angulaire (Guskiewicz & Mihalik, 2011).
1.3.2 Fragilité accrue des enfants face aux commotions
Pour un coup d’une même force en proportion à la masse corporelle, il semble que les enfants soient plus à risque de subir une CCOS (Buzzini & Guskiewicz, 2006; Daneshvar et al., 2011; Kirkwood et al., 2006). D’abord, leur ratio masse de la tête/masse corporelle est plus grand que chez les adultes ce qui signifie que, par rapport à leur masse corporelle, ils doivent générer plus de force avec les muscles de leur cou pour
maintenir leur tête en place. Qui plus est, les muscles de leur cou sont sous-‐développés et donc moins à même de limiter l’accélération de la tête en se contractant pour dissiper la force d’accélération au reste du corps. D’autres facteurs anatomiques ont été proposés comme contribuant à l’augmentation de la susceptibilité des enfants aux CCOS tels qu’un os crânial plus mince, une cavité subarachnoïdienne plus grande, ainsi qu’un cerveau de plus petit volume (Karlin, 2011). De surcroît, les axones sont plus vulnérables aux forces de cisaillement en raison de leur myélinisation incomplète, la gaine de myéline ayant entre autres un rôle de protection des axones (Cook et al., 2006; Ommaya, Goldsmith, & Thibault, 2009).
1.4 Pathophysiologie de la CCOS
Après l’atteinte biomécanique aux axones et aux neurones, une cascade chimique et métabolique est déclenchée dans le cerveau. Il semble que ce soit principalement cette cascade et le déséquilibre chimique qui s’en suit qui endommage le cerveau (Patterson & Holahan, 2012).
1.4.1 Perturbation membranaire : excitation excessive et désordre chimique
Les forces de cisaillement et d’étirement vont mener à une perturbation de la structure de la membrane axonale et de la membrane cellulaire. Au niveau de l’axone, les éléments du cytosquelette qui lui donnent sa structure, tels que les microtubules, sont désorganisés (Giza & Hovda, 2014). Des pores dans la membrane sont ainsi créées engendrant des déficiences au niveau de la régulation des canaux membranaires. Ceci entraîne la libération de neurotransmetteurs excitateurs (Farkas, Lifshitz, & Povlishock, 2006) ainsi qu’une entrée de calcium (Ca2+) et une sortie de potassium (K+) incontrôlées. L’accumulation de Ca2+ et d’autres protéines endommage encore plus la structure des axones, diminuant leur capacité de transmission électrique et la perméabilité de leur
membrane (Giza & Hovda, 2014). Ultimement, cela mener à une rupture partielle ou une déconnexion complète de l’axone.
De façon similaire, au niveau du neurone, la perturbation de la membrane, permet une entrée de Ca2+ et une sortie massive du potassium K+ (Giza & Hovda, 2014; MacFarlane & Glenn, 2015). Cette sortie de K+ engendre une dépolarisation de la membrane suivie d’une libération très importante d’autres neurotransmetteurs excitateurs, surtout du glutamate, au niveau des terminaisons dendritiques des neurones. Ces neurotransmetteurs, par le biais de récepteurs membranaires, majoritairement les récepteurs N-‐methyl-‐D-‐aspartate, vont ouvrir de façon massive des canaux par lesquels sera accentuée la sortie par gradient de K+ et de magnésium (Mg2+) ainsi que l’entrée de Ca2+ dans les neurones. Cette sortie importante de K+ aura pour effet de dépolariser encore une fois la membrane et libérer davantage de glutamate. Un cycle de dépolarisation est ainsi généré. Cela mène à un état d’excitation excessive et incontrôlée des neurones ainsi qu’à une accumulation importante de Ca2+ à l’intérieur de la cellule et de K+ dans le milieu extracellulaire. De surcroît, cette accumulation est accrue par le fait que, pour conserver une concentration de Ca2+ acceptable dans le cytoplasme, le Ca2+ est tamponné par le mitochondrie des neurones, créant ainsi un effet « d’évier de calcium» qui attire par gradient le Ca2+ des tissus environnants vers l’intérieur et la cellule (MacFarlane & Glenn, 2015). La présence prolongée et excessive de Ca2+ altère le métabolisme de la cellule ce qui endommage des mitochondries et peut potentiellement mener à la mort cellulaire (Giza & Hovda, 2014; MacFarlane & Glenn, 2015).
1.4.2 Hyperglycolyse et acidose
Afin de rétablir l’équilibre ionique, c’est-‐à-‐dire revenir aux concentrations d’ions qui permettent le maintien du potentiel membranaire de base, les neurones doivent produire une grande quantité d’adénosine triphosphate (ATP). Entres autres, les
pompes K+/Na+ nécessitent l’énergie de l’ATP pour faire rentrer le K+ dans la cellule. Cependant, l’utilisation des mitochondries pour produire de l’ATP, est restreinte par le Ca2+ qui y est séquestré (Giza & Hovda, 2014; MacFarlane & Glenn, 2015). Par conséquent, au lieu de produire de l’ATP efficacement grâce à l’oxydation du glucose, qui a lieu dans la mitochondrie, les cellules doivent majoritairement se rallier à la glycolyse anaérobie dans le cytoplasme, une manière de créer de l’ATP très rapide mais beaucoup moins efficace (MacFarlane & Glenn, 2015). De plus, cette hyperglycolyse diminue le pH des neurones, les mettant dans un état transitoire d’acidose qui affecte la perméabilité des membranes et le fonctionnement de la cellule.
1.4.3 Crise énergétique et d’oxygène
L’hyperglycolyse aura pour conséquence une déplétion rapide des réserves de glucose (Giza & Hovda, 2014; MacFarlane & Glenn, 2015). On assiste alors à une crise énergétique. Non seulement les mitochondries sont-‐elles dysfonctionnelles, mais, qui plus est, le débit sanguin au cerveau, en temps normal couplé avec la consommation de glucose par les neurones, est déréglé. L’acheminement du glucose et de l’oxygène aux cellules est donc problématique. La sortie de l’intérieur des cellules du Mg2+, qui participe à la production d’ATP, contribue également à cette crise énergétique. En raison de cette crise énergétique, le déséquilibre ionique (excès de Ca2+ intracellulaire et excès de K+ extracellulaire) perdure ce qui est très dommageable pour la cellule.
1.4.4 Immunoexcitotoxicité
La perturbation de l’homéostasie due à la blessure mécanique des cellules et des axones ainsi qu’à la cascade métabolique active la sécrétion de cytokines par les cellules immunitaires du cerveau, principalement les microglies (Blaylock & Maroon, 2011; Patterson & Holahan, 2012) pour défendre les cellules endommagées et contribuer à leur guérison (Lane et al., 2008). De plus, à la suite de de la rupture de la barrière
sanguine du cerveau (BSC) en raison du déséquilibre chimique qui règne dans le cerveau, d’autres cellules immunitaires en périphérie, des macrophages, parviennent au cerveau. En tout et partout, la réponse immunitaire et inflammatoire, bien qu’elle ait comme but la protection et la guérison des neurones et des axones, est exagérée ce qui engendre des dommages supplémentaires (Das, Mohapatra, & Mohapatra, 2012; Singh et al., 2016).
1.5 Dommages à long terme
1.5.1 Plasticité du cerveau
À la suite d’une CCOS, les dommages aux cellules et aux axones décrits plus haut ne mènent que très peu à la mort cellulaire (MacFarlane & Glenn, 2015). Alors que certaines cellules seront réparées, d’autres resteront à vie moins fonctionnelles. Par ailleurs, pour plusieurs axones, la transmission de l’influx nerveux demeurera moins efficace. Contrairement, à plusieurs autres types de cellules du corps humain, les neurones n’ont pas la capacité de se régénérer, d’être remplacés par de nouvelles cellules, si ce n’est qu’à très petite échelle. Néanmoins, le cerveau est doté d’une certaine réserve de neurones. Lorsque des circuits neuronaux sont endommagés et fonctionnent moins bien ou tout simplement ne fonctionnent plus, d’autres neurones ou circuits neuronaux peuvent être sollicités pour répondre à une même demande du cerveau (Bigler, 2008; Keightley, Chen, & Ptito, 2012). On appelle cette réorganisation des ressources neuronales la plasticité cérébrale. Certains prétendent que cette plasticité est également associée à la création de nouveaux liens, de nouveaux synapses entre les neurones pour acheminer le message électrique par de nouveaux chemins (Giza & Prins, 2006; Kolb & Gibb, 2014). Quel que soit son mécanisme exact, la plasticité permet au cerveau de partiellement compenser les dommages neuronaux et axonaux qui découlent d’une CCOS, mais certaines altérations plus subtiles persistent (Ellemberg et al., 2009). Lorsqu’un individu accumule plusieurs CCOS, la réserve de neurones
diminue et il devient de plus en plus difficile de compenser pour ces altérations au cerveau.
1.5.2 Plasticité du cerveau chez les enfants et les adolescents
Bien qu’un enfant ou un adolescent, de par son cerveau en développement, soit probablement pourvu d’une plasticité supérieure à celle d’un adulte, cela ne confère pas au cerveau immature une protection face aux commotions. Bien au contraire, les enfants et adolescents semblent davantage affectés (Anderson et al., 2011; Baillargeon et al., 2012; Choe et al., 2012; Giza & Prins, 2006). Field et al. (2003) suggèrent que les symptômes et les déficits cognitifs persistent plus longtemps après une commotion chez les adolescents que chez de jeunes adultes. De plus, Howell et al. (2015) ont observé, que les adolescents présentaient des problèmes d’équilibre à la marche lors d’une tâche double plus importants que les adultes dans les jours et semaines suivant la CCOS. De surcroît, une commotion durant le développement affecte probablement négativement la plasticité du cerveau immature ce qui nuit considérablement à son développement (Anderson et al., 2011; Choe et al., 2012; McCrory et al., 2009; Patel et al., 2005). Giza et Prins (2006) suggèrent, d’une part, que la plasticité dite « positive » est diminuée puisque le développement normal des circuits neuronaux avec l’âge est ralenti. D’autre part, comme certaines connexions normales sont perturbées à la suite d’une CCOS il est possible que, en réponse à un stimulus donné, des liens anormaux et dysfonctionnels soient créés, interférant avec le développement cognitif normal (Giza & Prins, 2006). Autrement dit, la blessure engendre une plasticité dite « négative ». En suivant cette logique on peut s’imaginer qu’il est possible que des déficits qui n’étaient pas présents dans la phase aigüe de la CCOS se manifestent dans les années suivantes en raison d’un développement anormal ou ralenti du cerveau (Anderson et al., 2011; Giza & Prins, 2006; Kirkwood et al., 2006).
1.5.3 L’effet de l’âge au moment d’une CCOS subie durant le développement
Une seule étude a comparé les conséquences à long terme des commotions chez différents groupes d’âge. Selon cette étude de Baillargeon et al. (2012), les CCOS affecteraient davantage les adolescents que les jeunes enfants et les adultes. Baillargeon et al. expliquent ces résultats par le fait que, durant l’adolescence, le lobe frontal du cerveau, une région généralement très touchée par les commotions (Witt, Lovejoy, Pearlson, & Stevens, 2010), est en croissance rapide avec le développement final de la mémoire de travail ainsi que d’autres fonctions exécutives (Luna, Padmanabhan, & O’Hearn, 2010). Cependant, d’autres études comparant les effets des commotions à long terme pour différents groupes d’âge sont nécessaires pour supporter cette hypothèse de fragilité accrue à l’adolescence.
1.5.4 La nature des conséquences à long terme
Comme indiqué plus tôt, la plasticité permettrait de compenser pour la plupart des dommages neuronaux, mais certains déficits subtils persistent même après une seule CCOS. Un nombre croissant d’études appuient l’idée selon laquelle les CCOS auraient des conséquences non seulement à court terme, mais aussi à long terme (Bernstein, 2002; Broglio et al., 2009; Ellemberg et al., 2009; Pontifex et al., 2009; Baillargeon et al., 2012; Ellemberg et al., 2007; Gosselin et al., 2012; Moser, Schatz, & Jordan, 2005; Kerr et al., 2012; Moore, Sauve, & Ellemberg, 2015). Les études sur les effets à long terme des CCOS se sont jusqu’à présent principalement intéressées aux conséquences des CCOS sur le cerveau lui-‐même. Ces études ont évalué les conséquences sur le fonctionnement du cerveau (Bernstein, 2002; Broglio et al., 2009; Ellemberg et al., 2009; Pontifex et al., 2009), son métabolisme (Henry et al., 2011) les fonctions cognitives (Baillargeon et al., 2012; Ellemberg et al., 2007; Gosselin et al., 2012; Moser, Schatz, & Jordan, 2005), l’état psycho-‐affectif (Kerr et al., 2012; Moore, Sauve, & Ellemberg, 2015) et la perception auditive (Turgeon et al., 2011). Cependant, peu d’études ont exploré les effets à long terme sur le fonctionnement d’autres organes du corps contrôlés par le
cerveau. Trois études ont observé les possibles conséquences des CCOS sur le contrôle de la fréquence cardiaque par le système nerveux autonome (Abaji et al., 2015; Gall, Parkhouse, & Goodman, 2004; La Fountaine, Heffernan, Gossett, Bauman, & De Meersman, 2009). Cependant, aucune d’entre elles n’était chez les enfants et une seule a testé les athlètes dans la phase chronique de la blessure (Abaji et al., 2015).
1.6 La fonction cardio-‐autonomique
1.6.1 Le système nerveux autonome
Le cerveau et la moelle épinière composent le système nerveux central (SNC). Le SNC est la partie du système nerveux qui intègre les informations provenant de tous les tissus du corps, les afférences, puis envoie des informations vers les tissus pour agir sur eux, les efférences. Il communique avec les tissus par l’entremise des nerfs du système nerveux périphérique (Brodal, 2004).
Le système nerveux autonome (SNA) est la partie du système nerveux qui régule tous les tissus du corps, sauf les muscles squelettiques, et reçoit des messages de ceux-‐ci. Par opposition, le système nerveux somatique perçoit les stimuli externes et contrôle la contraction volontaire des muscles squelettiques. Tout comme pour le système nerveux somatique, le SNA, est constitué en périphérie de nerfs et de ganglions, des amas de nerfs qui servent de centres de relais pour les efférences. Le SNA a son centre de traitement des afférences et de production des efférences dans le SNC. Le SNA a le rôle vital de veiller au maintien de l’homéostasie du corps humain par la régulation des fonctions cardiovasculaire, respiratoire, gastro-‐intestinale, métabolique, thermorégulatrice, endocrinienne, urinaire et reproductive pour ne nommer que celles-‐ ci (Jänig, 2008).
On divise le SNA en deux branches : le système nerveux sympathique (SNS) et le système nerveux parasympathique (SNP) (Hilz, 2013). Il est généralement convenu que le SNP est davantage activé au repos et durant la digestion (augmentation de la motilité intestinale et de la salivation, diminution de la tension musculaire, de la transpiration, de la respiration, de la fréquence cardiaque, de la pression artérielle et de la production surrénalienne). En contrepartie, le SNS est plus sollicité lors d’une situation d’urgence, lorsque le corps se met en mode « combat ou fuite » ou encore lors d’un effort physique (diminution de la motilité intestinale et de la salivation, augmentation de la tension musculaire, de la transpiration, le la respiration, de la fréquence cardiaque, de la pression artérielle et de la production surrénalienne). L’action du SNS est appelée activité sympathique et l’action du SNP, l’activité vagale en raison du nerf vagal utilisé par le SNP. Néanmoins, il est bien important de comprendre que, bien que l’action du SNP et celle du SNS soient souvent opposées, les deux systèmes agissent continuellement ensemble sur le corps. Un système n’arrête pas de fonctionner pendant que l’autre agi. Ils agissent plutôt de manière complémentaire et parallèle pour maintenir l’homéostasie du corps, c’est-‐à-‐dire l’équilibre des fonctions physiologiques du corps dans un contexte donné. L’activité de base du SNS est appelée tonus sympathique et celle du SNS, tonus parasympathique. C’est donc une modulation des tonus sympathique et parasympathique qui va permettre de faire les ajustements physiologiques nécessaires et non une activation ou une inhibition complète du SNP ou du SNS (Heathers, 2014).
Bien que les fonctions du SNA soient très nombreuses, seule l’interaction entre le SNA et le cœur sera détaillée étant donné que le présent projet porte spécifiquement sur cette partie de l’activité autonomique en lien avec les CCOS.
1.6.2 L’interaction entre le système nerveux autonome et le cœur
La contraction successive et automatique des différentes parties du cœur pour produire un battement cardiaque implique différents tissus cardiaques qui ont des propriétés