Mycophagie des micromammifères et diversité
fongique hypogée en forêt boréale de l’Est du Canada
Thèse
Véronique Cloutier
Doctorat en Sciences Forestières
Philosophiae Doctor (Ph. D.)
Mycophagie des micromammifères et diversité
fongique hypogée en forêt boréale de l’Est du Canada
Thèse
Véronique Cloutier
Sous la direction de :
André Desrochers, directeur de recherche
Yves Piché, codirecteur de recherche
RÉSUMÉ
Cette thèse examine la consommation de champignons hypogés par les micromammifères dans la forêt boréale de l’Est du Canada, dans le but de mieux comprendre la diversité et l’habitat de ces organismes. Le premier chapitre dresse un portrait de la diversité des champignons hypogés potentiellement consommés par les micromammifères, à partir d’échantillons fongiques provenant du raclage du sol. Ces échantillons ont été identifiés grâce à des caractères morphologiques macroscopiques, microscopiques et moléculaires obtenus par séquençage Sanger de l’espaceur transcrit interne du ribosome nucléaire (ITS - le « code à barres » fongique). De plus, cette thèse présente un metabarcoding de l’ADN fongique retrouvé dans les fèces de micromammifères mycophages grâce à la technologie de pyroséquençage 454 FLX+. L’identification des micromammifères ayant produit ces fèces a été obtenue en utilisant la technologie de séquençage Sanger sur une section du cytochrome b de l’ADN animal. La présence de 28 espèces de champignons hypogés fut confirmée. Ces espèces provenaient des phyla Ascomycotina, Basidiomycotina et Zygomycotina, incluant onze nouvelles mentions pour cette région. Dans le deuxième chapitre, la répartition spatiale des champignons hypogés, tirée de l’ADN de 230 échantillons fécaux de micromammifères, a été mise en relation avec des caractéristiques des peuplements forestiers. Douze espèces hypogées ont été identifiées dans cet ADN, incluant quatre espèces assez fréquentes pour permettre une analyse des facteurs de répartition. Deux de ces espèces, Chamonixia caespitosa et Cortinarius pinguis, étaient associées principalement à la présence de bryophytes. Une autre, Hydnotrya cubispora, était associée à une faible quantité de débris ligneux au sol et à une faible présence d’essences d’arbres à feuilles caduques. Une dernière espèce, Endogone sp.1, n’était associée à aucune de ces caractéristiques. Sur la base de 596 échantillons fécaux prélevés en 2011 et 2012, le troisième chapitre présente les espèces de micromammifères mycophages, examinant la proportion d’individus ayant consommé au moins un champignon hypogé et les espèces fongiques retrouvées dans l’alimentation de chacune des espèces animales étudiées. Cette troisième partie de l’étude a été réalisée dans 131 différents sites qui furent échantillonnés dans cinq régions de la forêt boréale de l’Est du Canada, constituées principalement sapinière à bouleaux blancs. Les données furent extraites de neuf espèces de micromammifères avec une proportion de mycophagie variant entre 0% et 81%. Un total de 27 champignons hypogés furent identifiés dans les échantillons fécaux. Nos résultats concordent avec la
littérature et révèlent de nouvelles informations relativement à la mycophagie animale dans l’Est du Canada telles que la consommation de Barssia sp., Leucangium carthusianum, Alpova cf. diplophloeus, Chamonixia caespitosa et Cortinarius pinguis par le campagnol à dos roux de Gapper (Myodes Gapperi); la consommation d’Hydnotrya spp. par la grande musaraigne (Blarina brevicauda); de Chamonixia caespitosa et de Cortinarius pinguis par la souris sylvestre (Peromyscus maniculatus) et d’Endogone sp. par l’écureuil roux (Tamiasciurus hudsonicus).
ABSTRACT
This thesis examines the consumption of hypogeous, sequestrate fungi by micro-mammals in the eastern Canadian boreal forest, in order to gain a better understanding of the diversity and habitat of these fungi. The first chapter surveys hypogeous, sequestrate fungi potentially available for consumption by micromammals, based on samples obtained from ground-scraping. We identified these samples using morphological and cellular criteria, as well as molecular criteria based on Sanger sequencing of the nuclear ribosomal internal transcribed spacer (ITS - fungal barcode). Additionally, this thesis presents fungal metabarcoding of feces obtained from mycophagous micromammals using 454 FLX+ technology. We identified micromammals with Sanger sequencing over a section of cytochrome b of the animals’ DNA. We confirmed the occurrence of 28 species of hypogeous, sequestrate fungi. Those species came from phyla Ascomycotina, Basidiomycotina and Zygomycotina, including eleven new species records for the area. In the second chapter, we examinated the spatial distribution of hypogeous, sequestrate fungi from 230 fecal samples in relation to forest stand characteristics. This subsample yielded twelve hypogeous, sequestrate species, four of them occurring frequently enough for their distribution to be analyzed. Two of these species, Chamonixia caespitosa and Cortinarius pinguis, were associated mostly with the occurrence of bryophytes. Another species, Hydnotrya cubispora, was negatively associated with two characteristics: coarse woody debris and deciduous trees. Endogone sp. 1 was not associated with any specific characteristic. Based on 596 fecal samples collected in 2011 and 2012, Chapter 3 documents which micromammal species are mycophagous, their proportion of mycophagy, and finally which hypogeous, sequestrate fungal species occur in diet of each animal species. This third chapter was based on 131 sites sampled in five regions of eastern Canadian boreal forest mostly consisting of balsam fir and white birch. From the nine micromammals species, the mycophagous extent ranged from 0% to 81%. A total of 27 hypogeous, sequestrate fungi were identified in the fecal samples. Our results are consistent with the current literature and significantly broadens the documented range of fungal species consumed by micromammals of eastern Canada, such as Barssia sp., Leucangium carthusianum, Alpova cf. diplophloeus, Chamonixia caespitosa and Cortinarius pinguis by the red-backed vole (Myodes gapperi); Hydnotrya spp. by the great shrew (Blarina brevicauda); Chamonixia caespitosa and
Cortinarius pinguis by the Scots mouse (Peromyscus maniculatus); and Endogone sp. by the red squirrel (Tamiasciurus hudsonicus).
TABLE DES MATIÈRES
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste de tableaux ... ix
Liste des figures ... x
Liste des abréviations, des acronymes et des sigles ... xi
Remerciements ... xii
Avant-propos... xvi
Introduction générale ... 1
1 Diversity of hypogeous sequestrate fungi in the eastern Canadian boreal forest ... 17
1.1 Abstract ... 18
1.2 Résumé ... 18
1.3 Introduction ... 19
1.4 Material and Methods... 20
1.4.1 Study areas ... 20
1.4.2 Identification of animal species ... 22
1.4.3 Fecal DNA extraction, amplification and sequencing ... 22
1.4.4 Data processing ... 23
1.4.5 mOTUs identification ... 24
1.4.6 Phylogenetic trees ... 25
1.5 Results ... 26
1.5.1 Fungal fructifications ... 26
1.5.2 Fungal DNA in micromammals feces ... 29
1.6 Discussion ... 31 1.7 Acknowledgements ... 34 1.8 Figure legends ... 35 1.9 Tables ... 37 1.10 References ... 45 1.11 Supplementary Material ... 50
1.12 Informations supplémentaires au chapitre 1 ... 56
2.1 Abstract ... 64
2.2 Résumé ... 64
2.3 Introduction ... 66
2.4 Material and Methods... 67
2.4.1 Study area ... 67 2.4.2 Identification of fungi ... 67 2.4.3 Data analysis ... 68 2.5 Results ... 68 2.6 Discussion ... 70 2.7 Acknowledgements ... 72 2.8 Tables ... 73 2.9 Figures ... 74
2.10 Informations supplémentaires au chapitre 2 ... 75
2.11 Références ... 76
3 Animal mycophagy in the eastern Canadian boreal forest ... 81
3.1 Abstract ... 82
3.2 Résumé ... 83
3.3 Introduction ... 84
3.4 Material and Methods... 85
3.4.1 Study area and field protocols ... 85
3.4.2 Identification of animal species from feces ... 86
3.4.3 Fungal identification ... 86 3.5 Results ... 87 3.6 Discussion ... 88 3.7 Acknowledgements ... 90 3.8 Tables ... 91 3.9 Figures ... 93 3.10 References ... 94 Conclusion générale... 97 Références ... 104
LISTE DE TABLEAUX
Hypogeous, sequestrate fungal species collected by scratching ... 37
List of 44 hypogeous macrofungi’s species confirmed as present in the province of Québec ... 38
Hypogeous, sequestrate fungal taxa identified from fungal DNA present in the 593 fecal pellets from micromammals. ... 42
Occurrence of hypogeous, sequestrate fungal species found in micromammal feces across 45 stations. ... 73
Animal species contributing to the fungal data among 230 fecal pellets. ... 73
Identification, localization, count and sampling period of analyzed micromammals ... 91
Count of fecal samples in which each species of fungi was extracted. ... 92 Liste des Tableaux – traduction française
Liste des 44 champignons hypogés macroscopiques confirmés comme présents au Québec. Champignons hypogés, séquestrés obtenus par raclage du sol manuel.
Champignons hypogés, séquestrés identifiés par l’ADN fongique présent au sein de 593 fèces de micromammifères. Occurrence de champignon hypogés, séquestrés au sein de fèces de micromammifères provenant de 45 stations. Espèces animales contribuant aux données fongiques provenant de 230 fèces.
Identification, localisation compte et période d’échantillonnage des micrommamifères analysés. Compte des fèces desquels les espèces fongiques ont été extraites.
LISTE DES FIGURES
Évolution de la morphologie des champignons hypogés basidiomycètes. ... 5
Évolution de la morphologie des champignons hypogés ascomycètes. ... 6
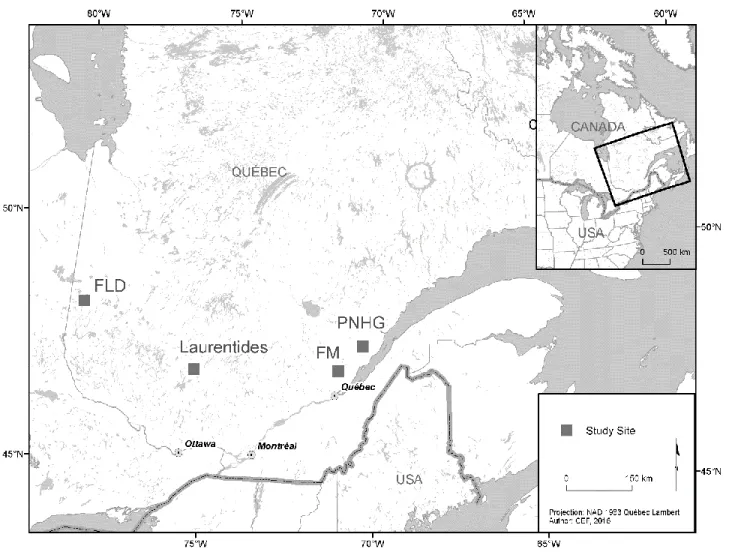
Four eastern Canadian boreal forest regions sampled in this study ... 35
Hypogeous fungi found by scratching, bar = 1cm. ... 36
Identification of the mOTUs ... 50
Molecular Phylogenetic analysis by Maximum Likelihood method of inventoried hypogeous, sequestrate fungi DNA not resolved to species ... 55
Les différentes zones d’échantillonnage en forêt boréale de l'Est du Canada ... 56
Sites de captures vivantes de grands polatouches (Glaucomys sabrinus) dans la région administrative de l’Abitibi-Témiscamingue et de la Forêt du Lac Duparquet ... 57
Sites de captures mortelles accidentelles de grands polatouches (Glaucomys sabrinus) dans trois zones d'exploitation contrôlée (ZEC) dans la région administrative des Laurentides ... 58
Sites d’échantillonnage sans capture sur plaque de nourrissage de fèces de plusieurs micromammifères dans la région administrative de Québec, à la Forêt Montmorency ... 59
Sites d’échantillonnage sans capture sur plaque de nourrissage de fèces de plusieurs micromammifères dans la région administrative de Charlevoix au Parc national des Hautes-Gorges-de-la-Rivière-Malbaie ... 60
Courbes d’accumulation d’espèces ... 62
Influence of the forest stand characteristics on the occurrence of fungal species. ... 74
Five eastern Canadian Boreal Forest regions sampled in this study ... 93 Liste des Figures – traduction française
[…] Quatre régions de l’Est de la forêt boréale Canadienne échantillonnés lors de cette étude. Champignons hypogés, séquestrés obtenus par raclage du sol manuel.
Identification des mOTUs.
Analyse phylogénétique moléculaire par la méthode de maximum de ressemblance des champignons hypogés, séquestrés dont l’ADN n’a pas permis l’identification à l’espèce.
[…] Influence des caractéristiques des peuplements forestiers sur l’occurrence des espèces fongiques. Cinq régions de la forêt boréale Canadienne échantillonnés lors de cette étude.
LISTE DES ABRÉVIATIONS, DES ACRONYMES ET DES SIGLES
ADN : Acide désoxyribonucléique
CRSNG : Conseil de recherches en sciences naturelles et en génie du Canada FRQNT : Fonds de Recherche du Québec - Nature et Technologies
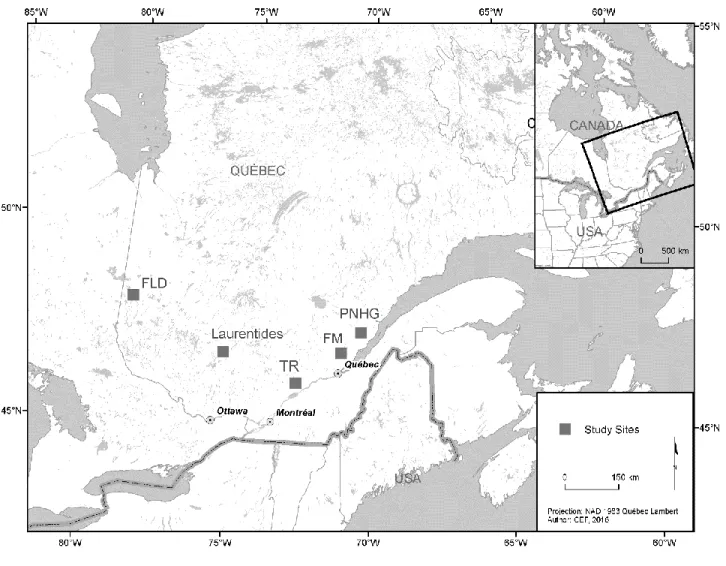
FLD : Forêt du Lac Duparquet
FM : Forêt Montmorency
ITS : Espaceur interne transcrit (Internal Transcribed Spacer)
LA : Laurentides
PNHG : Parc national des Hautes-Gorges-de-la-Rivière-Malbaie RDA : Analyse de redondance (Redundancy analisis)
SEG : Il s’agit du nom complet du permis octroyé par le Ministère des Forêts, de la Faune et des Parcs (provincial) permettant la capture des animaux sauvages à des fins scientifiques, éducatives ou de gestion de la faune. SEPAQ : Société des établissements de plein air du Québec
UQTR : Université du Québec à Trois-Rivières
REMERCIEMENTS
La réalisation et l’achèvement d’un doctorat est un travail d’équipe. J’aimerais d’abord remercier les organismes financiers qui ont supporté mes travaux. Ce projet s’insère dans le programme projet de recherche en équipe Consommation de champignons par les mammifères forestiers : patrons et mécanismes financé par le FRQNT. Des bourses d’études supérieures ont aussi permis la réalisation de ce travail, celles-ci ont été octroyées par leCRSNG, le FRQNT, le Fonds écologique Anne Vallée, le Cercle des
Mycologues de Montréal, la Fondation canadienne de la faune et le Conseil de l’industrie forestière du Québec. Sans oublier Ressources Naturelles Canada et Parcs Québec pour avoir financé directement une
partie des recherches. Aussi, je remercie le Centre d’étude de la forêt (CEF) qui a contribué financièrement à ma formation à l’Oregon State University, USA et à ma participation à la 8e conférence internationale sur les mycorhizes (8th International Conference on Mycorrhiza) en Arizona, USA. Je les remercie aussi de leur support dans plusieurs aspects logistiques essentiels au projet et à la publication. Finalement, Carole Puma, Marie-Ève Dextrase, Julie Decouttere et Denis Garand de l'équipe de Best in Genomics de m’avoir enseigné à produire une demande de subvention de recherche et pour m’avoir permis de présenter à trois reprises à Toronto; sans vous, ce projet n’aurait pas reçu tout le financement dont il a bénéficié.
Je tiens évidemment à remercier mon directeur de recherche, André Desrochers d’avoir accepté d’entrer dans un nouveau domaine, la mycophagie animale, de m’y avoir accompagnée et guidée, particulièrement concernant le dispositif expérimental, la méthode scientifique, la zoologie et les statistiques. J’adresse aussi de francs remerciements à mon codirecteur Yves Piché, aussi d’avoir accepté de travailler sur la mycophagie animale, de m’y avoir accompagnée et guidée, particulièrement concernant la mycologie, les dispositifs et techniques de laboratoire, la résolution de problèmes et la gestion des relations de travail. Merci pour toutes les fois où j’ai été bloquée et où vous m’avez fait progresser, au-delà de l’aspect scientifique, je ressors de cette aventure grandie grâce à vous. Je tiens aussi à remercier Jean Bérubé de m’avoir hébergée dans son laboratoire de recherche sur la gestion des ravageurs forestiers du Centre de foresterie des Laurentides de
Ressources naturelles Canada, ainsi que de m’avoir offert du support technique et matériel pendant toute la
phase de traitement en laboratoire de ce projet. Finalement, je tiens à remercier un homme d’exception J. André Fortin, un mentor d’une grande valeur. Si on ne peut avoir d’ambition intellectuelle qu’en grimpant sur les épaules de géants, il est un de ceux-ci. Merci de m’avoir transmis l’étincelle et la passion du règne fongique. Merci d’avoir cru en moi, d’avoir vu du potentiel dans mon projet, d’avoir mis en place tous les
éléments nécessaires à sa réalisation, d’avoir fait tomber les obstacles à sa mise en œuvre, de m’avoir mis en contact avec plusieurs chercheurs passionnants, d’avoir été là du début du projet jusqu’à la fin, d’avoir lu en moi dans les moments les plus difficiles, de m’avoir soutenue et d’avoir partagé avec moi le savoir, le savoir-faire et le savoir-être que j’ai pu assimiler. Plusieurs personnes ont contribué à ce projet, parfois énormément mais, sans vous, il n’aurait tout simplement jamais existé et je vous en suis profondément reconnaissante. Je tiens aussi à remercier mon autre mentor, Hélène Glémet de l’Université du Québec à Trois-Rivières (UQTR) de m'avoir initiée aux sciences en 2008 et d’être, depuis ce temps, une confidente aux conseils à la valeur inestimable me permettant de progresser dans ce milieu.
Gravitant autour du laboratoire d’André Desrochers et/ou du pavillon Abitibi-Price de l’Université Laval, j’aimerais remercier Mathieu Paradis qui poursuit des recherches sur la mycophagie.
Gravitant autour du laboratoire d’Yves Piché et/ou du pavillon Charles-Eugène-Marchand de l’Université
Laval, j’aimerais remercier Julien Ponchart, André Gagné, Aida Azaiez, Marie-Ève Beaulieu, Laurent
Fontaine, Jessika Pickford, Jean-Guy Catford, Christine Juge, François Belzile, Suzanne Marchand, Louis Bernier, Serge Sokolski, Mario Boutin, Alain Goulet et Richard Janvier.
Gravitant autour du laboratoire de Jean Bérubé et/ou du Centre de foresterie des Laurentides de Ressources
naturelles Canada, j’aimerais remercier Julie Dubé, Marie Lagacé, Guillaume Nicolas, Krystyna
Klimaszewska et Catherine Overton.
Évoluant autour du Parc national des Hautes-Gorges-de-la-Rivière-Malbaie, je veux remercier Miriane Tremblay, à l’époque responsable du Service de la conservation et de l’éducation, d’avoir cru en mes capacités, m'avoir permis de m'associer à la SEPAQ et pour les ressources apportées au projet; Benoit Dubeau, responsable du Service de la conservation et de l’éducation pour la continuité et le suivi du projet et pour les ressources apportées; Ève Murray, technicienne en milieu naturel de l'intérêt porté aux résultats et au suivi du projet. J’aimerais aussi remercier Miriane Demers-Lemay, Julie Michaud, Jimmy Paradis et Chloé Gosselin : l’équipe de terrain, merci de votre minutie et votre persévérance ainsi qu'à Miriane de m'avoir accueillie chez vous pendant les travaux.
Je tiens à remercier tout le personnel de la Forêt Montmorency. Merci pour toutes les fois où vous m'avez dépannée ! J'ai souvent dû dévier des procédures habituelles et je suis reconnaissante de votre flexibilité qui m'a permis de mener mon projet à terme. Merci aussi à toute l’équipe de terrain : Guylaine Guillemette, Patricia Bolduc, Marcel Cloutier, Johanne Brouillette, Guillaume Rheault, Marie-Audrey Nadeau Fortin, Vincent Lamarre, Denis Marcotte, Annie Desmarteau, Marc-André Desmarteau, Johannie Labillois, Gisèle Cloutier, André Théroux, Guillaume Giroux, Annie Guillemette, Rémi Bureau, Jean Bérubé, Élisabeth Garin, Agathe Bérubé, Jérôme Quirion, Francesca Marzitelli et Domenico Marzitelli de votre entrain, votre persévérance, votre professionnalisme... pour toutes ces fois sous la pluie et la fameuse journée sous la grêle ! J’ai aussi eu la chance d’avoir accès à des passionnés du Cercle des mycologues amateurs de Québec : Jean-Paul Blais, Claudine Boudreau, Robert Charpentier, J. André Fortin, Harold Gaboury, Jean-Jean-Paul Lussiaà-Berdou, Fernand Therrien, Lyane Tremblay, Martin Trépanier et Bertrand Pardoen, votre travail a été fort précieux et surtout l'apport de vos connaissances et de votre savoir-faire.
Gravitant autour du Ministère des Forêts, de la Faune et des Parcs, j’aimerais remercier Pierre Blanchette et Jean-Claude Bourgeois de la formation et les conseils relativement à la prise de données sur le terrain et à la base de données s'ensuivant. Aussi Nathalie Desrosiers, Gilles Lupien, Michel Hénault et les trappeurs gestionnaires : Philippe Lévesques, A.J. Milles et Aurèle Ouellette pour le don de micromammifères. Pour la même raison, j’aimerais remercier Marie-Line Dutil et Bertrand Le Grand du Cégep de Sainte-Foy, France Barrette du Centre de formation professionnelle Mont-Laurier ainsi que Pauline Priol et Louis Imbeau de l'Université du Québec en Abitibi-Témiscamingue. Steeve Côté et Sonia de Bellefeuille de l'Université Laval pour les échantillons de cerfs de Virginie. Claude Isabel et son équipe du Parc national de la Gaspésie pour les échantillons de caribous. Tous les échantillons n’ont pas servi à mon projet parce qu’il était devenu trop grand mais j’apprécie énormément le geste, soyez assurés qu’ils ont été transmis à une nouvelle étudiante qui poursuit des travaux sur la mycophagie. Je la remercie ici, Myriam Cadotte du laboratoire de Steeve Côté. De l’Oregon, j’aimerais remercier James Trappe, Michael Castellano et Matt Trappe de l'Oregon State
University, ainsi que Efren Cázares de Mycoroots et Mme Heinz de m'avoir accueilli en Oregon et de la
Je tiens aussi à remercier plusieurs intervenants provenant de différents milieux : Marcel Cloutier, Guylaine Guillemette et Patricia Bolduc de l’amélioration du protocole de terrain, Patrick Gagné du travail de laboratoire et en bio-informatique, Marc-André Gignac du travail en informatique et en bio-informatique, Annie Desmarteau de l’infographie en préimpression, Philippe Massicotte de l’Aarhus University et Louis Houde de l’UQTR de l'aide et des conseils relativement aux statistiques, Jérôme Quirion, de la compagnie
Les jardins de pommes, des sorties aux hypogés, du partage des connaissances et des conversations
stimulantes, Serge Audet des idées d'optimisation du processus d'identification des séquences d'ADN, Gregory Bonito de la Duke University de m’avoir transmis les informations clés sur le séquençage et le traitement de données, Sandra Cloutier, Patricia Corriveau de Transmorphosis Traductions et Jessika Pickford de Traduction Catalytik de la révision anglophone, Anne Pringle de l'Université Harvard ainsi que toute son équipe de laboratoire de vos précieux conseils. Rosanne Healy de l'Université Harvard et Erik Hobbie de l'Université du New-Hampshire de la transmission de vos connaissances. Ainsi que Jacques Laliberté du
Séminaire de Québec de l'autorisation d'accès à votre territoire entre mes deux terrains d'échantillonnage.
Finalement je tiens à remercier ma famille et mes ami(e)s de leur soutien constant dans cette période d’activité intense. Spécialement mon conjoint Denis Marcotte avec qui je partage une profonde complicité depuis près de 20 ans et qui m’a appuyé dans chaque étape du projet, autant les plus excitantes que les plus laborieuses; mes parents Marcel Cloutier et Johanne Brouillette d’avoir contribué concrètement au projet et d’avoir encouragé mes rêves les plus fous, je suis heureuse aujourd’hui grâce à tous vos sacrifices. Je remercie aussi mon frère, Sébastien Cloutier, de m’avoir donné l’exemple et ouvert la voie vers des études supérieures.
AVANT-PROPOS
État de publication des articles
Aucun article n’a été déposé actuellement.
Modifications entre l’article inséré et l’article publié
Aucune modification n’a été effectuée pour l’instant, les articles n’ayant pas été déposés.
Coauteurs de chaque article
Article 1 (chapitre 1) : Véronique B. Cloutier1, Yves Piché1, J. André Fortin1, Jean Bérubé2, Julien
P. Ponchart1 and André Desrochers1
Article 2 (chapitre 2) : Véronique B. Cloutier1, Yves Piché1, J. André Fortin1, Jean Bérubé2, and André
Desrochers1
Article 3 (chapitre 3) : Véronique B. Cloutier1, Yves Piché1, J. André Fortin1, Jean Bérubé2, and André
Desrochers1
1 Centre d’étude de la forêt, Université Laval., Québec, Canada, G1V 0A6 2 Centre de foresterie des Laurentides, Québec, Canada, G1V 4C7
Rôle exact dans la préparation de chaque article et statut d’auteur de l’étudiant
L’étudiante, Véronique Cloutier, est le premier auteur de chaque article. Elle a présenté le projet de recherche à ses directeurs, à l’époque André Desrochers et J. André Fortin, ensemble, ils ont ciblé des objectifs de recherche précis. Elle a dirigé les équipes de terrain à la Forêt Montmorency et au Parc des Hautes-Gorges-de-la-Rivière Malbaie et établi les contacts avec les équipes de l’Abitibi-Témiscamingue et des Laurentides pour obtenir plus d’échantillons. Pour réaliser les tests d’ADN, elle a utilisé un protocole de laboratoire qui existait déjà et qui était utilisé au sein du laboratoire de Jean Bérubé, protocole enseigné par Julien Ponchart supervisé par Jean Bérubé. Elle a aussi dirigé un aide de
laboratoire à cet effet. Elle a supervisé l’étudiant en bio-informatique, Patrick Gagné, qui développa le code de traitement de données pour les milliers de séquences obtenues par pyroséquençage et elle lui a fourni les formations nécessaires. Elle a fait les démarches pour l’utilisation des ressources de Calcul Québec à cet effet. Elle a réalisé les statistiques avec l’aide de professionnels et de ses directeurs. Elle a écrit les articles et cette thèse. Toutes les étapes ont été supervisées et révisées par ses directeurs de recherche, aujourd’hui André Desrochers et Yves Piché.
INTRODUCTION GÉNÉRALE
Le groupe des champignons hypogés, séquestrés, étudiés dans cette thèse inclut toutes les espèces fongiques produisant des fructifications macroscopiques dont la partie reproductrice séquestrée est partiellement ou totalement enfouie dans le sol ou l’humus. Le groupe d’espèces le plus connu, parmi les champignons hypogés, est le genre Tuber spp. (la truffe) qui se distingue par son rôle socio-économique important (Hawker, 1955, Bradai et al., 2015). Ces espèces fongiques forment couramment des symbioses avec les racines des végétaux (association nommée mycorhize) et sont ainsi importantes pour plusieurs arbres et végétaux forestiers (Maser & Maser, 1988a, Heijden et al., 2015) en assurant la mise en circuit des éléments nutritifs à partir des composantes minérales et organiques du sol et en recyclant les nutriments de la matière morte (Hättenschwiler et al., 2005, Lindahl & Tunlid, 2015). En plus de leur rôle primordial auprès des végétaux, les champignons hypogés assurent aussi une source alimentaire non négligeable aux espèces animales se nourrissant de champignons, dont plusieurs sont des rongeurs (Johnson, 1996, North et al., 1997, Cázares et al., 1999, Currah et al., 2000, Dubay et al., 2008, Trappe & Claridge, 2010). Dans certains écosystèmes, les champignons hypogés, séquestrés peuvent représenter une source alimentaire plus abondante que les champignons épigés, voir jusqu’à trente-cinq fois plus importante (Stephens et al., 2017).
Terminologie reliée au champ de recherches
Les ascomycètes sont une classe de champignons supérieurs (Septomycètes). Il s’agit d’un groupe hétérogène dont le seul élément commun est la production d’ascospores au sein d’asques (Boullard, 1997).
Les basidiomycètes sont une classe des champignons supérieurs (Septomycètes). Il s’agit d’un groupe dont le fil conducteur est la baside, siège de la caryogamie, de la méiose, et le site d’élaboration des spores externes haploïdes qui en dérivent (ou basidiospores) (Boullard, 1997).
Les carpophores et les sporocarpes sont les fructifications des champignons.
Les micromammifères sont des animaux de taille plus petite ou égale qu’un écureuil. Ce groupe inclus les souris, les rats, les lemmings, les campagnols, les taupes, les condylures, les musaraignes, les polatouches, les tamias et les écureuils.
La mycophagie signifie la consommation de champignons. Ainsi, un mycophage est un animal qui inclut des champignons dans son régime alimentaire (Maser et al., 2008). Couramment, les animaux mycophages consomment les fructifications hypogées. Les fructifications épigées (croissant au-dessus du sol) sont aussi consommées mais ces espèces ne sont pas tributaires des animaux pour disperser leurs spores.
Les zygomycètes sont une classe de champignons filamenteux, à thalle siphonné (très rarement pourvues de cloisons) et dont les spores sont élaborées dans des sporocystes. Ils sont généralement d’actifs dégradateurs […] parfois identifiés comme « moisissures » (Boullard, 1997).
État des connaissances sur la mycophagie
Les études sur la mycophagie (voir encadré) ont débuté en 1887 (Reess & Fisch, 1887) et ont cheminé par petites avancées pendant 100 ans, jusqu’à ce que Fogel et Trappe (Fogel & Trappe, 1978) fassent une première revue bibliographique (Zabel & Anthony, 2003). Dès 1919, non seulement l’alimentation fongique de quelques micromammifères était connue mais une association avait été faite entre certains de ceux-ci et les carpophores hypogés des champignons (Parks, 1919, Zabel & Anthony, 2003).
À la suite de leur revue bibliographique, Fogel et Trappe (Fogel & Trappe, 1978) proposèrent une tendance générale de la mycophagie dans le régime alimentaire de plusieurs micromammifères (voir encadré) (Trappe et al., 2009). Ils soulevèrent aussi plusieurs questions relativement à l’historique et aux fonctions écosystémiques des champignons et des animaux (Trappe et al., 2009). Il y a un peu plus d’une décennie, Claridge et Trappe (Claridge & Trappe, 2005) effectuèrent une mise à jour de la littérature sur la mycophagie en ajoutant plusieurs considérations. Entre autres, ils catégorisèrent les mycophages en quatre groupes : obligatoires, préférentiels, opportunistes ou accidentels (Trappe et al., 2009).
Plusieurs études sur la mycophagie dans la région du Nord-Ouest des États-Unis et au Sud-Est de l’Australie culminèrent dans un livre écrit par Maser et Claridge intitulé «Trees, Truffles, and Beasts: How Forests Function» (Maser et al., 2008). Dans les dernières années, Cázares et al. s’intéressèrent aussi à ce sujet, (Cázares & Trappe, 1994, Cázares et al., 1999, Loeb et al., 2000), particulièrement aux aspects écologiques liés à la mycophagie tels que la dispersion des spores, l’interaction d’abondance entre les champignons hypogés et les micromammifères ainsi que les habitats propices à la mycophagie.
Coévolution entre les champignons hypogés et les animaux mycophages
Les champignons hypogés et les animaux mycophages ont évolué vers une relation symbiotique non structurelle. Les deux partenaires bénéficient donc bilatéralement de leurs interactions, qui peuvent être obligatoires dans certains cas, mais leurs structures mutuelles ne sont pas unies une à l’autre, de sorte qu’il est aisé d’identifier individuellement les deux partenaires de la symbiose. Puisqu’il s’agit d’une
coévolution, bien que leurs structures ne soient pas unies, celles-ci ont subi des modifications évolutives suites à leurs associations bénéfiques.
Relation symbiotique : avantages retirés par les champignons
Les champignons hypogés dépendent des micromammifères en tant que premiers vecteurs de la dispersion de leurs spores (Maser et al., 1978). Les mammifères dispersent les spores en ingérant les carpophores hypogés puis en les rejetant dans leurs fèces (Trappe & Maser, 1976, Rothwell & Holt, 1978, Kotter & Farentinos, 1984, Lamont et al., 1985, Claridge et al., 1992, Colgan & Claridge, 2002, Tang et al., 2015). Certaines spores de champignons bénéficient d’une germination augmentée suite au passage dans le tractus intestinal des animaux (Claridge et al., 1992, Colgan & Claridge, 2002). Les spores de quelques espèces de champignons hypogés, particulièrement le genre Elaphomyces sp., sont aussi dispersées par l’air, mais nécessitent tout de même l’intervention d’un animal. En effet, la couche extérieure de ces carpophores est consommée par les bêtes, ce qui libère une masse poudreuse de spores et qui, lorsque l’animal est situé en hauteur, résulte en la dispersion des spores dans les courants d’air qui les dispersera (Ingold, 1973, Trappe et al., 2009). Par leur manière typique de consommer plusieurs espèces de champignons, les mycophages aident à perpétuer la diversité fongique à l’intérieur de leur domaine vital (Maser et al., 2008). Il est connu que les frugivores influencent la dynamique de population des plantes consommées, la structure de la communauté ainsi que son évolution (Rodríguez-Pérez, 2011). Par analogie, on pourrait s’attendre à retrouver les mêmes influences des mycophages chez les champignons, mais d’autres études sont nécessaires pour le confirmer.
Relation symbiotique : avantages retirés par les animaux
Les animaux mycophages obtiennent de manière directe des avantages nutritifs puisqu’ils consomment les carpophores. Ces champignons ont souvent une haute teneur en protéines, acides aminés, glucides, lipides, vitamines et minéraux (Claridge & Trappe, 2005). De plus, les champignons hypogés fournissent aussi la majorité de l’eau dont les mycophages ont besoin (Maser et al., 2008).
Coévolution : modifications morphologiques et olfactives des champignons
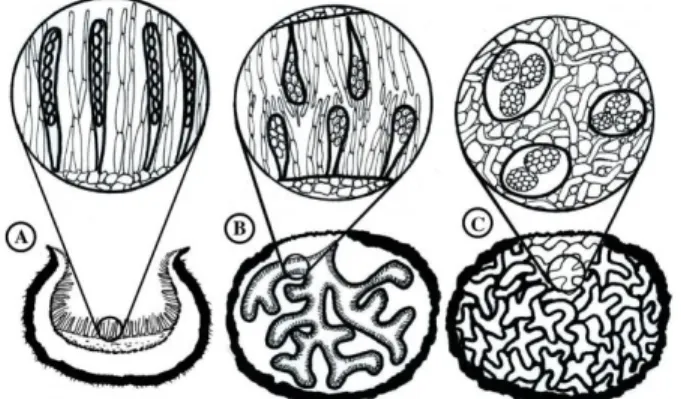
La majorité des champignons hypogés basidiomycètes et ascomycètes d’aujourd’hui sont le résultat d’un processus évolutif des champignons épigés (au-dessus du sol) par la séquestration de leur partie fertile (hyménium) et aussi par la production de parfums pour attirer plusieurs mammifères (Kendrick, 2000). Nous retrouvons une description détaillée de l’évolution des champignons hypogés basidiomycètes dans Trappe et al. (2009). Nous pouvons retrouver plusieurs basidiomycètes avec une morphologie intermédiaire entre les champignons hypogés et épigés. Ils peuvent avoir un pied (stipe) vestigial, trop peu formé pour leur permettre de sortir du sol ; un chapeau qui ne s’ouvre pas de manière à exposer les lamelles et celles-ci peuvent être distordues ou même être remplacées par des chambres (Figure 1.). Une évolution plus avancée vers la morphologie adaptée à la fructification hypogée inclut la perte totale du chapeau et du pied, celui-ci étant remplacé par une columelle : une petite colonne traversant le centre d’une fructification maintenant devenue ronde entourée d’une membrane extérieure (le péridium) (Figure 1). En dernier lieu, l’étape finale de ce type d’évolution (épigé vers hypogé) implique la perte totale du pied ou de son vestige (Figure 1.) (Trappe et al., 2009). L’évolution des champignons hypogés basidiomycètes se serait produite plusieurs fois et rapidement (Johnson, 1996).
Figure 1. Évolution de la morphologie des champignons hypogés
basidiomycètes.
Du haut vers le bas dans la colonne 1 puis dans la colonne 2 : la forme originale du champignon est perdue alors que le chapeau et le pied sont réduits jusqu’à ce que les tissus reproducteurs soient enclavés (Trappe et al., 2009). Illustration de Gretchen Bracher.
Nous retrouvons une description détaillée de l’évolution des champignons hypogés ascomycètes dans Bonito et al. (2013). L’ascomycète initialement ouvert pour exposer son hyménium contenant ses asques organisés avec un nombre égal de spores dans chacune des cellules mères (Figure 2.A), se referme sur lui-même formant des chambres intérieures entourées de l’hyménium avec des asques plus courts à la forme plus clavée (Figure 2.B) puis, la glèbe (partie intérieure) se solidifie et les asques deviennent ronds et contiennent un nombre variable de spores (Figure 2.C).
Finalement, comme nous le savons, les champignons hypogés ont développés une astuce au cours de leur évolution pour être repéré par les mycophages afin de disperser leurs spores. Fogel & Trappe (1978) ont observé que l’odeur des spécimens immatures n’était pas détectable et qu’à l’approche de la maturité, une légère odeur était perceptible. Au fur et à mesure que la proportion de spores matures augmente, l’intensité de l’odeur en fait tout autant.
Coévolution : modifications morphologiques des mycophages
Des modifications morphologiques ont été observées chez certains mycophages obligatoires. Par exemple, chez le campagnol roussâtre de Californie (Myodes californicus californicus), on retrouve des incisives qui arrêtent de pousser tout au long de la vie de l’animal contrairement à la majorité des rongeurs. Leurs dents sont fragiles et inadaptées à de la nourriture abrasive ou solide (Maser, 1998).
De plus, le campagnol roussâtre de Californie a également un appareil digestif adapté pour faciliter la Figure 2. Évolution de la morphologie des champignons
hypogés ascomycètes.
De gauche à droite : la forme originale du champignon est perdue alors que celui-ci se referme sur lui-même jusqu’à ce que les tissus reproducteurs soient emprisonnés. Les asques sont disposés sans ordre apparent et prennent une forme arrondie avec un nombre maintenant variable de spores (Bonito et al., 2013).
digestion des sporocarpes de champignons hypogés contrairement à beaucoup d’autres espèces de mammifères (Claridge et al., 1999). Pour s’en convaincre, il est pertinent de consulter l’étude de Claridge et al. (1999) dans laquelle des micromammifères ont été nourris seulement de sporocarpes de champignons hypogés dans un environnement contrôlé. On y apprend que le campagnol roussâtre de Californie parvient à égaler, voire surpasser, les capacités de digestion du grand polatouche malgré une masse corporelle six fois moindre. On peut s’attendre à ce que le degré de mycophagie soit intimement lié aux différentes adaptations morphologiques et physiologiques d’un animal (Dighton et al., 2005).
PROBLÉMATIQUE DE RECHERCHE
Contexte Nord-Américain
Étant donné que les relations entre les mammifères, les champignons et les arbres peuvent être compromises par les pratiques forestières (Amaranthus & Perry, 1994, Katarzyte & Kutorga, 2011) et que certaines espèces de champignons hypogés peuvent nécessiter plusieurs années avant de se remettre des perturbations (Colgan et al., 1999), il est pertinent de connaître les espèces fongiques indigènes d’un territoire ainsi que ses consommateurs pour assurer le maintien de la chaîne trophique. D’ailleurs, plusieurs auteurs ont ciblé les habitudes alimentaires des animaux mycophages comme faisant partie d’un champ de recherche fondamental pour l’avancement des connaissances sur un sujet encore mal connu (Zabel & Anthony, 2003, Claridge & Trappe, 2005, Dighton et al., 2005).
Aux États-Unis, l’Endangered Species Act de 1973 oblige le gouvernement fédéral à déclarer les espèces menacées d’extinction, à identifier les habitats nécessaires à leur survie et à protéger les deux. Par ailleurs, le Northwest Forest Plan de 1994 a entériné cette ligne directive comme étant une obligation légale de protéger les prédateurs des mycophages et par conséquent, la survie de ces derniers. Ce plan a été encore plus loin dans un souci de protection en établissant une liste de 234 espèces fongiques rares dépendantes de la forêt surannée (Moore et al., 2011).
D’un point de vue international, nous n’en sommes pas encore à protéger les mycophages mais de premiers pas ont été fait en termes de protection fongique. La Convention sur la diversité biologique, ratifiée par 193 pays et dont le secrétariat a son siège à Montréal, au Canada, a pour objectif, entre autres, la conservation de la diversité biologique et inclus, par définition, les champignons. Dans les faits, peu de pays ont adopté une réglementation protégeant les champignons. En Europe, quelques initiatives de protection sont présentes dont une ébauche de liste européenne réalisée en 2001, que les auteurs recommandaient de faire figurer à l’annexe I de la Convention de Berne afin de leur assurer une protection égale à celle des espèces animales (Koune, 2001). La Suisse et plusieurs départements de la France possèdent leur propre liste rouge des champignons en péril (Senn-Irlet et al., 2007, Sugny et al., 2013). La Croatie et la Slovénie possèdent aussi un cadre législatif pour la protection de la fonge (Ecolex, 2017).
Malgré que le siège de la Convention sur la diversité biologique soit à Montréal, la liste espèces sauvages canadiennes en péril (COSEPAC, 2016) inclus les mousses et les lichens mais n’inclut pas de champignons. Au Québec, des listes d’espèces menacées ou vulnérables existent, mais uniquement pour la faune et la flore. À l’heure actuelle, il n’en n’existe aucune concernant la fonge.
Chaîne trophique
La règlementation américaine empêchant la disparition des espèces et des habitats menacés s’est beaucoup développée à la suite de recherches appliquées au début des années 1990. À cette époque les États-Unis ont dû gérer une crise environnementale causée par la vulnérabilité des champignons à l’exploitation forestière (Moore et al., 2011). Cette crise nous a amené à comprendre que plusieurs micromammifères dépendent des fructifications fongiques, spécialement hypogées, pour combler une partie importante de leur régime alimentaire. Incidemment, les prédateurs des mycophages sont aussi affectés, notamment parmi certains oiseaux de proie. Le déclin de la chouette tachetée du nord (Strix occidentalis caurina) observé dans l’état de Washington est devenu un exemple typique pour bien comprendre l’équilibre fragile de la chaîne alimentaire (Marcot & Thomas, 1997). De fait, le manque de champignons en forêt est devenu la cause principale de l’effondrement de la population des micromammifères et par conséquent, aussi celle de la chouette tachetée du nord (Marcot & Thomas,
1997, Molina et al., 2001). En 2011, malgré les efforts de rétablissement, on comptait aussi peu qu’environ 500 couples dans l’état de Washington (Moore et al., 2011).
Inventaire des champignons hypogés
De manière à étudier la mycophagie des micromammifères, il est requis de connaître les espèces fongiques hypogées à leur disposition pour leur alimentation. Toutefois, la répartition des champignons sous terre est encore mal connue ce qui nous oblige à comprendre leur écologie pour savoir quel est l’endroit où creuser pour les trouver avant de commencer les recherches qui seraient, sinon, trop extensives donc laborieuses. Il s’agit d’un cercle vicieux puisque, pour connaître leur écologie, en premier lieu nous devons trouver un nombre de carpophores suffisant pour tirer des conclusions valides au plan statistique, à propos de leur habitat et de leur distribution. Par conséquent, un nombre très limité de régions du monde possèdent un inventaire des champignons hypogés sur leur territoire. La forêt boréale de l’Est du Canada pourtant reconnue pour héberger une grande variété de champignons forestiers demeure encore largement méconnue quant à sa flore fongique vivant sous terre.
Jusqu’à tout récemment au Canada, la façon usuelle d’échantillonner les champignons hypogés était de prédire où et quand pourrait être la période de fructification basée sur notre connaissance limitée de l’écologie de ces champignons souvent développée par d’autres pays. Bien entendu, la méthode classique du raclage du sol (scratching) est la première qui nous vient à l’esprit pour découvrir les champignons souterrains d’un nouveau territoire. Cette méthode de raclage consiste à gratter la surface du sol avec un râteau de jardinage jusqu’à environ 10 cm de profondeur (Luoma et al., 1991) Plusieurs indices visuels permettent la recherche de carpophores hypogés tels que la présence de débris ligneux, les excavations de micromammifères et la présence d’espèces d’arbres connues pour avoir une association mycorhizienne avec l’espèce fongique recherchée. Cette méthode amène des résultats utilisables si elle est réalisée par des experts des champignons hypogés mais elle demeure exigeante. Par conséquent, elle n’est pas appropriée pour échantillonner de grandes étendues telles que la forêt boréale pendant la courte période de fructification de ces espèces fongiques.
Dans la présente étude, l’utilisation des fèces d’animaux mycophages a facilité l’échantillonnage des champignons hypogés considérant que ces animaux ont vraisemblablement une coévolution avec de telles espèces fongiques dont ils dispersent les spores qui, autrement, resteraient piégés sous terre (Trappe et al., 2009, Tang et al., 2015). Conséquemment, les fèces d’animaux mycophages sont susceptibles de contenir les spores des champignons hypogés présents dans le domaine vital de l’animal. L’identification des champignons hypogés est dorénavant concevable en recourant aux techniques de séquençage à haut débit de l’ADN sporal contenu dans les fèces. Pour y arriver, on doit recourir aux marqueurs ribosomiques de l’espaceur interne transcrit (ITS) utilisés comme code-barre universel pour identifier tous les champignons (Schoch et al., 2012). Cette approche moléculaire appelée « metabarcoding de l’ADN fongique » nous a permis d’évaluer la diversité des champignons hypogés rencontrée dans les fèces des micromammifères. Il ne faut pas oublier non plus qu’il soit envisageable de trouver quelques espèces hypogées à partir du grattage du sol. En pratique, l’observation morphologique de ces champignons nouvellement déterrés couplée à la production de séquences d’ADN pourra vraisemblablement nous aider à valider leurs présences dans l’Est du Canada. Finalement, le gène ribosomique de référence « ITS » permettra au cours cette étude d’analyser les séquences de l’ADN présentes dans les tissus des champignons récoltés de même que dans les échantillons fongiques issus des fèces.
OBJECTIFS DE LA THÈSE
L’objectif général de cette thèse est l’évaluation de la consommation des champignons hypogés par les micromammifères de la forêt boréale de l’Est du Canada (qui mange quoi, où et quand).
Vu la connaissance embryonnaire de ce domaine de recherche dans l’Est du Canada, ce travail est de nature exploratoire plutôt que strictement hypothético déductive. Ainsi d'importants premiers jalons ont été posés, qui pourront éventuellement développer un cadre conceptuel et ainsi mener à une approche davantage fondée sur des tests d'hypothèses.
L’objectif général de la thèse est divisé en trois sous-objectifs, chacun correspondant à un chapitre :
Établir la diversité des champignons hypogés en forêt boréale de l’Est du Canada
Dans l’Est du Canada, l’avancement des connaissances sur la mycophagie est au ralenti compte tenu des difficultés méthodologiques pour découvrir les champignons hypogés en forêt boréale. Le développement d’une approche pionnière s’impose pour conduire une recherche en couplant l’identification moléculaire des séquences de l’ADN présentes dans les fèces avec l’isolement de carpophores par raclage du parterre forestier. Les deux méthodologies, une fois regroupées, ont permis de mettre au point une évaluation plus détaillée de la diversité et de la répartition des espèces hypogées potentiellement consommées par les micromammifères mycophages de la forêt boréale.
Décrire l’habitat des différentes espèces de champignons hypogés
La difficulté de détecter les champignons hypogés en forêt boréale est bien réelle par manque de repères écologiques associés au développement de ces champignons mycorhiziens et souterrains. Ne sachant pas où chercher, il est difficile d’obtenir suffisamment de spécimens pour établir de telles corrélations.
L’emphase a donc été mise dans ce deuxième chapitre sur la modélisation des champignons hypogés dans la chaîne trophique et dans les patrons de dispersion des spores par les animaux afin de construire les premières bases théoriques de la mycophagie dans l’Est du Canada.
En d’autres termes, l’identification moléculaire des champignons hypogés à partir des fèces est particulièrement utile pour établir les premières corrélations entre certaines espèces fongiques et les caractéristiques de l’habitat où vie l’animal mycophage. Pour la première fois, la modélisation des données servira de point de repère pour trouver les champignons cachés dans le sol et stimulera les futures recherches sur de telles espèces cryptiques.
Documenter l’alimentation fongique des micromammifères mycophages de la forêt boréale de l’Est du Canada
Selon nos connaissances, la majorité, si ce n’est la totalité des champignons hypogés de la présente étude (44 espèces) forment des ectomycorhizes avec les plantes ligneuses principalement des gymnospermes mais aussi quelques angiospermes de la forêt boréale (chapitre 1). Malgré qu’ils soient bien cachés dans le sol, la vie symbiotique des champignons ectomycorhiziens est comparable entre les régions du monde. À l’opposé des champignons hypogés, les animaux mycophages de la forêt boréale nous apparaissent familiers dans le paysage forestier mais leur consommation nous échappe encore par le manque d’études. En effet, leur régime alimentaire basé sur les champignons hypogés est plutôt anecdotique que scientifique jusqu’à ce que nos travaux de recherche apportent un éclairage nouveau sur l’identité moléculaire des spores contenues dans leurs fèces. La propension des micromammifères à consommer des champignons hypogés n’est plus à démontrer (Maser & Maser, 1988b, Maser et al., 2008) mais la généralisation des concepts de la mycophagie se heurte aux différents comportement des animaux en fonction de l’hétérogénéité des habitats forestiers (Le Tacon & Selosse, 1997). C’est dans ce contexte que nous abordons ce dernier chapitre afin de pouvoir identifier les particularités écologiques associées au phénomène de la mycophagie des micromammifères dans l’Est du Canada. En soi, la présente étude s’insère dans une démarche internationale de mieux comprendre l’importance de la mycophagie en lien avec les relations écologiques des champignons hypogés (Malajczuk et al., 1987, Lescourret & Génard, 1988, Claridge & Trappe, 2005). Finalement, cette thèse contribuera à la mise à jour des traités de zoologie et de mycologie au Canada en intégrant de nouvelles informations sur le régime alimentaire des petits animaux tout en définissant la diversité et l’habitat des champignons hypogés de la forêt boréale.
Ce projet apportera à réviser des traités de mycologie en permettant d'obtenir une approximation de la diversité et de l’habitat des champignons hypogés en forêt boréale de l’Est du Canada, plus spécifiquement dans la province de Québec. Ces connaissances permettront d’établir les premiers jalons d’une compréhension de la mycophagie dans cette région du monde et, éventuellement, de la dispersion des champignons hypogés par les mammifères en forêt boréale.
Références
AMARANTHUS, M.P. & PERRY, D.A. 1994. The functioning of ectomycorrhizal fungi in the field - linkages in-space and time. Plant and Soil, 159. 133-140.
BONITO, G., SMITH, M.E., NOWAK, M., HEALY, R.A., GUEVARA, G., CÁZARES, E., KINOSHITA, A., NOUHRA, E.R., DOMÍNGUEZ, L.S., TEDERSOO, L., MURAT, C.,
WANG, Y., MORENO, B.A., PFISTER, D.H., NARA, K., ZAMBONELLI, A., TRAPPE, J.M. & VILGALYS, R. 2013. Historical biogeography and diversification of truffles in the
Tuberaceae and their newly identified southern hemisphere sister lineage. PLoS ONE, 8. e52765.
BOULLARD, B. 1997. Plantes & champignons: dictionnaire. Estem.
BRADAI, L., NEFFAR, S., AMRANI, K., BISSATI, S. & CHENCHOUNI, H. 2015.
Ethnomycological survey of traditional usage and indigenous knowledge on desert truffles among the native Sahara Desert people of Algeria. Journal of Ethnopharmacology, 162. 31-38. CÁZARES, E., LUOMA, D.L., AMARANTHUS, M.P., CHAMBERS, C.L. & LEHMKUHL, J.F.
1999. Interaction of fungal sporocarp production with small mammal abundance and diet in Douglas-fir stands of the southern cascade range. Northwest Science, 73. 64-76.
CÁZARES, E. & TRAPPE, J.M. 1994. Spore dispersal of ectomycorrhizal fungi on a glacier forefront by mammal mycophagy. Mycologia, 86. 507-510.
CLARIDGE, A.W., TANTON, M.T., SEEBECK, J.H., CORK, S.J. & CUNNINGHAM, R.B. 1992. Establishment of ectomycorrhizae on the roots of two species of Eucalyptus from fungal spores contained in the faeces of the long-nosed potoroo (Potorous tridactylus). Australian Journal of Ecology, 17. 207-217.
CLARIDGE, A.W. & TRAPPE, J.M. 2005. Sporocarp mycophagy: nutritional, behavioral,
evolutionary and physiological aspects. The Fungal Community: Its Organization and Role in the Ecosystem, Third Edition. CRC Press. 960 pages.
CLARIDGE, A.W., TRAPPE, J.M., CORK, S.J. & CLARIDGE, D.L. 1999. Mycophagy by small mammals in the coniferous forests of North America: nutritional value of sporocarps of Rhizopogon vinicolor, a common hypogeous fungus. Journal of Comparative Physiology B. Biochemical, Systems, and Environmental Physiology., 169. 172-178.
COLGAN, W., CAREY, A.B., TRAPPE, J.M., MOLINA, R. & THYSELL, D. 1999. Diversity and productivity of hypogeous fungal sporocarps in a variably thinned Douglas-fir forest. Canadian Journal of Forest Research-Revue Canadienne De Recherche Forestiere, 29. 1259-1268. COLGAN, W. & CLARIDGE, A.W. 2002. Mycorrhizal effectiveness of Rhizopogon spores recovered
from faecal pellets of small forest-dwelling mammals. Mycological Research, 106. 314-320. COSEPAC. 2016. Espèces sauvages canadiennes en péril. [Online]. Comité sur la situation des
espèces en péril au Canada. Available: http://www.cosepac.gc.ca/fra/sct0/rpt/rpt_ecep_f.cfm [Accessed].
CURRAH, R.S., SMRECIU, E.A., LEHESVIRTA, T., NIEMI, M. & LARSEN, K.W. 2000. Fungi in the winter diets of northern flying squirrels and red squirrels in the boreal mixed wood forest of northeastern Alberta. Canadian Journal of Botany, 78. 1514-1520.
DIGHTON, J., WHITE JR., J.F. & OUDEMANS, P. 2005. The fungal community: its organization and role in the ecosystem, Third Edition. CRC Press. 960 pages.
DUBAY, S.A., HAYWARD, G.D. & DEL RIO, C.M. 2008. Nutritional value and diet preference of arboreal lichens and hypogeous fungi for small mammals in the Rocky Mountains. Canadian Journal of Zoology, 86. 851-862.
ECOLEX. 2017. Recencement mondial de la règlementation avec le mot fungi. [Online]. Le portail du droit de l'environnement. Available: https://www.ecolex.org/fr/result/?q=fungi [Accessed]. FOGEL, R. & TRAPPE, J.M. 1978. Fungus consumption (mycophagy) by small animals. Northwest
Science, 52.
HÄTTENSCHWILER, S., TIUNOV, A.V. & SCHEU, S. 2005. Biodiversity and litter decomposition in terrestrial ecosystems. Annual Review of Ecology, Evolution, and Systematics, 36. 191-218. HAWKER, L.E. 1955. Hypogeous fungi. Biological Reviews, 30. 127-158.
HEIJDEN, M.G.A., MARTIN, F.M., SELOSSE, M.A. & SANDERS, I.R. 2015. Mycorrhizal ecology and evolution: the past, the present, and the future. New Phytologist, 205. 1406-1423.
INGOLD, C.T. 1973. The gift of a truffle. Bulletin of the British Mycological Society, 7. 32-33. JOHNSON, C.N. 1996. Interactions between mammals and ectomycorrhizal fungi. Trends in Ecology
& Evolution, 11. 503-507.
KATARZYTE, M. & KUTORGA, E. 2011. Small mammal mycophagy in hemiboreal forest communities of Lithuania. Central European Journal of Biology, 6. 446-456.
KENDRICK, B. 2000. The fifth kingdom. Newburyport MA. Focus Pub. xii, 373 p.
KOTTER, M.M. & FARENTINOS, R.C. 1984. Formation of ponderosa pine ectomycorrhizae after inoculation with feces of tassel-eared squirrels. Mycologia, 76. 758-760.
KOUNE, J.-P. 2001. Fiches descriptives des champignons menacés d’Europe susceptibles de figurer à l’Annexe I de la Convention. European Council for the Conservation of Fungi.
LAMONT, B.B., RALPH, C.S. & CHRISTENSEN, P.E.S. 1985. Mycophagous marsupials as dispersal agents for ectomycorrhizal fungi on Eucalyptus calophylla and Gastrolobium bilobum. New Phytologist, 101. 651-656.
LE TACON, F. & SELOSSE, M.-A. 1997. Le Rôle des mycorhizes dans le colonisation des continents et la diversification des écosystèmes terrestres. ENGREF, Ecole nationale du génie rural, des eaux et des forêts, Nancy, France. 15-24.
LESCOURRET, F. & GÉNARD, M. 1988. Les mammifères forestiers, agents de la mycorhization des arbres. Arborescences, 19. 8-11.
LINDAHL, B.D. & TUNLID, A. 2015. Ectomycorrhizal fungi – potential organic matter decomposers, yet not saprotrophs. New Phytologist, 205. 1443-1447.
LOEB, S.C., TAINTER, F.H. & CÁZARES, E. 2000. Habitat associations of hypogeous fungi in the southern appalachians: Implications for the endangered northern flying squirrel (Glaucomys sabrinus coloratus). American Midland Naturalist, 144. 286-296.
LUOMA, D.L., FRENKEL, R.E. & TRAPPE, J.M. 1991. Fruiting of hypogeous fungi in Oregon douglas-fir forests - seasonal and habitat variation. Mycologia, 83. 335-353.
MALAJCZUK, N., TRAPPE, J.M. & MOLINA, R. 1987. Interrelationships among some ectomycorrhizal trees, hypogeous fungi and small mammals – western australian and northwestern american parallels. Australian Journal of Ecology, 12. 53-55.
MARCOT, B.G. & THOMAS, D.W. 1997. Of spotted owls, old-growth, and new policies: a history since the interagency scientific committee report. Page 34. USDA Forest Service, Pacific Northwest Research Station General Technical Report PNW-GTR-408.
State University Press. 406 pages.
MASER, C., CLARIDGE, A.W. & TRAPPE, J.M. 2008. Trees, truffles, and beasts: how forests function. Rutgers University Press. 282 pages.
MASER, C. & MASER, Z. 1988a. Interactions among squirrels, mycorrhizal fungi, and coniferous forests in Oregon. The Great Basin Naturalist, 48. 358-369.
MASER, C. & MASER, Z. 1988b. Mycophagy of red-backed voles, Clethrionomys californicus and C. gapperi. The Great Basin Naturalist, 48. 269-273.
MASER, C., NUSSBAUM, R.A. & TRAPPE, J.M. 1978. Fungal small mammal interrelationships with emphasis on Oregon coniferous forests. Ecology, 59. 799-809.
MOLINA, R., PILZ, D., SMITH, J., DUNHAM, S., DREISBACH, T., O'DELL, T. & CASTELLANO, M. 2001. Conservation and management of forest fungi in the Pacific Northwestern United States: an integrated ecosystem approach. In: Press, C.U. (ed.) Fungal conservation issues and solutions. Cambridge University Press. 19-63.
MOORE, D., ROBSON, G. & TRINCI, T. 2011. 21st Century Guidebook to Fungi. Cambridge University Press. 639 pages.
NORTH, M., TRAPPE, J. & FRANKLIN, J. 1997. Standing crop and animal consumption of fungal sporocarps in Pacific Northwest forests. Ecology, 78. 1543-1554.
PARKS, H.E. 1919. Note on California fungi. Mycologia, 11. 15-20.
REESS, M. & FISCH, C. 1887. Untersuchungen unter bau und lebensgeschichte der hirschtrüggel, Elaphomyces. Bibliotheca Botanica, 7. 1-24.
RODRÍGUEZ-PÉREZ, J. 2011. Frugivore behaviour determines plant distribution: a spatially explicit analysis of a plant-disperser interaction. Ecography, 35. 113-123.
ROTHWELL, F.M. & HOLT, C. 1978. Vesicular-arbuscular mycorrhizae established with Glomus fasciculatus spores isolated from the feces of cricetine mice. Forest Service Research Note NE-259. Broomall, Pa. : Dept. of Agriculture, Forest Service, Northeastern Forest Experiment Station. 4 pages.
SCHOCH, C.L., KEITH, A.S., SABINE, H., VINCENT, R., JOHN, L.S., LEVESQUE, C.A., WEN, C., FUNGAL BARCODING, C., FUNGAL BARCODING CONSORTIUM AUTHOR, L., ELENA, B., KERSTIN, V., PEDRO, W.C., ANDREW, N.M., MICHAEL, J.W., AIME, M.C., KWANG-DEUK, A., FENG-YAN, B., ROBERT, W.B., DOMINIK, B., MARIE-JOSÉE, B., MEREDITH, B., TEUN, B., MESFIN, B., NATTAWUT, B., ANA, R.B., BART, B., LEI, C., QING, C., CARDINALI, G., PRISCILA, C., BRIAN, J.C., ANA, C., PALOMA, C., CRAIG, C., ULRIKE, D., BEER, Z.W.D., HOOG, G.S.D., RUTH, D.-P., BRYN, D., JAVIER, D.-U., PRADEEP, K.D., BRIAN, D., MARGARITA, D., TUAN, A.D., URSULA, E., JOAN, E.E., MOSTAFA, S.E., KATERINA, F., MANOHAR, F., MIGUEL, A.G., ZAI-WEI, G., GARETH, W.G., GRIFFITHS, K., JOHANNES, Z.G., MARIZETH, G., MARTIN, G., MARIEKA, G., LIANG-DONG, G., FERRY, H., SARAH, H., RICHARD, C.H., KAREN, H., PAUL, H., GREGORY, H., CESAR, H., KAZUYUKI, H., YUURI, H., HSIAO-MAN, H., KERSTIN, H., VALÉRIE, H., FILIP, H., PETER, M.H., SEUNG-BEOM, H., KENTARO, H., JOS, H., KAREN, H., SEPPO, H., KEVIN, D.H., TIMOTHY, J., ERIC, M.J., JOAN, E.J., PETER, R.J., JONES, E.B.G., LAURA, J.K., PAUL, M.K., DÁNIEL, G.K., URMAS, K., GÁBOR, M.K., CLETUS, P.K., SARA, L., STEVEN, D.L., AUDRA, S.L., KARE, L., LORENZO, L.,
LUANGSA-ARD, J.J., LUMBSCH, H.T., HARINAD, M., SAJEEWA, S.N.M., MARÍA, P.M. & TOM, W.M. 2012. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal
DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences, 109. 6241. SENN-IRLET, B., BIERI, G. & EGLI, S. 2007. Liste rouge des champignons supérieurs menacés en
Suisse. L’environnement pratique no 0718. Office fédéral de l’environnement. 94 pages. STEPHENS, R.B., REMICK, T.J., DUCEY, M.J. & ROWE, R.J. 2017. Drivers of truffle biomass,
community composition, and richness among forest types in the northeastern US. Fungal Ecology, 29. 30-41.
SUGNY, D., BEIRNAERT, P., BILLOT, A., CAILLET, M., CAILLET, M., CHEVROLET, J.P., GALLIOT, L., HERBERT, R. & MOYNE, G. 2013. Liste rouge des champignons supérieurs de Franche-Comté. Publication commune Fédération Mycologique de l’Est, Conservatoire National Botanique de Franche-Comté et Société Botanique de Franche-Comté. 114 pages. TANG, X., MI, F., ZHANG, Y., HE, X., CAO, Y., WANG, P., LIU, C., YANG, D., DONG, J.,
ZHANG, K. & XU, J. 2015. Diversity, population genetics, and evolution of macrofungi associated with animals. Mycology: An International Journal on Fungal Biology, 6. 94-109. TRAPPE, J.M. & CLARIDGE, A.W. 2010. The hidden life of truffles. Scientific American, 302. 78-84. TRAPPE, J.M. & MASER, C. 1976. Germination of spores of Glomus macrocarpus (Endogonaceae)
after passage through a rodent digestive tract. Mycologia, 68. 433-436.
TRAPPE, J.M., MOLINA, R., LUOMA, D.L., CÁZARES, E., PILZ, D., SMITH, J.E.,
CASTELLANO, M.A., MILLER, S.L. & TRAPPE, M.J. 2009. Diversity, ecology, and conservation of truffle fungi in forests of the Pacific Northwest. Gen. Tech. Rep. PNW-GTR-772. Portland, OR: U.S. Department of Agriculture, Forest Service, Pacific Northwest Research Station.194 pages.
ZABEL, C.J. & ANTHONY, R.G. 2003. Mammal community dynamics, management and conservation in the coniferous forest of western North America. 732 pages.
CHAPITRE 1 - DIVERSITÉ DES CHAMPIGNONS HYPOGÉS EN FORÊT BORÉALE DE L’EST DU CANADA
1 Diversity of hypogeous sequestrate fungi in the eastern Canadian boreal forest
Authors' names Véronique B. Cloutier1, Yves Piché1, J. André Fortin1, Jean Bérubé2, Julien
P. Ponchart1 and André Desrochers1
Complete affiliations
1 Centre d’étude de la forêt, Université Laval, Quebec, Canada G1V 0A6 2 Centre de foresterie des Laurentides, Quebec, Canada G1V 4C7
Address for manuscript correspondence
Véronique Cloutier
1.1 Abstract
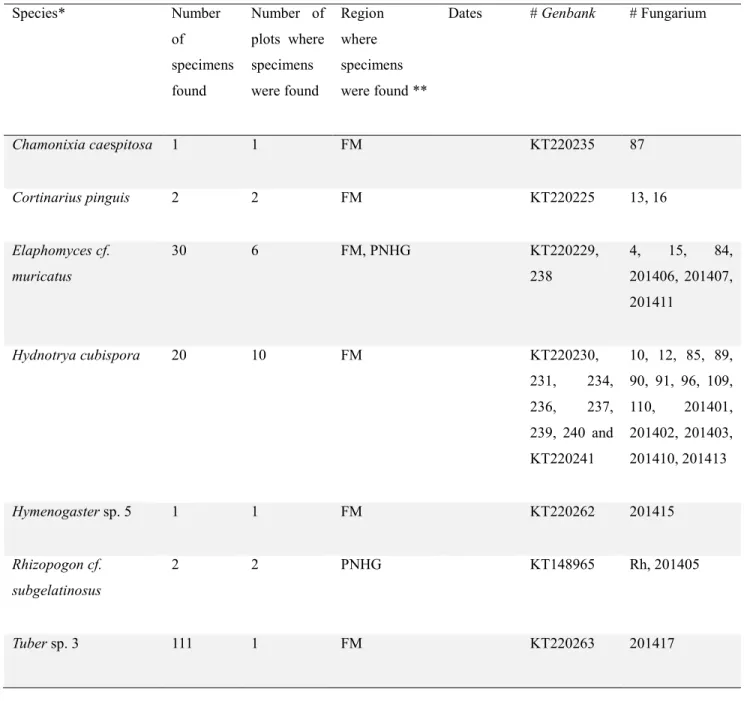
We performed surveys for hypogeous sequestrate fungi in four sectors of the eastern Canadian boreal forest in 2011–2012. We scraped the ground to collect fungal fructifications and used morphological and cellular criteria, as well as molecular criteria based on Sanger sequencing of the ribosomal ITS sequences (fungal barcode), to identify specimens. Additionally, we used fungal metabarcoding of feces obtained from mycophagous micromammals using 454 FLX+ technology. We confirmed the occurrence of 28 species of hypogeous sequestrate fungi from phyla Ascomycotina, Basidiomycotina and Zygomycotina, including eleven new species records for the area. This brings the total number of hypogeous sequestrate macrofungal species identified in the province Quebec to 44.
1.2 Résumé
Nous avons effectué des inventaires de champignons hypogés dans quatre secteurs de la forêt boréale de l’Est du Canada, en 2011-2012. Nous avons gratté le sol pour recueillir des fructifications fongiques et utilisé des critères morphologiques et cellulaires ainsi que moléculaires basés sur le séquençage Sanger des séquences ribosomiques ITS (codes à barres fongique) pour identifier les spécimens. De plus, nous avons réalisé du métabarcoding de l’ADN fongique présent dans les fèces des micromammifères mycophages, ceci en utilisant la technologie 454 FLX+. Nous avons ainsi confirmé l’occurrence de 28 espèces de champignons hypogés des phyla Ascomycotina, Basidiomycotina et Zygomycotina, incluant 11 nouvelles mentions pour cette région. Cela amène à 44 le total d’espèces identifiées dans la province de Québec.
4 to 6 Index descriptors
1.3 Introduction
Hypogeous sequestrate macrofungi include all species that produce fruiting bodies with sequestered reproductive part being partially or completely embedded in soil or humus. Hypogeous macrofungi commonly form symbioses with roots (mycorrhizae) and are thus important for native vegetation (Maser & Maser, 1988a, Heijden et al., 2015). Hypogeous macrofungi also serve as food for native mycophagous animals, especially rodents (Johnson, 1996, North et al., 1997, Cázares et al., 1999, Currah et al., 2000, Dubay et al., 2008, Trappe & Claridge, 2010). Lastly, certain hypogeous sequestrate fungi (Tuber spp.) play a significant economic role in regions where they occur (Hawker, 1955, Bradai et al., 2015).
Hypogeous fungi are notoriously difficult to find because they produce underground fructifications and have a patchy distribution. Their distribution is therefore largely unknown in many areas of the world, including eastern Canadian forests. Until recently, the common way to sample these fungi was to guess their fructification period based on limited knowledge and to scrape the surface of the ground with a garden rake down to about 10 cm deep (Luoma et al., 1991). Visual clues are also commonly used to identify search areas, such as the presence of coarse woody debris, micromammal excavations, or the presence of trees known to have specific mycorrhizal associations. This method yields results when conducted by experts, but remains time consuming, thus not amenable to sampling over extensive areas.
Mycophagous animal feces may facilitate sampling considering that these animals coevolved with hypogeous sequestrate macrofungi to disperse fungal spores that would otherwise remain underground (Trappe & Maser, 1976, Trappe et al., 2009, Tang et al., 2015). Some mycophagous animal species such as the Californian red-backed voles (Myodes californicus californicus), have evolved fragile teeth unsuitable to abrasive food, and a fungi-specialized digestive tract (Maser, 1998, Claridge et al., 1999). Passage through the digestive tract leaves spores intact and is thought to contribute to spore germination (Claridge et al., 1992, Colgan & Claridge, 2002). Consequently, mycophagous animal feces are likely to contain spores from available fungus species occurring in their local range.
In this paper, we propose a method to facilitate fungal diversity sampling of hypogeous sequestrate fungi using animal open baiting stations, in association with DNA sequencing of mycophagous animal feces