© Elsa Bourgeois, 2019
Étude sur les interactions entre les acétophénones de
l'épinette blanche et le Btk chez la tordeuse des
bourgeons de l’épinette sous diverses conditions
d'élevage en milieu artificiel
Mémoire
Elsa Bourgeois
Maîtrise en sciences forestières - avec mémoire
Maître ès sciences (M. Sc.)
Étude sur les interactions entre les acétophénones de
l’épinette blanche et le Bacillus thuringiensis var.
kurstaki
chez la tordeuse des bourgeons de l’épinette
sous diverses conditions d’élevage en milieu artificiel
Mémoire
Elsa Bourgeois
Sous la direction de :
Éric Bauce, directeur de recherche
Christian Hébert, codirecteur de recherche
iii
Résumé
La tordeuse des bourgeons de l’épinette (Choristoneura fumiferana (Clems.)) est le principal défoliateur des forêts de conifères de l’Amérique du Nord. Récemment, des épinettes blanches (Picea glauca (Moench) Voss) naturellement résistantes à cet insecte ont été découvertes dans une plantation subissant une forte infestation de ce ravageur. Des analyses chimiques du feuillage ont révélé la présence de deux acétophénones, le picéol (4’-hydroxy-acetophenone) et le pungénol (3’,4’-dihydroxy-acetophenone) chez ces épinettes résistantes. Les objectifs de cette étude étaient dans un premier temps de valider l’effet de ces deux molécules sur la survie des larves de la tordeuse selon plusieurs conditions d’élevage, et dans un deuxième temps de vérifier la compatibilité entre le picéol et le principal moyen de lutte utilisé au Québec contre ce ravageur, le Btk (Bacillus thuringiensis var. kurstaki). Les larves de la tordeuse des bourgeons de l’épinette ont été élevées en laboratoire sur de la diète artificielle, et les composées acétophénones leur ont été administrés en solution ou en les mélangeant à la diète artificielle. Les résultats ont montré que l’absorption directe d’une dose ponctuelle de picéol et de pungénol ne provoque pas de mortalité chez les larves alors que la toxicité du picéol chez la tordeuse des bourgeons de l’épinette soumise à une exposition chronique du produit varie selon les conditions d’élevage. De plus, un effet antagoniste entre le picéol et le Btk a également été détecté au laboratoire. Cette recherche a permis de faire avancer la compréhension des interactions complexes entre les molécules de défense de l’épinette blanche et les conditions d’élevage en laboratoire. D’autres travaux en laboratoire et sur le terrain sont nécessaires afin de mieux comprendre le mode d’action de ces composés de défense et ainsi les utiliser à leur plein potentiel.
iv
Table des matières
RÉSUMÉ ... III TABLE DES MATIÈRES ... IV LISTE DES FIGURES... V LISTE DES TABLEAUX ... VI REMERCIEMENTS ... VII
INTRODUCTION ... 1
MATÉRIEL ET MÉTHODES ... 7
Expérience 1 : Effet direct du picéol et du pungénol, administrés en solution ... 7
Expérience 2 : Effet des protocoles d’élevage sur l’efficacité du picéol ... 8
Expérience 3 : Interaction entre le Btk et le picéol ... 9
Dispositif expérimental et analyses statistiques ...10
RÉSULTATS ...11
Expérience 1 : Effet du picéol et du pungénol en solution ...11
Expérience 2 : Effet des protocoles d’élevage sur l’efficacité du picéol ...12
Expérience 3 : Interaction entre le picéol et le Btk ...15
DISCUSSION ...17
CONCLUSION ...22
v
Liste des figures
Figure 1 : Cycle de vie de la tordeuse des bourgeons de l'épinette, Choristoneura fumiferana (MFFP, 2019) ... 1 Figure 2 : Structure des deux acétophénones et de leur aglycone (Mageroy et al. 2017) ... 4 Figure 3 : Effet du picéol, du pungénol et des deux molécules combinées en solution sur la mortalité des larves de la TBE après 14 jours. Une concentration de 15mg/ml pour les deux molécules a été utilisée. ...11 Figure 4 : Interaction entre le protocole de fabrication de la diète et la concentration en picéol sur la mortalité des
larves de TBE après 3 jours (n=60)▲ Diète gardée à une température de 55°C ● Diète congelée puis chauffée à une température supérieure à 75°C. ...13 Figure 5 : Effet du picéol et de la durée de conservation de la diète sur la mortalité des larves de TBE après 3 jours
(n=60) ...14 Figure 6 : L’effet du picéol et de l’aération des contenants d’élevage sur la mortalité des larves de TBE après 3 jours
(n=60) ...15 Figure 7 : Effets combinés du picéol et du Btk (appliqué à une dose de 0.75 µl/larve) chez les larves de la tordeuse
vi
Liste des tableaux
Tableau 1 : Résultats de la régression de poisson entre la mortalité larvaire et le processus de fabrication de la diète 12 Tableau 2 : Résultats de la régression de poisson entre la mortalité larvaire et la durée de conservation au
réfrigérateur de la diète artificielle ...14 Tableau 3 : Résultats de la régression de poisson entre la mortalité larvaire et l’aération des contenants d’élevage ...15 Tableau 4 : Résultat de la régression logistique sur l’effet combiné du picéol et Btk sur la mortalité des larves de TBE ...16
vii
Remerciements
Je tiens à remercier mon directeur de recherche, le Dr Éric Bauce, de m’avoir donné l’opportunité de réaliser ce projet. Je le remercie pour son enseignement et son expertise, qui ont pleinement contribué à ma formation.
Je remercie sincèrement mon co-directeur, le Dr Christian Hébert, dont l’aide m’aura été indispensable. Son soutien, ses encouragements et sa disponibilité ont été essentiels à la réalisation de ce projet.
Merci au Dr Richard Berthiaume de m’avoir accordé son temps et ses conseils. Son appui tout au long du projet m’aura été très précieux.
Merci à Martin Charest pour son support technique, ainsi qu’à tous les auxiliaires de recherche qui ont eu la patience de m’aider à travers de longues et nombreuses expériences.
1
Introduction
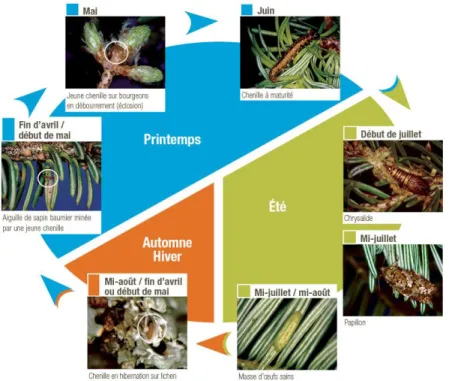
La tordeuse des bourgeons de l’épinette (TBE), Choristoneura fumiferana (Clemens) est le plus important insecte ravageur des forêts de conifères d’Amérique du Nord. Cet insecte produit une seule génération par année et son développement larvaire passe par six stades distinctifs (Martineau 1985) (Figure 1). Les œufs pondus sur les aiguilles des essences hôtes éclosent au milieu de l’été, puis les larves de premier stade se tissent un abri en soie, appelé hibernaculum, où elles effectuent leur première mue sans même avoir mangé (Miller 1963). Les larves passent alors l’hiver en diapause pendant leur deuxième stade larvaire, protégées par l’hibernaculum. Au printemps suivant, les larves de deuxième stade sortent de leur diapause et se nourrissent en minant les aiguilles du feuillage des années précédentes de leur hôte jusqu’à l’ouverture des bourgeons, moment où elles commencent à consommer les aiguilles de l’année courante. En se nourrissant ainsi du feuillage annuel de certains conifères, les larves de la TBE causent des dégâts importants à leurs hôtes. Le sapin baumier (Abies balsamea (L.) Mill.) est l’essence forestière subissant le plus de dommages, suivi de l’épinette blanche (Picea glauca (Moench) Voss), et, dans une moindre mesure, de l’épinette noire (Picea mariana (Mill.) B.S.P.) (Martineau 1985).
Figure 1 : Cycle de vie de la tordeuse des bourgeons de l'épinette, Choristoneura fumiferana (MFFP, 2019)
2
Généralement, la mortalité du sapin baumier a lieu après 4 ou 5 années de défoliation sévère (MacLean 1980). En s’attaquant ainsi aux principales essences commerciales, ce lépidoptère entraine des pertes considérables pour l’industrie forestière canadienne (Martineau 1985). Lors de l’apogée de la dernière épidémie, en 1975, un peu plus de 35 millions d’hectares de forêts ont été défoliés (MRNF 2005). L’épidémie actuellement en cours a déjà affecté plus de 8 millions d’hectares de forêts et elle progresse toujours (MFFP 2018). Le développement de nouvelles approches de lutte et l’optimisation des techniques existantes sont donc toujours nécessaires afin de limiter les dommages à venir ou de réduire les coûts de la protection.
Dans ce contexte, la mise à profit d’arbres naturellement résistants à la TBE pourrait s’avérer une excellente solution à long terme pour diminuer les pertes économiques. Les végétaux peuvent utiliser différents mécanismes pour se défendre contre les pathogènes et les herbivores (Bauce et Kumbaşli 2007, Freeman et Beattie 2008). Ces mécanismes de défense peuvent prendre la forme de barrières permanentes chez la plante, par exemple la présence de cire épicuticulaire ou d’une écorce épaisse, et sont dits alors constitutifs. Les mécanismes de défense induits sont quant à eux provoqués par l’activité alimentaire de l’herbivore et se traduisent par la production de composés chimiques nocifs pour l’insecte. Les composés chimiques impliqués dans ces mécanismes de défense sont des métabolites secondaires, c’est-à-dire des composés non essentiels à la croissance, au développement ou à la reproduction de la plante (Freeman et Beattie 2008). Ces composés sont souvent inclus dans un des trois grands groupes suivants : les terpènes, les phénols et les alcaloïdes (Freeman et Beattie 2008).
Au cours d’une épidémie localisée de TBE dans la région de Drummondville, une différence marquée a été constatée dans le niveau de défoliation de certaines épinettes blanches, suggérant que ces dernières possédaient un mécanisme de résistance naturel contre ce ravageur (Daoust et al. 2010). Les épinettes ayant moins de 10% de défoliation ont été considérées comme résistantes, et les épinettes ayant plus de 80% de défoliation comme sensibles (Bauce et Kumbaşli 2007). Le taux de mortalité des larves de TBE élevées sur le feuillage d’épinettes considérées comme résistantes a atteint 80% comparativement à seulement 42% pour les épinettes sensibles (Daoust et al. 2010).
L’étude du comportement des larves de la TBE a montré que celles-ci passaient plus de temps à inspecter les aiguilles des épinettes blanches résistantes avant de les consommer que celle des
3
épinettes sensibles (Daoust et al. 2010). En retirant la cire épicuticulaire des aiguilles, ce comportement d’inspection ne différait plus d’un type d’épinette à l’autre, ce qui indiquerait un effet dissuasif de la cire épicuticulaire ou des molécules qu’elle contient sur les larves de la TBE (Daoust et al. 2010). Or, les concentrations en monoterpènes dans la cire épicuticulaire se sont révélées beaucoup plus élevées chez les épinettes résistantes. En réalité, les concentrations en pinène et en myrcène, étaient respectivement 307 et 476% plus élevées chez les épinettes résistantes (Daoust et al. 2010). Ces composés pourraient être responsables de l’effet dissuasif de la cire épicuticulaire.
Toutefois, même sans cire épicuticulaire, la durée entre les repas était plus longue chez les larves se nourrissant d’épinettes résistantes, suggérant que leurs aiguilles seraient plus difficiles à digérer ou contiendraient des composés toxiques (Despland et al. 2011), en plus de l’effet dissuasif de leur cire épicuticulaire (Daoust et al. 2010). Or, le feuillage des épinettes résistantes contenait respectivement 20 et 27% de plus de composés phénoliques et de tannins (Daoust et al. 2010), dont les effets toxiques sur les insectes herbivores ont déjà été documentés (Kumbaşli 2005, Freeman et Beattie 2008). Finalement, deux autres composés phénoliques, le picéol (4’-hydroxy-acetophenone) et le pungénol (3’,4’-di(4’-hydroxy-acetophenone) ont également été retrouvés en concentrations significativement plus élevées dans le feuillage des épinettes blanches résistantes (Delvas et al. 2011).
Lorsqu’ajoutées à la diète artificielle, ces molécules combinées ont provoqué une diminution du taux de survie, une augmentation du temps de développement larvaire et une réduction du poids des chrysalides de la TBE (Delvas et al. 2011). Les concentrations maximales testées dans cette étude étaient le double des concentrations moyennes mesurées dans le feuillage des épinettes résistantes de la plantation de Drummondville en 2008, soit 6.7 et 5.4 mg/gsec pour le picéol et le pungénol respectivement (Delvas et al. 2011). Toutefois, Méndez Espinoza (2018) a montré que la concentration moyenne des acétophénones testés pouvait grandement varier chez les épinettes résistantes.
Dans les travaux de Parent et al. (2017), qui ont implanté des larves de la TBE sur des arbres contenant diverses concentrations de picéol et de pungénol, seul le temps de développement des femelles augmentait significativement avec la concentration des molécules, qui variait selon le gradient mesuré par Mageroy et al (2015), soit entre 0 et 18 mg/gsec. Méndez Espinoza (2018) a
4
également testé l’effet du picéol et du pungénol selon deux scénarios de synchronisme phénologique entre l’arbre et les larves de TBE. Dans le premier scénario, les larves ont été déposées sur les arbres juste avant leur débourrement, alors que les concentrations moyennes de picéol et de pungénol étaient respectivement de 10.4 et 6.5 mg/gsec. Aucun effet des molécules sur la mortalité larvaire n’a été détecté dans ce scénario et les arbres ont également subi d’importantes défoliations malgré la présence des molécules, soit 56% pour les arbres sans les molécules et 68% pour les arbres où elles étaient présentes. Dans le deuxième scénario, les larves ont été placées trois semaines après le débourrement, alors que les concentrations dans le feuillage annuel de picéol et de pungénol avaient atteint respectivement 21.8 et 12.6 mg/gsec. Dans ce scénario, seul le poids des femelles a été corrélé négativement aux concentrations des molécules. Cependant, dans ces deux scénarios d’élevages sur le terrain, les jeunes larves n’avaient pas miné le feuillage de l’année précédente des arbres résistants, feuillage reconnu pour contenir de fortes quantités de de picéol et de pungénol.
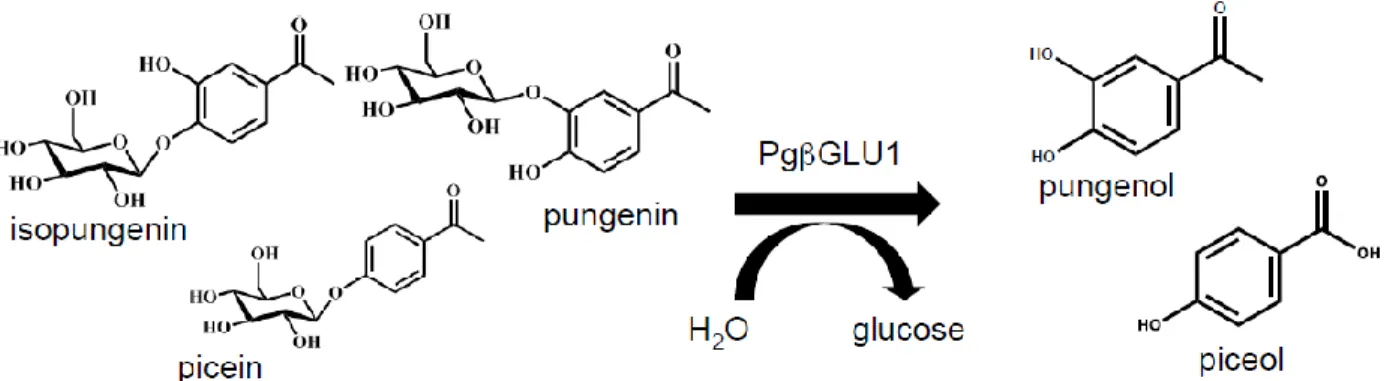
La production de ces deux molécules provient de l’action d’une enzyme sur deux aglycones, la pungénine et la picéine, présents chez toutes les épinettes blanches (Mageroy et al. 2017) (Figure 2). Cette enzyme est elle-même codée par un gène en particulier, le gène Pgβglu-1, dont le niveau d’expression est jusqu’à 1000 fois plus élevé chez les épinettes résistantes que chez les épinettes sensibles (Mageroy et al. 2015). Le gène Pgβglu-1 étant héréditaire (Mageroy et al 2015), cette découverte pourrait être mise à profit dans des programmes de production d’arbres résistants pour le reboisement.
Figure 2 : Structure des deux acétophénones et de leur aglycone (Mageroy et al. 2017)
Ces découvertes ont mené à l’étude du potentiel des épinettes blanches contenant du picéol et du pungénol pour lutter contre la TBE à grande échelle. Les travaux de Delvas et al. (2011) ont
5
détecté uniquement un allongement du temps de développement des mâles lorsque le pungénol était additionné seul à la diète artificielle. Lorsqu’additionné au picéol, le pungénol amplifiait les effets du picéol sur le développement de la TBE.
En conséquence, la présente étude s’est principalement concentrée sur les effets potentiels du picéol et ses interactions avec le Btk dans la lutte contre la TBE. Idéalement, cette molécule devrait être compatible avec le seul moyen actuellement utilisé pour lutter contre la TBE au Québec. Le Bt est une bactérie présente naturellement dans l’environnement et elle s’est révélée être un agent de lutte biologique efficace contre de nombreux lépidoptères grâce à ses propriétés entomopathogènes (Schnepf et al. 1998). Son efficacité est due au cristal protéique synthétisé par la bactérie lors de sa sporulation (Schnepf et al. 1998). Ces cristaux, une fois ingérés par la larve, se dissolvent et libèrent une δ endotoxine grâce à l’alcalinité du milieu intestinal de l’insecte. Cette toxine est ensuite activée par des enzymes spécifiques et peut alors se fixer à des récepteurs de l’intestin (Schnepf et al. 1998). Les dommages qui s’ensuivent à la paroi intestinale causent l’arrêt immédiat de l’alimentation. Si les dommages intestinaux sont importants, la mort de l’insecte surviendra 2 à 3 jours après l’ingestion du produit (Retnakaran et al. 1983). Si la larve survit à l’ingestion du Bt, des effets sous-létaux sont observés, tels qu’une augmentation du temps de développement, une réduction du poids des chrysalides et une baisse de la fécondité (Van Frankenhuyzen 1990, Pedersen et al. 1997, Bauce et al. 2002).
Toutefois, il a été démontré que pour certaines espèces, une alimentation comportant des composés phénoliques pouvait fortement modifier l’effet du Bt (Brewer et Anderson 1990, Bauce et al. 2006, Martemyanov et al. 2016). Chez le tournesol par exemple, la présence d’acide caféique réduit son efficacité sur la pyrale du tournesol (Homoeosoma electellum (Hulst)), alors que l’acide cinnamique l’augmente (Brewer et Anderson 1990). L’augmentation de l’efficacité du
Bt peut être expliquée grâce à la combinaison de stress induits par les différents produits
(Sivamani et al. 1992) affectant directement la vigueur de l’insecte, et donc sa capacité de récupération. De plus, certains composés phénoliques causent également des lésions intestinales, ce qui augmenterait le risque de septicémie (Brewer et Anderson 1990). À l’inverse, le Bt serait moins efficace si ces composés interfèrent directement avec les cristaux ou si leur propriété antibactérienne réduit le risque de septicémie (Merdan et al. 1975, Kumbaşli 2005). Or, le picéol
6
possède justement certaines propriétés antibactériennes (Stalheim et al. 2009), et pourrait donc interférer avec l’efficacité du Bt.
Les objectifs de cette étude sont 1) de valider l’effet toxique du picéol et du pungénol sur les larves de TBE à l’aide d’une méthode d’administration directe, 2) de déterminer si les conditions d’élevage, notamment l’utilisation de la diète artificielle, influence la mortalité engendrée chez la TBE au laboratoire et 3) d’évaluer les interactions possibles entre le picéol et le Btk.
7
Matériel et méthodes
Les larves de la TBE ont été obtenues du service de production d’insectes du Service Canadien des Forêts à Sault Les larves de la TBE ont été obtenues du service de production d’insectes du Service Canadien des Forêts à Sault-Sainte-Marie en Ontario, au deuxième stade larvaire et en fin de diapause. Elles sont expédiées dans des pièces de coton fromage dans lequel elles ont tissé leur
hibernaculum et ont été maintenues à 4°C jusqu`à ce qu’elles soient placées en chambre de
croissance à 23°C, 50% HR, et à une photopériode de 16L:8N. Une fois les larves sorties de diapause, elles ont été placées à la densité désirée pour chacune des différentes expériences dans des contenants de plastique (Solo Cup, Canada) de 1 ¼ oz, contenant environ 5 g de diète artificielle (McMorran 1965). La diète artificielle a été préparée dans une bouilloire à vapeur de 10 L de type Groen, permettant de maintenir le mélange à une température de 55°C afin d’éviter qu’il ne fige pendant sa fabrication. Une fois le mélange homogène, la diète est coulée dans des contenants en plastiques de 1 ¼ oz et peut être utilisée une fois refroidit. Elle peut aussi être entreposée au congélateur pour être utilisée ultérieurement. Elle est alors coulée dans des contenants de 450 g. Dans cette situation, la diète est, dans un premier temps, décongelée à température ambiante et à la noirceur. Puis, afin de pouvoir la couler dans les contenants de 1¼ oz, chaque contenant de 450g diète est reliquéfiée au micro-onde, en agitant le mélange à toutes les 4 minutes jusqu’à la dissolution complète des grumeaux, ce qui a pour conséquence de faire monter sa température au-dessus de 75°C. La diète est ensuite refroidie à la température de la pièce jusqu’à une température de 55°C pour y incorporer les vitamines et le picéol si nécessaire, puis elle est coulée dans les contenants en plastique de 1¼ oz.
Expérience 1 : Effet direct du picéol et du pungénol, administrés en solution
Le picéol et le pungénol ont été achetés chez Sigma-Aldrich (Oakville, ON, Canada) et TCI America (Portland, OR, USA) respectivement. Les solutions de picéol et de pungénol ont été obtenues en solubilisant les molécules dans de l’éthanol à 95% jusqu’à saturation, soit 150 mg de chacune des molécules dans 1 ml d’éthanol. Elles ont ensuite été diluées à l’aide d’une solution tampon (pH 8) afin de réduire la concentration en éthanol à 9.5%. La solution tampon contenait également 0.01% de Triton X-100 comme agent tensioactif, 0,2 % de bleu de bromothymol pour
8
que les gouttes de solution soient bien visibles et une concentration de 25 mM de sucrose pour inciter les larves à boire. Quatre solutions ont été utilisées, soit une solution à 15 mg.ml-1 , une solution de 15 mg.ml-1 de pungénol, une solution contenant à la fois 15 mg.ml-1 de picéol et de pungénol, ainsi qu’une solution témoin ne contenant que la solution tampon, le triton X-100, le bleu de bromothymol, le sucrose et 9.5% d’éthanol.
Environ 500 larves ont été élevées sur de la diète artificielle, réalisée le jour même de la mise en élevage, à une densité variant de 15 à 30 individus par contenant de 1¼ oz. Les traitements ont par la suite été réalisés avec des larves au 4e stade larvaire préalablement mises à jeun pendant 24 h, selon la méthode développée par Van Frankenhuyzen et al. (1997). Cette technique consiste à placer une goutte de 0.125 µl de solution dans un microtube de 50 µl à l’aide d’un microdoseur Cole Parmer et d’une seringue en verre de type Hamilton. Cinquante larves par traitement ont ensuite été insérées individuellement dans les microtubes puis placées à l’envers sous une source lumineuse, pour inciter les larves à monter vers la goutte. Les larves sont laissées dans les microtubes jusqu’à absorption complète de la goutte avant d’être retournée individuellement sur la diète. La mortalité a été évaluée deux semaines après le traitement.
Expérience 2 : Effet des protocoles d’élevage sur l’efficacité du picéol
Plusieurs paramètres d’élevage ont été testés afin de vérifier s’ils pouvaient influencer les effets du picéol sur la mortalité des larves de la TBE. Ainsi, nous avons comparé l’efficacité du picéol lorsqu’utilisé avec de la diète fraîche versus de la diète congelée et reliquéfiée. Nous avons également testé l’effet de la conservation de la diète au réfrigérateur pour différentes périodes de temps. Finalement, l’effet de l’aération des contenants d’élevage a également été vérifié.
Les différentes variations des protocoles sont décrites ci-dessous :
Effet de la congélation et du chauffage de la diète : Comme décrit précédemment, deux
protocoles ont été testés, soit un premier protocole où la diète est maintenue à 55°C pendant tout le processus de fabrication puis coulée directement dans les contenants de 1¼ oz en plastiques. Le deuxième protocole implique que la diète ait d’abord été congelée dans des contenants de 450 g pendant 24 h avant d’être décongelée puis reliquéfiée au micro-onde, ce qui implique que la température de la diète soit montée au-dessus de 75°C.
9
Les larves ont été placées individuellement dans les contenants juste après que la diète ait figé, et les couvercles ont été percés de deux trous d’aiguille pour permettre l’aération. Quatre doses de picéol ont été utilisées, soit 0, 50, 100 et 150 mg/gsec, pour chaque protocole de fabrication. Un total de 60 larves (1 larve/contenant) par traitement a été utilisé pour un total de 480 larves. La mortalité des individus a été enregistrée après trois jours.
Effet de la durée de conservation : La diète a été maintenue à 55°C pendant le processus
de fabrication et le picéol a été ajouté en dernier, juste avant que la diète ne fige. La diète a été coulée dans des contenants de plastique de 1 ¼ oz et placée au réfrigérateur (4°C) pendant 0, 3 et 6 jours. Les couvercles des contenants d’élevage ont été percés de deux trous d’aiguille. Deux doses de picéol ont été utilisées, soit un témoin et 50 mg/gsec, Soixante larves par traitement ont été utilisées pour un total de 360 larves. La mortalité des individus a été enregistrée après trois jours d’exposition aux différents traitements.
Effet de l’aération : La diète a été maintenue à 55°C pendant le processus de fabrication et
n’a jamais été congelée avant d’être transvasée dans les contenants de plastique de 1 ¼ oz. Les couvercles de plastique ont été percés pour générer trois niveaux d’aération : aucune (couvercle non percé), standard (2 trous d’aiguille), et forte (une vingtaine de trous d’aiguille). Les larves ont été placées individuellement dans les contenants juste après que la diète ait figé. Deux doses de picéol ont été utilisées dans cette expérience, soit un témoin et 50 mg/gsec. Un total de 60 larves par traitement (1 larve/contenant) a été utilisé pour un total de 360 larves. La mortalité des individus a été enregistrée après trois jours. Lors de cette expérience, la diète a également été analysée au HPLC afin de vérifier si la concentration en picéol variait dans le temps.
Expérience 3 : Interaction entre le Btk et le picéol
Environ 400 larves ont été élevées entre le 2e et le 4e stade larvaire à une densité de deux larves par contenant, sur de la diète artificielle contenant ou non du picéol et dont la recette originale a été modifiée pour y enlever l’auréomycine, qui pourrait interférer avec le Btk (Van Frankenhuyzen et al. 2009). Les taux d’azote ont donc été ajustés en ajoutant de la caséine afin de
10
compenser la perte d’azote contenu dans l’auréomycine. La diète artificielle a d’abord été congelée 24 h puis réchauffée au micro-onde afin de la verser dans les contenants de plastique de 1¼ once. L’expérience a été réalisée avec des doses de 0, 20 et 40 mg/gsec de picéol.
Le traitement au Btk, réalisé avec la formulation Foray 76B (Valent BioSciences), a été administré aux larves selon la méthode décrite dans l’expérience 1 (goutte de 0.125 µl dans un microtube). Les concentrations de Btk utilisées correspondaient à la DL50, qui a été estimée à 6 IU/µl (test préliminaire) ainsi qu’un témoin ne contenant que la solution tampon. La mortalité des individus a été évaluée tous les jours jusqu’à ce que toutes les larves aient recommencé à s’alimenter.
Dispositif expérimental et analyses statistiques
Chacune des larves a été suivie individuellement et la larve est donc considérée comme l’unité expérimentale. Les expériences ont été construites en plans entièrement aléatoires. Les larves au deuxième stade larvaire ont été distribuées aléatoirement dans chacun des traitements.
À l’exception de la première expérience, des dispositifs factoriels ont été utilisés afin de tester les effets simples de molécules, des conditions d’élevage et du Btk ainsi que leurs interactions. Les effets des traitements sur la mortalité des larves de TBE ont été analysés avec le logiciel SAS (SAS Institute, 2003). Un modèle linaire généralisé avec distribution de poisson et tableau de contingence a été utilisé (proc genmod).
11
Résultats
Expérience 1 : Effet du picéol et du pungénol en solution
La mortalité des larves de TBE ayant été forcées de consommer des extraits de picéol, de pungénol ou une combinaison des deux molécules dans une solution n’est pas significativement différente de celle des larves témoins (picéol df=1, χ2=0.01, p=0,9068; pungénol : df=1, χ2=0.23, p=0.6328; picéol et pungénol : df=1, χ2=0.13, p=0.7219). Dans le traitement témoin la mortalité atteint 18.9% (Figure 3)
Figure 3 : Effet du picéol, du pungénol et des deux molécules combinées en solution sur la mortalité des larves de la TBE après 14 jours. Une concentration de 15mg/ml pour les deux molécules a été utilisée. n = 36 n = 33 n = 36 n = 34 0 10 20 30 40
Témoin Piceol Pungenol Piceol et pungenol
M or tal it é (% ) Traitements
12
Expérience 2 : Effet des protocoles d’élevage sur l’efficacité du picéol
L’effet du picéol sur la mortalité des larves de TBE est significativement différent lorsque la diète utilisée est fraîche ou réchauffée après congélation (Tableau 1; Figure 3). En effet, le taux de mortalité des larves élevées sur diète artificielle ayant été réchauffée après congélation ne dépasse jamais 20% pour toutes les concentrations en picéol et atteint seulement 3% pour le témoin (Figure 4). En revanche, si la diète est utilisée fraîche, une concentration de 50 mg/gsec de picéol entraine une mortalité de 48%, alors qu’une concentration de 150 mg/gsec permet d’atteindre 98% de mortalité (Figure 4). En absence de picéol, seulement 12% des larves sont mortes lorsqu’élevées sur une diète fraîche.
Tableau 1 : Résultats de la régression de poisson entre la mortalité larvaire après 3 jours et le processus de fabrication de la diète (n=60).
Traitement D.l. χ2 P(>Chi)
Picéol 3 11.71 0.0084
Congélation et chauffage de la diète 1 2.55 0.1100
13
Figure 4 : Interaction entre le protocole de fabrication de la diète et la concentration en picéol sur la mortalité des larves de TBE après 3 jours (n=60)▲ Diète gardée à une température de 55°C ● Diète congelée puis chauffée à une température supérieure à 75°C.
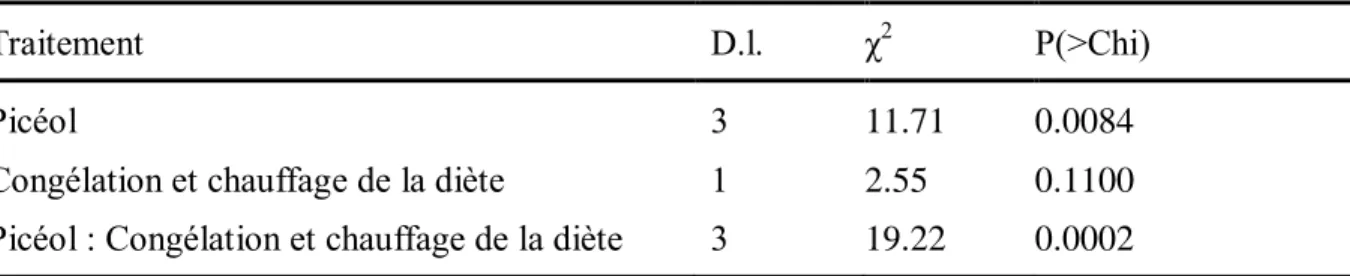
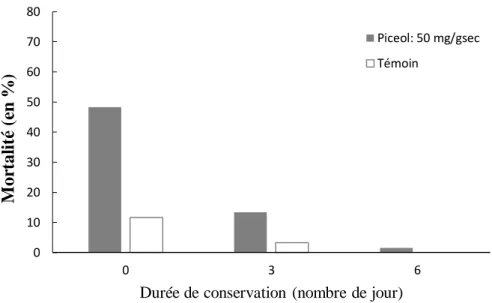
Le temps de conservation de la diète au réfrigérateur a entrainé une diminution de la mortalité des larves exposées au picéol, passant de 48% lorsque la diète contenant du picéol était fraîche à 2%, lorsque la diète avait été entreposée pendant six jours au réfrigérateur (Figure 5). Le temps de conservation de la diète influence aussi le niveau de mortalité du traitement témoin passant de 12% lorsque la diète est fraîche à 0% avec de la diète entreposée pendant six jours au réfrigérateur. Par ailleurs, l’ajout de picéol dans la diète entraine significativement plus de mortalité (χ2=3.88; df=1; p=0.0489) que dans le traitement témoin (Figure 5). Les résultats du HPLC ont montré que la concentration en picéol dans la diète artificielle restait stable dans le temps, soit 50 mg/gsec,.
0 10 20 30 40 50 60 70 80 90 100 0 20 40 60 80 100 120 140 160 M or tal it é (e n % )
14
Figure 5 : Effet du picéol et de la durée de conservation de la diète sur la mortalité des larves de TBE après 3 jours (n=60)
Tableau 2 : Résultats de la régression de poisson entre la mortalité larvaire après 3 jours et la durée de conservation au réfrigérateur de la diète artificielle (n=60).
Traitement D.l. χ2 P(>Chi)
Picéol 1 3.88 0.0489
Durée de conservation 2 20.81 <0.0001
Picéol : Durée de conservation 2 0.79 0.6750
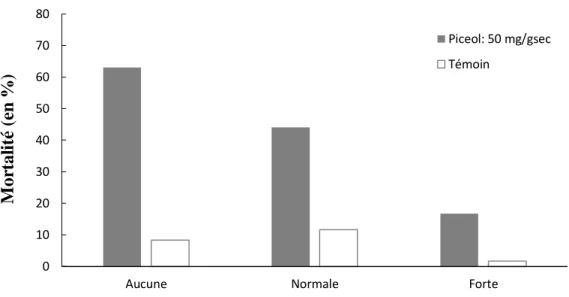
L’effet du picéol est hautement significatif dans cette expérience, et l’aération des contenants d’élevage entraine une diminution de la mortalité des larves de TBE (Tableau 3). Pour une concentration de 50 mg/gsec de picéol, la mortalité a atteint 16±5% lorsque les contenants étaient fortement aérées, comparativement à 63±6% lorsque les contenants n’étaient pas ventilés (Figure 5). Par ailleurs, pour les trois niveaux d’aération testés, l’ajout de picéol dans la diète entraine significativement plus de mortalité que dans le traitement témoin (Figure 6).
0 10 20 30 40 50 60 70 80 0 3 6 M or tal it é (e n % )
Durée de conservation (nombre de jour)
Piceol: 50 mg/gsec Témoin
15
Figure 6 : L’effet du picéol et de l’aération des contenants d’élevage sur la mortalité des larves de TBE après 3 jours (n=60)
Tableau 3 : Résultats de la régression de poisson entre la mortalité larvaire de la tordeuse des bourgeons de l’épinette et l’aération des contenants d’élevage et la présence de picéol.
Traitement D.l. χ2 P (>Chi)
Picéol 1 14.93 0.0001
Aération 2 6.25 0.0439
Picéol : Aération 2 1.44 0.4877
Expérience 3 : Interaction entre le picéol et le Btk
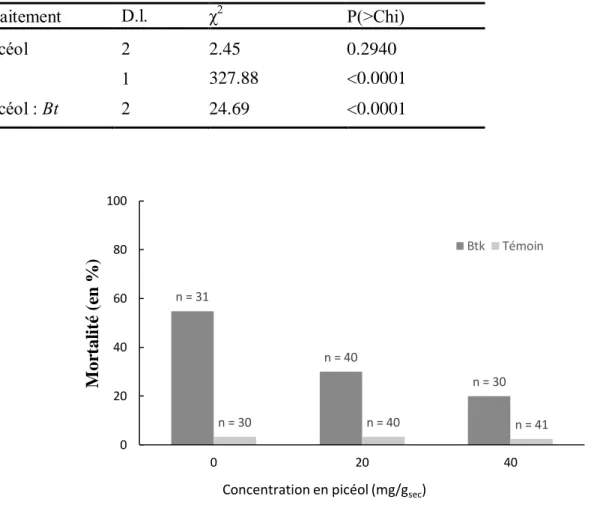
L’ajout du picéol dans la diète artificielle a provoqué une diminution significative de la mortalité des larves de TBE auxquelles avait été administré du Btk (Tableau 4), passant de 55% pour le témoin (sans ajout de picéol) à 30% et 20% lorsque 20 et 40 mg/gsec étaient ajoutés à la diète artificielle respectivement. Moins de 4% des larves n’ayant pas absorbé de Btk sont mortes, peu importe la concentration de picéol dans la diète. L’expérience ayant été réalisée sur des larves au quatrième stade larvaire et la diète ayant été congelée puis réchauffée dans cette expérience, ce résultat est donc cohérent avec celui de la deuxième expérience.
0 10 20 30 40 50 60 70 80
Aucune Normale Forte
M or tal it é (en % )
Niveau d’aération des contenants de ¼ once
Piceol: 50 mg/gsec Témoin
16
Tableau 4 : Résultat de la régression de poisson sur l’effet combiné du picéol et Btk sur la mortalité des larves de la tordeuse des bourgeons de l’épinette
Traitement D.l. χ2 P(>Chi)
Picéol 2 2.45 0.2940
Bt 1 327.88 <0.0001
Picéol : Bt 2 24.69 <0.0001
Figure 7 : Effets combinés du picéol et du Btk (appliqué à une dose de 0.75 µl/larve) chez les larves de la tordeuse des bourgeons de l’épinette (pourcentages ± S.E)
n = 31 n = 40 n = 30 n = 30 n = 40 n = 41 0 20 40 60 80 100 0 20 40 M or tal it é (e n % )
Concentration en picéol (mg/gsec)
17
Discussion
Les doses utilisées dans l’expérience sur l’ingestion du picéol et du pungénol en solution n’ont généré aucune mortalité significative chez les larves de TBE, tandis que l’incorporation du picéol dans la diète artificielle a entrainé, dans certaines circonstances, une hausse de mortalité comparable à celle obtenue dans les travaux précédents (Delvas et al. 2011). Toutefois, les variations dans la préparation de la diète artificielle et l’entreposage subséquent de cette dernière ont influencé les résultats obtenus. En effet, le fait de réchauffer après congélation la diète artificielle, de l’entreposer au réfrigérateur pendant une certaine période de temps ou d’aérer ou non les contenants de plastique dans lesquels sont élevées les larves ont tous influencé les taux de mortalité des larves.
Il est courant de congeler la diète artificielle jusqu’à deux mois sans que sans que sa valeur nutritive, soit la proportion en sucre et azote, ne soit affectée (Sylvie Lemieux, communication personnelle), mais la chaleur peut entrainer plusieurs modifications de la diète En effet, un changement de texture ou de goût peut avoir lieu et certains éléments nutritifs peuvent être détruits, tandis que la digestibilité des protéines augmente avec la température (Cohen 2004). De plus, lorsque la température dépasse 60°C, les enzymes responsables de l’oxydation de la diète, comme la polyphenol-oxydase ou la lipo-oxygenase, sont détruites (Cohen 2004). Ce dernier point peut avoir un rôle critique dans l’évaluation de la toxicité du picéol, car plusieurs auteurs mentionnent que les composés phénoliques ont besoin d’une activation oxydative pour être pleinement efficaces comme moyens de défense (Appel 1993, Felton et Summers 1993, Bi et Felton 1995). En effet, lors de l’oxydation phénolique, il y a production de dérivés réactifs de l'oxygène, qui peuvent causer des dommages importants aux cellules par l'inactivation des enzymes, la peroxydation des lipides membranaires ou la rupture de brins dans l'ADN (Appel 1993). Le potentiel oxydatif du milieu devient donc un facteur primordial pour étudier la possible toxicité d’un composé phénolique. Il est donc possible que dans le cas de la deuxième expérience, où le chauffage de la diète après sa congélation interfère avec l’efficacité du picéol, la dénaturation des enzymes par la chaleur ait empêché l’activation oxydative du picéol et que la diète artificielle soit ainsi restée non toxique pour les larves de TBE. En revanche, lorsque la température de la diète est maintenue à 55° C pendant son processus de fabrication, les enzymes
18
restent actives et l’ajout du picéol dans la diète peut alors provoquer une cascade de réactions chimiques, incluant la peroxydation des lipides. La diète artificielle est en effet extrêmement sensible à ce phénomène, qui entraine non seulement une perte de valeur nutritive de la diète, mais également la production de nombreuses toxines, par exemple de l’acide butanoïque ou pentanoïque (Cohen 2004). De plus, en présence d’ions métalliques, la réaction de peroxydation entraine la production de gaz hydrocarbures, tel que du pentane et de l’éthane (Halliwell et Susanna 1993). La production de ces gaz hydrocarbures pourrait être responsable de la mortalité rapide des larves des contenants non ou peu ventilés. La production de gaz pourrait s’arrêter suite à l’épuisement du réactif limitant, ce qui pourrait expliquer la baisse de la mortalité lors de l’entreposage de la diète au réfrigérateur pendant plusieurs jours. Considérant l’hypothèse d’une sensibilité de la diète artificielle à ces réactions chimiques, une étude pourrait mesurer la quantité de produits de peroxydation des lipides et de dérivés oxydatifs de l’oxygène présents dans la diète suite à l’ajout du picéol.
De plus, si le procédé de fabrication de la diète artificielle peut faire varier le potentiel oxydatif du milieu et éventuellement l’efficacité du picéol, cet effet pourrait être encore plus important sur un milieu d’alimentation plus complexe comme le feuillage naturel. En effet, la quantité d’enzymes foliaires ou microbiennes présentes, la quantité d’oxydants, le pH et les conditions redox de l’intestin de l’insecte sont autant de facteurs pouvant faire varier le potentiel oxydatif (Appel 1993). Ainsi, Appel (1993) mettait en garde contre l’utilisation de la diète artificielle dans l’étude de l’activité de composés phénoliques, à moins d’y ajouter les mêmes enzymes foliaires et oxydants présents naturellement dans l’arbre hôte. Ainsi, les résultats de la première expérience montrent que le picéol et le pungénol n’ont pas d’effet direct sur la mortalité des larves de la TBE lors d’une acquisition ponctuelle de dose. Cependant, il est possible que des larves nourries de feuillage plutôt que de diète artificielle, ou des larves n’ayant pas été préalablement mise à jeun, soient plus sensibles aux molécules, en raison d’un potentiel oxydatif différent. Il est aussi possible que l’absorption forcée d’une dose ponctuelle de picéol par le système d’alimentation utilisé dans cette étude soit peu représentative de l’acquisition des doses résultant de l’alimentation en continu de l’insecte sur le feuillage.
19
développement des femelles ont été corrélés avec les concentrations de picéol et de pungénol présent dans le feuillage (Parent et al. 2017, Méndez Espinoza 2018). Lors de ces études, les larves avaient été déposées sur le feuillage après ou juste avant le débourrement des pousses annuelles de l’arbre. Or les concentrations de picéol dans le feuillage annuel n’augmentent que vers le début du mois de juillet (Parent et al. 2017), soit vers la fin du sixième stade larvaire de la TBE. Il est donc possible que si les larves avaient été déposées plusieurs semaines avant le débourrement, elles aient été forcées de se nourrir du feuillage de l’année précédente, plus concentré en picéol, et les résultats auraient pu être différents. Ainsi, dans le dispositif d’élevage de terrain effectué par Bauce et Kumbasli (2007) sur plusieurs années, documenté aussi par Daoust et al (2010) et analysé au niveau du picéol et du pungénol par Delvas et al (2011), lorsque les insectes sont installés deux semaines avant le débourrement (période normale de sortie de diapause sur le terrain) sur des arbres résistants à haute teneur en picéol et pungénol versus des arbres non résistants à faible teneur en picéol et pungénol, de fortes corrélations négatives sont détectées entre ces composés de défenses et la mortalité larvaire.
Plusieurs mécanismes de résistance peuvent être impliqués dans la résistance à la TBE des phénotypes d’épinettes blanches documentées dans le dispositif de Drummondville (Bauce et Kumbasli 2007). Tout comme dans le cas de la tordeuse occidentale de l’épinette (Choristoneura
occidentalis (Freeman)) (Cates et al. 1983, Nealis et Nault 2005), les monoterpènes contenus
dans les arbres hôtes de la TBE constituent des facteurs de résistance importants contre cet insecte, puisque ces composées sont toxiques et dissuasifs pour la TBE (Daoust et al. 2010, Kumbasli et Bauce 2013). De plus, la concentration totale en composés phénoliques était également plus élevée (Daoust et al. 2010). Les tannins et les flavonoïdes peuvent également contribuer à la résistance de ces épinettes blanches (Freeman et Beattie 2008). Ces épinettes blanches semblent combiner différente mécanismes pour atteindre un niveau de résistance contre la TBE. La production de métabolites secondaires a un coût énergétique important pour l’arbre (Freeman et Beattie 2008) et il faut que le degré de résistance des épinettes blanches soit suffisamment élevé pour compenser ce coût. De plus, plusieurs espèces de lépidoptères sont capables de s’adapter à certains composés toxiques, par exemple à l’aide d’enzymes détoxifiantes (David et al. 2007). Il est donc probable que l’utilisation optimale d’arbres résistants passe par la sélection d’arbres synthétisant une combinaison de composés chimiques, certains dissuasifs et d’autres toxiques, plutôt que sur l’utilisation unique d’un type de composé.
20
Finalement, les résultats montrent que l’efficacité du Btk est diminuée sur des larves se nourrissant de diète artificielle contenant du picéol. Cette réduction de l‘efficacité pourrait être dû à une interaction purement chimique des molécules ou à une diminution du risque de septicémie dû aux propriétés antibactériennes du picéol (Stalheim et al. 2009). En effet, l’efficacité du Btk, en tant qu’insecticide bactérien, est corrélée à la quantité de composés antibactériens contenus dans l’alimentation de l’insecte (Merdan et al. 1975). Il est donc possible que les larves se nourrissant d’épinettes blanches contenant de fortes concentrations en picéol soient plus tolérantes au Btk. Cette situation est déjà démontrée pour les tannins présent dans le feuillage de l’épinette blanche qui désactivent le caractère pathogénique du Btk (Bauce et al. 2006).
Dans les travaux de Donkor (2018), le poids des larves se nourrissant de feuillage était significativement plus élevé que les larves se nourrissant de diète artificielle, indiquant une meilleure qualité nutritive du feuillage. Or, la qualité de l’alimentation de l’insecte influence les performances biologiques de ce dernier et par conséquent sa capacité de récupération des effets du Btk (Sivamani et al. 1992, Bauce et al. 2002). De plus, la recette de la diète artificielle est parfois modifiée pour y enlever l’auréomycine, et ne contient donc aucun antibiotique. Pourtant, les conifères contiennent de nombreux composés aux propriétés antibactériennes (Pang 2010). Il a déjà été démontré que les spores de Btk ne se développaient pas dans des extraits de sapin baumier ou même dans les sucs intestinaux de TBE se nourrissant de sapin baumier (Smirnoff 1974, Pang 2010). Le risque de septicémie est donc plus faible dans le cas d’une larve se nourrissant de sapin baumier que dans le cas d’une larve se nourrissant de diète artificielle. Finalement, le microbiote (l’ensemble des micro-organismesformant la faune intestinal de l’insecte) de l’insecte peut également avoir un effet sur l’efficacité du Btk (Pietri et Liang 2018). D’autres bactéries présentes naturellement dans l’intestin de l’insecte, telles qu’Enterococcus spp
ou Enterobacter spp., peuvent provoquer des septicémies, ce qui augmente l’efficacité du produit
(Dubois et Dean 1995, Broderick et al. 2006, Mason et al. 2011). À l’inverse, certaines bactéries présentes l’intestin de l’insecte et variant selon le type d’alimentation peuvent contribuer à la défense de l’insecte contre l’insecticide, en augmentant l’efficacité du système immunitaire ou en produisant elles-mêmes des estérases, pouvant détoxifier la toxine du Btk (Pietri et Liang 2018). Le microbiote joue donc un rôle non négligeable dans l’efficacité de plusieurs insecticides (Pietri et Liang 2018). Or, chez les larves de la TBE, la communauté bactérienne est acquise par leur alimentation, plus que par les parents, et les larves se nourrissant de diète artificielle possèdent un
21
microbiote très différent de celui des larves sauvages (Landry et al. 2015). Tous ces facteurs rendent la prédiction du niveau de susceptibilité d’une communauté de TBE au Btk particulièrement difficile, mais une meilleure compréhension des mécanismes d’actions du Btk
22
Conclusion
La découverte d’épinettes blanches naturellement résistantes est une belle opportunité pour la lutte contre les ravageurs forestiers. Néanmoins, dans un contexte de lutte contre la TBE, la recherche sur ces épinettes ne devrait pas se concentrer uniquement sur les deux acétophénones étudiés dans ce projet. L’absorption directe de doses ponctuelles de picéol et de pungénol ne provoque pas de mortalité chez les larves de TBE, et la toxicité du picéol contre la TBE soumises à une exposition chronique au produit varie selon les conditions d’élevage. Ainsi, d’autres études se concentrant sur la biochimie de ces molécules permettront d’améliorer la compréhension des mécanismes impliqués, autant en laboratoire que sur le terrain.
En conditions de laboratoire, le picéol interfère négativement avec l’insecticide bactérien Btk. L’efficacité du Btk dépend toutefois de très nombreux facteurs, dont un très grand nombre est relié à l’alimentation de l’insecte et à la composition chimique complexe du feuillage des arbres hôtes. Ainsi, les effets du Btk sur des larves d’élevage se nourrissant de diète artificielle peuvent donner de bonnes indications sur les effets simples entre certaines variables, mais les résultats doivent être utilisés avec précaution et validés sur le terrain où certaines variables peuvent supplanter les effets documentés en laboratoire. Afin de pouvoir améliorer la prédiction des effets de l’application de l’insecticide, d’autres études devraient donc se consacrer à la compréhension des mécanismes d’action de la bactérie et de ses interactions avec la complexité
23
Références
Appel, H. M. 1993. Phenolics in ecological interactions: The importance of oxidation. J. Chem. Ecol. 19: 1521‑1552.
Bauce, É., Y. Bidon, et R. Berthiaume. 2002. Effects of food nutritive quality and Bacillus
thuringiensis on feeding behaviour, food utilization and larval growth of spruce budworm Choristoneura fumiferana (Clem.) when exposed as fourth- and sixth-instar larvae. Agric.
For. Entomol. 4: 57‑70.
Bauce, É., et M. Kumbaşli. 2007. Natural resistance of fast growing white spruce, Picea glauca (Moench), trees against spruce budworm, Choristoneura fumiferana (Clem.), p. 17‑19. Dans Bottlenecks, Solut. Priorities Context Funct. For. Resour. Proc. Int. Symp. Istanbul, Turkey. Bauce, É., M. Kumbasli, K. Van Frankenhuyzen, et N. Carisey. 2006. Interactions among white
spruce tannins, subsp. kurstaki, and spruce budworm (Lepidoptera: Tortricidae), on larval survival, growth, and development. J. Econ. Entomol. 99: 2038‑2047.
Bi, J. L., et G. W. Felton. 1995. Foliar oxidative stress and insect herbivory: Primary compounds, secondary metabolites, and reactive oxygen species as components of induced resistance. J. Chem. Ecol. 21: 1511‑1530.
Brewer, G. J., et M. D. Anderson. 1990. Modification of the effect of Bacillus thuringiensis on sunflower moth (Lepidoptera : Pyralidae) by dietary phenols. J. Econ. Entomol. 83: 2219‑2224.
Broderick, N. A., K. F. Raffa, et J. Handelsman. 2006. Midgut bacteria required for Bacillus
thuringiensis insecticidal activity. Proc. Natl. Acad. Sci. 103: 15196‑15199.
Cates, R. G., R. Redak, et C. B. Henderson. 1983. Natural product defensive chemistry of Douglas‐fir, Western spruce budworm success, and forest management practices. Zeitschrift für Angew. Entomol. 96: 173‑182.
Cohen, A. C. 2004. Insect diets: science and technology. CRC Press. 473p.
Daoust, S. P., B. J. Mader, É. Bauce, E. Despland, A. Dussutour, et P. J. Albert. 2010. Influence of epicuticular-wax composition on the feeding pattern of a phytophagous insect: implications for host resistance. Can. Entomol. 142: 261‑270.
David, J., C. Gallet, et L. Despre. 2007. The evolutionary ecology of insect resistance to plant chemicals. Trends Ecol. Evol. 22: 298‑307.
Delvas, N., É. Bauce, C. Labbé, T. Ollevier, et R. Bélanger. 2011. Phenolic compounds that confer resistance to spruce budworm. Entomol. Exp. Appl. 141: 35‑44.
Despland, E., M. Gundersen, S. P. Daoust, B. J. Mader, N. Delvas, P. J. Albert, et É. Bauce. 2011. Taste receptor activity and feeding behaviour reveal mechanisms of white spruce natural resistance to eastern spruce budworm Choristoneura fumiferana. Physiol. Entomol. 36:
24 39‑46.
Donkor, D. 2018. How Choristoneura fumiferarana detoxify host plant toxins? Mémoire de maîtrise, Université Laval Québec 72p.
Dubois, N. R. et D. H. Dean. 1995. Synergism between CryIA insecticidal crystal proteins and spores of Bacillus thuringiensis, other bacterial spores, and vegetative cells against
Lymantria dispar (Lepidoptera: Lymantriidae) larvae. Environ. Entomol. 24: 1741‑1747.
Ennis, D. E., B. J. Mader, K. Burnside, É. Bauce, et E. Despland. 2015. Is feeding behaviour on foliage affected by lab-rearing on artificial diet ? J. Insect Behav. 28: 147‑156.
Felton, G. W., et C. B. Summers. 1993. Potential role of ascorbate oxidase as a plant defense protein against insect herbivory. J. Chem. Ecol. 19: 1553‑1568.
Freeman, B. C., et G. A. Beattie. 2008. An overview of plant defenses against pathogens and herbivores. Plant Heal. Instr.
Halliwell, B., et C. Susanna. 1993. Lipid peroxidation : significance and its mechanism. Am. J. Clin. Nutr. 57: 715S‑725S.
Kumbaşli, M. 2005. Études sur les composés polyphénoliques en relation avec l’alimentation de la tordeuse des bourgeons de l’épinette (Choristoneura fumiferana (Clem.)). Thèse de Doctorat, Université Laval Québec 199 p.
Kumbasli, M., et É. Bauce. 2013. Spruce budworm biological and nutritional performance responses to varying levels of monoterpenes. iForest 6: 310-314
Landry, M., Comeau, A. M., Derome, N., Cusson, M., et Levesque, R. C. (2015). Composition of the spruce budworm (Choristoneura fumiferana) midgut microbiota as affected by rearing conditions. PloS one, 10(12), e0144077.
MacLean, D. A. 1980. Vulnerability of fir-spruce stands during uncontrolled spruce budworm outbreaks: A review and discussion. For. Chron. 56: 213‑221.
Mageroy, M. H., D. Lachance, S. Jancsik, G. Parent, A. Séguin, J. Mackay, et J. Bohlmann. 2017. In vivo function of Pg β glu-1 in the release of acetophenones in white spruce. PeerJ. 5: e3535.
Mageroy, M. H., G. Parent, G. Germanos, I. Giguère, N. Delvas, H. Maaroufi, É. Bauce, J.
Bohlmann, et J. J. Mackay. 2015. Expression of the β -glucosidase gene Pg β glu-1 underpins natural resistance of white spruce against spruce budworm. Plant J. 81: 68‑80.
Martemyanov, V. V., I. A. Belousova, S. V. Pavlushin, I. M. Dubovskiy, N. I. Ershov, T. Y. Alikina, M. R. Kabilov, et V. V. Glupov. 2016. Phenological asynchrony between host plant and gypsy moth reduces insect gut microbiota and susceptibility to Bacillus thuringiensis. Ecol. Evol. 6: 7298‑7310.
25
Martineau, R. 1985. Insectes nuisibles des forêts de l’est du Canada. Service canadien des forêts, Administration centrale, Ottawa (Ontario). Rapport technique de foresterie 32F. 283 p. Mason, K. L., T. A. Stepien, J. E. Blum, J. F. Holt, N. H. Labbe, J. S. Rush, et K. F. Raffa. 2011.
From commensal to pathogen : translocation of Enterococcus faecalis from the midgut to the hemocoel of Manduca sexta. MBio. 2: e00065-11.
McMorran, A. 1965. A synthetic diet for the spruce budworm. Can. Entomol. 97: 58‑62. Méndez Espinoza, C. 2018. White spruce resistance against the spruce budworm : Genetic
control and insect-host interaction. Thèse de Doctorat, Université Laval 126 p.
Merdan, A., H. Abdel-Rahman, et A. Soliman. 1975. On the influence of host plants on insect resistance to bacterial diseases. Zeitschrift für Angew. Entomol. 78: 280‑285.
Miller, C. A. 1963. The spruce budworm. Mem. Entomol. Soc. Canada. 95: 12‑19.
Ministère des Forêts de la Faune et des Parcs. 2018. Aires infestées par la tordeuse des bourgeons de l’épinette au Québec en 2018. Québec.
Ministère des ressources naturelles et de la faune. 2005. Aires infestées par la tordeuse des bourgeons de l’épinette, au Québec, en 1990. Québec.
Nealis, V. G., et J. R. Nault. 2005. Seasonal changes in foliar terpenes indicate suitability of douglas-fir buds for western spruce budworm. J. Chem. Ecol. 31: 683‑696.
Pang, A. S. D. 2010. Possible role of plant allelochemical in clearance of bacteria from the gut of spruce budworm , Choristoneura fumiferana. Open Microbiol. J. 4: 26‑29.
Parent, G. J., I. Giguère, G. Germanos, M. Lamara, É. Bauce, et J. J. Mackay. 2017. Insect
herbivory (Choristoneura fumiferana, Tortricidea ) underlies tree population structure (Picea
glauca, Pinaceae ). Sci. Rep. 7: 42273.
Pedersen, A., J. Dedes, D. Gauthier, et K. Van Frankenhuyzen. 1997. Sublethal effects of Bacillus
thuringiensis on the spruce budworm, Choristoneura fumiferana. Entomol. Exp. Appl. 83:
253‑262.
Pietri, J. E., et D. Liang. 2018. The links between insect symbionts and insecticide resistance : causal relationships and physiological tradeoffs. Ann. Entomol. Soc. Am. 111: 92-97.
Retnakaran, A., H. Lauzon, et P. Fast. 1983. Bacillus thuringiensis induced anorexia in the spruce budworm, Choristoneura fumiferana. Entomol. Exp. Appl. 34: 233‑239.
SAS Institute, 2003. SAS/STAT User guide. SAS Institute, Cary, NC.
Schnepf, E., N. Crickmore, J. V. A. N. Rie, D. Lereclus, J. Baum, J. Feitelson, D. R. Zeigler, et D. H. Dean. 1998. Bacillus thuringiensis and its pesticidal crystal proteins. Microbiol. Mol. Biol. Rev. 62: 775‑806.
26
Sivamani, E., N. Rajendran, R. Senrayan, T. N. Ananthakrishnan, et K. Jayaraman. 1992. Influence of some plant phenolics on the activity of δ-endotoxin of Bacillus thuringiensis var. galleriae on Heliothis armigera. Entomol. Exp. Appl. 63: 243‑248.
Smirnoff, W. A. 1974. Three years of aerial field experiments with Bacillus thuringiensis plus chitinase formulation against the spruce budworm. J. Invertebr. Pathol. 24: 344‑348. Stalheim, T., V. Hormazabal, P. E. Granum, S. P. Hardy, et H. Mellega. 2009. Antibacterial
activity of sphagnum acid and other phenolic compounds found in Sphagnum papillosum against food- borne bacteria. Lett. Appl. Microbiol. 49: 85‑90.
Van Frankenhuyzen, K. 1990. Effect of temperature and exposure time on toxicity of Bacillus
thuringiensis Berliner spray deposits to spruce budworm, Choristoneura fumiferana Clemens
(Lepidoptera: Tortricidae). Can. Entomol. 122: 69‑75.
Van Frankenhuyzen, K., L. Gringorten, et J. Dedes. 1997. Susceptibility of different instars of the spruce budworm (Lepidoptera : Tortricidae) to Bacillus thuringiensis var. kurstaki estimated with a droplet-feeding method. J. Econ. Entomol. 90: 560‑565.
Van Frankenhuyzen, K., Y. Liu, et A. Tonon. 2009. Interactions between Bacillus thuringiensis subsp . kurstaki HD-1 and midgut bacteria in larvae of gypsy moth and spruce budworm. J. Invertebr. Pathol. 103: 124‑131.