Associations entre la longueur des télomères et les
facteurs pronostiques du cancer du sein
Mémoire
Kaoutar Ennour-Idrissi
Maîtrise en épidémiologie (épidémiologie clinique)
Maître ès sciences (M.Sc.)
Québec, Canada
Associations entre la longueur des télomères et les
facteurs pronostiques du cancer du sein
Mémoire
Kaoutar Ennour-Idrissi
Sous la direction de
Caroline Diorio, directrice de recherche
Bernard Têtu, codirecteur de recherche
Elizabeth Maunsell, codirectrice de recherche
iii
Résumé
Les télomères sont des structures hautement spécialisées qui coiffent les extrémités des chromosomes et qui assurent l’intégrité du génome durant la réplication. La longueur des télomères étant un marqueur de vieillissement cellulaire, leur raccourcissement est présumé être associé aux maladies liées au vieillissement, en particulier le cancer. Plusieurs études suggèrent que les habitudes de vie, facteurs pronostiques potentiels et modifiables du cancer du sein, ont un impact sur la longueur des télomères et que la longueur des télomères serait associée au pronostic du cancer du sein. L’objectif du projet présenté dans ce mémoire était d’étudier l’association entre la longueur des télomères et les différents facteurs pronostiques reconnus ou potentiels du cancer du sein. Tout d’abord, une revue systématique de la littérature a été réalisée afin d'évaluer l'état actuel des connaissances concernant la valeur de la longueur des télomères en tant que facteur pronostique du cancer du sein. Cette revue systématique a permis d’identifier d’importantes différences méthodologiques expliquant les résultats globalement peu concluants des études antérieures et de mettre en évidence le potentiel important de la longueur des télomères en tant que marqueur pronostique chez les patientes atteintes d’un cancer du sein. Une étude exploratoire transversale a ensuite été réalisée pour examiner l'association entre la longueur des télomères, mesurée dans les globules blancs périphériques, et les facteurs pronostiques reconnus ou potentiels du cancer du sein, chez 162 patientes recrutées consécutivement au Centre des maladies du sein Deschênes-Fabia de Québec. Cette étude a permis d’identifier une association positive entre certains domaines d’activité physique et la longueur des télomères des globules blancs périphériques. Si une association entre la longueur des télomères et les facteurs pronostiques traditionnels du cancer du sein n’a pas pu être établie, il n’en demeure pas moins que la valeur de la longueur des télomères, évaluée de façon appropriée, en tant que marqueur pronostique du cancer du sein mérite d’être explorée par une étude longitudinale de survie où toutes les précautions auront été prises pour minimiser le risque de biais.
iv
Abstract
Telomeres are highly specialized structures capping the ends of chromosomes that ensure genome integrity during replication. As telomere length is an indicator of cell aging, telomere shortening has been linked to aging-related diseases, especially cancer. Several studies suggest that lifestyle factors, which are modifiable factors and have been associated with breast cancer prognosis, have an impact on telomere length and that telomere length may be associated with breast cancer prognosis. The present project objective was to investigate the association of telomeres with traditional and potential breast cancer prognostic factors. First, a systematic review was conducted to evaluate the current state of knowledge concerning the value of telomere length as a prognostic factor. This systematic review identified important methodological differences that could account for the overall inconclusive results of previous studies and highlighted the potential value of telomere length as a breast cancer prognostic marker. A cross-sectional exploratory study was then performed to examine the association of peripheral white blood cells telomere length with traditional and potential prognostic factors among 162 breast cancer patients consecutively recruited at the « Centre des maladies du sein Deschênes-Fabia » in Quebec City. This study identified a positive association between specific domains of physical activity and telomere length in peripheral white blood cells. Even though an association of telomere length with traditional breast cancer prognostic factors was not identified, the value of telomere length as a breast cancer prognostic marker deserves to be explored through an unbiased longitudinal survival study.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... viii
Tableaux de l’introduction ... viii
Tableaux de l’article présenté au chapitre 3 ... viii
Tableaux de l’article présenté au chapitre 4 ... viii
Tableaux de l’annexe ... viii
Liste des figures ... ix
Figures de l’introduction ... ix
Figures de de l’article présenté au chapitre 3 ... ix
Figures de de l’article présenté au chapitre 4 ... ix
Figures de de l’annexe ... ix
Liste des abréviations ... x
Remerciements ... xiii
Avant-propos ... xiv
Considérations éthiques ... xvi
Financement ... xvi
1. Introduction ... 1
1.1. Les facteurs pronostiques du cancer du sein ... 2
1.2. Les télomères ... 4
1.3. Télomères et cancer du sein ... 10
2. Objectifs et hypothèses ... 11
3. Longueur des télomères et pronostic du cancer du sein : revue systématique de la littérature ... 12
3.1. Titre et résumé en français ... 12
3.2. Title and authors ... 13
3.3. Abstract and key words ... 13
3.4. Introduction ... 14
3.5. Materials and methods ... 15
Search methods for identification of studies ... 15
vi
Data collection and analysis ... 16
3.6. Results ... 18
Results of the search ... 18
Description of studies ... 19
Risk of bias in retained studies ... 19
Systematic data synthesis ... 20
3.7. Discussion ... 24 3.8. Conclusion ... 26 3.9. Competing interests ... 26 3.10. Authors' contributions ... 26 3.11. References ... 27 3.12. Tables ... 35 3.13. Figures ... 51
4. Longueur des télomères et facteurs pronostiques du cancer du sein : une étude transversale ... 57
4.1. Titre et résumé en français ... 57
4.2. Title and authors ... 58
4.3. Abstract and key words ... 59
4.4. Introduction ... 60
4.5. Methods ... 61
Study design and population ... 61
Data collection ... 61
Telomere length measurement ... 62
Statistical analysis ... 63 4.6. Results ... 64 4.7. Discussion ... 66 4.8. Conclusions ... 69 4.9. Competing interests ... 69 4.10. Authors’ contributions ... 69 4.11. Funding ... 69 4.12. References ... 70 1.1. Tables ... 74 4.13. Figures ... 79 5. Discussion et conclusion ... 80
vii
Bibliographie (hors articles) ... 84
Annexe : Compte-rendu sur les autres techniques réalisées initialement pour le projet ... 91
Pertinence ... 91
Échantillons biologiques ... 91
Résumé des techniques ... 92
Réalisation ... 92
Étape 1 : Sélection des échantillons tissulaires ... 92
Étape 2 : Construction des matrices tissulaires ou TMAs (Tissue microarrays) ... 92
viii
Liste des tableaux
Tableaux de l’introduction
Tableau 1 – Survie relative à 5 ans pour un cancer du sein par groupe d’âge au Canada, 2006-2008 (3) ... 2
Tableaux de l’article présenté au chapitre 3
Table 1 – Summary characteristics of studies reporting associations of telomere length with prognostic factors ... 35Table 2 - Main results of studies reporting associations of telomere length (TL) with prognostic factors ... 36
Table S1 – Search strategies ... 37
Table S2 - - Studies of telomere length measured in peripheral blood cells and survival outcomes ... 38
Table S3 - Studies of telomere length measured in breast tumor tissue and survival outcomes... 40
Table S4 - Studies reporting associations of telomere length in peripheral blood with breast cancer prognostic factors ... 42
Table S5 - Studies reporting associations of telomere length in breast tumor tissue with breast cancer prognostic factors ... 46
Tableaux de l’article présenté au chapitre 4
Table 1 – Patient characteristics ... 74Table 2 - Associations of telomere length with traditional prognostic factors ... 75
Table 3 - Associations of telomere length with lifestyle factors ... 77
Tableaux de l’annexe
Tableau 1 - Optimisation: Ac anti-hTERT Rockland – 600-401-252S ... 94ix
Liste des figures
Figures de l’introduction
Figure 1 : Représentation schématique de la structure télomérique, adapté de Calado RT et al. (28) ... 5 Figure 2 : Réplication de l’ADN et problème de réplication des extrémités, schéma adapté de Levy MZ et al. (32) ... 6 Figure 3 : Élongation des télomères par la télomérase, schéma adapté de Calado RT et al. et Blackburn EH et al. (28, 35) ... 7 Figure 4 : Télomères, télomérase et cancer, schéma adapté de Hahn WC et al. (41) ... 9
Figures de de l’article présenté au chapitre 3
Figure 1: Flow Diagram according to PRISMA (Preferred Reporting Items of Systematic Reviews and Meta-Analyses), with modifications. ... 51 Figure 2 : Forest plot for comparison of “long telomeres” vs “short telomeres” with survival outcomes. ... 52 Figure S1 : Risk of bias graph of studies reporting telomere length measured in peripheral blood cells and survival outcomes: review authors' judgements about each risk of bias item presented as percentages across all included studies. ... 53 Figure S2 : Risk of bias graph of studies reporting telomere length measured in breast tumor tissue and survival outcomes: review authors' judgements about each risk of bias item presented as percentages across all included studies. ... 54 Figure S3 : Risk of bias graph of studies reporting associations of telomere length measured in peripheral blood cells with prognostic factors: review authors' judgements about each risk of bias item presented as percentages across all included studies. ... 55 Figure S4 : Risk of bias graph of studies reporting associations of telomere length measured in breast tumor tissue with prognostic factors: review authors' judgements about each risk of bias item presented as
percentages across all included studies. ... 56
Figures de de l’article présenté au chapitre 4
Figure 1 : Associations of telomere length with levels of total, occupational and transportation-related physical activity ... 79
Figures de de l’annexe
Figure 1: Image de FISH d’une lignée cellulaire avec télomères courts (HT29_TeloFISH témoinC3_image273) ... 96 Figure 2 : Image de FISH d’une lignée cellulaire avec télomères longs (BT474_TeloFISH
x
Liste des abréviations
PCR : Réaction en chaîne par polymérase, polymerase chain reaction FISH : Hybridation in situ en fluorescence, fluorescence in situ hybridization IHC : Immunohistochimie
IC : Intervalle de confiance
ER : Récepteurs aux estrogènes, estrogen receptor
PR : Récepteurs de la progestérone, progesterone receptor
HER2 : Récepteur 2 du facteur de croissance épidermique humain, human epidermal growth factor receptor 2
TNM : Tumeur-ganglions-métastase, Tumor-Nodes-Metastasis
Ki-67 : Antigène Ki67, marqueur de prolifération (clone 67 identifié par l’étude réalisée à Kiel)
ADN : Acide désoxyribonucléique Kb : Kilobase
ARN : Acide ribonucléique
ALT : Élongation alternative à la télomérase, Alternative lengthening of telomeres IMC : Indice de masse corporelle
DNA: deoxyribonucleic acid TL: telomere length
HR: hazard ratio
xi
STELA: single telomere length analysis
Q-FISH: quantitative fluorescence in situ hybridization T/S: telomere to single copy gene ratio
TC: telomere DNA content
FFPE: formalin fixed paraffin embedded TRF: terminal restriction fragment
AJCC: American Joint Committee on Cancer T: telomere
S: single copy gene Hbg: human beta‐globin Ct: cycle threshold
CV: coefficient of variation BMI: body mass index
GLM: generalized linear models SD: standard deviation
rs: Spearman rank correlation coefficients
CI: confidence interval
xii
"La science ne cherche pas à énoncer des vérités éternelles ou des dogmes immuables ;
loin de prétendre que chaque étape est définitive et qu'elle a dit son dernier mot,
elle cherche à cerner la vérité par approximations successives." - Bertrand Russell (1872-1970), ABC de la relativité (1925)
xiii
Remerciements
Je tiens à remercier infiniment Dre Caroline Diorio pour la confiance qu’elle m’a témoignée en acceptant de me prendre sous son aile pour ma maîtrise. Je la remercie pour tout le temps qu’elle m’a consacré, la patience et la gentillesse avec laquelle elle a accueilli mes nombreuses sollicitations, pour sa disponibilité, son écoute et ses encouragements. Elle m’a marquée par son ouverture d'esprit, son dynamisme et par l’enthousiasme et la passion qu'elle voue à son travail. J’espère sincèrement avoir été à la hauteur de sa confiance.
Je tiens également à remercier Dr Bernard Têtu, sans qui je ne serai pas ici aujourd’hui. Un heureux hasard a placé mon dossier entre ses mains et, depuis, il veille sur mon cheminement avec sollicitude. J’ai été profondément marquée par sa gentillesse, sa générosité et sa modestie. Je ne le remercierai jamais assez pour m'avoir donné la chance de vivre une expérience aussi enrichissante.
Je remercie également Dre Elizabeth Maunsell pour tout le temps qu’elle m’a consacré, pour ses commentaires aussi pertinents que constructifs, pour son soutien et ses encouragements chaleureux.
J’aimerai remercier Dre Isabelle Bairati, qui a pris de son temps à plusieurs reprises pour soutenir mes demandes de bourses, Dr Patrick J. Rochette et Dre Alicia Montoni pour avoir gentiment accepté de partager leur expertise et offert de leur temps pour la réalisation de ce projet.
Je remercie aussi tous les membres de l’équipe de Dre Caroline Diorio, tout particulièrement Annick Michaud, qui a patiemment supervisé mes premiers pas au laboratoire. J’aimerai également remercier Michèle Orain, pour son accueil enthousiaste, sa sympathie et le temps qu’elle a consacré à mes déboires au laboratoire.
Je souhaite dédier ce travail à mes parents. Sans leur soutien indéfectible cette belle aventure n’aurait pas été possible.
xiv
Avant-propos
L’objectif initial de ce projet de maîtrise était d’étudier la fonction télomérique, par la mesure de la longueur des télomères et l’expression de la télomérase, à la fois au niveau du sang et au niveau des tissus mammaires (lobules normaux et tumeur) en association avec les facteurs pronostiques du cancer du sein.
La revue de littérature avait révélé que des différences méthodologiques majeures, principalement dans la méthode d’évaluation de la fonction télomérique, pouvaient expliquer que sa valeur pronostique dans le cancer du sein n’est pas encore claire. Notre objectif était donc d’utiliser des méthodes appropriées et potentiellement applicables en pratique clinique, pour étudier l’association entre les télomères et les facteurs pronostiques reconnus ou potentiels du cancer du sein. La mesure de la longueur des télomères dans le sang périphérique devait être effectuée par méthode de PCR quantitative. Le tissu mammaire normal et tumoral étant particulièrement hétérogènes, une évaluation à l’échelle cellulaire, par hybridation in situ en fluorescence (FISH) quantitative de la longueur des télomères et par immunohistochimie (IHC) de l’expression de la télomérase, était plus appropriée. Ces techniques avaient déjà été utilisées et validées dans la littérature. Ces différentes mesures devaient être examinées pour d’éventuelles corrélations entre elles ainsi qu’en relation avec les facteurs pronostiques du cancer du sein.
Durant ma première année de maîtrise, j’ai rédigé le protocole de recherche répondant à ces questions, j’ai revu les lames d’échantillons tissulaires des patientes, sélectionné les tissus et construit des micro-puces tissulaires (TMA). La technique de micro-puces tissulaires permet de traiter plusieurs échantillons tissulaires à la fois, sous les mêmes conditions techniques, pour permettre une comparaison sans biais de mesure des résultats des différentes patientes. Par la suite, j’ai travaillé à l’optimisation des techniques d’IHC et de FISH. Cette étape d’optimisation a été particulièrement laborieuse, et les difficultés techniques rencontrées ont retardé l’avancement du projet. Un compte-rendu détaillé de ce travail est présenté en annexe.
xv
Pour le présent mémoire, je ne présente donc qu’une partie du projet initial, celle se rapportant à l’évaluation de la longueur des télomères dans les globules blancs périphériques par PCR quantitative. Pour cette partie du projet, nous avons eu le plaisir de collaborer avec Dr Patrick J. Rochette, qui nous a gracieusement offert son protocole de PCR quantitative pour la mesure des télomères. Ainsi, j’ai pu optimiser la technique d’extraction d’ADN et de PCR quantitative pour nos types d’échantillons, et j’ai effectué les extractions d’ADN et les analyses par PCR. Par la suite, j’ai extrait les données relatives aux facteurs pronostiques liés à la tumeur dans les rapports de pathologie, et construit un programme pour établir le stade TNM selon le système de classification de l’American Joint Committee on Cancer (AJCC). Pour finir, j’ai effectué les analyses statistiques sur SAS et rédigé les deux articles présentés dans ce mémoire. Tout ce travail a été réalisé sous la supervision consciencieuse et attentionnée de Dre Caroline Diorio, ma directrice de recherche, qui m’a soutenue pas à pas tout le long des différentes étapes du processus. Le premier article, présenté au chapitre 3, correspond à la revue systématique de la littérature sur l’association de la longueur des télomères et le pronostic du cancer du sein. La rédaction de cet article a été supervisée par Dre Caroline Diorio et par ma co-directrice, Dre Elizabeth Maunsell. Il est actuellement en évaluation pour publication dans la revue Cancer Epidemiology, Biomarkers & Prevention. Le second article, présenté au chapitre 4, correspond à l’étude originale de l’association entre la longueur des télomères des globules blancs périphériques et les facteurs pronostiques du cancer du sein. Il est actuellement en préparation pour publication. En parallèle à mon projet de maîtrise, j’ai réalisé une revue systématique et méta-analyse d’essais cliniques randomisés de l’effet de l’activité physique sur les hormones de la femme. Ce travail a été initié dans le cadre du cours sur les revues systématiques et méta-analyses du programme d’épidémiologie clinique. Le sujet de cette méta-analyse a été suggéré par Dre Caroline Diorio, qui en a supervisé la réalisation. Il a abouti à la publication d’un article dans la revue Breast Cancer Research en novembre 2015 sous le titre de « Effect of physical activity on sex hormones in women: a systematic review and meta-analysis of randomized
xvi
controlled trials », article que je n’inclus pas dans le présent mémoire. Pour la rédaction de cet article, j’ai également bénéficié de l’aide précieuse de Dre Elizabeth Maunsell.
Les résultats de ces différents travaux ont été présentés à diverses occasions, incluant la journée de la recherche de la faculté de médecine 2014, les journées des étudiants du Centre de Recherche sur le Cancer (CRC) 2014 et 2015, la journée Carlton-Auger de pathologie de Québec 2015, la journée PHARE 2015 à Sherbrooke et la conférence «Translational Medicine 2015 » à Baltimore. Ils seront également présentés à la journée de la recherche de la faculté de médecine en mai 2016 et à la conférence étudiante de la Société Canadienne d'Épidémiologie et de Biostatistique (SCEB) à Winnipeg en juin 2016.
Considérations éthiques
Le présent projet a été a été approuvé par le Comité d’Éthique à la Recherche du Centre de recherche du Centre Hospitalier Universitaire de Québec de l’Hôpital Saint-Sacrement. Les participantes ont toutes donné leur consentement éclairé écrit pour l’analyse de leurs données et l’utilisation de leurs échantillons biologiques.
Financement
Ce projet a été possible grâce au financement de la "Fondation des Hôpitaux Enfant-Jésus - Saint-Sacrement» et de l'Alliance Canadienne pour la Recherche sur le Cancer (ACRC). Les échantillons biologiques ont été fournis par la Fondation du cancer du sein du Québec et la Banque de Tissus et de Données du Réseau de Recherche sur le Cancer du FRQS, qui est affiliée au Réseau Canadien de Banques de Tissus. Dre Caroline Diorio est détentrice d’un prix de développement de capacité de la Fondation Canadienne du cancer du sein-Société Canadienne du cancer (prix # 703003) et d’une bourse de Chercheurs-boursiers du FRQS.
Pour ma maîtrise, j’ai reçu un soutien financier des Dres Caroline Diorio et Elizabeth Maunsell et du Centre de recherche sur le cancer (CRC) de l’Université Laval qui m’a attribué une bourse d’excellence aux études de 2e cycle en 2014.
1
1. Introduction
Avec près de 1,67 millions de nouveaux cas diagnostiqués en 2012, soit 25% de tous les cancers, le cancer du sein est le deuxième cancer le plus répandu dans le monde et, de loin, le cancer le plus fréquent chez les femmes (1, 2). Les taux d'incidence varient de 27 pour 100 000 en Afrique centrale et en Asie de l'Est à 92 pour 100 000 en Amérique du Nord. Il constitue aujourd’hui la deuxième cause de décès par cancer chez les femmes dans les régions les plus développées, après le cancer du poumon (1, 2).
Pour 2015, l’incidence du cancer du sein au Canada a été estimée à 25 000 nouveaux cas, soit de 100 cas pour 100 000 femmes, et au Québec à 6 100 cas, soit 101 cas pour 100 000 femmes. La mortalité par cancer du sein a été estimée au Canada à 5 000 décès, soit 18 pour 100 000 femmes, et au Québec à 1 350 décès, soit 19 pour 100 000 (3). Le cancer du sein touche principalement les femmes âgées entre 50 et 69 ans (52%), 30,4% des cas sont diagnostiqués chez les femmes de plus de 69 ans et 17,6% chez les femmes de moins de 50 ans. La probabilité pour une femme d’être atteinte d’un cancer du sein au cours de sa vie est de 11,7%, soit une femme sur neuf et la probabilité d’en mourir est de 3,3% soit une femme sur 30. Le cancer du sein n'est pas exclusif aux femmes. En 2015, il a été estimé que 220 hommes auront reçu un diagnostic de cancer du sein au Canada (1 pour 100 000 hommes) et que 60 en mourront (2 pour 1 000 000 hommes).
Durant les deux dernières décennies, le taux d’incidence du cancer du sein a augmenté alors que le taux de mortalité attribuable au cancer du sein a diminué. Ce phénomène peut être expliqué par la concomitance de plusieurs facteurs : l'allongement de l’espérance de vie, les changements à long-terme dans les facteurs de risque, tels que les facteurs hormonaux (puberté plus précoce, grossesses menées à terme à un âge tardif, allaitement au sein moins fréquent et ménopause plus tardive) (4) et les autres facteurs liés aux habitudes de vie —sédentarité (5), obésité (6), diabète (7)—, la détection précoce de tumeurs moins agressives suite à la généralisation du dépistage par mammographie (8) et l’amélioration de l’efficacité
2
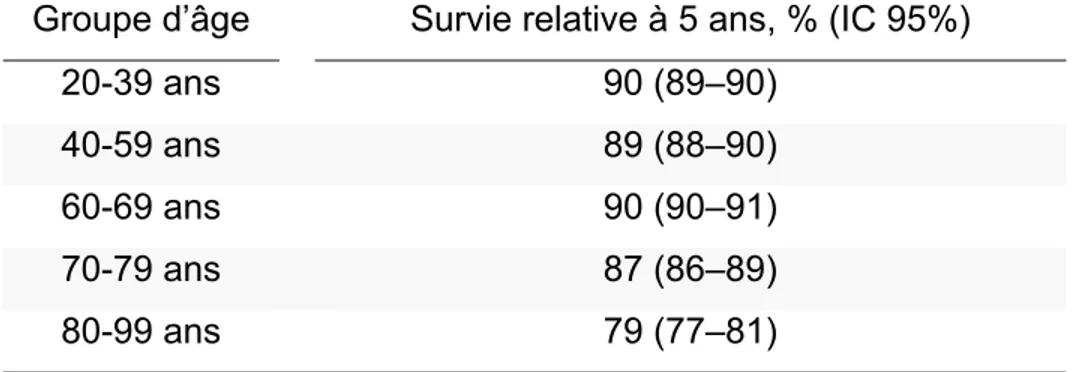
thérapeutique (9), notamment par le recours au traitement hormonal et à la thérapie ciblée. Les femmes souffrant d’un cancer du sein ont donc aujourd’hui une bonne survie à long terme, avec un taux de survie relatif à cinq ans atteignant les 88% au Canada (3) (tableau 1).
Tableau 1 – Survie relative à 5 ans pour un cancer du sein par groupe d’âge au Canada, 2006-2008 (3)
Groupe d’âge Survie relative à 5 ans, % (IC 95%)
20-39 ans 90 (89–90) 40-59 ans 89 (88–90) 60-69 ans 90 (90–91) 70-79 ans 87 (86–89) 80-99 ans 79 (77–81) IC : Intervalle de confiance
Avec l’amélioration de la survie au cancer du sein, il est devenu indispensable d’adapter la prise en charge thérapeutique à la sévérité de la maladie et au risque de récidive, tout en minimisant les effets secondaires des traitements, pour préserver la qualité de vie après un cancer du sein. Ceci passe par la prédiction précise du pronostic de la maladie, qui repose sur l’évaluation de différentes caractéristiques de la patiente et de la tumeur (10).
1.1. Les facteurs pronostiques du cancer du sein
Un facteur pronostique est une caractéristique clinique ou biologique objectivement mesurable, présente au moment du diagnostic ou de la chirurgie, qui, en absence d’un traitement adjuvant, est associée à l’issue clinique du patient (11, 12). Un facteur pronostique permet donc d’identifier les patientes à risque élevé de récidive métastatique et de décès qui pourraient bénéficier d’un traitement adjuvant systémique, et d’épargner aux patientes à moindre risque les effets secondaires de traitements agressifs et inutiles. Ces facteurs pronostiques peuvent être des caractéristiques de la patiente indépendantes de la maladie, des caractéristiques de
3
la tumeur, ou des marqueurs biologiques mesurables dans les tissus, cellules ou fluides biologiques (12).
Les facteurs pronostiques actuellement reconnus du cancer du sein sont l’âge, le statut de ménopause, la présence de comorbidité, la taille de la tumeur, le grade histologique (degré de différentiation histologique de la tumeur, combinant le degré de différentiation tubulaire, le grade nucléaire et le nombre de mitoses), l’atteinte ganglionnaire, le statut des récepteurs hormonaux aux estrogènes (ER, estrogen receptor) et à la progestérone (PR, progesterone receptor) et le statut du récepteur 2 du facteur de croissance épidermique humain (HER2, human epidermal growth factor receptor 2) (12-14).
Ces facteurs sont le plus souvent considérés en combinaisons pour construire des catégories pronostiques bien définies. Le stade TNM (Tumor-Nodes-Metastasis), allie la taille de la tumeur, le statut ganglionnaire et la présence ou non de métastases à distance (15). L’indice de Nottingham allie le grade histologique, la taille tumorale et le statut ganglionnaire (16). La classification basée sur les profils d’expression de ER, PR, HER2 et l’indice de prolifération Ki-67, classe les tumeurs en sous-types moléculaires (17) : type luminal (A et B), type HER2, et type basal (ou triple négatif). Ces catégories pronostiques sont utiles pour évaluer le pronostic dans des groupes de patientes atteintes de cancer du sein, mais leur habilité à déterminer un pronostic à l’échelle de l’individu est plus limitée (13).
Par ailleurs, de nombreuses études d’observation suggèrent que certaines habitudes de vie, tel que le tabagisme (18), la consommation d’alcool (19), la sédentarité (20) et l’obésité (21) sont associés à un moins bon pronostic chez les patientes atteintes d’un cancer du sein. Ces facteurs sont modifiables et différents organismes les ont intégrés aux recommandations d’habitudes de vie à adopter pour les patientes souffrant d’un cancer du sein (22).
Bien que les facteurs pronostiques traditionnellement reconnus soient fortement associés à l’issue clinique des patientes, des femmes présentant les mêmes caractéristiques cliniques et pathologiques peuvent avoir des issues cliniques
4
complètement différentes. En effet, ces facteurs sont en mesure d'identifier avec certitude un groupe d’environ 30% de patientes susceptibles d'avoir soit un très bon pronostic soit un pronostic très défavorable. Dans le groupe restant de 70%, environ 30% des patientes développeront des métastases (14). De nouveaux marqueurs pronostiques sont donc encore nécessaires pour raffiner la classification pronostique du cancer du sein, afin de proposer un traitement personnalisé adapté au risque de récidive et de décès de chaque patiente (14, 23-26).
1.2. Les télomères
Les cellules humaines sont des cellules eucaryotes, c’est-à-dire qu’elles sont munies d’un compartiment nucléaire qui contient le matériel génétique, les molécules d’acide désoxyribonucléique (ADN), organisées sous forme de chromosomes linéaires. Cette conformation linéaire des chromosomes entraîne deux problèmes concomitants au niveau des extrémités : 1/ un problème de protection des extrémités qui risquent d'être confondues avec une coupure double-brin et d’enclencher les mécanismes de réponse aux dommages de l'ADN et 2/ un problème de réplication des extrémités, qui entraine l’érosion progressive des chromosomes à chaque division cellulaire. Les télomères sont les structures nucléoprotéiques complexes qui coiffent les extrémités des chromosomes linéaires, et qui, par leur structure et maintenance particulières, pallient à ces deux problèmes (27) (Figure 1).
5
Figure 1 : Représentation schématique de la structure télomérique, adapté de Calado RT et al. (28)
Légende : L’extrémité télomérique se replie sur elle-même formant une boucle terminale appelée «T-loop » (boucle T). L’extrémité 3’ se termine en simple brin qui s’insère dans la double hélice en amont et s’hybride avec le brin complémentaire, formant au pied de la boucle principale une seconde boucle appelée « D-loop » (boucle D). Cette structure particulière et les 6 protéines spécifiques du complexe « shelterin » qui viennent la coiffer, jouent un rôle important dans la protection des extrémités télomériques, en évitant qu’elles soient reconnues comme des cassures double-brin de l’ADN.
6
Les télomères sont constitués de séquences répétées d'ADN, 5'-TTAGGG-3 ', longues de 5 à 15 kilobases (kb) chez l'être humain et liées par des protéines spécifiques (29-31) (Figure 1). Les télomères subissent l’érosion causée par le problème de réplication des extrémités, protégeant ainsi les zones codantes internes des brins d’ADN (Figure 2).
Figure 2 : Réplication de l’ADN et problème de réplication des extrémités, schéma adapté de Levy MZ et al. (32)
Légende : a, b. La synthèse de l’ADN commence simultanément des deux côtés, et sur chacun des 2 brins. L’ADN-polymérase delta ne lit le brin matrice (molécule mère) que dans le sens 3’ → 5’ et synthétise le nouveau brin (molécule fille) dans le sens 5’ → 3’, et ne peut qu’allonger une chaîne existante. L’ADN-polymérase alpha (ou primase) synthétise un court segment d'ARN puis un court segment d'ADN qui sert d’amorce à l’ADN-polymérase delta. La molécule d’ADN étant antiparallèle, la polarité de la réplication induit la synthèse continue du brin 3’ → 5’ (brin précoce) et une synthèse discontinue du brin 5’ → 3’ (brin tardif) par multiples courts fragments. c. Au fur et à mesure de la progression de la fourche de réplication, les séquences d'ARN des amorces sont remplacées par des fragments d'ADN et l'ADN-ligase relie les fragments d'ADN successifs. d, e. La réplication de l’extrémité 3' terminale de chacun des 2 brins d'un chromosome est impossible. Ces extrémités sont terminées par un simple brin d'ADN qui est finalement dégradé et les chromosomes sont raccourcis à chaque division cellulaire.
7
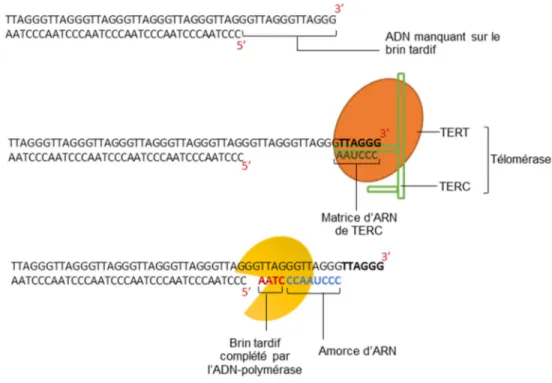
Quand le raccourcissement progressif des télomères atteint un seuil critique, la cellule entre en sénescence réplicative, un état d’arrêt irréversible du cycle cellulaire et des divisions cellulaires, mais elle reste encore métaboliquement active (32, 33). Par la suite, la cellule enclenche le processus d’apoptose : la mort cellulaire programmée. Pour parer au raccourcissement des télomères, la télomérase, une enzyme ribonucléoprotéique complexe munie d’une activité transcriptase inverse, restaure les séquences télomériques, préférentiellement au niveau des télomères les plus courts (27, 34) (Figure 3).
Figure 3 : Élongation des télomères par la télomérase, schéma adapté de Calado RT et al. et Blackburn EH et al. (28, 35)
Légende : La télomérase, par sa fonction de transcriptase inverse, rallonge l’extrémité non répliquée du télomère, ce qui permet à l’ADN-polymérase-alpha (primase) de synthétiser une amorce ARN sur laquelle va venir s’accrocher l’ADN polymérase-delta pour répliquer le brin d’ADN complémentaire.
8
Il existe un équilibre dynamique entre raccourcissement et élongation des télomères. L’élongation préférentielle des télomères les plus courts par la télomérase se traduit par des télomères hétérogènes à l’intérieur d’une même cellule et pour un même clone de cellules. La majorité des chromosomes ont des télomères de longueur moyenne, avec quelques télomères courts ou longs et leur distribution est théoriquement maintenue dans des limites spécifiques (36). En absence de télomérase, la longueur du télomère le plus court d’une cellule entraîne sa sénescence réplicative.
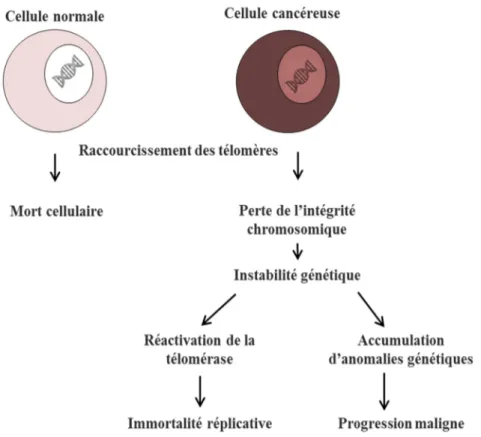
Dans les cellules humaines, la télomérase n’est active que durant le processus de différenciation cellulaire (au cours de la vie embryonnaire), dans les cellules de la lignée germinale, et dans certaines cellules souches spécialisées pour assurer le renouvellement tissulaire (37). Les cellules somatiques, qui en sont dépourvues, ont donc un nombre de divisions cellulaires limité. Cette limite à la prolifération, tout en impliquant le vieillissement cellulaire, constitue un mécanisme suppresseur de tumeur, qui protègerait contre l’apparition de tumeurs (38) (Figure 4).
En effet, la perturbation de la fonction télomérique entraîne des fusions chromosomiques aberrantes et une importante instabilité génétique, qui est un facteur déterminant dans l'initiation et la progression d'un cancer (38). Les cellules ayant acquis des mutations leur permettant d’échapper aux mécanismes de contrôle du cycle cellulaire et de mort cellulaire programmée, vont continuer à proliférer malgré leurs télomères courts. Le raccourcissement de leurs télomères s’accentuant, elles entrent en phase de « crise » et certaines cellules développent des mécanismes de maintien des télomères, en réactivant la télomérase (37, 39), ou bien par des recombinaisons inter-télomériques complexes, mécanisme connu sous le nom d’élongation alternative à la télomérase (Alternative Lengthening of Telomeres, ALT) et qui résulte en des télomères très longs et hétérogènes (40).
9
Figure 4 : Télomères, télomérase et cancer, schéma adapté de Hahn WC et al. (41) Si les anomalies de longueur des télomères et de l’activité de la télomérase ne semblent pas nécessaires à la transformation d’une cellule normale en cellule cancéreuse, elles sont responsables de l'accumulation des aberrations génétiques et de la pérennisation des cellules tumorales. Ceci favorise la progression du phénotype malin des cellules cancéreuses et la progression de tumeurs déjà établies. La longueur des télomères a donc un potentiel intéressant en tant que marqueur pronostique (42), d’autant plus que des molécules ciblant les mécanismes de maintien des télomères sont actuellement à l’essai in vitro et in vivo (43, 44).
10
1.3. Télomères et cancer du sein
Le dysfonctionnement télomérique semble être un marqueur de mauvais pronostic dans les tumeurs solides, y compris dans le cancer du sein (42). De nombreuses études de la longueur des télomères ont été menées chez les patientes atteintes d’un cancer du sein au cours des 20 dernières années. Cependant, leurs résultats ne permettent pas de déterminer la signification pronostique exacte de la longueur des télomères pour les patientes atteintes d’un cancer du sein.
La revue systématique présentée au chapitre 3 a permis d’identifier d’importantes différences méthodologiques entre ces études. En plus des causes traditionnelles d'hétérogénéité inhérentes aux études d'observation — que sont les différences des populations étudiées (sélection de patientes de stades différents), des durées de suivi, les patientes perdues de vue et le contrôle des facteurs confondants —, les différences dans les méthodes utilisées pour l'extraction de l’ADN et la mesure de la longueur des télomères ont probablement été à l’origine de l’apparente discordance entre leurs résultats.
Globalement, il a été observé que les télomères plus longs, que ce soit dans le sang périphérique ou dans le tissu tumoral, avaient tendance à être associés à un meilleur pronostic. La longueur des télomères apparaît donc être un marqueur pronostique prometteur pour le cancer du sein, d’autant plus que potentiellement modifiable (45). D'autres études avec une méthodologie rigoureuse, tout particulièrement avec un contrôle approprié des facteurs confondants et des méthodes de mesure de la longueur des télomères appropriées, sont encore nécessaires pour déterminer la signification pronostique exacte de la longueur des télomères et son implication dans la prise en charge des patientes atteintes d’un cancer du sein.
11
2. Objectifs et hypothèses
Le présent travail constitue un projet pilote dont l’objectif est d’étudier, par une analyse transversale, l’association entre la longueur des télomères des globules blancs périphériques et différents facteurs pronostiques du cancer du sein (chapitre 4). Ces facteurs pronostiques, identifiés comme les plus pertinents dans la littérature, ont été fixés à priori. Ils comprenaient les facteurs pronostiques traditionnels du cancer du sein (âge, statut de ménopause, stade TNM, type histologique, grade histologique, statut des récepteurs hormonaux ER et PR et statut du récepteur de l’HER2) ainsi que les principaux facteurs liés aux habitudes de vie (indice de masse corporelle (IMC), tabagisme, consommation d’alcool et activité physique), facteurs pronostiques potentiels et modifiables du cancer du sein. La revue systématique de la littérature présentée au chapitre 3 suggère que des télomères plus longs sont associés à un meilleur pronostic. Nous émettons donc l’hypothèse que des télomères plus longs seront associés aux facteurs de bon pronostic ainsi qu’à des habitudes de vie plus saines.
L’objectif à long terme est d’évaluer par une étude longitudinale portant sur la même cohorte l’association entre la longueur des télomères et la survie. Étant donné que notre cohorte de patientes est relativement jeune (recrutement en 2011-2012), les résultats du présent mémoire seront incorporés dans l’analyse subséquente des données de survie.
12
3. Longueur des télomères et pronostic du cancer
du sein : revue systématique de la littérature
L’article présenté ci-dessous a été soumis à la revue Cancer Epidemiology, Biomarkers & Prevention le 22 avril 2016 et est actuellement cours en d’évaluation pour publication.
3.1. Titre et résumé en français
Titre. Longueur des télomères et pronostic du cancer du sein : revue systématique de la littérature
Résumé. Les télomères assurent l’intégrité du génome durant la réplication. La perte de la fonction télomérique aboutit à la pérennisation de la cellule et à l'accumulation d’aberrations génétiques. L’association entre la longueur des télomères et le pronostic du cancer du sein est examinée par une revue systématique de la littérature. Les bases de données électroniques (MEDLINE, EMBASE et CENTRAL, depuis leur origine jusqu’à décembre 2015), ainsi que les listes bibliographiques des revues pertinentes sur le sujet, ont été explorées. Toute étude ayant évalué la longueur des télomères (mesurée dans le sang périphérique et/ou dans la tumeur) en association avec la survie et/ou un facteur pronostique du cancer du sein, a été incluse. Compte tenu de la forte hétérogénéité attendue entre les études, une synthèse systématique qualitative des données a été réalisée. Trente-six études répondaient aux critères d'inclusion et présentaient globalement un risque critique de biais. Huit études longitudinales ont analysé la survie. Des télomères plus longs tendaient globalement à être associés avec un meilleur pronostic. Sur les 33 études rapportant les associations avec les facteurs pronostiques, neuf ont ajusté pour les facteurs confondants potentiels. Les télomères semblaient être plus courts avec l’âge (dans le sang mais pas dans le tissu tumoral), la chimiothérapie (dans le sang), un taux élevé de récidive locale (dans le tissu normal adjacent à la tumeur) et un grade élevé (dans le tissu tumoral) et semblaient être plus longs pour un niveau élevé d’activité physique (dans le sang). Bien que les différences méthodologiques majeures entre les études, incluant la
13
méthode de mesure des télomères, ne permettent pas d’émettre des conclusions solides, la longueur des télomères possède une certaine valeur pronostique pour le cancer du sein.
3.2. Title and authors
Title: Telomere length and breast cancer prognosis: a systematic review
Authors: Kaoutar Ennour-Idrissi 1,2,3, Elizabeth Maunsell 1,2,3,4, Caroline Diorio 1,2,3,4
1. Axe Oncologie, Centre de Recherche du CHU de Québec-Université Laval 2. Centre de Recherche sur le Cancer, Université Laval
3. Département de médecine sociale et préventive, Faculté de médecine, Université Laval
4. Centre des Maladies du Sein Deschênes-Fabia, Hôpital du Saint-Sacrement, Québec, Canada.
Corresponding author: Caroline Diorio, Axe Oncologie, Centre de recherche du CHU de Québec-Université Laval, 1050 chemin Sainte-Foy, Quebec City, QC G1S 4L8, Canada; email: Caroline.Diorio@crchudequebec.ulaval.ca; Tel: 418-682-7511 # 84726
3.3. Abstract and key words
Abstract. Telomeres ensure genome integrity during replication. Loss of telomeric function leads to cell immortalization and accumulation of genetic alterations. The association of telomere length with breast cancer prognosis is examined through a systematic review. Electronic databases (MEDLINE, EMBASE, CENTRAL), from inception to December 2015, and reference lists of relevant reviews were searched. Studies that evaluated telomere length (blood and/or tumor) in association with breast cancer survival and/or with a breast cancer prognostic factor, were included. Given the expected high heterogeneity, a systematic qualitative synthesis of data was performed. Thirty-six studies met inclusion criteria. Overall risk of bias was critical. Eight studies reported survival outcomes. Overall, there was a trend toward an association of longer telomeres (blood and tumor combined) with better
14
outcomes. Of the 33 studies reporting associations with prognostic factors, 9 adjusted for potential confounders. Telomeres seemed to be shorter with older age (in blood but not breast tumor), higher local recurrence rates (normal breast tissue adjacent to tumor) and higher tumor grade (breast tumor tissue) and longer with greater physical activity (blood). Although major methodological differences, including telomere length measurement methods, preclude from drawing conclusive results, telomere length could be a valuable breast cancer prognostic marker. Keywords. Breast cancer, telomere length, prognosis, survival, prognostic factors, systematic review
3.4. Introduction
Telomeres are highly specialized structures capping the ends of linear chromosomes and consist of repeated DNA sequences, 5’-TTAGGG-3’ of 5 to 15 kb length in humans, bound by multiple telomeric interacting proteins (1-5). Telomeres ensure the stability of chromosomes and genome integrity during replication. In somatic cells, telomeres shorten with each cell division, due to incomplete replication of the chromosome's end by DNA polymerase enzymes, called the end-replication problem. In embryonic and adult stem cells, such as germline cells and some somatic tissues, including blood leukocytes, telomere length is kept within a cell type-specific narrow range by the telomerase enzyme complex (6), a specialized reverse transcriptase that extends the 3’ end of chromosomes by adding TTAGGG repeats (3, 6, 7). In absence of telomerase, the gradual shortening of telomeres reaches a critical point that elicits DNA damage responses. Hence, telomere shortening leads to replicative senescence, which protects from chromosome end-to-end fusion, chromosomal rearrangements and instability. Eventually, the cell undergoes apoptosis, known as programmed cell death. Telomeres shorten with increasing age. Inflammation and oxidative stress have been shown to result in accelerated telomere shortening, and some lifestyle factors seem to have an impact on telomeres (7-9).
15
Telomere shortening is thought to decrease tissue renewal capacity and increase the cancer susceptibility observed with aging (8). Loss of telomeric function leads to genomic instability, through cell immortalization and accumulation of genetic alterations, which is a main factor in the initiation and progression of cancers, particularly in cancer cells that lack normal DNA damage response mechanisms (10). Telomere dysfunction could therefore be of prognostic significance in tumors such as breast cancer (11). The objective of the present systematic review is to examine the association between telomere length and survival and/or known or potential breast cancer prognostic factors, in order to evaluate the current state of knowledge concerning the value of telomere length as a prognostic factor.
3.5. Materials and methods
A systematic review was conducted following a pre-established protocol and the general methods for Cochrane reviews (12). Considering the expected methodological diversity and heterogeneity between eligible studies, the great susceptibility of observational designs to selection bias and the variability in methods used to control for confounding, no quantitative synthesis was planned (12).
Search methods for identification of studies
An electronic search of the following databases was performed, from inception to December 2015: MEDLINE (via PubMed), EMBASE and CENTRAL (Cochrane Central Register of Controlled Trials). Search strategies were developed for each of these databases with text words and index terms referring to telomere, telomerase and breast cancer (Supplementary Table S1). No language or publication date restrictions were applied. The reference lists of relevant reviews as well as the included studies were scanned for any additional relevant studies not otherwise identified.
Criteria for considering studies for this review
Types of studies
Any observational or intervention study that evaluated the association between telomere length and breast cancer survival and/or a known or potential breast cancer
16
prognostic factor, whatever the study design, was eligible for inclusion. No restrictions were applied regarding the language or type (articles, short reports and abstracts) of publication.
Types of participants
Breast cancer patients, regardless of age, stage, treatment regimen and menopausal status, were eligible. No participants were excluded based on ethnicity.
Telomere length measurement
Studies that measured telomere length (TL) in peripheral blood and/or in breast tumors tissue, whatever the method of measurement, were eligible.
Breast cancer prognosis
Survival outcomes, including overall survival (all-cause mortality), breast cancer-specific survival (breast cancer-cancer-specific mortality), and breast cancer free survival (breast cancer recurrence), were the primary outcomes.
Studies that assessed the association of telomere length with traditional breast cancer prognostic factors (that is, age, stage, tumor size, lymph node involvement, histological type, grade, estrogen receptor (ER) and progesterone receptor (PR) status, human epidermal growth factor receptor 2 (HER2) status or molecular subtype, treatment received), as well as potential breast cancer prognostic factors, such as lifestyle factors (weight, body mass index, other measures of adiposity, diet, energy intake, smoking, alcohol consumption, physical activity) and psychological factors (mood disturbances [depression and/or anxiety], perceived stress, sleep disturbances such as insomnia, fatigue) were also eligible, as were studies that assessed the effect of an intervention (therapeutic, lifestyle modification or psychological intervention) on telomere length.
Data collection and analysis
Selection of studies
The references identified by the search strategy were reviewed by one author (K.E-I.) in a 2-step process. First, the title and abstract of each study were screened to exclude the obviously non-eligible studies and second, the full text of retained
17
articles was examined and subjected to evaluation using the predefined eligibility criteria. Whenever required, a second review author (C.D.) was consulted. When required, further information was sought from the authors by email.
Data extraction
Data extraction was performed using an exhaustive standardized form (Supplementary file 2) designed for this review. Information about the study design features (inclusion criteria, sample size and methodology), participant characteristics (age, ethnicity, menopausal status, stage, tumor size, lymph node involvement, grade, ER, PR and HER2 status, molecular subtype, treatment received), telomere length measurement (DNA source, tissue processing, DNA extraction method, measurement method, parameters measured), variables and potential confounders studied, as well as statistical analysis methods and study results, were collected. For observational studies, special attention was paid to distinguishing between adjusted and unadjusted results, and to the variable selection method used in multivariate analyses. The study's definition of each characteristic or variable retained was recorded. In the case of multiple publications related to the same study, the publication reporting the outcomes of interest to the present review or the one with the longest follow-up of these outcomes was considered as the reference, and information was supplemented by secondary publications as required. The data were extracted twice over the course of several days to insure their consistency.
Assessment of risk of bias in retained studies
Based on the “Reporting Recommendations for Tumor Marker Prognostic Studies” (REMARK) criteria (13), and the rating approach of the “Cochrane Risk Of Bias Assessment Tool for Non-Randomized Studies of Interventions” (14), the following domains were evaluated for risk of bias of included studies: selection of participants into the study, telomere length measurement, measurement of prognostic variables, potential confounding accounted for, missing data, and selective reporting (Supplementary file 3).
18
The assessment of the risk of bias was performed twice by a review author (K.E-I.), both for the risk of bias in each study and for the overall risk of bias across studies. When required, a second reviewer (C.D.) was consulted.
Assessment of heterogeneity
Differences between studies, including telomere length measurement (DNA source, tissue processing, DNA extraction method, and measurement method), participant characteristics (age, ethnicity, menopausal status, stage, molecular subtype, and treatment received), study design, and different levels of risk of bias were considered for exploring possible sources of heterogeneity. For survival outcomes, heterogeneity was explored using the I2 test, obtained from forest plots of individual
study results, with an I2 of 50% or greater indicating the presence of substantial
heterogeneity (15).
Data synthesis
Given that high heterogeneity between studies was expected, quantitative synthesis of data was considered not appropriate. For survival outcomes, forest plots of individual study results were drawn, without pooling estimates, using RevMan 5.3 software (Cochrane Review Manager Version 5.3; Nordic Cochrane Centre, Cochrane Collaboration, Copenhagen, Denmark). Adjusted hazard ratios (HR) for the comparison “long vs short telomeres” were used (short telomeres as the referent group), as the majority of studies reported this comparison. Reported hazard ratios for the comparison “short vs long telomeres” (long telomeres as the referent group) were converted to their reciprocal (1/HR). Using additional tables (12), a systematic qualitative synthesis of study characteristics and results was performed for both survival outcomes and associations with prognostic factors.
3.6. Results
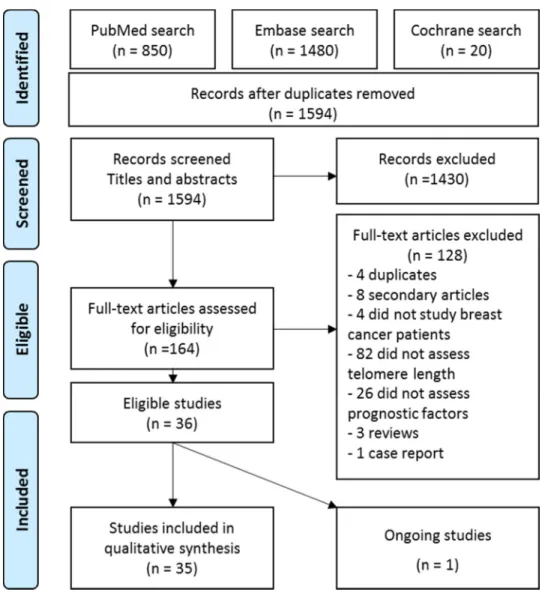
Results of the search
Of the 1594 references retrieved by electronic search, 36 met eligibility criteria (Figure 1), and included one ongoing randomized controlled trial (16), 13 longitudinal cohort studies (17-24, 29-31), 16 cross-sectional studies (25-27, 36-48), 2 case-control studies (28,49) and 4 randomized case-controlled trials (32-35).
19 Description of studies
The 36 included studies were published between 1994 and 2015 and involved between 30 and 1026 participants (median = 104 participants).
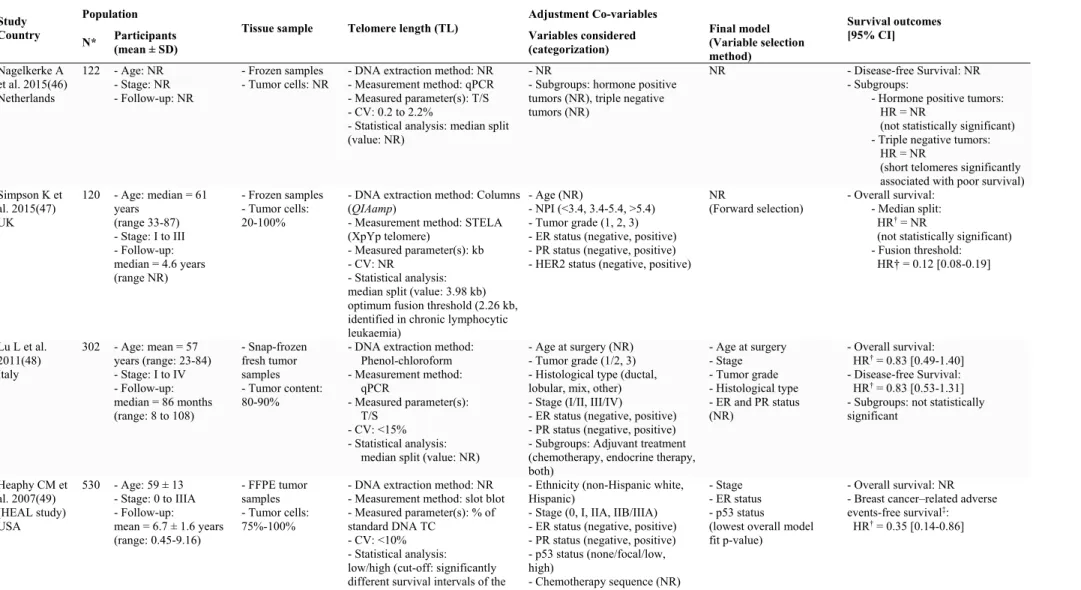
Eight longitudinal cohort studies reported survival outcomes (17-24), with 3 measuring TL in peripheral blood cells (17-19) (Supplementary Table S2), and 5 measuring it in breast tumor tissue (20-24) (Supplementary Table S3). Participants had stage 0 to stage IV breast cancer and follow-up times varied between 2.4 months and 23 years. TL was measured by quantitative polymerase chain reaction (qPCR) in all of the 3 studies of peripheral blood cells, whereas two studies of breast tumor tissue used qPCR, two studies used a slot blot method, and one study used the single telomere length analysis (STELA) of chromosome X.
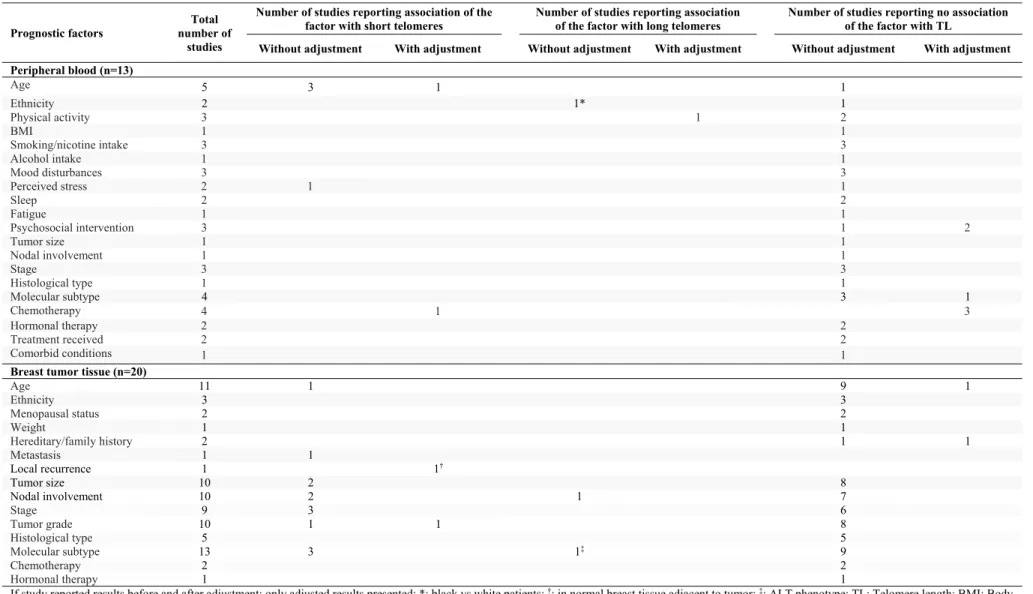
Characteristics of the 33 studies reporting associations of TL with one or more prognostic factor are summarized in Table 1 and described in Supplementary Tables S4 and S5. Participants’ mean age varied between 44 and 75 years, and they had stage 0 to stage IV disease. TL was measured in peripheral blood cells in 13 studies (17, 19, 25-35), of which 8 studies used qPCR and 4 studies used Southern blot (one study (33) did not report the measurement method). Twenty studies measured TL in breast tumor tissue (21-24, 36-51), of which the majority used fluorescence in situ hybridization (FISH; 9 studies, 5 quantitative measures and 4 qualitative measures) and Southern blot (5 studies); a slot blot method was used in 4 studies, qPCR in one study and STELA in one study.
Risk of bias in retained studies
Overall, studies reporting TL in peripheral blood cells and survival outcomes were at moderate risk of bias (Supplementary Fig. S1), whereas studies reporting TL in breast tumor tissue and survival outcomes were at critical risk of bias (Supplementary Fig. S2).
Overall, studies reporting associations of TL with prognostic factors were at serious risk of bias (Supplementary Fig. S3 and S4).
20 Systematic data synthesis
Telomere length and survival outcomes
Overall survival
Of the 3 studies evaluating baseline TL in peripheral blood and survival outcomes, 2 reported overall survival (17, 18) (Figure 2 and Supplementary Table S2). Compared to the group with shorter telomeres, patients with longer telomeres had non-significantly lower all-cause mortality in one study (n=611, HR=0.75, 95% confidence interval [CI]: 0.50 to 1.11) (17) and non-significantly higher all-cause mortality in the other study (n=1026, HR=1.10, 95% CI: 0.83 to 1.46) (18). The I2 test
for heterogeneity of these two studies’ results was 57%. The first study involved patients with stage I to IIIA disease and had a median follow-up time of 11.2 years, whereas the second one included patients with in situ and invasive stages for a mean follow-up time of 8.0 years. Both of these studies used a qPCR method. The first one used the column-based method for DNA extraction and a rescaled telomere to single copy gene ratio (T/S ratio) and obtained an intra-assay and inter-assay coefficient of variation of 6% and 7% respectively. The second study used the phenol-chloroform method for DNA extraction and a raw standard curve-derived T/S ratio, and the assay coefficient of variation ranged from 16 to 21%. In addition to baseline TL in peripheral blood, the first study evaluated overall survival after censoring follow-up at 5 years, and assessed measures of TL at 30 months and TL change between baseline and 30 months (17). Using the 5-year censored follow-up, the all-cause mortality hazard ratio for baseline TL was significantly lower when increasing TL was considered as continuous variable but not when dichotomized into long vs short telomeres. Long 30-month TL was associated with non-statistically significant lower all-cause mortality that became statistically significant when TL was considered as a continuous variable at 5-year censored follow-up. Shortening of telomeres between baseline and 30 months was associated with twofold higher all-cause mortality (p-0.006) for full follow-up and threefold higher mortality at 5 years (p-0.03) (Supplementary Table S2).
21
Two studies evaluated baseline TL in breast tumor tissue and overall survival (21, 22) (Figure 2 and Supplementary Table S3). The first one reported a significantly lower all-cause mortality with longer telomeres (n=120, HR=12, 95% CI: 0.08 to 0.19), and the second one a non-significantly lower all-cause mortality with longer telomeres (n=302, HR=0.83, 95% CI: 0.49 to 1.40). The I2 test for heterogeneity of
these two studies’ results was 97%. The first study included stage I to III patients for a median follow-up time of 4.6 years whereas the second one included stage I to IV patients for a median follow-up time of 7.2 years. The first study used the column-based method for DNA extraction from frozen tumor samples with 20 to 100% tumor content, measured the X chromosome TL (XpYp telomere) using a PCR-derived method (STELA) and a threshold for low telomeres derived from the optimum fusion threshold identified in chronic lymphocytic leukaemia. The second study used the phenol-chloroform method for DNA extraction from snap-frozen fresh samples with 80-90% tumor content and qPCR measured T/S ratios with a coefficient of variation <15% (Supplementary Table S3).
Breast cancer-specific survival:
Three studies evaluated baseline TL in peripheral blood and breast cancer-specific survival (17-19) (Figure 2 and Supplementary Table S2). The first one reported non-statistically significant lower breast cancer-specific mortality with longer telomeres (n=611, HR=0.75, 95% CI: 0.44 to 1.26) (17), the second study reported no association (n=1026, HR=1.01, 95% CI: 0.69 to 1.47) (18), and the third study statistically significant higher breast cancer-specific mortality with longer telomeres (n=176, HR=2.92, 95% CI: 1.33 to 6.39) (19). The I2 test for heterogeneity of these
three studies’ results was 75%. In the third study (19), 35.9% of patients had tumors >16mm in size (stage not reported), the follow-up lasted 7 years, and TL was measured by qPCR using a relative quantification of the telomere to single copy gene (T/S) ratio (sample T/S ratio on a reference cell line T/S ratio), with an inter-assay coefficient of variation of 3.96% (DNA extraction method not reported) (19). In addition, the first study (17), which evaluated breast cancer-specific survival using 5-year censored follow-up and TL measures at 30 months, reported non-significantly lower breast cancer-specific mortality for longer telomeres, and significantly higher
22
breast cancer-specific mortality for telomere shortening — HR=3.03 (95% CI: 1.11 to 8.18) for full follow-up and HR=2.46 (95% CI: 0.64 to 9.43) for 5-year censored follow-up (Supplementary Table S2).
No study reported on telomere length in breast tumor tissue and breast cancer-specific survival.
One study evaluated baseline TL in breast tumor tissue and breast cancer–related adverse event-free survival (23) (Figure 2 and Supplementary Table S3). Breast cancer–related adverse events included death due to breast cancer, breast cancer recurrence, or development of a new primary breast tumor. Longer telomeres in breast tumor tissue were associated with a significantly lower rate of breast cancer– related adverse events (n=530, HR=0.35, 95% CI: 0.14 to 0.86). This study included stage 0 to IIIA patients for a mean follow-up time of 6.7 years, used the phenol-chloroform method for DNA extraction from formalin-fixed paraffin-embedded (FFPE) samples with 75% to 100% tumor cells and a slot blot measure of telomere DNA content (TC; % of standard DNA TC) with a coefficient of variation <10% (Supplementary Table S3).
Breast cancer free survival:
No study reported on telomere length in peripheral blood and breast cancer free survival.
Two studies evaluating baseline TL in breast tumor tissue and breast cancer-free survival (22, 24) (Figure 2 and Supplementary Table S3) reported lower breast cancer recurrence rates associated with longer telomeres, one non-significantly lower (n=302, HR=0.83, 95% CI: 0.53 to 1.31), and the other significantly lower (n=77, HR=0.23, 95% CI: 0.07 to 0.69). The I2 test for heterogeneity of these two
studies’ results was 77%. Both of these studies included patients with stage I to IV disease, the first one for a median follow-up time of 7.2 years, and the second for up to 23 years follow-up. The first one used the phenol-chloroform method for DNA extraction from snap-frozen fresh samples with 80-90% tumor content and qPCR-measured T/S ratios (coefficient of variation <15%), whereas the second one used
23
the column-based method for DNA extraction from FFPE samples with 75% to 100% tumor cells and a slot blot measure of telomere DNA content (TC, % of standard DNA TC, coefficient of variation not reported).
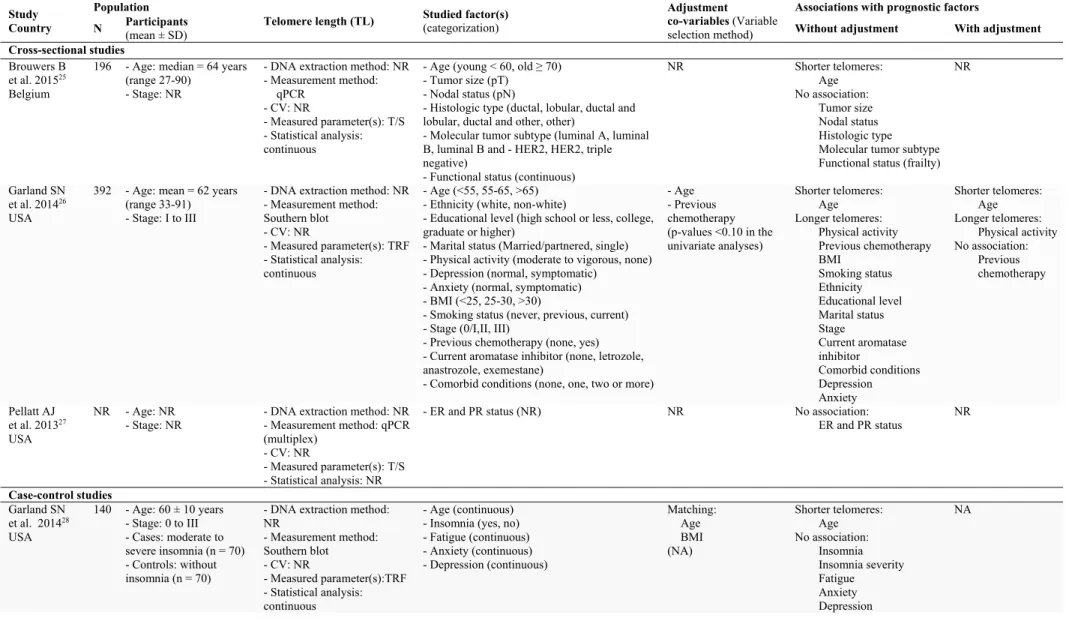
Telomere length and prognostic factors
The main results of the 33 studies reporting associations of TL with prognostic factors are summarized in Table 2. Sixteen studies were cross-sectional studies and nine reported adjustment for potential confounders.
Telomere length in peripheral blood:
Among the 13 studies evaluating the associations of TL measured in peripheral blood with prognostic factors, three were cross-sectional studies and 7 reported adjustment for potential confounders (19, 26, 30-33, 35) (Supplementary Table S4). In the studies that accounted for confounding, shorter telomeres were associated with older age, and longer telomeres with higher levels of physical activity in one study (26), telomeres were slightly longer in patients with positive tumor ER status in one study (19) but the difference between ER positive and ER negative patients was not statistically significant. Shorter telomeres were associated with getting chemotherapy in one study (30) but not in the 3 other studies (26, 31, 35). Randomization to mindfulness-based stress reduction intervention was not associated with TL in three studies (32-34) (Table 2).
Telomere length in breast tumor tissue:
Among the 20 studies evaluating the association of TL measured in breast tumor tissue with prognostic factors, 13 used a cross-sectional design and two reported adjustment for potential confounders (38, 49) (Supplementary Table S5). In these latter two studies, there was no association of TL with age or breast cancer hereditary origin while shorter telomeres were associated with higher tumor grade in one study (38) and shorter telomeres in normal breast tissue adjacent to tumor were associated with higher rates of local recurrence in the other study (n=152, OR=5.1, 95% CI: 1.2 to 22.2) (49) (Table 2).
24
3.7. Discussion
With the exception of a single study reporting a negative association, the present systematic review of telomere length and breast cancer prognosis indicates a trend toward a positive association of longer telomeres, measured in breast tumor tissue, with better survival outcomes, but not clearly for telomere length measured in peripheral blood. Shorter telomeres in normal breast tissue adjacent to tumor seem to be associated with higher local recurrence rates. In breast tumor tissue, shorter telomeres seem to be associated with higher tumor grade. Telomeres seemed to be shorter with older age when measured in peripheral blood but not when measured in breast tumor. In peripheral blood, longer telomeres seem to be associated with higher levels of physical activity, and shorter telomeres with getting chemotherapy. Even though the overall strength of evidence is weak, since few studies contributed to estimations of associations and the overall risk of bias in these studies ranged from moderate to critical, with nearly the half of studies being cross-sectional, these results are consistent with a recent systematic review and meta-analysis of the association of telomere length with cancer risk (52). In that review related to cancer risk, findings suggest that shorter telomere length in surrogate tissue (mostly peripheral blood cells) is associated with higher risk of cancer incidence; for breast cancer risk, in eight studies, all but two suggested a trend toward an association of shorter telomeres with higher risk of breast cancer incidence.
In addition to traditional causes of heterogeneity inherent in observational designs, that is, study population selection (breast cancer stage), length of follow-up, loss of follow-up, and handling of confounders, the variability in the methods used for telomere length measurement and/or DNA extraction is of particular importance. The Southern blot method is historically the first technique used for telomere length measurement, and is still considered the “gold standard” method (53). However, this method estimates the Terminal Restriction Fragment (TRF) length, which includes variable lengths of subtelomeric sequences, depending on the cutting restriction enzymes used and the last restriction site at a given chromosome arm, thus precluding reliable comparisons between studies (54, 55). Subtelomeric fragments
25
are dynamic structures that contribute to the normal polymorphism in the human genome (56, 57) and therefore differences of TRF lengths between individuals may not reflect the actual differences of their telomere lengths. Furthermore, the Southern blot technique is known to be relatively insensitive to very short telomeres, and thus underestimates the length and number of short telomeres (54, 55). The slot blot method is a variant of the Southern blot requiring less DNA material; it provides an indirect measure (ratio of telomere to centromere signals) and is relatively insensitive (54). In the quantitative polymerase chain reaction (qPCR) assay, the telomeric repeats (T) are amplified using primers that hybridize to telomeres but have mismatches across their length that prevent formation of primer dimer-derived products (i.e. products of hybridization of two primers) (58); amplification is measured quantitatively and compared to that of a single copy gene (S) to adjust for the amount of DNA in the reaction, yielding a relative telomere length estimation, the T/S ratio. Thus, qPCR is not suitable for measurement of telomere length in non-diploid and karyotypically unstable samples, such tumor tissue samples (54). Furthermore, tumor tissue samples are heterogeneous, especially breast cancer tumors, and can include variable amounts of benign and reactional cells, such as lymphocytes and fibroblasts, which have longer telomeres than cancer cells (43). It has been shown recently that the DNA extraction method used has an impact on telomere length. The column-based method yields the least accurate measurement, and results in shorter telomere length when compared to phenol-chloroform and salting-out methods, which likely contributed to the observed discrepancies between studies that measured telomere length by qPCR (59, 60).
The strength of this systematic review is the use of the Cochrane reviews rigorous methodology, including the extensive and highly sensitive search strategy to retrieve as many relevant studies as possible, the use of pre-established protocol, the assessment of the risk of bias, and the systematic analysis of results, in addition to considering the variability in telomere length measurement methods between studies. Limitations include the small number of studies involved in survival outcome analyses, the lack of high-quality evidence inherent in observational study designs and the overall critical risk of bias in studies reporting associations with prognostic