MÉLANIE TREMBLAY
INTERNALISATION CELLULAIRE DE
NANOPARTICULES D’OXYDES MÉTALLIQUES À
BASE DE MANGANÈSE ET DE GADOLINIUM,
POUR L’IMAGERIE PAR RÉSONANCE
MAGNÉTIQUE (IRM)
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l’Université Laval
dans le cadre du programme de maîtrise en génie de la métallurgie et des matériaux
pour l’obtention du grade de Maître ès sciences (M.Sc.)
DÉPARTEMENT DE GÉNIE DES MINES, DE LA MÉTALLURGIE ET DES MATÉRIAUX
FACULTÉ DES SCIENCES ET DE GÉNIE
UNIVERSITÉ LAVAL
QUÉBEC
2013
Résumé
Afin de permettre l’application chez l’homme de nouvelles technologies médicales comme la thérapie cellulaire régénératrice, il est primordial d’être en mesure de localiser in vivo les cellules transplantées à l’intérieur d'un tissu. L’imagerie par résonance magnétique (IRM) est une technique de choix en raison de son excellente résolution anatomique. Par contre, l’utilisation d’un agent de contraste est nécessaire afin de marquer et de suivre à la trace des cellules implantées puisque leur contraste intrinsèque les rend difficiles à distinguer des tissus environnants. Les agents à effet de contraste négatif tel que les oxydes de fer sont les plus souvent envisagés pour effectuer un suivi cellulaire in vivo. Un problème se pose lorsqu’il est question de quantification ou de localisation précise d’une implantation cellulaire. En effet, la présence d’un artéfact négatif excédant le volume qu’occupent les cellules nuit à la précision de la technique. Pour ces raisons, ce projet porte sur l’élaboration d’une méthodologie de marquage de cellules canc éreuses employant un agent de contraste d’IRM générant un contraste positif.
Ce projet de recherche avait pour but d’évaluer le potentiel des nanoparticules d’oxyde de manganèse (MnO) et d’oxyde de gadolinium (Gd2O3) comme agents de contraste pour le marquage cellulaire. Des nanoparticules synthétisées par des collègues ont été utilisées dans le cadre de ce projet. Le projet de maîtrise décrit ici est constitué de trois volets : 1) le développement d’un protocole d’analyse élémentaire des éléments chimiques Mn et Gd dans des cellules marquées d’agent de contraste; 2) l’élaboration d’une procédure de quantification du signal généré par des cellules marquées par un agent de contraste paramagnétique; et 3) la démonstration de la possibilité de suivre in vivo par IRM, des cellules marquées. Ce projet a été ponctué de mesures de viabilité cellulaire ainsi que d’études de microscopie à transmission (MET) cellulaire, permettant de démontrer l’internalisation des agents de contraste dans les cellules. Les cellules marquées ont été visualisées en IRM sous forme de culots de cellules de différentes tailles, puis implantées par stéréotaxie chez des souris afin de réaliser un suivi de la prolifération des cellules in vivo.
Ces études ont permis de mesurer le signal d’IRM généré par des cellules cancéreuses marquées de nanoparticules de MnO et de Gd2O3, en utilisant des séquences dites « pondérées en T1». Ces études montrent que les nanoparticules paramagnétiques permettent de détecter plusieurs dizaines de milliers de cellules implantées localement ( 20 000). Cette limite intrinsèque devrait être prise en compte dans les procédures d’implantation utilisant des marqueurs paramagnétiques à base de Gd et de Mn.
Mots-clés :
− imagerie par résonance magnétique (IRM);
− agents de contraste;
− nanoparticules;
Abstract
To allow the application of new medical technologies such as regenerative cell therapy to humans, it is essential to be able to localize the tissue-implanted cells in vivo. Magnetic resonance imaging (MRI) is a technique of choice because of its excellent anatomical resolution. On the other hand, use of a co ntrast agent is required to label and keep track of the implanted cells as their intrinsic contrasts make them difficult to distinguish from surrounding tissue. Negative contrast agents like iron oxides are the most often considered tracking cells in vivo. A problem appears when quantification or determination of the exact location of a cell implantation is needed. Indeed, the presence of a negative artifact far exceeding the volume occupied by the cells compromises the accuracy of the technique. For these reasons, this project focuses on developing a methodology to label cancer cells using a positive contrast agent for MRI.
This research project aims at evaluating the potential of manganese oxide (MnO) and gadolinium oxide (Gd2O3) nanoparticles as contrast agents for cell labeling. Nanoparticles synthesized by co -workers were used in this project. The master's project described here consi sts of three (3) components: 1) development of a valid protocol of elemental analysis of Mn and Gd quantification in labeled cells , 2) development of a procedure for quantification of the MRI signal generated by cells labeled with paramagnetic contrast agent, and 3) demonstrating of the in vivo track ability by MRI, cells labeled with a paramagnetic agent. This project was punctuated by measures of cell viability and cell visualisation by transmission electron microscopy (TEM), to demonstrate the internalization of contrast agents into cells. The labeled cells were visualized by MRI in the form of cell pellets of various sizes, and implanted in mice by stereotactic method s to achieve a monitoring of cell proliferation in vivo.
These studies measure the MRI signal generated by cancer cells labeled by MnO and Gd2O3 nanoparticles, using "T1 weighted" sequences. These studies show that paramagnetic nanoparticles can detect tens of thousands of locally implanted cells ( 20 000). This inherent limit should be taken into account in the settlement procedures using Gd and Mn based labels.
Keywords:
− magnetic resonance imaging (MRI);
− contrast agents;
− nanoparticles;
Avant-propos
Mon travail consistait à développer une méthodologie de marquage cellulaire permettant la quantification des effets de contraste positifs obtenus en IRM pa r des cellules marquées avec Gd2O3 et MnO. Mon projet ne porte donc pas sur les caractéristiques des particules utilisées, mai s plutôt sur l’internalisation cellulaire et leur utilisation comme agent de contraste cellulaire. Deux étudiants au doctorat ont particulièrement contribué à mon projet :
− Luc Faucher : étudiant au doctorat sur le sujet de la synthèse et de la cara ctérisation des nanoparticules d’oxyde de gadolinium.
− Mathieu Létourneau : étudiant au doctorat sur le sujet des nanoparticules d’oxyde de manganèse.
Ces projets ont été réalisés sous l’encadrement du Dr Fortin, appuyé des professionnels de recherche Pascale Chevallier, Ph.D. (chimie), Jean Lagueux, Ph.D. (biologie) et Stéphane Turgeon, Ph.D. (physique).
Pour ce faire, j’ai élaboré une procédure de marquage cellulaire. Par la suite, un protocole de quantification de l’internalisation cellulaire (par dosage des agents internalisés) a été élaboré. Une procédure de quantification du signal d’IRM sur des culots de cellules (in vitro) a été élaborée. Finalement, la préparation et l’élaboration de l’implantation de cellules in vivo ont été optimisées.
Bien qu’il soit important de décrire les synthèses ainsi que les caractéristiques des deux types de nanoparticules qui ont été utilisés dans ce projet (Gd2O3 et MnO), une revue complète de la littérature entourant l’élaboration de ces agents sera effectuée dans les travaux de thèse de mes collègues . Je tâcherai ici d’expliquer brièvement le contexte de fabrication et de caractérisation des nanoparticules utilisées , afin de consacrer plus de pages du mémoire aux études biologiques .
Ce mémoire est constitué d’un chapitre sur des travaux de mesure de la concentration du Mn et du Gd dans les cellules et de deux articles scientifiques . Voici une description de mes contributions à chacun des articles :
Le premier article, intitulé «Influence of agglomeration on positive contrast enhancement of MnO -labeled cells in MRI », porte sur l’influence de l’agglomération sur le contraste produit par des nanoparticules d’oxyde de manganèse. Ces nanoparticules ont été utilisées pour marquer des cellules humaines de fibrosarcome (HT-1080), visualisées sous forme de culots de cellules de différentes tailles . Cet article a été soumis au Journal «Journal of Physical Chemistry B» le 6 Avril 2012 et accepté le 3 octobre 2012. La synthèse et les caractérisations physicochimiques des agents de contraste ont été effectuées par l’étudiant au doctorat, Mathieu Létourneau. Les caractérisations relaxométriques ont été réalisées, par un autre étudiant
au doctorat, Luc Faucher lors de stage en Belgique, sous la supervision de Dr Gossuin. Dans ce travail, j’ai effectué la totalité des analyses et des expérimentations reliées à la culture cellulaire avec l’assistance de Dr Lagueux. J’ai aussi effectué la caractérisation de l’internalisation grâce à l’analyse élémen taire du Mn internalisé et à la visualisation de cellules marquées par MET. Les travaux d’acquisition et de traitement d’image IRM ont été effectués par Dr Lagueux, sous la direction de Dr Fortin avec un scanneur d’IRM préclinique de 1 T situé à l’Hôtel Dieu de Québec.
Le second article, intitulé « Rapid Synthesis of PEGylated Ultra-Small Gadolinium Oxide Nanoparticles for Cell Labeling and Tracking with MRI », porte sur le développement et la caractérisation d’une nouvelle synthèse de nanoparticules d’oxyde de gadolinium recouvertes de polyéthylène glycol. Ces nanoparticules ont été utilisées pour marquer des cellules de glioblastome multiforme (F98), injectées dans le cerveau de souris. Cet article a été soumis au Journal «ACS Applied materials and i nterfaces» le 3 Avril 2012 et accepté le 26 Juillet 2012. La division du travail s’est effectuée selon les mêmes principes que pour l’article précédent. La conceptualisation et le développement de la synthèse en une étape, permettant de greffer un ligand biocompatible (le PEG), à la surface de nanoparticules d’oxyde de gadolinium ont été réalisés par un étudiant au doctorat, Luc Faucher. Il a aussi effectué les synthèses, les caractérisations physicochimiques au Québec, ainsi que les caractérisations relaxométriques en Belgique (sous la supervision du Dr Gossuin). Dans ce travail, j’ai effectué l’intégralité des analyses et des expérimentations reliées à la culture cellulaire avec l’assistance de Dr Lagueux. J’ai aussi effectué la caractérisation de l’internalisation grâce à l’analyse élémentaire du Gd internalisé et à la visualisation de cellules marquées par MET. J’ai aussi participé aux travaux d’implantation dans l’animal sous la supervision de Dr Fortin, avec la contribution de Dr Steve Lacroix (CHUQ) et de la professionnelle de recherche Nadia Fortin (CHUQ). Les travaux d’acquisition et de traitement d’image IRM ont été effectués par Dr Lagueux, sous la direction de Dr Fortin.
Remerciements
Avant tout développement, j’aimerais remercier ceux qui m’ont beaucoup appris, et ceux qui ont eu la gentillesse de faire de ma maîtrise un moment très enrichissant. Je tiens à remercier tous ceux et celles qui directement ou indirectement m'ont permis de mener à terme ce projet. Ils sont nombreux . Que ceux ou celles qui n'auraient pas été cités soient remerciés et m'en excusent.
Tout d’abord, je voudrais remercier tout particulièrement mon directeur de maîtrise, le professeur Marc -André Fortin qui m’a chaleureusement accueillie dans son laboratoire et au sein de son équipe de recherche. Je le remercie de m’avoir donné l’opportunité de travailler sur un sujet aussi passionnant, de découvrir une multitude de techniques et de tous les conseils qu’il a pu me prodiguer pendant ces deux courtes années. Je voudrais surtout le remercier pour sa passion de la recherche et de l’enseignement qu’il a habilement sut me communiquer.
Ces remerciements s’adressent également à M. Jean Lagueux, professionnel de recherche avec qui j’ai eu la chance de découvrir le merveilleux monde de la culture cellulaire. Je le remercie pour sa confiance, sa disponibilité et pour le temps qu’il m’a accordé pour des explications et des discussions. Je le remercie aussi pour sa contribution aux résultats que ce soit lors du traitement des images ou lors des longues heures passées à l’IRM. Tes commentaires et suggestions sont toujours plus que pertinent, merci pour tout.
Je tiens aussi à remercier Luc Faucher et Mathieu Létourneau d’avoir contribué à l’avancement de nos projets communs. Je ne vous dirai jamais assez merci pour les préparations et les coups de main que vous m’avez fournis lors des expériences particulièrement intenses que la culture cellulaire me faisait vivre. Luc, merci d’avoir pris le temps de m’expliquer les rudiments de l’utilisation de la DLS et du relaxomètre (1 H-RMN). Merci de ta persévérance et de la pédagogie dont tu as fait preuve lorsque j’en avais besoin.
Je tiens à remercier tous les membres du laboratoire de Professeur Fortin, pour leur joie de vivre contagieuse. Andrée-Anne, Myriam, Jean-Luc, Rémi, Olivier, je vous remercie encore pour tout ce que vous m’avez apporté. Votre patience, vos conseils et l’aide précieuse que vous m’avez apportée m’ont été plus qu’utiles. Je remercie finalement tous les membres des autres groupes de recherche que j’ai eu le plaisir de côtoyer, pour l’ambiance chaleureuse qui règne dans nos laboratoires. Au premier abord, la créativité et la rigueur sont deux qualificatifs qui ne sont pas souvent à l’union, mais grâce à vous, je croi s fermement qu’ils sont à la base de la science. La recherche n’est-elle pas toujours plus intéressante lorsque le laboratoire est rempli de folies?
Les expériences de validation de méthode de digestion et de dosage de l’oxyde de gadolinium (Chapitre 4) ont été réalisées au laboratoire du professeur Dominic Larivière (Département de chimie, Université Laval). Je tiens donc à le remercier ainsi que tous les membres de son laboratoire pour leur soutien.
Les expériences de microscopie électronique à transmission ont été effectuées à l’Institut de biologie intégrative et des systèmes (IBIS) habilement orchestré par M. Richard Janvier. Merci à vous et toute votre merveilleuse équipe.
Tous les spécimens animaux utilisés dans le cadre de mon projet ont été traités avec soin par l’équipe de l’animalerie de l’Hôtel Dieu de Québec. Un merci tout particulier à Mme Mélissa Guignard pour votre joie de vivre et votre patience d’ange. Vous m’avez fait découvrir le monde des soins aux animaux de laboratoire.
Les expériences d’implantations cellulaires ont été réalisées à l’Hôtel Dieu de Québec avec la contribution de Mme Nadia Fortin (CHUL). Merci pour votre patience et pour toutes tes explications.
Je tiens à remercier toutes les personnes qui, de près ou de loin, ont contribué à l’avancement de mes travaux. Vos commentaires, vos suggestions, vos encouragements, votre aide, tout m’a été si précieux! Je tiens à remercier tous ceux qui ont pris le temps de lire, de corriger ou de commenter ce mémoire que je livre aujourd’hui. Nicole Tremblay, Audrey-Anne Prévèreau, Marie-Pier Plante et André Tremblay, merci pour vos conseils et votre aide!
Même si je ne pourrai jamais le faire suffisamment, je voudrai s remercier ma famille, mon amoureux et mes amis qui m’ont apporté un soutien incroyable. Merci à toi, Pierre, pour ton appui inconditionnel, tu as toujours su me redonner le sourire même dans les moments plus difficiles. Merci papa et maman pour de votre support quotidien, votre patience et votre confiance.
Je pense aujourd’hui que sans vous, je n’aurais peut-être pas cru aussi fermement au dicton : quand on veut, on peut! Ce mémoire est pour moi tout un accomplissement, et je sais que c’est en partie grâ ce à vous tous que j’y suis arrivée.
« On peut concevoir que dans des mains criminelles le radium puisse devenir très dangereux, et ici on peut se demander si l’humanité a avantage à connaître les secrets de la nature, si elle est mûre pour en profiter ou si cette connaissance ne lui sera pas nuisible... »
[Lettre de Pierre Curie à Marie Curie, datée du 10 août 1894]
« If you cannot explain a concept to a 6 year-old, then you do not fully understand it. »
À tous ceux qui m'ont appuyé, dans les jours heureux comme dans les jours plus difficiles. Je ne pourrai jamais assez vous remercier!!!
Mais surtout à mes parents, à qui il me parait impossible de rembourser l’amour inconditionnel et les sacrifices que vous avez fait pour moi.
Table des matières
Résumé ... III Abstract ... IV Avant-propos ...V Remerciements ... VII Liste des figures... XV Liste des tableaux ...XVII Liste des équations ... XVIII Légende des abréviations... XIX Abréviations latines ... XIX Abréviations grecques... XXI
CHAPITRE 1: Introduction...1
1.1 Objectifs du projet de maîtrise ...2
1.2 Structure du mémoire ...3
CHAPITRE 2: Cadre théorique ...4
2.1 Imagerie par résonance magnétique (IRM) ...4
2.1.1 Description de la technique d’imagerie...4
2.1.2 Historique...4
2.1.3 Avantages et inconvénients de l’IRM pour l’imagerie cellulaire...6
2.1.4 Mode de fonctionnement...7
2.1.4.1 Phénomène de résonance magnétique nucléaire...8
2.1.4.1.1 Modèle classique ...9
2.1.4.1.2 Modèle quantique ... 11
2.1.5 Temps de relaxation et relaxométrie... 13
2.1.5.1 Relaxation longitudinale (T1) ... 14
2.1.5.1.1 Paramètres influençant les valeurs de T1 dans un tissu ... 14
2.1.5.2 Relaxation transverse (T2) ... 15
2.1.5.2.1 Paramètres influençant les valeurs de T2 dans un tissu ... 16
2.1.6 Relaxivité ... 17
2.1.7 Mesure du signal (SIL)... 17
2.1.7.1 Description de T2* ... 18
2.1.8 Facteurs conditionnant le signal en IRM ... 19
2.1.9 Séquenc es d’IRM utilisées pour le suivi de cellules marquées d’agents de contraste ... 20
2.1.9.1 Séquenc es acquérant les images par tranche : l’écho de spin... 21
2.1.9.2 Séquenc es acquérant les images par volume : l’écho de gradient... 22
2.2.1 Agents de contraste « positifs »... 23
2.2.2 Agents de contraste « négatifs » ... 25
2.2.3 Toxicité et utilisations cliniques ... 26
2.3 La recherche : les nanoparticules ... 30
2.3.1 Propriétés des nanoparticules d’oxydes métalliques utilisées pour le marquage cellulaire ... 31
2.4 Marquage cellulaire ... 32
2.4.1 Intérêt de l’IRM ... 32
2.4.2 Caractéristique nécessaire nécessaires au marquage cellulaire en IRM ... 32
2.4.2.1 Agents de contraste développés et utilisés actuellement pour le marquage cellulaire... 33
2.4.2.1.1 Nanoparticules de Fe3O4 ou deγ-Fe2O3... 34
2.4.2.1.2 Les nanoparticules paramagnétiques (MnO et de Gd2O3) ... 35
2.4.3 Synthèse des nanoparticules de MnO et de Gd2O3 ... 36
2.4.3.1 Nanoparticules MnO – Décomposition thermique ... 36
2.4.3.2 Nanoparticules Gd2O3 - Synthèse polyol ... 37
2.4.3.2.1 Nanoparticules de Gd2O3 ou de MnO ... 37
2.4.4 Choix des cellules pour le marquage cellulaire ... 38
2.4.4.1 HT-1080 ... 38
2.4.4.2 F98... 39
2.4.5 Évaluation de la viabilité ... 39
2.4.6 Dosage de l’internalisation ... 40
2.4.6.1 Fonctionnement des techniques utilisées ... 40
2.4.6.1.1 Spectroscopie d’absorption atomique à four au graphite (GF-AAS) ... 40
2.4.6.1.2 Spectroscopie d'émission atomique (ICP-AES) ou optique (ICP-OES) par plasma à couplage inductif ... 43
2.4.6.1.3 Spectroscopie de masse à plasma couplé induit (ICP-MS)... 45
2.4.6.2 Choix des techniques utilisées ... 46
2.5 Implantation de cellules in vivo ... 47
2.5.1 Utilisation de souris – Choix des spécimens ... 47
2.5.2 Implantation stéréotaxique des cellules ... 48
CHAPITRE 3: Méthodologie... 49
3.1 Synthèse, purification, et caractérisation des nanoparticules ... 49
3.1.1 Synthèse ... 49
3.1.1.1 Synthèse de MnO ... 49
3.1.1.2 Synthèse de PEG-Gd2O3... 50
3.1.2 Purification des nanoparticules ... 50
3.1.3.1 Détermination du rayon hydrodynamique des particules (DLS)... 51
3.1.3.2 Mesure des propriétés relaxométriques (1H-RMN) ... 53
3.1.3.2.1 Relaxation longitudinale (T1) ... 53
3.1.3.2.2 Relaxation transverse (T2) ... 53
3.1.3.2.3 Propriétés relaxométriques (r1, r2 et r2/r1)... 54
3.2 Procédure de culture cellulaire... 54
3.2.1 Cinétique de prolifération cellulaire avant marquage ... 55
3.2.1.1 Ensemencement des cellules ... 55
3.2.1.2 Récolte des cellules ... 55
3.3 Incubation des cellules avec agent de contraste ... 58
3.3.1 Internalisation cellulaire d’agents de contraste ... 58
3.3.2 Dosage de l’internalisation des nanoparticules dans les cellules ... 59
3.3.2.1 Techniques de digestion... 59
3.3.2.1.1 Digestion par reflux acide ... 59
3.3.2.1.2 Digestion par micro-ondes... 60
3.3.2.2 Différentes méthodes d’analyse : validation de la méthode... 60
3.3.2.2.1 Zone de quantification de la méthode ... 61
3.3.2.2.2 Évaluation de la méthode ... 63
3.3.3 Visualisation MET des cellules marquées... 65
3.3.4 Visualisation IRM des cellules marquées ... 67
3.3.4.1 Quantification de signal cellulaire obtenu en IRM ... 67
3.4 Implantation de cellules in vivo et visualisation IRM ... 69
3.4.1 Implantation stéréotaxique des cellules ... 69
3.4.2 Visualisation IRM des animaux ... 71
CHAPITRE 4: Détermination de la méthode de quantification de l’élément magnétique en milieu cellulaire ... 72
4.1 Dosage du manganèse... 72
4.1.1 Méthode de dosage du manganèse... 72
4.1.2 Validation de la méthode de dosage du manganèse ... 73
4.2 Dosage du gadolinium ... 73
4.2.1 Méthode de dosage du gadolinium ... 73
4.2.2 Validation de méthode pour dosage du gadolinium... 74
4.2.3 Comparaison des méthodes de digestion... 76
4.2.3.1 Contamination croisée ... 76
4.2.3.2 Temps nécessaire ... 77
4.2.3.3 Coût d’acquisition, de fonctionnement et d’entr etien ... 77
4.2.4 Comparaison des techniques d’analyse ... 78
4.2.4.1 Limite de détection de l’appareil ... 78
4.2.4.2 Étendue de la plage de quantification de la méthode... 78
4.2.4.3 Les coûts... 79
4.2.4.4 Conclusions ... 79
CHAPITRE 5: Nanoparticules d’oxyde de manganèse (SPMnO et USPMnO) pour le marquage cellulaire ... 80
CHAPITRE 6: Nanoparticules de PEG-Gd2O3 pour le marquage cellulaire et l’implantation in vivo ... 114
CHAPITRE 7: Discussion ... 145
7.1 Marquage de cellules cancéreuses au moyen de nanoparticules paramagnétiques... 145
7.2 Apport spécifique à l’élaboration d’une méthodologie de dosage de l’internalisation cellulaire des agents de contraste (Chapitre 4) ... 145
7.3 Marquage cellulaire avec nanoparticules de MnO (Chapitre 5) ... 146
7.4 Marquage cellulaire avec nanoparticules de Gd2O3 (Chapitre 6) ... 150
7.5 Comparaison des résultats obtenus avec MnO (Chapitre 5) ainsi qu’avec Gd2O3 (Chapitre 6) ... 155
CHAPITRE 8: Perspectives... 159
CHAPITRE 9: Conclusion... 161
Bibliographie... 162
Annexe A: Acquisition d’image en IRM ... 172
Annexe B: Séquenc es d’acquisition d’image utilisées... 177
Annexe C: Mécanismes d’internalisation cellulaire... 179
Annexe D: Inhibiteurs chimiques d’intérêt pour l’étude des mécanismes d’internalisation cellulaire... 180
Annexe E: Courbes d’étalonnage en ICP-MS et ICP-OES ... 182
Liste des figures
Figure 1: Images IRM du cerveau... 4
Figure 2: Spectre du proton de l’éthanol obtenu avec le premier appareillage de RMN ... 5
Figure 3: Premier scan IRM sur un être humain avec transformée de Fourier. ... 6
Figure 4 : Appareil d’imagerie par résonance magnétique (IRM) moderne ainsi que ses composantes. ... 8
Figure 5 : Comportement des spins des protons en absence (gauche) ou en présence (droite) d’un fort champ magnétique orienté selon l’axe des z... 9
Figure 6: Mouvement de double précession occasionné lors de l’application simultanée de B0 et de B1. ... 10
Figure 7 : Différence énergétique entre les deux populations de protons 1H soumis à un fort champ magnétique. ... 11
Figure 8: Représentation schématique décrivant l’effet général des impulsions RF sur le vecteur d'aimantation macroscopique. ... 12
Figure 9 : Schématisation des phénomènes de rela xation transverse et longitudinale. ... 13
Figure 10 : Récupération de l’aimantation longitudinale. ... 14
Figure 11 : Relaxation longitudinale ... 14
Figure 12 : Temps de relaxation T1 et T2 de protons dans le gras, dans un solide ou dans l’eau... 15
Figure 13: Disparition de l’aimantation transverse. ... 16
Figure 14 : Relaxation transverse de deux tissus donnés... 16
Figure 15: Phénomène de relaxation. ... 17
Figure 16: Signal d'induction libre (SIL) recueilli par l'antenne de r éception. ... 18
Figure 17: Représentation schématique de T2* et de T2. ... 19
Figure 18: Coupe d’IRM du cerveau d’un patient sain ... 20
Figure 19: Interactions dipôle-dipôle entre un ion paramagnétique et les protons d’hydrogène du milieu.... 23
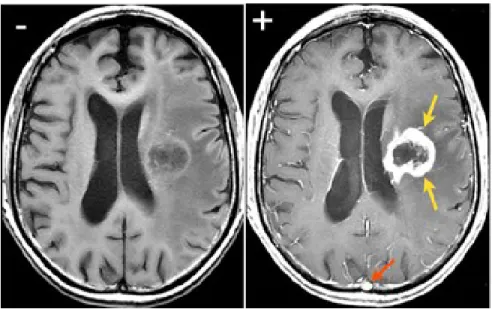
Figure 20 : Images d’IRM d’une tumeur cérébrale dont la barrière hémato-encéphalique est brisée acquises sans agent de contraste (gauche) et avec chélate de gadolinium (droite)... 28
Figure 21 : Quatre des sept chélates de gadolinium approuvés pour l’utilisation clinique ... 29
Figure 22 : Chélate de manganèse approuvé pour l’utilisation clinique... 30
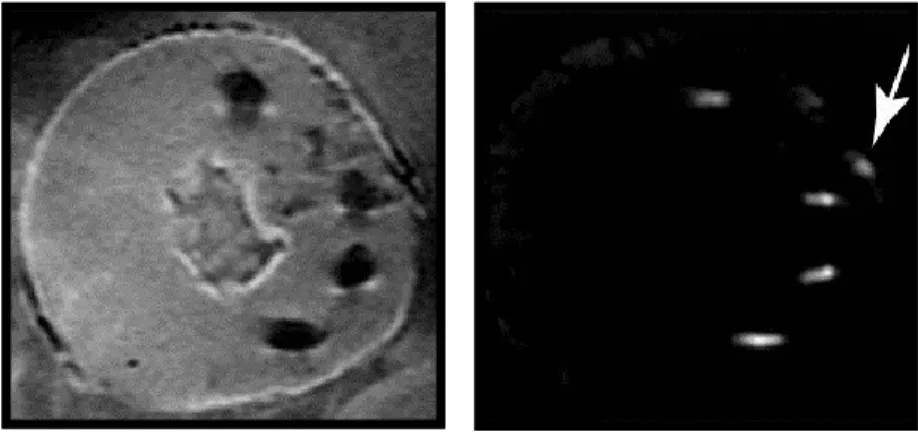
Figure 23 : Section d’un myocarde de porc imagé en écho de gradient (gauche) montrant un artéfact négatif et sa projection hors résonance à -800 Hz (droite)... 35
Figure 24: Cellules marquées avec oxyde de gadolinium implantées dans le cerveau d’une souris... 38
Figure 25: Schéma d'un AAS à flamme (haut) ou à four au graphite (bas). ... 41
Figure 26 : Rampe de température du cycle de mesure utilisé lors du dosage du manganèse. ... 42
Figure 27: Schématisation d'un appareil d’ICP-OES. ... 43
Figure 28 : Température obtenue dans une torche à plasma induit (ICP) typique. ... 44
Figure 29 : Schéma des composantes d’un appareil d’ICP-MS... 45
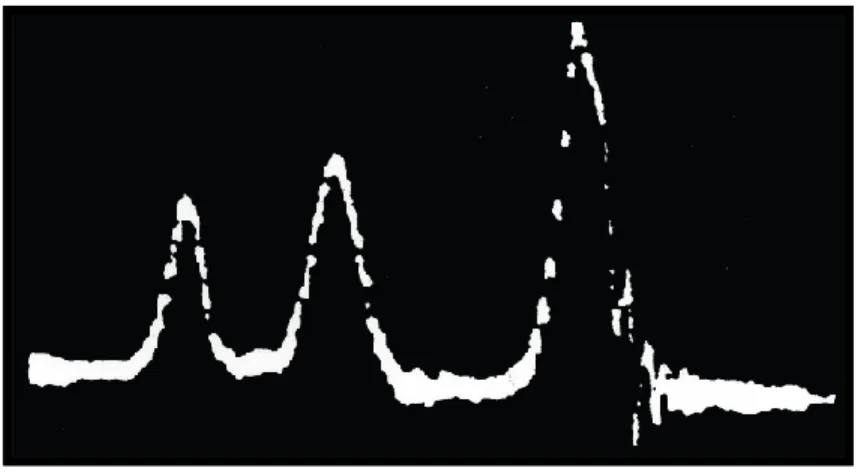
Figure 31: Fluctuation de l’intensité du signal en fonction du temps ... 52
Figure 32 : Séquenc e d’inversion-recouvrement (T1)... 53
Figure 33: Séquenc e de Carr-Purcell pour le temps de r elaxation transverse (T2). ... 54
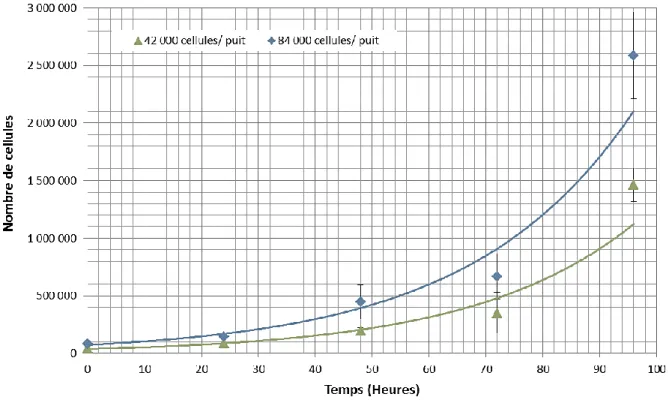
Figure 34 : Courbe de prolifération exponentielle des cellules HT-1080 ensemencées à deux concentrations. ... 56
Figure 35 : Courbe de prolifération logarithmique des cellules HT-1080 à deux concentrations... 57
Figure 36 : Courbe de prolifération logarithmique des cellules F98 ensemenc ées à deux concentrations... 57
Figure 37 : Zone quantifiable de la courbe d’étalonnage du manganèse et ses limites (LDM & LL). ... 63
Figure 38 : Microscope électronique à transmission et composantes du système. ... 65
Figure 39 : Détermination de l’intensité moyenne (mb) et de l’écart type (Stdb) de la matrice d’eau. ... 68
Figure 40 : Discrimination des voxels d’une image IRM. ... 69
Figure 41: Montage pour l’implantation de cellules par stéréotaxie. ... 70
Figure 42 : Protocole expérimental permettant de comparer deux techniques de digestion et de dosage. ... 74
Figure 43 : Le signal IRM par cellule normalisé par les quantités d’agents de contraste internalisées dans chaque cellule. ...157
Figure 44: Sélection de coupe. ...172
Figure 45: Codage de phase...173
Figure 46: Codage de fréquence. ...174
Figure 47: Principe de la transformée de Fourier. ...175
Figure 48: Image obtenue si l'on supprime l'information du centre de l'espace K. ...176
Figure 49: Image obtenue si l'on supprime l'information de la périphérie de l'espace K. ...176
Figure 50: Schéma général de la séquence écho de spin (SE). ...177
Figure 51 : Schéma général de la séquence d’écho de gradient (GRE). ...178
Figure 52 : Courbe d’étalonnage obtenue pour la validation de méthode pour le dosage du gadolinium en ICP-OES...182
Figure 53 : Courbe d’étalonnage obtenue pour de la validation de méthode pour le dosage du gadolinium en ICP-MS. ...182
Figure 54 : Images MET des cellules HT-1080 marquées avec SPMnO...183
Liste des tableaux
Tableau 1: Principaux isotopes utiles en résonance magnétique. ... 7
Tableau 2 : Temps de relaxation longitudinale (T1) et transverse (T2) pour divers tissus obtenus dans un IRM ayant un champ magnétique de 1.5 T. ... 16
Tableau 3 : Paramètres d’acquisition typiques en écho de spin d’images avec différentes pondérations... 20
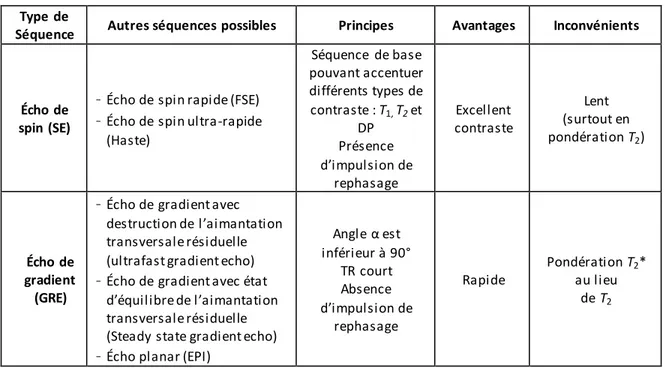
Tableau 4 : Avantages et inconvénients des différents types de séquences utilisées ... 21
Tableau 5 : Toxicité de différentes formes de gadolinium administrées par voie intraveineuse. ... 27
Tableau 6 : Toxicité de différentes formes de manganèse administrées par voie intraveineuse... 27
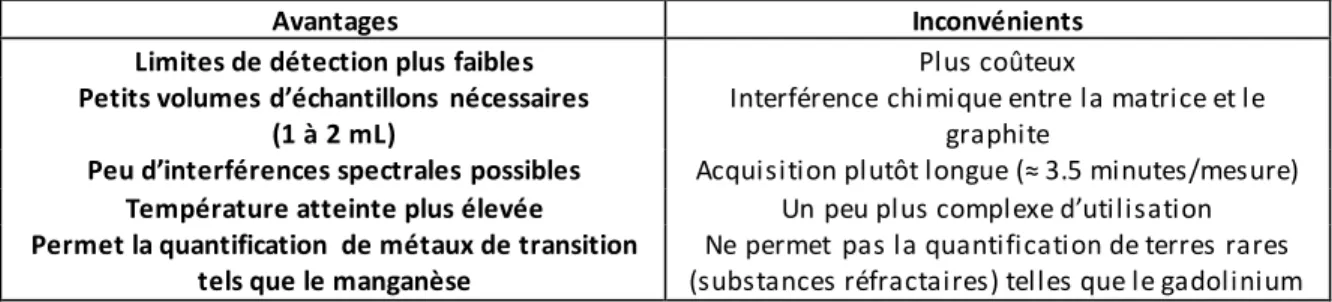
Tableau 7 : Avantages et inconvénients de l’utilisation de la spectroscopie d’absorption atomique ... 42
Tableau 8 : Avantages et inconvénients de l’utilisation de la spectroscopie d’émission (ICP -OES). ... 44
Tableau 9 : Avantages et inconvénients de l’utilisation de la spectroscopie de masse (ICP-MS). ... 46
Tableau 10 : Limites de détection du Mn et du Gd en fonction de diverses techniques d’analyse. ... 47
Tableau 11: Conditions de digestions par micro-ondes proposées par la compagnie Mars. ... 60
Tableau 12 : Traitement à faire sur les échantillons cellulaires avant la visualisation... 66
Tableau 13 : Paramètr es d’acquisition utilisés pour les images in vitro. ... 67
Tableau 14 : Paramètr es d’acquisition utilisés pour l’acquisition d’image in vivo... 71
Tableau 15 : Paramètr es obtenus de la validation de méthode pour le dosage du manganèse par GF -AAS .. 73
Tableau 16 : Paramètres obtenus de la validation de méthode pour le dosage du gadolinium par ICP -OES et ICP-MS. ... 75
Tableau 17 : Concentrations obtenues lors d’un dosage par ICP-OES de diverses solutions contenant du gadolinium digérées par deux techniques différentes. ... 75
Tableau 18 : Concentration de Gd3+ détectée en ICP-MS dans un témoin d’eau nanopure... 76
Tableau 19 : Temps nécessaire à la préparation et à la digestion d’un échantillon de dosage élémentaire, en fonction des deux techniques de digestion... 77
Tableau 20 : Tableau comparatif des études portant sur le marquage cellulaire effectué avec des nanoparticules de manganèse...147
Tableau 21 : Tableau comparatif des études portant sur le marquage cellulaire effectué avec des nanoparticules de gadolinium. ...151
Tableau 22 : Tableau comparatif des études de marquage cellulaire avec oxyde de manganèse ou de gadolinium...156
Tableau 23 : Résumé des mécanismes d’internalisation cellulaire. ...179
Tableau 24 : Avantages et inconvénients des inhibiteurs de pinocytose via le mécanisme de la clathrine. ..180
Tableau 25 : Avantages et inconvénients des inhibiteurs de pinocytose via le mécanisme de la cavéoline & de pinocytose indépendante (Rafts). ...181
Liste des équations
Équation 1 : Distribution de Boltzmann... 9
Équation 2 : Différence d’énergie entre les deux populations de protons. ... 11
Équation 3 : Valeur de la projection du vecteur d’aimantation sur l’axe des z ... 14
Équation 4 : Valeur de la projection du vecteur d’aimantation sur l’axe des xy... 15
Équation 5 : En séquences d’écho de spin, le signal d’IRM est une fonction de la densité de protons ( ), et des valeurs de T1 et T2, caractéristiques intrinsèques d’un tissu. ... 19
Équation 6 : Taux de relaxation observé dans un solvant donné. ... 24
Équation 7 : Taux de relaxation en présence d’un agent de contraste. ... 24
Équation 8 : Relaxivité causé par la présence d’un agent de contraste positif ... 25
Équation 9 : Calcul de la transmittance. ... 40
Équation 10 : Conversion de la transmittance en absorbance... 41
Équation 11 : Loi de Beer-Lambert. ... 41
Équation 12 : Calcul du temps de doublement de cellules. ... 57
Équation 13: Calcul de la LDM... 61
Équation 14 : Évaluation du rapport de conformité... 61
Équation 15: Calcul de la LQM... 62
Équation 16 : Calcul de la fidélité... 64
Équation 17: Calcul de la justesse... 64
Équation 18 : Calcul de la récupération ... 64
Légende des abréviations
Abréviations latines
CAM Membrane chorioallantoïque
DEG Diéthylène glycol
DEG-US-Gd2O3 Nanoparticules ultra-fines d’oxyde de gadolinium entourées de DEG
DMSA Acide dimercaptosuccinique
DMSA-PEG-MnO Nanoparticules d’oxyde de manganèse recouvertes d’acide dimercaptosuccinique et de polyéthylène glycol
DRX Diffraction des rayons-X
DTPA Acide diéthylène triamine penta acétique
FOV Champ de vue
GF-AAS Spectroscopie d’absorption atomique par four au graphite (GF-AAS) HAADF Détecteur annulaire à grand angle en champ sombre
HRTEM Microscopie électronique à transmission de haute résolution ICP-MS Spectroscopie de masse à plasma couplé induit
ICP-OES Spectroscopie d’émission optique par plasma à couplage inductif IRM Imagerie par résonance magnétique
MET Microscopie électronique à transmission
mM Millimolaire
MRI Imagerie par résonance magnétique (abréviation anglaise)
MW Masse molaire
NA Nombre d’Avogadro
NEX Nombre d’excitations
NMRD Résonance magnétique nucléaire dispersive
PEG Polyéthylène glycol
PEG-Gd2O3 Nanoparticules d’oxyde de gadolinium recouvertes de polyéthylène glycol
r1 Relaxivité longitudinale
r2 Relaxivité transverse
RF Radiofréquence
rhyd Rayon hydrodynamique
RMN Résonance magnétique nucléaire
SNR Ratio signal sur bruit
SPGR Spoiled gradient echo
T1 Temps de relaxation longitudinale
T2 Temps de relaxation transverse
TD-NMR Time-domain nuclear magnetic resonance
TE Temps d’écho
TR Temps de répétition
US Ultra-fine
USPIO Ultra-Small Particles of Iron Oxide USPMnO Ultra-Small Particles of Manganese Oxide
Abréviations grecques
Angle de bascule
Tension superficielle G Énergie libre de Gibbs Constante diélectrique
µ0 Constante de perméabilité du vide µeff Moment magnétique effectif
µB Magnéton de Bohr
eau Densité de l’eau
gras Densité du gras
H Densité de protons
solide Densité du solide c Temps de corrélation
c1 Temps de corrélation longitudinal c2 Temps de corrélation transverse D Temps de corrélation translationnel
M Temps d’échange entre les molécules d’eau coordonnées et l’eau du solvant R Temps de corrélation rotationnel du complexe hydraté
s Temps de relaxation électronique
s0 Temps de relaxation électronique à champ nul s1 Temps de relaxation électronique longitudinale v Temps de corrélation de la relaxation électronique 0 Fréquence de précession de Larmor du proton
eau Fréquence de précession de Larmor des protons de l’eau gras Fréquence de précession de Larmor des protons de gras I Fréquence de précession de Larmor du proton
s Fréquence de précession de Larmor des électrons
CHAPITRE 1: Introduction
Dans un futur proche, des procédures thérapeutiques nécessiteront l’injection, la visualisation et le suivi quantitatif de cellules dans le corps humain (ex. : cellules souches pour la médecine régénératrice) [1, 2]. D’autre part, certaines thérapies cellulaires, telles que l’implantation des îlots de Langerhans dans le but de reconstituer la sécrétion d‘insuline, sont maintenant en phase clinique d’approbation. La visualisation efficace et quantitative de cellules implantées est donc un enjeu majeur en médecine.
Le premier marquage cellulaire a eu lieu dès le début de la médecine nucléaire. Les chercheurs Kenneth Sterling et Seymour J. Gray ont utilisé des globules rouges marqués avec du chrome radioactif (51Cr) afin de mesurer le volume sanguin chez l’homme [3]. Cette méthode a d’ailleurs permis d’évaluer la durée de vie des globules rouges chez des patients présentant des troubles érythrocytaires. Plusieurs recherches ont été depuis réalisées afin d’être en mesure de localiser in vivo des petites quantités de cellules injectées in vivo. Plusieurs techniques d’imagerie médicale ont été utilisées telles que la tomographie par émission de positons (TEP), l’imagerie optique (bioluminescence ou fluorescence) ou l’imagerie par résonance magnétique (IRM).
Afin de démontrer l’utilité du développement d’un agent de contraste cellulaire, il est pertinent de comparer le potentiel de chaque modalité d’imagerie. Chaque technique a une sensibilité et une résolution qui lui sont propres et cela influence grandement le potentiel d’efficacité de détection des cellules marquées. La TEP est une technique d’imagerie ayant une sensibilité de détection particulièrement élevée. En revanche, il est impossible de marquer les cellules avec une grande quantité de sondes nucléaires puisque le fort rayonnement radioactif qui serait généré pourrait affecter gravement leur viabilité [4, 5]. Par ailleurs, les radio-isotopes sont rapidement excrétés par les cellules , ce qui limite les expériences dans le temps [5, 6]. Dans le cas de l’imagerie optique, qu’elle soit réalisée par le biais de la bioluminescence ou de la fluorescence, exige un accès direct (endoscopie ou chirurgie) puisque la lumière n’a pas une bonne capacité de pénétration dans les tissus. Il serait donc nécessaire d’opérer afin d’exposer le tissu à imager. Dans son ensemble, l’IRM est une excellente méthode d’imagerie puisqu’elle est la seule technique d’imagerie à pouvoir fournir des images anatomiques de haute résolution permettant la localisation et le suivi de cellules implantées dans un corps. Contrairement à la combinaison de la tomographie par émission de positrons et de la tomodensitométrie (TEP-TDM), l’IRM est en mesure de fournir une image précise de l’emplacement des cellules implantées sans utiliser de rayons ionisants. Finalement, l’IRM permet la détection de cellules dans le corps entier, en particulier lorsqu’elles sont marquées avec de l’oxyde de fer (USPIO) [7, 8], sans utilisation de rayonnement ionisant. Le marquage cellulaire grâce à un effet de contraste «négatif» (sombre) a été développé notamment par Weissleder [9-11] dans le début des années 1990.
Malgré leur petite taille, l eur caractère ferromagnétique provoque un fort contraste. Ce type d’agent est particulièrement performant puisque leur excellente sensibilité de détection est due à l’artéfact d’image qu’ils provoquent. Cet avantage est en contrepartie aussi leur plus grand désavantage. En effet, la présence de cet artéfact empêche la quantification du nombre de cellules. Le marquage cellulaire grâce à un effet de contraste «positif» (clair) a été démontré, quant à lui, au milieu des années 2000 tout d’abord par Crich (par le biais de chélate de gadolinium et d’europium) [12] puis par Aoki (grâce à du chlorure de manganèse) [13]. Un objectif demeure : il est impératif d’être en mesure, grâce à des agents de contraste, de visualiser le site d’implantation des cellules transplantées dans le tissu particulier où elles doivent exercer leur activité thérapeutique. Cette visualisation est aussi primordiale afin de faciliter l’étude mécanistique de certaines pathologies.
1.1 Objectifs du projet de maîtrise
L’objectif principal de mon projet de maîtrise porte sur l’élaboration d’une méthodologie de marquage de cellules cancéreuses au moyen d’agents de contraste à base d’oxyde de manganèse (MnO) et de gadolinium (Gd2O3), afin que celles-ci puissent être détectables en IRM (contraste positif). Pour ce faire, j’ai utilisé des agents de contraste développés au laboratoire de biomatériaux pour l’imagerie médicale (BIM). En premier lieu, les nanoparticules de MnO revêtues d’acide dimercaptosuccinique et de polyéthylène glycol (DMSA-PEG-MnO) ont été utilisées lors des recherches menées dans le cadre du chapitre 4 de ce mémoire. En second lieu, les nanoparticules de Gd2O3 vêtues de polyéthylène glycol (PEG-Gd2O3) ont été utilisées dans le cadre des travaux du chapitre 5. Les cellules marquées avec les deux agents de contraste ont été visualisées en IRM sous forme de culots de cellules de différentes tailles, et le signal unitaire par cellule a été corrélé à la concentration d’éléments paramagnétiques internalisés.
Trois objectifs secondaires ont aussi été identifiés lors de l’élaboration de ce projet de maîtrise:
1. Évaluer la viabilité des cellules marquées (Chapitre 5 et Chapitre 6).
2. Quantifier l’internalisation cellulaire en mesurant précisément la concentration de Mn ou de Gd internalisée dans les cellules. Pour ce faire, un protocole de dosage des deux éléments par analyse élémentaire a été élaboré, puis validé (Chapitre 4).
3. Visualiser la répartition dans la cellule des agents de contraste par microscopie électronique à transmission (MET) (Chapitre 5 et Chapitre 6).
Finalement, des cellules marquées de PEG-Gd2O3 ont été implantées par stéréotaxie chez la souris afin d’effectuer un suivi de la prolifération des cellules in vivo. Ce mémoire porte sur le développement et
l’évaluation des procédures de marquage cellulaire au moyen de nanoparticules paramagnétiques (MnO et Gd2O3).
1.2 Structure du mémoire
Ce mémoire de maîtrise est constitué de neuf chapitres. La seconde section consiste en un survol des concepts théoriques essentiels à la compréhension de ce projet de recherche. Dans la troisième section sont détaillées les méthodologies employées pour la réalisation des expériences. La validation de la méthode de quantification de l’internalisation cellulaire par analyse élémentaire (ICP-MS et GF-AAS) est abordée lors de la quatrième section. La section suivante est constituée d’un article scientifique portant sur l’utilisation d’oxyde de manganèse (SPMnO et USPMnO) pour le marquage de cellules cancéreuses. La sixième section porte sur l’utilisation de PEG-Gd2O3 pour le marquage de cellules cancéreuses F98 (cancer cérébral) ainsi que l’implantation de ces cellules dans les cerveaux de souris. La septième section sera constituée d’une discussion traitant des résultats présentés aux chapitres 4, 5 et 6. L’avant-dernière section portera sur les perspectives d’avenir du projet. Finalement, la neuvième et dernière section de ce mémoire sera une conclusion générale répondant aux objectifs de ce travail.
CHAPITRE 2: Cadre théorique
2.1 Imagerie par résonance magnétique (IRM)
2.1.1 Description de la technique d’imagerie
L’IRM est une technique d’imagerie médicale à haute résolution (100 microns) permettant de visualiser l’intérieur du corps sans utiliser de rayonnement ionisant. Elle permet aussi d’obtenir d’excellents effets de contraste entre les tissus mous tels que ceux du cerveau (Figure 1) [14].
Figure 1: Images IRM du cerveau. (Figure tirée de Southern Health [14])
2.1.2 Historique
Le fonctionnement de ce type d’imagerie repose sur les principes de résonance magnétique nucléaire (RMN). La RMN consiste à étudier l’influence sur l’aimantation de certains noyaux par l’action conjointe de deux champs magnétiques, l’un fixe ( ⃗ 0) et l’autre rotatif ( ⃗ 1). Le phénomène de résonance magnétique nucléaire a été décrit par deux équipes indépendantes, celle de Felix Bloch à Stanford et celle d’Edwa rd M. Purcell à Harvard en 1946, 22 ans après la découverte des spins par Pauli [15]. Ils obtinrent, pour cette découverte, le prix Nobel de physique en 1952 [16].
Les années 1950 à 1970 furent consacrées au développement de la spectroscopie par résonance magnétique grâce au travail acharné des biologistes, chimistes et physiciens de l’époque. En utilisant des appareils de recherche, i ls étudièrent l’influence de la fréquence d’excitation sur différents noyaux (1H, 13C, 31
P…), dans différentes molécules, au moyen de spectres révélant les fréquences de vibration propres à chaque noyau « excitable ». Par exemple, des physiciens ont trouvé difficile de mesurer précisément le
moment magnétique d’un noyau puisque son environnement chimique provoquait un déplacement du signal obtenu de sa «vraie valeur». Ce phénomène fut alors désigné « déplacement chimique», sans que ne fût immédiatement réalisée l’importance analytique de cette découverte. C’est ainsi que plusieurs caractéristiques, conduisant à une meilleure compréhension des données RMN, ont été découvertes, notamment le blindage chimique (1950) et les interactions spin-spin (1952) [17]. Le premier spectromètre RMN fut commercialisé en 1953. Le type de spectre que procuraient les appareillages RMN de l’époque (Figure 2) [18] était loin d’être comparable à ceux d’aujourd’hui .
Figure 2: Spectre du proton de l’éthanol obtenu avec le premier appareillage de RMN (30 MHz, Université de Stanford, 1951).
(Figure tirée de Arnold, 1951 [18])
L’IRM clinique est principalement axée sur le noyau d’hydrogène (1H), celui-ci étant particulièrement abondant dans le corps humain. Les autres noyaux présents dans le corps humain (13C, 19F, 23Na, 31P) ne sont pas encore largement utilisés puisqu’ils ont une abondance isotopique et une sensibilité beaucoup moins importante que celle du proton. Ce n’est qu’en 1971 que Raymond Damadian [19] rapporta une différence entre les réponses de tissus sains et cancéreux chez les rats grâce à la RMN. En 1973, Lauterbur utilisa une technique similaire et démontra pour la première fois, la possibilité de faire de l’imagerie grâce à la résonance magnétique [20]. L’évolution de cette technique fut alors très rapide. En 1975, Richard Ernst (Prix Nobel de chimie en 1991) [21] améliora la technique d’imagerie grâce à l’utilisation de la transformée de Fourier avec un codage de phase et de fréquence [22]. Ernst avait proposé l’utilisation de la transformée de Fourier pour la première fois en 1966 dans le cadre d’expérimentations sur la RMN [23]. Ce traitement permet une augmentation considérable de la sensibilité de l’appareil (10 à 100 fois). La transformée de Fourier est encore aujourd’hui le concept clé à la base des appareils de résonance magnétique (RMN comme IRM). C’est l’équipe d’Edelstein en 1980, qui a acquis la première image d’un corps grâce à la technique de transformée de Fourier (Figure 3) [24].
Figure 3: Premier scan IRM sur un être humain avec transformée de Fourier. (Figure tirée de Edelstein, 1980 [24])
Cette image a nécessité cinq minutes d’acquisition, un temps relativement long compte tenu de la résolution et des détails qu’elle fournit. Heureusement, les améliorations des cinq à six années qui suivirent permirent de réduire le temps d’acquisition d’image de cette qualité à moins de cinq secondes. L’IRM commença à s’imposer dans les routines cliniques à travers les États-Unis puis partout ailleurs dans le monde. Le premier appareil d’IRM clinique fut commercialisé par FONAR Corp. grâce à l’aide de M. Raymond Damadian [25].
Depuis les années 1980, de nombreuses avancées technologiques ont permis à l’IRM de devenir une des techniques d’imagerie les plus puissantes . C’est en 1977 que les séquences d’acquisition écho-planar (EPI) [26, 27] ont fait leur début grâce à Peter Mansfield (Prix Nobel de physiologie ou de médecine en 2003) [28]. Par exemple, l’apparition en 1987 de l’angiographie par résonance magnétique (ARM) [29] permit d’obtenir une cartographie du sang s’écoulant dans le corps humain. L’imagerie par résonance magnétique fonctionnelle (IRMf) [30-32] permet les fonctionnalités des différentes régions du cerveau. Cette fonctionnalité est possible puisque l’activité neuronale entraîne des changements dans le débit, le volume et l’oxygénation du sang [30, 31]. L'IRM devint rapidement indispensable pour le diagnostic de divers troubles dans les centres hospitaliers. Aujourd’hui, les avancées dans le domaine du marquage cellulaire permettent d’étendre le domaine d’applications de l’IRM. En effet, la possibilité de suivre l’évolution de cellules marquées in vivo permettrait le développement de nouvelles procédures pour les études biologiques fondamentales et pour divers diagnostics en lien avec la di ffusion et le suivi de cellules. Il est donc impératif de développer des agents de contraste efficaces pour ces nouvelles procédures de marquage cellulaire.
2.1.3 Avantages et inconvénients de l’IRM pour l’imagerie cellulaire
L’IRM est la technique d’imagerie de choix pour le suivi de cellules implantées in vivo puisqu’elle permet d’obtenir leur localisation précise dans l’organisme, grâce à l’excellente résolution des images qu’elle fournit. D’autres techniques d’imagerie peuvent être envisagées, mais elles sont moins avantageuses. En
effet, soient elles sont incapables de pénétrer en profondeur (ultra-son et fluorescence), soient elles ne permettent pas d’obtenir une résolution aussi importante (TEP-TDM).
2.1.4 Mode de fonctionnement
La résonance magnétique est un phénomène qui repose sur les principes d’acquisition de signal produit par des mécanismes d’excitation et de relaxation des noyaux de certains éléments chimiques (RMN : 1H, 13C, 19F, 23
Na, 31P et pour IRM : 1H éventuellement 19F). Ces mécanismes sont possibles seulement si les noyaux atomiques possèdent un spin nucléaire non nul. Les isotopes les plus fréquemment utilisés en résonance magnétique nucléaire sont les suivants (Tableau 1) [33] :
Isotope
Spin
Abondance
isotopique
(%)
Moment
magnétique
( )
Concentration
relative dans le
corps* (%)
Sensibilité
relative
1H
1/2 99.98 2.79 100 1.000 17O
5/2 0.04 1.89 50 9.0 x 10-6 19F
1/2 100.00 2.63 4.0 x 10-6 3.0 x 10-8 23Na
3/2 100.00 2.22 8.0 x 10-2 1.0 x 10-4 31P
1/2 100.00 1.13 7.5 x 10-2 6.0 x 10-5*Incl ua nt tous l es i s otopes de l ’él ément
Tableau 1: Principaux isotopes utiles en résonance magnétique. (Tableau tiré de Bushberg, 2002 [33])
Lorsque ces noyaux sont soumis à un champ magnétique, leurs spins s’alignent de manière parallèle ou antiparallèle avec le champ. Un vecteur d’aimantation résiduel ( ⃗⃗ ) est généré par la différence de population entre les niveaux énergétiques. Afin de permettre l’aimantation des tissus exposés, la RMN, tout comme l’IRM, nécessite un champ magnétique stable, puissant et uniforme. L’IRM clinique utilise un champ magnétique relativement fort, entre 1.5 et 3.0 Teslas (Figure 4) [34].
Figure 4 : Appareil d’imagerie par résonance magnétique (IRM) moderne ainsi que ses composantes. (Figure tirée de Coyne [34])
Afin de bien comprendre cette technique d’imagerie, il est pertinent de s’attarder aux principes physiques qui régissent son fonctionnement tel que le phénomène de résonance magnétique (Section 2.1.4.1) ainsi que celui de relaxation des protons (Section 2.1.5).
2.1.4.1 Phénomène de résonance magnétique nucléaire
Le noyau d’hydrogène est constitué d’une particule chargée positivement, appelée proton. Celui -ci tourne sur lui-même, provoquant l’apparition d’un moment magnétique nucléaire (vecteur d’aimantation; ⃗⃗ ). Exposé à un champ magnétique ( ⃗ 0), le vecteur s’y alignera de manière parall èle ou antiparallèle. Contrairement à une boussole, cet alignement n’est pas composé de vecteurs orientés tous dans le même sens, mais bien de deux populations puisque les noyaux obéissent aux règles de la mécanique quantique. L’une de ces populations sera orientée da ns le sens du champ (parallèl e; Figure 5a, côté droit en bas) et l’autre en sens contraire (antiparallèle; Figure 5b, côté droit en haut). Un vecteur d’aimantation ( ⃗⃗ sera alors formé puisque les deux populations ne seront pas présentes en nombre égal, mais distribuées sur deux niveaux énergétiques selon la distribution de Boltzmann (Équation 1).
⁄
KB : constante de Boltzmann; T : température; gi : dégénérescence (nombre d’états d’énergie Ei); N : nombre total de particules
Équation 1 : Distribution de Boltzmann.
Afin de mieux comprendre les fondements de l’IRM, il est primordial d’utiliser deux approches : celle de la mécanique classique et celle de la mécanique quantique. La mécanique classique permet de comprendre des notions importantes telles que les notions de précession et de bascule, tandis que le modèle quantique permet de bien comprendre les phénomènes de relaxation.
2.1.4.1.1 Modèle classique
En l’absence de l’influence du champ magnétique, le vecteur d’aimantation élémentaire ( ⃗⃗ ) des protons d’un échantillon est orienté de manière aléatoire. L’échantillon est alors en état d’équilibre, et la somme des vecteurs est un vecteur d’aimantation macroscopique ( ⃗⃗ ) nul (Figure 5) [35].
Figure 5 : Comportement des spins des protons
en absence (gauche) ou en présence (droite) d’un fort champ magnétique orienté selon l’axe des z. (Figure tirée de Kastler, 2003 [35])
Lorsque les protons se retrouvent en présence d’un champ magnétique, ils s’orientent de manière parallèle ou antiparallèle, provoquant l’apparition d’un vecteur d’aimantation macroscopique dans le tissu hydrogéné ( ⃗⃗ ). La répartition des protons sur chacun de ces niveaux d’énergie (parallèle : le niveau de plus basse énergie et antiparallèle : le niveau de plus haute énergie) est à peu près équivalente. Par contre, il y a une très faible proportion de protons préférentiellement alignés de manière parallèle ce qui permettra la génération d’un signal de RMN. Cet excès engendre l’apparition du vecteur d’aimantation macroscopique ( ⃗⃗ ). Cette différence varie en fonction du champ magnétique (Figure 7) et de la température (Équation 1).
∑ ⃗⃗ ∑ ⃗⃗
b)
À l’équilibre (état initial), ce vecteur parallèle au champ sur l’axe z (Figure 6) subit un mouvement de précession autour de ⃗ 0 (Figure 6, coin supérieur droit) selon un angle précis. Cette composante en z est appelée aimantation longitudinale ( ⃗⃗ ). Par ailleurs, la dispersion des composantes transverses (plan xy) élémentaires dans toutes les directions produit une résultante transverse nulle ( ⃗⃗ ).
Il est possible de perturber cet état d’équilibre grâce à l’application d’un deuxième champ magnétique tournant appelé ⃗ 1, appliqué dans le plan xy (horizontal). Il est produit par une onde électromagnétique radiofréquence (onde RF) générée en faisant passer un courant oscillant à travers une bobine. Sa fréquence de rotation ( ) est synchronisée à la fréquence de Larmor spécifique au proton d’hydrogène pour une intensité de champ magnétique donnée ( ⃗ ). Les deux systèmes sont alors en résonance ( ). À ce moment, le vecteur d’aimantation tournant autour de ⃗ 0 à une fréquence angulaire ( ⃗ ) va aussi se mettre à précesser autour de ⃗ à une seconde fréquence angulaire ( ⃗ ) créant ainsi un mouvement de double précession géométriquement complexe, tel qu’illustré par la Figure 6 [35].
Figure 6: Mouvement de double précession occasionné lors de l’application simultanée de B0 et de B1. (Figure inspirée de Kastler, 2003 [35])
Lorsque l’onde RF est générée, il y a diminution de la composante longitudinale ( ⃗⃗ ) et augmentation progressive de la composante transverse ( ⃗⃗ ). L’impulsion RF est de très courte durée (ms). Le vecteur d’aimantation bascule d’un angle généralement égal à 90° ( ⃗⃗ ) ou à 180° ( ⃗⃗ ⃗⃗ ). Dès la fin de l’excitation, le vecteur d’aimantation retourne à son état initial d’équilibre en précessant autour de ⃗ . Ce retour se traduit par une diminution rapide de la composante transverse ( ⃗⃗ ) et une croissance
progressive de la composante longitudinale ( ⃗⃗ ) : ces phénomènes parallèles et complémentaires sont appelés respectivement relaxation transverse (r2) et relaxation longitudinale (r1).
2.1.4.1.2 Modèle quantique
Tel que mentionné précédemment, les protons chargés positivement induisent un moment magnétique résultant de leur spin et de leur mouvement de rotation. L’excitation des spins au moyen de l’impulsion RF a pour résultat de mettre en phase les spins et de basculer le vecteur d’aimantation dans le plan xy ( ⃗⃗ ). Lorsque l’échantillon retrouve son état d’équilibre, il y a perte de cohérence des spins résultant d’une interaction mutuelle (Figure 5, côté gauche). En effet, le déphasage des protons est provoqué par l’induction de petits champs magnétiques locaux qui vont légèrement modifier la fréquence de précession ( ) des protons d’hydrogène situés à proximité les uns des autres. En réalité, l’état d’équilibre obtenu est composé de ces deux populations de spins , l’une parallèle et l’autre antiparallèle. La population parallèle au champ magnétique est en excès ce qui permet la création d’un vecteur d’aimantation (voir Section 2.1.4.1.1). La différence d’énergie entre les deux niveaux est égale à (Équation 2) :
E ⃗
Équation 2 : Différence d’énergie entre les deux populations de protons.
On voit que cette différence d’énergie est proportionnelle au champ magnétique ( ⃗ ) (Figure 7) [35].
Figure 7 : Différence énergétique entre les deux populations de protons 1H soumis à un fort champ magnétique.
(Figure tirée de Kastler, 2003 [35])
Ainsi, en fournissant grâce à la RF, la quantité d’énergie égale à une transition de protons du niveau E1 vers le niveau E2 (E1→ E2; Figure 8a), il est possible de modifier l’aimantation macroscopique d’un échantillon. En
effet, lors de l’application de l’excitation RF, il se produit un transfert de protons la population de basse énergie vers celle de haute énergie (Figure 8b) [35].
Lorsque le nombre de protons en excès passe du niveau E1 vers le niveau E2, l’égalisation des populations de protons annule provisoirement la composante longitudinale de l’aimantation macroscopique du tissu ( ⃗⃗ ; Figure 8b). D’autre part, il y a inversion de la composante longitudinale ( ⃗⃗ ⃗⃗ ) si tous les protons en excès étaient distribués sur le niveau E2 (Figure 8c). Ainsi, le phénomène d’atténuation et d’inversion de la composante longitudinale du vecteur macroscopique d’aimantation ( ⃗⃗ ) s’explique à la fois par les principes de la mécanique classique et de la mécanique quantique (Figure 8) [35].
Figure 8: Représentation schématique décrivant l’effet général des impulsions RF sur le vecteur d'aimantation macroscopique.
(Figure tirée de Kastler, 2003 [35])
L’apparition de la composante transverse ( ⃗⃗ ) fait appel à un autre principe : le rephasage des spins. Lorsque les protons subissent un transfert de niveau d’énergie, ils le font de manière simultanée les uns par rapport aux autres, faisant apparaître une composante transverse au vecteur d’aimantation. Il est possible
a)
b)
d’influencer la composante longitudinale ainsi que celle transverse du vecteur d’aimantation, grâce à deux mécanismes distincts et simultanés : les phénomènes de transition et de rephasage des protons.
Dès la fin de l’impulsion RF, il se produit un retour graduel à l’équilibre grâce aux phénomènes inverses. D’une part, le déphasage rapide des spins fait décroître rapidement la composante transverse ( ⃗⃗ ); d’autre part, une série de transitions inverses des protons du niveau E2 vers le niveau E1 (E2→ E1) fait réapparaître progressivement la composante longitudinale ( ⃗⃗ ). Ces phénomènes de relaxation transverse et longitudinale sont mesurables au moyen de bobines d’induction et permettent de quantifier les phénomènes de résonance magnétique nucléaire.
2.1.5 Temps de relaxation et relaxométrie
Afin de mieux comprendre les mécanismes de la relaxation longitudinale ( ⃗⃗⃗ ; T1; Section 2.1.5.1) et transverse ( ⃗⃗⃗ ; T2; Section 2.1.5.2) illustrés à la Figure 9 [35], il est préférable d’aborder ces phénomènes séparément.
Figure 9 : Schématisation des phénomènes de relaxation transverse et longitudinale. (Figure tirée de Kastler, 2003 [35])
2.1.5.1 Relaxation longitudinale (T
1)
Suite à l’impulsion RF, il y a une disparition de la composante longitudinale ( ⃗⃗ ) grâce à l’égalisation des spins sur les deux niveaux d’énergie (Figure 8b). Dès l’arrêt de l’impulsion, l’aimantation longitudinale revient graduellement à son état initial, ce phénomène s’appelle relaxation longitudinale. Le retour est possible, car les protons du niveau supérieur ont emmagasiné un excès d’énergie qui est retourné au milieu environnant par un échange thermique [35].
( ⁄ )
Équation 3 : Valeur de la projection du vecteur d’aimantation sur l’axe des z
Cette récupération de l’aimantation se fait selon une tendance exponentielle croissante (Équation 3). Le temps (T1) correspond au temps nécessaire pour récupérer 63 % de la composante longitudinale caractéristique à chaque tissu (Figure 10) [35].
Figure 10 : Récupération de l’aimantation longitudinale.
(Figure tirée de Kastler, 2003 [35])
Figure 11 : Relaxation longitudinale de deux tissus donnés. (Figure tirée de Hoa, 2007 [36])
Plus le T1 est court, plus le retour de l’aimantation longitudinale est rapide (Figure 11) [36]. Les tissus biologiques ont des T1 variant entre 500 et 1000 ms en fonction de leur structure moléculaire et de leur état (T1 plus long dans les liquides que dans les solides). Ces différences sont utilisées dans les séquences d’imagerie dites « pondérées en T1 » (Section 2.1.8).
2.1.5.1.1 Paramètres influençant les valeurs de T
1dans un tissu
Les différences de temps de relaxation longitudinal e (T1) proviennent de la capacité des protons excités à redonner leur énergie excédentaire au milieu (relaxation spin-réseau). Ce transfert est favorisé lorsque les
fréquences de mouvements translationnels, vibrationnels et rotationnels des tissus sont similaires à la fréquence de Larmor (ωo), c’est-à-dire 63.4 MHz pour un champ magnétique de 1.5 Tesla. Par exemple, l’eau a une fréquence de vibration supérieure à la fréquence de Larmor (ωeau >>> ωo), ce qui provoque peu d’échange énergétique avec le milieu. Le gras, d’autre part, a une fréquence de rotation du li en carbone-carbone (C-C) près de celle de Larmor (ωgras ≈ ωo) [37], ce qui permet un bon transfert d’énergie et donc une meilleure relaxation longitudinale (Figure 12) [37]. Si l’eau se lie aux macromolécules présentes dans un milieu biologique, il y aurait perte de degré de liberté. Sa fréquence naturelle se rapprocherait alors de celle de Larmor, entraînant une diminution du T1.
Figure 12 : Temps de relaxation T1 et T2 de protons dans le gras, dans un solide ou dans l’eau. (Figure tirée de Hashemi, 2003 [37])
2.1.5.2 Relaxation transverse (T
2)
Tel que vu précédemment (section 2.1.4.1.2), la mise en phase des protons suite à l’impulsion radiofréquence, engendre la composante transverse du vecteur d’aimantation macroscopique ( ⃗⃗ ). Dès l’arrêt de l’impulsion, il y a un rapide déphasage des protons. Ce phénomène s’appelle relaxation transverse ou spin-spin en raison de l’interaction des protons entre eux. Cette relaxation est provoquée par des inhomogénéités du champ magnétique local par l’évolution des protons dans des environnements moléculaires différents. La superposition de ces champs avec le champ magnétique de l’appareil engendre une précession des protons à des vitesses légèrement différentes. C’est cette variation de vitesse de précession qui provoque une diminution de signal. La relaxation transverse s’effectue selon une fonc tion exponentielle décroissante résultant de l’atténuation de l’aimantation dans le plan xy (Figure 13 et Équation 4) [35].
⁄
Le T2 est une caractéristique intrinsèque à chaque tissu et elle correspond à 63 % de décroissance de la composante xy de l’aimantation macroscopique (37 % de l’aimantation transverse totale). La relaxation T2
est reliée à la présence d’inhomogénéités de champ au niveau moléculaire.
Figure 13: Disparition de l’aimantation transverse.
(Figure tirée de Kastler, 2003 [35])
Figure 14 : Relaxation transverse de deux tissus donnés.
(Figure tirée de Hoa, 2007 [36])
Ainsi, plus le T2 est long, plus la disparition de l’aimantation transverse sera lente (Figure 14) [36]. Les tissus biologiques ont des T2 variant entre 50 et 100 ms en fonction de leur structure moléculaire et de leur état (T2 plus long dans les liquides que les solides). Ces valeurs sont approximativement cinq à dix fois plus petites que le T1 du même tissu biologique. Ces différences sont utilisées en imagerie pour des séquences pondérées en T2 (Section 2.1.8).
2.1.5.2.1 Paramètres influençant les valeurs de T
2dans un tissu
La valeur de T2 varie en fonction des interactions spin-spin entre les noyaux d’hydrogène présents à l’intérieur des molécules des divers tissus (Tableau 2) [38].
Tissus
T
1(ms)
T
2(ms)
Eau libre (solution) 3000 1500
Tissus adipeux 240-250 60-80
Cerveau (matière grise) 920 100
Cerveau (matière blanche) 780 90
Liquide céphalo-rachidien 2500 1000
Foie 490 40
Reins 650 60-75
Muscles 860-900 50
Tableau 2 : Temps de relaxation longitudinale (T1) et transverse (T2) pour divers tissus obtenus dans un IRM ayant un champ magnétique de 1.5 T.