Influence des nanoparticules d’argent élaborées par
procédé plasma sur la conformation de la fibronectine
Mémoire
Maîtrise en génie des matériaux et de la métallurgie - avec mémoire
Laurine Martocq
Université Laval
Québec, Canada
Maître ès sciences (M. Sc.)
et
Université Toulouse III - Paul Sabatier
Master (M.)
Influence des nanoparticules d’argent élaborées par
procédé plasma sur la conformation de la fibronectine
Mémoire
Maîtrise en génie des matériaux et de la métallurgie
Maître ès sciences (M. Sc)
Laurine Martocq
Sous la direction de :
Gaétan Laroche, Université Laval
Résumé
L’objectif de ce projet est d’étudier l’influence de nanoparticules d’argent intégrées dans une matrice organosiliciée sur l’organisation de la fibronectine. L’argent étant connu depuis des siècles pour ses propriétés antibactériennes, l’étude de l’adsorption de protéines au contact de ces nanoparticules est essentielle en vue d’une utilisation dans le domaine biomédical. Dans un premier temps, les nanoparticules ont été intégrées dans une matrice organosiliciée, le tout synthétisé par plasma à basse pression. La présence d’argent dans le plasma durant le dépôt a été analysée par spectroscopie d’émission optique. Puis, la fibronectine a été adsorbée sur les surfaces pour étudier l’influence des nanoparticules. Les surfaces ont été caractérisées par différentes techniques notamment par spectroscopie photoélectronique par rayons X pour identifier la présence d’argent et de la fibronectine. La rugosité des surfaces a également été analysée par microscopie à force atomique et des mesures d’angle de contact dynamique ont été réalisées. Enfin, pour quantifier la fibronectine sur les surfaces et pour connaître l’organisation de la protéine, des tests ELISA ont été effectués.
Abstract
The objective of this project is to study the influence of silver nanoparticles embedded in an organosilicon matrix on the fibronectin organization. Silver is known for its antibacterial properties for several centuries, the study of protein adsorption in contact of these nanoparticles is essential for a use in biomedical field. First, nanoparticles were embedded in an organosilicon matrix, all synthetized by low-pressure plasma. Presence of silver in the plasma during the deposition was analyzed by optical emission spectroscopy. Then, fibronectin was adsorbed on the surfaces to study the influence of silver nanoparticles. Surfaces were characterized by different methods, especially by X-ray photoelectron spectroscopy to identify the presence of silver and fibronectin. Roughness of the surfaces was analyzed by atomic force microscopy and dynamic contact angle measurements were realized. Finally, to quantify the fibronectin adsorbed on the surfaces and to know the protein organization, ELISA tests were performed.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vi
Liste des tableaux ... viii
Liste des abréviations ... ix
Remerciements ... x
Avant-propos ... xi
Introduction ... 1
Chapitre 1 – État de l’art ... 3
1.1 Biofilms et le rôle potentiel des protéines dans la formation de biofilms ... 3
1.2 Nanoparticules d’argent et leur utilisation comme agents antimicrobiens ... 8
1.3 Élaboration par procédé plasma de couches minces nanocomposites contenant des nanoparticules d’argent ... 12
1.4 Interactions des protéines avec des surfaces solides ... 20
Chapitre 2 – Matériel et méthodes ... 26
2.1 Fibronectine – Préparation des solutions protéiques ... 26
2.2 Procédé plasma au Laplace ... 26
2.3 Substrats étudiés ... 28
2.3.1 Couches minces de SiOC:H ... 28
2.3.2 Couches minces nanocomposites contenant des AgNPs intégrées dans une matrice SiOC:H ... 28
2.4 Dépôt de couches protéiques de fibronectine sur des couches minces nanocomposites ... 29
2.5 Méthodes de caractérisation des surfaces ... 29
2.6 Tests ELISA (Enzyme-Linked Immunosorbent Assay)... 31
Chapitre 3 – Article: Influence of silver nanoparticles on fibronectin adsorption at the surface of a plasma-deposited organosilicon coating ... 32
3.1 Résumé ... 32
3.3 Introduction ... 32
3.4 Material and methods ... 33
3.4.1 Plasma process ... 33
3.4.2 Fibronectin adsorption... 34
3.4.3 Surface characterization ... 35
3.5 Results and discussion ... 35
3.6 Conclusion ... 39
3.7 Acknowledgments ... 39
Chapitre 4 – Résultats supplémentaires : tests ELISA ... 40
Conclusion ... 41
Liste des figures
Figure 1 : Formation d’un biofilm sur une surface solide [8,10] ... 3
Figure 2 : Représentation en 3D d’un fragment de FN [20]... 6
Figure 3 : Représentation schématique de la structure de la fibronectine [21] ; les trois modules : type I en bleu, type II en marron, type III en vert ; les extradomaines A et B résultant de l’épissage alternatif et le domaine variable V en jaune ; les domaines de type I N-terminal marqués d'un astérisque rouge hébergent un motif immunoglobuline D (IgD) ; les sites d’adhésion pour la FN, le collagène, la fibrine, l’héparine et les bactéries sont indiqués ainsi que les sites de liaison des intégrines. ... 6
Figure 4 : Mécanismes d’action des AgNPs... 9
Figure 5 : Pansements à base d’argent : (A) ACTICOAT par Smith and Nephew et (B) ACTISORBTM Silver 220 par Johnson and Johnson [54,55] ... 9
Figure 6 : Vue schématique (a) d’un plasma et (b) d’une décharge [59] ... 13
Figure 7 : Évolution spatiale du potentiel plasma dans l’espace inter-électrode ... 15
Figure 8 : Dépôt physique en phase vapeur de l’argent par procédé plasma ... 16
Figure 9 : Dépôt chimique en phase vapeur assisté par plasma de la matrice organosiliciée SiOC:H ... 17
Figure 10 : Spectre FTIR de dépôts de SiOC:H [5] ... 17
Figure 11 : (a) et (b) Images TEM d’un revêtement organosilicié constitué d’AgNPs à différentes échelles et (c) distribution en taille des AgNPs [41] ... 19
Figure 12 : Représentation schématique des différentes structures des protéines (A) structure primaire, (B) structure secondaire, (C) structure tertiaire et (D) structure quaternaire [75] ... 20
Figure 13 : Adsorption d’une protéine sur une surface [78,81]... 21
Figure 14 : Angle de contact θ d’un liquide sur une surface solide ... 22
Figure 15 : Ligne du haut : après adsorption de BSA à 0,05 g/L, (a) image au microscope optique, (b) et (c) images AFM à différentes échelles. Ligne du bas : après adsorption de DsRed à 0,05 g/L, (d) image au microscope optique, (e) et (f) images AFM à différentes échelles [84]. ... 23
Figure 16 : Schéma du réacteur plasma RF asymétrique capacitif [91] ... 26
Figure 17 : Cycle d’injection de l’HMDSO ... 27
Figure 18 : Représentation schématique de la structure de la couche mince organosiliciée SiOC:H (réalisée sur [92]) ... 28
Figure 19: Représentation schématique de la structure de la couche mince nanocomposite contenant les AgNPs dispersées dans une matrice de SiOC:H (réalisée sur [92]) ... 29 Figure 20 : Représentations schématiques de l’adsorption de FN sur les surfaces (réalisées sur [92]) ... 29 Figure 21: Schematic representation of the axially-asymmetric radiofrequency plasma reactor ... 33 Figure 22: OES spectra from the plasma sustained in Ar/HMDSO mixture for the organosilicon (SiOC:H) layer and the nanocomposite (SiOC:H+AgNPs) layer deposition ... 36 Figure 23: (A) Elemental composition of the surfaces and (B) atomic ratios O/Si and C/Si ... 36 Figure 24 : High resolution spectra of (A) SiOC:H, (B) SiOC:H+AgNPs, (C) FN/SiOC:H and (D) FN/SiOC:H+AgNPs ... 37 Figure 25: (A) Average roughness of the surfaces and their AFM images corresponding of (B) SiOC:H, (C) FN/SiOC:H, (D) SiOC:H+AgNPs and (E) FN/SiOC:H+AgNPs ... 38 Figure 26: (A) Dynamic contact angle measurements for the different surfaces and (B) static angle and hysteresis corresponding to the measurements ... 38 Figure 27 : Résultats des tests ELISA ; (A) Quantification de la concentration de FN adsorbée sur les surfaces (polyclonal) et (B) Disponibilité des sites spécifiques (monoclonal) – Q : quartz ... 40
Liste des tableaux
Tableau 1 : Facteurs influençant l’adhésion microbienne sur une surface réceptrice ... 5 Tableau 2 : Exemples de méthodes utilisées pour la synthèse de AgNPs ... 10
Liste des abréviations
AFM : Microscopie à forme atomique/Atomic force microscopy AgNPs : Nanoparticules d’argent/Silver nanoparticles
FN : Fibronectine/Fibronectin
FTIR : Spectroscopie infrarouge à transformée de Fourier/Fourier transform infrared spectroscopy
HMDSO : Hexamethydisiloxane
OES : Spectroscopie d’émission optique/Optical emission spectroscopy
PECVD : Dépôt chimique en phase vapeur assisté par plasma/Plasma enhanced chemical vapor deposition
PPI : Pour préparation injectable
PVD : Dépôt physique en phase vapeur/Physical vapor deposition RF : Radiofréquence/Radiofrequency
ROS : Espèces oxygénées réactives/Reactive oxygen species SiO2plasma : Silice obtenue par plasma/Silica obtained by plasma
SiO2th : Silice obtenue par oxydation thermique/Silica obtained by thermal oxidation
SiOC:H Organosilicié(e)/Organosilicon
TEM Microscopie électronique à transmission/Transmission electron microscopy XPS : Spectroscopie photoélectronique par rayons X/X-ray photoelectron spectroscopy
Remerciements
Pour commencer, je tiens à remercier mes directeurs de recherche, Gaétan Laroche et Kremena Makasheva. Vous m’avez donné l’opportunité de réaliser ce projet sur plus d’un an et demi, au sein de vos laboratoires respectifs dans le cadre de ce double diplôme et je vous en remercie. Un parcours hors de l’ordinaire avec deux superviseurs et deux fois plus de conseils et d’expérience dans deux pays différents. Vous m’avez permis d’avoir une vision de comment se passe la recherche dans ces deux pays. Merci pour tous vos conseils et votre temps accordé durant ces deux ans.
Ensuite, j’adresse mes remerciements à Nicolas Naudé qui m’a permis d’intégrer la deuxième promotion du Master Sciences et Technologies des Plasmas dans le cadre du cheminement bi-diplômant.
Je remercie également Pascale et Morgane pour vos nombreux conseils, votre aide, votre temps accordé durant les manips, mais aussi pour les préparations d’oraux ou de posters… Sans vous, je ne sais pas comment j’aurais fait ! Vraiment merci mille fois !!!
Je remercie aussi toutes les personnes rencontrées à HSFA venant du LIS et du LBB qui ont été pour moi comme une deuxième famille et m’ont permis de passer une année extraordinaire. Je remercie particulièrement Melis, Ale, Lollo, Fa, Alex (x2) pour nos trips, les rires et pour tous les moments inoubliables passés ensemble. Merci à tous mes amis en France, et plus particulièrement à Camille (x2), Marina, Lucy, Léna… Merci d’être toujours là après 12 ans (et oui le temps passe) ! Merci à Julie et Myriam pour toujours être à l’écoute quand il y a besoin de se soutenir. Merci aussi à Rafael, Richard et Rémi toujours présents pour manger une bonne raclette composée de 10 kilos de fromage, et ça peu importe le mois de l’année !
Enfin, merci à mes parents, mon frère et toute ma famille qui m’ont soutenu dans cette expérience et qui n’ont pas hésité à traverser l’Océan pour venir voir la vie québécoise.
Avant-propos
Ce projet s’inscrit dans le cadre du cheminement bi-diplômant entre l’Université Paul Sabatier III à Toulouse (France) et l’Université Laval à Québec (Canada).
L’article présenté dans le chapitre 3 est prévu pour soumission dans le journal « Surface and Coatings Technology », en étant l’auteur principal. Il présente l’étude de l’adsorption de la fibronectine au contact de couches minces contenant des nanoparticules d’argent. Ce projet m’a été confié par mes directeurs de recherche Pr. Gaétan Laroche et Dr. Kremena Makasheva. J’ai effectué une partie des échantillons à Toulouse sous la supervision de Dr. Kremena Makasheva et d’autres lots d’échantillons ont été réalisés par Dr. Kremena Makasheva pour être envoyés à Québec. J’ai réalisé toutes les caractérisations de surface sous la supervision de Dr. Pascale Chevallier et Dr. Morgane Laurent. Les spectres XPS ont été effectués par Dr. Pascale Chevallier. La fibronectine a été fournie par Pr. Emmanuel Pauthe. Enfin, les tests ELISA ont été réalisés sont la supervision de Dr. Andrée-Anne Guay-Bégin. L’analyse des résultats a été effectuée par moi-même en étroite consultation avec Pr. Gaétan Laroche, Dr. Kremena Makasheva, Dr. Pascale Chevallier, Dr. Morgane Laurent et Dr. Andrée-Anne Guay-Bégin.
Introduction
Chaque année, des millions de personnes sont atteintes d’infections nosocomiales. L’Organisation Mondiale de la Santé estime que dans les hôpitaux, sur 100 patients hospitalisés, 7 dans les pays développés et 10 dans les pays en voie de développement, vont contracter au moins une infection nosocomiale [1]. Les infections nosocomiales sont des infections associées aux soins, contractées lors d’un séjour dans un établissement de santé. Ces infections sont très fréquemment liées à des interventions invasives : sondage urinaire ou trachéal (ventilation assistée), cathéter veineux, intervention chirurgicale, pose de dispositifs implantables (prothèses, stents, valves cardiaques), endoscopie, etc. On estime qu’environ 60% des infections nosocomiales proviennent d'infections liées au développement de biofilms sur les surfaces des matériaux [2]. En effet, les micro-organismes s’attachent sur les surfaces et leur adhésion devient irréversible grâce à la production d’une matrice exopolymérique constituée de protéines lipides et polysaccharides, ce qui mène à la formation de biofilms [3]. Staphylococcus aureus résistant à la méticilline (SARM), Enterococcus résistant à vancomycine (ERV) et Escherichia coli sont trois bactéries couramment trouvées dans les hôpitaux. Elles peuvent être responsables d’infections allant jusqu’au choc septique et à la mort. Ces bactéries sont grandement résistantes de par leur organisation. En plus de conséquences mortelles dans les populations des pays, elles entrainent d’importantes pertes économiques pour les systèmes de santé estimés à 7,0 milliards d’euros en Europe et 6,5 milliards de dollars aux Etats-Unis dues à une prise en charge plus longue des patients avec des traitements et contrôles supplémentaires. D’ailleurs, les microorganismes développent de nombreuses mutations les rendant hautement résistants aux agents antibactériens existants comme les antibiotiques qui ont une action ciblée. De nombreuses stratégies sont mises en place pour lutter contre ces biofilms et ces infections avec notamment des procédures de nettoyage et de désinfection, comme le système automatique de nettoyage en place (NEP) et de stérilisation en place (SEP), ou la prise d’antibiotiques. Mais la résistance accrue des micro-organismes envers ces méthodes ne les rend pas totalement efficace, c’est pourquoi de nouvelles solutions doivent être étudiées. L’émergence des nanomatériaux en raison de leur ratio surface/volume élevé constitue de nouveaux travaux dans le domaine biomédical notamment les nanoparticules d’argent (AgNPs) qui font partie de cette étude. En effet, les AgNPs présentent une activité antimicrobienne importante contre les bactéries, les virus et d’autres micro-organismes avec un mode d’action multiple [4]. Cette méthode est connue depuis des siècles mais, durant ces dernières années, de nombreuses industries ont commercialisé des crèmes ou des pansements à base d’argent pour des utilisations médicales suite au développement des mutations des bactéries envers les antibiotiques. Des revêtements à base d’AgNPs ont également été utilisés pour des lave-linge, des réfrigérateurs et également dans des filtres à eau. Ces AgNPs présentent ainsi un intérêt important dans le cadre de cette étude. En effet, tout matériau implanté dans le corps va être rapidement recouvert d’une fine couche de protéines de 1 à 10 nm d’épaisseur, comme les protéines provenant du plasma sanguin, qui forment un film conditionnant pour le développement de biofilms. Suivant le matériau et ses caractéristiques chimiques, les protéines vont adopter une certaine conformation et vont modifier les propriétés physico-chimiques du support, c’est pourquoi il est important d’étudier le comportement des protéines avec le matériau. Cette étude va donc reposer sur l’interaction d’une protéine provenant du plasma sanguin
humain, la fibronectine, en contact avec des revêtements de matrice organosiliciée SiOC:H contenant des nanoparticules d’argent (AgNPs) dispersées dans la matrice. Grâce à la matrice, les AgNPs vont être protégées de l’oxydation rapide et réparties de manière homogène [5,6].
Cette étude étant réalisée dans le cadre du master en bi-diplomation entre l’Université Paul Sabatier III (Toulouse, France) et l’Université Laval (Québec, Canada), une collaboration entre plusieurs laboratoires est nécessaire :
- Le LAboratoire PLAsma et Conversion d’Energie (LAPLACE) de Toulouse (France) est une Unité Mixte de Recherche du Centre Nationale de la Recherche Scientifique (CNRS), de l’Institut National Polytechnique de Toulouse (INPT) et de l’Université Toulouse III-Paul Sabatier (UPS) regroupant plus de 300 chercheurs, enseignants-chercheurs, ingénieurs, doctorants ou post-doctorants. Le LAPLACE réunit 12 groupes de recherche dont le groupe Matériaux et Procédés Plasma (MPP) qui m’ont accueillie dans leur équipe sous la direction du Dr. Kremena MAKASHEVA et en étroite collaboration avec Marvine SOUMBO, doctorant au sein du LAPLACE et du Laboratoire de Génie Chimique (LGC) de Toulouse.
- Le Laboratoire d’Ingénierie de Surface (LIS) de l’Université Laval à Québec sous la direction du Prof. Gaétan LAROCHE : la mission du LIS s'inscrit dans celle plus globale de l'Axe Médecine régénératrice du Centre de Recherche du CHU de Québec qui concentre plus de 500 chercheurs réguliers, associés, affiliés et membres honoraires regroupés principalement en 7 axes de recherche fondamentale et/ou clinique. Cet axe de recherche comprend trois thèmes principaux à savoir les biomatériaux, les prothèses et les implants, le génie tissulaire et les cellules souches, et enfin la santé de la vision. La majorité du travail a été réalisée sous la supervision du Dr. Pascale Chevallier et du Dr. Morgane Laurent. Les tests ELISA ont été effectués sont la supervision du Dr. Andrée-Anne Guay-Bégin.
Chapitre 1 – État de l’art
1.1 Biofilms et le rôle potentiel des protéines dans la formation de
biofilms
Les micro-organismes peuvent se trouver sous une forme planctonique ou bien, le plus souvent, sous forme de biofilms. En effet, environ 99% des bactéries se trouvent sous la forme de biofilms à divers stades de croissance [7]. Les biofilms sont des écosystèmes complexes et dynamiques constitués d’une communauté de micro-organismes adhérés entre eux et à une surface réceptrice. Dans leur environnement naturel, les micro-organismes sont attachés à une surface, organisés en communautés structurées, et enrobés par une matrice d’exopolysaccharides. L’adhésion des bactéries sur une surface est une stratégie de survie qui leur permet de s’installer et de coloniser un environnement [8]. L’état planctonique, où les bactéries se trouvent libres et isolées dans le milieu environnemental, pourrait être considéré comme un état transitoire. Cette forme de vie, appelée biofilm, a pris une importance toute particulière lorsqu’il a été établi qu’elle était impliquée dans un grand nombre d’infections bactériennes. Jusqu’à récemment, les biofilms, et l’activité bactérienne qui en résulte, étaient connus pour les problèmes de corrosion dans les canalisations ou sur les coques de bateaux. Depuis quelques années, il est apparu que leur implication dans le milieu hospitalier est importante, puisque plus de 60% des infections bactériennes chez l’Homme impliquent des biofilms. Les biofilms peuvent en effet se former au niveau de cathéters ou d’implants (valves cardiaques, prothèses de hanche, etc.), et attaquer des tissus corporels comme les dents, les yeux, les poumons, les oreilles ou le tractus urogénital [8].
Le processus de formation de biofilms se déroule en plusieurs étapes successives comme le schématise la figure 1 [3,9,10] :
Figure 1 : Formation d’un biofilm sur une surface solide [8,10]
1 – Film conditionnant (protéines) Micro-organismes 2 – Transport 3 – Adhésion initiale réversible 4 – Attachement irréversible Support Matrice exopolymérique 5 – Colonisation et détachement
- Film conditionnant : des composants organiques (fragments protéiques et osidiques) et des éléments minéraux (sels) issus du milieu environnant sont adsorbés à la surface.
- Transport et adhésion initiale réversible : des micro-organismes planctoniques, se déplaçant grâce à leurs flagelles ou transportés à proximité de la surface par mouvement brownien ou par sédimentation, adhèrent de manière réversible à cette surface, principalement grâce à des liaisons chimiques non covalentes (comme les liaisons électrostatiques, hydrophobes, de van der Waals, et acide/base de Lewis).
- Attachement irréversible : lorsque ces liaisons sont maintenues pendant un laps de temps suffisant, de nouveaux mécanismes chimiques et physiques se mettent en place et vont les rendre permanentes et irréversibles. En effet, l’attachement des cellules à la surface induit une cascade de changements physiologiques, conduisant dans la plupart des cas à la production de substances exopolymériques (principalement composées de protéines et de polysaccharides), qui constituent la matrice extracellulaire protectrice et augmentent la capacité d’ancrage des micro-organismes à la surface. L’adhésion devient alors irréversible avec, de ce fait, un accroissement de l’énergie mécanique nécessaire pour rompre les liaisons mises en jeu.
- Colonisation : le biofilm se développe et acquiert une structure tridimensionnelle complexe : les micro-organismes se multiplient par divisions cellulaires, communiquent via des signaux moléculaires (« quorum sensing ») et orientent leur métabolisme afin de s’adapter à leur état sessile. Cette étape est fortement influencée par les conditions environnementales (température, humidité, pH, nature de la surface). Le biofilm mature se développe jusqu’à atteindre une épaisseur parfois millimétrique.
- Détachement : À la suite de certains stress, tels que des carences nutritionnelles ou des modifications physico-chimiques de l’environnement, des micro-organismes individuels ou groupés au sein de fragments, peuvent retourner à l’état planctonique et coloniser d’autres surfaces. Un cycle de croissance et de dispersion cellulaire s’établit ainsi, favorisant la dissémination des micro-organismes et la prolifération des pathogènes.
L’adhésion initiale des bactéries au support constitue une étape cruciale dans le développement ultérieur des biofilms. Par conséquent, les stratégies visant à limiter, voire inhiber cette phase précoce constituent une approche pertinente pour prévenir la colonisation microbienne des surfaces solides.
Tableau 1 : Facteurs influençant l’adhésion microbienne sur une surface réceptrice
Facteurs Réf.
Propre à la surface
Hydrophobie : les micro-organismes s’attachent plus rapidement sur
des surfaces hydrophobes [9,11] Rugosité et microtopographie : les rugosités de taille plus grande que
les micro-organismes augmentent l’aire de contact et favorisent l’adhésion des micro-organismes en plus de les protéger des conditions hydrodynamiques et des agents chimiques de désinfection
[9,11]
Charge de surface : dépend du pH du milieu et de l’espèce [11]
Propre au
micro-organisme
Espèce : le pH optimal, la température optimale, … diffèrent selon l’espèce du micro-organisme ; suivant sa composition, sa structure et ses caractéristiques physico-chimiques les interactions avec la surface seront différentes
[9]
Propre à l’environnement
pH : pH optimal pour la production de polysaccharides (matrice exopolymérique) autour de 7 pour la plupart des bactéries [7,9] Température : température optimale propre à chaque micro-organisme qui favorise le développement du biofilm [7,9] Conditions hydrodynamiques : en régime d’écoulement turbulent, les tourbillons peuvent faciliter le contact entre les cellules et la surface mais la diminution de la couche limite réduit le temps d’interaction entre le micro-organisme et la surface. Aussi, une forte contrainte de cisaillement appliquée peut entraîner le détachement des micro-organismes
[9,11]
La formation des biofilms, et plus particulièrement, l’adhésion des micro-organismes est influencée par différents facteurs propres à la surface, au micro-organisme ou au milieu environnant et qui peuvent être interdépendants (Tableau 1). La présence de protéines constitue un facteur important dans la suite de la formation des biofilms. En effet, toutes les surfaces naturelles ou créées par l’Homme exposées à un environnement non stérile sont systématiquement recouvertes par une couche de macromolécules qui va modifier les propriétés physico-chimiques, et par conséquent, favoriser ou inhiber l’adhésion des micro-organismes sur ces surfaces [10,12]. En effet, plusieurs bactéries à Gram positif produisent des protéines capables de s’ancrer dans la paroi cellulaire afin de se lier aux composants de la matrice extracellulaire. Ces protéines de surface possèdent la capacité de se lier à différentes protéines et jouent un rôle important dans l’attachement initial des bactéries au tissu hôte
constituant une étape critique dans le développement de biofilms et d’infections. Par exemple, le fibrinogène et la FN sont capable de se lier à la bactérie Staphylococcus aureus [13,14].
Des études réalisées sur des échantillons de polytétrafluoroéthylène expansé (ePTFE) recouverts de FN ont démontré que ces échantillons ont des fonctions antithrombotiques [15]. De plus, suivant la conformation de la protéine, l’activité biologique de la FN ne sera pas la même. Une étude a montré que l’adhésion cellulaire était deux fois plus importante lorsque la FN était greffée avec un crosslinker sur des échantillons de PTFE traité par plasma plutôt qu’avec un autre crosslinker [16].
La FN est une glycoprotéine dimère de masse molaire élevée d’environ 440 kDa, constituée de 43% de feuillets β, 28% de coudes et de 25% de pelote aléatoire (Fig.2) [17,18]. Elle est formée de deux sous-unités unies par deux ponts disulfures au niveau de leur extrémité C-terminale. La structure de la FN est semblable à une tige composée de trois types différents de modules répétitifs (Fig.3) [19].
Figure 2 : Représentation en 3D d’un fragment de FN [20]
Figure 3 : Représentation schématique de la structure de la fibronectine [21] ; les trois modules : type I en bleu, type II en marron, type III en vert ; les extradomaines A et B résultant de l’épissage alternatif et le domaine variable V en jaune ; les domaines de type I N-terminal marqués d'un astérisque rouge hébergent un
motif immunoglobuline D (IgD) ; les sites d’adhésion pour la FN, le collagène, la fibrine, l’héparine et les bactéries sont indiqués ainsi que les sites de liaison des intégrines.
Cette protéine existe sous deux formes différentes mais avec des propriétés moléculaires très proches [22,23] :
- La fibronectine plasmatique, soluble, est synthétisée par les hépatocytes et circule dans les fluides physiologiques comme le plasma sanguin à une concentration d’environ 0,3 g/L [24,25].
- La fibronectine cellulaire, insoluble, est synthétisée sur place par les cellules de la matrice extracellulaire sous forme de fibrilles.
La FN interagit avec diverses macromolécules (collagène, fibrine, héparine, …) ou avec certaines bactéries, et elle aide dans l’adhésion cellulaire [22,26,27]. En effet, elle est connue pour promouvoir l’adhésion des cellules eucaryotes sur une surface et également des cellules procaryotes comme la bactérie Staphylococcus aureus [14,28]. Cependant, l’adhésion de Staphylococcus epidermidis est plus controversée, certains auteurs ont publié que la FN favoriserait son adhésion [13] et d’autres qu’elle l’inhiberait [29]. Elle est également impliquée dans la migration cellulaire dans le développement embryonnaire et dans la cicatrisation [24]. Au niveau oculaire, lors d’implant intraoculaire, la FN est également produite par les macrophages pour une réaction envers le corps étranger et par les cellules cristalliniennes en voie de prolifération [30].
La FN joue donc un rôle important dans l’attachement des micro-organismes et il est important d’étudier l’organisation qu’adopte la FN au contact des surfaces, et notamment des surfaces antibactériennes. En effet, suivant la conformation adoptée par la protéine, ses fonctions biologiques peuvent être affectées. L’utilisation de nanoparticules d’argent dans les matériaux permettrait d’éviter le développement de biofilms par son effet antimicrobien qui va être décrit dans le paragraphe suivant.
1.2 Nanoparticules d’argent et leur utilisation comme agents
antimicrobiens
Les propriétés antimicrobiennes de l'argent sous la forme de différents composés comme l'argent métallique ou le sel d'argent, sont connues pour combattre avec succès les infections depuis très longtemps. Par exemple, les civilisations de la Grèce antique et de la Rome antique utilisaient des récipients en argent pour stocker l’eau ou pour la transporter afin de la garder potable et ils disposaient également des pièces en argent dans leurs pots ou leurs récipients [31,32]. Cette application particulière est préservée aujourd'hui au sein des navettes spatiales ou de la Station Spatiale Internationale avec l’utilisation de l’argent ionique pour purifier et stocker l’eau [33–35]. Les Romains employaient également le nitrate d’argent, recensé dans la pharmacopée publiée à Rome en 69 avant JC, pour soigner les blessures, les brûlures et les ulcères [36]. En outre, depuis des centaines et milliers d’années, des composés d’argent ont été utilisés pour traiter des brûlures, des plaies chroniques et des infections bactériennes [4,33,37].
La découverte de la pénicilline par Alexander Fleming en 1928 et l'émergence consécutive de plusieurs antibiotiques durant le XXème siècle, ont fait que l'utilisation des composés d'argent a été minimisée pour le traitement des infections. Mais le développement récent de la résistance des micro-organismes face aux antibiotiques a incité les médecins, les entreprises pharmaceutiques ainsi que les chercheurs à trouver de nouveaux agents antibactériens [38–40]. Les nanoparticules d'argent (AgNPs) sont ainsi apparues comme des agents antimicrobiens innovants et puissants à haute efficacité en raison de leur rapport surface/volume élevé, possédant une stabilité thermique élevée et une faible volatilité [40,41]. En 1937, la propriété antibactérienne de l’argent a été attribuée au relargage d’ions argent dû à l’oxyde d’argent [42]. Il a été montré que l’argent, même à faible concentration, possède la capacité de perturber les processus biochimiques des cellules contre une large gamme de micro-organismes, comme les bactéries [43,44], les champignons [45,46], les virus [47,48] et également les parasites [49]. Il présente aussi très peu de toxicité envers les humains [4,50]. En effet, la toxicité de l’argent est observée sous la forme de l’argyrisme. Cette pathologie se caractérise par la coloration bleue-grise de la peau provoquée par l’ingestion d’une grande quantité de produits contenant de l’argent.
L’effet antibactérien de l’argent est principalement dû à l'interaction entre les cellules et les ions Ag+,
qui sont libérés en présence d’un milieu aqueux à partir des structures d'argent (Fig.4) [51]. En particulier, l’ion Ag+ est un acide de Lewis mou qui a une affinité pour le soufre, mais aussi pour l'azote.
De ce fait, il existe de nombreuses possibilités pour les Ag+ de perturber les processus biochimiques
de la cellule, par exemple l'interaction avec de nombreux groupements chargés négativement (thiols -SH, carboxyle -COOH, carbonyle -C=O, …), avec les acides nucléiques, avec la membrane cellulaire et avec les composants cellulaires internes (ADN, ribosome, protéine, enzyme) [39,52]. Une étude a également démontré que les ions Ag+ agissent sur la chaîne respiratoire des bactéries [53]. Au-delà
du réservoir d’Ag+ très efficace, les AgNPs ont des propriétés antibactériennes intrinsèques qui ne
dépendent pas que du relargage d'Ag+. En effet, les AgNPs peuvent interférer avec le système de
défense antioxydant et entrainer une accumulation d’espèces réactives oxygénées (ROS), telles que le superoxyde d'oxygène O2-, et par la suite à la destruction des mitochondries et à l’apoptose cellulaire
Figure 4 : Mécanismes d’action des AgNPs
Comme l’argent perturbe une large gamme de cibles dans les organismes, contrairement aux antibiotiques, les taux de résistance microbienne observés vis-à-vis de l’argent sont faibles. En effet, les micro-organismes devraient développer une multitude de mutations simultanées pour se protéger de ces attaques [43]. Durant les dernières années, des produits à base d’argent ont été commercialisés par différentes entreprises comme des pansements avec un relargage contrôlé d’Ag pour traiter les brûlures (Fig.5).
Figure 5 : Pansements à base d’argent : (A) ACTICOAT par Smith and Nephew et (B) ACTISORBTM Silver 220
par Johnson and Johnson [54,55]
Des recherches sur la libération contrôlée des AgNPs à partir de matériaux nanocomposites ont été également initiées, notamment au sein du LAPLACE. En effet, les AgNPs ont été enterrées dans des matrices siliciées SiO2 et organosiliciées SiOC:H qui permettent d’avoir un contrôle sur la quantité
d’ions argent relargués suivant la distance la plus probable où se trouvent les AgNPs [56] et ainsi obtenir une source continue de relargage d’ions argent sur plusieurs dizaines de jours [10]. L’intérêt de cette configuration est notamment de protéger les AgNPs de l’oxydation rapide avec le milieu et aussi de permettre d’éviter l’agglomération d’argent [57].
Différentes méthodes de fabrication d’AgNPs sont possibles (méthodes physiques, chimiques ou biologiques) avec chacune leurs avantages et leurs inconvénients. La diversité de ces méthodes est présentée dans le tableau 2 de manière non exhaustive.
Tableau 2 : Exemples de méthodes utilisées pour la synthèse de AgNPs
Méthodes de synthèse des
AgNPs Avantages/Inconvénients Réf.
Méthodes physiques
Ablation laser Avantages : absence de solvants, uniformité de la distribution des NPs
Inconvénient : peu de contrôle de la taille de NPs
[58]
Évaporation-condensation
Dépôt plasma PVD
Avantages : absence de solvants, uniformité de la distribution des NPs, contrôle de la taille des NPs Inconvénient : manque de protection des NPs
[5] Dépôts plasma simultanés PVD (NPs) + PECVD (matrice)
Avantages : absence de solvants, uniformité de la distribution des NPs, contrôle de la taille des NPs, protection des NPs de l’oxydation grâce à une matrice (dépôt PECVD), une seule étape
Inconvénient : matrice environnante non-stœchiométrique
[5]
Implantation ionique
Avantages : absence de solvants, uniformité de la distribution des NPs, contrôle de la taille des NPs Inconvénients : NPs instables, oxydation (création de canaux dans la matrice à cause de l’implantation ionique) [57] Méthodes chimiques Réduction chimique
Avantage : facile à réaliser
Inconvénients : utilisation de solvants, formation de clusters, coûteuse
[58]
Méthodes biologiques
Bactéries Avantages : éco-friendly, économique
Inconvénients : procédé très lent, quantités faibles
[58] Champignons Avantages : éco-friendly, économique, stabilité
Inconvénients : procédé très lent, quantités faibles
Plantes
Avantages : éco-friendly, économique, stabilité, non toxique, plus rapide que par les bactéries
Inconvénient : taille des AgNPs limitée à quelques nanomètres
Comme vu dans le tableau 2, il existe diverses techniques d’élaboration d’AgNPs. Le processus d’élaboration de ces couches par procédé plasma est décrit par la suite. Il offre la possibilité d’un choix de taille, densité et forme des AgNPs, ainsi que de la matrice environnante. De plus, ce procédé est compatible avec les technologies microélectroniques, ce qui permet d’envisager une intégration des couches minces nanocomposites contenant des AgNPs dans différents dispositifs.
1.3 Élaboration par procédé plasma de couches minces
nanocomposites contenant des nanoparticules d’argent
Les plasmas sont importants pour de nombreuses industries dans le monde, notamment pour l’industrie de la microélectronique avec de la gravure par plasma ou le dépôt de couches minces ayant des propriétés spécifiques. Ils présentent également beaucoup d’intérêt dans les industries de l’automobile (dépôt de couche mince anti buée ou anti reflet, électronique embarquée, …), de la métallurgie (soudage, découpage) ou encore de la biomédecine (modification de surface, stérilisation d’instruments médicaux, dépôt de couches antimicrobiennes, …) comme dans le cas de cette étude avec des dépôts de couches minces de silice contenant des AgNPs [59–61]. En effet, différents matériaux sont utilisés dans le domaine du biomédical comme des céramiques et notamment des céramiques à base de silice. Certains verres de silice ont été les premiers matériaux à être considérés comme bioactifs et ils présentent ainsi un grand intérêt dans ce domaine. Les principales applications de matériau à base de silice en médecine et biotechnologie sont les dispositifs de réparation osseuse et pour les systèmes d’administration ciblée de médicaments [62]. De la silice sous forme de nanoparticules mésoporeuses sont utilisées en introduisant un médicament dans leurs pores. Au niveau des implants, des revêtements minces de dioxyde de titane (TiO2), de silice (SiO2) ou
d’hydroxyapatite (Ca10(PO4)6(OH)2) sont souvent déposés sur la surface des implants afin d’en
améliorer leur biocompatibilité [63]. Les couches minces peuvent être aussi réalisées avec une matrice organosiliciée SiOC:H moins dense que la silice mais qui va donc se dégrader plus vite dans un fluide et ainsi, le relargage des ions argent sera plus important [41].
Avant d’aborder une description des procédés plasmas permettant le dépôt de couches minces nanocomposites, une présentation plus générale sur le plasma, leurs paramètres principaux et des notions importantes vont être détaillés dans ce qui suit.
Le plasma, appelé aussi « quatrième état de la matière » est un gaz ionisé macroscopiquement neutre et conducteur, qui constitue 99,5% de la matière visible de l’Univers. Cependant, sur Terre à l’état naturel, le plasma est peu répandu mais on le retrouve sous forme d’éclairs ou d’aurores boréales. En revanche, on rencontre une multitude de plasmas de laboratoire.Le plasma est composé d’un mélange d’électrons, d’ions positifs ou négatifs, de molécules et atomes neutres libres de se mouvoir dans toutes les directions de l’espace. Les électrons étant les particules les plus légères, leur énergie moyenne est supérieure à celle des ions, soit 𝑇𝑒 ≫ 𝑇𝑖. Ces électrons sont à l’origine du transfert
d’énergie aux particules lourdes (atomes, molécules) par collisions élastiques pour le transfert de quantité de mouvement et par collisions inélastiques permettant ainsi l’excitation, la dissociation et l’ionisation de ces espèces. Les deux propriétés principales du plasma sont la neutralité électrique (le milieu est macroscopiquement neutre, Fig.6 (a)) ainsi que le comportement collectif des particules. Pour créer une décharge plasma, une source de tension conduit le courant à travers un gaz entre deux électrodes conductrices (Fig.6 (b)).
Pour obtenir un plasma, plusieurs méthodes peuvent être mises en œuvre avec différents types d’alimentation en continu (DC) ou alternatif (AC) en basse/haute fréquence ou micro-onde, différents types de gaz et différentes pressions. Dans cette étude, un procédé plasma à décharge radiofréquence
contenant les AgNPs. L’amorçage d’une décharge entre deux électrodes nécessite un champ électrique supérieur à la rigidité diélectrique du milieu. On applique donc une tension supérieure à la tension de claquage du gaz Vb qui dépend de la pression p du milieu et de la distance inter-électrodes
d selon la loi de Paschen : 𝑉𝑏 = 𝑓(𝑝 × 𝑑) [59]. Quand le champ créé est suffisamment élevé, les
électrons libres présents dans le milieu acquièrent une énergie suffisante pour ioniser les atomes ou les molécules du gaz. L’ionisation du gaz va entrainer le développement d’une avalanche électronique, et cette multiplication de charges va conduire à une décharge auto-entretenue, appelée « plasma ».
Figure 6 : Vue schématique (a) d’un plasma et (b) d’une décharge [59]
On peut également définir différents phénomènes et grandeurs physiques dont les principales caractéristiques sont reprises ci-dessous :
- La densité des espèces
Elle est définie comme le nombre moyen de particules contenu par unité de volume dans une zone du plasma à un instant t. Comme le milieu est macroscopiquement neutre, la densité d’électrons 𝑛𝑒 est quasi identique à la densité d’ions positifs 𝑛𝑖+. Dans le cas général, en présence d’ions négatifs de
densité 𝑛𝑖−, la condition de quasi-neutralité devient :
𝑛𝑒+ 𝑛𝑖− = 𝑛𝑖+, (1)
- La fréquence plasma
Après une perturbation électrique locale dans un plasma initialement neutre, les espèces chargées subissent un déplacement par rapport à leur position d’équilibre. Sous l’effet du champ électrique, les électrons se déplacent ensemble ce qui provoque une séparation temporaire avec les charges de signe opposé. Un mouvement oscillatoire d’espèces chargées apparaît donc et est appelé la fréquence plasma 𝜔𝑝. On définit la fréquence d’oscillation des électrons
pe qui est :𝜔𝑝𝑒 = √𝑛𝑒0𝑒2
𝑚𝑒𝜀0,
(2) Où 𝑛𝑒0 est la densité des électrons du plasma non perturbé, 𝑒 la charge élémentaire, 𝑚𝑒 la masse
De même, on peut définir la fréquence d’oscillation des ions
pi qui est donnée par :𝜔𝑝𝑖 = √ 𝑛𝑖𝑒2
𝑚𝑖𝜀0, (3)
Où 𝑛𝑖 est la densité des ions et 𝑚𝑖 la masse des ions.
La fréquence plasma est une grandeur fondamentale. Sa valeur montre la capacité des particules chargées à suivre la variation périodique du champ électrique appliqué. Ainsi, si la fréquence du champ électrique est plus élevée que la fréquence plasma d’une particule chargée, celle-ci ne pourra pas suivre les variations du champ électrique.
Dans le cas de décharge RF, la fréquence la plus commune étant de 13,56 MHz, les électrons vont osciller tandis que les ions, dont la masse est beaucoup plus élevée que celle des électrons, ne vont pas pouvoir suivre cette fréquence. En effet, en prenant des conditions standards (T = 300 K, ne0 = 1×109 cm-3, p = 1-10 Pa) dans un plasma d’argon, on a :
𝑓𝑝𝑒 = 𝜔𝑝𝑒
2𝜋 ≈ 2 𝐺𝐻𝑧 et 𝑓𝑝𝑖 = 𝜔𝑝𝑖
2𝜋 ≈ 1 𝑀𝐻𝑧,
ainsi 𝑓𝑝𝑖 = 1 𝑀𝐻𝑧 < 𝑓𝑅𝐹 = 13,56 𝑀𝐻𝑧 < 𝑓𝑝𝑒 = 2 𝐺𝐻𝑧.
Les ions vont donc être quasiment immobiles et ne vont être sensibles qu’à la valeur moyenne du champ.
- Les gaines électrostatiques et le potentiel plasma Vp
En laboratoire, les dimensions du plasma sont limitées par les parois du réacteur. Lors des phénomènes d’oscillation des particules chargées, certaines sont perdues dans le volume ou sur les parois du réacteur. Afin de respecter la neutralité macroscopique, un gradient dans la répartition spatiale des charges s’instaure du centre jusqu’aux parois. Ainsi, au voisinage des parois, il se crée une rupture de la neutralité électrique avec la formation d’une zone de charge d’espace où 𝑛𝑖+ ≫ 𝑛
𝑒.
On peut alors distinguer trois zones : le plasma (zone centrale) et deux gaines électrostatiques (proches des électrodes). La charge d’espace est définie par le terme de gaine électrostatique dont la largeur 𝑙𝑔 est définie par l’expression suivante :
𝑙𝑔 = 𝜆𝑑[𝑒(𝑉𝑝−𝑉𝑓)
𝑘𝑏𝑇𝑒 ]
3/4
, (4)
Où 𝜆𝑑 est la longueur de Debye qui correspond à la distance maximale pour laquelle la condition de quasi-neutralité n’est pas respectée, Vp le potentiel plasma, Vf le potentiel flottant (dû à la présence
d’un corps étranger dans le plasma), kb la constante de Boltzmann et Te la température électronique.
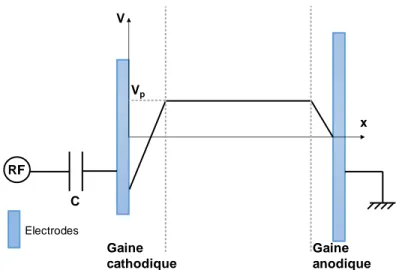
Au niveau des gaines, il existe une chute de potentiel tandis que dans la zone centrale du plasma dépourvue de charge d’espace, règne un potentiel stationnaire appelé potentiel plasma Vp.
Dans le cas d’une décharge asymétrique où l’électrode reliée à la fréquence RF est plus petite que l’électrode reliée à la masse, l’électrode RF se polarise à une tension continue appelée potentiel d’autopolarisation et la gaine au niveau de celle-ci va donc être plus importante que la gaine du côté
Figure 7 : Évolution spatiale du potentiel plasma dans l’espace inter-électrode
- Potentiel d’autopolarisation VDC
Lorsqu’on applique une tension RF entre deux électrodes, les électrons arrivent sur la surface de l’électrode. Pendant l’alternance suivante, les ions sont attirés vers cette électrode mais ils sont beaucoup plus lourds donc ils restent quasi-immobiles. Ces ions sont seulement sensibles à la valeur moyenne du champ. Il en résulte une accumulation de charges négatives sur cette électrode. L’électrode en question se polarise alors à une tension continue appelée tension d’autopolarisation qui est négative pouvant atteindre des valeurs de plus de -1000 V en fonction de la géométrie (asymétrie) du réacteur et de la puissance injectée dans le plasma. De plus, l’ajout de la capacité de blocage en série avec l’électrode et le générateur RF permet de minimiser la puissance réfléchie et d’optimiser donc le transfert de puissance du générateur RF vers le plasma.
- Dépôt des couches minces nanocomposites contenant des AgNPs
Afin d’élaborer des couches minces nanocomposites contenant des AgNPs, on peut utiliser un réacteur RF asymétrique afin que l’électrode la plus petite, reliée au signal RF, se polarise à la tension d’autopolarisation. Deux méthodes conduisant à deux types d’échantillons aux configurations différentes peuvent être utilisées pour l’élaboration de ces couches minces.
RF C x V Gaine cathodique Gaine anodique Vp Electrodes
- Dépôts successifs : dépôt physique en phase vapeur (PVD) puis dépôt chimique en phase vapeur assisté par plasma (PECVD)
1ère étape : PVD dépôt des AgNPs par pulvérisation de la cible
Figure 8 : Dépôt physique en phase vapeur de l’argent par procédé plasma
Le PVD consiste à pulvériser une cible en argent, qui est notamment l’électrode la plus petite afin d’éjecter des atomes de cette cible grâce au bombardement des ions du plasma (Fig.8). En effet, un transfert de quantité de mouvement entre ces ions incidents et les atomes de la cible d’argent se produit. Pour assurer le mécanisme de pulvérisation cathodique, les ions doivent acquérir une énergie minimale Es suivant l’équation suivante (Renou, 2006) :
𝐸𝑠 = 2𝑈0
𝛾(1−𝛾), (5)
Où U0 est l’énergie de sublimation de l’élément et γ est le rapport des masses des deux particules
(incidente et éjectée). Les atomes éjectés vont donc se déposer sur le substrat placé sur la deuxième électrode en se condensant.
2ème étape : PECVD dépôt de la matrice SiOC:H (activation des précurseurs chimiques)
Cette étape va permettre de déposer une matrice de polymère ou une matrice inorganique par procédé plasma afin de recouvrir les AgNPs [5,6,64,65]. En effet, il est possible de réaliser ces couches minces
par procédé plasma en présence de précurseurs gazeux comme le silane (SiH4) ou de sources
organosiliciées non toxiques, non explosives et plus sûres que le silane, comme l’orthosilicate de tétraéthyle (Si(OCH2CH3)4), le tétraméthoxysilane (Si(OCH3)4), le tétraméthylsilane (Si(CH3)4),
Figure 9 : Dépôt chimique en phase vapeur assisté par plasma de la matrice organosiliciée SiOC:H
La décomposition par le plasma de l’HMDSO produit des fragments organosiliciés qui vont se déposer sur les parois du réacteur et également sur l’électrode cible en argent (Fig.9). L’électrode étant recouverte, les ions argon vont bombarder le polymère de la cible qui va se déposer sur l’échantillon et la pulvérisation d’argent est ainsi évitée. Les précurseurs gazeux sont donc activés par collisions avec les espèces chargées du plasma mises en mouvement sous l’action du champ électrique. Ces réactions d’ionisation et de fragmentation produisent des ions et des radicaux très réactifs qui vont être transportés vers le substrat et s’y adsorber. Le dépôt va donc se développer grâce à des réactions chimiques de recombinaison et de polymérisation au niveau de la surface du substrat. Sur le spectre FTIR de dépôts de matrice SiOC:H (Fig.10), on remarque la présence des groupes correspondant à C—H autour de 3000 cm-1, C—H3 ou C—H2 autour de 1500 cm-1 ainsi que Si—O—Si autour de
1000 cm-1.
Pour obtenir une matrice inorganique de type SiO2plasma, l’ajout d’oxygène au protocole précédent
permet l’élimination du carbone et de l’hydrogène par la combustion des groupes méthyles (CH3) qui
produit d’autres éléments comme le formaldéhyde (COH2), l’acide formique (CO2H2), le monoxyde de
carbone (CO), le dioxyde de carbone (CO2) et de l’eau (H2O). Si la fragmentation de l’HMDSO est
partielle, les espèces déposées seront carbonées, ainsi, plus l’ajout d’O2 est important plus la
stœchiométrie de SiO2 sera respectée. Les caractéristiques de la couche de SiO2plasma déposée vont
donc dépendre de la quantité d’oxygène injectée [65,67,68]. Enfin, du dihydrogène (H2), du méthane
(CH4) ainsi que de l’acétylène (C2H2) sont créés par la présence du groupe CH3 [68]. La couche de
silice par plasma SiO2plasma aura des propriétés similaires mais pas exactement identiques à la couche
de silice thermique SiO2th.
On peut également utiliser les deux techniques de dépôt précédentes simultanément.
- Dépôts simultanés : PVD et PECVD combinés
Cette méthode de dépôt couplant le PECVD et le PVD afin de produire des échantillons constitués de nanoparticules de métal enterrées et dispersées dans une matrice est un procédé datant des années 80 et est encore utilisé de nos jours pour plusieurs avantages et notamment le contrôle de la taille des nanoparticules et leur dispersion homogène dans la matrice [69–73].
Une amélioration du dispositif a également été mise en place au LAPLACE avec une injection pulsée du précurseur organosilicié comme l’HMDSO afin de contrôler le recouvrement de l’électrode et son empoisonnement par le polymère et donc d’obtenir un dépôt contenant des AgNPs de même taille (Despax & Raynaud, 2007). En effet, si l’injection est continue, la cible va être recouverte de plus en plus par le polymère et les AgNPs déposées sur l’échantillon seront de plus en plus petites, jusqu’au moment où il n’y aura plus que le polymère déposé. Le dépôt se fait dans le même réacteur asymétrique RF que précédemment avec un mélange d’argon et d’HMDSO. Le polymère va recouvrir partiellement la cible en argent et va permettre de réduire la quantité d’argent pulvérisé. L’électrode cible alimentée en RF va être soumise à un bombardement d’ions argon qui vont pulvériser le polymère déposé ainsi que l’argent. L’injection pulsée permet ainsi d’obtenir des AgNPs de mêmes tailles intégrées dans une matrice sur les substrats. Comme Despax et al. l’ont montré avec des images en coupe transversale obtenue par microscopie électronique en transmission (TEM), les AgNPs obtenues par ce procédé sont d’une taille moyenne de 7 nm (Fig.11) [41].
Figure 11 : (a) et (b) Images TEM d’un revêtement organosilicié constitué d’AgNPs à différentes échelles et (c) distribution en taille des AgNPs [41]
Le mécanisme de dépôt est donc dépendant de l’injection d’HMDSO : pour une même période, plus les temps d’injection d’HMDSO sont importants, plus les nanoparticules seront petites, et inversement [5]. Comme pour les dépôts successifs décrits précédemment, l’ajout d’O2 permet d’obtenir une matrice
de silice de type SiO2plasma dans laquelle les AgNPs seront dispersées [74].
L’étude de l’interaction des protéines avec les matériaux en vue d’améliorer la connaissance sur le phénomène d’adhésion des protéines sur des surfaces structurées regroupe plusieurs recherches qui vont être détaillées dans la suite.
1.4 Interactions des protéines avec des surfaces solides
Comme vu dans le chapitre 1-1, l’adsorption des protéines sur des surfaces solides est une étape cruciale dans l’adhésion des micro-organismes et donc dans le développement des biofilms. Par conséquent, ce problème est important dans plusieurs domaines comme le biomédical, l’industrie agroalimentaire ou encore les réseaux de distribution d’eau potable, avec des conséquences plus ou moins graves.
Figure 12 : Représentation schématique des différentes structures des protéines (A) structure primaire, (B) structure secondaire, (C) structure tertiaire et (D) structure quaternaire [75]
Les protéines sont des macromolécules biologiques composées d’enchaînements d’acides aminés, de longueur variable et de niveaux d’organisation différents. Les acides aminés participant à la structure des protéines sont au nombre de 20. Les protéines sont organisées selon 4 niveaux de structurations différents (Fig.12) [76] :
- La structure primaire : elle correspond à la succession linéaire des acides aminés reliés entre eux par liaison covalente, appelée liaison peptidique.
- La structure secondaire : elle décrit le repliement local de la chaîne principale de la protéine. On trouve plusieurs types de structures comme les structures en hélices ou en feuillets. - La structure tertiaire : elle décrit comment la protéine se replie dans l’espace tridimensionnel.
Cette structure confère la fonction à la protéine.
- La structure quaternaire : elle correspond à l’arrangement des chaînes polypeptidiques, appelées sous-unités, d’une protéine dans l’espace.
Dans le corps humain, le taux de protéines dans le sang, appelé protéinémie, est compris entre 60 et 80 mg/mL [77]. Il comprend en grande partie les albumines, qui servent au transport de nombreuses substances dans le sang et permettent aussi de maintenir la pression oncotique (force qui attire l’eau en direction des protéines et qui permet le maintien de l’hydratation dans le corps), et également les globulines qui jouent un rôle important dans la réponse immunitaire ou la coagulation du sang. Les formations de biofilms chez l’Homme et par exemple, sur des dispositifs médicaux comme les cathéters, vont donc se produire en présence de protéines présentes dans le corps. Par conséquent, les surfaces des biomatériaux étant recouvertes par un film protéique, les interactions entre les bactéries et les surfaces seront alors modifiées puisque les protéines n’auront pas les mêmes
constituant les protéines peuvent être polaires ou apolaires, chargés négativement ou positivement ; ainsi la surface d’une protéine présentera des groupements hydrophiles et hydrophobes, des groupements chargés positivement et/ou négativement, des régions polaires et apolaires (Fig.13) [78]. La chaîne d’acides aminés aura donc tendance à se replier sur elle-même pour adopter une structure tertiaire précise qui va donner la fonctionnalité à la protéine. L’adsorption des protéines sur la surface va entrainer la formation d’un film conditionnant, qui modifie les propriétés physico-chimiques de la surface (tension de surface, polarité, mouillabilité) et elles peuvent soit améliorer l’adhésion bactérienne grâce aux interactions ligands-récepteurs ou acide/base de Lewis entre elles et les bactéries, soit au contraire, elles peuvent limiter l’adhésion des bactéries grâce à des interactions répulsives qui sont le plus souvent électrostatiques [78]. Il a été également montré par plusieurs études que l’adhésion des protéines augmente avec des surfaces hydrophobes [79,80].
Figure 13 : Adsorption d’une protéine sur une surface [78,81]
La désorption est le phénomène inverse de l’adsorption, lorsque les protéines qui étaient fixées se détachent de leur support. Cependant, pour que la désorption des protéines ait lieu, toutes les liaisons entre la protéine et la surface doivent être rompus simultanément. C’est pourquoi, dans le cas de protéines qui sont des macromolécules, la désorption est lente voire inexistante. A moins que des changements importants se produisent au niveau de l’interface, comme une augmentation de la force ionique, une baisse du pH ou l’utilisation de détergents ou d’agents chaotropiques (molécules pouvant perturber les liaisons non covalentes et amener à la dénaturation des protéines), l’adsorption de protéines sur une surface est quasiment irréversible [82].
Afin d’étudier les interactions entre un liquide et une surface, on peut mesurer l’angle de contact d’une microgoutte de liquide sur le solide nettoyé. On peut alors évaluer l’hydrophilie ou l’hydrophobie d’une surface. Pour des grands angles de contact (supérieurs à 90°), on parlera de surface hydrophobe, et au contraire pour des petits angles de contact (inférieurs à 90°), il s’agit d’une surface hydrophile. Un paramètre fondamental peut être caractérisé par l’angle de contact : la mouillabilité. Elle est définie comme l’aptitude à un liquide de s’étaler sur une surface solide et elle dépend de trois tensions interfaciales solide-liquide (γSL), solide-vapeur (γSV) et liquide-vapeur (γLV) (Fig.14).
Figure 14 : Angle de contact θ d’un liquide sur une surface solide
Pour étudier l’adsorption des protéines sur une surface et leur conformation adoptée, différentes techniques peuvent être utilisées.
Des études ont été réalisées sur l’interaction de protéines comme la Discosoma rouge naturellement fluorescente (DsRed) ou l’albumine de sérum bovin (BSA) avec des surfaces de silice SiO2 en étudiant
notamment la modification de l’angle de contact avec des solutions protéiques. Des gouttelettes de solution de contrôle d’eau pour préparation injectable (PPI) et des gouttelettes contenant différentes concentrations de DsRed diluées dans la solution de contrôle ont été déposées à la surface des couches de SiO2 et leur déshydratation a été suivie au cours du temps [83]. Pour étudier l’interaction
de la DsRed avec les surfaces de SiO2, l’angle de contact de chaque gouttelette a été mesuré. Pour
la solution de contrôle d’eau PPI, l’angle de contact est quasiment constant avec le temps tandis que pour les solutions de DsRed, l’angle de contact varie en fonction du temps ce qui s’explique par l’adsorption des protéines sur la surface de SiO2. En effet, les protéines de DsRed vont s’accrocher à
la surface et la gouttelette va s’évaporer sur les bords plutôt que de manière uniforme comme pour la solution de contrôle. L’effet Marangoni a également été observé avec un « anneau » de protéines plus épais qu’au centre de la gouttelette dû à la convection du liquide vers l’intérieur de la gouttelette et donc une accumulation de protéines vers l’extérieur. Cette étude a montré que l’adsorption de la DsRed sur la surface de SiO2 et sa déshydratation ne conduisent pas à la dénaturation de la protéine comme
on peut le voir avec la préservation de la fluorescence de la DsRed [83].
Une étude similaire a été menée en réalisant des couches minces protéiques de BSA et de DsRed à l’aide du procédé d’enduction par trempage (dip coating en anglais) pour différentes concentrations [84]. L’adsorption des protéines a été notamment étudiée par Microscopie à Force Atomique (AFM) qui permet de distinguer des structures différentes créées par les protéines adsorbées avec l’étude de la rugosité des surfaces (Fig.15).
Figure 15 : Ligne du haut : après adsorption de BSA à 0,05 g/L, (a) image au microscope optique, (b) et (c) images AFM à différentes échelles. Ligne du bas : après adsorption de DsRed à 0,05 g/L, (d) image au
microscope optique, (e) et (f) images AFM à différentes échelles [84].
L’analyse physico-chimique de l’adsorption de la BSA sur la surface de SiO2 montre aussi que
l’épaisseur de la couche protéique peut être contrôlée en changeant la concentration de la solution protéique. En effet, lorsque la concentration de BSA augmente, l’épaisseur sera plus importante. De plus, pour une même concentration, la couche de BSA est constituée principalement d’une structure en monocouche, alors que la DsRed comporte un film formé par des monomères mais aussi par des résidus de protéines sous leur forme tétramérique. Ces différences dans la formation de couches protéiques de BSA et DsRed sont dues à la cohérence interne des protéines qui auront plus de facilité à se déplier ou non sur la surface, ainsi qu’à la taille de la DsRed plus faible comparée à celle de la BSA, ce qui résulte en un nombre requis de protéines beaucoup plus élevé pour obtenir une monocouche de DsRed saturée [84].
La Spectroscopie Photoélectronique par rayons X (XPS) est aussi une méthode utilisée pour confirmer la présence de protéines après adsorption grâce à leurs fonctionnalités chimiques et notamment la présence de groupes amides, amines et acides carboxyliques. En effet, l’étude du pic caractéristique de l’azote N1s en survol et des liaisons C—N et C=O en haute résolution permet de déterminer la présence de protéines [85].
Une autre méthode est l’analyse par spectroscopie Infrarouge à Transformée de Fourier (FTIR). Elle permet d’analyser la structure secondaire des protéines grâce à l’apparition des bandes amides notamment la bande amide I. Chaque bande correspond à un ou plusieurs modes de vibration comme dans ce qui suit [86,87] :
- La bande de l’amide I se situe autour de 1650 cm-1 et est avant tout due aux vibrations d’élongation du C=O (70-85%) avec une plus faible contribution de l’élongation du C—N
(10-20%), de la déformation dans le plan du C—CN (10%) et de la déformation dans le plan du N—H.
- La bande de l’amide II se trouve vers 1550 cm-1. Elle est principalement due à la combinaison déphasée de la déformation dans le plan du N—H (40-60%) et de l’élongation du C—N (18-40%), mais également à la déformation dans le plan de C=O et à l’élongation du C—C (10%). - La bande de l’amide III est située dans la gamme de 1400-1200 cm-1. Elle est due à la combinaison en phase de la déformation dans le plan du N—H et de l’élongation du C—N avec une petite contribution de la déformation dans le plan de C=O et de l’élongation de C— C.
- La bande de l’amide A apparaît autour de 3300 cm-1 grâce à l’élongation du N—H.
L'estimation quantitative de la structure secondaire des protéines est basée sur l'hypothèse que toute protéine peut être considérée comme une somme linéaire de plusieurs éléments de la structure secondaire, et le pourcentage de chaque élément est seulement lié à l'intensité spectrale [86]. Ainsi, grâce à la spectroscopie FTIR, on peut accéder à la structure secondaire des protéines et en évaluer son repliement. Si la protéine est déposée sur un substrat ou plongée dans une solution, le changement de la structure secondaire sera observé grâce à la spectroscopie FTIR avec une nouvelle conformation mettant en jeu des modifications de la contribution de chaque composante de cette structure par rapport à un échantillon de contrôle. Des études réalisées sur l’adsorption de la DsRed et de la BSA sous forme de couches déposées sur des surfaces de SiO2 ont permis de déduire que
les protéines ne sont pas dénaturées au contact de ces surfaces, c’est-à-dire qu’elles ont conservé leur structure secondaire et donc leur activité biologique et leurs propriétés optiques (comme la fluorescence de la DsRed). En effet, les spectres FTIR obtenus confirment la présence des bandes caractéristiques des protéines avec l’amide A (3300-3500 cm-1), l’amide I (1654 cm-1) et l’amide II (1530
cm-1) [83,84].
L’adsorption de protéine sur une surface est un phénomène complexe qu’il reste à explorer et notamment pour l’adsorption de mélanges de protéines sur une surface. En effet, un phénomène appelé l’effet Vroman a lieu où les protéines sont en compétition les unes les autres. Les protéines ayant une mobilité plus élevée arrivent sur la surface et sont ensuite déplacées par d’autres protéines ayant une affinité plus élevée avec la surface [88–90].
Objectif du projet :
Les biofilms représentent un problème important dans les établissements de santé et ils sont responsables de pertes économiques estimées à 1 milliard de dollars au Canada dues à une prise en charge plus longue des patients. Mais ce problème est mondial, avec 7% de patients dans les pays développés et 10% dans les pays en voie de développement atteints par au moins une infection nosocomiale. Comme vu dans le chapitre 1-1, la présence de protéines sur la surface joue un rôle clé dans la suite du développement du biofilm en améliorant l’adhésion des micro-organismes sur la surface. De plus, à cause de la résistance accrue des micro-organismes aux antibiotiques, de nombreuses études sont réalisées afin d’élaborer de nouveaux matériaux utilisables dans le domaine biomédical. L’émergence des nanoparticules aux propriétés intéressantes par leur ratio surface/volume élevé constitue une nouvelle stratégie. Et notamment, les AgNPs connues pour leur propriété antimicrobienne due à une multitude de mécanismes d’action (chapitre 1-2), contrairement aux antibiotiques qui ont un mode d’action ciblé.
L’hypothèse de travail dans ce projet est que les AgNPs ont une influence sur l’organisation des protéines lors de leur adsorption sur les surfaces solides des matériaux nanocomposites contenant des AgNPs et donc sur l’attachement des micro-organismes par la suite.
L’objectif est donc d’étudier l’organisation de FN adsorbée sur des couches minces contenant des AgNPs.
Pour cela, les AgNPs seront synthétisées et intégrées dans une matrice organosiliciée SiOC:H obtenues par procédé plasma, avec un suivi par Spectroscopie d’Émission Optique (OES). La FN sera adsorbée sur les surfaces avec et sans AgNPs puis ces surfaces seront caractérisées par Spectroscopie Photoélectronique par rayons X (XPS) pour connaître la composition atomique en surface. La topographie et rugosité de surface seront évaluées par Microscopie à Force Atomique (AFM). Puis des mesures d’angle de contact seront réalisées pour connaître la mouillabilité des surfaces.
![Figure 1 : Formation d’un biofilm sur une surface solide [8,10]](https://thumb-eu.123doks.com/thumbv2/123doknet/2915058.75961/15.918.195.790.727.961/figure-formation-biofilm-surface-solide.webp)

![Figure 2 : Représentation en 3D d’un fragment de FN [20]](https://thumb-eu.123doks.com/thumbv2/123doknet/2915058.75961/18.918.321.589.394.676/figure-représentation-d-fragment-fn.webp)


![Figure 6 : Vue schématique (a) d’un plasma et (b) d’une décharge [59]](https://thumb-eu.123doks.com/thumbv2/123doknet/2915058.75961/25.918.253.678.302.446/figure-vue-schématique-plasma-décharge.webp)

![Figure 10 : Spectre FTIR de dépôts de SiOC:H [5]](https://thumb-eu.123doks.com/thumbv2/123doknet/2915058.75961/29.918.284.631.671.972/figure-spectre-ftir-dépôts-sioc.webp)
![Figure 12 : Représentation schématique des différentes structures des protéines (A) structure primaire, (B) structure secondaire, (C) structure tertiaire et (D) structure quaternaire [75]](https://thumb-eu.123doks.com/thumbv2/123doknet/2915058.75961/32.918.145.791.287.412/représentation-schématique-structures-protéines-structure-structure-secondaire-quaternaire.webp)