Qualités nutritives des microalgues marines au Nunavik
Mémoire
Kasey Cameron-Bergeron
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
Résumé
La région maritime du Nunavik, composé de l’est de la baie d’Hudson, du détroit d’Hudson et de la baie d’Ungava, est d’une importance capitale pour les populations Inuit qui y vivent grâce à son apport substantiel en nourriture et matériaux, en plus de permettre un passage des traditions et une cohésion sociale dans la communauté. Les Inuit consomment surtout du poisson et des mammifères marins comme le phoque et le béluga, des espèces particulièrement riches en composés essentiels comme les acides gras polyinsaturés et les pigments caroténoïdes, qui sont synthétisés par les microalgues à la base de la chaîne alimentaire marine. Cependant, les qualités nutritives de ces organismes sont susceptibles d’être altérées par la transformation rapide de l’environnement arctique. Ce projet avait pour but d’évaluer l’influence des paramètres physico-chimiques de l’eau sur la composition taxonomique et les qualités nutritives des microalgues marines au Nunavik pendant l’été en 2017 et en 2018. Les résultats ont révélé de forts contrastes entre les régions maritimes quant aux paramètres physico-chimiques; les eaux de la Baie d’Hudson était relativement chaudes, peu salées et peu alcalines, alors que celles du détroit d’Hudson et la baie d’Ungava étaient plutôt froides, salées et alcalines par comparaison. La composition taxonomique des communautés était très différente entre les deux années, avec une dominance de diatomées en 2017 et une transition vers une communauté comportant une proportion accrue de flagellés en 2018. Les contenus en pigments caroténoïdes étaient influencés négativement par la température, le pH ainsi que la contribution des flagellés à la communauté, mais étaient positivement influencés par la salinité et la contribution des diatomées. Le contenu en acide eicosapentaénoïque (EPA), un acide gras essentiel, était plutôt corrélé positivement à la salinité, au pH et à la contribution des diatomées, mais négativement à la température et à la contribution des flagellés. La température, la salinité et le pH ont aussi montré de fortes corrélations avec les proportions de diatomées et de flagellés, mettant en évidence une juxtaposition d’effets directs (via une réponse physiologique des microalgues) et indirects (liés à la composition des communautés) de l’environnement changeant de l’Arctique sur les propriétés nutritives des microalgues marines.
Table des matières
Résumé ... ii
Table des matières ... iii
Liste des tableaux ... iv
Liste des figures ... v
Remerciements ... vii
Avant-propos ... viii
Introduction générale ... 1
Mise en contexte ... 1
Les microalgues marines ... 2
Problématique ... 4
Les acides gras polyinsaturés ... 5
Les pigments antioxydants ... 6
Effet des conditions physico-chimiques sur la composition des microalgues ... 7
Le Nunavik ... 9
La baie d’Hudson ... 10
Le détroit d’Hudson et la baie d’Ungava ... 10
Hypothèses et objectifs ... 11
1. Nutritive qualities of marine microalgae in Nunavik ... 13
1.1 Résumé ... 13
1.2 Abstract ... 14
1.3 Introduction ... 15
1.4 Materials and Methods ... 18
1.4.1 Study area and sampling ... 18
1.4.2 Physical and chemical parameters ... 19
1.4.3 Particulate organic matter composition ... 19
1.4.4 Fatty acids ... 20
1.4.5 Pigments ... 20
1.4.6 Normalization and statistical analyses ... 21
1.5 Results ... 22
1.5.1 Environmental conditions ... 22
1.5.2 Taxonomy ... 25
1.5.3 Polyunsaturated fatty acids ... 27
1.5.4 Effects of environment and taxonomy on nutritive qualities ... 30
1.6 Discussion ... 34
1.6.1 Influence of taxonomy ... 34
1.6.2 Influence of physicochemical parameters ... 37
1.7 Conclusion ... 39
Conclusion générale ... 41
Références bibliographiques ... 44
Annexe A ... 55
Liste des tableaux
Table 1.1 Pearson correlation coefficient (r) between all studied parameters. The asterisk
Liste des figures
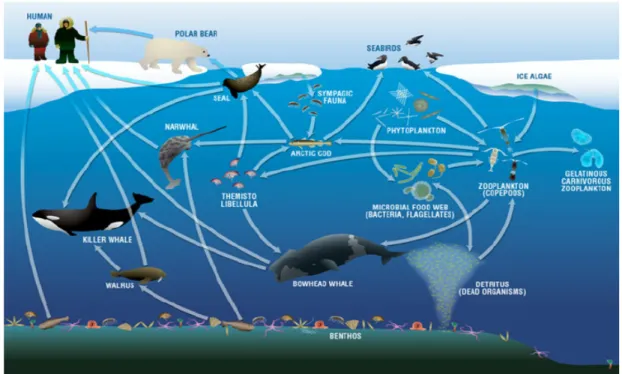
Figure i Représentation schématique du réseau trophique marin arctique. Les flèches
représentent le sens du transfert d’énergie, soit d’une proie vers son prédateur (Darnis et al. 2012)………4
Figure ii Carte du Nunavik (tiré de Savard et al. 2014)…………..………..9 Figure iii Carte des courants de surface de la baie d’Hudson, du détroit d’Hudson, de la
baie d’Ungava et du bassin de Foxe (AMAP)……….11
Figure 1.1 Map of Nunavik (Lemire et al. 2015)………16 Figure 1.2 Map of the stations sampled during July 2017 (red dots) and 2018 (yellow
diamonds) in Nunavik. Note that fewer stations were sampled in 2018 due to difficult ice conditions………...18
Figure 1.3 Values of a) temperature (°C), b) salinity (psu), c) pH and d) nitrate (µM) at the
surface in eastern Hudson Bay, Hudson Strait and Ungava Bay in early July 2017 (left) and 2018 (right). Note that surface values for station 736 (eastern Hudson Bay, 2017) are unavailable……….23
Figure 1.4 Values of a) temperature (°C), b) salinity (psu), c) pH and d) nitrate (µM) at the
SCM in eastern Hudson Bay, Hudson Strait and Ungava Bay in early July 2017 (left) and 2018 (right)……….24
Figure 1.5 Taxonomic composition of each station at the a) surface and b) SCM during
July in 2017 (left) and 2018 (right). The relative abundance of each phytoplankton group is given as a percentage of total cell counts. “Others” include dictyochophyceae, prasinophyceae and prymnesiophyceae. Surface data for station 689 (2018) is not available……….26
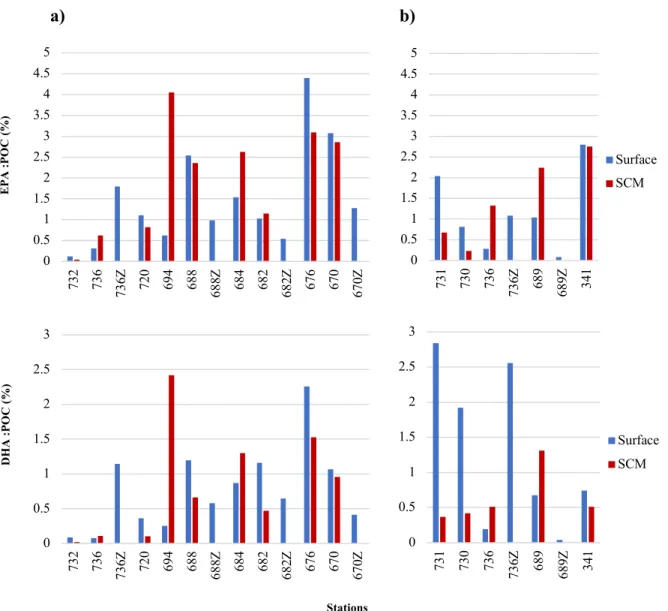
Figure 1.6 Proportions of EPA (top) and DHA (bottom) for July a) 2017 and b) 2018 at
the surface (blue) and the SCM (red)………..27
Figure 1.7 Relationships between the proportion of total carotenoids compared to a) EPA
and b) DHA contents at the surface (blue) and the SCM (red) for July 2017 and 2018 (combined).………..………..28
Figure 1.8 Relationships between the proportion of carotenoid pigments at the surface and
the SCM during July in a) 2017 and b) 2018. The line represents a 1:1 relationship and is provided for visual reference………..29
Figure 1.9 Relationship between the proportions of photosynthetic and photoprotective
carotenoid pigments at the surface (blue) and the SCM (red) during July 2017 and 2018 (combined). Photoprotective pigments represent the sum of b-carotene astaxanthin, violaxanthin, diadinoxanthin, antheraxanthin, diatoxanthin, zeaxanthin and lutein, while photosynthetic pigments represent the sum of peridinin, fucoxanthin, neoxanthin, prasinoxanthin and alloxanthin………..29
Figure 1.10 Relationship between the proportions of EPA and a) temperature, b) pH, c) %
contribution of diatoms and d) % contribution of flagellates at the surface (full square) and SCM (open circle) in July 2017 and 2018 (all data pooled). In b), the left-hand plot shows all data, whereas the right-hand plot includes only those for which temperature was < 1.9 ºC………32
Figure 1.11 Relationship between the proportions of total carotenoids (left) or fucoxanthin
(right) and a) temperature, b) pH, c) % contribution of diatoms and d) % contribution of flagellates at the surface (full square) and SCM (open circle) in July 2017 and 2018 (all data pooled)………33
Remerciements
Je tiens à remercier tous ceux qui ont été impliqués de près ou de loin dans ce projet, en commençant par mon directeur de recherche Jean-Éric Tremblay. Merci de m’avoir fait confiance pour mener à bien ce projet, ainsi que du soutien et des conseils tout au long de cette aventure qui m’a beaucoup apporté autant au niveau personnel que professionnel. Merci également à mon co-directeur Guillaume Massé et à Johann Lavaud pour les précieux commentaires et recommandations. Un énorme merci aux professionnels de recherche du laboratoire, Gabrièle Deslongchamps, Jonathan Gagnon ainsi que Gabrielle Fortin, pour toute l’aide et le support logistique apportés lors des missions en mer et au laboratoire. Merci pour tous les bons moments partagés, mais aussi pour le soutien lors des situations plus difficiles. Un merci particulier à Gabrièle pour l’aide, les conseils ainsi que le soutien moral lors de l’écriture de ce mémoire.
Un merci spécial à la Garde Côtière Canadienne, à l’équipage du NGCC Amundsen ainsi qu’aux techniciens d’ArcticNet, sans qui la récolte des données n’aurait pas été possible. Merci à tout le personnel d’ArcticNet, de Québec-Océan et de Takuvik, ainsi qu’aux divers collaborateurs. Merci à Caroline Guilmette pour sa patience infinie. Également, un énorme merci à mes collègues du laboratoire Tremblay ainsi que mes collègues de bureau : Gabrielle Filteau, Jang Han Lee, Nicolas Schiffrine, Vincent Marmillot, Vincent Villeneuve, Guillaume Cinq-Mars, Francis Dufour et Fanny Cusset. Merci pour les discussions et les rires. Merci également à mes collègues du projet BriGHT, Catherine Van Doorn, Xavier Dallaire et Sara Bolduc.
Finalement, ce projet n’aurait jamais pu être complété sans le soutien inconditionnel de ma famille, de mes amis et plus particulièrement de mon copain Guillaume. Merci de m’avoir accompagné dans cette aventure, de m’avoir soutenu et encouragé lors des nombreux moments de doutes et d’avoir célébré les accomplissements à mes côtés.
Avant-propos
Le présent mémoire regroupe le travail de recherche effectué lors de ma maîtrise, réalisée sous la direction du Professeur Jean-Éric Tremblay. Le manuscrit contient trois sections, dont une introduction et une conclusion générale. Le corps du manuscrit est présenté sous forme d’article scientifique en anglais, lequel sera soumis pour publication à une revue scientifique dans les semaines suivant le dépôt du mémoire. Les coauteurs de cet article sont, dans l’ordre : Kasey Cameron-Bergeron1, Jean-Éric Tremblay1,2, Guillaume Massé1,2
et Johann Lavaud1,2.
L’ensemble des données ont été récoltées à l’été 2017 et 2018 dans les régions côtières du Nunavik à bord du NGCC Amundsen. J’ai personnellement participé à chacune des étapes ayant mené à terme ce projet : de la planification des missions en mer et la préparation du matériel, à la récolte de la majorité des données, à leur traitement et analyse (appuyée par Jonathan, Gabrièle et Gabrielle), jusqu’à la rédaction du présent manuscrit (appuyée par Gabrièle et Jean-Éric). Les données de pH de la mission de 2017 ont été fournies par Alfonso Mucci3. L’analyse taxonomique du phytoplancton a été effectuée par Marie
Parenteau1 (2017) et Sylvie Lessard (2018). Finalement, les analyses de pigments ont été
effectuées par Joséphine Ras4 et Céline Dimier4.
Au cours de ma maîtrise, j’ai eu la chance d’assister à plusieurs congrès, à l’échelle provinciale et canadienne. Lors de ces divers congrès, j’ai pu présenter mes résultats sous forme d’affiche scientifique et de présentation orale. Encore une fois, je remercie mon directeur de recherche1 pour ces opportunités uniques.
1Québec-Océan, Département de Biologie, Université Laval, Québec, Canada 2Takuvik, Département de Biologie, Université Laval, Québec, Canada
3Department of Earth and Planetary Sciences, Université McGill, Montréal, Canada
Introduction générale
Mise en contexte
Depuis l’ère industrielle, la concentration de CO2 atmosphérique augmente de plus en plus
rapidement, particulièrement au cours des dernières décennies (Denman 2008). L’accumulation de ce gaz à effet de serre dans l’atmosphère mène à plusieurs perturbations, notamment le réchauffement de l’atmosphère et des océans à l’échelle planétaire, ainsi que l’acidification de l’eau de mer. Les océans jouent un rôle primordial dans la régulation du climat global (IPCC 2014) en absorbant de grandes quantités de carbone et de chaleur (Ramanathan 1981; Sabine et al. 2004). En effet, la température de la couche de surface a augmenté de plus de 0,1°C par décennie depuis les 39 dernières années (IPCC 2014) et prévoit atteindre une augmentation de 2,7°C en 2090 comparé à 1990 (Bopp et al. 2013). Les océans absorbent également environ 30% du CO2 anthropogénique émis dans
l’atmosphère; cependant, cette capacité d’absorption est en déclin (Lenton et al. 2012; Sabine et al. 2004). L’absorption du CO2 par les océans fait augmenter la concentration
d’ions H+, diminuant le pH du même coup (Doney 2010). Ces changements globaux, qui
se produisent à une vitesse sans précédent (Doney 2010), affectent différents paramètres physico-chimiques de la colonne d’eau et, conséquemment, les organismes marins qui y vivent ainsi que le fonctionnement de l’écosystème (Doney et al. 2012).
L’environnement arctique est particulièrement touché par les changements globaux. Un été sans glace pourrait être possible dès 2030 dans l’Arctique (Stroeve et al. 2008) et possiblement bien avant dans le bas Arctique et au Nunavik en particulier. La surface couverte par la glace étant de plus en plus petite, une plus grande superficie d’eau libre est alors exposée à la lumière directe du soleil pendant l’été et l’automne. Cette lumière permet notamment une fenêtre plus longue pour la croissance du phytoplancton (Arrigo et al. 2008). De plus, la stratification de la colonne d’eau est plus marquée grâce à des quantités importantes d’eau douce en surface apportées par les rivières, ce qui diminue le mélange vertical et réduit l’arrivée de nutriments dans la couche euphotique. Toutefois, certaines régions sont sujettes à plus de tempêtes, ce qui fait remonter des nutriments des eaux profondes et permet un deuxième bloom en automne où il n’y en avait pas auparavant
(Ardyna et al. 2014). L’abondance de certaines espèces de phytoplancton pourrait également changer suite aux changements globaux. Le réchauffement des eaux de surface entraîne un changement dans la taille des organismes, favorisant les espèces de petite taille comme le picoplancton, qui a un grand ratio surface/volume et est donc plus efficace pour absorber les nutriments, en plus d’avoir une plus grande résistance hydrodynamique à la sédimentation. Des eaux de surface plus chaudes entraînent une stratification plus importante, diminuant les échanges de nutriments et offrant un milieu où le picoplancton peut se développer, au détriment du nanoplancton (Li et al. 2009; Agawin et al. 2000). Cependant, un écosystème dominé par le picoplancton ne soutient pas un fort export de carbone dû au faible taux de sédimentation des organismes (Li et al. 2009).
La plupart des communautés vivant dans l’Arctique subsistent en utilisant les ressources marines, que ce soit pour leur alimentation ou en tant que source de revenus (pêche, chasse, tourisme, aquaculture) (Hovelsrud et al. 2008). Les mammifères marins sont un apport important pour ces communautés, fournissant nourriture, fourrures et matériaux (Hovelsrud et al. 2008). Les activités qui entourent la chasse et le partage des aliments marins traditionnels sont par ailleurs cruciales pour le maintien de l’identité, de la cohésion sociale et du bien-être des individus chez les Inuit (Lemire et al. 2015). Les populations Inuit vivant dans les régions côtières de l’Arctique consomment notamment du poisson et des prédateurs occupant des positions plus élevées au sein du réseau alimentaire, tel les mammifères marins (Dehn et al. 2006). Ces animaux sont une source essentielle de nombreux éléments et composés bénéfiques pour la santé humaine, par exemple des acides gras polyinsaturés et des antioxydants (Lemire et al. 2015).
Les microalgues marines
Les microalgues, composées d’organismes unicellulaires photosynthétiques, sont à la base de la chaîne alimentaire marine (Arrigo et al. 2012). Dans l’environnement arctique, deux floraisons (blooms) servent de sources principales de production primaire : le bloom des algues de glace et celui du phytoplancton. Le timing et l’ampleur de ces blooms sont sous l’influence de la glace de mer, qui a une double fonction (Smetacek et Nicol 2005), soit procurer un substrat pour les algues de glace et réguler la quantité de lumière disponible
pour le phytoplancton, qui se développe en eau libre (Kalač et Kyzlink 1979; Søreide et al. 2010). Les algues de glace commencent à se développer dès qu’une lumière suffisante arrive à traverser la glace et poursuivent leur croissance jusqu’à la fonte des glaces (Hegseth 1998). La production primaire par le phytoplancton commence lors de la fragmentation de la glace, laissant ainsi un certain laps de temps entre les deux blooms. À de hautes latitudes, cette fenêtre de production primaire est très courte, ce qui rend l’importance de ces blooms primordiale. Afin d’évaluer la proportion de la quantité totale de carbone fixé qui est disponible pour les niveaux trophiques supérieurs, on définit en tant que production primaire nette (PPN) ou production nouvelle la fraction se trouvant en excès du métabolisme basal de la communauté algale (Field et al. 1998). Cette production est généralement dépendante des apports verticaux d’éléments nutritifs essentiels tel l’azote (N) et le phosphore (P) (Howarth 1988; Falkowski et al. 1998). L’azote étant généralement limitant dans l’Arctique, on suppose que la PPN est directement proportionnelle à l’assimilation du nitrate, qui constitue la principale source d’azote issue de l’océan profond. Par ailleurs, les microalgues participent également à l’apport de matière vers le benthos par le biais du processus de « pompe organique », une composante majeure de la pompe océanique du CO2. La pompe organique débute avec la production primaire des
microalgues, qui convertissent le carbone inorganique particulaire (CIP) en matière organique, soit en carbone organique dissous (COD) ou particulaire (COP). Par la suite, des débris biogéniques sont produits, majoritairement sous forme particulaire, dont la majorité sera reminéralisés ou respirés par des bactéries dans un court intervalle de temps (Denman 2008). Une autre partie de ces débris est exportée vers le fond, où elle pourra être consommée par les organismes benthiques ou séquestrée dans les sédiments, parfois pour des milliers d’années (Denman et al. 2007). C’est ainsi que la production primaire joue un rôle essentiel dans les flux de CO2, le cycle biogéochimique du carbone et la nutrition des
organismes benthiques. Il est généralement admis que dans l’Arctique, l’export vertical rapide des algues de glace contribue davantage à la nutrition du benthos qu’à la nutrition du réseau alimentaire pélagique, qui lui repose principalement sur la production du phytoplancton.
Problématique
La plupart des composés bénéfiques à la santé des Inuit dans l’Arctique ne sont pas synthétisés de novo par les animaux qu’ils consomment (par ex : poissons, bivalves, mammifères marins). Ils proviennent plutôt des microalgues, qui sont à la base de la chaîne alimentaire (Arrigo et al. 2012). En effet, les microalgues sont les seuls organismes capables de synthétiser plusieurs composés essentiels, dont les acides gras polyinsaturés et les pigments antioxydants; les animaux des niveaux trophiques supérieurs doivent obligatoirement les obtenir par leur alimentation (Häubner et al. 2014; Tapiero et al. 2002).
Figure i Représentation schématique du réseau trophique marin arctique. Les flèches représentent
le sens du transfert d’énergie, soit d’une proie vers son prédateur (Darnis et al. 2012).
Les changements globaux attendus dans la région arctique, tels que la perte de couvert de glace ainsi que les changements environnementaux, auront des impacts sur la chaîne alimentaire marine dans son entièreté, avec des conséquences inévitables sur les communautés qui en dépendent (Hovelsrud et al. 2008). Les choix alimentaires que font ces dernières tiennent compte de plusieurs facteurs, dont la disponibilité des aliments marins (elle-même fonction de leur abondance et de leur accessibilité aux chasseurs), l’apparence de ces aliments (coloration et condition physique) et leur valeur ou qualité
nutritive. L’analyse de ces trois facteurs est au cœur du projet BriGHT de Sentinelle Nord, qui vise à comprendre comment le bien-être des Inuit du Nunavik est affecté par l’environnement marin et les changements globaux.
Les acides gras polyinsaturés
Chez l’humain, les acides gras polyinsaturés et les oméga-3 en particulier jouent un rôle essentiel dans le développement infantile et la prévention du cancer, en plus d’encourager une bonne santé cardiovasculaire et mentale (Riediger et al. 2009). Ces acides gras sont aussi cruciaux pour le réseau alimentaire qui supporte la production d’aliments marins. Leur rôle dans le développement et l’éclosion des œufs de copépodes ainsi que pour la croissance du zooplancton a été largement démontré (Pond et al. 1996; Swadling et al. 2000; Jónasdóttir et al. 2005). Calanus glacialis, un copépode arctique formant 80% de la biomasse du zooplancton arctique (Tremblay et al. 2006; Blachowiak-Samolyk et al. 2008), constitue une réserve importante de lipides à haute énergie (Lee et al. 2006; Falk-Petersen et al. 2009) grâce à son alimentation provenant des algues marines. C. glacialis est ainsi constitué de plus de 70% de lipides et constitue lui-même une source importante de nourriture pour les niveaux trophiques supérieurs (Falk-Petersen et al. 1990), notamment les poissons, qui accumulent ces composés et en ont besoin pour se développer adéquatement (Watanabe et al. 1983).
Les algues marines sont les seuls organismes à produire deux acides gras oméga-3 essentiels : l’acide eicosapentaénoïque (EPA) et l’acide docosahexaénoïque (DHA). Chez l’humain, l’EPA a un rôle anti-inflammatoire et sa consommation aide à prévenir certaines maladies intestinales comme la maladie de Crohn ou la colite ulcéreuse (Tapiero et al. 2002). Le DHA joue un rôle primordial dans le développement infantile du cerveau ainsi que son bon fonctionnement (Lauritzen et al. 2016). Nommé acide cervonique lors de sa découverte, il est particulièrement abondant dans les membranes cellulaires du système nerveux central. Son accumulation dans le cerveau se fait lors de la période de croissance in utero jusqu’à environ 2 ans de vie; les hautes concentrations sont ensuite maintenues tout au long de la vie des individus (Lauritzen et al. 2016). Dû au manque de synthèse de novo, l’accumulation de DHA lors de la période de croissance dépend du transfert maternel,
ainsi que de l’alimentation, dont l’allaitement (Lauritzen et al. 2016). Malgré leurs fonctions primaires différentes, l’EPA et le DHA favorisent tous deux une bonne santé cardiovasculaire et réduisent les risques d’hypertension (Williams 2000).
Le contenu en acides gras polyinsaturés est soumis à une variation interspécifique. En effet, les espèces avec des grandes concentrations d’oméga-3 comme les diatomées et les cryptophytes ont une plus grande qualité nutritive que les espèces avec peu d’oméga-3 comme les cyanophytes (Ravet et al. 2003).
Les pigments antioxydants
Les composés antioxydants caroténoïdes, comme le β-carotène, sont des précurseurs de la vitamine A chez les animaux et chez l’humain (Handelman 2001). Cette vitamine essentielle pour la santé humaine joue un rôle dans l’embryogenèse, la croissance et la différentiation de l’épithélium (Rothman et al. 1995). Elle semble également avoir un effet bénéfique contre la formation de cellules cancéreuses, mais ce rôle reste à prouver (van Poppel et van den Berg 1997). De plus, la vitamine A est particulièrement importante pour les femmes enceintes, qui en requièrent davantage pour assurer au fœtus un apport suffisant de cette vitamine essentielle (Lelièvre-Pégorier et al. 1998).
De nombreux composés antioxydants sont retrouvés dans le phytoplancton marin. Ces composés aident les organismes à éviter les dommages causés par divers stress oxydatifs, tels que les dérivés réactifs de l’oxygène, le H2O2 et les radiations solaires ultraviolettes,
entre autres (W. Sunda et al. 2002). Ces divers stress peuvent entraîner des dommages aux cellules et compromettre leur bon fonctionnement ainsi que leur intégrité (Cakmak et Marschner 1992). Ces composés antioxydants ont différentes fonctions cellulaires et n’ont pas les mêmes localisations au cœur des cellules. Les principaux composés antioxydants non enzymatiques sont le β-carotène et le α-tocophérol. Le β-carotène induit une protection photo-oxydative dans le photosystème II, alors que le α-tocophérol prévient la peroxydation des lipides membranaires (Häubner et al. 2014). Le β-carotène joue également un rôle dans la photosynthèse (Juneja et al. 2013). Certaines algues contiennent également du α-carotène, par exemple les cryptophytes et les chlorophycées (Takaichi
2011). Pour la plupart des composés antioxydants, l’intensité du stress oxydant influence la concentration des composés assurant la protection des organismes (W. Sunda et al. 2002; Häubner et al. 2014).
Effet des conditions physico-chimiques sur la composition des microalgues
Il est fort probable que les changements environnementaux puissent altérer et modifier les qualités nutritives des microalgues. Cependant, il est difficile de prévoir l’ampleur et la nature de ces changements. Ces effets peuvent être directs, en agissant sur la physiologie et le métabolisme des cellules, ou encore indirects, en agissant sur la composition taxonomique des assemblages de microalgues.
La température de l’eau affecte plusieurs processus cellulaires du phytoplancton, par exemple les changements de phase des lipides, la conformation des macromolécules et la vitesse des réactions physico-chimiques (Rhee et Gotham 1981). Une température plus basse augmente le niveau d’insaturation des lipides membranaires afin stabiliser la membrane. La synthèse intracellulaire des lipides peut également diminuer à des températures plus hautes que la température optimale de l’espèce (Juneja et al. 2013). De façon générale, une augmentation de la température de l’eau entraîne une augmentation du taux de croissance du phytoplancton, jusqu’à l’atteinte de la température optimale où celui-ci est maximal. Une fois dépassé cette température, le taux de croissance chute rapidement (Eppley 1972). Cependant, le taux d’assimilation des nutriments et le taux de croissance ont des températures optimales différentes, augmentant la gamme de température où les différentes espèces peuvent survivre (Rhee et Gotham 1981). Chaque espèce présente une température optimale qui lui est propre ; toutefois, cette température peut changer légèrement, par exemple dans diverses conditions de salinité et de nutriments (Eppley 1972; Rhee et Gotham 1981). Finalement, une augmentation de température entraîne généralement une concentration plus grande de pigments caroténoïdes, une plus haute température étant associée à une formation de dérivés réactifs de l’oxygène plus importante (Juneja et al. 2013).
Dans l’environnement marin, la quantité de lumière qui pénètre dans l’eau diminue avec la profondeur (Zlotnik et Dubinsky 1989). La croissance du phytoplancton est maximale à
saturation lumineuse ; elle diminue au-dessus (photoinhibition) ou en-dessous de cette intensité optimale (Juneja et al. 2013). Afin de remédier à un manque de lumière, le phytoplancton peut parfois augmenter sa concentration en chlorophylle a, un pigment photosynthétique (Falkowski et Owens 1980). De plus, de façon générale, une grande intensité lumineuse tend à endommager et ainsi réduire la quantité d’acides gras polyinsaturés (Juneja et al. 2013). Le mélange de la couche euphotique joue un rôle important dans l’accès à la lumière des organismes phytoplanctoniques. Lors de changements dans le régime de mélange des eaux, des changements dans les espèces présentes sont également observés. Par exemple, des eaux peu mélangées seront dominées par les dinoflagellés, alors que des eaux bien mélangées seront plutôt dominées par des diatomées (Huisman et al. 2004). De façon plus générale, dans les eaux bien mélangées, les espèces présentant l’intensité lumineuse critique la plus basse devraient éliminer les autres espèces (Huisman et Weissing 1994; Weissing et Huisman 1994). Les espèces à flottaison plus importante pourront flotter près de la surface dans des eaux peu mélangées, augmentant leur apport en lumière (Huisman et al. 2004).
La plupart des espèces de phytoplancton marines ne tolèrent pas un pH supérieur à 9,5 (Goldman et al. 1982). Comme pour la température et la quantité de lumière, les organismes ont une valeur de pH optimale pour leur croissance ; au-delà de cette valeur, le taux de croissance n’est pas maximal et le taux d’assimilation du carbone diminue. Ainsi, les espèces tolérantes à des changements de pH pourront survivre dans une plus grande variété de milieux, tandis que les espèces peu tolérantes se feront rapidement remplacer si le pH de leur milieu est modifié (Goldman et al. 1982). Il est suggéré qu’à un pH alcalin, la disponibilité du CO2 devienne limitante et altère la photosynthèse (Chen et Durbin
1994). Le pH est également un facteur important régissant les blooms de dinoflagellés dans les eaux côtières, car une valeur de pH élevée permettrait la floraison (bloom) de ces organismes en excluant les autres espèces moins tolérantes (Hinga 1992). Bien que le pH fluctue de manière saisonnière sous l’effet de la production primaire (Rudnick et Oviatt 1986), ces changements ne durent pas assez longtemps pour permettre un changement durable des espèces phytoplanctoniques et leur influence se manifeste seulement pendant et quelques temps après les blooms (Hinga 1992). Le pH agit également sur la physiologie
des microalgues. Dans un milieu alcalin, les cellules ont tendance à accumuler une plus grande quantité de triglycérides ; toutefois, leurs lipides membranaires diminuent et peuvent présenter un nombre réduit d’insaturations (Juneja et al. 2013). Dans un contexte d’acidification, les changements observés dans la composition en acides gras oméga-3 semblent plutôt liés à des changements dans la composition de la population de microalgues. En effet, un pH plus bas ne semble avoir aucun ou peu d’effets négatifs sur la qualité des acides gras polyinsaturés (Leu et al. 2012). Finalement, le β-carotène est dégradé dans des conditions acides (Kalač et Kyzlink 1979), ce qui laisse présager des quantités réduites de caroténoïdes dans les microalgues en milieux acidifiés.
Le Nunavik
De par leur position à l’extrême Nord de la zone de transition entre les écosystèmes tempérés et polaires, les eaux arctiques qui ceignent le Nunavik sont très susceptibles au changement climatique et présentent un large éventail de conditions environnementales. Ce contexte est particulièrement propice à l’examen des impacts de la température et du pH sur les qualités nutritives des microalgues.
Le Nunavik est constitué du territoire québécois situé au nord du 55ième parallèle. Son
territoire maritime comprend le nord-est de la baie d’Hudson, le détroit d’Hudson ainsi que la baie d’Ungava.
La baie d’Hudson
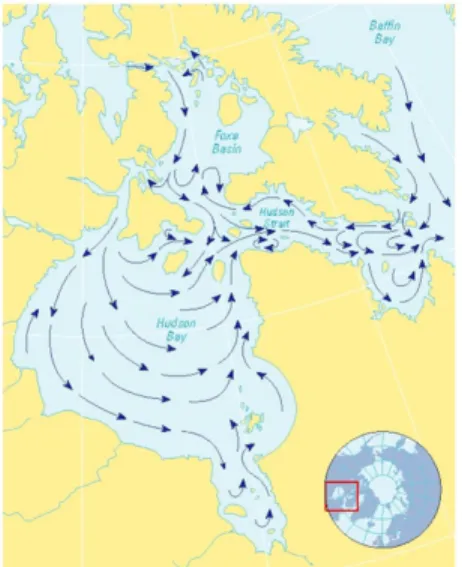
La baie d’Hudson est un plan d’eau ayant plusieurs caractéristiques uniques, soit sa localisation en périphérie de la zone arctique, sa grande superficie et sa profondeur relativement faible (Savard et al. 2014). Elle est connectée à la mer du Labrador par le détroit d’Hudson. Elle unit également la mer du Labrador à l’archipel arctique grâce au bassin de Foxe, ainsi qu’aux détroits de Fury et d’Hecla. La baie d’Hudson passe d’une étendue d’eau couverte de glace pendant l’hiver à de l’eau libre en été (Savard et al. 2014). Elle joue également un rôle important dans la variabilité régionale du climat (Maxwell 1986). Des quantités importantes d’eau douce sont acheminées dans la baie par les nombreuses rivières qui viennent s’y jeter et plus de 10003 km3 d’eau douce sont acheminés
chaque année dans la mer du Labrador par le détroit d’Hudson (Saucier et al. 2004). L’eau sortant de la baie par le détroit provient du courant de surface, constitué d’eau plus chaude et à faible salinité, contrairement à l’eau froide et salée du bassin de Foxe et du détroit d’Hudson (Prinsenberg 1991). Cependant, les flux d’eau douce dans la baie sont perturbés par la construction de centrales hydroélectriques, qui viennent modifier l’écoulement naturel des rivières. Ces perturbations peuvent éventuellement avoir un impact sur l’océanographie et le couvert de glace de la région (Prinsenberg 1991). Les glaces sont plus épaisses au nord de la baie ; cependant, lors de la fonte, la glace se dirige vers le sud et est piégée par la côte, où elle s’accumule avant de fondre. L’étendue interannuelle du couvert de glace est toutefois variable. Les changements climatiques pourraient apporter d’importants bouleversements : les scénarios actuels prédisent une transition vers une réduction de la période d’englacement de 7 à 9 semaines à des conditions d’eau libre à l’année d’ici la fin du siècle (Boer et al. 2000; Joly et al. 2011). La moitié du flux de chaleur atmosphérique vers la baie étant utilisé pour faire fondre la glace (l’autre moitié est utilisée pour réchauffer la colonne d’eau) (Prinsenberg 1984), la disparition de la glace bousculerait les flux d’eau douce et de chaleur, qui auraient à leur tour un impact sur la salinité, la température et les patrons de circulation de l’eau de la baie d’Hudson (Prinsenberg 1991).
Le détroit d’Hudson et la baie d’Ungava
Le détroit d’Hudson est un passage large et profond reliant la baie d’Hudson et le bassin de Foxe à l’ouest et la mer du Labrador et le détroit de Davis à l’est. On retrouve la baie d’Ungava à l’extrémité est du détroit d’Hudson. On retrouve deux afflux dans le détroit :
de l’eau douce provenant des rivières se jetant dans la baie d’Ungava et provenant de la baie d’Hudson et des eaux salées océaniques provenant de la mer du Labrador (Drinkwater 1986).
Figure iii Carte des courants de surface de la baie d’Hudson, du détroit d’Hudson, de la baie
d’Ungava et du bassin de Foxe (AMAP).
La couverture de glace y est présente 8 mois par année et la fonte de la glace commence vers la fin du mois de mai (Crane 1978). Vers la fin juillet, la glace est normalement limitée à l’ouest du détroit d’Hudson et à la baie d’Ungava (Drinkwater 1986). Les eaux de la baie d’Ungava sont similaires à celles du sud du détroit d’Hudson. Toutefois, une salinité plus faible est observée grâce aux rivières qui déversent de l’eau douce dans la baie (Drinkwater 1986).
Hypothèses et objectifs
L’étude de santé Qanuilirpitaa? (Comment allons-nous maintenant?) effectuée en 2017 dans les 14 communautés Inuit du Nunavik avait pour but d’évaluer l’état de santé physique et mental des jeunes et des adultes, ainsi que la santé des communautés. Cette étude fait suite à l’étude Qanuippitaa? (Comment allons-nous?) effectuée en 2004 et effectue également un suivi de certains participants rencontrés en 2004. De nombreuses différences régionales dans les états de santé des participants ont été observées, particulièrement en ce qui concerne les niveaux de contaminants et les concentrations d’acides gras sanguins. Les habitudes alimentaires concernant la consommation d’aliments traditionnels étaient aussi
très différentes d’une région à l’autre (Lemire et al. 2015). Ainsi, une question se pose : est-ce que la chaîne alimentaire marine arctique aurait un rôle à jouer dans la santé des Inuit du Nunavik? Afin d’aider à répondre à cette question, la présente étude se concentre sur les microalgues et les hypothèses de recherche suivantes:
H1: L’augmentation de la température de l’eau fait augmenter la quantité de
pigments caroténoïdes, mais diminuer la proportion d’acides gras polyinsaturés dans les microalgues
H2 : L’acidification de l’eau fait diminuer la quantité de pigments caroténoïdes,
mais n’a que peu ou pas d’effets sur les acides gras polyinsaturés
H3: La composition taxonomique de la communauté a une influence sur les qualités
nutritives de celle-ci
Une caractérisation détaillée du territoire maritime entourant le Nunavik nous permet de bien comprendre les différents facteurs pouvant avoir une influence sur les qualités nutritives ainsi que la composition des microalgues. Ainsi, le premier objectif était de caractériser les régions maritimes de l’est de la baie d’Hudson, du détroit d’Hudson ainsi que de la baie d’Ungava. Des mesures des différents paramètres physico-chimiques ont été effectuées, soit la température, la salinité et le pH, en plus d’analyses taxonomiques afin de décrire les communautés phytoplanctoniques.
Le deuxième objectif était d’évaluer l’influence des différents paramètres physico-chimiques de l’eau ainsi que de la composition de la communauté sur les qualités nutritives des microalgues. Des mesures des différentes composantes des microalgues ont été réalisées, soit les acides gras polyinsaturés, les pigments caroténoïdes ainsi que la composition élémentaire (carbone (C), azote (N), phosphore (P)). Ces mesures ont ensuite été mises en relation avec les différents paramètres physico-chimiques et la taxonomie, afin d’estimer leur influence sur les microalgues.
1. Nutritive qualities of marine microalgae in Nunavik
1.1 Résumé
La région maritime du Nunavik est d’une importance fondamentale pour les populations Inuit qui y vivent grâce à son apport substantiel en nourriture et matériaux. Les microalgues marines à la base de la chaîne alimentaire sont une source de composés essentiels comme les acides gras oméga-3 et les pigments caroténoïdes, mais leur qualité nutritive pourrait être modifiée par les changements de l’environnement marin. Considérant que les contrastes spatiaux de conditions environnementales entre les trois régions du Nunavik peuvent servir d’analogue aux changements à venir, cette étude avait pour but d’étudier l’influence des paramètres physico-chimiques de l’eau sur la composition et les qualités nutritives des microalgues marines. Les communautés algales ont passé d’une dominance de diatomées en 2017 à une dominance de flagellés en 2018. Les caroténoïdes étaient négativement influencés par la température, le pH et la contribution des flagellés, mais positivement par celle des diatomées. L’EPA était également influencé négativement par la température et les proportions de flagellés, mais positivement par le pH et la contribution des diatomées. Une combinaison d’effets directs et indirects de l’environnement sur les qualités nutritives des microalgues a pu être démontrée grâce aux corrélations entre les composés essentiels et les paramètres physico-chimiques de l’eau ainsi que l’effet de ces derniers sur la contribution de différents groupes d’algues à la communauté phytoplanctonique.
1.2 Abstract
The maritime region of Nunavik is of utmost importance for the Inuit populations who live there, as it provides sustenance and materials. Marine microalgae at the base of the food chain are a source of essential compounds such as polyunsaturated fatty acids and carotenoids, but their nutritive quality is possibly altered by Global change. Using contrasted environmental conditions between the Nunavik maritime regions as an analog of climate change, this study aimed to assess the influence of physicochemical parameters on composition and nutritive qualities on marine microalgae. Algal communities showed a dominance of diatoms in 2017 but were outnumbered by flagellates in 2018. Carotenoids showed a negative correlation with temperature, pH and the proportion of flagellates in the community but were positively influenced by the proportion of diatoms. EPA was also correlated negatively to temperature and the contribution of flagellates but positively correlated to pH and diatom proportion. A combination of direct and indirect effects on the nutritive quality of microalgae was demonstrated by the relationships between essential compounds and the physicochemical properties of the water column, as well as the latter’s influence on the contribution of different algal groups to the phytoplankton assemblage.
1.3 Introduction
The Arctic region is home to many indigenous groups, ranging from North America to Greenland and Russia. Many of these groups are exclusive to this region, including the Inuit People from Nunavik in Northern Quebec (Hovelsrud et al. 2008). These communities have a strong relationship with their surrounding environment, especially the aquatic ecosystem which provides traditional foods such as fish, seal, whale and shellfish (Lemire et al. 2015; Dehn et al. 2006). These traditional foods are remarkably rich in several essential compounds and the activities surrounding the hunting and sharing of these country foods among the community is crucial to social cohesion and cultural continuity (Lemire et al. 2015). However, a rapidly changing Arctic environment is expected to alter the entire marine food web, therefore impacting the Inuit communities that rely on these resources (Hovelsrud et al. 2008).
The impacts of climate change are particularly rapid and severe in the Arctic Ocean due to the phenomenon of Arctic amplification (Serreze and Barry 2011). Thick multi-year ice is gradually being replaced by a thin annual sea ice cover (Arrigo et al. 2008) and an iceless summer could be possible as early as 2030 (Stroeve et al. 2008). This reduced sea ice extent has already increased annual primary production through a decreased minimum summer ice extent and longer phytoplankton growth season (Arrigo et al. 2008). Other effects include rising air temperatures (Serreze and Francis 2006; Serreze et al. 2007) and enhanced upper ocean stratification, which reduces vertical mixing and therefore limits the input of deep-sea nutrients to the surface layer (Ardyna et al. 2014). These changes will presumably alter the structure and functioning of Arctic marine ecosystems in ways that are not fully known (Tremblay et al. 2015). Since phytoplankton forms the base of the pelagic food web, any changes in their chemical composition or nutritive qualities will affect the entire ecosystem. These characteristics can be modified directly through a modification of cell physiology and/or indirectly via shifts in the taxonomic composition of phytoplankton assemblages, for instance by the replacement of large-sized species by smaller ones (Li et al. 2009).
Microalgae are the only organisms able to synthesize several essential compounds in sufficient quantities, such as omega-3 fatty acids and antioxidant pigments (Tapiero et al. 2002; Häubner et al. 2014). Essential fatty acids, specifically, are considered as key components of food quality (Kainz et al. 2004). Two polyunsaturated fatty acids are particularly important: eicosapentaenoic acid (EPA) and docosahexaenoic acid (DHA). The effect of these omega-3 on human health include anti-inflammatory properties, brain development and functioning as well as cardiovascular health (Tapiero et al. 2002; Lauritzen et al. 2016). Some antioxidant pigments, such as b-carotene, are vitamin A precursors (Handelman 2001). Vitamin A is crucial for fetal development and pregnant women require a relatively high dietary supply (Lelièvre-Pégorier et al. 1998). Since de novo synthesis of these health-enhancing compounds cannot be achieved by humans or the animals they consume, they must be obtained from their diet (Tapiero et al. 2002; Stahl and Sies 2003; Kainz et al. 2004).
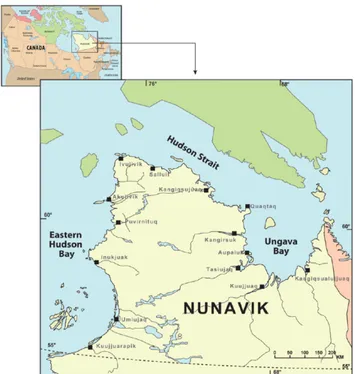
Nunavik, in the North of Quebec province in Canada, is home to fourteen Inuit communities that rely on local marine foods for a significant portion of their diet (Lemire et al. 2015). This territory can be divided into three oceanic domains that correspond to different sections of the coast and have distinct physicochemical properties.
Hudson Bay covers a large but relatively shallow area; it connects to the Labrador Sea via Hudson Strait, and is also connected to the Arctic Archipelago through the Foxe Basin (Savard et al. 2014). Surface conditions in Hudson Bay vary from a full ice cover in winter (January to May) to completely ice-free conditions in summer (August to September) (Savard et al. 2014). It receives large quantities of freshwater from more than 29 rivers and each year, more than 1M of km3 of water are conveyed to the Labrador Sea through the
Hudson Strait (Saucier et al. 2004). Current scenarios predict that the ice season in Hudson Bay will be reduced by at least 7 to 9 weeks in the coming decades (Boer et al. 2000; Joly et al. 2011). The will most certainly induce major changes in heat and freshwater fluxes, which will, in turn, affect the salinity and temperature of surface waters and their circulation in the Bay (Prinsenberg 1991). Hudson Strait is ice covered for 8 months every year, with an ice-free season that extends from August to October (Crane 1978). The surface waters of Ungava Bay are similar to those of Hudson Strait, although less salty due to the discharge of numerous rivers (Drinkwater 1986). Sea ice forms in situ during late November and usually melts in mid-June like in Hudson Strait (Drinkwater 1986).
This study is part of the BriGHT (Bridging Global change, Inuit Health and the Transforming Arctic Ocean) program. BriGHT aims to deepen our understanding of the Arctic marine food web and the interactions within its trophic levels, in order to apprehend the effects of environmental changes and its potential consequences on the Inuit population of Nunavik, who heavily rely on marine animals in their diet. Here we report a comprehensive analysis of the microalgae found in the eastern Hudson Bay, Hudson Strait and Ungava Bay. The main objectives of this study were to 1) characterize the maritime territory of Nunavik in terms of physicochemical properties and taxonomic composition and 2) assess the influence of these physicochemical conditions and taxonomy on the composition and nutritive qualities of marine microalgae in Nunavik. Based on the available literature, three hypotheses have been formulated: 1) rising water temperature increases carotenoids quantities, but lowers omega-3 proportions (Juneja et al. 2013), 2) a drop in pH decreases carotenoids quantities but has little to no effect on omega-3 proportions (Kalač and Kyzlink 1979; Leu et al. 2012) and 3) the taxonomic composition
of the phytoplankton community affects both the carotenoid and omega-3 proportions in microalgae (Ravet et al. 2003; Li et al. 2009).
1.4 Materials and Methods
1.4.1 Study area and sampling
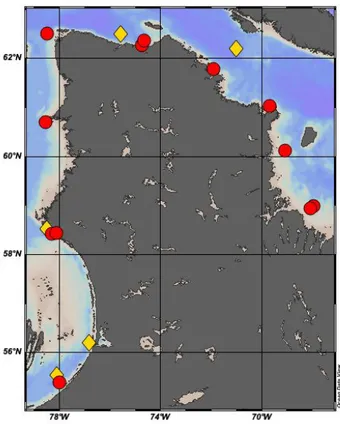
This study was carried out aboard the CCGS Amundsen in early July 2017 and 2018 during a Sentinel North-BriGHT expedition. The sampling was conducted around the coasts of Nunavik, Northern Quebec, Canada. In 2017, 9 stations were sampled, whereas in 2018, 5 stations were sampled.
Figure 1.2 Map of the stations sampled during July 2017 (red dots) and 2018 (yellow diamonds) in Nunavik.
Note that fewer stations were sampled in 2018 due to difficult ice conditions.
Samples were collected at the surface and at the subsurface maximum of chlorophyll fluorescence (SCM). At each station, water samples were collected using a rosette sampler equipped with 12 liters Niskin-type bottles (OceanTest Equipment Inc., n = 24), a conductivity-temperature-depth (CTD) profiler (SBE-911, Sea-Bird Inc.), a chlorophyll fluorometer (Seapoint Sensors Inc.) and a sensor measuring photosynthetically active radiation (PAR; QCP2300, Biosperical Instruments Inc.). Water samples were pre-filtered
using a 200 µm Nylon mesh and collected in clean 20 liters carboys. The SCM depth was determined at each station during the downcast of the CTD. At target stations, the zodiac was used to sample coastal areas; in this case, only surface water was collected. Those zodiac stations are identified by numbers ending with “z”.
1.4.2 Physical and chemical parameters
At each station, water temperature and salinity were determined with the CTD profiler. The concentration of ammonium (NH4+) was determined on fresh samples using the
fluorimetric method (Holmes et al. 1999), with an analytical detection limit of 0.02 µmol l-1. Other nutrients (nitrite (NO
2-), nitrate (NO3-), phosphate (PO43-) and silicate (SiO4-))
were collected into acid-washed 15-ml polyethylene tubes after filtration on a Whatman GF/F filter (25 mm diameter, nominal porosity of 0.7 μm) inserted in a filter holder to remove large particles. Concentrations were determined by routine colorimetric methods using a Bran and Luebbe Autoanalyzer III. Analytical detection limits were 0.02 µmol l-1
for NO2-, 0.03 µmol l-1 for NO3-, 0.05 µmol l-1 for PO43- and 0.1 μmol l-1 for SiO4-. The pH
measurements were determined by the spectrophotometric method as described by Dickson et al. (2007).
1.4.3 Particulate organic matter composition
Chlorophyll a (chl a) was measured by filtering between 250 ml and 1 liter of water onto Whatman GF/F filters (25 mm diameter, nominal porosity of 0.7 µm). Pigments were extracted in 90% acetone for 24 hours in the dark at 4 ºC, and concentrations were determined using the fluorometric technique (Parsons et al. 1984). The taxonomic composition of samples was determined on samples preserved with acidic Lugol solution. Cells larger than 2 µm were identified to the lowest possible taxonomic rank using inverted microscopy (Nikon Eclipse TS100 and Zeiss Axiovert 10) using methods based on Lund et al. (1958) and Utermöhl (1958). At least 400 cells were enumerated at a magnification of 400X for each sample. Particulate organic phosphorus (POP) was determined following the method described by Solórzano and Sharp (1980). Samples for the determination of particulate organic carbon (POC) and particulate nitrogen (PN) were collected by filtering 1 liter onto pre-combusted (450ºC for 24h) Whatman GF/F filters (25 mm diameter,
nominal porosity of 0.7 µm). Filters were then placed in cryovials, dried at 60 ºC for 48 hours and stored until subsequent analysis at home laboratory. Prior to the analyses, filters were dried again at 60 ºC for 48 hours, wrapped in tin foil and pressed tightly to evacuate air. They were then analyzed with an elemental analyzer and continuous flow Isotope-Ratio-Mass-Spectrometer (IRMS) (Delta V Advantage, Thermo-Finnigan) using the modified Dumas method (Fiedler and Proksch 1975). All isotopic enrichments were expressed as atom% relative to internationally reference standards (L-glutamic acid, USGS-40, USGS-41 and IAEA-N3) calibrated against N2.
1.4.4 Fatty acids
Samples for fatty acid (FA) analyses were obtained by filtering between 3 and 5 liters of water onto pre-combusted Whatman GF/C filters (47 mm diameter, nominal porosity of 1.2 µm) and freezing them quickly at -80 ºC until analysis at home laboratory. 5b-Cholanic Acid (50 µl, 10.056 µg 100 µl-1) was added as an internal standard to each sample (~ 0.2 g
dry weight). Samples were saponified (KOH 5%, MeOH/H2O 80/20, 90ºC, 1 hour), then
saponifiable lipids (SL) were extracted from the saponification mixture by acidification (HCl 37%, 2 ml) and liquid extraction (Hexane, 3 x 2 ml). BF3-methanol 10% (500 µl) and NaCl-saturated water (2 ml) were used for derivatization and enhancing polarizability, respectively. SL were once again extracted by liquid extraction (Hexane, 3 x 2 ml) and rinsed out with Milli-Q water (3 ml). After filtering through a glass Pasteur pipette containing anhydrous Na2SO4 to remove water from samples, FA composition was
analyzed by gas chromatography-mass spectrometry (GC-MS) (Belt et al. 2007). Quantification of lipids was possible using internal standards and systematic determination of response factor of said standards.
1.4.5 Pigments
Between 500 ml and 2 liters of water were filtered onto pre-combusted (450 ºC, 24 hours) Whatman GF/F filters (25 mm diameter, nominal porosity of 0.7 µm) that were quickly frozen at -80ºC until analysis. Samples were analyzed with HPLC Agilent Technologies 1200 using the method described by Ras et al. (2008). Carotenoids and chlorophyll b and c were detected at 450 nm, whereas chlorophyll a and derivatives were detected at 667 nm.
1.4.6 Normalization and statistical analyses
In order to facilitate comparisons between polyunsaturated fatty acids and carotenoids variables, values were normalized to POC. Values of fatty acids and POC were first transformed into mg per g of dry weight per L. The ratio fatty acid:POC was then calculated and expressed as a percentage. For carotenoids, values were expressed as mg pigment per L and divided by POC (expressed as mg L-1) to calculate a ratio, again expressed as a
percentage.
Phytoplanktonic communities are presented in relative numerical abundance to obtain a better visual demonstration of the importance of certain taxonomic groups. These results could also have been presented in carbon abundance, and this method may have given more information concerning the contribution of each phytoplanktonic group to the total biomass. However, for this study, the focus was more on the influence of each taxonomic group on the essential compounds. Therefore, it was decided that for the present analyses, relative numerical abundances were the best option.
Shapiro-Wilk test and residual diagrams were used prior to statistical analyses to test variables for normality and homoscedasticity, respectively. Pearson correlation coefficients with a significant threshold of p = 0.05 were used to assess the degree of linear dependence between environmental parameters, taxonomy and nutritive qualities. These analyses were made using R 4.0.0 software (package vegan). Nutrient concentrations were not considered in the correlations because of a lack of sufficient data for meaningful analyses, as surface samples often contained undetectable quantities of nitrate. Multivariate analyses were not conducted in this study because the small number of stations did not provide enough data to permit this type of analysis.
1.5 Results
1.5.1 Environmental conditions
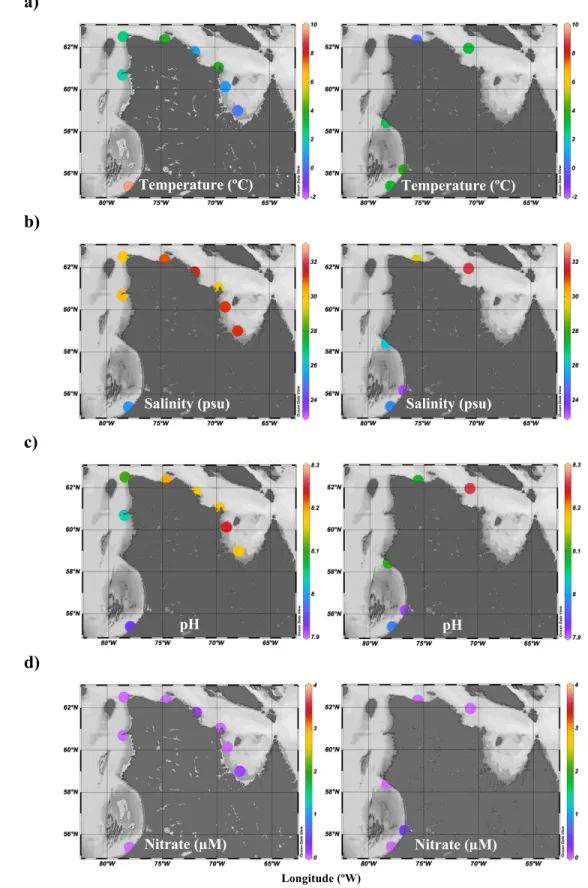
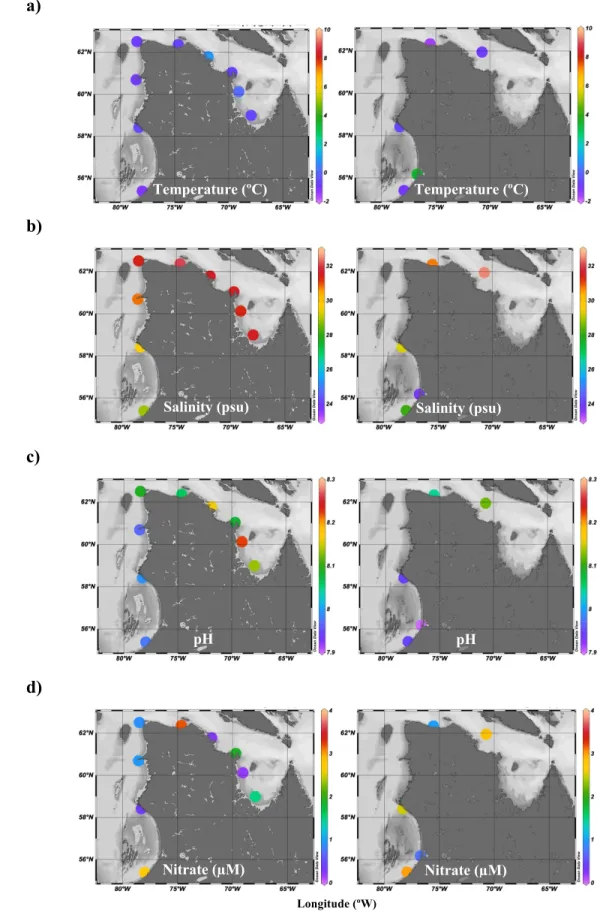
The physicochemical parameters measured in July 2017 and 2018 include temperature, salinity, pH and NO3-. Surface values showed the most variability between the regions
(Figure 1.3 and 1.4). Water temperature was highest at the surface in eastern Hudson Bay (9.56 ºC) and got colder following the coast with lowest value in Ungava Bay (0.19 ºC). At the SCM, water temperature was consistently less than 1 ºC, with an exception at station 730 (2018) where it reached 3.4 ºC. The lowest salinity values were found in south-eastern Hudson Bay (23.27 psu). There was no strong difference between Hudson Strait and Ungava Bay values both at the surface and the SCM, however SCM values showed slightly higher salinity than their surface counterparts. Hudson Bay exhibited the lowest pH value (7.91), while the highest value (8.26) was found in Ungava Bay. In 2017, station 676 showed high pH (> 8.2) simultaneously at the surface and the SCM. At other stations, pH at the SCM was lower than the surface. Nitrate concentrations were very low (< 0.15 µM) in all surface samples. At the SCM, there was no clear regional patterns for NO3- values,
although values were higher than the surface. The highest value was found in Hudson Strait (3.18 µM) in 2017. Thus, NO3- was almost completely depleted at the surface, but increased
a)
b)
c)
d)
Longitude (ºW)
Figure 1.3 Values of a) temperature (°C), b) salinity (psu), c) pH and d) nitrate (µM) at the surface in eastern Hudson Bay, Hudson Strait and Ungava Bay in early July 2017 (left) and 2018 (right). Note that surface values for station 736 (eastern Hudson Bay, 2017) are unavailable.
La ti tu de ( ºN ) Temperature (ºC) Temperature (ºC)
Salinity (psu) Salinity (psu)
pH pH
a) b) c) d) Longitude (ºW)
Figure 1.4 Values of a) temperature (°C), b) salinity (psu), c) pH and d) nitrate (µM) at the SCM in eastern Hudson Bay, Hudson Strait and Ungava Bay in early July 2017 (left) and 2018 (right).
La ti tu de ( ºN ) Temperature (ºC) Temperature (ºC)
Salinity (psu) Salinity (psu)
pH pH
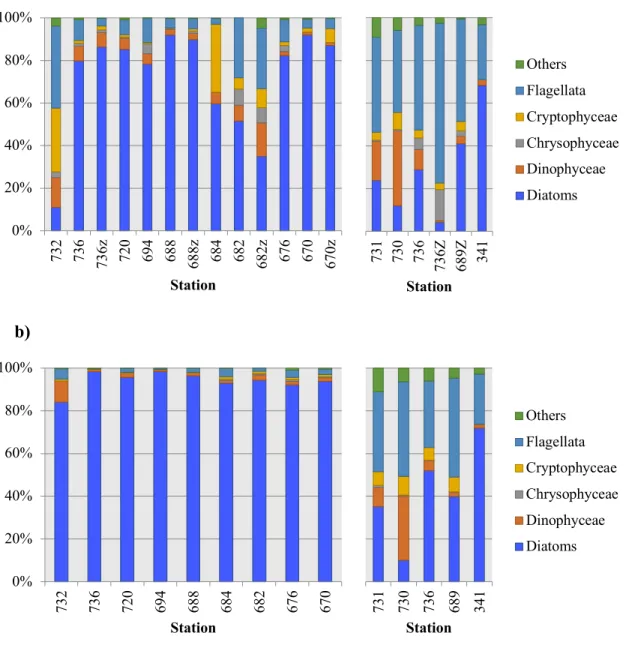
1.5.2 Taxonomy
Different groups of phytoplankton composed the communities depicted in Figure 1.5. In 2017, there was a dominance of diatoms, especially at the SCM where they systematically made up more than 80% of the community. All stations exhibited similar phytoplankton diversity except at station 732 where dinophyceae were slightly more represented. Surface communities were more mixed, with a significant contribution of flagellates, cryptophyceae and dinophyceae. The highest surface diversity was found in Hudson Bay (station 732) and eastern Hudson Strait (stations 684, 682 and 682Z). Flagellates were the most represented group in 2018, dominating all surface communities except at station 341 (eastern Hudson Strait) where diatoms were the most abundant group. The highest contributions of Dinophyceae were observed at stations 730 and 731 in Hudson Bay, both at the surface and SCM. Diatom abundance was generally slightly higher at the SCM than at the surface, except at station 730 where this group was conspicuously under-represented.
a)
b)
Figure 1.5 Taxonomic composition of each station at the a) surface and b) SCM during July in
2017 (left) and 2018 (right). The relative abundance of each phytoplankton group is given as a percentage of total cell counts. “Others” include dictyochophyceae, prasinophyceae and prymnesiophyceae. Surface data for station 689 (2018) is not available.
0% 20% 40% 60% 80% 100% 732 736 736z 720 694 688 688z 684 682 682z 676 670 670z Station 731 730 736 736Z 689Z 341 Station Others Flagellata Cryptophyceae Chrysophyceae Dinophyceae Diatoms 0% 20% 40% 60% 80% 100% 732 736 720 694 688 684 682 676 670 Station 731 730 736 689 341 Station Others Flagellata Cryptophyceae Chrysophyceae Dinophyceae Diatoms
1.5.3 Polyunsaturated fatty acids
The proportions of EPA and DHA to the POC showed no clear grouping among the three coastal regions (Figure 1.6). Systematic vertical differences were also absent, with surface proportions being higher than SCM values in 50% and 71% of cases for EPA and DHA contents, respectively. DHA contents were generally lower than EPA contents.
a) b)
Stations
Figure 1.6 Proportions of EPA (top) and DHA (bottom) for July a) 2017 and b) 2018 at the surface
(blue) and the SCM (red).
0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 732 736 736Z 720 694 688 Z688 684 682 682Z 676 670 670Z 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 731 730 736 736 Z 689 689 Z 341 Surface SCM 0 0.5 1 1.5 2 2.5 3 732 736 736Z 720 694 688 Z688 684 682 682Z 676 670 670Z 0 0.5 1 1.5 2 2.5 3 731 730 736 736Z 689 689Z 341 Surface SCM EP A : P O C ( %) DH A : P O C ( %) (º N )E
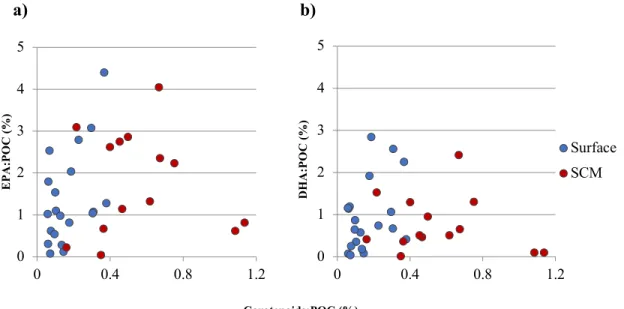
Our results showed no positive correlation between the proportions of specific polyunsaturated fatty acids and carotenoids with respect to POC (Figure 1.7). Samples with the highest EPA and DHA concentrations exhibited low to moderate carotenoid proportions, while carotenoid-rich samples generally had low EPA and DHA. Overall, the potential benefits of having high algal omega-3 or carotenoid contents for the food seldom occurred at the same location.
a) b)
Carotenoids:POC (%)
Figure 1.7 Relationships between the proportion of total carotenoids compared to a) EPA and b)
DHA contents at the surface (blue) and the SCM (red) for July 2017 and 2018 (combined). By contrast with essential fatty acids, carotenoid proportions were almost systematically higher at the SCM than at the surface (Figure 1.8). No clear regional pattern was observed but the surface samples of northern Hudson Bay and western Hudson Strait had very low carotenoid proportions in 2017 (not shown). Within carotenoids, photosynthetic pigments were generally more abundant than photoprotective ones, especially at the SCM (Figure 1.9), where their concentrations were one order of magnitude higher than at the surface for some stations. 0 1 2 3 4 5 0 0.4 0.8 1.2 EP A :P O C ( % ) 0 1 2 3 4 5 0 0.4 0.8 1.2 DH A: P O C (% ) Surface SCM
a) b)
Carotenoids:POC (%) Surface
Figure 1.8 Relationships between the proportion of carotenoid pigments at the surface and the
SCM during July in a) 2017 and b) 2018. The line represents a 1:1 relationship and is provided for visual reference.
Figure 1.9 Relationship between the proportions of photosynthetic and photoprotective carotenoid
pigments at the surface (blue) and the SCM (red) during July 2017 and 2018 (combined). Photoprotective pigments represent the sum of b-carotene astaxanthin, violaxanthin, diadinoxanthin, antheraxanthin, diatoxanthin, zeaxanthin and lutein, while photosynthetic pigments represent the sum of peridinin, fucoxanthin, neoxanthin, prasinoxanthin and alloxanthin.
0 0.2 0.4 0.6 0.8 1 1.2 0 0.1 0.2 0.3 0.4 Ca ro te n oi d s: P O C (% ) S CM 0 0.2 0.4 0.6 0.8 1 1.2 0 0.1 0.2 0.3 0.4 0 0.2 0.4 0.6 0.8 1 1.2 0 0.02 0.04 0.06 0.08 0.1 0.12 Pho to sy nt he ti c: PO C ( % ) Photoprotective:POC (%) Surface SCM
1.5.4 Effects of environment and taxonomy on nutritive qualities
The responses of essential compounds to environmental parameters and taxonomy were highly variable (Table 1.1). Carotenoids were correlated with temperature and the contribution of diatoms to the phytoplankton assemblage, with the highest correlation with temperature. EPA proportions covaried will all parameters and the correlation was strongest with pH. No correlation was observed between DHA contents and the variable considered. Carotenoids and EPA showed the same correlations to all parameters except pH, where they exhibited an inverse correlation. Environmental parameters have more influence on taxonomy than on nutritive qualities (Table 1.1). The contribution of diatoms to the community showed a positive correlation with salinity and pH and a negative correlation to temperature. Contribution of flagellates showed inverse results, with negative correlation to salinity and pH and positive correlation to temperature. Salinity was positively correlated to the temperature and negatively to pH. Temperature and pH showed the weakest correlation.
Table 1.1 Pearson correlation coefficient (r) between all studied parameters. The asterisk denotes
correlations that were significant (p < 0.05).
Carotenoids EPA DHA Salinity Temperature pH % Diatoms % Flagellates
Carotenoids 0.14 -0.12 0.36 -0.67* -0.27 0.36* -0.24 EPA 0.62* 0.39* -0.37* 0.59* 0.45* -0.35* DHA -0.22 0.08 0.23 -0.16 0.20 Salinity -0.65* 0.66* 0.62* -0.73* Temperature -0.05 -0.56* 0.51* pH 0.46* -0.39* % Diatoms -0.92* % Flagellates
The most salient significant relationships obtained in Table 1.1 are detailed in Figures 1.10 and 1.11. Although data from all depths were pooled for the correlation analysis, Figure 1.10 shows that the relationships between EPA content, pH and the contribution of diatoms or flagellates hold for the surface and the SCM as well. For the EPA-pH relationship, a new analysis was included (right-hand side of Fig. 2.10b) in which only those stations where temperature was below 1.9 ºC were included. This plot indicates that the relationship between EPA and pH also holds at the low range of temperatures for which this variable does not explain any variability in EPA content. By contrast with the EPA, Figure 1.11 shows that the relationships between carotenoid pigments and physicochemical variables differ between the SCM and the surface, with a tendency to be much flatter or non-significant for the latter. For the %diatoms, this pattern also holds for fucoxanthin specifically (right-hand side of Fig. 2.11c) since this pigment often made up a large fraction of the total carotenoids. An additional analysis (not shown) showed that the positive relationship between carotenoid content and pH depicted in Fig. 2.10b also held when only the samples for which diatoms made up more than 75% of total phytoplankton were considered. This result is particularly revealing because carotenoid content was largely independent of %diatom and temperature for this subset of data.
a) b) c) d)
Figure 1.10 Relationship between the proportions of EPA and a) temperature, b) pH, c) %
contribution of diatoms and d) % contribution of flagellates at the surface (full square) and SCM (open circle) in July 2017 and 2018 (all data pooled). In b), the left-hand plot shows all data, whereas the right-hand plot includes only those for which temperature was < 1.9 ºC.
a) b) c) d)
Figure 1.11 Relationship between the proportions of total carotenoids (left) or fucoxanthin (right)
and a) temperature, b) pH, c) % contribution of diatoms and d) % contribution of flagellates at the surface (full square) and SCM (open circle) in July 2017 and 2018 (all data pooled).
1.6 Discussion
Given the key role of the marine ecosystem for the nutrition and food security of coastal Inuit communities in Nunavik (Hovelsrud et al. 2008; Lemire et al. 2015), this study aimed to evaluate how the physicochemical parameters of the environment may affect the production of essential health-enhancing molecules by algae at the base of the food web. The gradients in temperature (-1.54 ºC to 9.56 ºC), salinity (32.5 psu to 23.3 psu) and pH (8.26 to 7.90) observed across the three maritime regions of Nunavik, namely eastern Hudson Bay, Hudson Strait and Ungava Bay, can be considered as spatial analogs for the temporal trends in warming, freshening and acidification expected from climate change in the Arctic. In this regard, this study is the first to explore the combined influence of large differences in multiple physicochemical parameters on the carotenoid and omega-3 contents of microalgae in a natural setting. The following discussion assesses how the environment can affect these contents indirectly by shifting the assemblage composition of phytoplankton and/or directly by altering the physiology of the dominant algal groups.
1.6.1 Influence of taxonomy
The nutritive qualities of microalgae with respect to fatty acids have already been shown to vary across taxonomic groups, both in fresh (Ravet et al. 2003) and marine organisms (Brett and Müller‐Navarra 1997). In this study, the phytoplankton communities were very different in 2017 and 2018 (Figure 1.5), with the major disparity being in the relative abundance of diatoms and flagellates. While sampling took place at the same time of year in both cases, open-water conditions were prevalent in 2017 while heavy ice conditions persisted in 2018. This difference presumably resulted in a more advanced stage of seasonal algal succession in 2017, with diatoms having replaced the pre-bloom community dominated by flagellates and other small-sized algal groups in 2018.
A greater relative abundance of diatoms was linked to elevated EPA contents in this study (Figure 1.10). Diatoms are known to be rich in fatty acids, especially EPA (Falk-Petersen et al. 1998; Ravet et al. 2003; Hixson and Arts 2016), and are therefore considered high-quality food for consumers (Ravet, et al. 2003; Hixson and Arts 2016). These qualities contribute to maintain high rates of growth and reproduction in a wide variety of marine