T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par L’Université Toulouse III – Paul Sabatier
Discipline ou spécialité : Écologie et évolution des populations et communautés
Présentée et soutenue par Wafa BOUZID LAMINE Le 07/05/08
Titre :
Structure génétique de Ligula intestinalis (Cestode : Diphyllobothriidea),
parasite des poissons d’eau douce
JURY
M André Théron Directeur de Recherche (DR1) - Université de Perpignan, France Rapporteur Mme Amel Ben Ammar El Gaaïed Professeur - Faculté des sciences de Tunis, Tunisie Rapporteur M Tomáš Scholz Professeur - Université de parasitologie, République Tchèque Examinateur Mme Brigitte Crouau-Roy Professeur - Université Paul Sabatier de Toulouse, France Examinateur Melle Géraldine Loot MCF - Université Paul Sabatier de Toulouse, France Examinateur Mme Oum Kalthoum Ben Hassine Professeur - Faculté des sciences de Tunis, Tunisie co-Directeur de Thèse
Dédicaces
A mes chers parents et à mes sœurs pour leur soutien de tous les instants et pour la confiance et l’amour qu’ils me témoignent chaque jour.
A mon époux et à ma fille qui font de ma vie un rêve.
– AUTEUR : Wafa Lamine Bouzid
– TITRE : Structure génétique de Ligula intestinalis (Cestode : Diphyllobothriidea), parasite des poissons d’eau douce.
– DIRECTEUR DE THÈSE : Pr.Oum Kalthoum Ben Hassine et Pr.Sovan Lek
– LIEU DE SOUTENANCE : Salle des conférences de l’IBCG, Université Paul Sabatier Toulouse III. – DATE : 07 Mai 2008
________________________________________________________________________________ RESUMÉ
Les parasites présentant une large distribution géographique et un cycle de vie complexe offrent une rare occasion pour l’étude des mécanismes de spéciation et d'évolution.
Ligula intestinalis (Cestoda, Diphyllobothriidea) présente une large distribution géographique et évolue dans un cycle de vie à plusieurs hôtes. Les études montrent que le spectre d’hôte varie en fonction des populations étudiées et qu’il existe des différences de pathologie entre des espèces hôtes vivant en sympatrie. En outre, le tableau de L. intestinalis est d’autant plus complexe du fait de la paraphylie de cette espèce avec les espèces Ligula colymbi et Digramma interrupta.
Le but de cette étude est de comprendre l’origine des différences écobiologiques et des discordances phylogénétiques et de tester l’hypothèse de l’existence de différentes lignées/espèces de ce parasite. Pour ce faire, nous avons analysé la phylogénie et la structure génétique de plérocercoides de ligules appartenant à différentes espèces hôtes et régions géographiques à large échelle.
Les résultats basés sur les séquences génomiques montrent l’existence de différents patrons évolutifs: A l’échelle locale, une structure génétique plate a été trouvée et est vraisemblablement due à la migration de l’hôte définitif empêchant la formation d’entités génétiques différentes. A contrario, à large échelle des groupes génétiquement distants et bien isolés sont présents montrant une forte correspondance entre la structuration génétique et l’isolement géographique. De plus, une structuration liée à l’espèce hôte est également observée.
Les spécimens de ligules identifiés comme des individus de l’espèce L. colymbi se répartissent dans différents clades de L. intestinalis tandis que les individus de Digramma montrent une différentiation claire du reste des individus de Ligula. Cependant, leur clade monophylétique apparaît au sein des spécimens de L. colymbi et L. intestinalis. Ainsi le genre Digramma devra être reconsidéré.
Mots clés : Ligula intestinalis, phylogénie parasitaire, spécificité parasitaire, isolement géographique, Digramma interrupta, Ligula colymbi, Diphyllobothriidae.
– DISCIPLINE ADMINISTRATIVE : Écologie
– INTITULE ET ADRESSE DU LABORATOIRE : Laboratoire Évolution et Diversité Biologique.
Remerciements
La bonne réalisation de cette thèse n’a été rendue possible que grâce à l’aide, l’encouragement et au concours d’un grand nombre de personnes auxquelles je tiens à exprimer mes vifs remerciements :
Ma première pensée est dirigée vers mes deux directeurs de thèse, sans qui rien de tout cela n’aurait été possible. De manières très différentes mais complémentaires, ils ont su guider et cadrer ce travail de recherche :
– A M. Sovan Lek, Professeur à l’université Paul Sabatier et directeur de l’école doctorale SEVAB. Son encadrement de grande qualité et sa disponibilité m’ont permis d’avancer dans la bonne direction et d’arriver à bon port.
– A Mme Oum Kalthoum Ben Hassine, Professeur à la faculté des sciences de Tunis pour ses conseils pertinents. Sa vue globale sur la parasitologie était un atout majeur pour la finalisation de ce travail. Je n’oublie pas la confiance qu’elle m’a témoignée et son soutien tout au long de la thèse, qu’elle en soit vivement remerciée.
Je remercie également :
– Melle Géraldine Loot, Maître de conférences à l’université Paul Sabatier d’avoir essayé de suivre mon travail de près. Sa bonne humeur et ses conseils scientifiques ont contribué à mener à bien ce travail.
– Mr Luc Legal, Maître de conférences à l’université Paul Sabatier pour son encadrement sur la partie génétique de mon travail. Je le remercie également pour la grande disponibilité dont il a fait preuve même à l’autre bout du monde. Vive MSN messenger !
– Mme Lilia Bahri, Maître assistant à la faculté des sciences de Tunis pour son aide, sa disponibilité et sa collaboration de qualité de l’autre côté de la méditerranée. Je la remercie aussi d’avoir généreusement pris en charge mes obligations administratives en Tunisie.
Je tiens ensuite à exprimer mes remerciements aux membres du jury, qui ont accepté d’évaluer mon travail de thèse :
– A M. André Théron, Directeur de l’UMR Biologie et Écologie tropicale et méditerranéenne, Université Paul Alduy de Perpignan, qui m’a fait l’honneur d’être rapporteur de ma thèse malgré ses très nombreuses occupations. Je le remercie également d’avoir toujours répondu à mes interrogations tout au long de ma thèse.
– A Mme Gaaïed Ben Ammar Amel, Professeur à la faculté des sciences de Tunis d’avoir également accepté la lourde charge d’être le rapporteur de ce travail de recherche et d’avoir suggéré des perspectives pertinentes à cette thèse.
– A M. Tomáš Sholz, Directeur de l’université de parasitologie et de phylogénie moléculaire en République Tchèque, qui me fait l’honneur de sa présence à mon jury et qui a eu l’amabilité d’accepter de présider ce jury. Je le remercie également pour son accueil chaleureux lors de mes séjours au sein de son équipe en R. Tchèque.
Je tiens aussi à exprimer ma profonde gratitude :
– A nos collaborateurs Tchèques Jan Štefka et Václav Hypša pour les nombreux échanges que nous avons eux et qui m’ont permit d’enrichir la qualité de mon travail. Je les remercie vivement pour leur accueil bienveillant au sein de leur équipe.
– A Mr Abdesselem Arab, Mme Sonia Thabet, Mr Abderrafik Meddour, Sabrina Frank, Tahani Dkhil, Ande Lymbery, P. Nie, A. Kangur, Tomáš Sholz qui nous ont généreusement communiqué les spécimens de ligules et sans qui ce travail n’aurait pas pris autant d’ampleur.
– Aux membres du laboratoire :
+ A Mme Galy pour sa disponibilité, sa gentillesse et sa bonne humeur de tous les jours.
+ A Rosy pour son aide notamment dans les manipulations de biologie moléculaire. Je la remercie également pour sa disponibilité et son amitié.
+ A Alexandre Riberon, Lounès Chiki et Hervé Gryta pour leurs nombreux conseils scientifiques et leur écoute.
+ A Matthias et Maxime pour le temps qu’ils m’ont consacré pour me familiariser avec certains logiciels, merci pour votre disponibilité et votre aide précieuse.
+ A Muriel pour son aide notamment pour la partie réseaux de neurones et pour sa disponibilité de tous les jours.
+ A Gaël pour l’aide qu’il m’a apportée pour travailler avec R, je le remercie également pour sa gentillesse et sa disponibilité.
+ A Leslie et Fabien pour leur précieuse aide à comprendre les ANOSIM.
+ A Loïc et Clément pour leur dépannage en informatique et pour la grande générosité qu’ils m’ont témoignée.
Je remercie chaleureusement :
– Claude Boutin, Maître de conférences (hors classe) honoraire qui a bien voulu relire ce manuscrit et me faire part de ses précieux conseils et corrections.
– Roya, Docteur en sciences économiques qui a accepté de lire ma thèse et de corriger mes fautes. Je la remercie aussi pour sa grande disponibilité et son soutien de tous les jours. – Salma, pour toutes les facilités qu’elle m’a accordées pour réaliser les réactions de
séquençage et pour son aide lors de la réalisation des manipulations de clonage. Je la remercie également pour sa disponibilité et son amitié.
Je n’oublie pas le commencement de toute cette aventure :
– A Sadok Bouzid, Professeur à la faculté des sciences de Tunis, pour m’avoir aiguillée dans mon parcours scolaire et m’avoir offert toutes les chances pour être ce que je suis aujourd’hui.
– A toute l’équipe de parasitologie de la faculté de pharmacie de Monastir en Tunisie où j’ai commencé mes premiers pas en parasitologie moléculaire.
cours de ma thèse.
Je n’oublie pas non plus d’exprimer ma profonde gratitude au ministère de l’enseignement supérieur de Tunisie ainsi qu’à l’ambassade de France en Tunisie pour avoir financé ma thèse.
Je remercie également le programme de mobilité internationale Egide de France pour avoir pris en charge notre collaboration avec l’institut de Parasitologie en République Tchèque et ce dans le cadre du projet Barrande.
Au tour des amis maintenant :
– A Candy Canella, merci d’avoir accepté avec beaucoup de générosité de me corriger mes quelques « mistakes » en Anglais. Merci surtout pour ton amitié et ton soutien. Je n’oublierai jamais les oranges parties de 16h00 !!
– A tous mes amis en Tunisie : Selma, Rim, Olfa, Imen, Zouhour, Maha, et à tous les autres pour leur sympathie et leur amitié
Quant à toi Elyes… un simple merci est loin d’être suffisant pour t’exprimer toute ma reconnaissance et toute ma gratitude. Je te remercie de m’avoir « parasitée » de ton sens du perfectionnement et de professionnalisme. Tu as adopté le sujet comme si c’était le tien et tu as su m’aiguiller et me montrer par tes précieux conseils le bon chemin. Tu as été mon meilleur encadrant ! Merci du fond du cœur de m’avoir accompagnée, encouragée et soutenue tout au long de ce chemin …Merci mon cher époux !
S
OMMAIRE
RESUMÉ... III LISTES DE FIGURES ET TABLEAUX... XI FIGURES...XI TABLEAUX...XII
INTRODUCTION GÉNÉRALE ... 13
I. PROBLÉMATIQUE...17
II. PLAN DE LA THÈSE...19
III. COLLECTE DES LIGULES...21
III.1. Collecte ...21
III.2. Procédure d’échantillonnage ...23
CHAPITRE I : ÉTAT DE CONNAISSANCE SUR LA LIGULE ... 27
I. INTRODUCTION... 29
II . SYSTÉMATIQUE, BIOÉCOLOGIE ET RELATION HÔTE PARASITE DE LA LIGULE... 30
II.1. Systématique...30
II.2. Bioécologie...32
II.3. Relation hôte parasite ...36
III. SPÉCIFICITÉ PARASITAIRE CHEZ LA LIGULE...40
III.1. Considérations générales ...40
III.2. Cas de la ligule...42
III.3. Les trois compartiments biologiques de la ligule ...44
IV. GÉNÉTIQUE DE LA LIGULE... 47
IV.1. Considérations générales...47
IV.2. Variation intraspécifique chez la ligule ...48
IV.3. Variation inter et intra-générique ...49
CHAPITRE II : ÉTUDE DE LA VARIABILITÉ INTRASPÉCIFIQUE DE LIGULA INTESTINALIS... 55
I. INTRODUCTION... 57
II. OBJECTIFS... 58
III. OUTILS D’ANALYSES... 58
III.1. Les marqueurs ISSR ...58
III.2. Cartes auto-organisatrices ...60
IV. RÉSUMÉ DES PRINCIPAUX RÉSULTATS...61
V. ARTICLE 1: BOUZID ET AL. IN PRESS “GENETIC DIVERSITY OF LIGULA INTESTINALIS (CESTODA: DIPHYLLOBOTHRIIDEA) BASED ON ANALYSIS OF INTER-SIMPLE SEQUENCE REPEAT (ISSR) MARKERS”... 63
CHAPITRE III : STRUCTURE GÉNÉTIQUE DE LIGULA SP... 79
I. INTRODUCTION... 81
II. OBJECTIFS... 83
III. OUTILS D’ANALYSE... 83
III.1. Les gènes ribosomaux nucléaires...84
III.2. Les gènes mitochondriaux ...86
IV. RÉSUMÉ DES PRINCIPAUX RÉSULTATS... 87
V. ARTICLE 2: BOUZID ET AL. IN PRESS “GEOGRAPHY AND HOST SPECIFICITY: TWO FORCES BEHIND THE GENETIC STRUCTURE OF THE FRESHWATER FISH PARASITE LIGULA INTESTINALIS (CESTODA: DIPHYLLOBOTHRIIDAE) “ ... 89
CHAPITRE IV : INTRODUCTION DES ESPÈCES HÔTES : QU’EN EST-IL DE LEURS PARASITES ? ... 97
I. INTRODUCTION... 97
II. OBJECTIFS... 98
III. RÉSUME DES PRINCIPAUX RÉSULTATS... 99
ARTICLE 3: BOUZID ET AL. EN PREPARATION “INTRODUCTION OF EUROPEAN CYPRINID FISH WITH THEIR ASSOCIATED PARASITE LIGULA INTESTINALIS IN TUNISIAN FRESHWATER: A THREAT TO AUTOCHTHON FISH POPULATION?” ... 100
LIGULES... 124
I.1. LES ISSR...124
I.2. L’espaceur intergénique 2 de l’ADNr (ITS2) ...125
I.3. Les gènes mitochondriaux : COI versus COB ...126
II. LIGULA INTESTINALIS : ENSEMBLE D’ESPÈCES CRYPTIQUES ?...127
III. QU’ELLE EST LA DÉFINITION D’ESPÈCE EN PARASITOLOGIE ? ... 129
IV. LES SÉQUENCES DES GÈNES : UNE PANACÉE POUR PALLIER LE MANQUE DE CARACTÈRES MORPHOLOGIQUES ? ... 129
V. PHYLOGÉOGRAPHIE VERSUS SPECIFICITE DE LIGULA SP. ... 130
VI. LE PROBLÈME DES RELATIONS PHYLOGÉNÉTIQUES AU SEIN DES DIPHYLLOBOTHRIIDAE...132
L
ISTES DE FIGURES ET TABLEAUX1F
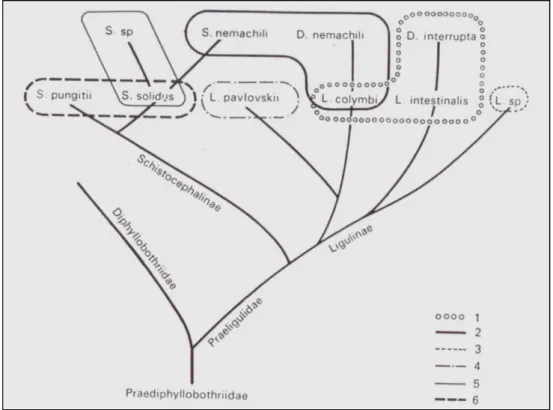
IGURESFigure 1: Pêche aux filets trémail à la retenue de barrage de Sidi Salem en Tunisie (Photographie W. Bouzid & N. Haddaoui) ...24 Figure 2: Spécimens de ligules prélevés chez des poissons infestés (Photographie W. Bouzid & C. Shinn)...25 Figure 3: Cycle biologique de Ligula intestinalis (Cestode, Diphyllobothriidae). Trois hôtes interviennent dans ce cycle : un oiseau ichtyophage comme hôte définitif, un copépode zooplanctonique comme premier hôte intermédiaire et un poisson planctonophage comme second hôte intermédiaire...34 Figure 4: Larves plérocercoïdes de Ligula intestinalis prélevées dans la cavité abdominale d’un poisson infesté (second hôte intermédiaire). Le poisson peut contenir plusieurs larves plérocercoïdes à la fois...39 Figure 5: Phylogénie des Diphyllobothriidae inférée à partir des ITS2 de l'ADNr montrant l'existence de plusieurs lignées au sein de l'espèce L. intestinalis et l'invalidité du genre Digramma et de l'espèce L. colymbi d'après Logan et al. (2004) ...49 Figure 6: Diagrammes de l'emplacement des complexes reproducteurs chez a) Ligula intestinalis et b)
Digramma interrupta...50
Figure 7: Relations phylogénétiques des Ligulidae de différentes familles de poissons. 1, Cyprinidae ; 2, Cobitidae ; 3, Catostomidae; 4, Gobidae; 5, Cottidae; 6, Gasterosteidae. D'après Dubinina (1980)...52 Figure 8: Phylogénie de spécimens de Ligula et de Digramma inférée des séquences ITS et 28S de l’ADNr selon Luo et al. (2003). ...53 Figure 9: Amplification d’une région inter-microsatellites utilisant une amorce ancrée en 3’ et 5’ pour un motif de répétition CA...59 Figure 10: Architecture d'un réseau de neurones multi-couches. xe constitue l'information introduite en entrée et W l’ensemble des poids de connexion entre la couche d’entrée et la couche de sortie...61 Figure 11: Spécificité parasitaire révélée par les données génétiques. L'identification morphologique regroupe les parasites sous le nom d’une même espèce (Parasite 1) inféodés à plusieurs espèces hôtes (Hôte 1, 2, 3). Les données génétiques révèlent l’existence de plusieurs lignées de parasites (Parasite 1a, 1b et 1c), chacune spécifique seulement à très peu ou une seule espèce hôte. Modifié de Poulin & Keeney (2008). ...82 Figure 12: Organisation d’unité de répétition de l’ADNr d'eucaryote. Les unités sont arrangées en tandem. Chaque unité comprend les gènes d’ARNr 18S, 5.8S et le 28S. Les espaceurs séparant ces gènes sont les ITS1 et ITS2 et les IGS (Intergenic Spacer) renfermant ...85
1 Figures et tableaux hors articles
T
ABLEAUXTableau 1 : Liste des ligules collectées ou fournies lors de notre étude...22 Tableau 2 : Nomenclature actuelle de l’espèce Ligula intestinalis ...32 Tableau 3 : Spécificité de la ligule pour ses hôtes intermédiaires et finaux selon Dubinina (1980) et
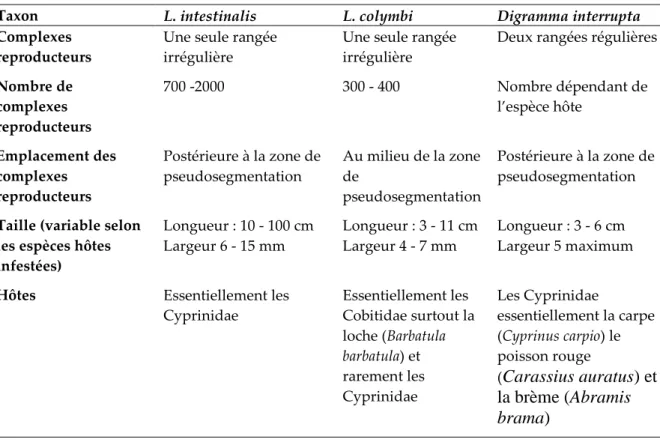
quelques exemples des principales espèces décrites ...46 Tableau 4: Les caractéristiques essentielles différenciant le genre Digramma de Ligula et l’espèce L.
I
NTRODUCTION
G
ÉNÉRALE
L’analyse de la structure génétique des parasites est essentielle pour la compréhension des paramètres intraspécifiques tels que les stratégies de reproduction, le taux de transmission entre les hôtes ainsi que la taille réelle de la population (Prugnolle et al. 2005a). En termes d’évolution, ces analyses offrent des possibilités considérables pour élucider des questions relatives à la spécificité, les événements de co-spéciation et l'évolution des systèmes hôtes-parasites (Criscione et al. 2005). Grâce à la disponibilité des outils combinant à la fois la phylogénie moléculaire et la génétique des populations, ces analyses sont devenues de plus en plus courantes.
Plusieurs études ont montré que la structure génétique et l'évolution des parasites au niveau intraspécifique varient considérablement entre les différents taxa (par exemple, Anderson 2001, McCoy et al. 2001, Johnson et al. 2002, Brant & Orti 2003, Wickström et al. 2003). Cette variation semble une conséquence logique liée à la grande variabilité entre les traits d’histoire de vie de ces organismes. A ce titre, il a été démontré que la diversité dans les modes de reproduction (e.g hermaphrodisme, parthénogenèse) et la capacité de dispersion des stades libres sont les principaux déterminants de la structure génétique des parasites (Johnson et al. 2002, Criscione et al. 2005).
A l’heure actuelle, la plupart des études ont porté sur des parasites présentant un cycle de vie direct (un seul hôte) (par exemple, Page et al. 1998, McCoy et al. 2001, Johnson et al. 2002, McCoy 2003). Or, il semblerait que la co-évolution hôte-parasite dans un système à plusieurs hôtes diffère de celle qui pourrait exister dans un système à un seul hôte (Prugnolle et al. 2005b). Chez les plathelminthes, les nématodes et les acanthocéphales, le parasitisme faisant intervenir un ou plusieurs hôtes intermédiaires (cycle de vie complexe) est très commun (Poulin 1998). Pour ces systèmes, la structure génétique est contrôlée par l’histoire des traits de vie à chaque stade du cycle du parasite et par la mobilité des espèces hôtes (Jarne & Théron 2003, Prugnolle et al. 2005b). A titre d’exemple, il a été démontré que la structuration de
populations d’espèces de trématodes circulant dans des hôtes d’eau douce (autogénique) est beaucoup plus forte que celle des populations circulant à la fois dans les hôtes d’eau douce et terrestre (allogénique) (Criscione & Blouin 2004).
Chez les plathelminthes, très peu d’études ont porté sur la structuration intraspécifique qu’elle soit morphologique ou génétique hormis quelques groupes d’importance médicale et/ou économique (Echinococcus, Taenia, Hymneolepis et Diphyllobothrium) (Mariaux 1996). De façon générale, la systématique chez les plathelminthes a été difficile à résoudre (Mariaux 1996). En effet, l’absence de fortes structures cuticulaires et d’importants supports squelettiques rend ces parasites remarquablement fragiles. En outre, leur statut de parasites entériques obligatoires au stade adulte complique leur récolte pour au moins deux raisons. La première est d’ordre technique car si l’on considère le cas des hôtes aviaires, la grande mobilité de ces organismes rend difficile leur capture et l’observation de leurs parasites intestinaux. La deuxième raison est liée au fait que plusieurs espèces de vertébrés, notamment les oiseaux sont maintenant protégées par des lois nationales ou des conventions internationales interdisant leur capture (Mariaux 1996).
Hormis ces problèmes basiques, d’autres aspects comme l’établissement de spectre d’hôtes, la répartition géographique, la limite d’espèces et la définition de niveaux supérieurs, demeurent encore obscurs pour beaucoup de groupes (Mariaux 1996). Ceci est dû en partie à la difficulté rencontrée pour l’obtention d’un large échantillonnage d’individus de parasites d’une espèce hôte ou d’une région géographique donnée. Ainsi plusieurs taxa ont été définis à partir d’un nombre réduit, voire d’un seul spécimen et en conséquence peu d’études ont documenté convenablement le degré de variabilité phénotypique des parasites (Bona 1983).
Chez les plathelminthes Diphyllobothriidae, certaines discordances entre la classification basée sur les caractères morphologiques et les données moléculaires ont été récemment relevées (Olson et al. 2002, Luo et al. 2003, Logan et al. 2004). Le manque de caractères morphologiques discriminants au sein de cette famille,
nécessite aujourd’hui de fournir plus de données moléculaires et d’œuvrer à l’obtention d’un plus large échantillonnage (Luo et al. 2003, Logan et al. 2004).
C’est dans ce contexte que s’inscrit notre travail de recherche dont le but est d’apporter des informations supplémentaires sur la taxonomie de certaines espèces de la famille des Diphyllobothriidae à savoir l’espèce Ligula intestinalis Linnaeus, 1758, Ligula colymbi Zeder, 1803 et Digramma interrupta Rudolphi, 1810). Le but sera également d’étudier en particulier, la structure génétique des populations de l’espèce L. intestinalis (Cestode, Diphyllobothriidea) à large échelle géographique et d’inférer les mécanismes sous-jacents (isolement géographique versus spécificité parasitaire).
I.
PROBLÉMATIQUE
L’endoparasite2 L. intestinalis offre une bonne opportunité pour l’étude des
processus évolutifs des parasites à cycle complexe et les parasites à large répartition géographique en un seul modèle. En effet, ce parasite présente une distribution holarctique et australasienne (Dubinina 1980, Weeks & Perlington 1986, Morgan 2003).et évolue dans un cycle de vie complexe faisant appel à plusieurs hôtes.
Pour compléter son cycle de vie, la ligule fait intervenir un copépode (premier hôte intermédiaire), un poisson planctonophage (second hôte intermédiaire) et un oiseau ichtyophage (hôte définitif). Chez le poisson, les effets pathogènes sont considérables (castration parasitaire, modification de comportement dans les populations de poissons, mortalité…).
La spécificité hôte-parasite décrite à ce stade du cycle de vie du parasite varie considérablement en fonction des populations de ligules étudiées. En effet, une population de ligules peut présenter une forte spécificité locale pour une espèce hôte donnée et être totalement absente ou faiblement représentée dans cette même espèce
hôte à une localité géographique différente (Dubinina 1980, Barus & Prokes 1994, Loot et al. 2002).
Outre ces différences de spécificité parasitaire, des différences pathologiques au niveau du second hôte intermédiaire ont également été rapportées. En effet, Arme (1997) démontre que l’infection par la ligule chez le gardon (Rutilus rutilus) entraîne des effets pathogènes telle qu’une inflammation tissulaire. Ces effets pathogènes n’ont jamais été observés chez le rotengle (Gobio gobio) en milieu naturel. Même si ces différences peuvent être dues à des réactions physiologiques différentes selon l’espèce hôte, l’hypothèse de l’existence de différentes lignées ou espèces de ligules à l’origine des différences pathologiques a été ainsi avancée (Arme 1997, Kennedy & Burrough 1981, McManus 1985). Récemment, l’examen des séquences génomiques de deux populations de ligules prélevées chez le goujon et le gardon a mis en évidence l’existence de différentes lignées/ espèces de ce parasite pouvant expliquer de telles différences pathologiques (Olson et al. 2002). Un peu plus tard, l’investigation des séquences nucléotidiques de populations de ligules appartenant à différentes origines géographiques et espèces hôtes montre l’existence d’entités génétiques différentes de ligules (Luo et al. 2003, Logan et al. 2004).
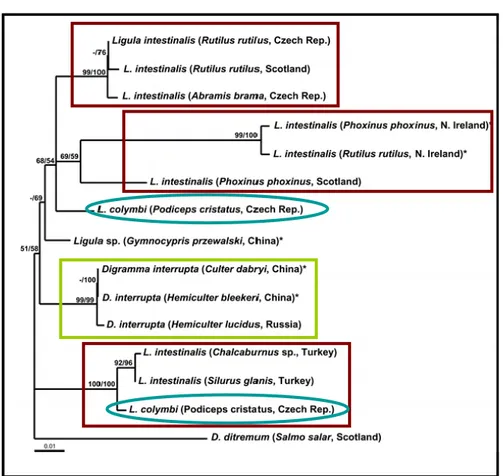
Par ailleurs, le statut taxonomique de L. intestinalis se complique encore plus si l’on considère les relations de parenté de cette espèce avec d’autres espèces de la famille des Diphyllobothriidae à savoir L. colymbi et D. interrupta. En effet, les données moléculaires issues de représentants de ces espèces suggèrent leur paraphylie avec l’espèce L. intestinalis (Luo et al. 2003, Logan et al. 2004). Si les différences morphologiques de L. intestinalis avec l’espèce L. colymbi ne sont pas entièrement discriminantes, celles avec D. interrupta sont pourtant bien résolues et définies (Dubinina 1980).
En tenant compte de toutes les considérations évoquées ci-dessus, l’existence d’un assemblage de lignées et/ou d’espèces cryptiques au sein de l’espèce L. intestinalis pourrait expliquer les différences de spécificité parasitaire, de pathologie
et la complexité phylogénétique de cette espèce. Si cette hypothèse a déjà été évoquée et en partie testée, n’en revanche aucune analyse phylogénétique à large échelle ni étude de la structuration génétique des populations au sein de cette espèce ne sont aujourd’hui disponibles. Il est à noter de surcroît qu’aucune analyse multigénique utilisant des marqueurs hypervariables n’est à ce jour disponible.
Notre travail de recherche s’organisera autour de trois grands axes :
(i) Étude de la variabilité génétique au sein des populations de l’espèce L. intestinalis inféodées à différentes espèces hôtes et couvrant une grande échelle géographique.
(ii) Évaluation des déterminants majeurs de la structuration génétique des populations de parasite analysées.
(iii) Révision du statut taxonomique des espèces D. interrupta et L. colymbi et de leur relation de parenté avec l’espèce L. intestinalis.
II.
PLAN DE LA THÈSE
Le présent travail repose sur un ensemble d’analyses génétiques menées sur des plérocercoides de ligules inféodés à différentes espèces hôtes et couvrant une large échelle géographique. Il comporte quatre grands chapitres3.
Dans le premier chapitre, nous ferons une synthèse bibliographique du modèle étudié L. intestinalis (cycle de vie, effet pathogènes, taxonomie, spécificité parasitaire...) en rappelant quelques notions fondamentales en parasitologie. Dans la mesure où ce travail traite essentiellement de la structuration génétique du parasite L. intestinalis, nous consacrerons une partie de synthèse bibliographique sur l’état des connaissances actuel de la génétique de la ligule et des relations phylogénétiques au
3 Les résultats obtenus au cours de cette thèse seront, pour l’essentiel, présentés sous forme d’articles
sein des Diphyllobothriidae en précisant les différents points non encore résolus à ce jour.
La nécessité de la mise au point de marqueurs moléculaires polymorphes au niveau intra-spécifique pour la ligule, nous a incité dans le deuxième chapitre au développement des marqueurs multigéniques. Ces marqueurs permettraient d’accéder à la variabilité génétique au sein des populations de ligules et donneraient une première idée de la manière dont est distribuée cette diversité au niveau intra-spécifique. Les résultats issus de cette étude seront présentés sous forme d’article (article 1).
Dans le troisième chapitre, nous étudierons la phylogénie de différentes populations de ligule à partir des séquences de gènes mitochondriaux et nucléaires ribosomaux. Le patron phylogénétique obtenu devrait apporter des éléments de réponses quant à la structuration génétique et aux facteurs écologiques déterminant de telle structuration. Nous étudierons et discuterons également les relations intergénérique et interspécifique de l’espèce L. intestinalis (article 2) avec L. colymbi et D. interrupta. L’étude de ces relations phylogénétiques devrait résoudre certaines ambiguïtés taxonomiques au sein des Diphyllobothriidae.
Le chapitre quatre, quant à lui, abordera un problème connu lors des introductions d’espèces allochtones pouvant transmettre leurs faunes de parasites au sein du nouvel écosystème. Nous prendrons comme modèle les retenues de barrages tunisiens qui ont été empoissonnées par des Cyprinidés, hôtes potentiels de la ligule. Nous étudierons l’impact de ces introductions sur la faune locale et comparons les empreintes génétiques des différents spécimens de ligules nord-africains (article 3).
Nous terminerons notre travail de recherche par une conclusion générale dans laquelle nous discuterons des apports de notre étude et exposerons diverses perspectives ainsi que des voies de recherches futures.
III.
C
OLLECTE DES LIGULESIII.1.Collecte
Compte tenu du temps de séjour relativement important du parasite pendant la phase plérocercoide du cycle (2 à 3 ans) comparé à la phase adulte (2 à 5 jours), il était plus raisonnable de réaliser la collecte à cette phase du cycle. La facilité de capture des poissons par rapport aux oiseaux (espèces protégées et difficulté de capture) était également un facteur déterminant dans notre choix d’échantillonnage.
Une étude bibliographique préalable, nous a permis de repérer des localités où la ligule a été décrite et de prendre contact avec des personnes ayant collecté quelques individus de ce parasite. La liste des pays, localités, espèces hôtes et des personnes qui nous ont fourni certains spécimens de ligules figurent dans le Tableau 1.
Pays Localités Espèce hôte Source Année de collecte Algérie Oued Hamiz Babus sp. (Cyprinidae) A. Arab 2006 Allemagne Lac Müggelsee Rutilus rutilus (Cyprinidae) S. Frank 2005 Australie Rivière Goodga Galaxias maculatus (Galaxiidae) A. Lymbery 2006 Galaxias truttaceus (Galaxiidae) A. Lymbery 2006 Canada Lac Dumbo Semotilus atromaculatus
(Cyprinidae)
Cette étude 2005 Lac Dalpec Couesius plumbeus (Cyprinidae) Cette étude 2005 Chine Reserve Zhanghe Neosalanx taihuensis (Salangidae) Cette étude 2004 Estonie Peipsi Abramis brama (Cyprinidae) Cette étude 2004 Éthiopie Lac Tana Barbus humilis (Cyprinidae) T. Sholz 2007 Barbus tsanensis (Cyprinidae) T. Sholz 2007 Barbus intermedius (Cyprinidae) T. Sholz 2007 Barbus brevicephalus (Cyprinidae) T. Sholz 2007 Écosse Rivière Gryfe Phoxinus phoxinus (Cyprinidae) T. Sholz 2005
Airthrey Loch, stirling
Rutilus rutilus T. Sholz 2005
France Pareloup Rutilus rutilus Cette étude 2004
Alburnus alburnus (Cyprinidae) Cette étude 2004
Lavernose Rutilus rutilus Cette étude 2005
Blicca bjoerkna (Cyprinidae) G. Loot 1999
Muret Rutilus rutilus G. Loot 1999
Créteil Rutilus rutilus Cette étude 2006
Irlande du Nord
Lough Neagh Rutilus rutilus P. Olson 2002
Gobio gobio (Cyprinidae) P. Olson 2002 Mexique Lac Tonatzahua, Girardinichthys multiradiatus
(Goodeidae)
T. Sholz 2005 Russie Rivière Rybinsk Abramis brama (Cyprinidae) T. Sholz 2005 R. Tchèque Lac Hluboka Phalacrocorax carbo
(Phalacrocoracidae)
T. Sholz 2005
Lac Lipno Rutilus rutilus J. Štefka 2005
Lac Mlyny Abramis brama J. Štefka 2005
Lac Zelivka Alburnus alburnus J. Štefka 2006
Rutilus rutilus J. Štefka 2006
Tunisie Retenue du barrage de Sidi Salem
Rutilus rubilio Cette étude 2004
Scardinus erythrophthalmus Cette étude 2004 Oued Nebhana Rutilus rubilio Cette étude 2006 Scardinus erythrophthalmus Cette étude 2006 Tableau 1 : Liste des ligules collectées ou fournies lors de notre étude
III.2.Procédure d’échantillonnage
La méthode de prélèvement des poissons a été différente selon le site d’échantillonnage. Au Sud Ouest de la France, nous avons utilisé des filets maillants en nylon monofilament ayant une taille de mailles variant entre 10 et 25 mm. Les filets ont été posés perpendiculairement à la berge et la durée de pose était généralement de 20 heures pour les pêches réalisées en hiver et d’environ 15 min en été. Les poissons ont été récupérés dans de la glace et ramenés pour être examinés au laboratoire. (Pour plus de détails sur la méthode de pêche, voir Loot 2001a).
Plus au Nord de la France, dans le lac de Créteil, l’échantillonnage a été réalisé avec la même procédure décrite ci-dessus. La pêche a été organisée avec la collaboration de Ph. Boët au CEMAGREF de Paris à l’unité de recherche Hydrosystèmes et bioprocédés.
En Tunisie la pêche a été réalisée par l’aide de pêcheurs professionnels au moyen de filets trémail (Figure 1). La pêche a été organisée sous la tutelle de l’unité de Recherche, Biologie, Écologie et Parasitologie des organismes aquatiques, Faculté des Sciences de Tunis, Tunisie sous la direction du Professeur O.K. Ben Hassine et avec la collaboration de L. Bahri et de N. Haddaoui.
Au Canada, en Chine et en Estonie, la pêche a été réalisée par G. Loot (codirecteur de thèse). Pour le Canada, les poissons ont été pêchés au moyen de bourolle4 avec la collaboration de S. Blanchet. La dissection des poissons a été réalisée
à l’Université Laval - Québec-Océan / CIRSA, Canada.
4 La bourolle : Engin de pêche fabriqué de fil à mailler ou de treillis métallique monté sur des cerceaux
d’au plus 60 cm de longueur et 25 cm de largeur, dont la plus petite ouverture en forme d’entonnoir ne dépasse pas 2,5 cm de diamètre.
Figure 1: Pêche aux filets trémail à la retenue de barrage de Sidi Salem en Tunisie (Photographie W. Bouzid & N. Haddaoui)
En Chine et en Estonie, la pêche a été réalisée avec des pêcheurs professionnels à l’aide de filets trémail. La dissection et le prélèvement des parasites ont été respectivement réalisés dans les institutions suivantes :
• State Key Laboratory of Freshwater Ecology and Biotechnology and Laboratory of Fish Diseases, Institute of Hydrobiology, Chinese Academy of Sciences Wuhan, Hubei, China avec la collaboration du Professeur P. Nie.
• Institute of Zoology and Botany of the Estonian Academy of Sciences, Vortsjärv Limnological Station, Tartumaa, Estonia avec l’aide d’A. Kangur et K. Kangur.
Quelque soit la méthode de pêche et le site d’échantillonnage, les poissons ont été acheminés aux différents laboratoires et disséqués pour l’examen de leur cavité générale où devront se loger les ligules. Si elles sont présentes, les ligules ont été prélevées (Figure 2) et conservées à – 20°C ou dans l’alcool à 70° pour assurer leur acheminement jusqu’en France où les analyses génétiques ont été réalisées.
Figure 2: Spécimens de ligules prélevés chez des poissons infestés (Photographie W. Bouzid & C. Shinn).
Les ligules hébergées dans la cavité générale d’un même poisson ont été séparées individuellement dans des tubes différents. Chaque tube est étiqueté en indiquant le numéro du parasite, son origine géographique et l’espèce hôte où il a été prélevé.
C
HAPITRE I
:
ÉTAT
DE
CONNAISSANCE
SUR
I.
I
NTRODUCTIONAu sens étymologique, le mot parasite5 signifie « qui mange à côté, à la même
table, à la même assiette ... ». L’association à une espèce hôte est obligatoire pour le parasite qui seul en tire avantage pendant l’intégralité ou une partie au moins de son cycle vital. Les parasites hétéroxènes (= polyxènes) sont des parasites dont le cycle vital exige le passage par deux ou trois, voire quatre hôtes d’espèces différentes. Pour ce type de parasite, on distingue traditionnellement deux types d’hôtes : (i) intermédiaires où le parasite vit à l’état larvaire et peut se multiplier par voie asexuée et (ii) définitifs hébergeant les formes adultes du parasite se reproduisant par voie sexuée. Pour assurer sa pérennité, le parasite doit trouver les conditions propices à son développement et contourner les barrières défensives élaborées par l’hôte, en réponse à toute agression étrangère.
Le devenir de l’association hôte parasite dépend de la stratégie qu’adoptent ces deux partenaires. Pour les interactions durables entre les deux associés, il s’établit un équilibre dynamique résultant d’une co-évolution prolongée. La susceptibilité des individus à l’infestation parasitaire dépend fortement des facteurs externes comme la coïncidence spatiale et temporelle, la superposition des aires de répartition, les modes et les milieux de vie etc. définis par Combes (1995) comme filtres de rencontre incluant les facteurs écologiques et filtres de compatibilité incluant les facteurs intrinsèques d’ordre physiologique et /ou génétique.
En matière de génétique évolutive, il a été admis que la virulence d’un parasite par rapport à son hôte est un caractère adaptatif s’accroissant ou diminuant en réponse aux pressions exercées par celui-ci. Si les filtres de rencontre et de compatibilité sont plus ou moins fermés, l’hôte exerce une pression sur le parasite et
la virulence augmente avec le temps. En effet, pour celui-ci des gènes vont généralement être sélectionnés permettant d’améliorer sa performance. En revanche, si ces filtres sont bien ouverts, les espèces hôtes vont développer des mécanismes tendant à éviter les rencontres ou renforcer les défenses immunitaires (Combes 1995). Ainsi, les parasites agissent comme des acteurs invisibles des interactions durables, issues d’une longue histoire évolutive au cours de laquelle ont été sélectionnés des « gènes pour rencontrer » et des « gènes pour survivre ». De l’autre côté de l’association, des « gènes pour éviter » et des « gènes pour tuer » ont été sélectionnés par leurs hôtes. Des compromis évolutifs se sont donc mis en place après une longue « course aux armements » (Combes 1995).
L’analyse de la structuration spatiale et temporelle des populations de parasites (dynamique, adaptation et évolution) est l’objectif principal de l’écologie parasitaire. Rappelons ici que la notion de population désigne des individus appartenant à la même espèce et entre lesquels se font des échanges génétiques réguliers. Quand ces échanges ou flux de gènes sont interrompus, des divergences génétiques peuvent s’établir, généralement à la suite d’isolement géographique.
II.
S
YSTÉMATIQUE,
BIOÉCOLOGIE ET RELATION HÔTE PARASITE DE LALIGULE
II.1.Systématique
Le nom du genre Ligula est apparu en 1788. Les scientifiques se sont basés tantôt sur des caractères morphologiques et tantôt sur le spectre d’hôtes du parasite. Certains auteurs ont décrit quasiment une trentaine d’espèces de ligules qu’ils différenciaient en se basant sur les caractères morphologiques donnant naissance aux appellations Ligula uniserialis Rudolphi 1810, L. interrupta, L. sparsa, L. nodosa, L. 5 Un parasite est un organisme qui vit aux dépens d’un autre être vivant, l’hôte, véritable milieu
biologique, donc habitat protégé, nurserie ou couveuse, moyen de transport et source d’énergie (Barbault 1992).
contortrix, L. Cingulum Pallas 1781, L. accuminata, L. Digramma ou sur les espèces hôtes que recrute la ligule : Ligula avium Bloch 1758, L. mergorum, L. soricis moshati, L. colymbi cristati, L. colymbi immeris. Certains auteurs ont attribué à chaque espèce de poisson une espèce de ligule caractéristique correspondante : Ligula piscium, L. salvenili, L. salmonis wartmanni, L. carpionis, L. tincae, L. gobionis, L. alburni, L. leucisci.
Anciennement les sous-familles des Ligulinae et des Schistocephalinae étaient groupées au sein de la famille des Praeligulidae (voir Figure 129 dans Dubinina 1980). La famille des Diphyllobothriidae formait un embranchement séparé. La sous-famille des Ligulinae renfermait trois genres distincts : Ligula Bloch, 1782, Digramma Cholodkovsky, 1914 et Schistocephalus Creplin, 1829. Une classification postérieure a élevé les sous-familles des Ligulinae et des Schistocephalinae en rang de familles au même titre que la famille des Diphyllobothriidae (Dubinina 1980). La validité des Ligulidae comme famille distincte des Diphyllobothriidae a été souvent remise en question (Joyeux & Baer 1936, Schmidt 1986, Bray et al 1994, Bray et al 1999). Récemment, les travaux de Logan et al. (2004), basés sur le polymorphisme des ITS2 (Internal Transcribed Spacer) d'ADN ribosomal, ont renforcé l’hypothèse selon laquelle la famille des Ligulidae sensu Claus, 1868 (c’est à dire incluant les genres Ligula, Digramma et Schistocephalus) ne doit plus être considérée comme une famille valide, mais doit plutôt être incluse dans celle des Diphyllobotriidae. Récemment, les études de Kuchta et al. (2007) suppriment l’ordre des Pseudophyllidea et proposent deux nouveaux ordres, à savoir les Bothricephalidea et les Diphyllobothriidea où est classée la ligule.
L’évolution historique des études sur la ligule fût certes lente mais continue d’autant plus que la ligule offre un excellent matériel pour les recherches en helminthologie compte tenu de la fréquence de la parasitose et du grand nombre de parasites. La position taxonomique actuelle de l’espèce L. intestinalis est présentée dans le Tableau 2.
Niveau de classification Nomenclature
Embranchement Plathelminthes
Classe Cestode, Rudolphi 1808
Sous-classe Eucestode, Southwell 1930
Ordre Diphyllobothriidea, Kuchta et al. 2007
Famille Diphyllobothriidae, Lühe 1910
Sous-famille Ligulinae, Montcelli & Créty 1891
Genre Ligula, Bloch 1788
Espèce Intestinalis, Linneus 1758
Tableau 2 : Nomenclature actuelle de l’espèce Ligula intestinalis
II.2.Bioécologie
II.2.1 Cycle de vie
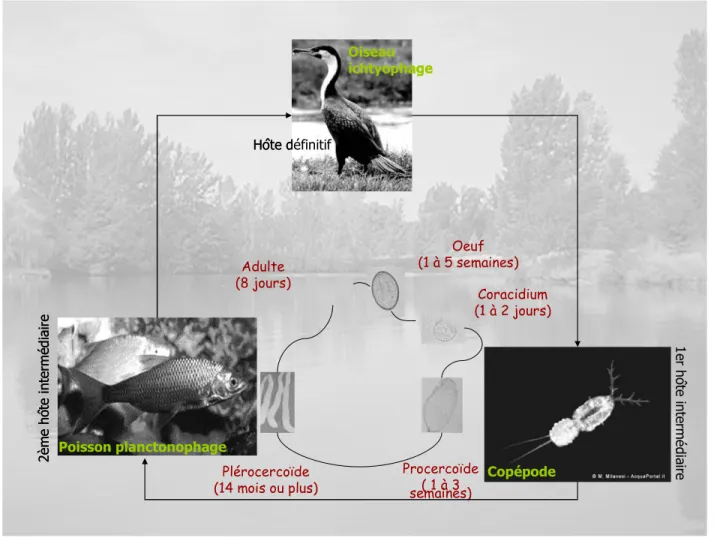
« Je peux dire dès maintenant que la Ligula effectue une triple migration. Dans le premier hôte intermédiaire se développe un procercoïde semblable à ceux des Bothriocéphales segmentés » c’est ainsi que Rosen (1918) a défini le cycle de vie de la ligule. Ce cycle s’inscrit donc dans le cadre d’une transmission à trois hôtes dont deux intermédiaires et un définitif et est donc appelé cycle hétéroxène. Dans le milieu aquatique, l’œuf éclot et se transforme en une larve ciliée libre et mobile : le coracidium. Celle-ci est généralement ingérée par le premier hôte intermédiaire, un copépode (crustacé zooplanctonique). La coracidie se transforme chez ce dernier et donne naissance à la larve procercoïde. Le copépode infesté peut être capturé par un poisson zooplanctonophage : deuxième hôte intermédiaire où la larve procercoïde se transforme en plérocercoide. Cette dernière se loge dans la cavité abdominale du poisson et y séjourne durant une longue période (plus de deux ans). Enfin, ce poisson parasité peut être ingéré par un oiseau ichtyophage : hôte définitif où la larve plérocercoide acquiert sa forme adulte. Celle-ci arrive à maturité et produit des œufs qui seront relâchés dans l’eau via les fèces de l’oiseau terminant ainsi le cycle et amorçant le cycle suivant. Le temps de séjour du parasite chez l’oiseau aquatique est
très court (2 à 5 jours) et le passage de la forme plérocercoide à la ligule mature est également très bref. Le cycle de vie de la ligule est représenté dans la Figure 3.
Oiseau ichtyophage Hôte définitif Oiseau ichtyophage Hôte définitif Copépode Poisson planctonophage 2 è m e h ô te i n te rm é d iai re Poisson planctonophage 2 è m e h ô te i n te rm é d iai re Procercoïde ( 1 à 3 semaines) Adulte (8 jours) Plérocercoïde (14 mois ou plus) Coracidium (1 à 2 jours) Oeuf (1 à 5 semaines) 1 e r h ô te in te rm é d ia ir e
Figure 3 : Cycle biologique de Ligula intestinalis (Cestode, Diphyllobothriidae). Trois hôtes interviennent dans ce cycle : un oiseau ichtyophage comme hôte définitif, un copépode zooplanctonique comme premier hôte intermédiaire et un poisson planctonophage comme second hôte intermédiaire
II.2.2 Mode de reproduction
Les parasites à stratégies r comme la ligule ont un renouvellement rapide et une mortalité importante aux stades jeunes. Ils ont pu coloniser leurs hôtes grâce au grand nombre de propagules produits. Pour cela, ils ont le plus souvent développé un appareil reproducteur envahissant et performant et ont affecté une part considérable de leurs ressources énergétiques à la reproduction.
Un grand nombre de parasites hermaphrodites (Cestodes, Trématodes, Monogènes) se reproduisent soit par autofécondation soit par fécondation croisée (Williams & McVicar 1968, Nollen 1983). Contrairement aux Trématodes chez lesquels la multiplication asexuée à l'état larvaire est obligatoire, les Cestodes n'utilisent ce mode de multiplication qu'occasionnellement. Chez ces animaux, l'autofertilisation est souvent considérée comme possible. Les œufs fertilisés sont stockés dans les segments postérieurs au scolex (proglottis), et, arrivés à maturité, ces segments sont relâchés avec les excréments de l'hôte définitif. Il y a une croissance continue de segments au niveau du scolex qui remplacent de façon continuelle ceux qui sont éliminés par fragmentation du strobile.
Bien que l’autofécondation ait un coût réduit pour le parasite, les travaux de Luescher & Milinski (2003) ont montré que la fécondation croisée constitue une stratégie de choix pour la plupart des parasites. Les œufs issus d’une fécondation croisée semblent avoir à la fois un taux d’éclosion élevé et des avantages compétitifs aussi bien dans le premier que dans le deuxième hôte intermédiaire (Christen et al. 2002, Christen & Milinski 2003).
II.2.3 Répartition géographique
La ligulose présente une distribution holarctique (Orr 1967) ; elle affecte le Canada, les Etats-Unis, le Mexique, le Royaume uni, l’Europe, la Turquie, la Russie, la Chine, l’Afrique du Nord. Même si on a souvent attribué à la ligule une distribution limitée à l’hémisphère nord, elle se rencontre également en Australasie,
(par exemple en Australie, en Inde et au Sri Lanka), et en Afrique (par exemple en Afrique du Sud, en Uganda, au Zaïre et au Zimbabwe). La ligule a aussi été signalée dans certains pays où il y a eu un transfert de stocks de poissons infestés et/ ou avènement des œufs de ligule par le biais des oiseaux migrateurs facilitant ainsi leur dispersion (Kennedy & Burrough 1981), comme l’exemple des introductions en Australie (Morgan 2003) et en Nouvelle Zélande (Weeks & Perlington 1986).
De manière générale, l’affection sévit là où se rencontrent les Cyprinidés. La distribution de la ligule et, de manière générale, de la sous-famille des Ligulinae est sensiblement conditionnée par la distribution du second hôte intermédiaire, les poissons d’eau douce et de l’hôte définitif, les oiseaux piscivores.
II.3.Relation hôte parasite
II.3.1 Effets pathogènes
Les effets pathogènes exercés par le parasite sur son hôte dépendent de plusieurs facteurs liés (i) à l’hôte (âge, sexe, régime alimentaire, facteurs génétiques et/ immunitaires) et (ii) au parasite (taille, nombre, virulence, mobilité, migration, mode de nutrition).
Les parasites à cycle complexe sont confrontés au problème de leur transmission de l’hôte amont à l’hôte aval. Des modifications comportementales induites par ces parasites sont fréquemment observées chez les hôtes intermédiaires et ont pour conséquence l’augmentation de la transmission trophique du parasite à son hôte définitif.
Dans le cas de la ligule, les travaux de recherche n’ont quasiment concerné que les effets pathogènes provoqués chez le second hôte intermédiaire. Aucune manifestation clinique n’a été observée chez les oiseaux et les données concernant les copépodes sont encore plus rares. Cependant, Dubinina (1980) a démontré
expérimentalement que si le procercoïde migre vers le segment céphalique et s’y développe, il entraîne la mort du copépode.
Chez le poisson, la ligule loge dans sa cavité abdominale (Figure 4). L’augmentation de la taille du plérocercoide et la réinfestation par d’autres plérocercoides provoquent une dilatation de l’abdomen du poisson infesté. Cette dilatation apparaît en région ventrale, en avant de l’orifice anal et forme une saillie que les pêcheurs appellent «Bouton» (Moisan 1956). Le poisson infesté est considérablement alourdi et sa nage est moins vigoureuse devenant ainsi plus facilement capturable par les oiseaux. Moisan (1956) a remarqué aussi que les gardons parasités présentent des besoins alimentaires supérieurs à ceux des gardons sains. Par ailleurs, il semble que la ligulose peut provoquer une véritable castration parasitaire. En effet, la ligule écrase les organes sexuels de son hôte et les atrophie plus ou moins intensément. De plus, des changements hypophysaires inhibent le développement des gonades (Arme & Owen 1968). Il s'avère que le parasite en inhibant la reproduction de son hôte détourne l’énergie normalement attribuée à la reproduction de celui ci. Il se trouve également que cette inhibition des fonctions reproductrices créerait un environnement hormonal plus favorable au parasite (Barber et al. 2000). En général, Les poissons parasités sont, quelque soit leur sexe, incapables de se reproduire (Arme 1975).
L'inhibition de la fonction reproductrice de l’hôte est une stratégie fréquente, observée dans le cas de diverses parasitoses. A titre d’exemple, le parasite Trichobilharzia ocellata provoque un gigantisme et un arrêt de la production des œufs chez son hôte Lymnea stagnalis (Joose & Van Elk 1986). Crews & Yoshino (1989) ont observé que le parasite Schistosoma mansoni supprimait également la reproduction et le développement des gonades chez Biomphalaria glabrata.
Récemment, les travaux de Carter et al. (2005) ont montré que chez les gardons infestés par L. intestinalis, le taux des ARN messagers de la gonadotrophine LH (Lutinizing Hormone) est réduit de 50% par comparaison aux gardons non infestés.
Ces résultats suggèrent que le parasite secrète des produits qui interagissent avec l’axe gonado-hypophysaire du poisson, inhibant ainsi le développement des gonades.
Les organes viscéraux (foie, estomac, intestin) peuvent aussi subir une atrophie voire même une dégénérescence. Le foie, qui est le plus particulièrement touché, diminue de volume par diminution d’irrigation sanguine entraînant une baisse considérable de la fonction digestive mais également l’apparition de foyers de nécrose (Kozareva 1961).
Comme tout cestode, la ligule n’a pas de tube digestif, elle se nourrit par diffusion transtégumentaire des nutriments solubles présents dans la cavité abdominale du poisson. En prélevant sa nourriture, elle provoque aussi des hémorragies. Le poisson parasité est donc très anémié et cette anémie est aussi due aux compressions des vaisseaux sanguins allant jusqu’à une déchirure entraînant de graves hémorragies (Moisan 1956).
L’importante infection causée par la ligulose a été associée à un déclin considérable dans les populations de poissons infectés (Wilson 1971). Arme (1968) a noté que beaucoup de poissons ont souffert d’une co-infection fongique due au champignon Saprolegnia parasitica. De manière générale, le poisson parasité est voué à la mort. Cette mort peut également être indirecte c’est à dire que les effets pathogènes engendrés provoquent un affaiblissement du poisson ou un changement de son comportement le rendant plus vulnérable aux prédateurs (poissons carnassiers, oiseaux ichtyophages). Expérimentalement, Loot et al. (2002) ont montré que les gardons infestés par L. intestinalis ont une tendance à se déplacer en permanence, ce qui pourrait induire des stimuli visuels attracteurs pour les prédateurs. La distension abdominale des poissons infestés entraîne une perte de l’hydrodynamisme du poisson et de son aptitude au camouflage (Moisan 1956) ; il en résulte une diminution de sa capacité de nage et de la vivacité des individus parasités, notamment face à une attaque par les prédateurs.
Figure 4: Larves plérocercoides de Ligula intestinalis prélevées dans la cavité abdominale d’un poisson infesté (second hôte intermédiaire). Le poisson peut contenir plusieurs larves plérocercoides à la fois.
II.3.2 Réponse immunitaire chez l’hôte
Lors d’une infestation par la ligule, Hoole & Arme (1983) ont observé une forte accumulation de tissu connectif autour des plérocercoides. La majorité des cellules produites par l’hôte et déposées autour du parasite sont des fibroblastes (Arme & Owen 1970, Hoole & Arme 1982). En outre, deux types de leucocytes ont été décrits : des macrophages et des leucocytes polymorphonucléaires avec en plus deux types de cellules A et B commençant à être présentes chez les poissons jeunes (Taylor & Hoole 1989).
Chez le gardon Rutilus rutilus, une production d’anticorps spécifique à la ligule a été démontrée (Williams & Hoole 1992). Cependant, leur rôle dans la protection contre le parasite n’est pas encore bien établi. D’après les études de Williams & Hoole (1995), ces anticorps adhèrent aux bords des microtrichies du parasite mais la nature de l’antigène reconnu est encore une fois indéterminée.
L’hôte est incapable de tuer le parasite et des études ont montré que ceci est dû aux téguments et aux microtriches6 couvrant la surface entière du parasite et
6 Microtriche : Petite projection portant des microvillosités, située à la surface du tégument des
parasites. Les microtriches accroissent la surface disponible pour les échanges gazeux et peuvent s'interdigiter avec les microvillosités de l'intestin de l'organisme hôte.
empêchant les molécules immunitaires de l’hôte d’atteindre la surface du parasite (Hoole & Arme 1988, Conradt & Schmidt 1992).
Les effets pathogènes et la réponse immunitaire peuvent être différents selon l’espèce hôte considérée. En effet, Bean & Winfield (1989) notent que, chez le goujon, la réduction de la taille des gonades est moins importante que chez le gardon et les plérocercoides sont recrutés non seulement au cours de la première ou des deux premières années, mais aussi tout au long de la vie du goujon. L’infestation par les plérocercoides de L. intestinalis devient de plus en plus rare chez les gardons de plus de 3 ans (Harris & Wheeler 1974, Sweeting 1977, Bean & Winfield 1992, Loot et al. 2001b). Arme & Owen (1968) notent que, chez le goujon, aucune distension de la cavité abdominale et aucune réponse tissulaire ne sont observées alors qu’elles sont observées chez le gardon. Un transfert direct de plérocercoïdes de gardon a été réalisé chez différents individus de goujons. Ces plérocercoïdes de gardons ont provoqué des réponses cellulaires chez les goujons (Hoole & Arme 1983). En 1975, Arme suggère que les différences de pathologie observées chez le goujon et chez d’autres espèces (gardon, vairon, brème...) sont dues soit à des variations physiologiques chez l’espèce hôte soit à l’existence de plusieurs lignées de parasites.
III.
S
PÉCIFICITÉ PARASITAIRE CHEZ LA LIGULEIII.1.Considérations générales
« Les organismes vivants sont ces systèmes matériels qui, en face d’un avenir imprévisible, sont construits pour construire de l’imprévu ». Autour d’une table ronde de la société zoologique de France à Paris, Bartoli (2004) a repris cette citation de Danchin (2000) expliquant que les parasites, comme tous les êtres vivants, ont une aptitude particulière leur permettant de répondre à l’imprévu. L’évolution des parasites répond sans cesse à un imprévu lié aux changements des faunes et des milieux et surtout à l’évolution de leurs hôtes. En réponse à ces différents
changements, ils peuvent s’adapter ou au contraire disparaître. Toutefois, la majorité des parasites ont fait preuve d’une adaptation face à l’imprévu. Selon Bartoli (2004), chaque fois que les conditions changent au cours du temps, les parasites «bricolent» à partir des «matériaux taxinomiques» disponibles à ce moment là. Ainsi, au cours de leur vie, ils peuvent changer d’espèce hôte ou bien ajouter d’autres espèces à leur panoplie.
Le terme de spécificité dans le sens commun est défini comme étant le nombre d’espèces hôtes décrites pour chaque parasite ; spécialistes7 versus généralistes.8. Ces
espèces sont généralement estimées par un état des lieux des espèces décrites dans la littérature (Poulin & Morand 2004). Le degré de spécialisation est ultimement déterminé par l’histoire évolutive et biogéographique du parasite et de ses hôtes potentiels (Poulin 2007). Le destin des parasites spécialistes est étroitement lié à celui de leur hôte, contrairement aux parasites généralistes qui peuvent persister après l’extinction de leur hôte et ce en exploitant alternativement d’autres espèces (Poulin & Keeney 2008).
En pratique, l‘utilisation de la spécificité pour établir la systématique des parasites a beaucoup souffert du fait que la spécificité a été décidée a priori et puis utilisée pour définir des taxa (Mariaux 1996). Selon Combes (1995), la spécificité ne doit pas être simplement liée au nombre d’espèces hôtes exploitées mais aussi à la manière dont celles-ci sont liées les unes par rapport aux autres (distance phylogénétique) Le degré de similarité écologique entre des espèces hôtes vivant en sympatrie doit également être considéré pour définir le degré de spécificité d’un parasite (Poulin & Keeney 2008).
7 Spécialistes : se dit des parasites exploitant une seule espèce hôte 8 Généralistes : se dit des parasites exploitant de multiples espèces hôtes
III.2.Cas de la ligule
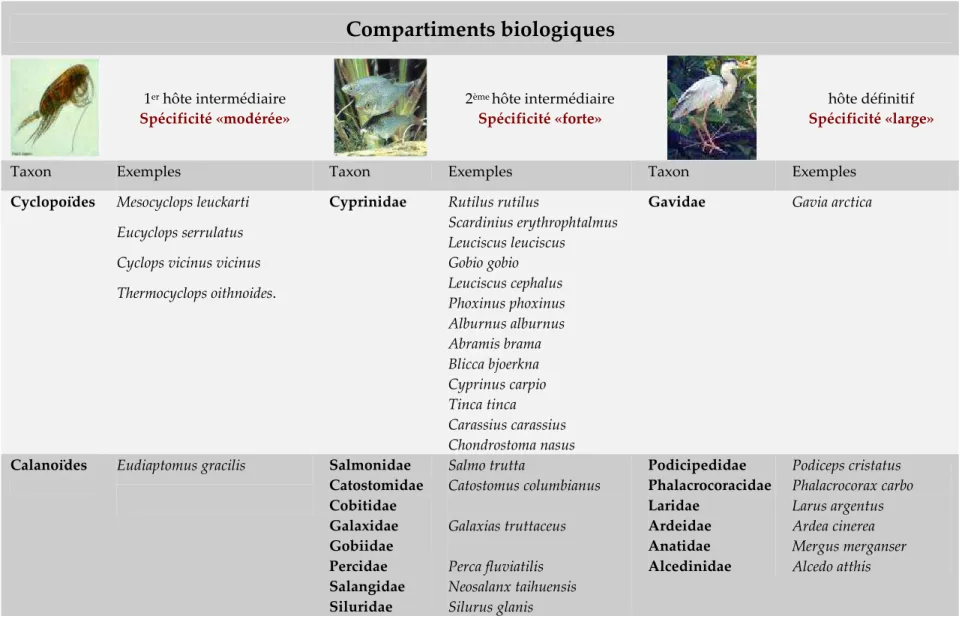
Pour l’espèce L. intestinalis, la spécificité a été définie comme étant «modérée» à l’état procercoide (chez le 1er hôte intermédiaire), «forte» au stade plérocercoide
(chez le second hôte intermédiaire) et «faible» pour le stade adulte (chez l’hôte définitif) (Dubinina 1980, Guillou 1982).
Lors du développement du parasite, le stade plérocercoide représente la phase la plus importante. En effet, la majorité des caractères morphophysiologiques est établie à cette phase du cycle (Dubinina 1980) définissant ainsi des conditions strictes de l’habitat e.d. second hôte intermédiaire. A cet hôte doivent correspondre certaines conditions physiologiques qui ne peuvent être partagées que par des groupes de poissons phylogénétiquement très proches. En conséquence, les Ligulidae sensu Claus (1868), et particulièrement la ligule sont des parasites à spécificité étroite impliquant des familles particulières de poissons. En revanche, lors de la phase adulte où le changement majeur réside dans la formation des œufs, les parasites présentent une large spécificité vis à vis des oiseaux piscivores. Il a été démontré expérimentalement que les larves plérocercoïdes pouvaient arriver à maturité chez presque tous les oiseaux incluant les granivores mais aussi chez les Mammifères (Joyeux & Baer 1936, Dubinina 1953, 1980) et même dans la cavité abdominale du second hôte intermédiaire (poisson) à des températures d’eau de 36 à 37°C (Dubinina 1980).
La complexité du développement au cours du stade plérocercoide est apparemment due au long séjour de cette phase larvaire dans la cavité abdominale du poisson. Ce long séjour semble aussi être dû aux difficultés surgissant au niveau des liens trophiques entre le deuxième hôte intermédiaire vivant constamment dans certains milieux aquatiques et l’hôte définitif (oiseaux piscivores migrateurs) faisant des migrations annuelles. Le séjour aviaire dans ces milieux est souvent occasionnel et ne concerne qu’une courte période. La prolongation de la phase de développement
et sa complexité au stade plérocercoide serait donc une forme d’adaptation qui favorise la survie de ces parasites en augmentant la probabilité qu’un grand nombre de plérocercoïdes atteigne l’hôte définitif et complète leur cycle de vie (Dubinina 1980).
Des analyses comparatives du développement morphophysiologique des Ligulidae et d’autres Cestodes de l’ordre des Pseudophyllidea ont conclu que le degré de complexification du développement morphophysiologique détermine le degré de spécificité des différentes phases du parasite vis à vis de ses hôtes (Dubinina 1980). Plus ces changements sont importants, plus la spécificité est importante.
Par ailleurs, et pour le cas de la ligule, la spécificité a été qualifiée de « forte » au stade plérocercoide, il existe une inégalité frappante de l’espèce parasitée en fonction des publications disponibles dans la littérature. Par exemple, Shpolyanskaya (1953), note que Carassius carassius est la seule espèce de poisson infestée par la ligule dans quelques localités en Russie. Selon Huculak (1960), Abramis brama représente la seule espèce infestée en Pologne et en Belgique. Le gardon Rutilus rutilus et le goujon Gobio gobio ont été signalés comme étant les hôtes préférentiels de la ligule dans le lac Lough Neagh au nord de l’Irlande (Bean & Winfield 1989). Dans le lac Dauphin au Canada, l’espèce Notropis hudsonius était le principal hôte de la ligule parmi plusieurs espèces de poissons examinées (Szalai et al. 1989). En France, Loot et al. (2001b) ont montré que la ligule n’infestait que l’espèce Rutilus rutilus dans des conditions locales de la gravière Lavernose dans le sud ouest de la France. L’infestation de la brème bordelière (Blicca bjoerkna) dans cette localité n’a pas été signalée et des essais d’infestation expérimentale de cette espèce ont échoué (Loot et al. 2001b). Cette espèce a pourtant été signalée comme étant un hôte potentiel de la ligule dans d’autres localités européennes (Huculak 1960, Dubinina 1980).
III.3.Les trois compartiments biologiques de la ligule
III.3.1 Compartiment du premier hôte intermédiaire :
La coracidie de la ligule infecte les Crustacés Entomostracés Copépodes qui sont les premiers hôtes intermédiaires. Les taxons de l’ordre des Calanoides et Cyclopoïdes sont les plus concernés (Dubinina 1980, Guillou 1982). Très peu d’études en milieu naturel ont réussi à trouver des Crustacés infestés par des Cestodes Pseudophyllidae (Watson & lawer 1965, Marcogliese & Esch 1989). Etant donné le faible taux de prévalence observé en milieu naturel, plusieurs infestations expérimentales ont été réalisées en laboratoire afin d’évaluer les sensibilités différentielles des espèces de Copépodes vis à vis de la ligule (Rosen 1920). Ces études ont décrit des espèces de Copépodes devant être envisagées comme premiers hôtes intermédiaires mais les infestations expérimentales de Dubinina (1980) ont remis en cause ces observations. Selon ses travaux, seuls quelques individus des Copépodes Mesocyclops leuckarti et Eucyclops serrulatus sont concernés. Une infestation expérimentale réalisée par Gerdeaux (1986) ultérieurement a permis de décrire trois autres espèces comme premier hôte intermédiaire; il s’agit de Cyclops vicinus vicinus, Eudiaptomus gracilis et Thermocyclops oithonoides.
Récemment, les travaux de Loot et al. (2001b) confirment que le copépode Eudiaptomus gracilis est à considérer comme premier hôte intermédiaire et qu’il représente l’hôte préférentiel de L. intestinalis dans la gravière de Lavernose. Le succès probable de ce Copépode dans la transmission du parasite semble être le résultat de son abondance et de sa pérennité dans le milieu.
III.3.2 Compartiment du second hôte intermédiaire
Les plérocercoïdes de L. intestinalis infestent des poissons appartenant principalement à la famille des Cyprinidés comprenant le gardon (Rutilus rutilus), le rotengle (Scardinius erythrophthalmus), la vandoise (Leuciscus leuciscus), l’ablette (Alburnus alburnus), le vairon (Phoxinus phoxinus), la brème commune (Abramis
brama), la brème bordelière (Blicca bjoerkna), le barbeau (Barbus spp.), la carpe commune (Cyprinus carpio), la tanche (Tinca tinca), le carassin (Carassius carassius), le hotu (Chondrostoma nasus), la queue à taches noires (Notropis hudsonius), le goujon (Gobio gobio) et même des hybrides (gardon x brème) (Weekes & Penlington 1986, Szalai et al. 1989, Barus & Prokes 1994). L'infestation a aussi été signalée, mais de façon moindre (Orr 1967) dans d’autres familles : les Percidae, les Catastomidae, les Cibitidae, les Galaxidae, les Gobiidae, les Siluridae et les Esocidae.
III.3.3 Compartiment de l’hôte définitif
Des conditions de températures optimales semblent être un pré-requis pour la maturation des plérocercoïdes. Ces conditions adéquates sont présentes chez un grand nombre d’oiseaux ictyophages homéothermes (Dubinina 1980). D’après Moisan (1956) et Péchoux (1977), six principaux ordres d’oiseaux aquatiques représentent des hôtes définitifs de la ligule : les Gaviiformes, les Pelecaniformes, les Charadriiformes, les Ciconiiformes les Ansériformes et les Coraciiformes.
Nous récapitulons sous forme d’un tableau (Tableau 3) les espèces hôtes qui ont été décrites pour les trois compartiments hôtes du cycle biologique avec quelques exemples des principales espèces décrites. Les différents degrés de spécificité observés selon Dubinina (1980) sont également résumés dans le Tableau 3