Impact des procédés de fabrication des yogourts de
type grec sur les communautés microbiennes durant
l’entreposage
Mémoire
Andréanne Moineau-Jean
Maîtrise en sciences et technologie des aliments
Maître ès sciences (M. Sc.)
Québec, Canada
Impact des procédés de fabrication des yogourts de
type grec sur les communautés microbiennes durant
l’entreposage
Mémoire
Andréanne Moineau-Jean
Sous la direction de :
Denis Roy, directeur de recherche
Claude Champagne, codirecteur de recherche
iii
Résumé
Les yogourts de type grec sont devenus très populaires en Amérique du Nord au cours des dernières années. Une étape de production supplémentaire est nécessaire pour augmenter la teneur en protéines. Le procédé utilisé influence grandement la composition et les propriétés rhéologiques des yogourts produits. Toutefois, très peu d’études ont analysé l’effet des procédés sur les différentes communautés microbiennes des yogourts de type grec. Le but du projet était donc de comparer la croissance et la survie de probiotiques et de contaminants microbiens ajoutés dans des yogourts de type grec et un yogourt brassé régulier durant l’entreposage. Trois types de yogourt ont été produits; yogourt grec par ultrafiltration du lait avant la fermentation, yogourt grec par centrifugation du caillé après la fermentation, et yogourt brassé régulier. Dans un premier temps, les yogourts ont été produits avec des cultures probiotiques (Bifidobacterium longum ssp. longum R0175 ou Lactobacillus
helveticus R0052). Les populations bactériennes et certaines propriétés physicochimiques des
yogourts ont ensuite été analysées durant l’entreposage à 4°C. Dans un deuxième temps, des contaminants microbiens (Escherichia coli ATCC® BAA-1430™ ou Kluyveromyces marxianus ATCC® 36907™) ont été ajoutés aux trois types de yogourt à la suite de la fermentation, puis dénombrés durant l’entreposage à 4°C ou 8°C. Parmi les procédés testés, aucun n’a pu améliorer la survie du probiotique B. longum R0175. Par contre, lorsqu’un probiotique plus résistant comme L.
helveticus R0052 est utilisé, les populations obtenues dans les yogourts de type grec frais sont
supérieures. De plus, un yogourt produit par centrifugation améliore la stabilité du probiotique durant l’entreposage, alors qu’un yogourt produit par ultrafiltration amplifie la mortalité d’E. coli. Toutefois, la croissance de la levure contaminante K. marxianus est également favorisée dans les yogourts de type grec. Les procédés de fabrication ont donc une influence importante sur les populations microbiennes.
iv
Abstract
Greek-style yogurt became very popular in North America in the past few years. To produce these yogurts, an additional step is required to increase the protein content. Composition and rheological properties of yogurt are greatly influenced by the production process applied. However, there is a lack of knowledge about the impact of Greek-style yogurt production processes on microbial communities. The aim of this project was to compare the growth and the survival of probiotic bacteria and microbial contaminants added in Greek-style yogurts and regular stirred yogurt during storage. Three kinds of yogurt were produced; Greek-style yogurt obtained by ultrafiltration of the milk prior to fermentation, Greek-style yogurt obtained by centrifugation of the curd after fermentation, and regular stirred yogurt. In a first series of experiments, yogurts were produced with probiotic cultures (Bifidobacterium longum subsp. longum R0175 or Lactobacillus helveticus R0052). Bacterial populations and physicochemical properties of the products were analyzed during refrigerated storage at 4°C. In a second series of experiments, microbial contaminants (Escherichia coli ATCC® BAA-1430™ or Kluyveromyces marxianus ATCC® 36907™) were added to the three yogurt types after fermentation, and their populations were followed during storage at 4°C or 8°C. None of the processes tested could improve B. longum R0175 survival in yogurt. On the other hand, with a more resistant probiotic species as L. helveticus R0052, fresh Greek-style products provided higher populations than regular stirred yogurt. Moreover, Greek-style yogurt produced by centrifugation improved probiotic stability during storage, while Greek-style yogurt produced by ultrafiltration is more detrimental to E. coli. However, Greek-style products also improved the growth of the contaminating yeast K. marxianus, in comparison with regular stirred yogurt. Therefore, production processes greatly influence microbial populations in Greek-style yogurt.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... ix
Liste des figures ... x
Liste des abréviations et des sigles ... xii
Remerciements ... xv
Avant-propos ... xvii
Introduction générale ... 1
Chapitre 1: État des connaissances ... 4
1.1 Historique ... 4
1.2 Les yogourts de type grec ... 4
1.2.1 Définition et composition ... 4 1.2.2 Étapes de fabrication ... 5 1.2.2.1 Préparation du lait ... 7 1.2.2.1.1 Standardisation du lait ... 7 1.2.2.1.2 Homogénéisation du lait ... 7 1.2.2.1.3 Traitement thermique ... 8
1.2.2.2 Inoculation des cultures lactiques et fermentation ... 8
1.2.2.3 Refroidissement, brassage, lissage, mise en pot et entreposage ... 9
1.3 Les cultures microbiennes utilisées dans le yogourt ... 10
1.3.1 Les cultures lactiques ... 10
1.3.1.1 Croissance et fermentation ... 10
1.3.1.2 Influence sur les propriétés sensorielles ... 11
1.3.1.3 Activité antimicrobienne ... 12 1.3.2 Les probiotiques ... 13 1.3.2.1 Définition ... 13 1.3.2.2 Croissance et survie ... 13 1.3.2.2.1 La température ... 14 1.3.2.2.2 Le pH ... 14 1.3.2.2.3 L’oxygène ... 15 1.3.2.2.4 Les nutriments ... 16 1.3.2.3 Les bifidobactéries ... 16 1.3.2.3.1 Bifidobacterium longum ... 17
vi
1.3.2.3.1.1 Bifidobacterium longum ssp. longum R0175 ... 17
1.3.2.4 Les lactobacilles ... 18
1.3.2.4.1 Lactobacillus helveticus ... 18
1.3.2.4.1.1 Lactobacillus helveticus R0052 ... 19
1.4 Les contaminants microbiens associés au yogourt ... 20
1.4.1 Les levures et moisissures ... 20
1.4.1.1 Kluyveromyces marxianus ... 21
1.4.2 Les bactéries pathogènes ... 21
1.4.2.1 Escherichia coli O157: H7... 22
1.5 Les protéines laitières ... 23
1.5.1 Description et propriétés physicochimiques ... 23
1.5.2 Influence des protéines sur les propriétés physicochimiques du yogourt ... 24
1.6 Les procédés de concentration des protéines ... 25
1.6.1 Concentration par ajout d’ingrédients laitiers ... 25
1.6.1.1 Les poudres de lait écrémé... 26
1.6.1.2 Les concentrés et isolats protéiques ... 27
1.6.2 Concentration par séparation ... 28
1.6.2.1 L’égouttage ... 28
1.6.2.2 La centrifugation ... 29
1.6.2.3 L’ultrafiltration ... 30
Chapitre 2 : Problématique, but, hypothèse et objectifs ... 33
2.1 Problématique ... 33
2.2 But ... 33
2.3 Hypothèse ... 33
2.4 Objectifs ... 34
Chapitre 3: Impact of production processes on starter and probiotic bacteria in Greek-style yogurt during storage ... 35
3.1 Résumé ... 36
3.2 Abstract ... 37
3.3 Introduction ... 38
3.4 Materials and methods ... 40
3.4.1 Microorganisms and media ... 40
3.4.2 Milk preparation ... 40
3.4.3 Yogurt production for the smoothing process assays ... 41
3.4.4 Yogurt production for Greek-style yogurt analyses ... 42
vii
3.4.4.2 Production steps specific to yogurts containing Bifidobacterium longum subsp. longum
R0175…... 43
3.4.4.3 Production steps specific to yogurts containing Lactobacillus helveticus R0052 ... 43
3.4.5 Bacterial enumeration ... 44
3.4.5.1 Plating technique ... 44
3.4.5.2 Flow cytometry technique ... 45
3.4.6 Compositional and physicochemical analyses ... 46
3.4.7 Statistical analyses ... 47
3.5 Results ... 49
3.5.1 Influence of dissolved oxygen and smoothing process on probiotics survival ... 49
3.5.2 Yogurt production ... 50
3.5.3 Yogurts made with the probiotic strain Bifidobacterium longum subsp. longum R0175 ... 51
3.5.3.1 Survival of Bifidobacterium longum subsp. longum R0175 during storage ... 51
3.5.4. Yogurts made with the probiotic strain Lactobacillus helveticus R0052 ... 53
3.5.4.1 Chemical attributes of yogurts ... 53
3.5.4.2 Survival of Lactobacillus helveticus R0052 during storage ... 55
3.5.4.3 Survival of Streptococcus thermophilus during storage ... 57
3.6 Discussion ... 60
3.6.1 Influence of dissolved oxygen and smoothing process on probiotics survival ... 60
3.6.2 Production of Control, GS-UF and GS-CF probiotic yogurts ... 61
3.6.3 Survival of Bifidobacterium longum subsp. longum R0175 during storage ... 62
3.6.4 Chemical attributes of yogurts made with Lactobacillus helveticus R0052 ... 63
3.6.5 Survival of Lactobacillus helveticus R0052 during storage ... 66
3.6.6. Survival of Streptococcus thermophilus during storage ... 67
3.7 Conclusion ... 68
3.8 Acknowledgements ... 69
Chapitre 4: Fate of Escherichia coli and Kluyveromyces marxianus contaminants during storage of Greek-style yogurt produced by centrifugation or ultrafiltration ... 70
4.1 Résumé ... 71
4.2 Abstract ... 72
4.3 Introduction ... 73
4.4 Materials and methods ... 76
4.4.1 Microorganisms and media ... 76
4.4.2 Milk preparation ... 77
4.4.3 Yogurt production ... 77
4.4.4 Contamination with yeast and E. coli surrogate cultures ... 78
viii
4.4.6 Yogurt analyses ... 79
4.4.7 Statistical analyses ... 80
4.5 Results ... 81
4.5.1 Fermentation process ... 81
4.5.2 Comparison of the two Escherichia coli strains ... 82
4.5.3 Survival of Escherichia coli surrogate in yogurt ... 83
4.5.4 Growth of Kluyveromyces marxianus in yogurt ... 84
4.5.5 pH profiles during storage ... 85
4.6 Discussion ... 88
4.6.1 Fermentation profiles ... 88
4.6.2 Survival of Escherichia coli... 88
4.6.3 Growth of Kluyveromyces marxianus ... 89
4.7 Conclusion ... 91
4.8 Acknowledgements ... 92
Conclusion générale ... 93
Annexes ... 96
Annexe 1. Procédés de concentration en protéines par séparation du lait ou du caillé ... 96
Annexe 2. Mise au point du dénombrement sélectif des microorganismes et des méthodes de production des yogourts ... 99
A2.1 Choix des milieux sélectifs ... 99
A2.1.1 Essai de milieux de culture ... 99
A2.1.1.1 Essai en bouillon ... 100
A2.1.1.2 Essais en boites de Petri... 101
A2.1.2 Vérification de la sélectivité des milieux de culture... 103
A2.2 Choix du ferment et du taux d’inoculation ... 106
A2.2.1 Détermination du taux d’inoculation ... 106
A2.2.1.1 Essais de ratios St : Lb ... 106
A2.2.1.2 Essais de taux d’inoculation ... 108
A2.2.2 Essais de différents ferments ... 110
A2.3 Détermination des paramètres de centrifugation ... 112
ix
Liste des tableaux
Tableau 1.1. Exigences requises selon la loi Canadienne pour la composition du yogourt. ... 4
Tableau 1.2. Composition générale des yogourts réguliers et des yogourts concentrés en protéines (type grec). ... 5
Tableau 1.3. Teneur moyenne en composants principaux du lait de vache ... 7
Tableau 1.4. Composés aromatiques ayant le plus d’influence sur les propriétés sensorielles du yogourt ... 12
Tableau 1.5. Composition moyenne de la poudre de lait écrémé et de la poudre de lactosérum ... 26
Tableau 1.6. Concentrés et isolats de protéines laitières principalement retrouvés sur le marché... 27
Table 3.1. Treatments performed on regular stirred yogurt to test the impact of the smoothing process on probiotics survival ... 41
Table 3.2. Selective media and incubation conditions used for the enumeration of the probiotic and starter bacterial strains in yogurt ... 44
Table 3.3. Relevant characteristics of the milk bases and the three yogurts produced for the comparative study of probiotic populations and physicochemical properties ... 50
Table 3.4. Total nitrogen (Ntot) content, α-amino nitrogen (AAN) content and degree of hydrolysis (DH) in the regular stirred yogurt (Control) and Greek-style yogurts made by centrifugation CF) or ultrafiltration (GS-UF) during storage at 4°C. ... 54
Table 3.5. Syneresis index (%) of the regular stirred yogurt (Control) and Greek-style yogurts made by centrifugation (GS-CF) or ultrafiltration (GS-UF) during storage at 4°C ... 55
Table 4.1. Relevant characteristics of the milk bases and the three yogurts produced for the comparative study of the microbial contaminant populations ... 78
Tableau A2.1. Liste des milieux sélectifs sélectionnés parmi la littérature pour l’énumération sélective des ferments, probiotiques et contaminants microbiens utilisés dans le projet ... 99
Tableau A2.2. Efficacité de milieux MRS supplémentés d’un agent sélectif à diverses concentrations pour générer des croissances sélectives de L. helveticus et L. bulgaricus ... 100
Tableau A2.3. Essais en Petri de divers milieux et conditions d’incubation pour le dénombrement sélectif de S. thermophilus (St), L. bulgaricus (Lb), B. longum (Bl), L. helveticus (Lh), K. marxianus (Km) et E. coli (Ec) ... 102
Tableau A2.4. Ferments commerciaux testés pour la fermentation de deux matrices laitières ... 110
Tableau A2.5. Paramètres de centrifugation retenus pour la production des yogourts de type grec centrifugés… ... 112
x
Liste des figures
Figure 1.1. Schéma des étapes principales de fabrication du yogourt. ... 6
Figure 1.2. Taux d'incidence des sérotypes d'E. coli O157 et d'E. coli non-O157 déclarés à l'Agence de la Santé Publique du Canada ... 23
Figure 1.3. Liaison des protéines suite au traitement thermique ... 24
Figure 1.4. Types de filtration par membrane utilisés dans l’industrie laitière ... 30
Figure 3.1. Antibody specificity and positive labelling of Lactobacillus helveticus R0052 in yogurt ... 46
Figure 3.2. Influence of the moment of probiotics inoculation and the smoothing process of regular stirred yogurt on the level of dissolved oxygen (a) and the viable counts of the probiotics Bifidobacterium longum subsp. longum R0175 and Lactobacillus helveticus R0052 (b) during storage at 4°C. ... 49
Figure 3.3. pH profile and population of Bifidobacterium longum subsp. longum R0175 in regular stirred yogurt (Control) and Greek-style yogurts made by centrifugation (GS-CF) or ultrafiltration (GS-UF) during storage at 4°C ... 52
Figure 3.4. Sugar and organic acid profiles of the 4% protein milk (Milk 1), 10% protein milk (Milk 2), regular stirred yogurt (Control) and Greek-style yogurts made by centrifugation (GS-CF) or ultrafiltration (GS-UF) during storage at 4°C ... 53
Figure 3.5. Comparison of two methods for the enumeration of viable Lactobacillus helveticus R0052 in regular stirred yogurt (Control) and Greek-style yogurts made by centrifugation (GS-CF) or ultrafiltration (GS-UF) during storage at 4°C. ... 56
Figure 3.6. pH and populations of Streptococcus thermophilus from the YO-MIX® T11 yogurt cultures in regular stirred yogurt (Control) and Greek-style yogurts made by centrifugation CF) or ultrafiltration (GS-UF) during storage at 4°C ... 58
Figure 4.1. Effect of the protein content of the milk matrix on the fermentation profiles of the starter bacteria Streptococcus thermophilus R0083 and Lactobacillus delbrueckii subsp. bulgaricus HA-137 (100:1 ratio) at 42 °C ... 81
Figure 4.2. Comparison between a pathogenic Escherichia coli O157: H7 (ATCC® 43895™) strain and a non-pathogenic E. coli surrogate strain (ATCC® BAA-1430™) ... 82
Figure 4.3. Population of Escherichia coli surrogate ATCC® BAA-1430™ in regular stirred yogurt (Control) and Greek-style yogurts made by centrifugation (GS-CF) or ultrafiltration (GS-UF) during storage at 4°C and 8°C…. ... 83
Figure 4.4. Population of Kluyveromyces marxianus ATCC® 36907™ in regular stirred yogurt (Control) and Greek-style yogurts made by centrifugation (GS-CF) or ultrafiltration (GS-UF) during storage at 4 °C and 8 °C.. ... 85
Figure 4.5. pH of the regular stirred yogurt (Control) and the Greek-style yogurts made by centrifugation (GS-CF) or ultrafiltration (GS-UF), which were contaminated with Escherichia coli surrogate ATCC® BAA-1430™, during storage at 4 °C and 8 °C ... 86
Figure 4.6. pH of the regular stirred yogurt (Control) and the Greek style yogurts made by centrifugation (GS-CF) or ultrafiltration (GS-UF), which were contaminated with Kluyveromyces marxianus ATCC® 36907™, during storage at 4 °C and 8 °C ... 87
Figure A1.1. Égouttage du caillé en sac de tissu sous l’effet de la gravité (a) ou par pressage (b) ... 96
Figure A1.2. Exemple de centrifugeuse industrielle appelée « séparateur à buses » pouvant être utilisée pour concentrer le yogourt ... 97
xi
Figure A1.3. Fonctionnement interne d’un séparateur à buses ... 97 Figure A1.4. Exemple de système d’ultrafiltration pouvant servir à la concentration du lait ... 98 Figure A1.5. Fonctionnement interne d’une cartouche d’ultrafiltration. ... 98 Figure A2.1. Vérification de la sélectivité en Petri des milieux de culture et conditions d’incubation sélectionnés pour effectuer les dénombrements sélectifs dans les yogourts avec probiotiques ... 104 Figure A2.2. Vérification de la sélectivité en Petri des milieux de culture sélectionnés pour effectuer les dénombrements sélectifs dans les yogourts avec contaminants microbiens ... 105 Figure A2.3. Effet du ratio de St : Lb et du taux d’inoculation sur la durée de fermentation à 40°C d’un lait régulier à 4% de protéines ... 107 Figure A2.4. Effet du taux d’inoculation du ferment sur la durée de fermentation à 40°C d’un lait régulier à 4% de protéines et d’un lait ultrafiltré à 10% de protéines ... 109 Figure A2.5. Profil de fermentation des différents ferments dans le lait régulier à 4% de protéines et dans le lait UF à 10% de protéines ... 111
xii
Liste des abréviations et des sigles
AAC/ AAFC: Agriculture et Agroalimentaire Canada/ Agriculture and Agri-Food Canada AAN: Azote alpha-aminé/ Alpha-Amino Nitrogen
ACIA/ CFIA: Agence Canadienne d’Inspection des Aliments/ Canadian Food Inspection Agency ATCC: American Type Culture Collection
B. bifidum: Bifidobacterium bifidum B. cereus: Bacillus cereus
B. lactis: Bifidobacterium animalis ssp. lactis B. longum: Bifidobacterium longum ssp. longum
Bl: Bifidobacterium longum ssp. longum
C. jejuni: Campylobacter jejuni
CaCn: Caséinate de calcium/ Calcium caseinate
CCIL/ CDIC: Centre Canadien d’Information Laitière/ Canadian Dairy Information Centre CF: Centrifugé/ Centrifuged
CIP: Ciprofloxacine CL: Clindamycine
CMI: Concentration minimale inhibitrice
CRDSH: Centre de Recherche et de Développement de Saint-Hyacinthe Da: Dalton
DH: Degré d’hydrolyse/ Degree of hydrolysis DO2: Oxygène dissous/ Dissolved oxygen DRBC: Dichloran Rose-Bengal Chloramphénicol
E. coli: Escherichia coli
Ec: Escherichia coli EPS: Exopolysaccharides
FACS: Fermentation Acquisition and Control System FC: Cytométrie de flux/ Flow Cytometry
FCD: Cytométrie de flux – Cellules mortes/ Flow Cytometry – Dead cells FCV: Cytométrie de flux – Cellules viables/ Flow Cytometry – Viable cells FIL/ IDF: Fédération Internationale du Lait/ International Dairy Federation FRQNT: Font de Recherche du Québec – Nature et Technologies GRAS: Generally Recognized As Safe
xiii
HPLC: Chromatographie en phase liquide à haute performance/ High-Performance Liquid Chromatography HTP: Haute teneur en protéines
INAF: Institut sur la Nutrition et les Aliments Fonctionnels/ Institute of Nutrition and Functional Foods ISO: International Organization for Standardization
K. marxianus: Kluyveromyces marxianus
KAN: Kanamycine kDa: Kilo-Dalton
Km: Kluyveromyces marxianus
L. acidophilus: Lactobacillus acidophilus
L. bulgaricus: Lactobacillus delbruecki ssp. bulgaricus L. helveticus: Lactobacillus helveticus
L. paracasei: Lactobacillus paracasei ssp. paracasei
LAB: Bactéries lactiques/ Lactic Acid Bacteria Lb: Lactobacillus delbruecki ssp. bulgaricus Lh: Lactobacillus helveticus
M. circinelloides: Mucor circinelloides
M17-L: M17 + Lactose MAC: MacConkey
MAPAQ: Ministère de l’Agriculture, des Pêcheries et de l’Alimentation du Québec MC: Caséine micellaire/ Micellar Casein
MPC: Concentré de protéines de lait/ Milk Protein Concentrate MPI: Isolat de protéines de lait/ Milk Protein Isolate
MRS: de Man, Rogosa, Sharpe
MRS 5.2: de Man, Rogosa, Sharpe à pH 5.2 MRS-B: de Man, Rogosa, Sharpe + Sels biliaires MRS-CIP: de Man, Rogosa, Sharpe + Ciprofloxacine MRS-CL: de Man, Rogosa, Sharpe + Clindamycine MRS-F: de Man, Rogosa, Sharpe + Fructose MRS-KAN: de Man, Rogosa, Sharpe + Kanamycine MRS-MUP: de Man, Rogosa, Sharpe + Mupirocine MUP: Mupirocine de lithium/ Lithium Mupirocin NaCn: Caséinate de sodium/ Sodium caseinate NTot: Azote total/ Total Nitrogen
PBS: Tampon phosphate salin/ Phosphate Buffered Saline pH: Potentiel hydrogène
xiv PM: Poids moléculaire
Psi: Livre-force par pouce carré
RPM: Tour par minute/ Revolution Per Minute SC/ HC: Santé Canada/ Health Canada
SEM: Erreur standard de la moyenne/ Standard Error of the Mean
S. thermophilus: Streptococcus thermophilus
St: Streptococcus thermophilus
S. Typhimurium: Salmonella enterica ssp. enterica serovar Typhimurium
TOS: Oligosaccharides trans-galactosylés./ Transgalactosylated oligosaccharides TOS-MUP: Oligosaccharides trans-galactosylés + Mupirocine
TSB: Bouillon tryptone soja/ Tryptic Soy Broth UF: Ultrafiltré/ Ultrafiltered
UFC/ CFU: Unités Formatrices de Colonies/ Colony Forming Units WPC: Concentré de protéines de lactosérum/ Whey Protein Concentrate WPI: Isolat de protéines de lactosérum/ Whey Protein Isolate
xv
Remerciements
Durant ma dernière année de baccalauréat à l’Université de Montréal, jamais je n’aurais pu imaginer que le simple geste de m’inscrire au cours optionnel « microbiologie des aliments I », donné par Claude P. Champagne, allait avoir des conséquences majeures sur ma vie. Dès le premier jour, Claude m’a transmis sa passion contagieuse pour la microbiologie alimentaire, ce qui m’a ultimement conduite à la maîtrise en sciences et technologie des aliments. Claude est donc la personne qui mérite le plus grand Merci pour la réalisation de ce mémoire.
Ainsi, je tiens d’abord à remercier mon directeur Denis Roy et mon codirecteur Claude P. Champagne pour m’avoir donné l’opportunité de mener un projet de recherche sous leur supervision. Je suis extrêmement reconnaissante de l’intérêt, de la disponibilité et du soutien qu’ils m’ont accordé tout au long de ma maîtrise. J’aimerais également remercier toutes les personnes ayant contribué à la conception du projet, soit Gisèle Lapointe, Denis Roy, Claude P. Champagne, Évelyne Guèvremont et Sylvie Gauthier.
Ensuite, je ne peux passer à côté de ma super équipe de recherche du Centre de Recherche et de Développement de Saint-Hyacinthe (CRDSH) d’Agriculture et Agroalimentaire Canada. Merci à Yves Raymond pour avoir été à la fois mon mentor et mon bras droit, et pour m’avoir supporté dans les moments difficiles. C’est grâce à lui que j’ai pu mener à terme ce projet et obtenir autant de résultats. Merci aussi à Marie-Josée Lemay pour son support et ses précieux conseils. Finalement merci à Germaine Forkwa, ma coéquipière de tous les jours, toujours présente pour m’encourager et me remonter le moral grâce à sa bonne humeur et ses nombreuses aventures rocambolesques.
Je remercie également toutes les autres personnes du CRDSH qui m’ont apporté du support technique ou scientifique en cours de route : Sonia Lafleur, Gaétan Bélanger, Daniel St-Gelais, Nancy Graveline, Annie Caron et Hélène Drolet.
xvi
Il ne faut pas non plus oublier l’Université Laval et le CRDSH qui m’ont permis de réaliser les cours et les expérimentations nécessaires à l’obtention de mon diplôme de maîtrise. Un grand merci également au Fonds de recherche du Québec - Nature et technologies (FRQNT) et Novalait, pour avoir subventionné le projet et les bourses qui m’ont été remises. Puis, merci à Lallemand Solutions santé (Montréal, Qc) et Aliments Ultima (Granby, Qc) pour avoir gracieusement fourni du matériel.
Je dois également faire une mention spéciale aux personnes de mon entourage rapproché. Les longues heures de travail et de route, le stress et mes horaires chargés n’ont pas seulement eu des répercussions sur moi, mais aussi sur ma famille, mes amis et tout particulièrement mon amoureux Maxime qui était au premier plan de tout. C’est pourquoi j’apprécie grandement la patience que vous avez tous eu envers moi et le soutien que vous m’avez apporté. En plus de signifier la réussite d’une nouvelle étape dans ma vie scolaire et professionnelle, la finalisation de ce mémoire signifie également que je vais ENFIN retrouver du temps pour avoir une vie sociale normale et passer du temps de qualité avec les personnes qui me sont chères!
xvii
Avant-propos
Le projet a été supervisé à la direction par Denis Roy Ph.D., professeur titulaire à l’Université Laval, et à la codirection par Claude P. Champagne Ph.D., chercheur scientifique à Agriculture et Agroalimentaire Canada. Les expériences de laboratoire ont été menées au Centre de recherche et de développement de Saint-Hyacinthe (CRDSH) d’Agriculture et Agroalimentaire Canada (AAC). Ce mémoire est composé de quatre chapitres dont deux articles.
Le premier chapitre intitulé « États des connaissances » fait une revue de la littérature sur les sujets touchés par les chapitres trois et quatre. Plus précisément, il porte sur la fabrication des yogourts et leur composition, en faisant état des différences entre les yogourts réguliers et les yogourts de type grec. Il porte également sur l’incorporation de cultures probiotiques et des facteurs influençant leur croissance et leur survie dans le yogourt, tout en exposant des données récentes sur leurs bienfaits pour la santé. La contamination microbienne du yogourt est ensuite abordée, avec un accent sur les levures contaminantes et bactéries pathogènes, leur survie dans le yogourt et les problèmes économiques et sociétaux associés. Le chapitre fait finalement état des différents procédés pouvant être utilisés dans la fabrication des yogourts de type grec pour augmenter la teneur en protéines. Pour finir, le fonctionnement des procédés et leurs impacts connus sur la composition, les propriétés rhéologiques, physicochimiques et microbiologiques des yogourts y sont abordées.
Le deuxième chapitre intitulé « Problématique, but, hypothèse et objectifs » fait d’abord une description de la problématique ayant mené à l’établissement du but général du projet de maîtrise. Il établit ensuite l’hypothèse générale du projet en lien avec le contenu du chapitre 1, et présente finalement, point par point, les objectifs de recherche.
Le troisième chapitre est intitulé « Impact of production processes on starter and probiotic bacteria in Greek-style yogurt during storage ». Il s’agit d’un article rédigé en anglais. L’article est toujours en processus de révision par les coauteurs et n’a donc pas encore été soumis à un journal. L’auteure de ce mémoire, Andréanne Moineau-Jean, est également l’auteure principale de cet article. Elle a mené les expériences au laboratoire pour produire les résultats et a rédigé l’intégral de l’article en anglais. Les coauteurs sont Claude P. Champagne Ph.D. (CRDSH, Qc), Denis Roy Ph.D. (Université Laval,
xviii
Qc), Yves Raymond (CRDSH, Qc) et Gisèle Lapointe Ph.D, (University of Guelph, ON). Chacun des coauteurs a contribué à la planification des expériences et à la bonification de l’article suite à la première version rédigée par l’auteure principale. Yves Raymond a également contribué à la réalisation des expériences au laboratoire. Le chapitre porte sur l’impact des procédés de fabrication des yogourts de type grec sur les cultures probiotiques ajoutées. Deux types de yogourt grec et un yogourt brassé régulier, supplémentés avec une souche probiotique (Bifidobacterium longum ssp.
longum R0175 ou Lactobacillus helveticus R0052), ont été produits pour l’étude. Les différences de
croissance et de survie des probiotiques et du ferment Streptococcus thermophilus durant l’entreposage des trois types de yogourt y sont décrites. L’évolution de la teneur en azote, sucres et acides, de même que celle des valeurs de pH et de synérèse durant l’entreposage des trois yogourts est également montrée. De plus, l’impact sur les cultures probiotiques de la méthode de lissage employée dans la fabrication des yogourts de ce chapitre a été analysé. Afin de s’adapter au format du mémoire, le résumé du chapitre ainsi que les numéros de sections, tableaux et figures ont été modifiés par rapport à la version article qui sera soumise à un journal pour publication. Les figures y sont également présentées en couleur, contrairement à l’article où elles y seront présentées en nuances de gris. Pour finir, des références aux annexes du mémoire, qui seront absentes de l’article, ont été ajoutées dans le texte.
Le quatrième et dernier chapitre est intitulé « Fate of Escherichia coli and Kluyveromyces marxianus contaminants during storage of Greek-style yogurt produced by centrifugation or ultrafiltration ». Il s’agit d’un deuxième article rédigé en anglais. Cet article a été publié le 15 avril 2017 par la revue « International Dairy Journal » (Doi : 10.1016/j.idairyj.2017.04.002). Andréanne Moineau-Jean en est également l’auteure principale. Elle a mené les expériences au laboratoire pour produire les résultats et a rédigé l’intégral de l’article en anglais. Les coauteurs sont Évelyne Guévremont Ph.D. (CRDSH, Qc), Claude P. Champagne Ph.D. (CRDSH, Qc), Denis Roy Ph.D. (Université Laval, Qc), Yves Raymond (CRDSH, Qc) et Gisèle Lapointe Ph.D. (University of Guelph). Chacun des coauteurs a contribué à la planification des expériences et au perfectionnement de l’article suite à la première version rédigée par l’auteure principale. Yves Raymond a également contribué à la réalisation des expériences au laboratoire. Le chapitre porte sur l’impact des procédés de fabrication des yogourts de type grec sur les contaminants microbiens. Deux types de yogourt grec et un yogourt brassé régulier ont été produits, puis contaminés avec la bactérie Escherichia coli ou la levure
xix
Kluyveromyces marxianus. Les différences de croissance et de survie des contaminants dans les
trois types de yogourt y sont décrites. L’influence de la température de réfrigération sur les populations des contaminants microbiens y est également décrite. La survie de la souche non pathogène d’E. coli utilisée pour l’étude est également comparée à celle d’une souche pathogène d’E. coli O157: H7. Comme pour le chapitre trois, des modifications ont été apportées à l’article original pour s’adapter au format du mémoire. Le résumé du chapitre, le style des références, ainsi que les numéros de sections, tableaux et figures ont été modifiés. Des couleurs ont été ajoutées aux figures et des références aux annexes du mémoire, absentes de l’article original, ont été intégrées dans le texte.
Finalement, le mémoire inclut deux annexes. La première complémente la revue de littérature en apportant des supports visuels des procédés de concentration des protéines par séparation. La deuxième annexe présente des expériences et résultats préliminaires aux chapitres 3 et 4 qui ont permis de mettre au point les méthodes de dénombrements sélectifs des microorganismes utilisés dans ces chapitres et les méthodes de production des yogourts.
1
Introduction générale
Depuis le début des années 2000, la production de yogourt au Canada ne cesse d’augmenter (CCIL, 2016b). La consommation des Canadiens a été estimée à près de 3 litres par habitant en 2016 (CCIL, 2016a). On retrouve aujourd’hui sur les tablettes des supermarchés une grande variété de produits. Avec le souci grandissant des consommateurs à intégrer des aliments sains et naturels à leur alimentation, les yogourts aux « effets santés », tels que les yogourts sans gras et les yogourts probiotiques, suscitent un intérêt particulier. C’est sans doute pour la même raison que les yogourts de type grec sont devenus très populaires en Amérique du Nord au cours des dernières années (Wouters, 2012). Ces yogourts à haute teneur en protéines (HTP) ont l’avantage d’être nutritifs, généralement faibles en gras et d’avoir une texture ferme et crémeuse sans qu’il ne soit nécessaire d’ajouter d’agents gélifiants. Originaires du Moyen-Orient où ils sont appelés « Labneh », les yogourts HTP sont aujourd’hui consommés un peu partout dans le monde, avec des appellations différentes selon la région (Tamime & Robinson, 1999).
La méthode de production traditionnelle des yogourts HTP consiste à concentrer le caillé par égouttage dans un sac de tissu, où le lactosérum est retiré sous l’effet de la gravité. Cette méthode lente, pour laquelle il est difficile d’assurer une bonne salubrité, est principalement utilisée pour la fabrication de yogourt concentré maison ou à petite échelle (Al-Kadamany et al., 2002; Tamime & Robinson, 1999). Étant difficilement applicables au niveau industriel, de nouveaux procédés ont été développés pour faciliter la production de ces yogourts. Ceux-ci peuvent être divisés en deux catégories; les procédés d’ajout d’ingrédients et les procédés de séparation.
L’ajout d’ingrédients laitiers permet d’augmenter directement la concentration en protéines du lait avant la fermentation. Des produits tels que la poudre de lait écrémée, la poudre de lactosérum, ainsi que les concentrés et isolats protéiques dérivés du lait, peuvent être utilisés. Ayant des teneurs différentes en protéines et en autres composants laitiers, tels que le lactose et les minéraux, ces poudres influencent grandement la composition du yogourt produit (Huffman & De Barros Ferreira, 2011; O'Kennedy, 2011).
2
Les procédés de séparation permettent quant à eux d’augmenter la teneur en protéines du lait ou du caillé en les concentrant via le retrait de certains composés. Les procédés les plus couramment utilisés en industrie sont l’ultrafiltration et la centrifugation (Tamime & Robinson, 1999). La centrifugation effectue une concentration du caillé par retrait du lactosérum sous l’effet de la force centrifuge (Kilara & Chandan, 2013). L’ultrafiltration concentre plutôt certains composants du lait ou du caillé par filtration forcée au travers d’une membrane (Tetra Pak, 2003). Différents composants du lait peuvent ainsi être retenus ou perdus selon le type de séparation effectuée. Les procédés de séparation influencent donc également la composition du yogourt produit.
Les études portant sur les yogourts de type grec et ses homologues ont démontré que le type de procédé utilisé pour augmenter la concentration en protéines a non seulement une grande influence sur la composition, mais également sur les propriétés physicochimiques, rhéologiques et sensorielles du yogourt produit (Bong & Moraru, 2014; Ozer et al., 1998; Ozer et al., 1999a; Ozer et al., 1999b; Yazici & Akgun, 2004).
L’étape de concentration en protéines requise lors de la fabrication des yogourts de type grec représente un risque accru de contamination microbienne. Les levures et moisissures peuvent aisément se développer dans le yogourt grâce à leur forte tolérance à l’acidité (Fleet, 1990; Ledenbach & Marshall, 2010). Certaines bactéries pathogènes plus acido-résistantes peuvent même y survivre durant l’entreposage (Cirone et al., 2013; Gulmez & Guven, 2003; Osaili et al., 2013; Tirloni et al., 2015). Le yogourt n’est toutefois pas un milieu favorable pour tous les microorganismes. En plus de l’effet bactériostatique du faible pH (Conner & Kotrola, 1995; Guraya et al., 1998; Nicolò
et al., 2011), les bactéries lactiques produisent des métabolites antibactériens qui permettent de
réduire la survie ou la croissance d’un grand nombre de microorganismes (Nassib et al., 2006; Qiuye
et al., 2016; Reis et al., 2012; Yang et al., 2012). Les conditions de production et la composition du
yogourt influencent également la croissance et la survie des contaminants microbiens (Tirloni et al., 2015).
3
Les yogourts sont aussi couramment utilisés pour véhiculer des cultures probiotiques. Au Canada, un aliment doit contenir un minimum de 1 milliard de cellules viables par portion jusqu’à la date de péremption pour avoir la dénomination « probiotique » (ACIA, 2016; Santé Canada, 2009a, 2009b). Plusieurs espèces de lactobacilles et de bifidobactéries survivent très bien à l’entreposage des yogourts (Damin et al., 2008; Gilliland et al., 2002; Gueimonde et al., 2004). Comme pour les contaminants microbiens, les conditions de production et la composition du yogourt influencent grandement la croissance et la survie des probiotiques (Abe et al., 2009; Ostlie et al., 2005; Prasanna et al., 2012a; Tripathi & Giri, 2014).
La majorité des études microbiologiques du yogourt ont été effectuées avec des produits réguliers fermes ou brassés. Très peu d’études ont analysé l’effet des procédés de fabrication des yogourts de type grec sur les différentes communautés microbiennes de ces yogourts. Puisque les populations microbiennes du yogourt sont affectées par la composition de la matrice, et que la composition de la matrice est à son tour affectée par les procédés de fabrication, des différences au niveau de la croissance et de la survie des cultures probiotiques et des contaminants microbiens devraient être observées entre les différents types de yogourt. Ce projet avait ainsi pour objectif de comparer deux procédés de fabrication des yogourts de type grec (centrifugation et ultrafiltration) à une fabrication classique de yogourt brassé, quant à leur impact sur les comptes de probiotiques et contaminants microbiens durant l’entreposage.
4
Chapitre 1: État des connaissances
1.1 Historique
Les yogourts égouttés connus sous le nom de Labneh sont originaires du Moyen-Orient. Autrefois, le yogourt produit était conservé dans des sacs faits de peau animale. Une partie du lactosérum était alors absorbée par le sac puis évaporée, ce qui menait à la concentration du caillé. C’est ce qui est à l’origine de l’égouttage en sac de tissu (Annexe 1), la méthode traditionnelle de production des yogourts concentrés à haute teneur en protéines (HTP), encore utilisée aujourd’hui à petite échelle (Tamime & Robinson, 1999). Les yogourts HTP sont maintenant consommés partout dans le monde. Ils sont d’ailleurs mieux connus sous le nom de « yogourt de type grec » en Amérique du Nord. Ceux-ci varient toutefois en nom et en composition selon la région d’origine.
1.2 Les yogourts de type grec
1.2.1 Définition et composition
Le yogourt est défini comme un lait fermenté par les bactéries lactiques Streptococcus thermophilus et Lactobacillus delbrueckii ssp. bulgaricus contenues à un taux minimum de 107 UFC/g (CanLII,
2016; CAC, 2003). Le tableau 1.1 montre les exigences requises par la loi Canadienne pour la composition du yogourt.
Tableau 1.1. Exigences requises selon la loi Canadienne pour la composition du yogourt.
Composant Quantité requise
Acide lactique > 0.7%
Solides non gras du lait > 9.5%
Protéines laitières > 3%
S. thermophilus et L. bulgaricus > 1.0 x 107 UFC/g
5
Un yogourt concentré est quant à lui défini comme étant un lait fermenté dont la teneur en protéines a été augmentée à un minimum de 5.6% avant ou après la fermentation (CAC, 2003). Toutefois, il n’existe aucune exigence légale au sujet des yogourts de type grec, ou tous autres types de yogourts HTP, autant au Canada qu’aux États-Unis. Peu importe leur appellation, ceux-ci ont en commun d’avoir une teneur nettement plus élevée en protéines qu’un yogourt ferme ou brassé régulier. Généralement, les yogourts de type grec sont constitués d’environ 10% de protéines tandis qu’un yogourt régulier en contient plutôt autour de 4%. Le tableau 1.2 montre un aperçu des principales différences de composition entre les deux types de yogourt.
Tableau 1.2. Composition générale des yogourts réguliers et des yogourts concentrés en protéines (type
grec).
Composant Yogourt régulier Yogourt concentré
Protéines (%) 4 - 5 6 - 11
Solides totaux (%) 15 - 18 20 - 27
Gras (%) 0 - 3 0 - 12
Lactose (%) 7 - 8 3 - 9
(Kumar & Mishra, 2004; Ozer et al., 1999a; Tamime & Robinson, 1999)
La composition des yogourts de type grec varie grandement selon le procédé utilisé pour augmenter la teneur en protéines et le type de matrice laitière de base (ex : lait écrémé vs entier, lait frais vs en poudre, lait de vache vs autre animal, etc…).
1.2.2 Étapes de fabrication
Deux grandes catégories de yogourt régulier sont couramment fabriquées en industrie; les yogourts fermes et les yogourts brassés (figure 1.1). Ces deux types de yogourt diffèrent principalement par l’ordre des étapes de production (Tamime & Robinson, 1999).
6
Figure 1.1. Schéma des étapes principales de fabrication du yogourt. Les étapes de concentration en
protéines pouvant être utilisées dans la production des yogourts de type grec sont indiquées en pointillés.
Les yogourts de type grec peuvent être fabriqués en suivant l’une ou l’autre de ces voies. Il y aura toutefois une étape supplémentaire requise pour augmenter la teneur en protéines du produit.
Standardisation Homogénéisation Traitement thermique Refroidissement (42°C) Inoculation Mise en pot Fermentation en pot (42°C) Entreposage (4°C) Mise en pot Fermentation en cuve (42°C) Refroidissement (20°C) Entreposage (4°C) Brassage et Lissage Lait Yogourt ferme Yogourt brassé
Addition d’ingrédients laitiers ▪ Poudres de lait ▪ Poudre de lactosérum ▪ Concentrés protéiques ▪ Isolats protéiques Concentration du caillé ▪ Égouttage ▪ Centrifugation ▪ Ultrafiltration Concentration du lait ▪ Ultrafiltration
7
1.2.2.1 Préparation du lait
1.2.2.1.1 Standardisation du lait
La composition du lait reçu à l’usine de transformation est très variable. En effet, de nombreux facteurs relatifs à l’animal producteur et son environnement peuvent influencer la composition du lait (Schwendel et al., 2015). Le tableau 1.3 montre la teneur moyenne des principaux composants du lait de vache. Afin d’obtenir des produits identiques entre chaque lot de production, et de contrôler la teneur en certains composants tels que le gras et les solides non gras, il est nécessaire de standardiser la composition du lait (Tamime & Robinson, 1999). De nombreuses méthodes peuvent être utilisées pour ajouter ou retirer des composants de manière contrôlée, telles que l’écrémage, la filtration, l’évaporation, et l’ajout de poudre de lait, de concentrés protéiques, de sucre, de vitamines, de minéraux ou de crème (Lapointe-Vignola, 2002).
Tableau 1.3. Teneur moyenne en composants principaux du lait de vache.
Composant Teneur (%) Eau 87.5 Glucides 4.6 Matière grasse 3.7 Protéines 3.2 Minéraux 0.8 Tiré de Lapointe-Vignola (2002) 1.2.2.1.2 Homogénéisation du lait
L’étape d’homogénéisation permet principalement de réduire la taille des globules de gras pour empêcher leur montée à la surface du lait, ce qui créerait une séparation de phase. Ce procédé rend également le lait plus blanc et améliore la stabilité des protéines. Pour ce faire, le lait est propulsé au travers d’une valve avec une certaine pression. Cela permet de faire éclater les globules de gras qui se reforment par la suite en une multitude de globules de tailles inférieures (Lapointe-Vignola, 2002). L’homogénéisation a ainsi une grande influence sur la texture du yogourt, en augmentant notamment la viscosité, la consistance et la fermeté (Lanciotti et al., 2004; Patrignani et al., 2016). Des études ont même démontré que l’homogénéisation du lait permet d’améliorer la croissance des ferments
8
lactiques (Lanciotti et al., 2004) et la survie des probiotiques durant l’entreposage du yogourt (Patrignani et al., 2016; Ramona et al., 2015).
1.2.2.1.3 Traitement thermique
L’objectif premier du traitement thermique est de réduire la flore microbienne du lait. En effet, le lait contient une grande quantité de microorganismes provenant de l’animal et de l’environnement. Certains de ces microorganismes peuvent être pathogènes, alors que d’autres peuvent altérer le goût du lait et des produits dérivés, ou interférer avec la croissance des ferments lactiques lors de la fermentation (Tamime & Robinson, 1999). Une étape de traitement thermique est donc nécessaire pour réduire au maximum cette flore microbienne.
Pour la production du yogourt, le traitement thermique vise également à agir sur les protéines laitières pour améliorer la texture finale du produit fermenté (Remeuf et al., 2003). Pour avoir un impact sur les protéines, un traitement thermique de température et de durée supérieure à ce qui est appliqué pour la pasteurisation du lait de consommation est nécessaire. Le traitement thermique est ainsi généralement de 30 minutes à 80-85°C ou de 5 minutes à 90-95°C (Robinson et al., 2007). De telles températures causent la dénaturation des protéines sériques, ce qui permet d’augmenter le nombre de liaisons entre les caséines et les protéines sériques, provoquant ainsi la formation d’un gel de densité et viscosité supérieure. La capacité de rétention d’eau du gel est également améliorée, ce qui réduit la synérèse durant l’entreposage. Toutefois, le traitement thermique peut également causer une augmentation de la granulosité du gel, ce qui semble être directement liée à la quantité de protéines sériques dénaturées (Remeuf et al., 2003; Robinson et al., 2007).
1.2.2.2 Inoculation des cultures lactiques et fermentation
Après la pasteurisation, le lait est refroidi jusqu’à la température de fermentation, puis les cultures lactiques sont ajoutées. Comme le mentionne la définition du yogourt, le ferment doit être composé des bactéries lactiques S. thermophilus et L. bulgaricus. Celles-ci doivent être inoculées à un taux minimal total de 107 UFC/g, mais il n’y a toutefois aucune spécification du ratio requis entre les deux
9
souches (CanLII, 2016; CAC, 2003). Ces cultures lactiques peuvent être obtenues sous forme congelée ou lyophilisée. Il est aussi possible d’ajouter des cultures probiotiques au même moment.
Le lait est ensuite incubé autour de 42°C pour permettre la fermentation (Robinson et al., 2007). À cette température, les bactéries du ferment agissent en synergies pour dégrader le lactose en glucose et galactose. Le galactose s’accumule généralement dans le milieu alors que le glucose est transformé en acide lactique (De Vin et al., 2005; Svensson et al., 2007), causant ainsi l’acidification du lait. Le gel commence à se former à un pH de 5.3 par l’agrégation des protéines. La fermentation est arrêtée après 3-4 h lorsque le pH final désiré est atteint, soit autour de 4.6, le point isoélectrique des caséines. C’est également à ce pH que la fermeté du gel atteint son maximum (Robinson et al., 2007).
1.2.2.3 Refroidissement, brassage, lissage, mise en pot et entreposage
L’arrêt de la fermentation se fait par refroidissement afin de ralentir l’activité métabolique des bactéries. En industrie, le refroidissement est majoritairement effectué en deux étapes. Le yogourt est d’abord refroidi autour de 20°C, température à laquelle les manipulations subséquentes occasionnent le moins de dommage au caillé. Le yogourt est ensuite refroidi à 4°C en chambre réfrigérée (Tamime & Robinson, 1999).
Puisque la fermentation des yogourts brassés survient en cuve, une étape de brassage est nécessaire pour homogénéiser après la fermentation. Le yogourt doit par la suite être pompé pour être transféré dans les contenants d’entreposage, ce qui produit en même temps un lissage (Tamime & Robinson, 1999). Finalement, les pots de yogourts sont entreposés au réfrigérateur jusqu’à l’expédition.
Puisque le yogourt contient des cultures actives, l’entreposage à 4°C est important pour maintenir au minimum l’activité métabolique bactérienne, et ainsi prolonger la durée de vie du produit. De plus, les manipulations subséquentes au traitement thermique du lait durant la production amènent un risque de post-contamination microbienne. L’entreposage du yogourt à 4°C sert donc également à prévenir
10
le développement de microorganismes contaminants pouvant altérer le produit ou causer des toxi-infections alimentaires (Mataragas et al., 2011; Tirloni et al., 2015; Viljoen et al., 2003).
1.3 Les cultures microbiennes utilisées dans le yogourt
1.3.1 Les cultures lactiques
Les cultures lactiques sont des bactéries utilisées pour la fermentation du lait. Dans le cas du yogourt, ce sont les espèces S. thermophilus et L. bulgaricus qui sont employées.
1.3.1.1 Croissance et fermentation
Les bactéries lactiques S. thermophilus et L. bulgaricus sont thermophiles, anaérobies facultatives et homofermentaires (Vos et al., 2011). Elles fermentent donc le glucose en acide lactique via la voie métabolique Embden-Meyerhof (Slattery et al., 2010). Elles agissent en protocoopération en promouvant la croissance de l’une et de l’autre (Oliveira et al., 2012). Ayant un pH optimal de 6.5, le streptocoque entame la fermentation et l’abaissement du pH, ce qui favorise la croissance du lactobacille qui a un pH optimal de 5.8 (Beal et al., 1989). Également, via la protéolyse des protéines,
L. bulgaricus libère des peptides et acides aminés qui sont utilisés par S. thermophilus, puis ce
dernier produit du dioxyde de carbone et de l’acide formique qui stimule la croissance de L.
bulgaricus (Radke-Mitchell & Sandine, 1986).
L’espèce L. bulgaricus peut produire jusqu’à trois fois plus d’acide lactique que S. thermophilus puisqu’elle est plus acido-tolérante. Cette bactérie est ainsi la principale cause de sur-acidification des yogourts qui survient durant l’entreposage (Antunes et al., 2005; Tamime & Robinson, 1999). La croissance de S. thermophilus durant la fermentation est toutefois plus importante que celle de L.
bulgaricus, faisant en sorte que cette espèce représente la population majeure du yogourt (Ozer &
Robinson, 1999). La plus haute proportion de S. thermophilus dans le produit fermenté est aussi le reflet des pratiques modernes d’inoculation qui favorisent cette espèce au détriment du lactobacille
11
afin de réduire les problèmes de sur-acidification durant l’entreposage (Beal et al., 1989; Dave & Shah, 1998; Xanthopoulos et al., 2001).
1.3.1.2 Influence sur les propriétés sensorielles
Les propriétés sensorielles d’un yogourt peuvent être définies par la texture, l’odeur et le goût. Ces trois aspects peuvent être influencés par une multitude de facteurs, dont les cultures lactiques qui en sont les principaux déterminants.
Les cultures lactiques agissent sur la texture d’abord en causant la précipitation des caséines et la formation d’un gel à la suite de la production d’acide lactique par la fermentation du lactose. Certaines cultures peuvent aussi produire des exopolysaccharides (EPS) à partir du lactose (Escalante et al., 1998), ce qui modifie la texture du yogourt et affecte la viscosité, la fermeté et la synérèse (Amatayakul et al., 2006; Wacher-Rodarte & Farres, 1993).
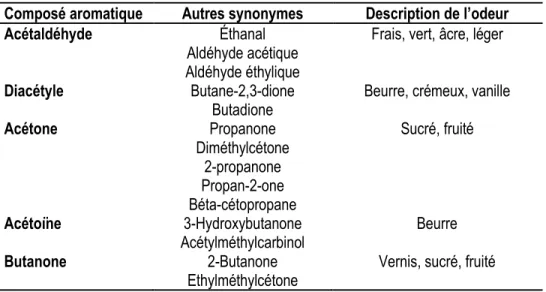
Les cultures lactiques ont également un rôle important dans le développement des saveurs et des odeurs du yogourt. Durant la fermentation, le métabolisme du lactose, du lactate et du citrate mène à la production de plusieurs arômes importants tels que le lactate (acide lactique), l’acétaldéhyde, l’acétoine et le diacétyle (Cheng, 2010). Le tableau 1.4 montre les arômes retrouvés dans le yogourt qui ont le plus d’impact sur les propriétés sensorielles. L’acétaldéhyde est le composé aromatique le plus important puisqu’il confère l’arôme caractéristique du yogourt (Biliaderis et al., 1992). Ce composé est produit majoritairement par L. bulgaricus lors de la fermentation (Antunes et al., 2005). D’autres composés aromatiques tels que le diacétyle et l’acétoïne sont produits uniquement dans les co-cultures de S. thermophilus et L. bulgaricus (Oliveira et al., 2009).
12
Tableau 1.4. Composés aromatiques ayant le plus d’influence sur les propriétés sensorielles du yogourt. Composé aromatique Autres synonymes Description de l’odeur
Acétaldéhyde Éthanal
Aldéhyde acétique Aldéhyde éthylique
Frais, vert, âcre, léger
Diacétyle Butane-2,3-dione
Butadione Beurre, crémeux, vanille
Acétone Propanone Diméthylcétone 2-propanone Propan-2-one Béta-cétopropane Sucré, fruité Acétoïne 3-Hydroxybutanone Acétylméthylcarbinol Beurre Butanone 2-Butanone
Ethylméthylcétone Vernis, sucré, fruité
Tiré de Cheng (2010)
Les cultures lactiques peuvent également générer des arômes à partir des protéines, des peptides et des acides aminés, ou encore à partir des lipides dans les yogourts faits de lait entier (Boelrijk et al., 2003).
1.3.1.3 Activité antimicrobienne
Les cultures lactiques du ferment procurent un effet antimicrobien au yogourt via la production de substances inhibitrices, telles que de l’acide lactique (Wang et al., 2015), des bactériocines (Mohammed & Ijah, 2013; Yang et al., 2012), du peroxyde d’hydrogène (Dave & Shah, 1997b; Tamime & Robinson, 1999) et des surfactants (Rodrigues et al., 2006). Elles peuvent également nuire à la croissance des pathogènes simplement par leur importante biomasse qui accapare les nutriments. En effet, en plus de leur nombre élevé au moment de l’inoculation, leur population peut augmenter de plus de deux log UFC/g durant la fermentation et demeurer stable lors de l’entreposage (Al-Kadamany et al., 2002; Canganella et al., 1998; Cutrim et al., 2016; Osaili et al., 2013; Tirloni et al., 2015). L’effet antibactérien du yogourt envers plusieurs bactéries pathogènes telles que Escherichia coli, Listeria monocytogenes, Salmonella et Shigella, est d’ailleurs connu depuis longtemps (Alm, 1983; Jasjit et al., 1979; Kotz et al., 1990; Rubin & Vaughan, 1979; Schaack & Marth, 1988). L’ajout de bactéries lactiques, autres que les cultures du ferment, peut également
13
augmenter l’effet antibactérien du yogourt et même lui procurer un effet antifongique (Delavenne et
al., 2013; Reis et al., 2012).
1.3.2 Les probiotiques
1.3.2.1 Définition
Les probiotiques sont définis comme des microorganismes vivants qui confèrent un bénéfice santé à l’hôte, lorsqu’administrés en quantité suffisante (Hill et al., 2014). L’incorporation de probiotiques dans les aliments est un moyen de procurer un aspect fonctionnel à ceux-ci. Toutefois, pour obtenir la dénomination « probiotique » ainsi qu’une allégation santé, les effets bioactifs doivent d’abord être démontrés par des études cliniques. De plus, le gouvernement canadien exige que l’aliment contienne un minimum de 1 milliard de cellules viables par portion, ainsi que le minimum de cellules viables nécessaires pour obtenir l’effet bénéfique allégué, et ce tout au long de la durée d’entreposage (ACIA, 2016; Santé Canada, 2009a, 2009b). Ce nombre minimal est justifié par le fait que pour procurer un effet santé, les probiotiques doivent atteindre et coloniser l’intestin en nombre suffisant. Ainsi, ils doivent d’abord survivre à la production du produit alimentaire dans lequel ils sont incorporés, puis à son entreposage.
1.3.2.2 Croissance et survie
Plusieurs facteurs physicochimiques influencent la survie des probiotiques dans le yogourt. La capacité des cultures probiotiques à survivre aux diverses conditions environnementales varie toutefois d’une souche à l’autre puisque chacune possède ses propres conditions optimales et ses propres limites de tolérance (Andriantsoanirina et al., 2013). Les cultures probiotiques sont généralement incorporées dans le lait au même moment que les cultures lactiques du ferment. Elles doivent donc résister aux étapes de fabrication, allant de la fermentation à l’entreposage du yogourt. Dans le yogourt, les facteurs environnementaux ayant le plus d’influence sur les cultures microbiennes sont la température, le pH et l’acidité, l’oxygène et les nutriments.
14
1.3.2.2.1 La température
La température à un impact important sur le métabolisme bactérien. Ce dernier atteint une vitesse maximale à la température optimale de la souche. Une température trop basse peut ralentir l’activité métabolique jusqu’à l’arrêt complet, alors qu’une température trop élevée peut mener à la dénaturation des protéines de la cellule et causer la mort (Lacasse, 2002).
Traditionnellement, la température de fermentation du yogourt se situe autour de 42°C pour favoriser l’activité métabolique des cultures du ferment (Robinson et al., 2007). Cela représente une moyenne des températures optimales de croissance de S. thermophilus et L. bulgaricus qui peuvent varier respectivement de 35°C à 42°C et 43°C à 46°C selon les souches (Beal et al., 1989; Radke-Mitchell & Sandine, 1986). Des souches probiotiques thermophiles, qui sont résistantes et métaboliquement actives à une telle température, peuvent être utilisées. Dans le cas où une souche probiotique mésophile serait employée, la température de fermentation peut être abaissée autour de 40°C pour ainsi améliorer sa survie sans trop ralentir le métabolisme de L. bulgaricus (Kailasapathy & Chin, 2000). Par contre, une température plus basse diminue l’activité métabolique des cultures du ferment du yogourt, ce qui allonge la durée de la fermentation (Beal et al., 1989). La croissance et la survie des probiotiques à différentes températures de fermentation varient grandement selon l’espèce et la souche (Ostlie et al., 2005).
Dans le yogourt, les cultures probiotiques sont également confrontées aux températures de réfrigération. Elles doivent ainsi résister à un changement important de température et à une longue période d’entreposage à 4°C. La survie des souches probiotiques reste tout de même meilleure à température de réfrigération qu’à température pièce (Gardiner et al., 2000).
1.3.2.2.2 Le pH
Les bactéries ont également un pH optimal et des seuils de tolérances qui influencent leur activité métabolique. Les conditions de pH pour la croissance optimale de S. thermophilus et de L. bulgaricus sont respectivement de 6.5 et 5.8 (Beal et al., 1989). Ainsi, le pH initial du lait, près de 6.6, favorise initialement la croissance de S. thermophilus. Durant la fermentation, la production d’acide lactique
15
par les bactéries du ferment abaisse le pH du lait jusqu’à environ 4.5, rendant ainsi les conditions plus favorables à L. bulgaricus en fin de fermentation. La baisse du pH peut même se poursuivre lors de l’entreposage (Beal et al., 1989; Dave & Shah, 1998). Par ailleurs durant l’entreposage, les lactobacilles peuvent généralement tolérer des valeurs de pH plus faibles que les bifidobactéries mais, encore une fois, cela varie grandement selon les espèces et les souches (Andriantsoanirina et
al., 2013; Tripathi & Giri, 2014). De plus, l’acide lactique du yogourt a également un effet
antibactérien en lui-même, et peut être néfaste pour les probiotiques en affectant leur croissance et leur activité métabolique (Amrane & Prigent, 1999; Reis et al., 2012; Wang et al., 2015).
1.3.2.2.3 L’oxygène
Les cultures probiotiques ont généralement des exigences réduites en oxygène puisqu’elles sont majoritairement anaérobies facultatives, microaérophiles ou anaérobies strictes. Les deux premiers types peuvent effectuer de la respiration cellulaire ou de la fermentation dépendamment de la présence d’oxygène, alors que les bactéries anaérobies strictes ont uniquement un métabolisme fermentatif (Lacasse, 2002).
L’oxygène peut également être néfaste pour plusieurs bactéries probiotiques, soit en affectant directement les cellules, soit en étant dégradé en dérivés réactifs de l’oxygène tels que les radicaux libres et les peroxydes (Dave & Shah, 1997b). Les bactéries anaérobies strictes, comme les bifidobactéries, sont particulièrement sensibles à la présence d’oxygène puisqu’elles ne possèdent pas les enzymes nécessaires pour dégrader les dérivés toxiques. La présence d’oxygène peut ainsi mener à la mort des cellules. Au contraire, les lactobacilles tolèrent mieux l’oxygène que les bifidobactéries puisqu’ils possèdent des enzymes pour dégrader les dérivés toxiques (Roy, 2005; Talwalkar & Kailasapathy, 2004).
Dans le yogourt, de l’oxygène peut être incorporé lors de certaines étapes de fabrication comme le brassage, mais également durant l’entreposage par perméation au travers des contenants (Damin et
al., 2008; Dave & Shah, 1997a). L’ajout d’antioxydant ou d’enzymes permettant la dégradation des
dérivés toxiques de l’oxygène peut améliorer la survie des probiotiques (Cruz et al., 2012a; Dave & Shah, 1997a).
16
1.3.2.2.4 Les nutriments
Le lait n’est pas un milieu riche en nutriments facilement accessibles. Son glucide principal, le lactose, ne peut être assimilé par toutes les bactéries. C’est pourquoi, les probiotiques utilisés dans les produits laitiers fermentés sont principalement des bactéries lactiques ou des bifidobactéries qui peuvent fermenter le lactose. De plus, le lait comporte très peu de peptides, d’acides aminés et d’acides gras essentiels sous forme libre. Les bactéries doivent donc posséder des protéases ou des lipases pour avoir une croissance abondante (Juillard et al., 1995). Ainsi, les cultures lactiques du yogourt contribuent grandement à la libération de ces nutriments par l’hydrolyse des protéines du lait lors de la fermentation (Beshkova et al., 1998). Ils deviennent alors disponibles pour alimenter la croissance des probiotiques.
1.3.2.3 Les bifidobactéries
Les bifidobactéries font partie du microbiote intestinal humain. Elles représentent le groupe dominant chez les nouveau-nés, mais leur population diminue avec l’âge (Favier et al., 2002; Harmsen et al., 2000; Hopkins et al., 2001; Turroni et al., 2012). Ce sont des bacilles Gram positifs de forme irrégulière, ayant majoritairement un métabolisme anaérobie strict. Ces bactéries sont mésophiles et acido-tolérantes, mais croissent davantage en pH neutre. Toutes les espèces sont en mesure de fermenter le glucose, le galactose et le fructose, et certaines peuvent aussi fermenter le lactose. Cette fermentation se fait via une voie métabolique particulière appelée « Bifid shunt », où les hexoses sont transformés principalement en acide lactique et en acide acétique (Bergey et al., 1984; Gomes & Malcata, 1999; Leahy et al., 2005; Ventura et al., 2004). Les bifidobactéries sont tout de même fastidieuses puisqu’elles ont des besoins spécifiques variables en certains nutriments et facteurs de croissance (Gomes et al., 1998). Cet aspect peut ainsi rendre difficile leur incorporation dans les aliments.
Parmi les souches acceptées par l’Agence Canadienne d’inspection des aliments (ACIA) pour leur utilisation en tant que probiotique, on retrouve les espèces Bifidobacterium adolescentis, B. animalis (Sous-espèces animalis et lactis), B. bifidum, B. breve et B. longum (sous-espèces infantis et
17
1.3.2.3.1 Bifidobacterium longum
L’espèce B. longum a été largement étudiée. Elle fait notamment partie des espèces de bifidobactéries capables de fermenter le lactose (Audy et al., 2010; Champagne et al., 2009) ce qui justifie son utilisation dans les produits laitiers. Plusieurs effets bénéfiques de l’espèce sur la santé ont été démontrés. On retrouve parmi ceux-ci des bienfaits sur la santé intestinale, dont la réduction des diarrhées causées par la prise d’antibiotique et la réduction de l’intolérance au lactose, des effets préventifs du cancer, des effets modulateurs du système immunitaire, et des effets antimicrobiens envers Salmonella enterica ssp. enterica serovar Typhimurium (Jiang et al., 1996; Orrhage et al., 1994; Silva et al., 2004; Singh et al., 1997; Yasui et al., 1992). Les différents effets recensés chez cette espèce peuvent toutefois varier selon la souche.
Dans le yogourt, la croissance de B. longum durant la fermentation et sa survie durant l’entreposage varie grandement d’une étude à l’autre (Abe et al., 2009; Antunes et al., 2005; Gilliland et al., 2002; Odamaki et al., 2011). Cette variation indique une grande sensibilité de l’espèce bactérienne aux conditions environnementales, et suggère également des différences importantes entre les souches.
1.3.2.3.1.1 Bifidobacterium longum ssp. longum R0175
L’une des souches de B. longum documentées dans la littérature est B. longum ssp. longum R0175, une souche d’origine humaine isolée par Lallemand Solutions Santé (Montréal, Qc). Plusieurs propriétés modulatrices du système immunitaire lui ont été attribuées (Masotti et al., 2011; Qiuye et
al., 2016; Wagar et al., 2009). Des études in vivo chez des rats et des humains ont également révélé
plusieurs bienfaits sur la santé à la suite de l’ingestion de B. longum R0175 en combinaison avec la souche Lactobacillus helveticus R0052. Ces études ont notamment démontré des effets modulateurs du système immunitaire ainsi que des effets bénéfiques sur la santé gastro-intestinale, notamment via le maintien de l’intégrité de la barrière et la réduction des symptômes gastro-intestinaux causés par le stress. Des effets psychologiques ont même été prouvés, tels que l’amélioration de l’humeur, la réduction du stress, et l’atténuation du développement de dépression post-infarctus (Arseneault-Breard et al., 2012; Diop et al., 2008; Gilbert et al., 2013; Messaoudi et al., 2011).