Combinaison des hautes pressions hydrostatiques et de
l'ultrafiltration pour générer un nouvel ingrédient
fonctionnel à partir du jaune d'oeuf
Mémoire
Mélanie Giarratano
Maîtrise en sciences des aliments - avec mémoire
Maître ès sciences (M. Sc.)
Combinaison des hautes pressions hydrostatiques et de
l’ultrafiltration pour générer un nouvel ingrédient fonctionnel à
partir du jaune d’œuf
Mémoire
Mélanie Giarratano
Sous la direction de :
Alain Doyen, directeur de recherche
Guillaume Brisson, codirecteur de recherche
Résumé
La phosvitine (45 kDa) de la granule du jaune d’œuf est une phosphoprotéine reconnue pour ses propriétés émulsifiantes. Un traitement de la granule par hautes pressions hydrostatiques (HPH) a récemment permis le transfert de la phosvitine vers le plasma, la fraction soluble diluée. Ainsi, ce projet avait pour objectif d’évaluer les performances du procédé d’ultrafiltration (UF) lors de la concentration du plasma enrichi en phosvitine afin de générer un ingrédient aux propriétés émulsifiantes améliorées. Une pressurisation (400 MPa, 5min) a été appliquée sur une granule (G1) (10 % m/m), afin d’obtenir après centrifugation, une deuxième granule (G2) et un plasma (P2). Le P2 a été ultrafiltré sur une membrane en polyéthersulfone de 10 kDa pour concentrer la phosvitine. La phosvitine a été identifiée et caractérisée dans le P2 pressurisé (1,73 % m/m) et son rétentat d’UF (26,00 % m/m), validant sa rétention totale par la membrane d’UF. Des flux de perméation similaires ont été obtenus durant l’UF, et ce peu importe les conditions, démontrant que la présence de phosvitine n’impacte pas les performances du procédé. Par conséquent, la combinaison des HPH et de l’UF s’est avérée efficace pour la récupération sélective de la phosvitine et sa concentration. Les propriétés émulsifiantes des rétentats (témoin et pressurisé) ont été évaluées. L’émulsion préparée avec le rétentat enrichi en phosvitine était plus stable à la floculation et au crémage. La microscopie confocale à balayage laser a montré un réseau de protéines agrégées dans lequel sont encapsulées les gouttelettes d’huile, dans l’émulsion avec le rétentat enrichi en phosvitine. Le profil protéique de la crème a montré la présence de plusieurs protéines dont la β-phosvitine, suggérant un effet positif de la β-phosvitine sur les propriétés émulsifiantes du rétentat d’UF enrichi en phosvitine par pressurisation et centrifugation de la granule du jaune d’œuf.
Abstract
Phosvitin (45 kDa) from egg yolk granule is a phosphoprotein known for its emulsifying properties. Recently, a high hydrostatic pressure (HHP) treatment on the egg yolk granule, has induced the transfer of phosvitin to the soluble plasma fraction. This project aimed to evaluate the performance of ultrafiltration (UF) treatment for the generation of a fraction enriched in phosvitin, to produce an ingredient with improved emulsifying properties. An HHP treatment (400 MPa during 5 min) was applied to the granule (G1) (10 % w/w), in order to obtain a second granule (G2) and a plasma (P2) after centrifugation. The P2 fraction was ultrafiltered on a 10 kDa-polyethersulfone membrane to concentrate phosvitin. Phosvitin was identified and characterized in pressure-treated fraction P2 (1.73 ± 0.07% w/w) as well as in its corresponding UF retentate (26.00 ± 4.12% w/w) validating its total retention by the membrane. Similar permeation fluxes were obtained during UF, regardless of the conditions, demonstrating that the presence of phosvitin does not affect the performance of the process. Therefore, the combination of HHP and UF represents an interesting processing for the recovery and the concentration of phosvitin.The emulsifying properties of both retentates (control and pressure-treated) were evaluated. The emulsion prepared with the phosvitin-enriched retentate was more stable to flocculation and creaming. Confocal laser scanning microscopy showed a network of aggregated protein similar to a gel, which encapsulated oil droplets in emulsion made with UF retentate of pressure-treated plasma. SDS-PAGE profiles of the proteins recovered in the washed cream fraction showed the presence of several proteins, including β-phosvitin. Overall, the phosvitin enriched UF concentrate obtained from the plasma of pressurized egg yolk granule show better emulsifying properties than the plasma control suggesting a positive effect of β-phosvitin on the emulsifying properties.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des figures ... viii
Liste des tableaux ... ix
Liste des abréviations, sigles, acronymes ... x
Remerciements ... xi
Avant-propos ... xiii
Introduction ... 1
Chapitre 1 : Revue de littérature ... 3
1. Le jaune d’œuf ... 3
1.1. Composition ... 3
1.2. Fractionnement ... 4
2. La phosvitine ... 5
2.1. Structure ... 5
2.2. Capacités de liaisons des minéraux ... 6
2.3. Propriétés biologiques et fonctionnelles ... 7
2.3.1. Activité antioxydante ... 7
2.3.2. Impact sur la biodisponibilité du calcium ... 7
2.3.3. Activité antimicrobienne ... 7
2.3.4. Activité antiproliférative ... 8
2.4. La phosvitine comme agent émulsifiant ... 8
2.4.1. Généralités sur les émulsions ... 8
2.4.2. Activité émulsifiante ... 10
2.5. Techniques d’extraction et de purification ... 11
3. Les hautes pressions hydrostatiques ... 12
3.1. Principe et utilisation en industrie alimentaire ... 12
3.2. Effets sur les protéines alimentaires ... 14
3.3. Études réalisées sur les protéines de l’œuf ... 14
4. Les procédés baromembranaires... 16
4.2. Caractéristiques de l’ultrafiltration ... 18
4.3. Utilisation de l’UF pour la concentration et la purification de la phosvitine ... 19
Chapitre 2 : Hypothèse et objectifs ... 20
1. Hypothèse ... 20
2. Objectifs ... 20
Chapitre 3 : Combination of high hydrostatic pressure and ultrafiltration to generate a new functional ingredient from egg yolk ... 21
Résumé ... 21
Abstract ... 22
1. Introduction ... 23
2. Materials and methods ... 25
2.1. Granules preparation ... 25
2.2. High hydrostatic pressure treatment ... 25
2.3. Ultrafiltration ... 27
2.4. Compositional analysis ... 27
2.4.1. Quantification of phosvitin ... 27
2.4.2. Protein profiles by SDS-PAGE ... 27
2.4.3. Proteomic analysis... 28
2.5. Determination of emulsifying properties ... 28
2.5.1. Emulsion preparation ... 28
2.5.2. Particle size distribution ... 28
2.5.3. Creaming index... 29
2.5.4. Protein profiles of emulsion fractions ... 29
2.5.5. Confocal laser scanning microscopy ... 29
2.6. Statistical analysis ... 29
3. Results and discussion ... 30
3.1. Ultrafiltration performance ... 30
3.2. Impact of HHP and UF on egg-yolk fractions composition ... 30
3.2.1. Protein and lipid composition ... 30
3.2.2. Protein profiles ... 32
3.2.3. Mineral composition ... 33
3.2.4. Phosvitin analysis ... 34
3.3.1. Particle size distribution ... 38
3.3.2. Creaming index... 40
3.3.3. Protein profiles of emulsion fractions ... 40
3.3.4. Confocal laser scanning microscopy ... 41
4. Conclusion ... 42
Chapitre 4 : Discussion générale ... 44
Conclusion générale et perspectives ... 47
Liste des figures
Figure 1 : Composition des fractions plasma et granule du jaune d'œuf (Anton & Gandemer, 1997) ... 4 Figure 2 : Schéma de la granule du jaune d'œuf (Naderie et al, 2017a) ... 5 Figure 3 : Représentation schématique de la phosvitine (Huopalahti et al, 2007) ... 6 Figure 4 : Représentation des phénomènes de déstabilisation d'une émulsion (adaptation de http://www.agir-crt.com/blog/les-mecanismes-destabilisation-emulsions/ ) ... 9 Figure 5 : Schéma d'un appareil à hautes pressions hydrostatiques et son principe
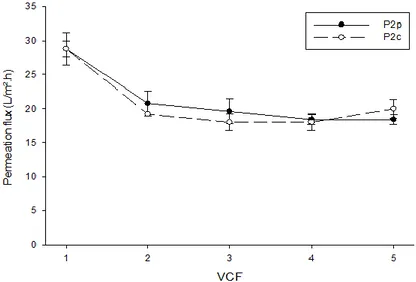
(http://www.idmer.com/idmer-hautes-pressions-conservation/) ... 13 Figure 6 : Les différents procédés baromembranaires (adapté de Bazinet et Castaigne, 2011) ... 16 Figure 7 : Experimental design for production of the different fractions resulting from the high hydrostatic pressure (HHP) treatment of egg yolk granule, and the concentration of the resulting plasma by ultrafiltration (UF). ... 26 Figure 8 : Permeation flux obtained during ultrafiltration (UF) of control and pressure-treated egg yolk plasmas at different volume concentration factor (VCF). P2C: control plasma, P2P: pressure-treated plasma. ... 30 Figure 9 : Protein profiles of control and pressure-treated fractions of egg yolk obtained by SDS-PAGE. Pvt Std : commercially phosvitin standard, G1: initial granule, G2C: control granule, P2C: control plasma, G2P:
pressure-treated granule, P2P: pressure-treated plasma, PmC: control permeate, RC: control retentate, PmP: pressure-treated permeate, RP: pressure-treated retentate. ... 33 Figure 10 : Chromatograms obtained by FPLC for control and pressure-treated plasma, retentate and
permeate fractions. P2C: control plasma, P2P: pressure-treated plasma, PmC: control permeate, PmP:
pressure-treated permeate, RC: control retentate, RP: pressure-treated retentate. ... 37 Figure 11 : Distribution size of oil droplets of control (a) and pressure-treated (b) at 0h after emulsion
preparation, without SDS (blue line) and with addition of SDS (green line). ... 39 Figure 12 : The volume frequency distribution (d[4,3]) of control and pressure-treated emulsion 0 h, 4 h and 24 h after emulsion preparation. ... 39 Figure 13 : Protein profiles by SDS-PAGE of cream and aqueous phases of control and pressure treated emulsions. Pvt Std: commercially phosvitin standard, 1: control emulsion, 2: control aqueous phase, 3:
pressure-treated emulsion, 4: pressure-treated aqueous phase, 5: control cream, 6: pressure-treated cream.41 Figure 14 : Images obtained by confocal laser scanning microscopy of control (a) and pressure-treated (b) emulsions made of retentates and labelled by Fast Green and Nile Red to observe proteins and fat,
Liste des tableaux
Tableau 1 : Poids et pourcentages des différentes parties pour un œuf de poule de 60 grammes (Nau et al,
2010) ... 3
Tableau 2 : Tableau récapitulatif sur la fixation des ions par la phosvitine (Nau et al, 2010) ... 6
Table 3 : Protein and lipid contents of control and pressure-treated fractions of egg yolk. ... 31
Table 4 : Phosphorus and iron contents of control and pressure-treated fractions of egg yolk. ... 34
Table 5 : Phosvitin content of control and pressure-treated fractions of egg yolk. ... 36
Liste des abréviations, sigles, acronymes
5-MTHF : 5-methyltetrahydrofolateFCV : Facteur de concentration volumique
FPLC : De l’anglais « Fast protein liquid chromatography » G : Granule
H : Heure ou de l’anglais « hour »
HDL : De l’anglais « high density lipoprotein » ou lipoprotéine de haute densité
HPH / HHP : Haute pression hydrostatique ou de l’anglais « high hydrostatic pressure » ICP-OES : De l’anglais “Inductively coupled plasma - optical emission spectrometry” kDa : Kilodalton
LC-MS/MS : Chromatographie liquide couplée à la spectrométrie de masse LDL : De l’anglais « low density lipoprotein » ou lipoprotéine de basse densité M : Mole
Min : Minute MPa : Mégapascal
MS : De l’anglais « mass spectrometry » ou spectrométrie de masse mV : millivolt
P : Plasma
PES : Polyéthersulfone pH : Potentiel Hydrogène
Pm : perméat ou de l’anglais « permeate » PTM : Pression transmembranaire R : rétentat ou de l’anglais « retentate »
SDS-PAGE : De l’anglais « sodium dodecylsulfate polyacrylamide gel electrophoresis » ou électrophorèse sur gel de polyacrylamide avec du dodécylsulfate de sodium
UF : Ultrafiltration
VCF : De l’anglais « volume concentration factor » v/v : Volume sur volume
Remerciements
Je tiens tout d’abord à remercier mon directeur de recherche Dr. Alain Doyen qui m’a proposé ce projet de maitrise et m’a accueillie dans son équipe, une équipe dynamique où l’entraide est de mise. Alain est très motivant et nous pousse à toujours donner le meilleur de nous-même. Il est toujours disponible pour répondre à nos questions et nous diriger en cas de doutes. Il nous accorde sa confiance et nous encourage à approfondir notre réflexion. Ces deux années de maitrise au sein de l’équipe d’Alain ont su me donner confiance en moi et en mes capacités, et j’en suis très reconnaissante.
Je tenais également à remercier mon co-directeur Dr. Guillaume Brisson. En plus d’être disponible, d’émettre des idées toujours pertinentes et d’avoir de l’humour, il s’est beaucoup impliqué dans ce projet en m’accompagnant dans mes manipulations au laboratoire.
J’aimerais aussi remercier le Dr. Yves Pouliot, puisqu’en plus d’avoir accepté d’évaluer ce mémoire, c’est très certainement grâce à lui que j’ai poursuivi une maitrise sur ce sujet. En effet, en plus d’être un acteur primordial de ce projet, il a su développer chez moi le goût pour la recherche et les technologies de l’œuf, lors d’un stage réalisé dans le cadre de mes études au Cégep, il y a plus de cinq ans maintenant.
Je tiens à remercier Pauline Duffuler, ma collègue dans ce projet de recherche. Nous avons beaucoup trimé, mais ensemble nous avons toujours réussi à surmonter les difficultés. Merci à toi d’avoir toujours été présente pour m’aider. Je te souhaite le meilleur dans la poursuite de tes projets à Edmonton.
Je remercie aussi Julien Chamberland, qui m’a beaucoup aidé dans la rédaction de mon article scientifique. Il a toujours été disponible et m’a donné de très bons conseils.
Je voudrais remercier les Dr. Nassim Naderi, Dr. Alice Marciniak et Dr. Shyam Suwal, d’être toujours disponibles pour aider au laboratoire et donner de précieux conseils. Ils sont toujours de bonne humeur et prêts à aider les autres membres de l’équipe. Même si aujourd’hui ils ne font plus partie de la team Doyen et ont poursuivi leur chemin dans les quatre coins du globe, nous pensons toujours à eux.
Je remercie tout le personnel technique Diane Gagnon, Sophie Fortin, Mélanie Martineau, Pascal Lavoie et plus particulièrement Véronique Perreault. Tous ont été d’une aide précieuse au laboratoire et ont toujours été de très bon conseil.
Un grand merci aussi à mes parents et à mon frère qui m’ont toujours soutenue dans tout ce que j’ai entrepris. Même s’ils ne sont pas avec moi, ils m’envoient tout leur soutien et sont toujours présents qu’importe le décalage horaire. Merci à mes amies Victoire, Aurore, Noémie et Olivia, ma deuxième famille, qui ont été présentes tout
au long de ma maitrise, dans les bons et les mauvais moments. Et enfin merci à mon compagnon M’hamed, qui a toujours cru en moi et qui réussit à me motiver au quotidien.
Finalement, je tiens à remercier la Fédération des producteurs d’œufs du Québec, d’avoir aidé au financement de ce projet de recherche.
Avant-propos
Ce mémoire est composé de cinq chapitres. L’ensemble de ce projet a été réalisé au département des Sciences des Aliments de la Faculté des Sciences de l’Agriculture et de l’Alimentation à l’Université Laval, sous la direction du Dr. Alain Doyen et la codirection du Dr. Guillaume Brisson.
Le premier chapitre est composé d’une introduction générale et de la revue de littérature dans laquelle l’état des connaissances sur le jaune d’œuf et la phosvitine, ainsi que sur les technologies à hautes pressions hydrostatiques et d’ultrafiltration appliquées. Plus précisément, la composition de la granule du jaune d’œuf et l’effet des HPH sur cette granule sont détaillés. Également, les problématiques reliées à l’extraction de la phosvitine, une protéine d’intérêt de la fraction granulaire, sont énumérées. Enfin, le procédé d’ultrafiltration pour la concentration de la phosvitine est présenté.
Le deuxième chapitre présente l’hypothèse de recherche et les trois objectifs spécifiques proposés pour y répondre.
Le troisième chapitre constitue l’article scientifique intitulé « Combination of high hydrostatic pressure and ultrafiltration to generate a new functional ingredient from egg yolk » rédigé au cours de la maîtrise et qui sera soumis dans le journal Food Chemistry. Cet article regroupe les résultats principaux des expérimentations menées pendant ce projet, ainsi que les discussions qui en émanent. Mélanie Giarratano est le premier auteur et les co-auteurs sont Pauline Duffuler, Julien Chamberland, Yves Pouliot, James D. House, Guillaume Brisson et Alain Doyen, qui ont participé à la planification et à la révision de l’article.
Le quatrième chapitre consiste en une discussion générale du projet.
Enfin, la dernière partie de ce mémoire présente une conclusion générale et expose des perspectives afin d’approfondir les résultats obtenus, et peut-être amener une suite au projet.
Introduction
Avec 7,8 milliards d’œufs produits en 2017, la production de cet aliment au Canada représente une part importante de son économie. L’Ontario et le Québec sont les deux plus importantes provinces productrices d’œufs : leurs activités contribuent à un demi-milliard de dollars au PIB du Canada (Producteurs d’œufs du Canada, 2017). Au Québec, 1,5 milliard d’œufs ont été produits durant l’année 2018-2019, dont 22% ont été transformés en divers produits finis. La transformation de cet aliment est d’intérêt majeur puisque, depuis 2010, le pourcentage d’œufs transformés augmente progressivement (+9%) (Fédération des producteurs d’œufs du Québec, 2018).
L’œuf est un aliment populaire et dont la valeur nutritionnelle est particulièrement intéressante. Cet aliment représente une source de protéines et de lipides insaturés de haute qualité nutritionnelle. Les constituants de l’œuf, notamment les protéines, sont également d’excellents ingrédients en lien avec leurs propriétés moussantes, gélifiantes et émulsifiantes, notamment pour la confection de sauces ou de crèmes. Plus précisément, le jaune d’œuf est un ingrédient très répandu en industrie pour la confection de sauces grâce à ses propriétés émulsifiantes reconnues (Vincent et al, 1966; Davey et al, 1969; Dyer-Hurdon et Nnanna, 1993, Mine, 1998).
Le jaune d’œuf est constitué de deux fractions : les granules insolubles dans un plasma soluble. Les granules sont composées à 70% de HDLs, à 16% de phosvitine et à 12% de LDLs. Le plasma est composé à 85% de LDLs et à 15% de livétines (Powrie et Nakai, 1986). Il a été démontré qu’une centrifugation de 1000 g pendant 30 min permet de séparer les deux fractions du jaune d’œuf (McBee et Cotterill, 1979). Si la microstructure et la composition des granules ont beaucoup été étudiées pour leurs propriétés fonctionnelles et leur richesse en molécules d’intérêt, la composition et les propriétés du plasma ont fait l’objet d’un nombre limité d’études.
La phosvitine est une phosphoprotéine contenue dans la granule du jaune d’œuf et présente une structure linéaire due à la présence de nombreuses fonctions phosphosérines (Joubert et Cook, 1958; Damodaron et Xu, 1996; Dickinson et al, 1997). Cette protéine a déjà fait l’objet d’études en lien avec ses propriétés émulsifiantes intéressantes (Chung et al, 1991 et 1992; Dickinson et al, 1992; Aluko et Mine 1997; Castellani et al, 2004, Chen et al, 2011; Li et al, 2018). Récemment, deux études réalisées par Naderi et al. (2017a et 2017b) ont porté sur l’application de hautes pressions hydrostatiques (HPH) sur le jaune d’œuf et la granule. Le procédé utilisant les HPH est non-thermique et est utilisé principalement en industries alimentaires depuis les années 1990 pour augmenter la durée de vie de divers aliments. Ce procédé est également à l’étude pour l’extraction d’une large gamme de molécules d’intérêt (Shouqin et al, 2005; Jun, 2006 et 2009; Corrales et al, 2008; Jun et al, 2009; Galanakis, 2012; Pinela et al, 2017; Naderi et al, 2017; Marciniak et al, 2018). L’application de HPH sur le jaune et la granule a engendré une déstructuration majeure du réseau granulaire. En effet, la phosvitine, initialement
présente dans la granule, a été détectée dans la fraction plasma après centrifugation du jaune et de la granule pressurisés. Une étude du profil protéique a montré que l’intensité de la bande de phosvitine semblait être plus élevée suite à un traitement de 600 MPa pendant 10 minutes sur la granule (Naderi et al, 2017b). Peu sensible aux traitements par HPH grâce à sa structure linéaire, la phosvitine préserverait l’ensemble de ses propriétés fonctionnelles. De ce fait, il serait donc intéressant d’investiguer sur le mécanisme régissant le transfert de la phosvitine dans le plasma après pressurisation ainsi que sur ses propriétés émulsifiantes.
Cependant, la phosvitine étant très diluée dans le plasma issu de la pressurisation du jaune d’œuf, une étape de concentration est nécessaire. Une étude précédente de Chay Pak Ting et al. (2010) a porté sur la concentration de la phosvitine extraite du jaune d’œuf par ultrafiltration (UF). Lors de ce procédé, les membranes en polyéthersulfone (PES) de seuil de coupure de 10 et 30 kDa ont retenu 84% de la phosvitine dans le rétentat, et ont augmenté son taux de pureté. Comparativement à cette étude, notre projet porte sur spécifiquement sur la fraction plasma du jaune d’œuf générée après pressurisation hydrostatique de la granule. Par conséquent, il devient nécessaire d’optimiser le procédé d’UF sur cette matrice.
Dans ce contexte, le but de cette étude est de concentrer le plasma généré après pressurisation de la granule du jaune d’œuf par un procédé d’UF optimisé afin de produire un ingrédient enrichi en phosvitine, aux propriétés émulsifiantes intéressantes. Pour cela, le plasma sera caractérisé après le traitement aux hautes pressions hydrostatiques et après sa concentration par UF, les performances de filtration seront évaluées et les propriétés émulsifiantes du plasma généré seront déterminées.
Chapitre 1 : Revue de littérature
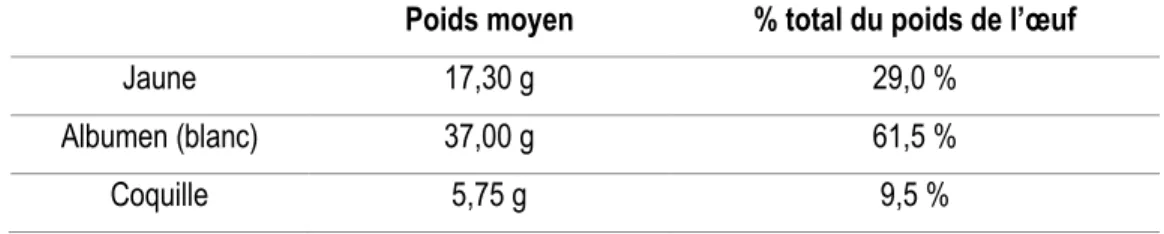
L’œuf de poule est composé de la coquille, de l’albumen et du jaune. Chacun de ces éléments représente en moyenne respectivement 9,5%, 61,5% et 29% du poids de l’œuf entier. Le tableau 1, présenté ci-dessous, résume les poids et pourcentages moyens de chaque constituant pour un œuf de 60 grammes.
Tableau 1 : Poids et pourcentages des différentes parties pour un œuf de poule de 60 grammes (Nau et al, 2010)
Poids moyen % total du poids de l’œuf
Jaune 17,30 g 29,0 %
Albumen (blanc) 37,00 g 61,5 %
Coquille 5,75 g 9,5 %
La coquille est composée à plus de 98% de carbonate de calcium. Elle constitue une barrière contre les agressions extérieures et la contamination microbienne, et permet les échanges gazeux entre le milieu extérieur et l’embryon, du fait de sa structure poreuse. L’albumen est une solution aqueuse (88%) contenant majoritairement des protéines (11%), mais aussi quelques glucides (1%) (Nau et al, 2010). Ces protéines ont une haute valeur nutritive du fait de leur richesse en acides aminés essentiels. Également, ce sont des protéines aux propriétés fonctionnelles remarquables. Ainsi, l’ovalbumine, le lysozyme, l’ovomucine et les globulines ont démontré des propriétés moussantes (Britten et Lavoie, 1992; Kitabatake et Doi, 1988; MacDonnell et al, 1955; Mine, 1995; Poole et al, 1984). L’ovalbumine et l’ovotransferrine participent largement aux propriétés gélifiantes de l’albumen (Nau et al, 2010). Le lysozyme est reconnu pour ses propriétés antimicrobiennes, et est utilisé dans les aliments comme agent de conservation (Cunningham et al, 1991; Losso et al, 2000). Le blanc d’œuf est par conséquent un ingrédient alimentaire incontournable pour l’ensemble des propriétés citées. Le jaune d’œuf, qui est le sujet principal de l’étude, est décrit plus en détail dans la section suivante.
1.
Le jaune d’œuf
1.1. Composition
Le jaune d’œuf qui baigne dans l’albumen, est entouré de la membrane vitelline ce qui empêche la dilution du jaune dans le blanc. C’est une matrice très concentrée puisqu’elle contient près de 50% d’extrait sec. Le jaune d’œuf est majoritairement composé de lipides (30%), mais contient également de protéines (16%) et quelques glucides et minéraux (Powrie et Nakai, 1986). Parmi les lipides, des triglycérides (62%), des phospholipides (33%), du cholestérol (5%) et moins de 1% de caroténoïdes sont retrouvés. Les acides gras qui
composent les triglycérides sont majoritairement monoinsaturés. Cependant la teneur en divers acides gras peut grandement changer du fait de l’alimentation de la poule. Pour ce qui est des protéines, les livétines, qui font parties de la famille des immunoglobulines, et la phosvitine sont principalement présentes. La totalité des lipides et la plupart des protéines sont liés entre eux pour former des lipoprotéines soit de basse densité (LDLs), soit de haute densité (HDLs), représentant respectivement 66% et 16% de la matière sèche du jaune d’œuf. Les LDLs ont été identifiées comme les composants majeurs responsables des propriétés émulsifiantes du jaune d’œuf. Il a été démontré que c’est la partie protéique de ce complexe qui joue un rôle majeur dans la stabilisation des émulsions, en s’absorbant à l’interface, tandis que les lipides s’orientent vers la phase continue (Vincent et al, 1966; Davey et al, 1969; Dyer-Hurdon et Nnanna, 1993, Mine, 1998).
1.2. Fractionnement
Le jaune d’œuf est une matrice complexe constituée d’agrégats protéiques non-solubles (granule) en suspension dans un fluide soluble (plasma). Ces deux fractions peuvent être séparées par une centrifugation de 10000
×
g pendant 30 minutes (McBee et Cotterill, 1979). La figure 1, présentée ci-dessous, montre le fractionnement du jaune d’œuf et la composition de ses fractions.Le plasma est la fraction soluble du jaune d’œuf et représente 75 à 85% de sa masse sèche. Il est composé de deux composés principaux; soient les LDLs et les livétines. (Powrie et Nakai, 1986). La majorité des caroténoïdes est également contenue dans le plasma et lui donne sa couleur jaune orangé. De plus, par sa richesse en LDLs, le plasma présente des propriétés émulsifiantes plus intéressantes que la fraction granulaire (Anton et Gandemer, 1997).
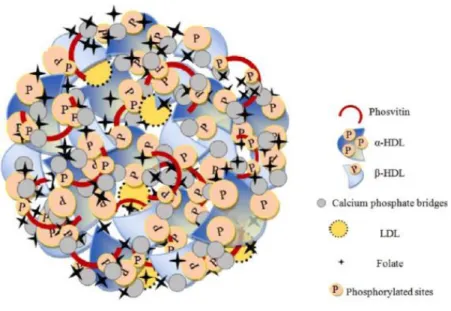
La granule représente la fraction non soluble du jaune d’œuf et compte pour 20 à 25% de sa matière sèche. Elle est constituée de HDLs, de phosvitine et de LDLs résiduelles (LDLg) (Powrie et Nakai, 1986) dont l’ensemble forment des sphères de 0.3 à 2 µm de diamètre (Chang, Powrie et Fennema, 1997). Les HDLs et la phosvitine sont reliés entre eux par des ponts phosphocalciques, entre les groupements phosphates des HDLs
Jaune d’œuf 70% HDLs Granule (20 à 25%) Plasma (75 à 85%) 16% Phosvitine 15% Livétines 85% LDLs 12% LDLg Centrifugation 10000g x 30min
et les résidus phosphosérines de la phosvitine, par des ions calcium divalents (Causeret et al, 1992), rendant ainsi la structure granulaire très compacte et peu hydratée (voir figure 2). Des pH acides (inférieurs à 3,5) ou basiques (supérieurs à 7,2), permettent la solubilisation des granules de façon réversible puisque si le pH est ramené proche de la neutralité, la granule retrouve une faible solubilité (Causeret et al, 2012). L’augmentation de la force ionique permet également de dissocier les granules. En effet, l’ajout d’une quantité importante de cations monovalents, notamment le Na+ va permettre le déplacement des ions calcium, brisant les ponts phosphocalciques entre les HDLs et la phosvitine (Chang et al, 1977; Causeret et al 1991; Anton et Gandemer, 1997). À une concentration de plus de 0,58 M de NaCl, les granules sont entièrement solubilisées (Causeret et al, 1992).
Figure 2 : Schéma de la granule du jaune d'œuf (Naderie et al, 2017a)
2. La phosvitine
2.1. Structure
La phosvitine est une phosphoprotéine de la granule du jaune d’œuf représentant 4% de la matière sèche du jaune d’œuf (Joubert et Cook, 1958). Elle est issue, avec les HDLs, du clivage d’un précurseur; la vitellogénine II (Byrne et al, 1984). La phosvitine se retrouve sous deux isoformes, qui sont en fait des agrégats de polypeptides : la α-phosvitine (160kDa) et la β-phosvitine (190kDa) (Itoh et al, 1983). Ces isoformes sont composés de 3-4 sous-unités de 35-40 kDa pour la α-phosvitine et de 4-5 sous-unités de 45 kDa (Anton, 2007). C’est une protéine hautement phosphorylée puisque 57% de ses acides aminés sont des sérines (123 résidus phosphoséryles pour 217 résidus d’acides aminés) dont 90% sont phosphorylées. Cette particularité en fait la protéine la plus phosphorylée dans la nature (Clark, 1985). L’isoforme α contient 3% de phosphore comparé à
10% pour l’isoforme β (Abe et al, 1982). Les phosphosérines sont regroupées les unes à la suite des autres en formant des blocs au centre de la molécule, ce qui lui confère un centre très hydrophile et une charge fortement négative de -179 mV à pH neutre. Cet arrangement conduit à la présence de fortes répulsions électrostatiques, ce qui empêche la phosvitine de se replier sur elle-même, et lui donne une structure linéaire. Seul 10% de ces acides aminés sont hydrophobes et se répartissent aux extrémités N-terminale et C-terminale (Damodaron et Xu, 1996; Dickinson et al, 1997). La protéine est très stable aux traitements thermiques et aux traitements de pressions, très certainement grâce à sa structure linéaire (Castellani et al, 2003). La figure 3 ci-dessous présente de façon schématique une molécule de phosvitine et les éléments qui la caractérisent.
Figure 3 : Représentation schématique de la phosvitine (Huopalahti et al, 2007)
2.2. Capacités de liaisons des minéraux
Grâce à ses nombreux résidus phosphosérines, la phosvitine est reconnue pour lier fortement les ions métalliques, et en particulier le fer (Hegenaeur et al, 1979). Dans l’œuf, 95% du fer est lié à la phosvitine, jusqu’à 115 mg de fer peuvent se fixer par mg de phosvitine. Dans le jaune d’œuf, la protéine n’est cependant pas saturée en ion ferrique, possédant ainsi la capacité de lier d’autres molécules de fer ou divers cations divalents. La fixation du fer est facilitée à pH neutre et à faible force ionique ; les phosphates sont complètement ionisés et il n’y a pas de sels pour compétitionner avec la fixation du fer. (Albright et al, 1984; Castellani et al, 2005). Les autres cations pouvant interagir avec la phosvitine sont les ions calcium, magnésium, manganèse ou cobalt (Grizzuti et Perlmann, 1973; Causeret et al, 1992) (Tableau 2).
Tableau 2 : Tableau récapitulatif sur la fixation des ions par la phosvitine (Nau et al, 2010)
Ion Ca2+ Ion Mg2+ Ion Fe3+ Ion Mn2+ Ion Co2+
Moles d’ions fixés par mole de phosvitine
127 103 72 113 120
2.3. Propriétés biologiques et fonctionnelles
2.3.1. Activité antioxydante
La capacité de la phosvitine à lier le fer lui confère une activité antioxydante dépendante du pH et de la température ; des pH acides et des traitements thermiques intenses diminuent son activité antioxydante (Lu et Baker, 1987). Cependant, Castellani et al, 2003 ont montré que la phosvitine est capable de lier le fer même après des traitements thermiques et de pression élevés (90°C et 600 MPa), ce qui suggèrerait que même dans des conditions extrêmes, la protéine conserve une activité antioxydante intéressante. Le complexe phosvitine-fer peut notamment inhiber l’oxydation des lipides dans la viande et les émulsions. Jung et al (2013), ont mis en évidence que l’ajout de phosvitine couplé à un traitement à HPH sur du bœuf haché, avait un effet antioxydant sur les lipides et les protéines de la viande, mais aussi un effet bactéricide (Jung et al, 2013). Également, la phosvitine couplée à un polyphénol peut réduire l’oxydation des lipides dans les fines émulsions obtenues par un homogénéisateur à hautes pressions (Duan et al, 2016). Finalement, Xu et al (2007), ont montré que les phosphopeptides issus de l’hydrolyse enzymatique de la phosvitine possédaient une activité antioxydante plus importante que la phosvitine non hydrolysée dans un système modèle d’acide linoléique (Xu et al, 2007).
2.3.2. Impact sur la biodisponibilité du calcium
Plusieurs études ont démontré que la phosvitine et les phosphopeptides de phosvitine permettent une amélioration de la biodisponibilité du calcium dans l’intestin et de l’absorption du calcium par les os (Jiang et Mine 2000, Choi et al 2004, Ren et Li 2015, Zhang et al 2015). Jiang et Mine (2015) ont prouvé que les phosphopeptides de phosvitine permettaient une meilleure capacité à lier le calcium et à inhiber la formation de phosphate de calcium, comparativement aux phosphopeptides de caséine (Jiang et Mine, 2015). Également, la phosvitine contient beaucoup plus de phosphosérines que la caséine (123 résidus contre 15 résidus), or les résidus phosphosérines issus des phosphopeptides de caséine ont démontré une efficacité pour augmenter la densité osseuse et améliorer la solubilisation du calcium dans l’intestin (Ren et al, 2015). Par ailleurs, les phosphopeptides issus de la phosvitine du jaune d’œuf réduiraient le stress oxydatif des cellules épithéliales de l’intestin, dans un essai in vitro (Katayama et al, 2006).
2.3.3. Activité antimicrobienne
Sattar Khan et al. (2000) ont démontré que la phosvitine joue un rôle antimicrobien contre Escherichia coli. En effet, après un traitement de 20 minutes à 50°C en présence de phosvitine, E.coli a été entièrement inhibée. La phosphoprotéine agit en tant qu’antimicrobien en captant les cations de la paroi cellulaire de la bactérie causant des dommages cellulaires irréversibles. De plus, il a été suggéré que l’application d’un traitement thermique permettrait d’accélérer ce phénomène (Sattar Khan et al, 2000).
2.3.4. Activité antiproliférative
Des études récentes ont également montré que la phosvitine pourrait être intégrée dans la formulation de produits cosmétiques comme inhibiteur de la mélanogénèse. La phosvitine permet en effet d’inhiber l’activité de la tyrosinase et la synthèse de mélanine qui en excès peuvent causer une hyperpigmentation de la peau (Jung et al 2012, Liu et al 2017, Pillaiyar et al 2017).
Hormis l’ensemble des propriétés bioactives citées dans les sections précédentes, plusieurs études ont montré que la phosvitine présente également diverses propriétés fonctionnelles, dont un pouvoir émulsifiant intéressant.
2.4. La phosvitine comme agent émulsifiant
2.4.1. Généralités sur les émulsions
Une émulsion huile dans eau, consiste en la dispersion de gouttelettes d’huile dont le diamètre peut varier entre 100 nm et 100 µm, dans une phase aqueuse (McClements, 2005). Le lait, la crème, la mayonnaise ou la vinaigrette sont des exemples d’émulsions huile/eau couramment rencontrées dans le domaine alimentaire. La formation d’une émulsion se fait en deux étapes. La première consiste à réaliser une pré-émulsion en introduisant la phase lipidique dans la phase aqueuse et en appliquant une première agitation mécanique modérée pour former des gouttelettes de gras entre 10 et 100 µm. À ce stade, la pré-émulsion reste très instable. La deuxième étape consiste en l’émulsification du mélange en appliquant une agitation mécanique plus intense pour l’obtention de gouttelettes de gras de plus petites tailles (une centaine de nm) et donc plus stables (Legrand, 2013). L’agitation mécanique peut être appliquée via des mélangeurs à grandes vitesses, des homogénéisateurs à valves à haute pression dynamique ou des broyeurs colloïdaux (McClements, 2005).
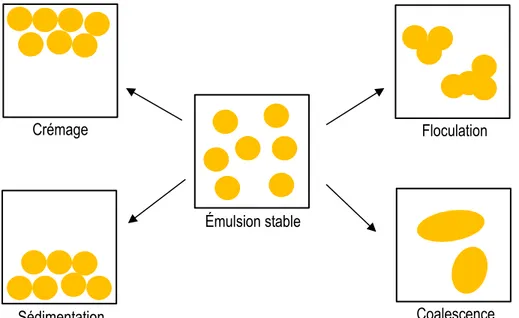
La stabilité d’une émulsion désigne sa capacité à résister aux changements de propriétés dans le temps, et permet d’évaluer sa durée de vie. Il existe quatre types d’instabilités qu’une émulsion peut subir (Figure 4) ; le crémage, la sédimentation, la floculation et la coalescence. Le crémage consiste en la remontée des gouttelettes d’huile à la surface de l’émulsion. La sédimentation consiste au contraire, en la retombée des gouttelettes d’huile au fond de l’émulsion. Le crémage et la sédimentation sont des phénomènes réversibles puisqu’ils n’impactent pas sur la distribution de la taille des gouttelettes. Une faible agitation permet de retrouver l’émulsion initiale. La vitesse de migration des gouttelettes va dépendre de leur taille, de la différence de masse volumique entre les deux phases et de la viscosité de la phase aqueuse. La loi de Stokes permet d’évaluer la vitesse de crémage ou de sédimentation d’une émulsion :
𝑣 =2𝑟
2𝑔𝛥(𝜌)
où v est la vitesse de migration (en m/s), r est le rayon de la gouttelette (en m), g est l’accélération de la pesanteur (en m/s2), Δ(ρ) est la différence de masse volumique entre la gouttelette et la phase aqueuse 9en kg/m3) et η est la viscosité de l’émulsion (en Pa.s). La floculation consiste au regroupement de plusieurs gouttelettes d’huile pour former des flocs. Une émulsion aura tendance à floculer si les gouttelettes rentrent fréquemment en collision et si la barrière de potentiel entre les gouttelettes est faible. Tandis que la coalescence consiste en la fusion irréversible de plusieurs petites gouttelettes d’huile pour en former une nouvelle plus grosse, pouvant mener à la séparation totale des deux phases non-miscibles. Ce phénomène se produit lorsque le film entourant la gouttelette d’huile s’amincit et se rompt (Legrand, 2013).
Pour stabiliser les émulsions, des agents émulsifiants, composés d’une partie hydrophile et d’une partie hydrophobe, sont utilisés. Ils s’adsorbent à l’interface des gouttelettes d’huile, la partie hydrophobe est orientée vers la phase lipidique tandis que la partie hydrophile est orientée vers la phase aqueuse, permettant ainsi de réduire la tension interfaciale entre l’huile et l’eau et maintenir en formation les gouttelettes (McClements, 2005). La phosvitine présente bien ces caractéristiques puisque la protéine a un centre hydrophile et deux extrémités hydrophobes. Castellani et al. (2006) ont d’ailleurs montré que ces extrémités hydrophobes s’adsorbent bien à l’interface des gouttelettes d’huile dans les émulsions huile/eau, ce qui permet sa stabilisation.
Figure 4 : Représentation des phénomènes de déstabilisation d'une émulsion (adaptation de
http://www.agir-crt.com/blog/les-mecanismes-destabilisation-emulsions/ ) Coalescence Floculation Sédimentation Crémage Émulsion stable
2.4.2. Activité émulsifiante
L’activité émulsifiante de la phosvitine a fait l’objet de nombreuses études. La structure flexible de la protéine permet d’exposer ses extrémités hydrophobes et permet la formation d’émulsion. Également, ses résidus phosphates jouent un rôle dans son activité émulsifiante, puisque l’élimination des phosphates entraine une diminution notable de l’activité et de la stabilité émulsifiante (Kato et al, 1987). En 1991 et 1992, Chung et Ferrier ont étudié les effets de différentes conditions physico-chimiques sur les propriétés émulsifiantes de la protéine. Ainsi, il a été mis en évidence que la force ionique diminue l’activité émulsifiante et la stabilité des émulsions contenant de la phosvitine, et qu’au-delà de 0,5M de NaCl il y a coalescence. Le pH a quant à lui induit une légère tendance à augmenter l’activité émulsifiante entre pH 3 et 10. Enfin, cette étude a montré que l’activité et la stabilité des émulsions de phosvitine sont plus grandes avec l’augmentation de la concentration en protéine, de la fraction volumique d’huile et de la combinaison vitesse/temps de mixage (Chung et Ferrier, 1991 et 1992). Aluko et Mine (1997) ont montré que dans les émulsions contenant de la phosvitine, il y a plus de protéines absorbées à l’interface à pH 4 qu’à pH 7 ou 9, car la densité de charge est plus faible rendant la phosvitine plus flexible et facilitant l’absorption de plusieurs molécules autour de la gouttelette d’huile. De plus, le film protéique formé par la phosvitine à pH 4 était plus résistant qu’à pH 7 et 9 puisque les répulsions électrostatiques qui fragilisent le film protéique à l’interface étaient réduites (Aluko et Mine, 1997). Chung et Ferrier en 1991 ont également constaté qu’à pH 4 les émulsions huile dans eau de phosvitine étaient les plus stables. Castellani et al. (2006) ont confirmé que la phosvitine possédait une bonne activité émulsifiante à pH neutre et faible force ionique, et ont également montré qu’elle a une faible absorption à l’interface des gouttelettes d’huile puisque ce sont seulement ces deux extrémités hydrophobes qui s’absorbent à l’interface, ce qui lui permet de garder sa capacité à lier le fer (Castellani et al, 2006). De plus, à pH 6, la phosvitine montre une meilleure activité émulsifiante quand elle est non agrégée, en revanche lorsqu’elle est dans un état agrégé, elle donne des émulsions plus stables à la coalescence (Castellani et al, 2005). La température joue également un rôle sur l’activité émulsifiante, puisqu’un traitement thermique à plus de 65°C pendant 60 min d’une solution de phosvitine à pH 7 mène à la diminution de l’activité émulsifiante de la solution. Également, après un traitement à plus de 70°C pendant 60 min de la même solution, la stabilité de l’émulsion était diminuée de 13% (Chung et Ferrier, 1995). L’ajout d’ions calcium dans les émulsions de phosvitine affecte l’état d’agrégation de la protéine et donc la stabilité de celles-ci (Dickinson et al, 1992). Enfin, plusieurs cycles de congélation-décongélation modifient l’hydrophobicité de surface et la structure secondaire de la phosvitine, ce qui permet d’améliorer son activité émulsifiante (Li et al, 2018).
Cependant, la phosvitine exprime son caractère émulsifiant lorsqu’elle est la seule protéine dans le mélange. En présence d’autres protéines, il y a un effet de compétition qui l’empêche de s’absorber aux interfaces de gouttelettes de gras (Nau et al, 2010). Par conséquent, dans le jaune d’œuf entier, elle a une capacité émulsifiante plus faible puisque ce sont les LDLs qui se placent en majorité aux interfaces, les
interactions étant plus fortes avec les protéines hydrophobes comme les LDLs, qu’avec les protéines hydrophiles comme la phosvitine (Aluko et Mine, 1997; Le Denmat, Anton et Beaumal, 2000).
2.5.
Techniques d’extraction et de purification
La phosvitine est d’intérêt majeur dans les secteurs alimentaires et pharmaceutiques grâce à ses propriétés biologiques et fonctionnelles. Afin de l’utiliser sous forme purifiée, il devient nécessaire de mettre au point des stratégies d’extraction et de purification.
L’extraction de la phosvitine de la granule du jaune d’œuf est réalisée par l’utilisation de chlorure de sodium (NaCl) ou de sulfate d’ammonium ((NH4)2SO4) qui vont briser les ponts phosphocalciques du complexes HDL-phosvitine et vont libérer la phosphoprotéine de la matrice granulaire. Ko et al. (2011) ont réussi à récupérer 72% et 97% de la phosvitine du jaune d’œuf en utilisant du NaCl et du (NH4)2SO4 respectivement. Dans les deux cas, ils ont obtenu des fractions purifiées à 85% en se servant d’éthanol pur à 85% pour éliminer les impuretés (lipides et phospholipides) (Ko et al, 2011). Jung et al. (2013) ont également utilisé du NaCl et du (NH4)2SO4 pour extraire la phosvitine, mais ont ensuite chauffé à 90°C pendant 1h pour retirer les HDLs et LDLs. Ils ont ainsi pu obtenir un rendement de 78% et une pureté de 56%, en utilisant le (NH4)2SO4 combiné à un traitement thermique (Jung et al, 2013).
Ren et Wu, 2015 ont montré que l’utilisation de la chaleur pouvait augmenter la pureté des fractions enrichies en phosvitine, préalablement extraites de la granule par l’utilisation de NaCl à 100g/L. Un chauffage à 90°C pendant 1h a permis d’obtenir une fraction pure à 88%, alors qu’au-delà de 95% la pureté commence à diminuer (Ren et Wu, 2015).
La chromatographie par échange d’anions est également très efficace pour la récupération d’une fraction purifiée en phosvitine. Castellani et al, 2003 ont récupéré la phosvitine de la granule à pH 7,25 en utilisant du NaCl 0,17M, du MgSO4 0.9M et plusieurs étapes de centrifugation ; un rendement de 85% a été atteint. Ils ont ensuite utilisé la chromatographie par échange d’anions pour purifier leur fraction jusqu’à 98% (Castellani et al, 2003). D’autres études ont utilisé la chromatographie par échange d’anions pour obtenir des fractions purifiées en phosvitine ; des taux de pureté de 92,6% à 97,1% ont été obtenus (Lei et Wu, 2011; Ren et Wu, 2014 et 2015).
La filtration sur gel (Clark, 1970; Abe et al, 1982) et les gels d’électrophorèse (Wallace et Morgan, 1986) ont également été testés pour l’isolement de la phosvitine du jaune d’œuf.
Malgré des rendements et des taux de pureté très intéressants, ces méthodes font intervenir des solvants organiques et des produits chimiques, ce qui n’est pas compatible avec une utilisation en alimentaire, ni avec les politiques actuelles sur la préservation de l’environnement et le développement durable. De plus certaines de ces techniques sont longues et couteuses donc difficilement adaptables à l’échelle industrielle. Dans le cadre de ce projet, nous proposons d’utiliser le procédé à HPH pour induire une extraction et purification de la
phosvitine. Dans ce contexte, la section suivante présente le principe de cette technologie et ses effets sur les constituants de l’œuf.
3. Les hautes pressions hydrostatiques
3.1. Principe et utilisation en industrie alimentaire
Les HPH sont appliquées en industrie alimentaire depuis les années 1990, principalement pour la préservation des aliments afin de diminuer la charge microbienne sans altérer drastiquement les propriétés nutritionnelles et organoleptiques, particulièrement dans les produits à base de fruits (Oey et al, 2008; Rivalain et al, 2010; Chawla et al, 2011). Comparativement à un traitement thermique où la montée et la baisse en température peuvent prendre plusieurs minutes, un traitement aux HPH est plus rapide puisqu’il est possible d’appliquer instantanément une pression homogène et uniforme dans l’aliment quel que soit sa forme et son volume. De plus, c’est une technique moins énergivore car le maintien en pression n’implique pas l’ajout d’énergie. Les HPH sont d’ailleurs reconnues comme une technologie clean label, et sont considérés comme l’une des technologies non-thermales les plus prometteuses pour la conservation des aliments (Pereira et Vicente, 2010). Malheureusement, son coût d’achat important et un processus en batch limitent grandement son application en industrie.
Un système à HPH (Figure 5) est composé des éléments majeurs suivants : une cuve de pression, un mécanisme de joug pour sécuriser la cuve pendant le fonctionnement, un intensificateur de pression et une pompe génératrice de pression, un système de chargement et déchargement des aliments et un système de surveillance pour enregistrer les paramètres d’opération. L’aliment est d’abord placé dans un emballage souple, principalement en polymère plastique, et placé dans un cylindre. Le cylindre est ensuite placé dans la cuve de pression qui est remplie avec le fluide transmetteur de pression, le plus souvent de l’eau. La pompe et l’intensificateur de pression vont comprimer le fluide jusqu’à atteindre la pression d’opération. L’aliment est maintenu à cette pression pendant un temps déterminé préalablement. À la fin du cycle, la dépressurisation du système est instantanée et l’aliment est déchargé de la cuve. Lors de la compression, l’aliment va monter en température de 3°C à 9°C par 100 MPa pour les aliments très humides et les aliments riches en lipides respectivement. Après la décompression, l’aliment reprend rapidement sa température initiale. Ce phénomène est particulièrement intéressant pour la pasteurisation et la stérilisation des aliments sans altérer leurs constituants (Balasubramaniam et al, 2016).
Hormis son utilisation comme technologie de pasteurisation à froid des aliments, d'autres applications ont récemment été publiées. L’application des HPH peut réduire, voire inhiber l’allergénicité de certaines protéines alimentaires. La combinaison d’une hydrolyse enzymatique par la pepsine ou la trypsine et des HPH (100, 200, 300 MPa pendant 15 min) sur des hydrolysats de protéines de lactosérum, a permis d’obtenir des peptides dont la réactivité immunochimique était largement diminuée (Penas et al, 2006). De la même manière, la combinaison de l’hydrolyse enzymatique et des hautes pressions (400 et 500 MPa pendant 15 min) a permis de réduire le potentiel allergique du soja, un allergène majeur dans le domaine alimentaire (Meinlschmidt et al, 2017). Des traitements à 200, 400 et 600 MPa pendant 20 min ont tous permis de réduire significativement l’allergénicité de l’hémocyanine, une protéine du sang de certains crustacés (Zhang et al, 2017). Également, l’application d’un traitement de 200 MPa pendant 20 min sur la morue, a conduit à la diminution de son allergénicité (Zhang et al, 2019).
Une production plus efficiente de peptides bioactifs par la combinaison des HPH et de l’hydrolyse enzymatique est également une voie prometteuse, puisque ce couplage augmente le degré d’hydrolyse et la concentration en peptides à activités biologiques comparativement à une hydrolyse enzymatique réalisée à pression atmosphérique ((Zhang et Mu, 2017; Guan et al, 2017; Boukil et al, 2018; Franck et al, 2018; Marie et al, 2018).
Les HPH sont également particulièrement intéressantes pour l’extraction de molécules d’intérêt à haute valeur ajoutée, comme les molécules phénoliques issues de diverses matrices alimentaires (Shouqin et al, 2005; Jun, 2006 et 2009b; Corrales et al, 2008; Galanakis, 2012; Pinela et al, 2017), la caféine issue de la feuille de thé vert (Jun 2009a), l’α-lactalbumine d’une solution modèle de protéines sériques (Marciniak et al, 2018) ou encore l’acide folique du jaune d’œuf (Naderi et al, 2017).
Figure 5 : Schéma d'un appareil à hautes pressions hydrostatiques et son principe (http://www.idmer.com/idmer-hautes-pressions-conservation/)
De plus, les modifications de certains composés, en particulier les protéines, les enzymes et les composés phénoliques, sous l’effet de la pression peuvent mener à l’amélioration de leurs propriétés fonctionnelles dans les aliments (meilleure digestibilité, amélioration de la texture, ralentissement du brunissement enzymatique) (Ashie et Simpson, 1996; Lòpez-Fandino, 2006; Sampedro et al, 2009; Rao et al, 2014; Zhang et al, 2019).
3.2. Effets sur les protéines alimentaires
L’impact des HPH sur une matrice alimentaire repose sur le principe de Le Châtelier, selon lequel tout système en équilibre va se déplacer vers un nouvel équilibre, pour pallier l’impact d’un changement induit (température, concentration ou pression) (Balasubramaniam et al, 2016). L’énergie véhiculée par la pression affecte seulement les liens de faible énergie (liaisons non-covalentes, interactions électrostatiques, liaisons hydrogènes et liaisons hydrophobes). La pression induit une diminution du volume initial qui peut se traduire par la formation d’une nouvelle structure et la dissociation des molécules d’eau (Rivalain et al, 2010). L’application de HPH entraine des modifications sur la structure ordonnée des protéines. En effet, les liaisons hydrophobes, principalement responsables des structures tertiaire et quaternaire des protéines sont déstabilisées à partir de 200 MPa, tandis que les liaisons covalentes, de plus grande énergie, qui stabilisent la structure primaire des protéines, ne sont pas affectées par les niveaux de pression généralement appliqués en industrie (Chawla et al, 2010; Rivalain et al, 2010). L’application de HPH mène donc à la dénaturation totale ou partielle des protéines. La dénaturation et le dépliement des protéines résultent au dévoilement de certaines fonctions, notamment les fonctions thiol libres. Par exemple, après un traitement de pressurisation du lactosérum, la β-lactoglobuline et l’α-lactalbumine forment des agrégats protéiques, suite à la formation de ponts disulfures entre leurs groupes thiol libres (Lòpez-Fandino, 2006; Marciniak et al, 2018). Aussi, sous pression, les molécules d’eau vont pouvoir pénétrer plus ou moins facilement dans les cavités, suite aux bris des liaisons de faible énergie, affectant encore la structure et la conformation de la protéine (Naderi et al, 2017). Généralement, au-delà de 300 MPa, la dénaturation protéique est irréversible (Balasubramaniam et al, 2016). Inévitablement, les HPH mènent donc à des modifications des propriétés fonctionnelles des protéines, qu’elles soient désirées ou non souhaitées. Toutefois l’ampleur de ces changements est propre à la structure de chaque protéine. Également, la température, le pH et la force ionique vont jouer un rôle dans l’ampleur des modifications des protéines par hautes pressions (Balasubramaniam et al, 2016).
3.3. Études réalisées sur les protéines de l’œuf
Dans l’industrie des ovoproduits, des traitements peuvent être appliqués pour augmenter leur durée de vie. La pasteurisation est le traitement le plus couramment utilisé pour diminuer la charge microbienne des ovoproduits, mais les HPH semblent être une alternative intéressante. Santé Canada a d’ailleurs affirmé en
2015, qu’un traitement par les HPH à 600 MPa pendant des durées de 2 à 27 minutes n’avait aucun impact sur la sécurité alimentaire des ovoproduits (Gouvernement du Canada, 2015). L’application des HPH sur les œufs est donc largement étudiée depuis plusieurs années. Wang et al 2016 et Naderi et al 2017c ont recensé dans leurs articles l’ensemble des travaux réalisés sur les œufs et l’impact des HPH sur les constituants de l’œuf. Cette technologie est surtout testée sur les œufs entiers liquides comme alternative à la pasteurisation, pour augmenter leur durée de vie, et diverses études tentent de déterminer quels changements sur les constituants de l’œuf en résultent.
Parmi les protéines du blanc d’œuf, le lysozyme ne semble pas entièrement affecté, puisqu’après un traitement aux HPH, plusieurs formes partiellement dénaturées de la protéine sont observées. Ces changements partiels dans la conformation semblent tout de même inhiber la capacité du lysozyme à cristalliser. L’ovalbumine reste stable à des pressions inférieures à 400 MPa quand elle est en faible concentration. Les HPH dénaturent les protéines du blanc d’œuf en brisant les liens disulfures. La rupture de ce lien permet de réduire l’allergénicité des protéines, or les protéines du blanc d’œuf (ovomucoïde, ovalbumine, ovotransferrine et lysozyme) sont reconnues pour être allergènes. Les traitements thermiques et les digestions enzymatiques étant peu efficaces, les HPH peuvent être une technique prometteuse (Naderi et al, 2017c). Le bris des liens disulfures entraine l’exposition des groupements SH, ce qui peut aussi améliorer les propriétés moussantes des protéines du blanc d’œuf (Wang et al, 2016). Dans le jaune d’œuf, les livétines et en particulier l’immunoglobuline Y, montre une bonne stabilité aux hautes pressions jusqu’à une pression de 500MPa. Au-delà, son activité d’anticorps est diminuée (Naderi et al, 2017c).
Récemment, Naderi et al, 2017a et 2017b ont étudié l’utilisation des HPH comme pré-traitement sur le jaune et la granule pour l’amélioration de l’extraction de l’acide folique ou 5-methyltetrahydrofolate (5-MTHF). Plusieurs couples de pressions (200, 400 ou 600 MPa) et de temps (5 ou 10 minutes) ont été testés sur le jaune et la granule, puis la composition de chaque fraction (granule et plasma) après centrifugation a été identifiée. Les HPH ont ainsi engendré la désintégration du réseau granulaire et ont modifié considérablement la composition de chaque fraction ; le 5-MTHF et la phosvitine étant libérés du réseau, ils ont été dans le plasma. À l’état natif, les granules présentaient une structure très compacte de complexes HDL-phosvitine liés par des ponts phosphocalciques. La perturbation du réseau granulaire peut être expliquée par le fait que la pression induit une rupture des ponts phosphocalciques et une entrée d’eau dans le réseau. L’étude des profils protéiques des différentes fractions avec des gels natifs et dénaturés, a permis de mettre en évidence que la phosvitine est très stable aux HPH, puisqu’elle est la seule protéine à se retrouver dans les deux gels. En outre, les différences de profils protéiques ont ainsi validé l’impact des traitements par HPH sur les protéines. Plus spécifiquement, l’intensité de la bande de phosvitine sur gel SDS-PAGE semblait être plus importante avec le traitement de pressurisation de 600 MPa pendant 10 min appliqué sur la granule (Naderi et al, 2017b). Castellani et al 2004 a également montré que la phosvitine conserve sa forte capacité à lier le fer, même après un traitement aux
HPH de 600 MPa pendant 10 min. Ce résultat suggère encore une fois, la stabilité de cette protéine après un traitement de pressurisation (Castellani et al, 2004).
Malgré tout, le plasma enrichi en phosvitine généré après l’application des HPH sur le jaune d’œuf ou la granule est un milieu très dilué, il faut donc le concentrer. Les procédés baromembranaires apparaissent comme une solution pertinente pour la concentration de la phosvitine.
4. Les procédés baromembranaires
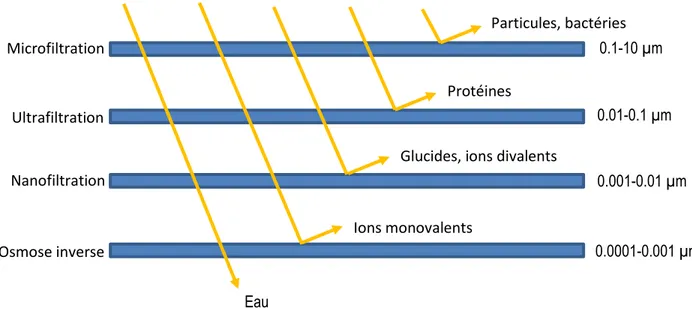
4.1. Généralités sur les procédés baromembranaires
En industries alimentaires, les techniques de séparation par membranes sont devenues incontournables pour séparer les différents constituants d’un mélange. Le principe consiste à appliquer un gradient de pression pour faire passer un liquide sur une membrane dont la taille des pores va permettre le passage de certains constituants dans le perméat et la rétention d’autres composés dans le rétentat. Il existe plusieurs types de procédés baromembranaires selon la taille des pores de la membrane et la pression appliquée : la microfiltration, l’UF, la nanofiltration et l’osmose inverse (Bazinet et Castaigne, 2011) La microfiltration est particulièrement utilisée pour débactériser le lait cru ou encore pour éliminer le gras résiduel du lait ou concentrer les micelles de caséines, l’UF est très utilisée pour enrichir le lait ou le lactosérum en protéines, enfin la nanofiltration et l’osmose inverse permettent de déminéraliser partiellement ou en totalité des solutions de par la faible taille des pores membranaires (Chandrapala et al, 2016).
La filtration peut se faire soit de façon frontale, soit de façon tangentielle. La filtration frontale consiste à faire circuler la solution perpendiculairement à la membrane, alors que pour la filtration tangentielle la solution
Microfiltration Ultrafiltration Nanofiltration Osmose inverse Particules, bactéries Protéines
Glucides, ions divalents
Ions monovalents Eau 0.1-10 µm 0.01-0.1 µm 0.001-0.01 µm 0.0001-0.001 µm
circule parallèlement à la membrane. Cependant la filtration tangentielle est largement préférée car elle permet de limiter l’encrassement membranaire (Bazinet et Castaigne, 2011).
Il existe quatre configurations membranaires : membrane plane, membrane spiralée, membrane à fibres creuses et membrane tubulaire. Le choix de l’une de ces configurations dépend de besoins techniques et financiers (Bazinet et Castaigne, 2011).
Les membranes de filtration sont composées de polymères (cellulose régénérée, l’acétate de cellulose, le nitrate de cellulose, polysulfone, polyacrylonitrile, polyéthersulfone, etc.); elles sont généralement bon marché et facile à utiliser, mais leur résistance chimique est faible. Plus récemment, sont apparues les membranes inorganiques, notamment en céramique. Elles sont plus résistantes aux températures et pressions élevées, à la dégradation chimique par les produits de nettoyage et à la contamination microbiologique, mais elles sont plus dispendieuses (Cot, 1998).
Les membranes peuvent également se différencier par leurs propriétés physico-chimiques. Une membrane hydrophile absorbe moins de protéines qu’une membrane hydrophobe, ce qui limite le colmatage membranaire (Makardij et al, 1999). Également, les membranes chargées présentent une meilleure sélectivité par rapport aux membranes non-chargées, du fait de leur affinité avec les molécules de même charge et limitent l’encrassement de la membrane grâce à l‘augmentation des répulsions électrostatiques (Mohammad et al, 2012).
Les conditions opératoires sont à mesurer pour pouvoir évaluer les performances du système membranaire. Parmi les plus importants, on retrouve :
- Le facteur de concentration volumique ou FCV est le rapport entre le volume initial à traiter et le volume final du rétentat. Le FCV représente le nombre de concentrations qu’a subi la solution de départ (Bazinet et Castaigne, 2011).
- La pression transmembranaire ou PTM caractérise la pression différentielle entre la pression à la sortie du rétentat et la pression à la sortie du perméat et se calcule comme suit :
- PTM =𝑃1−𝑃2
2 − 𝑃3,
- où P1 est la pression à l’entrée de la solution, P2 est la pression à la sortie du rétentat et P3 est la pression à la sortie du perméat.
- Le flux de perméation (J) représente le débit de la solution à la surface de la membrane par unité de surface et est un indicateur majeur des performances de filtration. Il se calcule comme suit : (Makardij et al, 1999)
- J (L/h.m2)=𝑑é𝑏𝑖𝑡 𝑑′é𝑐𝑜𝑢𝑙𝑒𝑚𝑒𝑛𝑡 𝑑𝑢 𝑝𝑒𝑟𝑚é𝑎𝑡 (𝐿/ℎ) 𝑠𝑢𝑟𝑓𝑎𝑐𝑒 𝑚𝑒𝑚𝑏𝑟𝑎𝑛𝑎𝑖𝑟𝑒 (𝑚2)
L’encrassement ou le colmatage des membranes est la problématique majeure des procédés baromembranaires. Les matières en suspension et les molécules se déposent à la surface ou dans les pores de la membrane ce qui ralentit drastiquement les flux de perméation. Si l’encrassement est trop important, la fréquence de nettoyage de la membrane augmente, pouvant aller jusqu’à son remplacement prématuré, ce qui résulte en une augmentation des coûts du procédé (Mohammad et al, 2012). Il existe trois mécanismes majeurs au colmatage des membranes : le phénomène de polarisation de la concentration, l’absorption de solutés à la surface et dans les pores, et le blocage des pores par des agrégats protéiques (Cot, 1998). Le phénomène de polarisation de la concentration est une accumulation des différents constituants de la solution à filtrer à la surface de la membrane qui se traduit par une augmentation du gradient de pression de part et d’autre de la membrane et empêche le passage des molécules. Une simple diafiltration permet de diluer les constituants et rétablit le gradient de pression. L’absorption de solutés par la membrane se fait par affinité entre les matériaux membranaires et les constituants de la solution, en particulier les protéines, par des forces de Van Der Waals, des attractions électrostatiques ou des liaisons chimiques. En plus de bloquer les pores de la membrane, l’absorption de solutés modifie l’hydrophobicité et la charge de celle-ci. Enfin, lors de l’UF, les protéines peuvent se dénaturer et former des agrégats protéiques qui par leur taille vont bloquer les pores de la membrane et donc le passage des molécules (Shi et al, 2014). Ces trois mécanismes opèrent généralement ensemble jusqu’à l’encrassement de la membrane et nuisent à la sélectivité de la séparation.
4.2. Caractéristiques de l’ultrafiltration
L’UF est principalement utilisée dans l’industrie laitière pour la concentration et la séparation des composants du lait et du lactosérum. Elle est également intéressante pour la clarification du vin, de la bière ou du jus de fruits, car elle permet de remplacer l’utilisation de la terre de diatomée, un élément polluant (Mohammad et al, 2012). La taille des pores des membranes d’UF se situe généralement entre 0.01 µm et 0.1 µm et le seuil de coupure est entre 10 et 100 kDa (Bazinet et Castaigne, 2011). La pression appliquée sur un système d’UF est compris entre 1 et 10 bars. La température d’opération varie selon les besoins. Par exemple dans le domaine laitier, l’UF est réalisée à des températures inférieures ou égales à 10°C pour limiter le développement microbien. Des températures élevées, aux alentours de 50°C, permettent également de s’éloigner de la zone de prolifération des microorganismes et permettent également de réduire la viscosité du fluide à filtrer et donc d’améliorer les flux de perméation (Chay Pak Ting et al, 2010). Cependant des températures trop élevées (>50°C) peuvent dénaturer les protéines et accélérer le colmatage. De plus, au-delà de 65°C l’activité émulsifiante de la phosvitine tend à diminuer (Chung et Ferrier, 1995). Il est donc important dans notre étude d’opérer l’UF en dessous de cette température.
4.3.
Utilisation de l’UF pour la concentration et la purification
de la phosvitine
Chay Pak Ting et al, (2010) sont les seuls à ce jour à avoir étudié les performances de l’UF pour la purification de la phosvitine. Plus spécifiquement, des solutions à 5% (p/v) de phosvitine extraite par précipitation au NaCl à partir de poudre de jaune délipidé ont été traitées. Un pH de 8 a été sélectionné pour l’UF, pour un flux de perméation optimal. En effet, lorsque le pH se rapproche du point isolélectrique de la phosvitine (pI = 4), il y a moins de répulsions électrostatiques entre les molécules et donc leur concentration au niveau de la membrane est plus grande ce qui peut ralentir le flux. De plus, la phosvitine forme des complexes non-solubles avec les HDL à des pH entre 4,2 et 6,5 ce qui peut engendrer également un encrassement de la membrane. Enfin, une agrégation des protéines à pH acide pourrait aussi diminuer le flux. La pression transmembranaire déterminée comme optimale a été fixée à 1,4 bar. La phosvitine ayant un poids moléculaire de 45 kDa, des membranes en polyéthersulfone de 10 et 30 kDa ont été sélectionnées afin de concentrer la phosvitine dans le rétentat. Finalement, l’UF a été opérée à 50°C jusqu’à un facteur de concentration volumique de 6X, suivi d’une diafiltration de 10 diavolumes jusqu’à un facteur de concentration volumique de 11X. Ces conditions ont permis une récupération de la phosvitine de 84% dans le rétentat et de maximiser la pureté de la molécule, et ce pour les deux membranes. Les travaux de Chay Pak Ting et al, (2010) sont prometteurs, cependant, dans le cas de la présente étude, il est nécessaire d’étudier le potentiel d’utilisation des membranes d’UF pour concentrer la phosvitine à partir d’un plasma issu du fractionnement du jaune d’œuf et de la pressurisation de la granule.
Chapitre 2 : Hypothèse et objectifs
1. Hypothèse
Un prétraitement de la granule du jaune d’œuf par HPH et la concentration par UF du plasma issu de son fractionnement génère un ingrédient aux propriétés émulsifiantes améliorées grâce à sa teneur élevée en phosvitine.
2. Objectifs
Pour confirmer cette hypothèse, trois objectifs ont été établis :
1) Déterminer les performances du système d’UF lors de la concentration d’un plasma enrichi en phosvitine
2) Caractériser l’ensemble des fractions générées et déterminer spécifiquement leurs teneurs en phosvitine
Chapitre 3 : Combination of high hydrostatic
pressure and ultrafiltration to generate a new
functional ingredient from egg yolk
Résumé
La phosvitine (45 kDa) est une phosphoprotéine de la granule du jaune d’œuf connue pour ses propriétés émulsifiantes. Récemment, un traitement par haute pression hydrostatique sur la granule a induit le transfert de la phosvitine vers la fraction plasma soluble. Ce projet visait à évaluer les performances d’ultrafiltration (UF) utilisée pour concentrer la phosvitine dans la fraction plasma après pressurisation, pour produire un émulsifiant naturel. La concentration en phosvitine a été caractérisée en particulier dans le plasma pressurisé (1.73 ± 0.07% w/w) et son rétentat d’UF (26.00 ± 4.12% w/w). Les propriétés émulsifiantes des deux rétentats (témoin et pressurisé) ont été évaluées. L’émulsion préparée avec le rétentat enrichi en phosvitine était plus stable à la floculation et au crémage. La microscopie confocale à balayage laser a montré un réseau de protéines agrégées similaire à un gel, dans lequel sont encapsulées les gouttelettes de gras, dans l’émulsion préparée avec le rétentat pressurisé. Le profil protéique de la crème lavée a montré la présence de plusieurs protéines, incluant la β-phosvitine et une grande proportion de β-livétine et α-livétine. Globalement, le rétentat d’UF enrichi en phosvitine obtenu à partir du plasma après pressurisation de la granule du jaune d’œuf montre de meilleures propriétés émulsifiantes que le plasma témoin, suggérant un effet positif de la β-phosvitine sur les propriétés émulsifiantes.
Mots-clés : phosvitine; haute pression hydrostatique; granule; ultrafiltration; jaune d’œuf; propriétés émulsifiantes