Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc Tel +212 (0) 537 77 18 34/35/38, Fax : +212 (0) 537 77 42 61, http://www.fsr.ac.ma
FACULTÉ DES SCIENCES
RABAT
N° d’ordre : 2627THÈSE DE DOCTORAT
Présentée par
EL HAMIDI Adnane
Discipline : Chimie
Spécialité : Matériaux et Environnement
Etude de l’interaction du cuivre (II) avec le phosphate de calcium dihydrate
CaHPO
4, 2H
2O : Application à la dépollution des eaux
Soutenue le 22/03/2013
Devant le jury
Président :
M. HALIM, Professeur à la Faculté des Sciences, Rabat
Examinateurs :
A. EL YAHYAOUI, Professeur à la Faculté des Sciences, Rabat M. KACIMI, Professeur à la Faculté des Sciences, Rabat
A. EL MANSOUR, Professeur à la Faculté des Sciences, Rabat S. ARSALANE, Professeur à la Faculté des Sciences, Rabat
Avant propos
Le travail présenté dans ce mémoire a été réalisé au Laboratoire des Matériaux, Nanomatériaux et
Environnement, au sein de l’équipe Physico-Chimie des Matériaux, Catalyse et Environnement de la Faculté
des Sciences de Rabat, sous la direction conjointe de Messieurs les professeurs Said ARSALANE et Mohammed
HALIM.
Je tiens à exprimer toute ma reconnaissance à mes directeurs de thèse, Messieurs Said ARSALANE et
Mohammed HALIM pour leurs encadrements, leurs encouragements perpétuels, leurs compétences
scientifiques remarquables ainsi les meilleures conditions qu’ils m’ont offert pour mener à bien ce travail.
Je remercie profondément Monsieur Mohammed HALIM, professeur et chef du département de chimie à
la Faculté des Sciences de Rabat, d’avoir accepté de présider le jury de cette thèse.
Mes sincères remerciements vont à Monsieur Said ARSALANE, professeur de l’enseignement supérieur à
la Faculté des Sciences de Rabat, pour sa disponibilité, ses nombreux et précieux conseils qui m’ont été d’un
grand intérêt, sans oublier sa gentillesse et sa bonne humeur.
Je prie Monsieur Ahmed EL YAHYAOUI, professeur de l’enseignement supérieur à la Faculté des
Sciences de Rabat, de croire à mes sincères remerciements d’avoir accepté d’être rapporteur et juger ce travail.
Un grand merci à Monsieur Abdellah EL MANSOUR, professeur de l’enseignement supérieur à la
Faculté des Sciences de Rabat, pour l’intérêt qu’il a porté à ce travail en acceptant de participer au jury.
Mes remerciements s’adressent également à Monsieur Mohammed KACIMI, professeur de
l’enseignement supérieur et responsable de l’équipe Physico-Chimie des Matériaux, Catalyse et Environnement
à Faculté des Sciences de Rabat, pour l’honneur qu’il me fait en acceptant d’examiner ce travail et d’être parmi
le jury.
Mes plus vifs remerciements vont à Monsieur Hassan HANNACHE, professeur de l’enseignement
supérieur à la Faculté des Sciences Ben M’sik-Casablanca, pour l’intérêt qu’il a manifesté à ce travail en
acceptant de le juger et d’être rapporteur.
Je ne manquerai pas d’adresser mes remerciements à tous les membres de l’UATRS-CNRST pour leurs
collaborations dans les analyses chimiques et la caractérisation de nos produits.
Je tiens aussi à remercier mon Dieu, le tout puissant, qui m’a tant donné et soutenu et toute ma famille
et en particulier mes parents pour leurs confiances et leurs appuis ainsi que mon frère pour sa très bonne
compagnie durant toutes les années de ma thèse.
Mes remerciements s’adressent enfin à tous ceux qui ont participé de près ou de loin à la réalisation de
cette thèse, aux enseignants-chercheurs pour leurs soutiens et leurs encouragements, à mes chers amis qui
n’ont jamais hésité à m’apporter de précieux conseils et aides ainsi qu’à tous les collègues, doctorants et
personnel de la Faculté des Sciences de Rabat.
Résumé
L'effet de l'ajout des ions cuivre (II) sur les propriétés chimiques et structurales du phosphate dicalcique CaHPO4, 2H2O a été caractérisé par plusieurs
techniques (DRX, IR, UV-vis. et MEB-EDX) et a conduit, par réaction d'échange à l'apparition d'une solution solide limitée de formule Ca1-xCuxHPO4, 2H2O (x≤0.25),
qui se transforme à 250°C, en phosphate monetite Ca1-xCuxHPO4. L'étude de la
cinétique thermique (ATG/DTG/ATD) du phosphate pur et de certaines compositions de DCPD-%Cu2+ par les méthodes isoconversionnelles a mis en
évidence la complexité des mécanismes de dégradation et la formation d'un intermédiaire instable qualifié comme une monetite désordonnée.
La modélisation de la cinétique de sorption des ions Cu2+ sur le phosphate
CaHPO4, 2H2O a montré la prédominance des processus de diffusion externe et
intra-particulaire suivie d'une réaction de pseudo-premier ordre de type échange cationique. L’étude du système à l’équilibre a révélé la grande affinité "solide-soluté" et le processus d’adsorption est représenté par le modèle de Sips avec une capacité d’adsorption maximale de l’ordre de 258 à 309 mg/g.
Mots clés : Dicalcium phosphate dihydraté, Réaction d’échange, Solution solide, Analyse thermique, Rétention du cuivre, Modélisation cinétique et isotherme
Absract
The effect of adding copper (II) ions on chemical and structural properties of dicalcium phosphate CaHPO4, 2H2O have been characterized by several techniques
(DRX, IR UV-Vis and SEM-EDX) and have led to the apparition of a limited solid solution by exchange reaction with formula Ca1-xCuxHPO4, 2H2O (x≤0.25), which is
converted to monetite phosphate Ca1-xCuxHPO4 at 250°C. The thermal kinetic study
(TGA / DTG / DTA) of pure phosphate and some compositions of DCPD-%Cu2+ by
isoconversionnal methods has revealed the complexity of the degradation
mechanisms and the formation of an unstable intermediate phase qualified as a disordered monetite.
The modeling of sorption kinetics of Cu2+ ions on the phosphate CaHPO4, 2H2O
showed the predominance of external and intra-particle diffusion processes followed by a pseudo-first-order reaction of cation exchange type. The equilibrium system study indicated a high "solid-solute" affinity and the adsorption process is represented by the Sips model with a maximum adsorption capacity of order 258-309 mg/g.
Mots clés : Dicalcium phosphate dihydrate, Exchange reaction, Solide solution, Thermal analysis, Copper retention, Isothermal and kinetic modeling
Sommaire Globale
Introduction générale ... 1
1ère Partie Effet de l’ajout des ions Cu2+ sur le phosphate CaHPO4, 2H2O : Etude physico-chimique et thermique Chapitre I Revue bibliographique I. Les phosphates de calcium... 10
I.1. Les orthophosphates de calcium naturels ... 10
I.1.1. Origine biologique ... 10
I.1.2. Origine géologique ... 11
I.1.3. Composition et structure des orthophosphates de calcium naturels ... 12
I.2. Les orthophosphates de calcium synthétiques... 13
I.3. Les phosphates monocalciques (Ca/P = 0.5) ... 15
I.4. Les phosphates dicalciques (Ca/P = 1) ... 17
I.4.1. Le DiCalcium Phosphate Dihydraté (DCPD, CaHPO4, 2H2O) ... 17
I.4.2. Synthèse du phosphate CaHPO4, 2H2O ... 17
I.4.3. Caractérisation structurale et thermique du phosphate CaHPO4, 2H2O. 18 I.4.3.1. Diffraction RX et des Neutrons ... 18
I.4.3.2. Spectroscopie infrarouge à transformée de fourrier (IRTF) ... 22
I.4.3.3. Spectrométrie RMN-MAS 1H et 31P... 24
I.4.3.4. Analyse thermique ... 25
I.5. Le DiPhosphate de Calcium Anhydre (DCPA, CaHPO4) ... 26
I.5.1. Structure du phosphate monetite CaHPO4 (DCPA) ... 26
I.5.2. Spectroscopie IRTF de la monetite CaHPO4 ... 29
I.6. Les phosphates octocalciques (OCP) ... 30
I.6.1. Le phosphate octocalcique triclinique (OCPt) ... 30
I.6.2. Le phosphate octocalcique apatitique (OCPa) ... 32
I.7.1. Le phosphate tricalcique amorphe (TCPam) ... 34
I.7.2. Le phosphate tricalcique apatitique (TCPa) ... 36
I.8. Les phosphates tricalciques cristallisés (α et β) ... 37
I.8.1. Le phosphate β-TCP ... 37
I.8.2. Le phosphate α-TCP ... 38
I.9. L'hydroxyapatite ... 40
I.9.1. L'hydroxyapatite phosphocalcique non-stœchiométrique (CDHA) ... 40
I.9.2. L'hydroxyapatite phosphocalcique stœchiométrique (HAP) ... 42
I.10. Le phosphate tétracalcique (TTCP) ... 44
I.11. Les pyrophosphates de calcium (Ca/P = 1)... 46
II. Utilisation industrielle des phosphates de calcium ... 47
II.1. Applications en agriculture et en agroalimentaire ... 47
II.1.1. Les engrais phosphatés naturels ... 48
II.1.2. Les scories de déphosphoration ... 49
II.1.3. Les phosphates de calcium en agroalimentaire ... 50
II.2. Domaines d'applications médicale et pharmaceutique ... 50
II.3. Applications en technologies et dans l'industrie chimique ... 51
Références bibliographiques ... 54
Chapitre II Etude physico-chimique et thermique du phosphate CaHPO4, 2H2O Introduction ... 65
I. Analyse physico-chimique du phosphate CaHPO4, 2H2O (DCPD) ... 65
I.1. Analyse chimique ... 65
I.2. Etude de la stabilité chimique ... 66
I.3. Analyse par diffraction RX et calcul des paramètres cristallins ... 68
I.4. Analyse par spectroscopie IRTF ... 69
II. Analyse thermique du phosphate CaHPO4, 2H2O ... 70
II.1. Rappel bibliographique sur l'analyse thermique ... 70
II.1.1. Généralités et définitions ... 70
II.1.2. Transformation thermique d’un solide ... 73
II.2. Modélisation cinétique ... 75
II.2.1. Aspect fondamental ... 75
II.2.3. Méthodes d'évaluation de l'énergie d'activation Ea ... 78
II.2.4. Méthodes de détermination du modèle cinétique ... 79
II.3. Analyse thermique du phosphate CaHPO4, 2H2O ... 82
II.3.1. Mode opératoire ... 82
II.3.2. Résultats expérimentaux ... 82
II.4. Corrélation entre les données thermiques et les fréquences de vibration IR 87 II.4.1. Rappels et définitions ... 87
II.4.2. Résultats ... 88
II.5. Etude cinétique de la dégradation du phosphate CaHPO4, 2H2O ... 89
II.5.1. Détermination de l'énergie Ea par la méthode isoconversionnelle ... 91
II.5.2. Interprétation des résultats d’énergie d’activation ... 96
II.5.3. Modélisation de la cinétique de dégradation ... 97
II.5.4. Interprétation des résultats de la modélisation... 102
II.6. Détermination des paramètres thermodynamiques ... 103
Conclusion ... 105
Références bibliographiques ... 106
Chapitre III Interaction des ions cuivre (II) avec le phosphate CaHPO4, 2H2O Introduction ... 111
I. Technique de mise en œuvre ... 111
II. Influence du pH sur les processus d’interaction ... 112
III. Analyse chimique ... 113
IV. Analyse par DRX ... 114
V. Spectroscopie IRTF ... 116
VI. Spectroscopie UV-visible ... 119
VII. Microscopie électronique... 120
VIII. Analyse thermique ... 122
VIII.1. Comportement thermique des phosphates DCPD-%XCu2+ ... 122
VIII.2. Traitement thermique en isotherme ... 125
IX. Modélisation cinétique de la dégradation thermique ... 126
IX.1. Détermination de l’énergie d’activation ... 129
IX.2. Modélisation de la cinétique de dégradation ... 132
Conclusion... 136
Références bibliographiques ... 138
2ème Partie Application du phosphate CaHPO4, 2H2O à l’immobilisation du cuivre (II) en solution aqueuse Chapitre IV Mise au point bibliographique Introduction ... 144
I. Techniques physico-chimiques de dépollution des eaux ... 144
I.1. Coagulation – floculation ... 145
I.2. Précipitation ... 145
I.3. Filtration membranaire ... 145
I.4. Flottation... 147
I.5. Traitement électrochimique ... 147
I.6. Echange ionique ... 148
I.7. Adsorption ... 149
II. Applications des phosphates de calcium dans la dépollution des eaux ... 150
II.1. Rétention des métaux par les phosphates de calcium ... 150
II.2. Elimination des polluants organiques par les phosphates de calcium ... 150
II.3. Mécanismes de rétention des métaux lourds ... 151
III. Le cuivre dans l'environnement ... 152
III.1. Rappel sur le cuivre ... 152
III.2. Propriétés physico-chimiques du cuivre ... 153
III.3. Domaines d'application du cuivre... 154
III.4. Importance biologique du cuivre ... 155
III.5. Origines du cuivre dans l'environnement ... 157
III.6. Comportement du cuivre ... 158
III.7. Toxicité du cuivre ... 158
IV. Interactions "solide-soluté" en solution et modélisations ... 159
IV.1. Interactions "solide-soluté" en solution ... 159
IV.2.1. Adsorption ... 160
IV.2.2. Echange d’ions ... 161
IV.2.3. Dissolution/précipitation et précipitation en surface ... 161
IV.2.4. Complexation de surface ... 162
IV.3. Modélisations mathématiques ... 162
IV.3.1. Cinétique d’adsorption ... 162
IV.3.1.1. Diffusion externe ... 163
IV.3.1.2. Diffusion intra-particulaire ... 165
IV.3.1.3. Réaction de surface ... 166
IV.3.2. Isothermes d’adsorption ... 169
IV.3.2.1. Modèles à deux paramètres ... 172
IV.3.2.2. Modèles à trois paramètres ... 174
IV.3.2.3. Modèles à plus de trois paramètres ... 175
IV.4. Méthodologies d’application des modèles théoriques ... 176
IV.4.1. Formes linéaire et non-linéaire ... 176
IV.4.2. Fonctions d’erreurs ... 177
Références bibliographiques ... 179
Chapitre V Etude de la rétention du cuivre en milieu aqueux par le phosphate CaHPO4, 2H2O (DCPD) Introduction ... 191
I. Méthodes expérimentales ... 191
I.1. Protocole opératoire ... 191
I.2. Modélisation mathématique ... 193
II. Etude cinétique de la rétention ... 193
II.1. Etape de diffusion externe ... 198
II.2. Etape de diffusion intra-particulaire ... 201
II.3. Etape de réaction de surface ... 202
II.3.1. Régression linéaire et non-linéaire ... 207
II.3.2. Mécanisme de réaction de surface ... 208
III. Modélisation du système (DCPD-Cu2+) à l’état d’équilibre ... 209
IV. Conclusion ... 211
Conclusion générale ... 216
Principaux symboles et abréviations
DCPD DiCalcium Phosphate Dihydraté (brushite) DCPA DiCalcium Phosphate Anhydre (monetite)
a Degré de conversion
m0 Masse initiale du réactant (g)
mt Masse mesurée au temps t durant la réaction (g)
m∞ Masse mesurée à la fin de la réaction (g)
f(a) Modèle de la réaction
g(a) Intégrale du modèle de la réaction
A Facteur pré-exponentiel, c’est un paramètre relatif aux fréquences de collisions des molécules.
R Constante des gaz parfaits (J.mol-1.K-1) Ea Energie d’activation (kJ/mol)
b Vitesse de chauffe (°C/min)
ATG Analyse thermogravimétrique ATD Analyse thermique différentielle DTG Dérivé de la thermogravimétrie FWO Flynn-Wall et Ozawa
KAS Kissinger-Akhira-Sunrose
C0 Concentration initiale du soluté (mg/l)
Ce concentration à l’équilibre du soluté en solution (mg/l)
Ct Concentration du soluté à l’instant t (mg/l)
A Aire de l’interface solide/liquide (m2) V Volume de la solution (l)
kf Coefficient de transfert de masse externe (m/min)
Ss Aire de la surface de l’adsorbant (m2/l)
qt Quantité éliminée à un temps donné (mg/g)
kdif Constante de la vitesse de diffusion (mg/g.min1/2)
C Epaisseur de la double couche (mg/g) qe Quantité éliminée à l'équilibre (mg/g)
k2 Constante de réaction (g.mg-1.min-1)
kads Constante de vitesse d’adsorption (g.l.mg-2.min-1)
ms Concentration en adsorbant (mg/l)
aE Constante d’Elovich relative au taux de chimisorption
(mg/min/g)
bE Constante d’Elovich relative au taux de recouvrement de
surface (g/mg)
KL Constante d’équilibre ou également le paramètre de Langmuir
(l/mg)
KF Constante d’équilibre ou également le paramètre de Freundlich
(mg.l/g)
qm Capacité d’adsorption maximale (mg/g)
aLF Constante d’affinité d’adsorption (l/mg)
Liste des figures
Figure 1 : Spectre IR du phosphate de calcium monocalcique (MCPM) ... 16
Figure 2 : Diagramme DRX du MCPM ... 16
Figure 3 : Diagramme DRX du phosphate CaHPO4, 2H2O ... 19
Figure 4 : Vue 3D de la structure du phosphate CaHPO4, 2H2O ... 21
Figure 5 : Structure de CaHPO4, 2H2O avec les liaisons hydrogènes ... 21
Figure 6 : Spectre IRTF de CaHPO4, 2H2O ... 23
Figure 7 : Spectre RMN-MAS 1H de CaHPO4, 2H2O ... 24
Figure 8 : Diagramme d'analyse ATG/DSC de CaHPO4, 2H2O ... 25
Figure 9 : Structure 3D de la monetite CaHPO4 ... 27
Figure 10 : Projection de la structure de la monetite selon le plan normal à b, pour la basse variété (P1) et la haute variété (P1) ... 28
Figure 11 : Diagramme DRX de la monetite CaHPO4 ... 29
Figure 12 : Spectre IRTF de la monetite CaHPO4 ... 29
Figure 13 : Le diffractogramme RX de l'OCPt ... 31
Figure 14 : Spectre Infrarouge de l'OCPt ... 32
Figure 15 : Diagramme DRX de l'OCP apatitique ... 33
Figure 16 : Spectre IR du phosphate octocalcique apatitique ... 33
Figure 17 : Diagramme DRX du phosphate de calcium amorphe (ACP) ... 35
Figure 18 : Spectre IR du phosphate de calcium amorphe (ACP) ... 35
Figure 19 : Spectre DRX du phosphate tricalcique apatitique (TCPa) ... 36
Figure 20 : Spectre IR du phosphate tricalcique apatitique ... 37
Figure 21 : Diagrammes DRX des phosphates tricalciques cristallisés ... 39
Figure 22 : Spectres IR du α-TCP et du β-TCP ... 40
Figure 23 : Spectres IR de l'hydroxyapatite non-stœchiométrique ... 41
Figure 24 : Diagrammes DRX de l'hydroxyapatite non-stœchiométrique ... 42
Figure 25 : Spectre IR de l'hydroxyapatite (HAP) ... 43
Figure 26 : Diagramme DRX de l'HAP ... 44
Figure 27 : Diagramme DRX du TTCP ... 45
Figure 29 : Diagrammes DRX du a, b et g–Ca2P2O7 ... 46
Figure 30 : Spectres infrarouge du a, b et g–Ca2P2O7 ... 47
Figure 31: Stades de fabrication des engrais phosphatés ... 48
Figure 32 : Spectre d'émission de Ca5(PO4)3F : Sb3+, Mn2+ ... 52
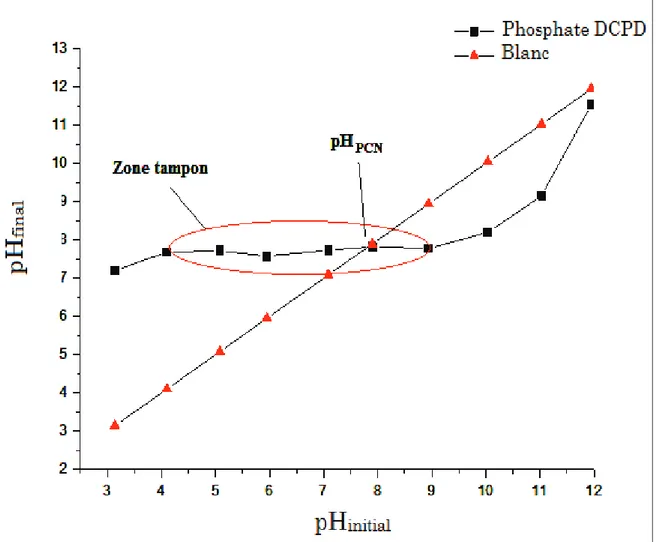
Figure 33 : Variation du pH en fonction du temps ... 66
Figure 34 : Variation du pH final en fonction du pH initial du phosphate CaHPO4, 2H2O ... 67
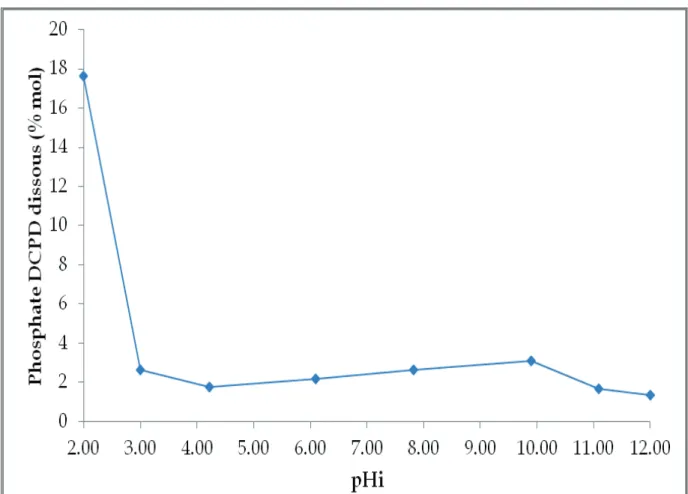
Figure 35 : Solubilité de CaHPO4, 2H2O en fonction du pH initial de la solution ... 68
Figure 36 : Diagramme DRX du phosphate CaHPO4, 2H2O (DCPD) ... 69
Figure 37 : Spectre IRTF du phosphate CaHPO4, 2H2O ... 70
Figure 38 : Modes de programmation de la température ... 72
Figure 39 : Illustration schématique du phénomène de déshydratation thermique d'un solide ... 74
Figure 40 : Courbes des principaux modèles cinétiques ... 77
Figure 41 : Organigramme de détermination du modèle cinétique en utilisant la fonction y(α) ... 81
Figure 42 : Schéma de détermination du modèle cinétique en utilisant la fonction z(α) ... 81
Figure 43 : Courbes ATG/DTG de CaHPO4, 2H2O sous He et à différentes vitesses de chauffe β ... 82
Figure 44 : Courbe ATD de CaHPO4, 2H2O sous He et à différentes vitesses de chauffe β... 83
Figure 45 : Diagrammes DRX du phosphate DCPD à différentes températures ... 86
Figure 46 : Spectres IRTF du phosphate DCPD à différentes températures ... 86
Figure 47 : Variation en 3D de la vitesse de conversion en fonction du taux de conversion a et de la température ... 90
Figure 48 : Variation du degré de conversion en fonction de la température à différentes vitesses de chauffe, dans les trois régions ... 91
Figure 49 : Analyse de la dégradation du phosphate DCPD par la méthode isoconversionnelle en utilisant les équations de a) OFW b) KAS et c) Friedman [Région 1] ... 92
Figure 50 : Analyse de la dégradation du phosphate DCPD par la méthode isoconversionnelle en utilisant les équations de a) OFW b) KAS et c) Friedman [Région 2] ... 93
Figure 51 : Analyse de la dégradation du phosphate DCPD par la méthode isoconversionnelle en utilisant les équations de a) OFW b) KAS et c)
Friedman [Région 3] ... 94
Figure 52 : Ea = f(a) "Région 1" ... 96
Figure 53 : Ea = f(a) "Région 2" ... 96
Figure 54 : Ea = f(a) "Région 3" ... 96
Figure 55 : Représentation de z(a) et y(a) à différentes valeurs de a [région 1] ... 98
Figure 56 : Représentation de z(a) et y(a) à différentes valeurs de a [région 2] ... 98
Figure 57 : Représentation de z(a) et y(a) à différentes valeurs de a [région 3] ... 98
Figure 58 : Représentation des données expérimentales et théoriques de la décomposition thermique du phosphate CaHPO4, 2H2O à différentes vitesses de chauffe a) région 1 b) région 2 c) région 3 ... 101
Figure 59 : Surface 3D des données expérimentales et théoriques de la décomposition thermique du phosphate CaHPO4, 2H2O en région 2 à différentes vitesses de chauffe ... 102
Figure 60 : Variation du pH initial et final du mélange (phosphate DCPD et Cu2+) 112 Figure 61 : Analyse élémentaire des différentes compositions du phosphate DCPD-%Cu2+ ... 113
Figure 62 : Diagrammes DRX du phosphate DCPD et des différentes compositions DCPD-%Cu2+ ... 115
Figure 63 : Spectres infrarouge du DCPD pur et des différentes compositions DCPD-%Cu2+ ... 117
Figure 64 : Spectres IR des différentes compositions de DCPD-%Cu2+ traitées à 250°C ... 118
Figure 65 : Spectres de réflexion diffuse du phosphate DCPD pur et des composés de DCPD-%XCu2+ ... 119
Figure 66(a) : Cliché MEB du phosphate DCPD pur ... 120
Figure 66(b) : Cliché MEB du phosphate DCPD-20%Cu2+ ... 121
Figure 66(c) : Cliché MEB du phosphate DCPD-30%Cu2+ ... 121
Figure 67 : Diagrammes ATG des phosphates DCPD-X%Cu2+ (Avec X=0, 5 et 35) .. 123
Figure 68 : Diagrammes ATD des phosphates DCPD-X%Cu2+ (Avec X=0, 5 et 35) .. 124
Figure 69 : Diagrammes DRX des composés DCPD-X%Cu2+ (Avec X= 0, 5 et 35) calcinés à 480° C ... 125
Figure 70 : Spectres IRTF des composés DCPD-X%Cu2+ (Avec X= 0, 5 et 35) calcinés
à 480°C... 125
Figure 71 : Diagrammes ATG et DTG du DCPD-5%Cu2+ à différentes vitesses de chauffe ... 127
Figure 72 : Diagramme ATD du DCPD-5%Cu2+ à différentes vitesses de chauffe ... 127
Figure 73 : Diagrammes ATG et DTG du DCPD-35%Cu2+ à différentes vitesses de chauffe ... 128
Figure 74 : Diagramme ATD du DCPD-35%Cu2+ à différentes vitesses de chauffe . 128 Figure 75: Variation de la vitesse de conversion en fonction de la température et du taux de conversion pour : a) DCPD-5%Cu2+ et b) DCPD-35%Cu2+ ... 129
Figure 76 : Valeurs de l’énergie en région 1 ... 130
Figure 77 : Valeurs de l’énergie en région 2 ... 130
Figure 78 : Valeurs de l’énergie en région 3 ... 131
Figure 79 : Représentation des données expérimentales et théoriques de la dégradation en région 2 à différentes vitesses de chauffe pour : a) DCPD-5%Cu2+ et b) DCPD-35%Cu2+ ... 134
Figure 80 : Zones intervenant dans les processus de sorption ... 160
Figure 81 : Représentation de la double couche diffuse selon le modèle de Stern .... 163
Figure 82 : Les quatre types d’isothermes d’adsorption ... 169
Figure 83(a) : Représentation 3D de la cinétique d’adsorption du phosphate DCPD à différentes concentrations initiales en Cu2+ ... 194
Figure 83(b) : Représentation 3D de la cinétique d’adsorption du phosphate DCPD à différentes concentrations initiales en Cu2+ ... 194
Figure 83(c) : Représentation 3D de la cinétique d’adsorption du phosphate DCPD à différentes concentrations initiales en Cu2+ ... 195
Figure 84 : Rendement de rétention à différentes concentrations initiales en Cu2+ et à m(DCPD) = 0.1g ... 195
Figure 85(a) : Représentation 3D de la cinétique d’adsorption à différentes masses en DCPD ... 196
Figure 85(b) : Représentation 3D de la cinétique d’adsorption à différentes masses en DCPD ... 196
Figure 86 : Rendement de rétention à différentes masses en DCPD et à concentration initiale en cuivre égale à 280mg/l ... 197
Figure 87(b) : Modélisation de la diffusion externe par le modèle classique ... 199 Figure 88 : Modélisation de la diffusion externe en utilisant le modèle de Furusawa
et Smith ... 200 Figure 89(a) : Représentation de la quantité adsorbée de Cu2+ en fonction de la
racine carrée du temps ... 201 Figure 89(b) : Représentation de la quantité adsorbée de Cu2+ en fonction de la
racine carrée du temps ... 202 Figure 90 : Cinétique d’adsorption des ions Cu2+ sur le phosphate DCPD,
(à droite : régression non-linéaire, à gauche : régression linéaire) ... 205 Figure 91 : Cinétique d’adsorption des ions Cu2+ sur le phosphate DCPD,
(à droite : régression non-linéaire, à gauche : régression linéaire) ... 206 Figure 92 : Représentation des résultats des fonctions d’erreurs issues des
modélisations par régression linéaire et par régression non-linéaire .... 207 Figure 93: Isothermes d’adsorption des ions Cu2+ sur le phosphate DCPD a) m=1g et
b) m = 0.1g ... 209 Figure 94 : Isothermes d’adsorption de Cu2+ sur le phosphate DCPD – Régression
Liste des tableaux
Tableau 1 : Composition des phases inorganiques des tissus calcifiés d'un humain
adulte normal ... 11
Tableau 2 : Classification des différents phosphates de calcium synthétiques ... 13
Tableau 3 : Paramètres de maille de quelques orthophosphates de calcium ... 14
Tableau 4 : Paramètres de maille de MCPM et MCPA ... 15
Tableau 5 : Dépouillement du diagramme DRX du phosphate CaHPO4, 2H2O ... 20
Tableau 6 : Coordonnées cristallographiques des atomes du phosphate CaHPO4,2H2O ... 22
Tableau 7 : Modes de vibration IRTF de CaHPO4, 2H2O ... 23
Tableau 8 : Paramètres RMN 1H et 31P de CaHPO4, 2H2O... 24
Tableau 9 : Coordonnées des atomes de la monetite CaHPO4 ... 28
Tableau 10 : Modes de vibration IRTF de la monetite CaHPO4 ... 30
Tableau 11 : Paramètres cristallins de Ca2P2O7 ... 46
Tableau 12 : Utilisation des engrais phosphocalcique dans les sols ... 49
Tableau 13 : Apport nutritif de quelques phosphates calciques ... 50
Tableau 14 : Luminescence des phosphates commerciaux ... 52
Tableau 15 : Dosage chimique du phosphate CaHPO4, 2H2O ... 65
Tableau 16 : Paramètres de maille du phosphate DCPD ... 68
Tableau 17 : Principales techniques d’analyse thermique ... 71
Tableau 18 : Modèles cinétiques les plus connus avec leurs significations physiques 77 Tableau 19 : Comparaison des pertes de masse observées et calculées de CaHPO4,2H2O ... 83
Tableau 20 : Valeurs des fréquences de vibrations H2O observées et calculées ... 89
Tableau 21 : Région prise en compte pour l’analyse isoconversionnelle ... 90
Tableau 22 : Calcul des énergies d'activation Ea et du facteur R2 [région 1] ... 93
Tableau 23 : Calcul des énergies d'activation Ea et du facteur R2 [région 2] ... 94
Tableau 24 : Calcul des énergies d'activation Ea et du facteur R2 [région 3] ... 95
Tableau 25 : Comparaison des valeurs de ap∞, aM et ap obtenues en différentes régions ... 99
Tableau 26 : Comparaison des paramètres cinétiques obtenus dans les trois régions100
Tableau 27 : Paramètres thermodynamiques d’activation ... 104
Tableau 28 : Paramètres de maille des différentes compositions DCPD-%Cu2+ ... 116
Tableau 29 : Comparaison des analyses chimiques réalisées par ICP-AES et EDX 122 Tableau 30 : Comparaison des pertes de masse entre DCPD et DCPD-X%Cu2+ ... 123
Tableau 31 : Régions prises en compte pour l’analyse isoconversionnelle ... 130
Tableau 32 : Valeurs des énergies effectives du phosphate DCPD et des différentes compositions DCPD-%Cu2+ ... 132
Tableau 33 : Comparaison de valeurs de ap∞, aM et ap obtenues dans le cas du phosphate DCPD-5%Cu2+ ... 132
Tableau 34 : Comparaison de valeurs de ap∞, aM et ap obtenues dans le cas du phosphate DCPD-35%Cu2+ ... 133
Tableau 35 : Paramètres cinétiques des compositions de DCPD-%Cu2+ selon le modèle RO ... 133
Tableau 36 : Expression des équations cinétiques des compositions de DCPD-%Cu2+ à différentes régions ... 134
Tableau 37 : Principaux paramètres du cuivre et ses minéraux ... 154
Tableau 38 : Concentration moyenne de cuivre dans certains aliments ... 156
Tableau 39 : Les différentes équations d’isothermes d’adsorption ... 171
Tableau 40 : Différentes formes linéaires du modèle cinétique du pseudo-second ordre et de l’isotherme de Langmuir ... 177
Tableau 41 : Liste des fonctions d’erreurs ... 178
Tableau 42 : Expérimentations de l’étude cinétique de rétention ... 192
Tableau 43 : Expérimentations de l’étude des isothermes de sorption ... 193
Tableau 44 : Modélisation de l’étape de diffusion externe ... 198
Tableau 45 : Coefficients de diffusion intra-particulaire de Cu2+ ... 201
Tableau 46 : Données cinétiques obtenues par régression linéaire et non-linéaire du modèle de pseudo-premier ordre ... 203
Tableau 47 : Données cinétiques obtenues par régression linéaire et non-linéaire du modèle de pseudo-second ordre ... 203
Tableau 48 : Données cinétiques obtenues par régression linéaire et non-linéaire du modèle d’Adam-Bohart-Thomas ... 204
Tableau 49 : Données cinétiques obtenues par régression linéaire et non-linéaire du modèle d’Elovich ... 204 Tableau 50 : Paramètres des isothermes de Langmuir, Freundlich et Sips pour la
sorption des ions Cu2+ sur le phosphate DCPD ... 210
Tableau 51 : Comparaison de la capacité maximale d’adsorption de différents
1
2 Le travail présenté dans cette thèse s'inscrit dans un vaste programme de recherches menées dans notre laboratoire, depuis plusieurs années et qui visent l'élaboration et l'étude physico-chimiques des matériaux phosphatés contenant les éléments de transition 3d. L'objectif est d'apporter une contribution à leur utilisation, en particulier dans les domaines de la catalyse et de l'environnement.
Les phosphates de calcium constituent, en effet, une grande classe de matériaux attractive par leur diversité de compositions, structures et propriétés physico-chimiques. Selon leur utilisation, ces matériaux correspondent à des composés cristallins ou à des amorphes. Ainsi, les biocéramiques d’hydroxyapatite (HAp), le phosphate tri-calcique (β-TCP) et les phosphates dicalciques (DCPD) de type brushite et (DCPA) de type monetite ont pour la majorité présenté des propriétés intéressantes dans les processus biologiques comme substituts osseux synthétiques ou ciments minéraux pour le comblement des cavités osseuses et dentaires [1-3]. Leur biocompatibilité a été confirmée par les essais in vitro et in vivo [4,5].
De par leur grande stabilité thermique et la flexibilité particulière de leur structure de base, les phosphates de calcium conduisent à de nombreuses formulations catalytiques par substitutions partielles des entités (PO4)3- ou des
cations Ca2+. On retrouve ainsi les composés contenant les éléments métalliques
comme le fer, cuivre, cobalt et nickel qui ont été testés dans des réactions faisant intervenir les processus rédox ou les propriétés acido-basiques de la surface. Parmi les réactions catalytiques examinées, on peut citer la conversion simple et oxydante des alcools, la déshydrogénation oxydante d'alcanes, l'hydratation de chlorobenzène et l'hydroxylation des composés aromatiques [6-9].
Dans le domaine de l'environnement, l'utilisation des phosphates de calcium comme supports de décontamination des eaux chargées en métaux lourds et en polluants organiques a fait l'objet de plusieurs investigations, dans cette dernière décennie, en raison des propriétés intéressantes d'adsorptions et d'échanges ioniques qui peuvent présentés. Récemment, des études de fonctionnalisation par greffage avec des molécules inertes ont conduit à une nouvelle famille de matériaux
3 présentant des performances comparables à celles observées sur les zéolites, le charbon actif et les argiles [10-12].
Par ailleurs, le système CaO-P2O5-H2O est considéré comme une des plus
complexes familles des phosphates existants, car la stabilité chimique de la plupart des compositions est affectée non seulement par le rapport atomique Ca / P, mais aussi par d'autres facteurs qui déterminent la cinétique de la réaction de synthèse tels que la température, le pH de précipitation, la nature des précurseurs et les agents complexants [13]. Pour pallier à ces difficultés, d'autres voies d'élaborations ont ainsi été développées en alternative soit en utilisant des solvants apolaires, inertes ou les méthodes dites micro-ondes avec ou sans solvants [14, 15].
Les travaux développés dans ce mémoire concernent d'une part l'étude physico-chimique et thermique du phosphate dicalcique dihydraté CaHPO4, 2H2O, et d'autre
part l'application de ce matériau en tant que support permettant de fixer les ions cuivre divalent en solution. La grande disponibilité de ce matériau et son aptitude à abriter dans sa structure divers espèces ioniques, soit par dopage ou par substitution du calcium ou des groupements phosphates, sont les principales motivations pour le choix du sujet.
Ainsi, le présent mémoire est divisé en cinq chapitres, répartis entre deux grandes parties :
La première partie, contenant trois chapitres, consiste en la caractérisation physico-chimique du phosphate pur CaHPO4, 2H2O (DCPD) et les échantillons de
(DCPD-%Cu2+) issus de l’interaction du CaHPO4, 2H2O avec les ions cuivre en
solution.
Le premier chapitre est une étude bibliographique qui rappelle les différentes méthodes d'élaboration et les caractéristiques des principaux phosphates de calcium ainsi que leurs domaines d’applications.
Le deuxième chapitre est consacré à l’étude expérimentale des propriétés physico-chimiques du phosphate dicalcique dihydraté CaHPO4, 2H2O et à l’examen
4 décomposition thermique a aussi été traitée dans ce chapitre, afin d’évaluer les différents paramètres contrôlant la réaction et les mécanismes qui interviennent.
Le troisième chapitre est réservé à l'examen de l’effet de l’ajout des ions cuivre (II) sur les propriétés structurales et physico-chimiques du phosphate dicalcique CaHPO4, 2H2O. L’étude cinétique de la dégradation thermique des produits formés a
également été abordée dans l’objectif de comparer les paramètres cinétiques et énergies d’activation obtenus avec ceux de l’échantillon pur.
La deuxième partie de ce mémoire est relative à l’étude de la rétention des ions cuivre par le phosphate CaHPO4, 2H2O.
Le chapitre IV est une étude bibliographique sur les différentes méthodes de traitement physico-chimique utilisées pour la décontamination des eaux et sur les applications des phosphates de calcium dans la rétention des métaux lourds, en indiquant les principaux mécanismes mis en jeu. Enfin, une mise au point est effectuée sur les différents modèles mathématiques capables de décrire les mécanismes de rétention.
Le cinquième et dernier chapitre exploite les données expérimentales issues de la rétention des ions Cu2+ par le phosphate CaHPO4, 2H2O en vue de proposer une
modélisation mathématique adéquate. Les études de la cinétique de la sorption et les isothermes d’adsorption ont également fait l’objet de discussion afin d’évaluer les différentes étapes intervenant lors du passage de l’ion Cu2+ depuis la solution
5
Références bibliographiques
[1] C. Moseke, U. Gbureck, Acta Biomaterialia, 2010, 6(10), pp 3815–3823. [2] S. V Dorozhkin, Biomaterials, 2011, 1(2), pp 121–164.
[3] M. P. Ginebra, T. Traykova, J. A. Planell, Journal of Controlled Release: Official Journal of the Controlled Release Society, 2006, 113(2), pp 102–110. [4] P. N. Kumta, C. Sfeir, D.-H. Lee, D. Olton, D. Choi, Acta Biomaterialia, 2005,
1(1), pp 65–83.
[5] M. Julien, I. Khairoun, R. Z. LeGeros, S. Delplace, P. Pilet, P. Weiss, G. Daculsi, J. M. Bouler, J. Guicheux, Biomaterials, 2007, 28(6), pp 956–965. [6] A. Aaddane, M. Kacimi, M. Ziyad, Catalysis Letters, 2001, 73(1), pp 47–53. [7] C. Boucetta, M. Kacimi, A. Ensuque, J.-Y. Piquemal, F. Bozon-Verduraz, M.
Ziyad, Applied Catalysis A: General, 2009, 356(2), pp 201–210.
[8] A. Figoli, A. Cassano, A. Criscuoli, M. S. I. Mozumder, M. T. Uddin, M. A. Islam, E. Drioli, Water Research, 2010, 44(1), pp 97–104.
[9] M. Bahidsky, M. Hronec, Catalysis Today, 2005, 99(1-2), pp 187–192.
[10] S. H. Jang, Y. G. Jeong, B. G. Min, W. S. Lyoo, S. C. Lee, Journal of Hazardous Materials, 2008, 159(2-3), pp 294–299.
[11] O. G. da Silva, M. G. da Fonseca, L. N. H. Arakaki, Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2007, 301(1-3), pp 376–381. [12] G. N. Kousalya, M. Rajiv Gandhi, C. Sairam Sundaram, S. Meenakshi,
Carbohydrate Polymers, 2010, 82(3), pp 594–599.
[13] A. Ferreira, C. Oliveira, F. Rocha, Journal of Crystal Growth, 2003, 252(4), pp 599–611.
[14] E. Hasret, M. Ipekoglu, S. Altintas, N. A. Ipekoglu, Environmental Science and Pollution Research International, 2012, 9(7), pp 2766–2775.
[15] P. Wang, C. Li, H. Gong, X. Jiang, H. Wang, K. Li, Powder Technology, 2010, 203(2), pp 315–321.
6
1
ère
Partie
Effet de l’ajout des ions Cu
2+
sur le phosphate
7
Chapitre I
8
Sommaire
I. Les phosphates de calcium ... 10 I.1. Les orthophosphates de calcium naturels ... 10
I.1.1. Origine biologique ... 10
I.1.2. Origine géologique ... 11
I.1.3. Composition et structure des orthophosphates de calcium naturels ... 12 I.2. Les orthophosphates de calcium synthétiques ... 13 I.3. Les phosphates monocalciques (Ca/P = 0.5) ... 15 I.4. Les phosphates dicalciques (Ca/P = 1) ... 17
I.4.1. Le DiCalcium Phosphate Dihydraté (DCPD, CaHPO4, 2H2O) ... 17
I.4.2. Synthèse du phosphate CaHPO4, 2H2O ... 17
I.4.3. Caractérisation structurale et thermique du phosphate CaHPO4, 2H2O 18
I.4.3.1. Diffractions des Rayons X et des Neutrons ... 18 I.4.3.2. Spectroscopie infrarouge à transformée de fourrier (IRTF) ... 22 I.4.3.3. Spectrométrie RMN-MAS 1H et 31P ... 24
I.4.3.4. Analyse thermique ... 25 I.5. Le DiPhosphate de Calcium Anhydre (DCPA, CaHPO4) ... 26
I.5.1. Structure du phosphate monetite CaHPO4 (DCPA) ... 27
I.5.2. Spectroscopie IRTF de la monetite CaHPO4 ... 29
I.6. Les phosphates octocalciques (OCP) ... 30
I.6.1. Le phosphate octocalcique triclinique (OCPt) ... 30
I.6.2. Le phosphate octocalcique apatitique (OCPa) ... 32 I.7. Les phosphates tricalciques (TCP) ... 34
I.7.1. Le phosphate tricalcique amorphe (TCPam) ... 34
I.7.2. Le phosphate tricalcique apatitique (TCPa) ... 36 I.8. Les phosphates tricalciques cristallisés (α et β) ... 37
I.8.1. Le phosphate β-TCP ... 37
I.8.2. Le phosphate α-TCP ... 38 I.9. L'hydroxyapatite ... 40
I.9.1. L'hydroxyapatite phosphocalcique non-stœchiométrique (CDHA) ... 40
I.9.2. L'hydroxyapatite phosphocalcique stœchiométrique (HAP) ... 42 I.10. Le phosphate tétracalcique (TTCP) ... 44 I.11. Les pyrophosphates de calcium (Ca/P = 1) ... 46
9 II. Utilisation industrielle des phosphates de calcium ... 47
II.1. Applications en agriculture et en agroalimentaire ... 47
II.1.1. Les engrais phosphatés naturels ... 48
II.1.2. Les scories de déphosphoration ... 49
II.1.3. Les phosphates de calcium en agroalimentaire ... 50 II.2. Domaines d'applications médicale et pharmaceutique ... 50 II.3. Applications en technologies et dans l'industrie chimique ... 51 Références bibliographiques ... 54
10
I. Les phosphates de calcium
Les phosphates de calcium sont constitués de trois éléments majeurs : le calcium (Ca2+), le phosphore (P5+) et l’oxygène (O2-). Ces derniers sont présents en
abondance à la surface de la planète avec des pourcentages massiques de 47 % en oxygène, 3.3 à 3.4 % en calcium et 0.08 à 0.12 % en phosphore. Certains de ces phosphates présentent des substitutions cationiques et/ou anioniques conduisant à de nombreuses formes de structures. De part leur composition et leur disponibilité, ils ont acquis une importance particulière dans divers domaines de la science comme la biologie, la chimie, la santé et la médecine.
I.1. Les orthophosphates de calcium naturels I.1.1. Origine biologique
Allant des bactéries aux cellules isolées et jusqu’aux vertébrés et invertébrés, tous ces organismes vivants synthétisent les orthophosphates de calcium. Leur formation dans les organismes primitifs est considérée comme nécessaire au stockage et à la régulation de certains éléments essentiels comme le calcium, le phosphore et le magnésium…
Chez les vertébrés, les orthophosphates se voient être les principaux constituants inorganiques des calcifications normales (os, dents, emails de poissons, bois de cerf et quelques espèces de coquilles) et pathologiques (les calculs dentaires et urinaires, les cailloux, les lésions athérosclérosiques,…) [1]. Excepté une petite portion à l’intérieur de l’oreille, tous les tissus durs du corps humain en sont formés avec un pourcentage en masse allant de 60 à 70%, le reste étant sous forme de collagène (20-30% en masse) et d’eau (s’élevant à 10% en masse) [2]. Ces phosphates existent principalement sous forme de structures faiblement cristallines et non stœchiométriques de Na-, Mg-, et carbonate d’hydroxyapatite (appelée apatite biologique ou dahllite). Des informations détaillées sur la composition chimique des plus importants tissus calcifiés d’un humain normal sont regroupées dans le tableau 1. Quant aux calcifications pathologiques, on trouve, en plus de l'hydroxyapatite, d'autres phosphates de calcium comme le phosphate de calcium amorphe (ACP), le phosphate de calcium dihydraté (DCPD), le phosphate octocalcique (OCP),… [3].
11 Tableau 1 : Composition des phases inorganiques des tissus calcifiés d'un humain adulte
normal [2, 4]
Composition, wt % Enamel Dentin Bone HA
Calcium 36.5 35.1 34.8 39.6
Phosphorus (as P) 17.7 16.9 15.2 18.5
Ca/P (molar ratio) 1.63 1.61 1.71 1.67
Sodium 0.5 0.6 0.9 - Magnesium 0.44 1.23 0.72 - Potassium 0.08 0.05 0.03 - Carbonate (as CO32-) 3.5 5.6 7.4 - Fluoride 0.01 0.06 0.03 - Chloride 0.30 0.01 0.13 - Pyrophosphate (as P2O74-) 0.022 0.10 0.07 - Total inorganic 97 70 65 100 Total organic 1.5 20 25 - Water 1.5 10 10 -
Ignition products (800°C) β-TCP+HA β-TCP+HA HA + CaO HA
Elastic modulus (GPa) 80 15 0.34-13.8 10
Tensile strength (MPa) 10 100 150 100
I.1.2. Origine géologique
Les orthophosphates de calcium se trouvent dans différentes régions du monde. Ils sont majoritairement présents en tant que dépôts de phosphorites (roches sédimentaires) ou également sous forme d’apatites comme la fluorapatite naturelle (FA) (roches éruptives). A cause de leur origine sédimentaire, l’apparence générale ainsi que la composition chimique des phosphorites naturelles varient beaucoup. Il est toutefois communément admis de considérer la francolite (ou carbonate-hydroxyfluorapatite) comme minerais phosphorite de base [1]. Ces phosphorites naturelles existent sous différents aspects (nodules, cristaux ou massiques).
12 Occasionnellement, on trouve d’autres types d’orthophosphates de calcium comme la clinohydroxyapatite (Ca5(PO4)3OH) [5] et la staffelite propre au fluorapatite riche
en carbonate (Ca5[(F,OH)(PO4,CO3)3]) [6], ou aussi le phosphate CaHPO4, 2H2O [7].
Les réserves mondiales en orthophosphates naturels sont estimées à plus de 150 billions de tonnes, desquelles 85% approximativement sont des phosphorites et le reste, 15%, sont constituées d'apatites. Le plus grand dépôt d’apatites naturelles se trouve en Russie (the Khibiny and Kovdor massifs, Kola Peninsula), au Brésil et en Zambie, tandis que le dépôt le plus large des phosphorites naturelles est localisé au Maroc, en Russie, au Kazakhstan, aux USA, en Chine et en Australie ainsi qu'aux fonds des océans [8].
I.1.3. Composition et structure des orthophosphates de calcium naturels
Les minéraux phosphatés sont dans la plupart des cas colorés à cause de l'inclusion de certains ions métalliques comme impuretés dans leurs structures. Par exemple, les ions calcium sont parfois partiellement remplacés par du Sr, Ba, Mg, Mn, K, Na, Fe,... Quant aux ions orthophosphates, ils peuvent être substitués par AsO43-, CO32-, VO43- et SO42-. Les ions hydroxyde, chlorure, bromure, carbonate et
oxyde peuvent aussi remplacer à une certaine limite les fluorures dans le réseau cristallin des apatites naturelles [9].
La structure cristalline des apatites naturelles peut abriter la moitié des éléments chimiques du tableau périodique, dans son arrangement atomique. La facilité des substitutions atomiques dans l’apatite rend ce minéral ouvert à un large éventail de compositions et de propriétés physiques et cela en raison de la grande flexibilité que peut offrir le squelette apatitique. La substitution s'effectue généralement avec des concentrations traces, mais de larges concentrations aussi bien que des solutions solides complètes existent pour certains substituants comme le F- et le OH-.
Dans des cas particuliers, certains ions peuvent manquer dans la structure cristalline et laissent des défauts cristallographiques conduisant à des composés non-stœchiométriques.
13 I.2. Les orthophosphates de calcium synthétiques
Les diverses combinaisons des deux espèces CaO et P2O5 ou du système
Ca(OH)2-H3PO4-H2O donnent une large variété de structures qui se distinguent par
le type d’anion phosphate qui les compose: ortho-(PO43-), méta-(PO3-), pyro-(P2O74-)
et poly-((PO3)nn-). Dans la catégorie des anions multichargés tels que les
orthophosphates et les pyrophosphates, on peut distinguer les différents phosphates de calcium par le nombre de protons H+ attachés à l’anion tels que le
mono-(Ca(H2PO4)2), di-(CaHPO4), tri-(Ca3(PO4)2) et le tétra-(Ca4P2O5) phosphate de
calcium.
Ainsi, on peut trouver jusqu’à 13 orthophosphates de calcium avec un rapport atomique Ca/P variant de 0.5 jusqu’à 2 (Tableau 2).
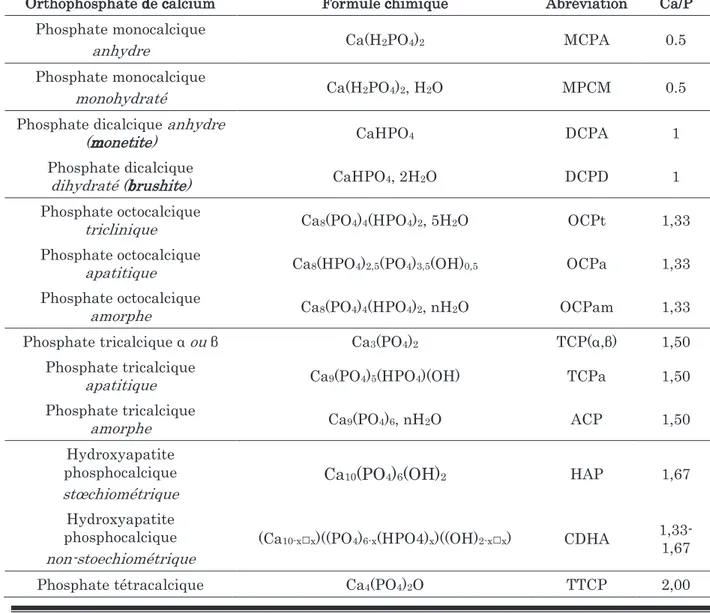
Tableau 2 : Classification des différents phosphates de calcium synthétiques Orthophosphate de calcium Formule chimique Abréviation Ca/P
Phosphate monocalcique
anhydre Ca(H2PO4)2 MCPA 0.5
Phosphate monocalcique
monohydraté Ca(H2PO4)2, H2O MPCM 0.5 Phosphate dicalcique anhydre
(monetite) CaHPO4 DCPA 1
Phosphate dicalcique
dihydraté (brushite) CaHPO4, 2H2O DCPD 1 Phosphate octocalcique
triclinique Ca8(PO4)4(HPO4)2, 5H2O OCPt 1,33 Phosphate octocalcique
apatitique Ca8(HPO4)2,5(PO4)3,5(OH)0,5 OCPa 1,33 Phosphate octocalcique
amorphe Ca8(PO4)4(HPO4)2, nH2O OCPam 1,33 Phosphate tricalcique α ou β Ca3(PO4)2 TCP(α,β) 1,50
Phosphate tricalcique
apatitique Ca9(PO4)5(HPO4)(OH) TCPa 1,50 Phosphate tricalcique
amorphe Ca9(PO4)6, nH2O ACP 1,50 Hydroxyapatite
phosphocalcique stœchiométrique
Ca10(PO4)6(OH)2 HAP 1,67
Hydroxyapatite phosphocalcique non-stoechiométrique
(Ca10-x□x)((PO4)6-x(HPO4)x)((OH)2-x□x) CDHA
1,33-1,67
14 Les paramètres les plus importants qui permettent de distinguer entre ces composés sont : le rapport atomique Ca/P, l’acido-basicité et la solubilité en fonction du pH. Plus le rapport Ca/P est petit, plus le composé est acide et plus ou moins soluble dans l’eau.
L’arrangement atomique des orthophosphates de calcium s’effectue autour d’un réseau infini d’orthophosphates (PO4), donnant ainsi une stabilité chimique et
thermique à la structure. La plupart des orthophosphates de calcium sont légèrement solubles dans l’eau, insolubles dans les solutions alcalines et facilement solubles dans les acides. Par ailleurs, ils sont tous de couleur blanchâtre et plus ou moins durs.
Le tableau 3 rassemble les paramètres de maille de quelques orthophosphates de calcium ainsi que leurs groupes spatiaux.
15 I.3. Les phosphates monocalciques (Ca/P = 0.5)
Comme le montre le tableau 2, il existe deux variétés du phosphate de calcium monocalcique, de rapport atomique Ca/P = 0.5 : le phosphate monocalcique monohydraté (MCPM, Ca(H2PO4)2, H2O) et le phosphate monocalcique anhydre
(Ca(H2PO4)2, MCPA). Parmi tous les phosphates de calcium, le MCPM et le MCPA
sont les composés les plus acides et les plus hydrosolubles. A cause de ces deux propriétés, ils ne sont pas biocompatibles et donc on ne les trouve jamais dans les tissus biologiques [11].
Le phosphate monocalcique monohydraté (MCPM) peut facilement être obtenu à l'ambiante, par la méthode classique de précipitation, en utilisant des solutions aqueuses ‘’d'acétone – eau’’ ou ‘’éthanol – eau’’ et à l'aide du carbonate de calcium CaCO3 et l'acide phosphorique H3PO4.
Le MCPM cristallise dans un système triclinique avec le groupe d'espace P1 (Z=2). Il se transforme en la forme anhydre (MCPA), par simple chauffage à une température supérieure à 100°C. Le MCPA cristallise également dans une maille triclinique P1 .
Les paramètres cristallographiques des deux phosphates MCPM et MCPA sont regroupés dans le tableau 4.
Tableau 4 : Paramètres de maille de MCPM et MCPA
[12][13] Les figures 1 et 2 représentent le spectre infrarouge ainsi que le diagramme de diffraction des rayons X du MCPM.
16 Figure 1 : Spectre IR du phosphate de calcium monocalcique (MCPM) [14]
17 I.4. Les phosphates dicalciques (Ca/P = 1)
I.4.1. Le DiCalcium Phosphate Dihydraté (DCPD, CaHPO4, 2H2O)
Le dicalcium phosphate dihydraté (DCPD), appelé aussi brushite, est naturellement présent sous la forme pathologique des calculs rénaux ou sous formes d'arthrites et de caries. Il est aussi trouvé dans les cavernes riches en guano et se forme par interaction entre une solution phosphatée issu du guano, la calcite et l'argile à faible pH [16] ou également par interaction de la solution phosphatée et les roches calcaires ou les blocs enfouis à l’intérieur du guano [17]. Le phosphate DCPD est utilisé pour diverses applications en particulier dans le domaine biomédical et dans l'industrie alimentaire [18].
Le phosphate DCPD peut abriter dans sa structure plusieurs autres éléments ioniques soit par dopage, par substitution de calcium ou par substitution des groupements phosphates [19–21].
I.4.2. Synthèse du phosphate CaHPO4, 2H2O (DCPD)
La synthèse du phosphate DCPD s'effectue par voie humide et à température ambiante, en utilisant une source de calcium soluble dans l'eau (Ca(NO3)2, 4H2O,
CaCl2, 2H2O ou Ca(CH3COO)2, H2O) et des sels de phosphates ((NH4)2HPO4,
Na2HPO4, NaH2PO4, KH2PO4 ou K2HPO4) pris en quantités stœchiométriques
[22,23]. Il peut également être synthétisé en mélangeant l'hydroxyde de calcium Ca(OH)2 et l'acide phosphorique H3PO4. Ferreira et al. [24] ont décrit la
précipitation de DCPD selon 5 étapes :
- Précipitation spontanée de l'hydroxyapatite (HAP),
- Dissolution complète de Ca(OH)2 et croissance cristalline de l'HAP,
- Formation du premier nucléon de la DCPD sur la surface de l'HAP,
- Coexistence de la DCPD et l'HAP en solution,
- Transformation de l'HAP en DCPD et croissance des cristaux de la DCPD. De nombreux auteurs ont abordé la cristallisation en solution du phosphate DCPD en présence d'additifs ou en milieu non-aqueux. En effet, Madsen [25] a étudié l'influence de l'ajout de 14 ions métalliques di- et trivalents sur la formation et la croissance des cristaux de DCPD. Il a remarqué l'effet inhibiteur des uns (Al3+,
18 Fe3+, Zn2+, Cu2+, Cr3+, Cd2+, Mn2+) et l'effet promoteur des autres (Pb2+, Ni2+). Sekar
et al. [26], quant à eux, ont étudié l'effet de l'ajout des fluorures et ont observé qu'ils réduisent la taille et le nombre total des cristaux formés. La cristallisation du phosphate DCPD en milieu gélifié et en présence du cobalt et de l'acide malique [27] ainsi qu'en présence des ions strontium et des ions pyrophosphates [28] ou aussi en présence du fer [29] a eu pour effet de changer considérablement la morphologie des cristallites par l’incorporation du métal dans la structure du phosphate. D'autres auteurs ont abordé la substitution des ions phosphates de DCPD par les sulfates. Ainsi, Pinto et al [30] et Frost et al [31] ont pu isoler un composé défini qui est l'ardéalite, de formule Ca2(HPO4)(SO4), 4H2O. A l'état naturel, ce minéral tient son
apparition à la décomposition du guano ayant réagi avec la calcite en présence de gypse, brushite et apatite [31].
I.4.3. Caractérisation structurale et thermique du phosphate CaHPO4, 2H2O
(DCPD)
De nos jours, le phosphate DCPD demeure l'un des phosphates de calcium le plus étudié, en raison de sa faculté de se transformer en hydroxyapatite en milieu physiologique (pH~7) [32]. Il a fait l'objet de caractérisation par différentes méthodes d'identifications structurales et physico-chimiques.
I.4.3.1. Diffractions des Rayons X et des Neutrons
L'analyse par diffraction RX sur monocristal a été réalisée en premier lieu par Beevers et al. [33], en utilisant la méthode de Patterson et la synthèse de Fourier différence. L'affinement de structure a montré que le phosphate DCPD cristallise dans le groupe d'espace centrosymétrique I2/a. Plus tard, Jones et Smith [34] ont repris la résolution structurale en utilisant le calcul d'affinement par la méthode des moindres carrés. Ce calcul d'affinement a montré cependant que la structure est mieux décrite en partant du groupe d'espace non centrosymétrique Ia. Pour tenter de résoudre cette controverse, Curry et Jones [35] ont employé la diffraction des neutrons en tenant compte de la position des atomes légers. L'affinement structural a enfin été effectué avec succès dans le groupe d'espace Ia et les positions des différents atomes ont été déterminées.
19 La figure 3 montre le diagramme DRX du phosphate DCPD et le tableau 5 regroupe l'indexation des raies de diffraction observées.
Figure 3 : Diagramme DRX du phosphate CaHPO4, 2H2O [36]
Comme la symétrie Ia est considérée non-standard et ne figure donc pas dans les tables internationales de cristallographie, quelques auteurs [37,38] ont choisi le groupe Cc qui a une symétrie similaire à celle du groupe Ia. Les paramètres cristallographiques sont :
a = 5,812 Å, b= 15, 180 Å, c = 6,239 Å, β = 116,25° et Z = 4
20 Tableau 5 : Dépouillement du diagramme DRX du phosphate CaHPO4, 2H2O [36]
Le squelette structural du phosphate DCPD est constitué d'un arrangement linéaire de feuillets ondulés de composition CaHPO4, parallèle à (010). Ces feuillets
sont liés entre eux par deux types de molécules d'eau formant ainsi un réseau pseudo hexagonal semblable à celui de la structure glaserite. Le calcium est entouré par six oxygènes des tétraèdres (PO4) et deux autres appartenant aux molécules
d'eau, constituant un polyèdre de coordinence 8. La figure 4 illustre une représentation 3D d'un fragment de la structure.
21 Figure 4 : Vue 3D de la structure du phosphate CaHPO4, 2H2O [39]
La diffraction neutronique montre qu'il n'y a qu'un seul type de tétraèdre (PO4)
dont les liaisons P-O sont asymétriques. La plus longue d'entre elles est celle portant (OH) où réside le proton responsable du caractère acide du phosphate. De même, les différentes positions des 5 atomes d'hydrogène de la structure ont également été étudiées par Curry et Jones [35]. En plus du proton acide déjà cité, il y a quatre autres H+ appartenant aux deux molécules d'eau (w1 et w2). L'eau
d'hydratation forme une bicouche reliant les feuillets de [CaHPO4] par des liaisons
hydrogènes fortes (figure 5).
22 Le tableau 6 donne les différentes positions des atomes dans la maille élémentaire du phosphate DCPD.
Tableau 6 : Coordonnées cristallographiques des atomes du phosphate CaHPO4, 2H2O [36]
I.4.3.2. Spectroscopie infrarouge à transformée de fourrier (IRTF)
La première étude complète du spectre infrarouge du phosphate DCPD a été effectuée par Petrov et al. [40]. Le dépouillement du spectre a été réalisé en tenant compte de deux régions différentes (figure 6) :
- Dans la région entre 4000 et 1600 cm-1, on observe les 4 bandes
caractéristiques des vibrations de deux types de molécules d'eau (3541, 3480, 3282 et 3166 cm-1). L'épaulement à 2930 cm-1 correspond à la vibration d'élongation O-H
des entités P(OH). Cette attribution de bandes est en parfait accord avec les données structurales signalées auparavant. Le paquet de bandes situé à environ 2385 cm-1 est assigné à des vibrations de combinaisons et la forte bande située à
1649 cm-1 correspond aux modes de déformations des molécules d'eau.
- Dans la région comprise entre 1600 et 400 cm-1, se regroupe tous les modes de
vibrations d'élongations (1135, 1065, 987 cm-1) et de déformations (576, 528 et 408
cm-1) des liaisons P-O. La bande observée à 877 cm-1 correspond au mode de
vibration d'élongation de la liaison P-O(H). Les autres bandes ont été assimilées aux modes de vibrations par agitation des molécules d'eau (661 cm-1) et à la déformation
23 cm-1). Le tableau 7 regroupe les différentes bandes observées ainsi que leurs
attributions.
Figure 6 : Spectre IRTF de CaHPO4, 2H2O [38]
Tableau 7 : Modes de vibration IRTF de CaHPO4, 2H2O [38]
Nombre d'onde (cm-1) Groupement fonctionnel Mode de vibration
3541 - 3480 O – H (H2O) Élongation 3282 - 3166 2930 (P)O - H Élongation 2385 Combinaison 1649 H – O – H (H2O) Déformation
1208 P – O – H Déformation dans le plan
1135
P - O Élongation
1065 987
877 P – O(H) Élongation
795 P – O – H Déformation hors plan
661 Eau Agitation
576
O – P – O(H) Déformation 528
24 I.4.3.3. Spectrométrie RMN-MAS 1H et 31P
En complément à la diffraction RX, la RMN du proton 1H et du phosphore 31P
permet de mettre en évidence les différentes liaisons P-O et O-H susceptibles d'exister dans la structure du phosphate DCPD. En effet, le spectre RMN-MAS 1H
expérimental et celui modélisé (Figure 7) confirme la présence dans la structure de deux espèces de molécules d'eau avec 4 différentes liaisons O-H. Le proton H+ situé
sur les groupements (PO4) a aussi été identifié par l’apparition d’une bande à δ =
10.2 ppm. De même, la RMN-MAS 31P de CaHPO4, 2H2O (Tableau 8) ne montre
qu'une seule position cristallographique du phosphore à δ = 1.6 ppm, en accord avec les résultats de la diffraction RX et de Neutrons.
Figure 7 : Spectre RMN-MAS 1H de CaHPO4, 2H2O [41]
Tableau 8 : Paramètres RMN 1H et 31P de CaHPO4, 2H2O [41] d (ppm) Calc Exp Brushite P1 2.0 1.6 H1 (POH) 10.2 H2 (H2O) 6.0 H3 (H2O) 6.9 H4 (H2O) 4.6 H5 (H2O) 3.5
25 I.4.3.4. Analyse thermique
La dégradation thermique du phosphate DCPD a largement été discutée dans la littérature. Plusieurs mécanismes de déshydratation ont été proposés et sont dans la plupart controversés [42–45]. Selon les conditions opératoires adoptées, les résultats de l'analyse thermique obtenus par V. Bourgier [42] (Figure 8) montrent en effet :
- Deux pertes de masse successives entre 100 et 200°C correspondant en ATD à un effet de nature endothermique.
- Une troisième perte de masse endothermique à 415°C.
- Un phénomène exothermique qui est enregistré vers 550°C mais sans effet de masse.
26 A température allant de 100 et jusqu'à 200°C, c'est la réaction de déshydratation en monetite CaHPO4 qui est mise en jeu. Cette réaction, dans
laquelle le phosphate CaHPO4, 2H2O perd ses deux molécules d'eau a été décrite de
différentes manières. Ainsi par exemple, Murray et al. [46] ont proposé qu'elle se déroule en une seule étape, alors que Dumitras et al. [7], Sivakumar [47], Tortet [43] et V. Bourgier [42] ont proposé que la déshydratation s’effectue en deux étapes. La première correspond à la perte d'eau faiblement liée (4,11%) et la seconde à celle de l'eau fortement liée (16,42%), ce qui conduit à un pourcentage de 20,43% qui n'est autre que le pourcentage des molécules d'eau présentes dans l’échantillon initial (20,92%). Par contre, les travaux de Dugleux et al. ont fait l'objet d'énormes critiques car ils ont supposé que le mécanisme de déshydratation du phosphate DCPD passe par trois étapes avec formation du triphosphate de calcium Ca3(PO4)2
et du monophosphate de calcium Ca(H2PO4)2 comme phases intermédiaires entre le
phosphate DCPD et la monetite [42,45]. Récemment, Dosen et al. [48] ont suggéré la formation d'une phase amorphe résultante de la déshydratation non-linéaire du phosphate DCPD. Cette phase amorphe peut être considérée comme une monetite hautement désordonnée avec probablement des molécules d'eau piégées dans sa structure.
La troisième perte de masse, enregistrant un effet endothermique à 415°C, a été associée à la déshydroxylation de la monetite qui conduit à un pyrophosphate amorphe Ca2P2O7 [7,42,44].
Le pic exothermique enregistré à 550°C correspond à la cristallisation du pyrophosphate amorphe en g-Ca2P2O7 [42,44].
I.5. Le DiPhosphate de Calcium Anhydre (DCPA, CaHPO4)
Le diphosphate de calcium anhydre appelé aussi monetite, de formule chimique CaHPO4 est la forme anhydre du phosphate DCPD. En plus d'être présente dans les
calcifications pathogènes, la monetite se trouve également dans les calcifications normales.
27 I.5.1. Structure du phosphate monetite CaHPO4 (DCPA)
La monetite cristallise en solution aqueuse, à température allant de 80 à 100°C [49–52]. Elle peut également être préparée à température ambiante en présence de gels [47], en présence d'éthanol [53] ainsi que dans les systèmes hétérogènes huile-eau [54].
La structure de la monetite est constituée de chaînes ondulées de motif [CaHPO4], disposées parallèlement et liées entre elles par des liaisons Ca-O (Figure
9). La maille primitive contient deux types de (PO4) ainsi que trois différents
protons H+. En effet, L'étude structurale par diffraction RX et des neutrons montre
qu'à basse température (270-290K), la monetite présente une transition de phase réversible (ordre/désordre) où seuls les atomes d'hydrogène sont impliqués. Les phases dites basse et haute températures appartiennent respectivement à deux groupes spatiaux différents P1 (centrosymétrique, pour la variété ordonnée) et P1 (non centrosymétrique, pour la variété désordonnée). Or, la monetite présente un faible effet piézoélectrique et par conséquent son groupe spatial doit obligatoirement être non centrosymétrique (P1 ). Il en résulte alors qu'un proton se trouve statistiquement entre deux positions désordonnées alors que les deux autres protons se trouvent sur un centre de symétrie (Figure 10).
28 Figure 10 : Projection de la structure de la monetite selon le plan normal à b, pour la basse
variété (P1) et la haute variété (P1) [38]
A l'ambiante, la monetite cristallise dans un système triclinique (G.E. P1) avec les paramètres cristallographiques :
a = 6,910 Å ; b = 6,627 Å ; c = 6,998 Å ; α = 96,34° ; β = 103,82° ; γ = 88,33°. Le diagramme DRX de la monetite est représenté sur la figure 11. Les positions des différents atomes sont consignées dans le tableau 9.
29 Figure 11 : Diagramme DRX de la monetite CaHPO4 [57]
I.5.2. Spectroscopie IRTF de la monetite DCPA
Le spectre infrarouge à transformée de Fourier de la monetite ainsi que l'assignement des bandes de vibrations observées sont consignées dans la figure 12 et tableau 10.
30 Tableau 10 : Modes de vibration IRTF de la monetite CaHPO4[38]
Nombre d'onde (cm-1) Groupement fonctionnel Mode de vibration
3447 O – H (H2O) Élongation 3190 2849 2360 (P)O - H Élongation 1600-1700 H – O – H (H2O)
Déformation et rotation des molécules d’eau libre
1400-1300 P – O – H Déformation dans le plan
1170 1131 1081 996 P - O Élongation 891 P – O(H) Élongation 578 532 O – P – O(H) Déformation 420 O – P – O Déformation
I.6. Les phosphates octocalciques (OCP)
Selon les conditions de synthèse, les phosphates octocalciques (OCP) de rapport molaire Ca/P = 1.33 peuvent exister soit sous formes cristallines (apatitique ou triclinique) ou à l'état amorphe.
I.6.1. Le phosphate octocalcique triclinique (OCPt)
Ce phosphate a pour formule chimique Ca8(HPO4)2(PO4)4, 5H2O. Il est
rencontré dans les stades intermédiaires de la précipitation de certains orthophosphates de calcium en solution aqueuse, comme l'hydroxyapatite [58]. Le phosphate octocalcique triclinique (OCPt) est retrouvé fréquemment dans les calculs urinaires et dentaires [58]. Il participe également comme phase initiale à la formation des émails minérales et dentaires à travers sa précipitation et son hydrolyse [59]. Il intervient aussi à la formation "in vivo" de l'apatite biologique.
La préparation de l'OCPt peut s'effectuer par hydrolyse de certains phosphates de calcium tels que le β-TCP (β-Ca3(PO4)2) ou le phosphate DCPD (CaHPO4, 2H2O)
[60–62]. Il peut aussi être préparé par la méthode directe de précipitation en utilisant des sels solubles de calcium et de phosphate [63].
![Tableau 3 : Paramètres de maille de quelques orthophosphates de calcium [10]](https://thumb-eu.123doks.com/thumbv2/123doknet/2188484.11200/35.892.130.764.593.1151/tableau-parametres-maille-quelques-orthophosphates-calcium.webp)
![Figure 27 : Diagramme DRX du TTCP [115]](https://thumb-eu.123doks.com/thumbv2/123doknet/2188484.11200/66.892.149.764.182.586/figure-diagramme-drx-ttcp.webp)

![Tableau 14 : Luminescence des phosphates commerciaux [140]](https://thumb-eu.123doks.com/thumbv2/123doknet/2188484.11200/73.892.100.804.202.942/tableau-luminescence-phosphates-commerciaux.webp)

![Figure 39 : Illustration schématique du phénomène de déshydratation thermique d'un solide [12]](https://thumb-eu.123doks.com/thumbv2/123doknet/2188484.11200/95.892.115.805.662.1078/figure-illustration-schematique-phenomene-deshydratation-thermique-solide.webp)
![Figure 42 : Schéma de détermination du modèle cinétique en utilisant la fonction z( α ) [29]](https://thumb-eu.123doks.com/thumbv2/123doknet/2188484.11200/102.892.163.751.106.561/figure-schema-determination-modele-cinetique-utilisant-fonction-a.webp)