Indice et charge glycémiques de l’alimentation et
relations avec l’obésité et le syndrome métabolique au
sein de l’étude des familles de Québec (QFS)
Mémoire
Kathryn Adel
Maîtrise en kinésiologie
Maître ès sciences (M.Sc.)
Québec, Canada
©Kathryn Adel, 2014
iii
Résumé
Les associations entre l’indice et la charge glycémique (IG, CG) de l’alimentation et l’obésité et le syndrome métabolique (SM) demeurant controversées, celles-ci ont été explorées au sein des participants de l’étude des familles de Québec. Des associations positives significatives ont été observées entre l’IG, la CG et l’obésité, de même qu’entre les changements de CG et les changements d’adiposité avec le temps chez les femmes seulement. Cependant, certaines associations n’étaient plus significatives après exclusion des participants ayant fait des déclarations alimentaires improbables. Les associations entre l’IG, la CG et le SM ou ses facteurs de risque n’étaient généralement pas significatives. Ces résultats suggèrent que les femmes ayant une alimentation à IG et CG élevés sont plus à risque d’obésité et qu’une augmentation de la CG de leur alimentation est associée à des gains d’adiposité. Ils illustrent aussi l’importance de considérer la déclaration improbable de l’apport énergétique dans ce type d’études.
v
Abstract
Many high-carbohydrate foods common to Western diets have been shown to produce a high glycemic response, which may favor weight gain and metabolic syndrome (MetS), but associations between glycemic index (GI), glycemic load (GL) and obesity and MetS remain inconsistent. These associations were examined in the Quebec Family Study. GI and GL were positively associated with obesity, and an increase in GL over time was associated with gains in adiposity in women only. However, some associations were no longer significant when subjects with implausible reported energy intake (rEI) were excluded. GI and GL were generally not associated with MetS or its risk factors. Results suggest that GI and GL are associated with obesity in women, and that an increase in the GL of their diet is associated with gains in adiposity over time. They also reinforce the importance of considering implausible rEI in dietary surveys in relation to metabolic disease.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations... xv
Remerciements ... xvii
Avant-propos ... xix
Introduction ... 1
Chapitre 1. Problématique ... 3
1. L’indice glycémique (IG) et la charge glycémique (CG) ... 3
1.1 Définitions et mesures de l’IG et de la CG ... 3
1.2 Facteurs qui influencent l’IG des aliments ... 5
1.3 Importance clinique de l’IG et de la CG ... 6
2. L’obésité et le syndrome métabolique ... 11
2.1 Définition, conséquences et prévalence de l’obésité ... 11
2.2 Définitions, conséquences et prévalence du SM ... 12
2.3 Étiologie de l’obésité et du SM ... 14
3. Relations entre IG, CG et obésité, adiposité et SM et ses facteurs de risque ... 17
viii
3.2 Relations entre IG, CG et différentes variables d’adiposité ... 18
3.3 Mécanismes proposés pour expliquer la relation entre IG, CG et obésité ... 25
3.4 Relations entre IG, CG et SM ... 28
3.5 Relations entre IG, CG et les facteurs de risque du SM ... 29
3.5.1 Relations entre IG, CG et les niveaux de cholestérol HDL et de triglycérides ... 29
3.5.2 Relations entre IG, CG et la tension artérielle ... 33
3.5.3 Relations entre IG, CG et le niveau de glucose à jeun ... 33
3.6 Mécanismes proposés pour expliquer la relation entre IG, CG et SM ... 35
3.7 Limites des études ... 36
4. Hypothèses et objectifs ... 39 4.1 Hypothèse générale ... 39 4.2 Hypothèses spécifiques ... 39 4.3 Objectif général ... 40 4.4 Objectifs spécifiques ... 40 5. Méthodologie... 41
5.1 L’Étude des Familles de Québec (QFS) ... 41
5.2 Mesures anthropométriques ... 41
5.3 Évaluation de l’apport alimentaire et détermination et calcul de l’IG et de la CG ... 42
5.3.1 Évaluation de l’apport alimentaire ... 42
5.3.2 Détermination de l’IG et de la CG des aliments consommés par les participants ... 42
5.3.3 Calcul de l’IG et de la CG moyens ... 43 5.3.4 Identification de l’apport calorique non conforme aux valeurs prédites de la dépense d'énergie 44
ix
5.4 Évaluation des covariables ... 45
Chapitre 2. Articles ... 47
Article 1. Glycemic index, glycemic load, and their relationships with adiposity in the Quebec family study (QFS) ... 47
Article 2. Glycemic index, glycemic load, and their relationships with metabolic syndrome in the Quebec family study (QFS) ... 71
Chapitre 3. Discussion générale et conclusion... 97
Bibliographie ... 103
xi
Liste des tableaux
Tableau 1. Valeurs associées à un IG et à une CG faible, modéré(e) et élevé(e) ... 4
Tableau 2. Facteurs qui influencent l’IG des aliments ... 6
Tableau 3. Classification de l’obésité chez les adultes selon l’IMC ... 11
Tableau 4. Critères diagnostiques du syndrome métabolique ... 13
Tableau 5. Résultats d’études observationnelles ayant examiné les associations entre IG, CG et adiposité ... 19
Tableau 6. Résultats d’études d’intervention ayant étudié l’effet d’une diète à IG ou CG faible sur l’adiposité 21 Tableau 7. Études ayant examiné les liens entre IG, CG et obésité, adiposité classées selon le type d’étude et les relations trouvées ... 25
Tableau 8. Résultats d’études observationnelles ayant examiné les associations entre IG, CG et C-HDL, TG 29 Tableau 9. Résultats d’études d’intervention ayant examiné les effets d’une diète à IG ou CG faible sur le C-HDL et les TG ... 31
xiii
Liste des figures
Figure 1. Détermination de l’IG d’un aliment . ... 4
Figure 2. Mécanismes potentiels par lesquels une alimentation à IG ou CG élevés pourrait augmenter le risque de DT2 . ... 10
Figure 3. Étiologie de l’obésité ... 15
Figure 4. Apport moyen en glucides et en lipides selon le sexe chez les adultes de 20 à 74 ans . ... 17
xv
Liste des abréviations
AACE : American Association of Clinical Endocrinologists CG : Charge glycémique
C-HDL : Cholestérol HDL CT : circonférence de la taille DT2 : Diabète de type 2 GV : Graisse viscérale
IDF : International Diabetes Federation IG : Indice glycémique
IMC : Indice de masse corporelle MCV : Maladie cardiovasculaire MG : Masse grasse
NCEP ATP III : National Cholesterol Education Program Adult Treatment Panel III NR: Sujet ayant fait une déclaration plausible de leur apport énergétique
OMS: Organisation mondiale de la santé
OR : Sujets ayant sur-déclaré leur apport énergétique pER : Besoins énergétiques prédits
rEI : Apport énergétique déclaré SD : Écart type
SM: Syndrome métabolique TA: Tension artérielle TG : Triglycérides
xvii
Remerciements
L'étude réalisée dans le cadre de ma maîtrise a été rendue possible grâce à la collaboration, la participation et le soutien de plusieurs personnes. Dans un premier temps, je tiens à remercier mon directeur, Louis Pérusse, et ma co-directrice, Vicky Drapeau, pour avoir eu confiance en mes capacités et m’avoir donné l’opportunité d’effectuer ce projet, de même que pour leur excellent soutien et encadrement. Ils ont su faire preuve de beaucoup de confiance, de souplesse, de patience et de disponibilité à mon égard et j’en suis très reconnaissante.
J'adresse également mes remerciements à Christian Couture et Annette Gallant pour leur aide avec les analyses statistiques et leur disponibilité à mon égard, Claude Leblanc pour son aide avec l’ajout des données d’IG et de CG au fichier QFS, de même que l’Équipe Scientifique du Glycemic Index Laboratories et Dr Megan McCrory pour leurs conseils. J’aimerais aussi remercier tous les coauteurs qui ont révisé les résumés soumis aux congrès et apporté des commentaires constructifs, et qui réviseront les manuscrits.
Finalement, j’aimerais remercier les Instituts de recherche en santé du Canada (IRSC) et l’INAF pour leur support financier.
xix
Avant-propos
Ce projet de maîtrise s’est avéré être une expérience très enrichissante pour moi, autant pour mon cheminement personnel que scientifique et professionnel. Entres autres, j’ai eu l’opportunité de participer à plusieurs congrès internationaux et de présenter oralement certains résultats de ce projet. La recherche en kinésiologie et en nutrition est un domaine très vaste, stimulant et qui me passionne.
Dans le cadre de ce projet, j’ai contribué à la conception, la réalisation et l’analyse des données. D’abord, dans le cadre d’un stage d’été, j’ai déterminé l’IG et la CG moyens pour tous les sujets de QFS à partir de l’information contenue dans les journaux alimentaires et de tables de valeurs d’IG. J’ai aussi appliqué la méthode de Huang et collaborateurs (1) à la cohorte QFS afin de déterminer les participants ayant sous-déclaré leur apport énergétique. J’ai ensuite réalisé toutes les analyses statistiques et effectué l’analyse des résultats. Ce mémoire présente deux articles scientifiques qui seront soumis à des revues en vue de publication. J’ai rédigé l’entièreté des manuscrits et les ai révisés sous la supervision de mon directeur, Louis Pérusse, et de ma co-directrice, Vicky Drapeau.
1
Introduction
Dans les dernières décennies, la prévalence d’obésité et du SM ont augmenté drastiquement à travers le monde (2, 3). L’obésité et le SM sont des conditions sous-jacentes au développement de maladies chroniques telles que les maladies cardio-vasculaires (MCV) et le diabète de type 2 (DT2) et s’accompagnent d’un risque accru de morbidité et de mortalité (4, 5).
L’étiologie de l’obésité et du SM est complexe et englobe des facteurs d’origine génétique, individuels, biologiques, environnementaux et alimentaires (4). Dans les dernières décennies, l’IG et la CG de l’alimentation occidentale ont aussi augmenté (6). Bien qu’ils aient été associés au risque de MCV (7-9) et de DT2 (10), leurs effets sur le risque d’obésité et de SM sont moins bien connus. En effet, les résultats d’études s’étant intéressées aux relations entre l’IG et la CG et l’obésité et le SM sont très controversés, cela étant dû entres autres à des différences d’ordre méthodologique entre les études et à la déclaration improbable de l’apport énergétique. De plus, bien que plusieurs mécanismes aient été proposés pour expliquer ces relations, la contribution de l’IG et de la CG dans le développement de l’obésité et du SM demeure encore incomprise. Ainsi, l’étude des associations entre l’IG, la CG et l’obésité et le SM tout en tenant compte de la déclaration improbable de l’apport énergétique pourrait permettre une meilleure compréhension du rôle de l’IG et de la CG dans le développement de maladies chroniques.
L’objectif général de ce projet était l’étude des associations entre l’IG et la CG de l’alimentation et l’obésité et le SM. Plus spécifiquement, le projet visait d’abord à examiner les associations entre l’IG et la CG et la prévalence d’obésité de même que différents indicateurs d’adiposité et leur variation sur une période de six ans. Deuxièmement, il avait comme objectif d’examiner les associations entre l’IG et la CG et le risque de développer le SM ou ses facteurs de risque de même que l’augmentation de ses facteurs de risque sur une période de six ans. Finalement, il visait aussi à évaluer l’impact d’une déclaration improbable de l’apport énergétique sur ces relations.
Ce mémoire comporte quatre sections. Dans la première section, les concepts d’IG et de CG de même que leur utilité clinique par rapport à leurs associations avec diverses maladies chroniques sont d’abord décrits. La prévalence, les conséquences et l’étiologie de l’obésité et du SM sont ensuite présentées. Enfin, l’IG et la CG sont mis en relations avec l’obésité et l’adiposité de même qu’avec le SM et ses facteurs de risque. Un aperçu des études effectuées et des principales conclusions qui en découlent, les mécanismes suggérés pour expliquer ces relations ainsi que certaines considérations d’ordre méthodologique sont présentés. La deuxième section comprend deux articles, soient Glycemic index, glycemic load, and their relationships with
2
obesity in the Quebec Family Study et Glycemic Index, Glycemic load, and their relationships with metabolic syndrome in the Quebec Family Study, qui seront soumis à des revues pour publication. La troisième section
3
Chapitre 1. Problématique
1. L’indice glycémique (IG) et la charge glycémique (CG)
Cette section explique d’abord les concepts d’IG et de CG et les facteurs qui les influencent. L’utilité clinique de l’IG et de la CG est ensuite mise en évidence par rapport à leurs associations avec diverses maladies chroniques.
1.1 Définitions et mesures de l’IG et de la CG
Le concept d’indice glycémique (IG) a été développé en 1981 par une équipe de chercheurs dirigée par le Dr. David Jenkins, professeur de nutrition à l’Université de Toronto, qui cherchait à identifier les aliments les plus appropriés pour les diabétiques (6). L’IG permet de classer les aliments selon leur effet immédiat sur la glycémie. Il reflète la qualité des glucides en lien avec leur digestion et absorption. Pour déterminer l’IG d’un aliment, on compare la réponse glycémique d’une portion d’un aliment qui contient 50 g de glucides avec celle de 50 g d’un aliment de référence, soit le glucose ou le pain blanc, en mesurant la glycémie toutes les 15 minutes pendant deux à trois heures. On trace ensuite une courbe de la glycémie en fonction du temps, et l’aire sous la courbe, exprimée en pourcentage de l’IG de l’aliment de référence, correspond à l’IG de l’aliment (6). L’IG d’un aliment représente donc la réponse glycémique d’une quantité de cet aliment contenant 50 g de glucides par rapport à un aliment de référence. Ainsi, un aliment à IG élevé ayant une teneur en glucides équivalente à celle d’un aliment à IG faible induit une aire sous la courbe de glucose plus grande pendant la période postprandiale, et vice versa (voir figure 1). L’aliment de référence original était le glucose, mais le pain blanc a aussi été introduit comme standard, car c’est une source de glucides très populaire et donc parfois plus acceptable pour les sujets volontaires pour évaluer les aliments (11). De façon générale, on utilise une portion équivalente à 50 g de glucides pour évaluer un aliment, mais pour les aliments qui contiennent peu de glucides et donc pour lesquels cette portion représente un volume trop grand, une portion équivalente à 25 g de glucides peut être utilisée (11).
4
Figure 1. Détermination de l’IG d’un aliment (Figure adaptée de Venn et Green, Eur J Clin Nutr, 2007) (12).
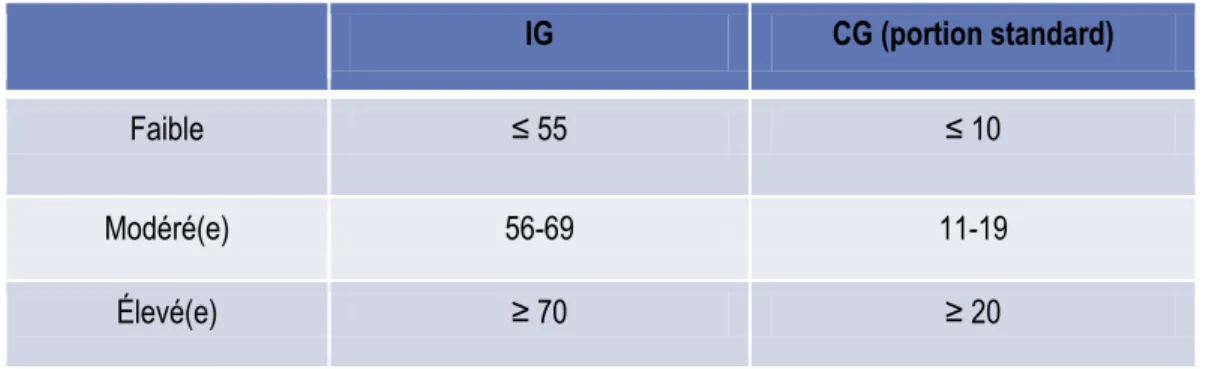
Puisque l’IG ne tient pas compte de la quantité de glucides normalement consommés, qui a aussi un effet sur la glycémie, le concept de charge glycémique (CG) a été développé comme mesure du potentiel global de l’alimentation à élever la glycémie. En effet, alors que l’IG compare le potentiel de différents aliments à élever la glycémie pour une même quantité de glucides, l’élévation de la glycémie suite à l’ingestion d’aliments dépend aussi de la quantité de glucides réellement ingérés. Par exemple, le melon d’eau a un IG élevé et donc risque de ne pas être considéré comme un aliment de choix pour une diète à IG faible. Cependant, cet aliment contient seulement 5 g de glucides par 100 g d’aliment, donc il aurait un effet minime sur la glycémie (12), c’est pourquoi sa CG est faible. Le tableau 1 présente les valeurs associées à des aliments à IG et CG faibles, moyens et élevés.
Tableau 1. Valeurs associées à un IG et à une CG faible, modéré(e) et élevé(e)
IG CG (portion standard)
Faible ≤ 55 ≤ 10
Modéré(e) 56-69 11-19
Élevé(e) ≥ 70 ≥ 20
Tableau adapté de Brand-Miller et collaborateurs, The New Glucose Revolution, 2007 (6)
La charge glycémique de l’alimentation peut être réduite en diminuant l’IG ou bien en diminuant la quantité de glucides consommés. Les deux méthodes contribuent à réduire les réponses glycémiques et insulinémiques postprandiales, mais peuvent s’accompagner d’effets métaboliques distincts à court et long terme. L’IG et la
5 CG sont donc deux concepts très distincts qui n’impliquent pas les mêmes conséquences métaboliques et physiologiques, et leurs effets sur différentes variables doivent être analysés séparément (13).
1.2 Facteurs qui influencent l’IG des aliments
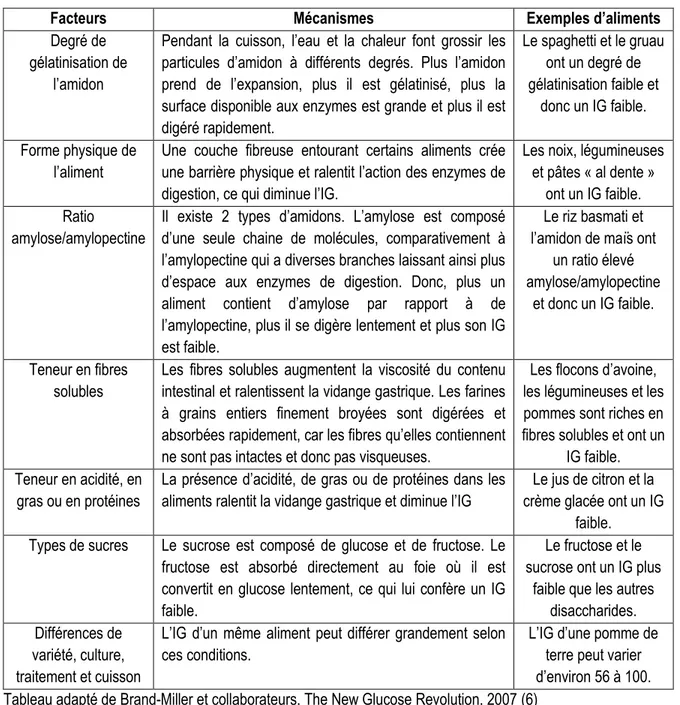
Divers facteurs peuvent faire varier l’IG des aliments, et plusieurs mythes naviguent autour du concept d’IG. D’abord, ce n’est pas parce qu’un aliment a un IG élevé qu’il a une faible valeur nutritive, puisque l’on retrouve des aliments de valeur nutritive faible et élevée dans chaque catégorie d’IG. Par exemple, la citrouille, le melon d’eau et les carottes cuites ont un IG élevé, alors que le chocolat, la marmelade à l’orange et la crème glacée ont un IG faible (14). Ensuite, ce n’est pas parce qu’un aliment est sucré qu’il a un IG élevé. En fait, le sucrose (i.e. le sucre de table), dû à sa teneur à 50% en fructose qui est métabolisé directement au foie, a un IG plus faible que le glucose. Finalement, certains pourraient croire que tous les aliments riches en fibres ont un IG faible. Cependant, beaucoup de produits identifiés à grains entiers contiennent des grains broyés finement, qui leur confèrent un IG élevé (15). Ce sont en fait surtout les fibres solubles qui confèrent aux aliments un IG faible (16). Le tableau 2 présente les principaux facteurs qui influencent l’IG des aliments, accompagnés des mécanismes à l’appui et d’exemples d’aliments pour chacun des facteurs. De façon générale, l’IG, contrairement à la CG, est une propriété des aliments qui ne varie pas significativement d’un individu à l’autre, qu’il soit diabétique ou en santé (16). Par contre, il est à noter que d’autres facteurs, tels que degré de mastication, la quantité de nourriture ingérée, le moment de la journée où est consommé le repas, la fréquence des repas et les aliments consommés aux repas précédents, influencent non pas l’IG des aliments mais plutôt la réponse glycémique d’un individu suite à sa consommation d’aliments (16). Ainsi, la consommation d’aliments ayant un IG identique n’entraînera pas nécessairement la même réponse glycémique d’un individu à l’autre ou pour un même individu d’une fois à l’autre. Ce type de variabilité inter- et intra-individuelle de la réponse glycémique suivant la consommation de deux repas identiques peut être évitée en contrôlant pour ces facteurs.
6
Tableau 2. Facteurs qui influencent l’IG des aliments
Facteurs Mécanismes Exemples d’aliments
Degré de gélatinisation de
l’amidon
Pendant la cuisson, l’eau et la chaleur font grossir les particules d’amidon à différents degrés. Plus l’amidon prend de l’expansion, plus il est gélatinisé, plus la surface disponible aux enzymes est grande et plus il est digéré rapidement. Le spaghetti et le gruau ont un degré de gélatinisation faible et donc un IG faible. Forme physique de l’aliment
Une couche fibreuse entourant certains aliments crée une barrière physique et ralentit l’action des enzymes de digestion, ce qui diminue l’IG.
Les noix, légumineuses et pâtes « al dente »
ont un IG faible. Ratio
amylose/amylopectine
Il existe 2 types d’amidons. L’amylose est composé d’une seule chaine de molécules, comparativement à l’amylopectine qui a diverses branches laissant ainsi plus d’espace aux enzymes de digestion. Donc, plus un aliment contient d’amylose par rapport à de l’amylopectine, plus il se digère lentement et plus son IG est faible.
Le riz basmati et l’amidon de maïs ont
un ratio élevé amylose/amylopectine
et donc un IG faible.
Teneur en fibres solubles
Les fibres solubles augmentent la viscosité du contenu intestinal et ralentissent la vidange gastrique. Les farines à grains entiers finement broyées sont digérées et absorbées rapidement, car les fibres qu’elles contiennent ne sont pas intactes et donc pas visqueuses.
Les flocons d’avoine, les légumineuses et les pommes sont riches en fibres solubles et ont un
IG faible. Teneur en acidité, en
gras ou en protéines
La présence d’acidité, de gras ou de protéines dans les aliments ralentit la vidange gastrique et diminue l’IG
Le jus de citron et la crème glacée ont un IG
faible. Types de sucres Le sucrose est composé de glucose et de fructose. Le
fructose est absorbé directement au foie où il est convertit en glucose lentement, ce qui lui confère un IG faible.
Le fructose et le sucrose ont un IG plus
faible que les autres disaccharides. Différences de
variété, culture, traitement et cuisson
L’IG d’un même aliment peut différer grandement selon ces conditions.
L’IG d’une pomme de terre peut varier d’environ 56 à 100. Tableau adapté de Brand-Miller et collaborateurs, The New Glucose Revolution, 2007 (6)
1.3 Importance clinique de l’IG et de la CG
Initialement, la seule application clinique de l’IG visait l’amélioration du contrôle glycémique chez les personnes diabétiques. En effet, selon trois méta-analyses d’études cliniques randomisées (17-19), une diète à IG faible serait associée à une diminution significative de l’hémoglobine glyquée, à une réduction du risque de complications micro vasculaires de même qu’à une diminution des épisodes d’hypoglycémie chez les personnes diabétiques. À ce jour, il existe de plus en plus d’évidences qu’une alimentation à IG ou CG faible
7 s’accompagne d’une diminution du risque de diverses maladies chroniques, dont entres autres le DT2, les MCV, l’obésité, le SM, les maladies de la vésicule biliaire, les maladies oculaires et plusieurs types de cancers. Cependant, les associations entre ces maladies et l’IG et la CG demeurent controversées. En effet, une méta-analyse de 37 études de cohortes prospectives s’est intéressée à l’association entre l’IG, la CG et le risque de plusieurs maladies chroniques (20). Un IG faible a été associé à un risque réduit de DT2, MCV, cancer du sein et maladie de la vésicule biliaire indépendamment des facteurs confondants potentiels (âge, IMC, antécédents familiaux médicaux, tabagisme, consommation d’alcool, activité physique, apport en fibres, médication et prise de suppléments alimentaires), alors qu’aucune association significative n’a été trouvée pour les autres types de cancers et les maladies oculaires. En ce qui concerne la CG, des associations positives significatives ont été trouvées pour le DT2 et les maladies de la vésicule biliaire après ajustement pour les covariables, mais pas pour les autres pathologies. Lorsque toutes les maladies ont été combinées, une association positive modeste, mais significative, a été trouvée autant pour l’IG que la CG (RR= 1.14 et 1.09 respectivement). Ces résultats suggèrent qu’une alimentation ayant un IG ou une CG élevés augmentent le risque de maladies chroniques, indépendamment d’autres facteurs tels que l’apport en fibres alimentaires. De plus, l’augmentation du risque de maladies chroniques était plus élevée pour l’IG que pour la CG, suggérant que l’IG aurait un effet spécifique et indépendant de la quantité de glucides consommés. Cependant, une revue de littérature s’étant intéressée uniquement aux études de cohorte et d’interventions provenant des pays de l’Europe du Nord a conclu que les évidences ne sont pas suffisantes pour suggérer qu’une alimentation à IG faible s’accompagne d’une diminution du risque de maladies chroniques, sauf chez les personnes obèses ou ayant un surplus de poids (21).
Maladies cardio-vasculaires (MCV)
Dans trois méta-analyses incluant entre 8 et 14 études de cohorte prospectives (7-9), une alimentation ayant un IG ou une CG élevés s’est accompagnée d’une augmentation du risque de MCV chez les femmes mais pas chez les hommes. De plus, dans la méta-analyse de Dong et collaborateurs (2012), les effets néfastes semblaient être plus prononcés chez les participantes obèses ou ayant un surplus de poids. Selon la méta-analyse de Ma et collaborateurs (2012), une augmentation de la CG de 50 unités s’accompagnerait d’une augmentation du risque de MCV de 18% chez les Caucasiens. Les résultats de ces méta-analyses permettent de conclure qu’il y a une relation positive entre l’IG, la CG et le risque de MCV et que cette relation semble être plus élevée chez les femmes.
Une alimentation ayant un IG et une CG élevés, en augmentant la glycémie, peut augmenter le risque de MCV de plusieurs façons. D’abord, selon une méta-analyse d’études prospectives (13), il y aurait une relation linéaire positive entre la glycémie postprandiale et le risque de MCV même chez les individus non-diabétiques,
8
et le risque serait plus élevé chez les femmes. Chez les individus non-diabétiques, une glycémie élevée serait associée à une augmentation de l’épaisseur de la paroi des vaisseaux sanguins (épaisseur intima media), un facteur de risque reconnu de l’infarctus, et interfèrerait avec la vasodilatation (22). Une hyperglycémie postprandiale serait aussi toxique pour l’endothélium en générant du stress oxydatif, altérant ainsi la fonction endothéliale (23). De plus, l’hyperinsulinémie, une conséquence de l’hyperglycémie, est impliquée dans le développement de dyslipidémies (22). Il a aussi été suggéré que, pour un écart type d’augmentation du niveau d’insuline à jeun, les chances de développer une maladie cardiaque ischémique augmentent de 60% chez les hommes âgés entre 45 et 76 ans (24). Il est aussi possible qu’une diète à IG élevé puisse augmenter le risque de MCV en exacerbant le processus pro-inflammatoire. En effet, des associations positives entre l’IG ou la CG et la concentration plasmatique de protéine C-réactive (CRP) ont été observées dans plusieurs grandes études observationnelles (25, 26), dont entres autres dans la Women’s Health Study (27), une étude randomisée à l’aveugle avec groupe placebo. La CRP, qui est un marqueur sensible de l’inflammation, a été reliée au risque de MCV dans plusieurs grandes études prospectives (13).
Cancer
Plusieurs études ont investigué le lien entre l’IG, la CG et le risque de cancer, et les résultats obtenus sont variables d’une étude à l’autre. Une méta-analyse de 39 études de cohortes ou cas-témoin (28), visant à explorer l’association entre l’IG, la CG et le risque de cancer, a démontré qu’une alimentation à IG ou CG élevés s’accompagnait d’une augmentation de 26% et 18%, respectivement, du risque de cancer du côlon et d’une augmentation de 36% et 22%, respectivement, du risque de cancer de l’endomètre. Les relations entre l’IG, la CG et le cancer du sein et du pancréas n’étaient pas significatives. Une autre méta-analyse de 36 études de cohorte (29) a aussi observé une augmentation du risque de cancer du côlon avec une alimentation à IG élevé (RR= 1.08) et du cancer de l’endomètre avec une alimentation à CG élevée (RR= 1.21). Par contre, dans cette méta-analyse, une alimentation à IG élevé était aussi associée à une augmentation de 6% du risque de cancer du sein. Cependant, d’autres évidences ne supportent pas l’association positive entre une alimentation à IG ou CG élevés et le risque de cancers. Par exemple, une méta-analyse de 14 études de cohorte s’étant intéressée uniquement au cancer colorectal (30) n’a pas identifié de relations entre une alimentation à IG ou CG élevés et le cancer du côlon, alors qu’une autre méta-analyse de 10 études de cohorte (31) a suggéré qu’une alimentation à IG élevé était associée à un risque 8% plus élevé de cancer du sein, mais qu’il n’y avait aucune association avec la CG.
Le rôle de l’IG et de la CG dans le développement du cancer pourrait être lié au facteur de croissance apparenté à l’insuline (Insulin-like growth factor, IGF-1) (28). En effet, l’insuline agit comme un facteur de croissance pour les cellules de la muqueuse du côlon. Une concentration élevée d’insuline induite par une
9 alimentation à IG ou CG élevés pourrait augmenter l’activité de l’IGF-1, qui à son tour pourrait stimuler la prolifération et la différentiation cellulaire et inhiber l’apoptose. L’insuline pourrait aussi supprimer les sécrétions hépatiques de la protéine de liaison de IGF-1 (IGF-binding protein-1), influencer la concentration d’hormones sexuelles et réduire la concentration de leurs protéines de liaison (22, 28, 32).
Diabète de type 2 (DT2)
Tel que mentionné plus haut, l’application clinique de l’IG visait principalement le contrôle de la glycémie chez les personnes diabétiques et, dans ce contexte, plusieurs études ont tenté de déterminer s’il y avait une association entre l’IG, la CG et le risque de développer le DT2. Les résultats d’une méta-analyse basée sur 13 études de cohorte (33) démontrent qu’une alimentation ayant un IG ou une CG élevés est associée à une augmentation du risque de DT2 de 16 et 20%, respectivement, suggérant que réduire l’IG et la CG de l’alimentation pourrait être bénéfique pour prévenir le DT2. Cependant, il est à noter que plusieurs études ne supportent pas le lien entre l’IG, la CG et le risque de DT2 (34-36). Par contre, une méta-analyse très récente basée sur 24 études de cohorte s’est intéressée à l’effet dose-réponse entre la CG et le risque de DT2 (10). En effectuant leurs analyses, les auteurs ont tenu compte des sources d’hétérogénéité entre les études et ont démontré que des facteurs comme le sexe, l’ethnicité et la validité des méthodes d’évaluation nutritionnelle utilisées expliquaient 97% de l’hétérogénéité entre les études. En tenant compte de ces sources d’hétérogénéité, les auteurs ont conclu que la relation entre la CG et le DT2 avait été sous-estimée, et que les études ayant démontré une association entre la CG et le risque de DT2 étaient robustes et indiquaient de façon consistante une diminution forte et significative du risque de DT2 chez les personnes ayant une alimentation à CG faible.
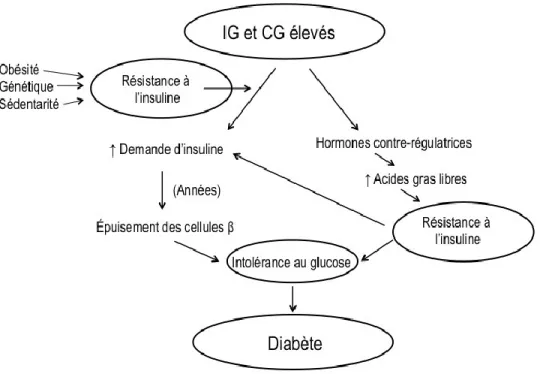
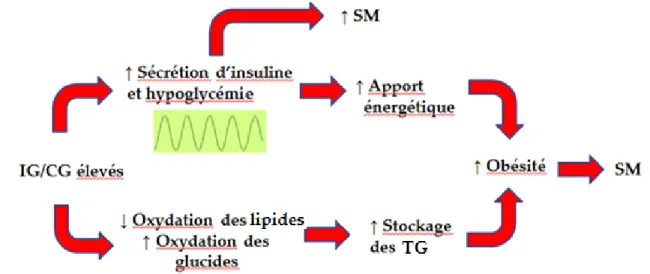
Deux mécanismes principaux permettent d’expliquer le lien entre l’IG, la CG et l’incidence du DT2 (37). Ces mécanismes sont illustrés dans la figure 2 ci-dessous. Premièrement, une alimentation à IG et CG élevés s’accompagne d’hyperglycémies et d’hyperinsulinémies répétées qui, à long terme, peuvent mener à un épuisement des cellules β du pancréas ou leur être toxiques, et ainsi induire une intolérance au glucose et par le fait même un risque augmenté de DT2. Deuxièmement, une alimentation à IG ou CG élevés pourrait augmenter la résistance à l’insuline, du moins à court terme. En effet, une diète à IG élevé s’est accompagnée d’une résistance à l’insuline plus élevée qu’une diète à IG faible dans des études animales (38, 39) de même que dans une étude regroupant 61 femmes pré-ménopausées où la résistance à l’insuline a été mesurée in vivo et dans des cultures d’adipocytes (40). L’augmentation de la résistance à l’insuline serait due à une production accrue d’acides gras libres dans la période postprandiale, possiblement causée par une hypoglycémie réactive médiée par une augmentation des hormones contre-régulatrices telles que le cortisol, le glucagon et l’hormone de croissance. Il est à noter que la réponse individuelle à un aliment glucidique varie
10
selon le degré de résistance à l’insuline, qui est déterminé, entres autres, par le degré d’adiposité, la pratique d’activité physique, la génétique et d’autres caractéristiques alimentaires. Ainsi, on pourrait s’attendre à ce que les effets d’une alimentation à IG ou CG élevés soient exacerbés chez les individus sédentaires, obèses ou ayant une susceptibilité génétique.
Figure 2. Mécanismes potentiels par lesquels une alimentation à IG ou CG élevés pourrait augmenter le risque de DT2 (figure adaptée de Willett et collaborateurs, Am J Clin Nutr, 2002)(37).
En conclusion, malgré la présence de controverses, les données disponibles suggèrent que l’IG et la CG ont un rôle à jouer dans l’étiologie de plusieurs maladies chroniques telles que les MCV, certains cancers et le DT2. Cependant, il est possible que leurs effets soient modulés par divers facteurs tels que le sexe, l’âge, la génétique et l’adiposité. Bien que certaines hypothèses aient été suggérées pour expliquer les effets observés, les mécanismes précis restent à être déterminés. De plus, puisque l’obésité et le SM augmentent le risque de développer ces maladies chroniques, cela démontre l’importance d’étudier les associations entre l’IG, la CG et l’obésité et le SM, afin de permettre une meilleure compréhension de la contribution de l’IG et de la CG dans l’étiologie du SM et de l’obésité, et par le fait même de maladies chroniques telles que les MCV et le DT2.
11
2. L’obésité et le syndrome métabolique
Cette section traitera des définitions, des conséquences et de la prévalence de l’obésité et du SM, puis de leur étiologie.
2.1 Définition, conséquences et prévalence de l’obésité
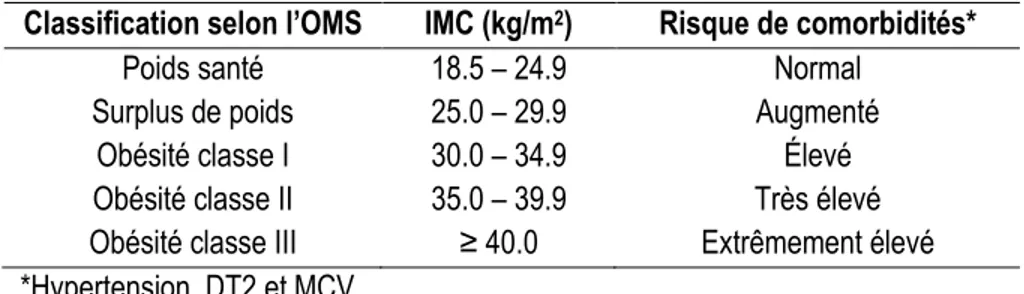
Selon l’organisation mondiale de la santé (OMS) (41), le surpoids et l’obésité se définissent comme une accumulation anormale ou excessive de graisse corporelle qui peut nuire à la santé. L’indice de masse corporelle (IMC) permet d’estimer l’adiposité chez l’adulte et correspond au poids d’un individu (en kilogrammes) divisé par le carré de sa taille (en mètres). La classification de l’obésité chez l’adulte selon l’IMC est présentée au tableau 3 (42). Bien que l’IMC représente une méthode simple à utiliser (43), qu’il soit fortement corrélé avec d’autres mesures d’adiposité (43), et qu’il ait une bonne spécificité (44), il a aussi des limites. En effet, il a une faible sensibilité, et sa précision diminue avec l’âge et est plus faible chez les hommes de même que chez les individus ayant un IMC entre 25 et 29 kg/m2 (44). Ainsi, pour un même IMC, le pourcentage de gras peut varier grandement d’un individu à l’autre. De plus, l’IMC ne permet pas de déterminer la répartition de la masse adipeuse, qui est importante pour évaluer le risque pour la santé (43). La circonférence de la taille (CT) est un marqueur de l’adiposité viscérale abdominale et permet de différencier l'obésité gynoïde de l'obésité androïde, cette dernière s’accompagnant d’un risque accru d’hypertension, de DT2 et de MCV (43). En effet, pour un individu ayant un IMC faible mais une CT élevée, le risque de développer des problèmes de santé associés à un excès de masse adipeuse est aussi, sinon plus élevé, que pour un individu ayant un IMC élevé mais qui ne souffre pas d'obésité abdominale (45). Donc, l’IMC devrait être utilisé conjointement à une mesure qualitative de la distribution d’adiposité telle que la CT pour améliorer la qualité de l’interprétation du risque pour la santé.
Tableau 3. Classification de l’obésité chez les adultes selon l’IMC
Classification selon l’OMS IMC (kg/m2) Risque de comorbidités*
Poids santé 18.5 – 24.9 Normal
Surplus de poids 25.0 – 29.9 Augmenté
Obésité classe I 30.0 – 34.9 Élevé
Obésité classe II 35.0 – 39.9 Très élevé
Obésité classe III ≥ 40.0 Extrêmement élevé
*Hypertension, DT2 et MCV Tableau tiré de WHO, 1998 (42)
12
Les conséquences de l’obésité sont multiples (4, 46). D’abord, l’obésité s’accompagne d’un risque accru de mortalité et de morbidité. Plus précisément, cette condition augmente le risque de MCV, DT2, hypertension artérielle, dyslipidémies, asthme, affections de la vésicule biliaire, arthrose, ostéoarthrite, douleurs lombaires chroniques, plusieurs types de cancer (cancer colorectal, du rein, du sein, de l’endomètre, des ovaires et du pancréas) et apnée obstructive du sommeil. L’obésité peut aussi avoir des conséquences psychosociales considérables telles qu’une diminution de l’estime de soi, de la satisfaction par rapport à l’image corporelle et de la qualité de vie de même que la dépression et la discrimination. Finalement, en plus des préjudices sur la santé, l’obésité représente un fardeau économique important pour la société. Au Canada, les coûts associés à l’obésité et au surplus de poids (estimés avec des données de 2006) s’élèvent à six milliards $ en coûts directs et de cinq milliards $ en coûts indirects, totalisant 4,1% des coûts totaux de santé (47).
Au cours des dernières décennies, la proportion de la population mondiale souffrant d’obésité (IMC ≥ 30 kg/m2) ou d’embonpoint (IMC ≥ 25 et < 30 kg/m2) a considérablement augmenté. En effet, depuis 1980, la prévalence d’obésité dans le monde aurait doublé, pour atteindre 1,4 milliards de personnes souffrant d’embonpoint dont 500 millions de personnes obèses en 2008 (48). Au Canada, selon les résultats de l’Enquête canadienne sur les mesures de la santé, entre les années 2009 et 2011, 67% des hommes et 54% des femmes âgés entre 18 et 79 ans étaient obèses ou avaient un surplus de poids (49).
2.2 Définitions, conséquences et prévalence du SM
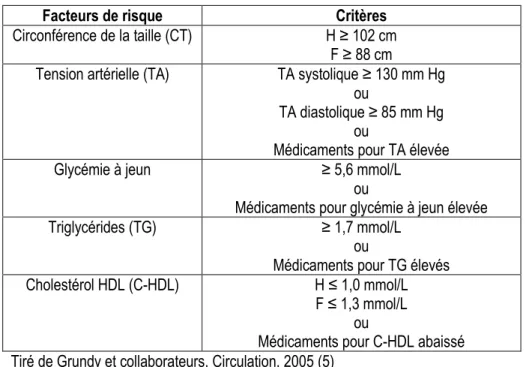
Le syndrome métabolique (SM), aussi appelé syndrome X ou syndrome de résistance à l’insuline (50) se caractérise par un ensemble d’anormalités métaboliques interreliées qui augmentent le risque de développer des maladies chroniques telles que les MCV et le DT2. Plus précisément, des études populationnelles prospectives démontrent que le SM s’accompagne d’un risque deux fois plus élevé de MCV et cinq fois plus élevé de DT2 (5). Les individus ayant le SM sont aussi plus susceptibles de développer d’autres conditions telles que le syndrome des ovaires polykystiques, une stéatose hépatique, des calculs biliaires de cholestérol, l’asthme, des troubles de sommeil et certains types de cancers (50). Dans la dernière décennie, différents critères ont été suggérés pour définir le syndrome métabolique. Six composantes du SM ont été identifiées comme étant liées aux MCV, soient les dyslipidémies athérogènes (concentrations élevées de triglycérides et d’apolipoprotéine B, particules LDL petites et denses, concentration faible de cholestérol HDL), l’hypertension artérielle, un état pro-thrombotique, un état pro-inflammatoire, la résistance à l’insuline et l’obésité abdominale, les deux dernières étant considérées comme les plus importantes (50). En 2001, le National Cholesterol Education Program (NCEP) Adult Treatment Panel III (ATP III) a proposé une définition du SM basée sur cinq critères : circonférence de la taille (CT) élevée, glucose à jeun élevée, tension artérielle (TA) élevée,
13 triglycérides (TG) élevés et cholestérol HDL (C-HDL) faible. En 2004, des modifications mineures ont été apportées à ces critères (5), soit la permission d’abaisser le seuil de CT pour les individus et groupes ethniques susceptibles à la résistance à l’insuline, la considération d’un des facteurs de risque métaboliques comme pathologique lorsqu’il y a usage de médicaments pour ce facteur, la clarification selon laquelle une TA élevée est un niveau qui dépasse le seuil de tension systolique ou diastolique et l’abaissement du seuil de glucose à jeun élevé de 6,1 mmol/L à 5,6 mmol/L. Ainsi, selon les plus récents critères du NCEP ATP III, un diagnostic de SM peut être établi lorsque trois parmi les cinq facteurs de risque présentés au tableau 4 sont présents (5).
Tableau 4. Critères diagnostiques du syndrome métabolique
Facteurs de risque Critères
Circonférence de la taille (CT) H ≥ 102 cm F ≥ 88 cm
Tension artérielle (TA) TA systolique ≥ 130 mm Hg ou
TA diastolique ≥ 85 mm Hg ou
Médicaments pour TA élevée
Glycémie à jeun ≥ 5,6 mmol/L
ou
Médicaments pour glycémie à jeun élevée
Triglycérides (TG) ≥ 1,7 mmol/L
ou
Médicaments pour TG élevés
Cholestérol HDL (C-HDL) H ≤ 1,0 mmol/L
F ≤ 1,3 mmol/L ou
Médicaments pour C-HDL abaissé Tiré de Grundy et collaborateurs, Circulation, 2005 (5)
D’autres organismes ont aussi proposé des définitions du SM. Avant 2009, la définition de l’International Diabetes Federation (IDF) (51) identifiait la CT comme une composante essentielle du SM, mais sa définition fait maintenant consensus avec celle du NCEP ATP III. Par contre, dans la définition de l’IDF, le seuil de CT élevée varie selon l’origine ethnique. Quant à l’organisation mondiale de la santé (OMS) et à l’American Association of Clinical Endocrinologists (AACE), bien que leurs critères soient similaires à ceux du NCEP ATP III de plusieurs façons, l’importance qu’ils accordent aux différents critères varie (50). En effet, selon l’OMS, la résistance à l’insuline est un critère obligatoire du SM, alors que ce n’est pas le cas pour le NCEP ATP III et l’AACE. De plus, contrairement au NCEP ATP III, l’OMS et l’AACE exigent un test de tolérance au glucose pour les sujets dont la concentration de glucose à jeun est normale, ce qui a le désavantage d’être moins pratique cliniquement. Il est aussi à noter qu’une CT élevée ne fait pas partie des critères de la définition de
14
l’AACE. Ainsi, selon la définition de l’OMS (50), pour avoir le SM, un individu doit être résistant à l’insuline (DT2, glucose à jeun élevé, test de tolérance au glucose élevé ou intolérance au glucose) et répondre à deux des critères suivants : TA élevée, TG élevés, C-HDL abaissé, IMC ≥ 30 25 kg/m2 et/ou ratio taille/hanche élevé, taux d’excrétion urinaire d’albumine ou ratio albumine/créatine élevés. En ce qui concerne l’AACE, elle a proposé des critères pour définir le SM mais n’a pas spécifié un nombre minimal de critères à rencontrer et laisse le jugement clinique décider du diagnostic (50). Les critères de l’AACE sont : IMC ≥ 25 kg/m2, TG élevés, C-HDL abaissé, TA élevée, glucose à jeun élevé ou test de tolérance au glucose élevé et autres facteurs de risque (histoire familiale de DT2, hypertension ou MCV, sédentarité, âge avancé, groupes ethniques à haut risque de DT2 ou MCV, syndrome des ovaires polykystiques). Dans la présente recherche, la définition du NCEP ATP III a été utilisée pour identifier les sujets ayant le SM.
La prévalence du SM varie d’un pays à l’autre, entres autres selon les critères utilisés, la méthodologie des études, l’âge et le mode de sélection de la population étudiée de même que la période de réalisation de l’étude (52). Au Canada, selon les résultats de l’Enquête canadienne sur les mesures de la santé, entre 2007 et 2009, un individu sur cinq âgé entre 6 et 79 ans avait le SM (53). Aux États-Unis, selon les données du
National Health and Nutrition Examination Surveys (NHANES), entre les années 1999 et 2006, environ 34 %
des adultes avaient le SM (soient 34,9 % des hommes et 33,3 % des femmes après ajustement pour l’âge) (3). Dans les dernières décennies, la prévalence du SM a grandement augmenté. En effet, Ford et collaborateurs (2004) (54) ont estimé, à partir des données de NHANES de 1990 à 2000, que 50 millions d’adultes américains avaient le SM en 1990 par rapport à 64 millions en 2000, ce qui représente une augmentation de 28 %. Puis, à partir des données de NHANES de 1999 à 2006, Mozumdar et Liguori (2011) (3) ont estimé que 68 millions d’adultes américains avaient le SM, ce qui représente une augmentation additionnelle de 6 %. Il est à noter qu’entre 1988 et 2006, l’augmentation de la prévalence du SM a été plus élevée chez les femmes (augmentation de 28,4 %) que chez les hommes (augmentation de 16,8 %) (3).
2.3 Étiologie de l’obésité et du SM
L’étiologie de l’obésité est très complexe et inclut un ensemble de facteurs biologiques, comportementaux et environnementaux qui interagissent ensemble (4), tel qu’illustré à la figure 3. En effet, il n’existe pas une cause unique à l’obésité mais bien diverses causes. De plus, ces causes sont interreliées et varient d’un individu à l’autre, ce qui complique la compréhension de l’étiologie de l’obésité et par le fait même l’élaboration de moyens de traitement de cette condition.
15
Figure 3. Étiologie de l’obésité (figure tirée du groupe Équilibre, www.equilibre.ca/)
D’abord, l’obésité est en partie déterminée par la génétique. Par exemple, dans l’Étude des familles de Québec (QFS), une héritabilité de 10 % à 50 % a été observée pour différents phénotypes de l’obésité (55). De plus, tel que démontré dans le Human Obesity Gene Map, en 2005, plus de 600 locus et 135 gènes candidats avaient été associés ou liés avec un phénotype d’obésité (56). Par contre, dans un contexte où la prévalence d’obésité a évolué très rapidement, il est difficile de concéder aux gènes un rôle primordial dans l’étiologie de l’obésité. Ainsi, des facteurs biologiques et individuels tels que des facteurs hormonaux, l’âge, le sexe, la prise de certains médicaments, le tabagisme et les habitudes de sommeil (57) ont aussi une influence. À cela s’ajoute la diminution des niveaux d’activité physique au cours du dernier siècle et l’augmentation des comportements sédentaires qui ont été directement associés à l’obésité (58). Sans oublier les facteurs socio-environnementaux (59), tels que l’omniprésence de nourriture, l’abondance d’aliments à densité énergétique élevée entres autres par l’augmentation des chaines de restauration rapide, l’augmentation de la grosseur des portions et l’aménagement urbain défavorable à l’activité physique qui ont assurément un rôle à jouer dans l’épidémie d’obésité actuelle. Finalement, de nombreux facteurs alimentaires, dont les apports en gras (60), en glucides (voir plus bas), en protéines (61), en alcool (62) et en calcium (63), les édulcorants (64), la densité énergétique (65), l’indice glycémique, l’allaitement (64) et plusieurs comportements alimentaires (fréquence des repas, repas pris au restaurant, vitesse d’ingestion, variété alimentaire) (66, 67) ont été associés à l’obésité, mais leurs effets demeurent controversés.
En ce qui concerne le SM, bien que son étiologie précise demeure inconnue, divers facteurs ont été associés à son développement. Son étiologie semble se diviser en trois catégories potentielles, soient l’obésité et les désordres du tissu adipeux, la résistance à l’insuline et une constellation de facteurs indépendants d’origine hépatique, vasculaire et immunologique (50). Par contre, les facteurs de risque les plus importants semblent
16
être l’obésité abdominale et la résistance à l’insuline (5). L’inactivité physique, l’âge, des débalancements hormonaux, l’inflammation et des prédispositions génétiques et ethniques ont aussi été associés à ce syndrome (5). De plus, certains facteurs alimentaires, tels que l’IG et la CG de l’alimentation, pourraient avoir un rôle à jouer dans le développement du SM (68). Le rôle de divers facteurs alimentaires dans l’étiologie du SM a très peu été étudié. Par contre, divers aspects de l’alimentation ont été associées aux facteurs de risque du SM, tels que les apports en différents macronutriments (différents types de lipides, glucides, protéines et alcool), en fibres et en produits laitiers, certains aliments fonctionnels (antioxydants, probiotiques), la densité énergétique et la diète Méditerranéenne, mais leurs effets demeurent très controversés (69).
L’augmentation de la prévalence d’obésité et du SM aux États-Unis dans les dernières décennies est temporellement associée à une augmentation de l’apport en glucides (70). En effet, selon le National Health
and Nutrition Examination Surveys (71), entre les années 1970 et 2000, aux États-Unis, la consommation de
lipides est restée relativement stable (et aurait même diminué si l’on considère l’apport en lipides exprimé en pourcentage de l’énergie totale), alors que la consommation de glucides a augmenté de 60 à 70 g par jour (voir figure 4). Par contre, l’association entre la consommation de glucides et l’obésité est controversée dans la littérature. Une revue de la littérature indique que la plupart des études épidémiologiques démontrent une association inverse entre l’apport en glucides et l’IMC, indépendamment des facteurs confondants potentiels (70). En fait, cette association semble différer selon le type d’aliment. Par exemple, l’IMC a été négativement associé à la consommation de grains entiers (70) et de fruits (72) et positivement associé à la consommation de boissons sucrées (73). L’association entre l’apport en glucides et le SM, quant à elle, demeure à ce jour très méconnue. Dans les dernières décennies, l’IG et la CG de l’alimentation ont aussi augmenté (6). Cela suggère que l’association entre l’apport en glucides et l’obésité et le SM pourrait être en partie modulée par l’IG et de la CG de l’alimentation. En effet, l’IG et la CG pourraient avoir contribué à l’épidémie d’obésité et de SM actuelle, mais leur rôle précis reste à être clarifié.
17
Figure 4. Apport moyen en glucides et en lipides selon le sexe chez les adultes de 20 à 74 ans aux États-Unis (Données provenant du National Health and Nutrition Examination Surveys, 2004) (71).
3. Relations entre IG, CG et obésité, adiposité et SM et ses
facteurs de risque
Cette section traitera d’abord des relations entre l’IG et la CG de l’alimentation et l’obésité et différentes variables d’adiposité, de même que des mécanismes qui ont été proposés pour tenter d’expliquer ces relations. Il sera ensuite question des relations entre l’IG, la CG et le SM et ses facteurs de risque ainsi que des mécanismes à l’appui. Finalement, les contraintes méthodologiques des études seront abordées.
3.1 Relations entre IG, CG et obésité
Les études ayant examiné le lien entre l’IG, la CG et le risque d’obésité sont limitées, et les résultats obtenus suggèrent que les associations avec l’obésité varient selon l’âge et le sexe des sujets. Youn et collaborateurs (2012) (74) ont examiné les associations entre l’IG, la CG et la prévalence de surpoids (IMC >25 kg/m2) auprès de 933 adultes coréens. Chez les hommes, la CG était négativement associée à la prévalence de surpoids et aucune association significative n’a été observée avec l’IG, alors que chez les femmes, l’IG et la CG étaient positivement associés à la prévalence de surpoids. Dans une étude effectuée auprès de 15974 enfants âgés entre 6 à 11 ans et de 8202 adolescents âgés entre 12 et 15 ans, une CG (mais pas un IG)
18
élevée était associée à un risque augmenté d’embonpoint chez les enfants de même que chez les adolescents, mais pas chez les adolescentes (75). Dans une autre étude effectuée auprès de 818 enfants âgés entre 4 et 10 ans et 818 adolescents âgés entre 11 et 18 ans, la CG, mais pas l’IG, était associée à un risque accru d’embonpoint chez les enfants et d’obésité chez les adolescents (76). Finalement, dans une étude effectuée auprès de 3714 enfants italiens âgés entre 6 et 14 ans, un IG élevé était associé à un risque de surpoids environ 50 % plus élevé et à un risque d’obésité abdominale environ deux fois plus élevé (77).
3.2 Relations entre IG, CG et différentes variables d’adiposité
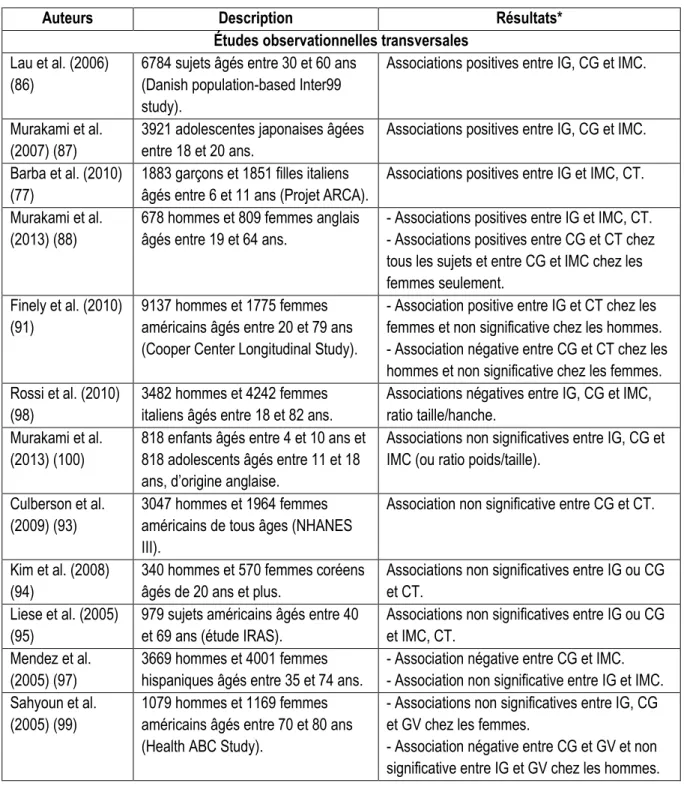
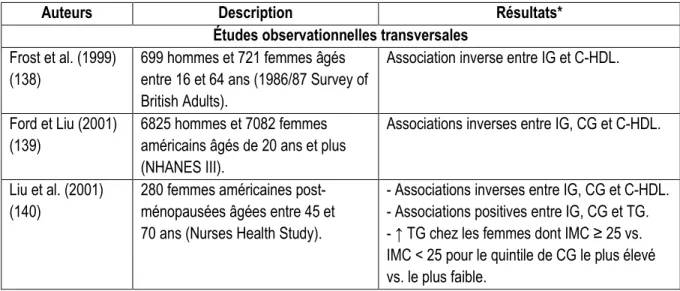
Le lien entre l’IG ou la CG et l’adiposité est très controversé dans la littérature. Bien que les études animales supportent l’effet bénéfique d’un IG faible sur l’adiposité, les études observationnelles et cliniques ne s’entendent pas sur le sujet. Les tableaux 5 et 6 présentent les résultats de l’ensemble des études observationnelles et d’intervention ayant étudié les effets de l’IG et de la CG sur le poids corporel, l’indice de masse corporelle (IMC), la circonférence de la taille (CT), le pourcentage de gras (% gras), la masse grasse (MG) et la graisse viscérale (GV).
Les études effectuées sur les animaux s’entendent pour dire qu’une diète à IG élevé s’accompagne d’un gain de poids, de masse grasse et de graisse viscérale plus important qu’une diète à IG faible (78-83), mais les effets de la CG sur l’adiposité ne semblent pas être documentés chez les animaux. Par contre chez l’humain, les études observationnelles et d’intervention ne s’entendent pas sur le lien entre l’IG, la CG et l’adiposité, et les résultats varient selon les variables étudiées, la grande majorité des études ayant trouvé des relations significatives pour certaines variables d’adiposité et non significatives pour d’autres, ou encore des relations significatives pour l’IG mais pas pour la CG, ou vice-versa. En effet, concernant les études observationnelles, des relations positives significatives ont été observées entre l’IG et/ou la CG et l’IMC (77, 84-88), la circonférence de la taille (77, 84, 88-91), le pourcentage de gras (90) et la masse grasse (76), alors que des relations non significatives ont été observées dans plusieurs études (92-95). De plus, on retrouve des différences selon le sexe (75, 84, 88, 90, 91, 96) et on a même trouvé quelques relations négatives (91, 97-99). Par exemple, une étude effectuée chez 19 694 hommes et 28 937 femmes de la cohorte EPIC suggère que l’IG initial est associé à une augmentation sur cinq ans et demi de la CT ajustée pour l’IMC, qui est un indicateur de l’adiposité viscérale, chez tous les sujets, et que la CG initiale est associée à une augmentation de la CT ajustée pour l’IMC chez les femmes seulement (96). Dans une autre étude effectuée auprès de 37 561 hommes et 51 871 femmes provenant de 5 pays européens, faisant partie du projet DiOGenes et suivis pendant 6.5 ans en moyenne, une augmentation d’IG de 10 unités était associée à une augmentation de la CT de 0,26 cm par année après ajustement pour les facteurs confondants potentiels. Par contre,
19 l’association entre la CG initiale et le changement de CT sur 6,5 ans de même que les associations entre l’IG et la CG initiaux et le changement de poids n’étaient pas significatives après ajustement pour les covariables (89).
Tableau 5. Résultats d’études observationnelles ayant examiné les associations entre IG, CG et adiposité
Auteurs Description Résultats*
Études observationnelles transversales
Lau et al. (2006) (86)
6784 sujets âgés entre 30 et 60 ans (Danish population-based Inter99 study).
Associations positives entre IG, CG et IMC.
Murakami et al. (2007) (87)
3921 adolescentes japonaises âgées entre 18 et 20 ans.
Associations positives entre IG, CG et IMC. Barba et al. (2010)
(77)
1883 garçons et 1851 filles italiens âgés entre 6 et 11 ans (Projet ARCA).
Associations positives entre IG et IMC, CT. Murakami et al.
(2013) (88)
678 hommes et 809 femmes anglais âgés entre 19 et 64 ans.
- Associations positives entre IG et IMC, CT. - Associations positives entre CG et CT chez tous les sujets et entre CG et IMC chez les femmes seulement.
Finely et al. (2010) (91)
9137 hommes et 1775 femmes américains âgés entre 20 et 79 ans (Cooper Center Longitudinal Study).
- Association positive entre IG et CT chez les femmes et non significative chez les hommes. - Association négative entre CG et CT chez les hommes et non significative chez les femmes. Rossi et al. (2010)
(98)
3482 hommes et 4242 femmes italiens âgés entre 18 et 82 ans.
Associations négatives entre IG, CG et IMC, ratio taille/hanche.
Murakami et al. (2013) (100)
818 enfants âgés entre 4 et 10 ans et 818 adolescents âgés entre 11 et 18 ans, d’origine anglaise.
Associations non significatives entre IG, CG et IMC (ou ratio poids/taille).
Culberson et al. (2009) (93)
3047 hommes et 1964 femmes américains de tous âges (NHANES III).
Association non significative entre CG et CT.
Kim et al. (2008) (94)
340 hommes et 570 femmes coréens âgés de 20 ans et plus.
Associations non significatives entre IG ou CG et CT.
Liese et al. (2005) (95)
979 sujets américains âgés entre 40 et 69 ans (étude IRAS).
Associations non significatives entre IG ou CG et IMC, CT.
Mendez et al. (2005) (97)
3669 hommes et 4001 femmes hispaniques âgés entre 35 et 74 ans.
- Association négative entre CG et IMC. - Association non significative entre IG et IMC. Sahyoun et al.
(2005) (99)
1079 hommes et 1169 femmes américains âgés entre 70 et 80 ans (Health ABC Study).
- Associations non significatives entre IG, CG et GV chez les femmes.
- Association négative entre CG et GV et non significative entre IG et GV chez les hommes.
20
Études observationnelles prospectives
Murakami et al. (2013) (76)
208 garçons et 218 filles âgés de 12 ans (Northern Ireland Young Hearts Study), suivi de 3 ans.
- Association positive entre IG et ∆ indice de MG
- Associations non significatives entre IG et ∆ IMC, ∆ % gras.
- Associations non significatives entre CG et ∆ adiposité.
- Associations non significatives entre ∆ IG ou ∆ CG et ∆ adiposité.
Du et al. (2009) (89)
37 561 hommes et 51 871 femmes âgés entre 20 et 78 ans provenant de 5 pays européens (projet DiOGenes), suivi moyen de 6,5 ans.
- Pour chaque 10 unité d’IG, ↑ significative de 0.26 cm de CT par année.
- Associations non significatives entre IG ou CG et ∆ poids et entre CG et ∆ CT. Gopinath et al.
(2013) (84)
435 garçons et 421 filles âgés de 12 ans (Sydney Childhood Eye Study), suivi de 5 ans.
- Associations positives entre ∆ CG et ∆ IMC, ∆ CT chez les filles et non significatives chez les garçons.
- Associations non significatives entre ∆ IG et ∆ IMC ou ∆ CT.
- Associations non significatives entre IG ou CG et ∆ IMC, ∆ % gras et ∆ CT.
Ma et al. (2005) (85)
297 hommes et 275 femmes américains âgés entre 20 et 70 ans, suivi d’un an.
- Associations positives entre IG et IMC et ∆ IMC.
- Associations non significatives entre CG et IMC ou ∆ IMC.
Hare-Bruun et al. (2006) (90)
185 hommes et 191 femmes danois âgés entre 30 et 60 ans (étude MONICA), suivi de 6 ans.
- Associations positives entre IG et ∆ poids, ∆ CT et ∆ % gras chez les femmes et non significatives chez les hommes.
- Associations non significatives pour la CG. Romaguera et al.
(2010) (96)
19 694 hommes et 28 937 femmes âgés de moins de 60 ans (cohorte EPIC), suivi de 5,5 ans.
- Association positive entre IG et ∆ adiposité viscérale (CT ajustée pour IMC).
- Association positive entre CG et ∆ adiposité viscérale (CT ajustée pour IMC) chez les femmes et non significative chez les hommes. Cheng et al.
(2009) (92)
99 garçons et 116 filles âgés de plus de 5 ans (étude DONALD), suivi de 4 ans.
Associations non significatives entre ∆ IG ou ∆ CG et ∆ IMC ou ∆ % gras.
*IMC : indice de masse corporelle; CT : circonférence de la taille; MG : masse grasse; GV : graisse viscérale; % gras : pourcentage de gras; IG : indice glycémique, CG : charge glycémique; ∆ : changement avec le temps
En ce qui concerne les études d’intervention, deux méta-analyses ont étudié le lien entre l’IG ou la CG et le poids corporel ou l’adiposité. La première incluait les résultats de 23 études ayant mesuré la perte de poids en lien avec des diètes à IG ou CG faible et a démontré que les diètes à IG ou CG faibles ad libitum, mais pas
21 celles où l’apport énergétique était restreint, s’accompagnaient d’une perte de poids significative (101). L’autre méta-analyse, publiée l’année suivante, s’est intéressée spécifiquement à des sujets obèses ou ayant un surplus de poids. Elle regroupait six études cliniques contrôlées et randomisées d’une durée d’au moins deux semaines (total de 202 participants) ayant comparé les effets d’une diète à IG ou CG faible à ceux d’une diète à IG ou CG plus élevé ou à ceux d’une diète faible en gras sur l’adiposité. Elle a indiqué que les pertes de poids et de MG de même que la réduction de l’IMC étaient significativement plus élevées chez les sujets ayant consommé une diète à IG ou CG faible que chez ceux ayant eu une diète alternative. En effet, les diètes à IG ou CG faible se sont accompagnées de réductions statistiquement significatives de 1,1 kg de poids, 1,1 kg de MG et 1,3 unités d’IMC comparativement aux diètes contrôles (102).
Plusieurs études d’intervention suggèrent qu’une diète à IG ou CG faible s’accompagne d’une perte de poids plus importante (103-108) ou encore d’un regain de poids moins important suite à une perte de poids (109), d’une réduction de l’IMC (105), de la CT ou du ratio taille/hanche (105, 110, 111), de la MG ou du % gras (107, 112-115) et de la GV (115). Certaines ont trouvé des résultats concluants seulement chez les sujets ayant un taux d’insuline élevé suite à un test de tolérance au glucose (107, 108). Finalement, d’autres études se sont avérées non concluantes (116-122). Il est à noter que certaines études ont utilisé des diètes ad libitum alors que d’autres ont utilisé des diètes restrictives, et que certaines diètes étaient contrôlées pour certaines variables d’influence, telles que l’apport en macronutriments et en fibres, alors que d’autres ne l’étaient pas, ce qui a pu influencer les résultats des études.
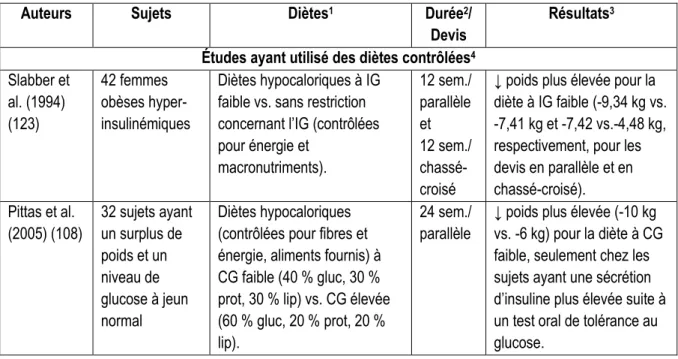
Tableau 6. Résultats d’études d’intervention ayant étudié l’effet d’une diète à IG ou CG faible sur l’adiposité
Auteurs Sujets Diètes1 Durée2/
Devis
Résultats3
Études ayant utilisé des diètes contrôlées4
Slabber et al. (1994) (123) 42 femmes obèses hyper-insulinémiques Diètes hypocaloriques à IG faible vs. sans restriction concernant l’IG (contrôlées pour énergie et macronutriments). 12 sem./ parallèle et 12 sem./ chassé-croisé
↓ poids plus élevée pour la diète à IG faible (-9,34 kg vs. -7,41 kg et -7,42 vs.-4,48 kg, respectivement, pour les devis en parallèle et en chassé-croisé). Pittas et al. (2005) (108) 32 sujets ayant un surplus de poids et un niveau de glucose à jeun normal Diètes hypocaloriques (contrôlées pour fibres et énergie, aliments fournis) à CG faible (40 % gluc, 30 % prot, 30 % lip) vs. CG élevée (60 % gluc, 20 % prot, 20 % lip).
24 sem./ parallèle
↓ poids plus élevée (-10 kg vs. -6 kg) pour la diète à CG faible, seulement chez les sujets ayant une sécrétion d’insuline plus élevée suite à un test oral de tolérance au glucose.
22 Larsen et al. (2010) (109) 773 sujets avec un surplus de poids ayant perdu au moins 8% de leur poids corporel au préalable
5 diètes visant le maintien du poids, contrôlées en lipides et énergie mais différant en termes d’IG et de contenu en protéines : 1) IG↑ et prot ↑; 2) IG↑ et prot ↓; 3) IG↓ et prot ↑; 4) IG↓ et prot ↑, 5) témoin.
26 sem./ parallèle
Regain de poids de 0,95 kg de moins pour les diètes à IG faible. Das et al. (2007) (113) 34 sujets ayant un surplus de poids (étude CALERIE) Diètes hypocaloriques à CG faible vs. élevée (contrôlées pour fibres, densité
énergétique, apparence et goût, aliments fournis pendant 6 mois).
1 an/ parallèle
-Aucune différence significative entre les 2 diètes en ce qui concerne ∆ poids, ∆ IMC et ∆ MG. McMillan-Price et al. (2006) (106) 129 sujets ayant un surplus de poids 4 diètes hypocaloriques (contrôlées en lipides, fibres et énergie) : 1)↑gluc et IG↑; 2)↑gluc et IG↓; 3)↑prot et IG↑; 4)↑prot et IG↓).
12 sem./ parallèle
- Perte poids semblable pour les 4 diètes. Armeno et al (2011) (110) 86 adolescents obèses et hyper-insulinémiques Diètes hypocaloriques à IG faible vs. sans restriction concernant l’IG (contrôlées en macronutriments).
16 sem./ parallèle
- Perte de poids semblable pour les 2 groupes. - ↓ plus élevée de la CT (-9,1 cm vs. -6,6 cm) pour la diète à IG faible. de Assis Costa et de Cássia Gonçalves Alfenas (2012) (111) 17 sujets ayant un surplus de poids
Diètes ad libitum à IG faible vs. élevé (contrôlées pour macronutriments, fibres, densité énergétique et nombre de portions de fruits et incluant 2 repas/j consommés en laboratoire). 14 jours/ chassé-croisé - ↓ du poids (580 g) et de la CT (≈1.5 cm) pour la diète à IG faible seulement. - Aucune différence significative entre les 2 diètes en ce qui concerne ∆ IMC et ∆ % gras. Sichieri et al. (2007) (117) 203 femmes ayant un surplus de poids
Diètes avec faible restriction calorique à IG faible vs. élevé (contrôlées en macronutriments et fibres). 18 mois/ parallèle Aucune différence significative concernant ∆ poids. Pal et al. (2008) (118) 21 sujets ayant un surplus de poids
Déjeuners à IG faible vs. élevé contrôlés en macronutriments et fournis (autres repas non contrôlés) 21 jours/ chassé-croisé Aucune différence significative concernant ∆ poids. Sloth et al. (2004) (120) 45 sujets ayant un surplus de poids
Diètes ad libitum faibles en gras et riches en glucides à IG faible vs. élevé (contrôlées pour macronutriments, fibres et densité énergétique).
10 sem./ parallèle
Aucune différence significative entre les 2 diètes en ce qui concerne ∆ poids et ∆ MG.