HAL Id: dumas-02071258
https://dumas.ccsd.cnrs.fr/dumas-02071258
Submitted on 18 Mar 2019HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Actualité sur le développement pubertaire : étude pilote
observationnelle de faisabilité
Johan Mazzarino
To cite this version:
Johan Mazzarino. Actualité sur le développement pubertaire : étude pilote observationnelle de fais-abilité. Médecine humaine et pathologie. 2018. �dumas-02071258�
HAL Id: dumas-02071258
https://dumas.ccsd.cnrs.fr/dumas-02071258
Submitted on 18 Mar 2019HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Actualité sur le développement pubertaire : étude pilote
observationnelle de faisabilité
Johan Mazzarino
To cite this version:
Johan Mazzarino. Actualité sur le développement pubertaire : étude pilote observationnelle de fais-abilité. Médecine humaine et pathologie. 2018. <dumas-02071258>
Université de Bordeaux
U.F.R DES SCIENCES MEDICALES
Année 2018 N°3074
Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN MEDECINE
Présentée et soutenue publiquement Par MAZZARINO Johan
Né le 7/11/1989 à Villeneuve St-Georges (94) le 3/09/2018
Actualité sur le développement pubertaire – Étude pilote observationnelle de
faisabilité
Directeur de thèse
Dr PUEL Olivier
Jury
Dr BRISSAUD Olivier, PU-PH (président) Dr BARAT Pascal, PU-PH
Dr DURIEUX William, Professeur associé Dr PIGEON-KHERCHICHE Patricia, Docteur
Université de Bordeaux
U.F.R DES SCIENCES MEDICALES
Année 2018 N°3074
Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN MEDECINE
Présentée et soutenue publiquement Par MAZZARINO Johan
Né le 7/11/1989 à Villeneuve St-Georges (94) le 3/09/2018
Actualité sur le développement pubertaire – Étude pilote observationnelle de
faisabilité
Directeur de thèse
Dr PUEL Olivier
Jury
Dr BRISSAUD Olivier, PU-PH (président) Dr BARAT Pascal, PU-PH
Dr DURIEUX William, Professeur associé Dr PIGEON-KHERCHICHE Patricia, Docteur
REMERCIEMENTS
En premier lieu, je voudrais remercier le Dr Olivier Puel d’avoir dirigé ma thèse. Un grand merci de m’avoir intégré à ce projet, pour ta disponibilité de tous les instants et ton aide précieuse. J’ai beaucoup de chance d’avoir pu réaliser ce travail avec toi.
Je voudrais ensuite remercier le Pr Olivier Brissaud qui a accepté de présider le Jury de cette thèse. Merci pour l’honneur que tu me fais. Merci également pour ton enseignement en réanimation et pour l’esprit de compagnonnage dont tu fais bénéficier les internes.
Un remerciement particulier au Pr Pascal Barat dont l’accompagnement ne se limite pas à son rôle de rapporteur de thèse ou de membre de jury. Un grand merci pour vos conseils avisés tout au long de ce travail. Merci d’avoir pensé à moi pour travailler sur ce projet qui me correspond bien. Et merci pour votre accompagnement tout au long de mon cursus.
Merci également Dr Durieux William d’avoir accepté de faire partie de mon jury et pour votre soutien dès le premières étapes de ce travail.
Au Dr Pigeon-Kherchiche Patricia pour avoir accepté de faire partie de mon jury avec enthousiasme.
Pour la réalisation de cette thèse, je voudrais également remercier tous les médecins qui ont participé à l’étude ainsi que les enfants et leurs familles. Des remerciements non quantifiables au Dr Jesuran-Perelroizen Monique pour son investissement et ses conseils avisés. Merci également à Charlotte Renoir pour son accompagnement et son travail dans ce projet. Enfin merci à Kristina et David pour leur aide précieuse dans la relecture de la version anglaise. A tous les soignants que j’ai pu côtoyer au cours de ma formation et qui m’ont chacun enrichi un peu plus. Merci à mes co-internes et amis sans qui ces années auraient été bien différentes. Tout particulièrement merci à Anaïs, Marion, Margaux, Adeline, Ambre, Julien, Sarah, Camille… Merci à mes co-internes et mes chefs de réanimation de St Denis à La Réunion pour m’avoir supporté ces dernières semaines. Merci à Anthéa, Manu, Marie, Léa…
Merci à mes amis qui m’ont soutenu dans les étapes plus anciennes ; Camille, Béa, Seb, Gwen, Max, Mélanie, Lucille, Jerem, Vincent, Xavier, Jasmine, Nelly…
Merci surtout à mes parents, à ma précieuse sœur Lucille, à Maxime. Vous avez fait ce parcours avec moi, à toutes les étapes. Il m’aurait été impossible de réussir sans vous. MERCI. Enfin à Brice, merci de me rappeler chaque jour que là n’est pas l’essentiel.
Table des matières
PARTIE I – PRE-REQUIS ... 7 1. LA PUBERTE ... 7 1.1. Définition ... 7 1.2. Méthode d’évaluation ... 7 1.2.1. Stades de Tanner ... 71.2.1.1. Développement mammaire selon Tanner ... 7
1.2.1.2. Pilosité pubienne des filles selon Tanner ... 8
1.2.1.3. Développement des organes génitaux externes du garçon selon Tanner . 8 1.2.1.4. Pilosité pubienne du garçon selon Tanner ... 8
1.2.2. Volume testiculaire ... 10
1.2.3. Autres marqueurs pubertaires cliniques ... 10
1.2.4. Discussion autour des marqueurs pubertaires ... 11
1.2.4.1. Chez la fille ... 11
1.2.4.2. Chez le garçon ... 11
1.3. Physiologie et biologie de la puberté... 11
1.3.1. L’axe Hypothalamo-Hypophyso-Gonadique (HHG) ... 11
1.3.2. Mécanisme biologique du développement pubertaire ... 12
1.4. Épidémiologie ... 13
1.4.1. Historique ... 13
1.4.2. Normes actuelles ... 13
1.4.2.1. Filles ... 13
1.4.2.2. Garçons ... 14
1.4.3. Évolution de la puberté sur les dernières décennies ... 14
1.4.3.1. Filles ... 14
1.4.3.1.1. Âge de début de puberté ... 14
1.4.3.1.2. Chronologie et cinétique de la puberté ... 17
1.4.3.1.3. Durée de la puberté ... 18
1.4.3.2. Garçons ... 20
1.4.3.2.1. Âge de début de puberté ... 20
1.4.3.2.2. Chronologie de la puberté ... 20
1.4.3.2.3. Durée de la puberté ... 21
1.4.4. Variabilité ethnique ... 21
1.4.5. Données françaises ... 23
1.5. Facteurs influents... 24 1.5.1. Généralités ... 24 1.5.2. Obésité ... 25 1.5.2.1. Filles ... 25 1.5.2.2. Garçons ... 26 1.5.2.3. Hypothèses explicatives ... 27 1.5.2.3.1. Aromatase ... 27 1.5.2.3.2. Insulinorésistance ... 27 1.5.2.3.3. Leptine(30,34) ... 27 1.5.2.3.4. Kisspeptines ... 28 1.5.3. Perturbateurs endocriniens ... 29
1.5.4. Facteurs influents et période d’exposition ... 29
2. La recherche en libéral ... 31
2.1. AFPA / AFPEL ... 31
2.2. Intérêt d’un échantillon extra hospitalier ... 31
3. Justification de l’étude ... 32
3.1. Étude nationale PROSPEL ... 32
3.2. Étude pilote de faisabilité ... 32
PARTIE II – Étude pilote ... 33
PARTIE III – Discussion complémentaire ... 56
1. Discussion sur les bornes pubertaires ... 56
1.1. Puberté précoce... 56
1.2. Bornes de puberté physiologiques ... 56
1.2.1. Vers une redéfinition des âges limites ?... 56
1.2.2. Limites... 56
1.2.3. Vers une nouvelle approche : notion de phénotype pubertaire ... 57
2. Pistes méthodologiques pour l’étude nationale ... 57
2.1. Généralités ... 57
2.2. Constitution d’un échantillon représentatif de médecins. ... 58
2.3. Constitution d’un échantillon représentatif de patients ... 58
2.4. Optimisation de l’acceptabilité des médecins et des patients ... 59
2.5. Paramètres soumis à évaluation ... 59
BIBLIOGRAPHIE ... 61
LISTE DES ANNEXES
Annexe 1 : Fiche memo recto-verso
Annexe 2 :Notice d’information, de non opposition et affiche de salle d’attente Annexe 3 : Fiche de recueil papier anonymisée
Annexe 4 : Feuille de correspondance
PARTIE I – PRE-REQUIS
1. LA PUBERTE
1.1. Définition
La puberté représente le processus physique et psychologique, duquel résulte l’acquisition des capacités de reproduction. Elle repose sur une séquence complexe d’événements biologiques aboutissant à la maturation des caractères sexuels secondaires et à l’accélération de la croissance staturale.
Chez la fille, le développement pubertaire aboutit notamment au développement des seins, de la pilosité pubienne ainsi qu’à l’apparition des premières menstruations témoignant d’une mise en activité du système de reproduction. On nomme thélarche le moment d’apparition des premiers signes de développement mammaire, pubarche les premiers signes de développement de la pilosité pubienne, et ménarche les premières menstruations.
Chez le garçon, le développement pubertaire se traduit en autre par une augmentation du volume testiculaire, un allongement de la verge, et le développement de la pilosité pubienne, ainsi que plus tardivement les premières éjaculations et une modification de la voix.
1.2. Méthode d’évaluation
Différents marqueurs pubertaires peuvent être utilisés pour apprécier l’évolution pubertaire. Les médecins se basent historiquement sur la classification proposée par Tanner et Marshall.
1.2.1. Stades de Tanner
Tanner et Marshall se sont attachés à décrire en 1969 et 1970 les différents stades évolutifs de la puberté chez les garçons et chez les filles. Ils ont proposé une classification qui est encore aujourd’hui utilisée comme référence. (1,2).
(Voir photographie 1)
1.2.1.1. Développement mammaire selon Tanner
- Stade S1 : Stade infantile, absence de bourgeon mammaire.
- Stade S2 : Petit bourgeon mammaire avec élévation du sein et de la papille et élargissement de l’aréole.
- Stade S3 : Poursuite de l’augmentation de la taille du sein et de l’aréole sans que leurs contours ne soient séparés et pigmentation de l’aréole.
- Stade S4 : Saillie de l’aréole et de la papille au-dessus du plan du sein.
- Stade S5 : Stade adulte, saillie de la papille en avant de l’aréole et de la glande mammaire. (Retour de l’aréole dans le même plan que la glande mammaire)
1.2.1.2. Pilosité pubienne des filles selon Tanner
- Stade P1 : Stade infantile, pas de pilosité.
- Stade P2 : Quelques poils droits peu nombreux le long des lèvres et sur le pubis. - Stade P3 : Poils plus denses, épais et bouclés commençant à s’étendre vers la jonction
pubienne.
- Stade P4 : Pilosité d’aspect adulte, triangulaire, fournie.
- Stade P5 : Stade adulte, extension à la partie interne des cuisses.
1.2.1.3. Développement des organes génitaux externes du garçon selon Tanner
- Stade G1 : Stade infantile, organes génitaux de taille et proportions similaires à la petite enfance.
- Stade G2 : Changement de texture et de coloration du scrotum avec élargissement de ce dernier et augmentation du volume des testicules.
- Stade G3 : Poursuite de la croissance du volume des testicules et du scrotum, et début de croissance de la verge, en longueur puis en largeur.
- Stade G4 : Poursuite de la croissance de la verge et des testicules. La peau du scrotum devient plus foncée.
- Stade G5 : Taille adulte.
1.2.1.4. Pilosité pubienne du garçon selon Tanner
- Stade P1 : Stade infantile, pas de pilosité ou simple duvet. - Stade P2 : Quelques poils droits à la racine du pénis.
- Stade P3 : Poils plus denses épais et bouclés, visible à la jonction avec le pubis. - Stade P4 : Pilosité d’aspect adulte, triangulaire, fournie.
- Stade P5 : Stade adulte, extension à la racine des cuisses et à la ligne ombilico-pubienne.
Photographie 1 – Illustration des stades pubertaires selon Tanner
1.2.2. Volume testiculaire
Le volume testiculaire est un marqueur pubertaire clé dans l’évaluation du développement génital du garçon.
Il est apprécié en pratique clinique à l’aide d’un orchidomètre. Cet outil a été mis au point en 1966 par le pédiatre endocrinologue suisse Andrea Prader. Il consiste en une suite de douze perles numérotées, en bois ou en plastique, de taille croissante de 1 à 25 millilitres (voir
Photographie 2). Les perles sont comparées aux testicules du patient. Le volume est lu sur la
perle de taille la plus proche. Les tailles correspondant à la pré-puberté vont de 1 à 3 ml. La taille du démarrage de la puberté correspond à 4 ml.
La corrélation entre les stades de Tanner et le volume testiculaire estimé à l’aide de l’orchidomètre a été défini comme suit :
- Stade G1 : 1 à 3 ml - Stade G2 : 4 à 6 ml - Stade G3 : 8 à 10 ml - Stade G4 : 12 à 15 ml - Stade G5 : 20 à 25 ml
Photographie 2 – Orchidomètre de Prader
1.2.3. Autres marqueurs pubertaires cliniques
D’autres marqueurs pubertaires plus ou moins sensibles et faciles à évaluer peuvent être utilisés comme l’âge de ménarche chez la fille, l’âge de début de poussée de croissance, l’âge du pic de croissance, l’âge de mue de la voix, de la pilosité faciale ou des premières éjaculations chez le garçon (spermarche ou éjacularche).
1.2.4. Discussion autour des marqueurs pubertaires
1.2.4.1. Chez la fille
Les marqueurs pubertaires chez la fille sont plus accessibles que chez le garçon. La simple inspection est déjà informative. L’âge de la ménarche est une donnée facile à obtenir.
En revanche, le stade S2 est parfois difficile à distinguer à l’inspection seule. Même à la palpation il est parfois difficile de différencier une glande mammaire en début de développement d’une masse graisseuse, en particulier chez les jeunes filles en surpoids (3). Du fait de la prévalence croissante de l’obésité, cette situation est souvent rencontrée et il faut tenir compte du risque de sur-classification de filles en réalité pré-pubères (4).
1.2.4.2. Chez le garçon
Les changements subtils de la taille du pénis et de la texture de la peau scrotale comme décrits par Tanner sont des marqueurs pubertaires difficiles à apprécier. Ils sont sources de subjectivité et de variabilité interindividuelle bien plus élevées que la stadification avec l’orchidomère (5). Il a été admis par des comités d’experts que cette approche devait désormais être favorisée pour une estimation plus fiable du développement gonadique (3). L’utilisation de l’orchidomètre de Prader surévalue le volume testiculaire réel d’environ 25%. Cependant la corrélation entre orchidomètre et échographie testiculaire est généralement très bonne en cours de puberté (6). Il est difficile de trouver un consensus pour définir si le début de puberté correspond à un volume testiculaire de 3 ou 4 ml. Au regard des taux de testostérone, une étude semblait montrer que le début de puberté correspondait à un volume testiculaire de 3 ml (7), mais la plupart des auteurs définissent comme 4 ml le volume testiculaire signant l’entrée en puberté (8).
Les marqueurs pubertaires plus tardifs comme la spermarche ou la mue de la voix ont une physiologie moins bien connue. De plus, la détermination de l’âge de la spermarche par la recherche répétée de spermatozoïdes dans les urines est difficile à mettre en place en pratique courante et sa détermination par simple interrogatoire est soumise à un risque de biais de mémoire ou de subjectivité.
1.3. Physiologie et biologie de la puberté
1.3.1. L’axe Hypothalamo-Hypophyso-Gonadique (HHG)
A l’âge adulte, la sécrétion pulsatile de GnRH (Gonadotrophine Releasing Hormone) par l’hypothalamus induit la libération des hormones gonadotropes, LH (Luteinizing Hormone) et FSH (Follicle Stimulating Hormone) qui ont une action directe sur les gonades. Elles stimulent la production et la sécrétion des stéroïdes sexuels (œstrogènes et testostérone). Ces derniers exercent un rétrocontrôle négatif sur l’hypothalamus et l’hypophyse.
1.3.2. Mécanisme biologique du développement pubertaire
L’axe HHG est activé de façon transitoire dans les mois qui suivent la naissance (mini puberté), puis devient quiescent, pendant plusieurs années jusqu’à la puberté (9). La réactivation de cet axe est l’évènement primaire fondamental pour l’initiation de la puberté. Les facteurs responsables de la réactivation de l’axe HHG au début de la puberté sont encore mal compris, mais impliquent une interaction complexe entre des facteurs métaboliques, nutritionnels et stéroïdiens (4). (Voir figure 1)
Figure 1 –Activité et mécanisme de l’axe HHG au cours de la vie
(d’après Bouvattier 2014)
Aux premiers stades pubertaires, l’amplitude et la fréquence des pics sécrétoires de GnRH augmentent progressivement, la nuit initialement puis sur le nycthémère (10). La sécrétion de LH et FSH augmente proportionnellement.
Chez la fille, la FSH favorise le développement folliculaire, et en association avec la LH, entraine une augmentation progressive de la sécrétion d’œstradiol. Le premier signe de puberté vraie est le développement mammaire, témoin de l’imprégnation oestrogénique. Le développement de la pilosité peut être en rapport avec l’adrénarche, témoin de la maturation surrénalienne et de la sécrétion d’androgènes surrénaliens comme la DHEA (Déhydroépiandrostènedione). Ainsi le début de puberté chez la fille doit plutôt être défini par les premiers signes de développement mammaire. Les premières menstruations arrivent quand le taux de gonadotrophines est suffisamment élevé pour aboutir à un pic de LH en milieu de cycle provoquant l’ovulation (11).
Chez le garçon, la LH provoque la production de testostérone qui, conjointement avec la FSH, stimule la spermatogénèse. Les concentrations diurnes de testostérone augmentent progressivement au cours de la puberté jusqu’à l’âge adulte, la hausse la plus rapide se produisant entre les stades 2 et 3 de Tanner (10). Le développement de la pilosité et l’accélération de la vitesse de croissance sont régulés par les androgènes testiculaires, ce qui explique que ces évènements se produisent plus tardivement que chez la fille, car les concentrations augmentent progressivement.
1.4. Épidémiologie
1.4.1. Historique
De nombreuses études ont montré que l’âge d’entrée en puberté a varié au cours des siècles. L’étude des dents et des restes osseux ainsi que les textes historiques ou les manuels médicaux datant de l’antiquité ont permis de se faire une idée des tendances séculaires pubertaires depuis la préhistoire. On estime par exemple que les premières règles survenaient entre 7 et 12 ans au Paléolithique (12). Hogberg illustre dans son graphique (voir figure 2) l’élévation progressive de cet âge de puberté, culminant à la fin du 19ème siècle pour diminuer à nouveau par la suite.
Figure 2 – Évolution de l’âge de la ménarche au cours des âges
(D’après Hogberg 2013)
1.4.2. Normes actuelles
1.4.2.1. Filles
Les premiers signes de développement des seins apparaissent en moyenne vers 10 ans et demi, aboutissant à des seins de taille adulte vers 15 ans. Le développement de la pilosité pubienne débute le plus souvent quelques mois après celui des glandes mammaires.
L’accélération de la croissance pubertaire est synchrone des premiers signes pubertaires. La vitesse de croissance augmente rapidement, atteint un pic, puis diminue. Les règles apparaissent lors de la diminution de la vitesse de croissance. L’âge d’apparition des premières menstruations est considéré comme physiologique entre 10 et 15 ans, soit 12 ans et demi en moyenne.
1.4.2.2. Garçons
L’augmentation du volume testiculaire débute vers l’âge de 12 ans. Elle précède l’augmentation de la taille de la verge et le développement de la pilosité pubienne de 6 mois en moyenne.
La poussée de croissance débute 1 an après l’apparition des premiers signes de développement pubertaire. Le pic de croissance est plus tardif, vers 14 ans en moyenne, contemporain du stade G4 (12-15ml).
1.4.3. Évolution de la puberté sur les dernières décennies
1.4.3.1. Filles
1.4.3.1.1. Âge de début de puberté
Historiquement, la référence correspond aux études menées par Tanner et Marshall (1) qui considéraient l’âge normal du début de puberté entre 8 et 13 ans chez la fille, même si les premières données publiées aux États-Unis sur ce sujet datent des années 1930-1940.
L’âge de la puberté est resté stable pendant 30 à 40 ans dans les pays industrialisés, jusqu’à ce que des études américaines indépendantes (PROS et NHANES III) publiées en 1997 et 2002 observent une surprenante avancée de l’âge de début de développement des seins chez les filles américaines (13,14). De nombreuses études plus récentes corroborent ces observations. Dans l’échantillon observé par Tanner en 1969, l’âge moyen d’entrée en puberté, défini par le Stade S2, était de 11,15 ans. Les études plus récentes semblent confirmer qu’un début de développement pubertaire avant l’âge de 8 ans serait une situation fréquente, soulevant la question des bornes de la puberté physiologique. L’étude PROS en 1997 (13) observe chez les filles blanches que 5% des filles de 7 ans et 10,5% des filles de 8 ans présentaient un développement mammaire supérieur ou égal au stade S2, avec un âge moyen d’entrée dans le stade S2 estimé à 9,96 ans, soit plus d’une année plus tôt que ce qui était décrit par Marshall et Tanner. La méthodologie de cette étude a été largement critiquée du fait d’une évaluation uniquement visuelle (sans palpation). Cependant d’autres études ont rapidement appuyé ces résultats. L’étude NHANES III (14) et celle de Biro et al. (15) retrouvent une prévalence des signes pubertaires (S2 ou plus) chez les filles blanches de 8 ans respectivement de 11,4% et 18,3%. Une étude plus récente menée également par Biro et al. a retrouvé un âge moyen d’entrée en stade S2 encore plus précoce, estimé à 9,62 ans (16).
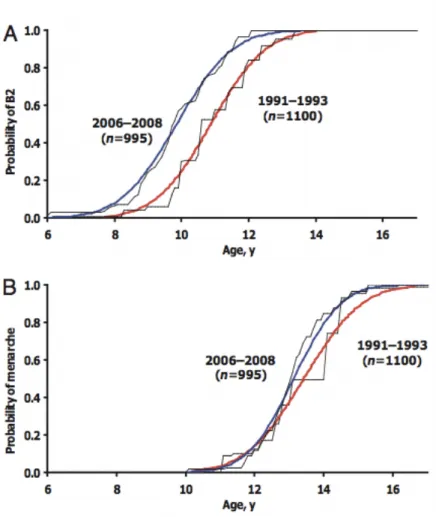
Des observations similaires ont également été décrites en Europe. Ainsi la Copenhagen Puberty Study qui compare le développement pubertaire chez les filles entre 1991-1993 et 2006-2008 (17) a montré que l’âge de début de puberté représenté par le stade S2 était significativement inférieur dans la cohorte de 2006 (9,9 ans), par rapport à la cohorte de 1991 (10,9 ans). (Voir figure 3)
Toutes ces données suggèrent qu’il existe une tendance séculaire à l’avancement de l’âge du développement mammaire (3).
Figure 3 – Prévalence des marqueurs pubertaires selon l’âge chez la fille – Évolution entre 1991-1993 et 2006-2008 au Danemark
(Aksglaede – Recent Decline in Age at Breast Development : The Copenhagen Puberty Study)
Le développement de la pilosité pubienne, témoin de l’adrénarche, ne doit pas être considéré isolément comme le démarrage de la véritable puberté. La prémature pubarche n’est pas une situation si rare. Le Stade P2 étant soumis à une grande variabilité interindividuelle dans les études, il n’est pas possible de conclure à une tendance séculaire à l’avancement de l’âge de la pubarche (3). En moyenne, la pubarche survient entre 9 et 11 ans. Dans la Copenhagen Puberty Study, Aksglaede observe un début de développement de la pilosité pubienne également plus précoce dans la cohorte de 2006 par rapport à la cohorte de 1991, mais moins marqué que pour le développement mammaire (0,2 vs 1,02 années) (17).
1.4.3.1.2. Chronologie et cinétique de la puberté
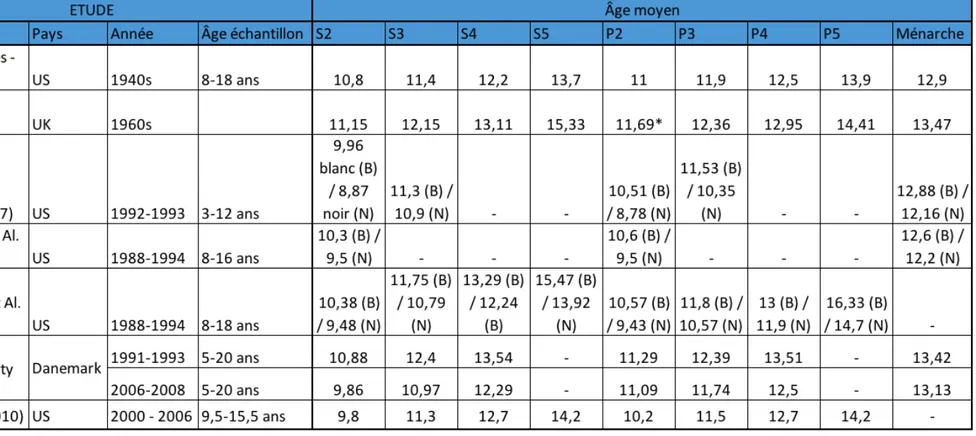
Le Tableau 1 résume les âges moyens d’entrée dans les différents stades pubertaires et l’âge
moyen de la ménarche au cours des dernières décennies.
On note une relative stabilité de l’âge des premières règles au cours du siècle qui contraste avec l’avancée observée pour le développement mammaire. Dans la Copenhagen Puberty Study, l’âge de la ménarche était de 13,42 ans dans la cohorte de 1991 vs 13,13 ans dans la cohorte de 2006, soit une avance très modérée de 0,29 ans (p = 0,23) (17).
La méthodologie utilisée par Tanner pour étudier la cinétique des événements était pertinente mais leurs résultats difficiles d’interprétation du fait de la sous-estimation très probable du développement de la pilosité pubienne. Un travail plus récent mené par Susman analyse également cette chronologie (18).
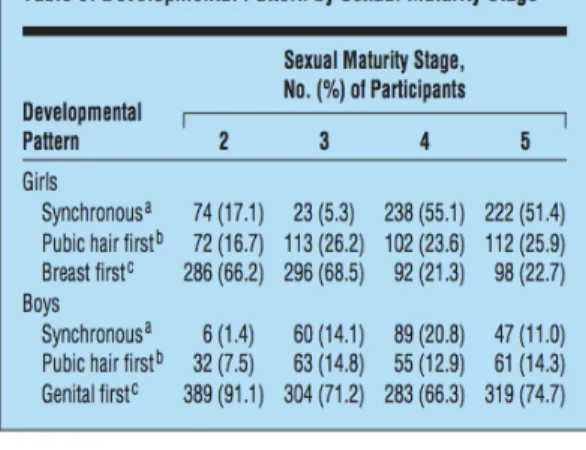
Dans cette étude (Tableau 2), 66,2% des filles atteignaient le Stade S2 au moins 4 mois avant d’atteindre le stade P2. L’analyse des stades ultérieurs montre une tendance vers une évolution plus simultanée entre le développement mammaire et le développement de la pilosité pubienne : 51,4% des filles atteignaient le stade S5 et le stade P5 sur la même période (inférieure à 4 mois). La thélarche précède le plus souvent la pubarche même si la pubarche précoce isolée n’est pas une situation rare.
Tableau 2 – Cinétique des évènements pubertaires selon Susman
(Susman – Longitudinal Development of Secondary Sexual Characteristics in Girls and Boys Between Ages 9½ and 15½ Years)
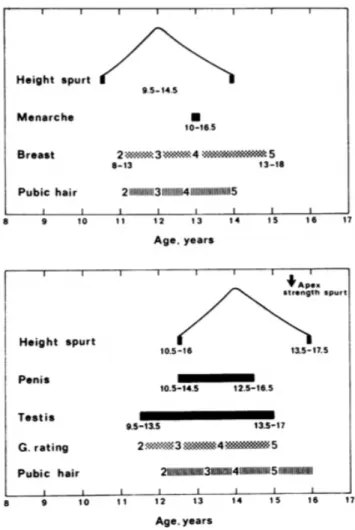
Pour Tanner et Marshall (1), la ménarche était le plus souvent contemporaine du stade S3 (environ 25% des filles) et du stade S4 (> 50% des filles). Sauf situation pathologique, elle n’est pas observée avant le stade S2 et rarement après le stade S5 (environ 10%). La poussée de croissance est précoce dans la chronologie pubertaire de la fille le plus souvent au stade S2/S3, jamais au stade S1 et toujours avant le stade S5/P5.
La figure 4 illustre la cinétique des événements pubertaires chez les garçons et les filles, selon
Figure 4 – Séquence pubertaire chez les filles et les garçons selon Tanner
(Tanner – Variations in the pattern of pubertal changes in boys)
1.4.3.1.3. Durée de la puberté
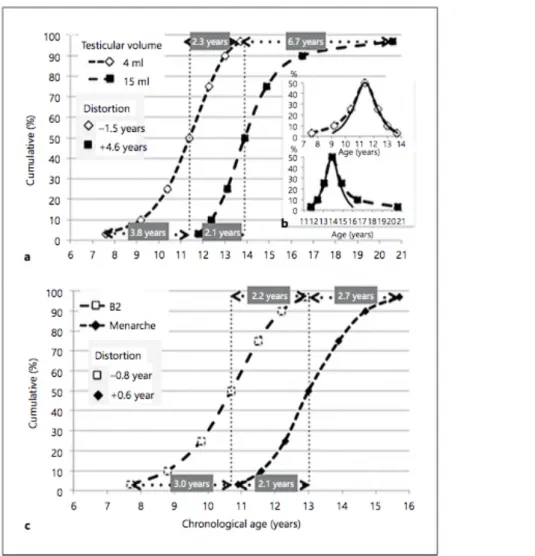
La plus grande précocité de la thélarche contrastant avec une globale stabilité de la ménarche, montre un allongement du temps de la puberté défini comme l’intervalle entre thélarche et ménarche. Cet intervalle estimé à 2,3 ans par Tanner et Marshall (1) est évalué à 3,3 ans dans la Copenhagen Puberty Study (17). Ainsi on peut penser qu’un laps de temps plus important que par le passé est nécessaire pour atteindre la ménarche ou bien qu’un certain nombre de filles présentent une puberté peu progressive après l’apparition des premiers signes pubertaires pendant 1 ou 2 ans (11). Cette réflexion introduit la notion de phénotype pubertaire.
Parent, dans ses travaux publiés en 2015 et 2016, va plus loin et conclue à un allongement de la puberté (19,20). La figure 5 illustre la distorsion de la variance d’âge pour les différents évènements pubertaire. Chez les filles, le calcul de la distorsion au centile 3 et 97 révèle une valeur négative pour l’âge de la thélarche soit une distribution plus précoce et une valeur positive pour la ménarche (distribution plus tardive). Cette distorsion de la variance portant sur la ménarche était négative dans les travaux les plus anciens, et s’est positivée dans les observations les plus récentes.
Figure 5 – Distorsion de la variance d’âge pour les différents évènements pubertaires
(Parent – Developmental variations in environmental influences including endocrine disruptors on pubertal timing and neuroendocrine control: revision of human observations and mechanistic insight from rodents)
1.4.3.2. Garçons
1.4.3.2.1. Âge de début de puberté
Alors que nombreuses études ont rapporté une avance pubertaire chez les filles ces dernières années, une telle tendance chez les garçons ne semble pas aussi évidente.
L’âge d’entrée en puberté chez le garçon a été défini historiquement par le stade G2 comme décrit par Tanner et Marshall, puis plus récemment par un volume testiculaire supérieur ou égal à 4 ml (8). La chronologie pubertaire masculine a été moins décrite que chez les filles et peu d’études font mention du volume testiculaire.
Selon Marshall et Tanner (2), l’âge moyen d’apparition du stade G2 est de 11,6 ans avec des bornes de début de puberté physiologique définies entre 9 et 15 ans. La borne supérieure a été depuis redéfinie à 14 ans (11,21).
On considère encore aujourd’hui que l’âge moyen d’entrée en puberté se situe entre 11 et 12 ans. L’analyse des données existantes sur la puberté des garçons aux États-Unis entre 1940 et 1994 n’a pas permis de conclure à un début de puberté plus précoce et ce, même si l’étude NHANES III (22) réalisée entre 1988 et 1994 montrait un âge moyen d’entrée en puberté nettement plus bas (10,1 ans) ; les résultats de cette étude ont été contestés, et la méthodologie nettement critiquée (classification erronée, non utilisation de l’orchidomètre) (4).
Quelques études récentes laissent penser qu’il existe tout de même une légère progression de l’âge des premiers signes pubertaires chez le garçon. Au Danemark, Sørensen, comparant les données obtenues entre les cohortes de 1991-1993 et 2006-2008, décrit une avance de l’âge de début de puberté (défini comme un volume testiculaire supérieur à 3 ml) de 3 mois (11,92 VS 11,66 ans, p=0,025), (23). Aux États-Unis, l’étude PROS (24) réalisée entre 2005 et 2010 montre un âge moyen d’apparition du stade G2 un an et demi plus tôt que dans l’étude de Tanner et Marshall (10,14 VS 11,6 ans).
L’analyse du développement de la pilosité pubienne au cours des années est rendue plus difficile par l’absence de données anciennes fiables. Pour Sørenson l’apparition du stade P2 pourrait être plus tardive d’environ 6 mois (23).
1.4.3.2.2. Chronologie de la puberté
Chez le garçon le premier signe pubertaire est l’augmentation du volume testiculaire (défini comme un volume supérieur à 3 ml). Ce volume augmente progressivement jusqu’à atteindre le volume adulte. La production de testostérone s’accroit proportionnellement. L’étude danoise menée par Sørenson (23) montre une croissance plus rapide et plus précoce du volume testiculaire dans la cohorte de 2006 par rapport à la cohorte de 1991 (Vitesse 3,8ml/an VS 3,7ml/an, p<0,001).
Même si la majorité des études ne conclue pas à l’existence d’un âge plus précoce des garçons complétant les stades génitaux 3 et 5 (4), les travaux de Parent (19,20) semblent prouver le contraire (figure 5). Ses résultats indiquent qu’à l’heure actuelle , certains garçons ont tendance à entrer plus tôt dans la puberté (distorsion négative pour l’apparition d’un volume
testiculaire >3ml) et d’autres à y mettre fin plus tard (distorsion positive pour l’obtention d’un volume testiculaire >15ml).
On note dans une étude américaine de 2010 que le développement de la pilosité pubienne se fait après le début de la puberté dans 91% des cas (18). En moyenne elle apparait 6 mois après les premiers signes de développement gonadique. Cette notion avait déjà été introduite par Marshall et Tanner (2) qui décrivaient que 41% des enfants avaient atteint le stade G4 au moment où leurs poils pubiens devenaient visibles sur les photographies. (Ce résultat est probablement surestimé du fait de leur méthodologie, les stades P2 et à moindre niveau P3 étant très difficiles à distinguer sur leurs photographies). Dans l’étude américaine, l’analyse des stades ultérieurs montre que cette tendance asynchrone persiste jusqu’à la fin du développement pubertaire. Ils montrent que 74,7% des garçons atteignent le stade G5 au moins 4 mois avant d’atteindre le stade P5. Cette évolution contraste avec celle observée chez les filles. Elle conforte l’idée que le développement de la pilosité pubienne chez le garçon est dépendant du taux progressivement croissant de testostérone produite par les testicules. L’augmentation de la taille de la verge et le début de la poussée de croissance arrivent en moyenne 1 an après le début de la puberté, confortant également l’idée du rôle des androgènes testiculaires dans leur genèse. Le pic de croissance maximum est atteint entre le stade G3 et le stade G4 pour un volume testiculaire moyen autour de 12-15ml (9). La figure 4
illustre la cinétique des événements pubertaires chez les garçons et les filles, d’après Tanner et Marshall.
L’âge moyen de mue de la voix est estimé à 14 ans dans une étude danoise (25). Les auteurs observent un âge plus précoce avec une différence significative entre les enfants recrutés en 1997 - 1999 et ceux entre 1990 et 1992, respectivement de 13,7 ans et 14 ans. Elle apparait entre les stades G3 et G4 d’après Harries et al (26).
1.4.3.2.3. Durée de la puberté
Malgré les discordances des différentes études, il semble qu’il y ait une tendance à l’allongement de la durée de la puberté. Ceci doit être pondéré étant donné la faible fiabilité des marqueurs pubertaires chez le garçon et le petit nombre d’études. Les résultats récents de Parent (19,20) vont dans ce sens.
1.4.4. Variabilité ethnique
L’étude de la chronologie de la puberté est indissociable de la notion de caractère ethnique. De nombreuses observations, pour la plupart américaines, ont montré qu’il y avait une différence nettement significative dans le déroulement de la puberté entre les différents groupes ethniques.
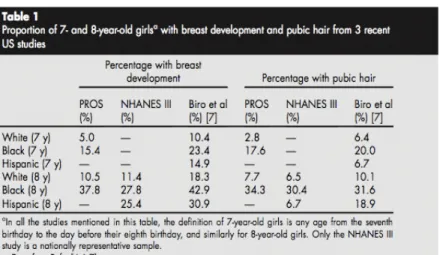
Tableau 3 – Synthèse des résultats des études PROS / NHANES III / Biro et Al. : prévalence des signes pubertaires chez les filles américaines de 7 et 8 ans
(D’après Kaplowitz – Update on precocious puberty: girls are showing signs of puberty earlier, but most do not require treatment)
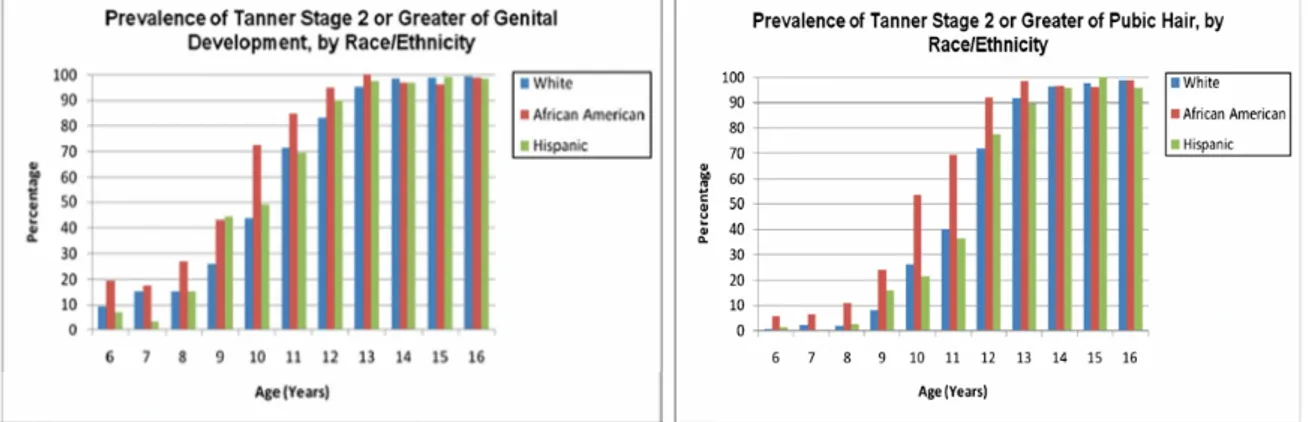
Pour les filles, l’étude NHANES III ( 1988 à 1994) s’est attachée à mettre en évidence cette variabilité (14). A 8 ans, 11,4 % des filles blanches présentaient des signes de développement mammaire correspondant à un stade 2 ou plus vs 27,8 % chez les filles noires et 25,4% chez les filles d’origine hispanique. Cette variabilité existait également pour le développement de la pilosité pubienne. A 8 ans, 6,5%, 30,4% et 6,7% des filles présentaient un stade P2 ou plus, respectivement pour les filles blanches, noires et d’origine hispanique. L’étude PROS (13) et celle de Biro (15) corroborent ces résultats. Le tableau 3 résume ces 3 études. La figure 6
illustre les résultats de l’étude PROS.
Figure 6 – Résultats de l’étude PROS
Une telle observation chez les garçons a également été rapportée dans plusieurs études dont celle menée par Herman-Giddens entre 2005 et 2010 (24). Les enfants noirs-américains semblent débuter leur puberté en moyenne 1 an avant les garçons blancs et hispaniques.
(Figure 7)
Les différences raciales et ethniques reflètent probablement une combinaison de facteurs génétiques, sociaux et environnementaux différents (3).
Ces résultats suggèrent que le caractère ethnique devrait être pris en considération dans toute discussion à propos de l’âge de la puberté.
Figure 7 – Prévalence des signes de développement pubertaire chez le garçon selon l’ethnie
(Herman-Giddens – Secondary sexual characteristics in boys : data from the Pediatric Research in Office Settings Network)
1.4.5. Données françaises
Il n’existe pas à notre connaissance, de données précises concernant l’âge d’apparition des signes pubertaires en France. En revanche on observe une augmentation des demandes de consultations pour avance pubertaire.
1.4.6. Puberté précoce
Teilmann en 2005 montre une incidence de la puberté précoce au Danemark de 0,2% chez les filles et de moins de 0,05% chez les garçons (27). Soriano en 2010 (Espagne) conforte ces résultats et indique un risque 11 fois plus élevé chez les filles que chez les garçons et 25 fois plus élevé chez les enfants adoptés (28).
Une étude française récente décrit une incidence de 2,68 / 10000 filles de moins de 9 ans et 0,24 / 10000 garçons de moins de 10 ans durant la période de l’étude (29).
1.5. Facteurs influents 1.5.1. Généralités
Le déroulement de la puberté suit souvent un schéma familial, ce qui souligne l’importance des facteurs génétiques dans son contrôle. Les facteurs épigénétiques ont également une influence. La nutrition, le surpoids, l’activité physique, le statut socio-économique, les facteurs psychologiques, l’adoption et les flux migratoires, la pollution ainsi que l’exposition à des perturbateurs endocriniens sont des acteurs potentiels qui peuvent influencer le système endocrinien et avoir un impact sur les organes et tissus dont la différentiation et le développement sont contrôlés par les hormones de la reproduction.
L’influence des facteurs environnementaux et leur intrication avec les facteurs génétiques ne sont pas des notions nouvelles. L’acquisition de la fonction de reproduction est un phénomène central dans l’histoire de la vie et dans la survie de l’espèce.
D’un point de vue anthropologique, nous pouvons considérer qu’au Paléolithique, la faible espérance de vie impliquait des capacités reproductives précoces. L’évolution favorable des conditions de vie au cours des millénaires et les caractéristiques évolutives humaines, auraient ensuite permis l’acquisition de ces capacités plus tardivement.
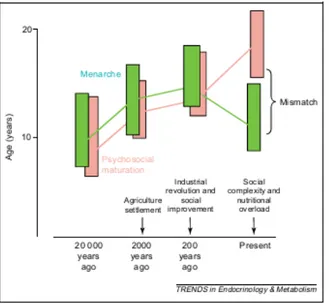
A l’époque moderne, au cours de la révolution industrielle, la détérioration des conditions de vie (concentration des populations, épidémies, …) est probablement la cause du recul de l’âge de la puberté et de la ménarche ; d’autant que cette tendance était plus marquée dans les classes sociales les moins favorisées. A l’inverse, on observe dès 1850 une accélération de la puberté avec une avance des premières règles, contemporaine d’une amélioration des conditions de vie. Le graphique proposé par Gluckman (12) (figure 8) illustre cette réflexion. Gluckman souligne ici que pour la première fois dans l’histoire, on observe une inadéquation entre l’âge de maturité physique et l’âge de maturité psychosociale des filles.
Figure 8 – Évolution de l’âge de la ménarche au cours de l’histoire : tendance et mécanismes
(D’après Gluckman – Evolution, development and timing of puberty)
1.5.2. Obésité
1.5.2.1. Filles
Sur la période d’observation où il a été observé un début de puberté plus précoce chez les filles, l’incidence du surpoids et de l’obésité a nettement augmenté. Cela incite à envisager l’association de ces deux événements.
Les preuves se sont accumulées au cours des 30 dernières années, indiquant une influence majeure de la graisse corporelle sur l’initiation et le déroulement de la puberté, du moins chez les filles. En général, l’indice de masse corporelle (IMC) est la mesure la plus couramment utilisée pour qualifier le surpoids, compte tenu de la fréquente absence de données sur le pourcentage de graisse corporelle et le tour de taille.
Figure 9 – Prévalence du stade S2 selon l’IMC – Comparaison entre les études BCERP et PROS
(Biro – Onset of Breast Development in a Longitudinal Cohort)
De nombreuses études ont montré que les filles qui ont un IMC élevé sont plus susceptibles d’avoir des menstruations précoces. Il existe également un lien entre l’IMC et les autres marqueurs pubertaires. Ces données sont résumées dans l’article de Kaplowitz publié en 2008 (30). Ainsi Biro observe une puberté plus précoce chez les filles dont l’ IMC est supérieur au 85ème percentile (16). De plus, il compare ses résultats avec ceux de la cohorte menée par Herman Giddens en 1997 et observe une différence significative entre les âges moyens d’entrée en puberté entre les deux populations. Cette différence n’était plus significative lorsqu’il considérait uniquement dans son échantillon les filles dont l’IMC était inférieur au
85ème percentile. Ces résultats témoignent du rôle probable de l’obésité dans cette tendance pubertaire plus précoce (figure 9). Kaplowitz illustre les données extraites de l’étude PROS
par un graphique (figure 10) soulignant le lien entre Z score moyen d’IMC et stade de développement mammaire.
Le lien entre l’excès de masse graisseuse précoce (rebond d’adiposité avant 3 ans) et la précocité pubertaire a également été mis en évidence (30).
Figure 10 – Relation entre Z-Score d’IMC et développement mammaire
(Kaplowitz – Link between body fat and the timing of puberty)
1.5.2.2. Garçons
Le lien entre obésité et puberté ne semble pas aussi évident que chez les filles.
Certaines travaux soulignent une association négative, d’autres concluent à une association positive ou à l’absence d’association.
Ainsi les résultats obtenus par les Danois laissent penser qu’il existe une association entre obésité et puberté ou mue de la voix plus précoce (23,25) alors que ceux du NICHD (USA) (31) montrent une association entre IMC très élevé et puberté tardive.
Comment expliquer ces disparités ?
L’utilisation de l’IMC comme reflet de la graisse corporelle peut être source d’erreurs. La corrélation IMC / graisse corporelle est beaucoup plus faible chez les garçons que chez les filles. Pendant la puberté masculine, la masse musculaire croissante liée à l’effet anabolique de la testostérone entraine une augmentation du poids et donc de l’IMC, indépendante de l’augmentation de la graisse corporelle (30).
De plus les marqueurs pubertaires chez le garçon, comme développé précédemment, sont plus difficiles à apprécier que chez la fille. Les disparités méthodologiques dans leur évaluation peuvent expliquer partiellement la discordance des résultats.
Certains ont émis l’hypothèse que chez le garçon, la corrélation entre IMC et puberté n’était pas linéaire. C’est ainsi que le surpoids pourrait être associé à une puberté précoce quand l’obésité serait, elle, un facteur de risque de puberté tardive (9).
La connaissance du lien entre obésité et puberté chez le garçon nécessite sans doute d’autres études.
1.5.2.3. Hypothèses explicatives
1.5.2.3.1. Aromatase
Le tissu adipeux possède une activité aromatase. Dans l’obésité, du fait de l’accroissement de la masse grasse, il existe une augmentation de la synthèse des stéroïdes sexuels à partir du cholestérol, de la conversion périphérique de l’androstènedione en œstrone et de la testostérone en œstradiol (32,33).
1.5.2.3.2. Insulinorésistance
L’insulinorésistance associée à l’obésité entraîne une diminution des taux de SHBG (Sex Hormone-Binding Globulin) et donc une biodisponibilité accrue des stéroïdes sexuels (32).
1.5.2.3.3. Leptine(30,34)
La découverte de la leptine, produite par les cellules adipeuses a fourni une base moléculaire au lien soupçonné entre la graisse corporelle et la fonction reproductrice. Initialement, la leptine était connue pour régulariser l'équilibre énergétique, en diminuant l'appétit et la consommation alimentaire et en augmentant la thermogenèse. Lorsque les réserves de graisse sont faibles, la diminution de la leptine entraîne une augmentation de l'appétit, ce qui aide à rétablir la masse adipeuse et à ramener le poids corporel à la normale.
Un nombre croissant de données provenant d'études sur les rongeurs, les primates et les humains, suggère que la leptine pourrait être le lien critique entre la graisse corporelle et la puberté. Les résultats de ces différents travaux sont synthétisés par Kaplowitz (30). Ainsi l’existence d’une quantité suffisante de masse graisseuse signalée au système neuroendocrinien par la leptine serait une condition nécessaire à l’apparition de la puberté chez la femelle. L’équilibre énergétique et le déroulement pubertaire partageraient donc des facteurs de régulation communs. Ce mécanisme permettrait de s’assurer qu’une grossesse ne puisse se produire que si les réserves énergétiques sont suffisantes à la fois pour la mère et pour le fœtus. La reproduction, quoique essentielle à la survie de l’ espèce, est coûteuse en termes de dépenses énergétiques. Il est logique que les mammifères femelles soient capables d'arrêter leur système reproducteur lorsque l'approvisionnement alimentaire est insuffisant. La leptine dont les taux sont en lien avec la masse graisseuse, pourrait donc être le lien entre le stockage d’énergie et l’axe HHG.
Aujourd'hui, cependant, la pénurie alimentaire a été remplacée par l'excès d’apports dans les régions développées. L'augmentation de la graisse corporelle qui en résulte pourrait avoir pour effet d'abaisser l'âge d’apparition des signes pubertaires.
L'implication évolutive de la graisse corporelle chez les mammifères mâles est quelque peu différente. Des études réalisées chez les primates (35) suggèrent que l’augmentation de la leptine circulante n’est pas le signal qui déclenche l'apparition de la puberté. L’apport des gamètes mâles est la seule contribution de l'homme à la grossesse. Le fait que l'homme maintienne un apport alimentaire adéquat et des réserves de graisse n' a aucune incidence directe sur la probabilité que la grossesse soit réussie et que la progéniture naisse en bonne santé. Par conséquent, il n’y a peut-être pas de justification évolutive d'un lien entre les réserves de graisse et la fonction reproductrice chez les mâles. On ne peut pas exclure le rôle de la leptine dans l'initiation de la puberté masculine, mais elle n'est probablement pas nécessaire pour sa progression.
Les travaux de Shalitin et Phillip passent en revue les résultats qui impliquent la leptine dans la physiopathologie de la puberté (34). Des récepteurs de la leptine ont été identifiés dans l'hypothalamus, les cellules gonadotropes de l'hypophyse antérieure, les cellules folliculaires ovariennes, ainsi que les cellules de Leydig testiculaires. La leptine accélère la pulsatilité de la sécrétion de GnRH dans les neurones hypothalamiques et a un effet direct sur l'hypophyse, favorisant la libération de LH et à moindre mesure de FSH. La leptine a un rôle spécifique dans la stimulation de l'activité des enzymes essentielles à la synthèse des androgènes par les surrénales. Enfin la leptine agirait comme un facteur de croissance avec un effet périphérique direct sur les cartilages de croissance. (Figure 11)
Figure 11 – Mécanisme d’action de la Leptine
(Shalitin et Phillip – Role of obesity and leptin in the pubertal process and pubertal growth)
1.5.2.3.4. Kisspeptines
La découverte du système des kisspeptines a permis de mieux comprendre ces mécanismes de régulation au niveau central. Les kisspeptines favorisent la sécrétion hypothalamique de GnRH. La leptine, produite par le tissu adipeux agirait par son récepteur pour stimuler directement ou indirectement la production des kisspeptines dans le noyau arqué (10).
1.5.3. Perturbateurs endocriniens
Les « perturbateurs endocriniens » sont sources de discussions scientifiques et sociétales multiples ces dernières années. Ils s’agit de substances chimiques ou naturelles, susceptibles de générer des effets nocifs sur la santé humaine par le biais de leurs propriétés hormonales. A ce jour, leurs effets délétères sont considérés comme plausibles mais n’ont pas été prouvés. La liste est longue parmi lesquels on peut trouver le diéthylstilbesterol, les phthalates, le bisphenol A ou les phyto-œstrogènes.
L’évolution récente de la chronologie pubertaire pourrait avoir un lien avec un augmentation concomitante de l’exposition aux produits chimiques perturbateurs endocriniens. Les tendances opposées entre les paramètres initiaux et finaux de la puberté comme décrit par Parent (19,20) peuvent refléter les effets contemporains des facteurs environnementaux sur le développement pubertaire. Cette hypothèse reste difficile à prouver. Le mécanisme physiopathologique sous-jacent est complexe. L’ « effet cocktail » induit par l’exposition à plusieurs perturbateurs au cours de la vie rend leur imputabilité difficile à mettre en évidence d’autant que leurs effets pourraient être variable selon les doses (20). Leur influence pourrait être centrale et/ou périphérique.
Ainsi les premiers signes de développement mammaire pourraient dans certains cas être initiées par des substances agissant comme des œstrogènes et ce, indépendamment de l’axe HHG qui resterait quiescent. Après une période de latence, la reprise d’une puberté évolutive serait cette fois ci sous le contrôle de l’axe HHG(19).
De plus certains perturbateurs endocriniens pourrait avoir une action « obésogène » , par promotion directe de l’adipogenèse(32).
Il semblerait que leur effet délétère puisse se produire lors d’une exposition dans la période pré pubertaire mais également beaucoup plus tôt (in utero, période néonatale)(19). Ainsi l’exposition précoce à faibles doses chez la souris peut avoir un impact sur sa prise de poids pendant la croissance ultérieure(32).
1.5.4. Facteurs influents et période d’exposition
L’impact pubertaire d’un facteur influent semble dépendre de la période d’exposition.
Le rôle des facteurs environnementaux dans le déclenchement pubertaire serait tout aussi important dans les périodes fœtales et néonatales qu’en pré-puberté.
Ainsi, quand la sous-alimentation ou l’excès d’adiposité chez l’homme peuvent respectivement conduire à une puberté retardée ou précoce, certains auteurs comme Ibanez (36) associent le retard de croissance intra utérin à un risque de puberté précoce.
De même le stress peu de temps avant ou pendant la puberté peut retarder l’âge de la ménarche ou provoquer une aménorrhée (37) alors qu’on décrit des avances pubertaires chez les filles ayant connu un tel stress en période néonatale ou dans la petite enfance (38,39).
L’analyse de la puberté chez les enfants adoptés est instructive.
On observe dans les travaux menés par Soriano-Guillén en Espagne un risque plus élevé de puberté précoce central parmi les enfants adoptés (28). Ce risque varie en fonction du sexe de l’enfant mais également en fonction du continent d’origine. Il y aurait plusieurs explications :
- Une variation dans la masse graisseuse avec possible dénutrition dans la petite enfance puis rebond important (même sans obésité) qui impliquerait l’action de la leptine.
- Un facteur de stress psycho-émotionnel. (Hypothèse corroborée par le fait que les enfants adoptés en Espagne, soumis donc aux mêmes expositions et en principe ne souffrant pas de malnutrition, présentent également une augmentation du risque relatif de puberté précoce centrale (28).)
- L’exposition précoce à des perturbateurs endocriniens comme l’insecticide organochloré DDT. Ainsi les travaux de Krstevska-Konstantinova montrent, en Belgique, une incidence de puberté précoce bien supérieure dans la population d’enfants migrants originaires de pays en voie de développement par rapport aux autochtones, indépendamment de l’origine ethnique ou des paramètres biométriques (40). L’étude toxicologique chez ces enfants retrouvait des dérivés sanguins du DDT, témoins d’une exposition chronique. Le DDT et ses dérivés pourraient avoir une action oestrogénique périphérique. Lors de l’arrivée dans un pays développé, l’arrêt de l’exposition pourrait entraîner une levée du rétrocontrôle et l’activation de l’axe HHG. A l’inverse pour les enfants exposés de façon chronique au DDT dans leur pays, l’action oestrogénique périphérique est équilibrée par le rétrocontrôle négatif et la puberté survient en temps normal. L'absence d'incidence accrue de puberté précoce dans les pays occidentaux alors que l'utilisation de pesticides organochlorés a été interdite dans les années 1960 pourrait s'expliquer par la suppression progressive de ces pesticides, ce qui est différent du sevrage aigu résultant d'un déménagement dans un pays développé.
L’étude de cette population présente un intérêt majeur pour illustrer le concept selon lequel les facteurs environnementaux influent différemment selon la période de la vie où ils sont impliqués.
Dans la période prénatale ou néonatale, des conditions défavorables pourraient être interprétées de façon évolutionniste comme représentant un risque pour la survie de l’espèce et entraînant un besoin de fonction reproductive précoce. Inversement, des conditions défavorables semblables en période pré pubertaire pourraient être interprétées comme représentant un risque pour la qualité et l’issue de la grossesse et induisant une non activation du système de reproduction (19).
2. La recherche en libéral
2.1. AFPA / AFPEL
L’Association Française De Pédiatrie Ambulatoire (AFPA) est une association crée en 1990 par des pédiatres libéraux pour promouvoir la pédiatrie ambulatoire et optimiser la prise en charge de la santé de l’enfant.
L'association a notamment pour buts :
• de promouvoir la recherche médicale dans le domaine de la pédiatrie ambulatoire • De développer les actions de formation continue, d'élaborer une réflexion sur les
programmes et les moyens de cette formation
• De promouvoir la recherche médicale dans le domaine de la pédiatrie libérale
L'Association Française des Pédiatres Endocrinologues Libéraux (AFPEL) a pour objet de réunir les pédiatres spécialisés en endocrinologie et diabétologie pédiatrique et exerçant leur activité en libéral afin de :
• Mettre en commun leurs expériences et d'échanger sur leurs pratiques libérales • Développer la collaboration ville-hôpital
• Mettre en place des enseignements et des formations continues s'adressant à d'autres professionnels médicaux exerçant en libéral
• Participer à des programmes de recherche clinique existants, en partenariat avec d'autres sociétés savantes et organiser des programmes de recherche clinique propres sur différents sujets d'endocrinologie pédiatrique
• Travailler en partenariat avec les associations AFPA (Association Française de Pédiatrie Ambulatoire) et SFEDP (Société Française d'Endocrinologie et de Diabétologie Pédiatrique)
• Mettre en place des outils pédagogiques sur des sujets d'endocrinologie pédiatrique à destination des professionnels de santé et des familles de patients
2.2. Intérêt d’un échantillon extra hospitalier
Les projets de recherche clinique menés en médecine libérale sont intéressants en termes de recrutement et d’échantillon. C’est d’autant plus vrai pour une étude comme la nôtre dont l’objectif est d’étudier la physiologie.
Un échantillon extra hospitalier est plus représentatif de la population générale . Cela permet d’inclure un plus grand nombre de sujet.
On peut penser qu’en milieu hospitalier, le patient (ou à fortiori sa famille), sera focalisé sur l’inquiétude qui a justifié sa présence à l’hôpital, ce qui le rend moins réceptif à tout autre requête.
Les essais portant sur la physiologie humaine (comme l’analyse du développement pubertaire) sont adaptés à la pratique de la pédiatrie ambulatoire dont un des rôles centraux reste le dépistage.
Une relation de confiance de qualité comme celle que l’on peut trouver dans la relation médecin-patient en pratique libérale est aussi un atout dans l’approche des sujets pour la réalisation de ces travaux. La notion de pudeur indissociable de l’observation des signes pubertaires, rend cette relation encore plus précieuse pour en optimiser l’acceptabilité. La mise en place et la réalisation d’un protocole de recherche clinique en libéral ne sont pas dénuées de difficultés, par manque de moyens financiers ou de structures adaptées. Mais la grande motivation individuelle de certains médecins à effectuer des travaux de recherche et la structuration de certaines associations comme l’AFPA ou l’AFPEL, permettent à ces projets d’aboutir et ouvrent de nouvelles portes à la recherche clinique.
3. Justification de l’étude
3.1. Étude nationale PROSPEL
Le nombre de consultations pour avance pubertaire semble en augmentation à l’heure actuelle, même si, à ma connaissance, aucune étude n’a encore référencé cette observation. En France il n’existe pas, à notre connaissance, de données concernant l’âge d’apparition des signes pubertaires. Il semble nécessaire de pouvoir disposer de données précises et actuelles concernant le développement pubertaire chez l’enfant sur notre territoire.
C’est pourquoi il nous a paru important de proposer une étude transversale, observationnelle, qui serait réalisée dans les cabinets de pédiatrie et de médecine générale répartis sur l’ensemble du territoire, avec une méthodologie s’inspirant des publications de référence en la matière.
3.2. Étude pilote de faisabilité
Ce PRemier Observatoire des Stades Pubertaires En pratique Libérale (PROSPEL) se doit d’être une étude nationale. Du fait de la complexité de la mise en place il était nécessaire d’en évaluer la faisabilité. Cette étude pilote avait pour objectifs d’analyser l’engagement des médecins participants, la population d’enfants recrutés, les difficultés rencontrées et la reproductibilité des résultats. Ces données essentielles seront précieuses pour affiner la méthodologie lors de la mise en place du protocole national.
PARTIE II – Étude pilote
Research Paper
Title : Update on pubertal development in France. PROSPEL - Observational study. Preliminary feasibility study
J. MAZZARINO*, O.PUEL**, M. JESURAN-PERELROIZEN***.
* Université de Bordeaux, Faculté de médecine, 146 rue Léo Saignat, 33076 Bordeaux, France.
** Cabinet de pédiatrie, 88 avenue Pasteur, 33600 Pessac, France
*** Cabinet d’endocrinologie-pédiatrie, 14 Rue du rempart Saint-Etienne, 31000 Toulouse, France
Corresponding author : prospel.pilote@gmail.com (J.Mazzarino)
ABSTRACT
Introduction. Recent publications report a decrease in age of onset of pubertal changes in the
US, as well as Europe. PROSPEL study (PRemier ObServatoire de la Puberté en Libéral) will provide the first French data on the age at which pubertal signs appear. Before considering this work at the national level, we wanted to assess its feasibility.
Materials and methods. Private pediatricians and general practitioners have been recruited in
Bordeaux and Toulouse. Before participating in the study, they had been trained in pubertal assessment and then evaluated. Each physician completed one to four weeks of inclusion during which children aged 5 to 18 seen in consultation were included except children who were adopted or had a chronic condition. Pubertal stages were assessed according to Tanner's classification and using an orchidometer for testicular volume. The causes of non-realization have been documented where appropriate. Inter-individual reproducibility was analyzed by a double examination in a number of children who had previously given their consent.
Results. Sixty-three physicians participated in the study (35 pediatricians and 28 general
practitioners). All were certified at the end of the training session. 2646 children were
included (1318 girls - 1328 boys) with a homogeneous age distribution. The study was carried out in 83.5% of cases. The main cause of non-realization was that physicians did not propose the study to patients who met the criteria (10.1%). Lack of time was the main reason. Inter-individual reproducibility was excellent.
Discussion and conclusion. Our results attest of the good feasibility of PROSPEL. They
allowed us to validate our methodology, the training and certification of participating physicians and to consider extending the study to the national level.
Keywords : Puberty / Feasibility / Growth and Development / Secular trend / Tanner staging /
1. Introduction
The age of puberty has fluctuated throughout history. Since the beginning of the 19th century (first published data), there has been a marked decrease in the age at which the first periods appeared [1,2]. This trend seems to have stabilized since the 1990s [3].
Reynolds [4] and Marshall [5,6] provide a more precise description of secondary sexual characteristics and their evolution in the 20th century. More recent data report a decrease in age of onset of pubertal changes in the US [7–10], as well as Europe [11,12]. Thus, in the Copenhagen Puberty Study [11], the B2 (Breast 2) stage appears on average at 10.88 years between 1991 and 1993 then at 9.86 years between 2006 and 2008, however without difference in age of the menarche. Among the boys, the same team found a younger onset of voice break [13]. In both sexes, a spreading of the period of appearance of secondary sexual characteristics is observed [14,15].
In France there are, to our knowledge, no precise data concerning the age at which pubertal signs appear. There is currently an increase in requests for early pubertal consultations. This is why it seemed important to us to propose a transversal, observational study of the pubertal process which would be carried out in private pediatrics and general practices throughout the territory, with a methodology inspired by one of the reference publications on the subject [8].
Before implementing this project at the national level, we wanted to assess its feasibility. To do this, we sought to demonstrate the commitment of the participating physicians, to evaluate the difficulties encountered and the reproducibility of the results. Finally, we made use of the data collected to conduct an initial analysis of pubertal stages. It is this study that we present here.
2. Materials and methods
2.1. Recruitment and training of physicians 2.1.1. Recruitment
To begin, we had to recruit 60 private doctors specializing in pediatrics (30) and general medicine (30) spread over the regions of Bordeaux (15+15) and Toulouse (15+15). Doctors have been co-opted in several ways: pediatricians who are part of a continuing medical education group in Bordeaux; general practitioners in contact with the university supervision of general medicine’s interns in Aquitaine; pediatricians (members of the Midi-Pyrénées pediatricians' association) and general practitioners in contact with the Toulouse Regional Union of Health Professionals (URPS). The group was coordinated by two principal investigators, one per region, assisted by two interns doing their internship in liberal medicine, one in pediatrics, the other in general medicine.
2.1.2. Training
Physicians to whom the study had been presented and who wished to participate were required to attend a training session on the practical modalities of assessing pubertal stages according to Tanner's classification. During the first learning phase, a slide show was projected consisting of photographs [5,6] and reference drawings [16] exposing breast and pubic hair development's staging. Orchidometers were distributed to participants, allowing them to familiarize themselves with testicular volume estimation. The orchidometer, developed by Andréa Prader [17], consists of a series of numbered beads, representing testicles of an increasing volume from 1 to 25 ml. The volume of 4 ml corresponds to the beginning of puberty of the boy.
2.1.3. Assessment
Thereafter, the doctors were evaluated:
The iconographies were projected again and participants indicated the pubertal stage on their mobile phone via the Kahoot application [18]. The test was repeated for boys (pubic hair) and girls (breast and pubic hair), according to a previously defined order, which could include several projections of the same pubertal stage and reproduced identically in the different training sessions that were given. For each image, account was taken of (i) the accuracy of the response and (ii) the possibility of distinguishing a pre-pubescent stage (stage 1) from a pubescent stage (stage 2, 3, 4 or 5). Responses were recorded for further processing. The ability of the participating physician was considered sufficient to participate in the study if more than 87.5% of his or her responses distinguished a pre-pubescent stage from a pubescent stage [8].
The beads from an orchidometer inserted into opaque cloth bags were presented individually to participants for "blind" palpation. Their volume had to be recognized using the orchidometer that had been distributed previously, and noted on an answer form. The test was conducted according to a predefined order, which could include several presentations of the same piece and reproduced identically in the different training sessions that were given. For each recognition, account was taken of (i) the accuracy of the response and (ii) the possibility of distinguishing a pre-pubescent stage (stage 1) from a pubescent stage (stage 2, 3, 4 or 5). Responses were recorded for further processing. The ability of the participating physician was considered sufficient to participate in the study if more than 80% of his or her responses distinguished a pre-pubescent stage from a pubescent stage.
The intra-individual reproducibility could be evaluated during these tests by repeatedly presenting the same orchidometer elements.
Educational material including an orchidometer, a double-sided plasticized "memo" sheet indicating Tanner's stages, information leaflets and a poster for the waiting room was distributed to all practitioners involved in the study.
Each participating physician was assigned a center number. 2.2. Study protocol
This non-interventional, multicenter, cross-sectional study was conducted in the Gironde and Haute-Garonne departments at the initiative of the Association Française des Pédiatres Endocrinologues Libéraux (AFPEL) between July and October 2017.
Subjects of both sexes over 5 years of age and under 18 years of age seen in consultation were included with the exception of adopted children and/or children with chronic condition
(unbalanced pathology that may affect growth and puberty or requiring prolonged treatments which, by themselves or because of the dosage used, are likely to interfere with growth and puberty).
The study was registered with ANDM (ID-RCB 2017-A01527-46) and reported to the CNIL. It obtained the agreement of CPP IDF VI (No. 55-17).
2.3. Practical procedure
The study was presented to the patient and family by the investigating physician who gave them an information leaflet. The doctor noted on the administrative part of an anonymous data sheet the child's date of birth and biometric parameters, indicating whether the study had been proposed, accepted, carried out and if any difficulties. The clinical examination assessed the pubertal signs that were recorded on the medical portion of the form. If the child or his or her family objected, only the administrative part of the form was completed. A correspondence record was also kept by the doctor, allowing a later identification of the children by their registration number to correct any input errors. This card remained in the center and was not communicated to the promoter.