Rôle des protéases dans la dystrophie endothéliale
cornéenne de Fuchs et la transition
endothélio-mésenchymateuse
Mémoire
Isabelle Xu
Maîtrise en sciences cliniques et biomédicales - avec mémoire
Maître ès sciences (M. Sc.)
Rôle des protéases dans la Dystrophie endothéliale
cornéenne de Fuchs et la transition
endothélio-mésenchymateuse
Mémoire
Isabelle Xu
Sous la direction de :
Résumé
Contexte: La cornée est le tissu transparent à l’avant de l’œil. Elle est composée de plusieurs couches, dont l’endothélium cornéen qui est une monocouche de cellules endothéliales cornéennes (CECs) assurant la transparence de la cornée. Dans la Dystrophie endothéliale cornéenne de Fuchs (DECF), les CECs deviennent dysfonctionnelles et sécrètent des guttae. Ces excroissances pathognomiques sont composées de matrice extracellulaire (MEC) normalement régulée par des protéases (ex. métalloprotéinases matricielles (MMPs)) et des inhibiteurs de protéases (IPs) (ex. inhibiteurs tissulaires des MMPs (TIMPs)).
Objectif: L’objectif de ce projet est d’analyser le profil des protéases et IPs dans la DECF en fonction de la morphologie cellulaire.
Méthode: Des CECs provenant de spécimens DECF (N=7) et de cornées saines (N=9) ont été mises en culture et classées selon l’index de circularité (IC) (4π*aire/périmètre2) : morphologie endothéliale (IC>0,68), intermédiaire (IC=0,55-0,68), fibroblastique (IC<0,55). Les surnageants ont été analysés par différents tests quantitatifs et d’activité. Les résultats obtenus ont été comparés aux résultats de profilage génique précédemment effectué. La localisation d’une MMP membranaire (MMP-14) a été étudiée par immunofluorescence sur spécimens ex vivo DECF (N=2) et sains (N=3).
Résultats: Les CECs DECF ont montré une baisse de la MMP-2 (4-fois, p=0,009) et de la MMP-10 (187-fois, p=0,209). Toutefois, le ratio forme actif:inactif de ces MMPs était plus élevé chez les populations DECF. Celles-ci avaient également un ratio MMPs:TIMPs moindre que les CECs saines. L’analyse du profilage génique a suggéré une régulation davantage post-transcriptionnelle. Une relocalisation de la MMP-14 autour des guttae chez les spécimens DECF natifs a été identifiée. De plus, la morphologie cellulaire influence le profil des MMPs et TIMPs, mais de façon différente entre les CECs DECF et saines.
Conclusions: Ces résultats suggèrent que les CECs DECF possèdent des profils de MMPs et TIMPs différents des CECs saines. Ce déséquilibre pourrait expliquer l’accumulation anormale de MEC dans la DECF.
Abstract
Background: The cornea is the transparent tissue located at the front of the eye. It is composed of multiple layers, such as the endothelium layer, which is a monolayer of corneal endothelial cells (CECs) that play a very important role in maintaining corneal clarity. In Fuchs endothelial corneal dystrophy (FECD), CECs become dysfunctional and their basal membrane becomes abnormally thickened and guttae appear. These excrescences are harmful to CECs, which makes them an important issue in FECD. They are composed of extracellular matrix (ECM) normally regulated by proteases, such as matrix metalloproteases (MMPs), and protease inhibitors, such as tissue inhibitors of MMPs (TIMPs).
Purpose: The purpose of this project is to assess the importance of proteases and protease inhibitors in FECD development.
Method: CECs from DECF specimen (N=7) and healthy corneas (N=9) were cultured and classified according to cell morphology determined by circularity index (CI) (4π*area/perimeter2): endothelial (IC>0,68); intermediate (IC=0,55-0,68); fibroblastic (IC<0,55). Cell culture supernatants were analyzed using quantitative activity tests. Results obtained were compared to results from previously performed gene expression profiling. Transmembrane MMP (MMP-14) was also studied, more precisely its location within DECF (N=2) and healthy explants (N=3) by immunofluorescence.
Results: Quantitative assays showed a decrease of MMP-2 (4-fold, p=0,009) and MMP-10 (187-fold, p=0,209) in FECD CECs when compared to healthy CECs. However, activity tests revealed higher active to inactive form ratios of these MMPs among FECD populations. FECD CECs also demonstrated lower MMPs:TIMPs ratio. Comparison with gene expression results suggested post-transcriptional regulation of certain proteins. Immunofluorescence revealed MMP-14 relocation around guttae in FECD specimens. Moreover, cell morphology was an influencing factor of MMPs and TIMPs profile, but its effect differs between FECD and healthy
Conclusion: Our results suggest that FECD CECs have different MMPs and TIMPs profiles than FECD CECs. This imbalance could explain the abnormal accumulation of ECM.
Table des matières
Résumé ...ii
Abstract ...iv
Table des matières ...vi
Liste des figures ... vii
Liste des tableaux ... viii
Liste des abréviations, sigles, acronymes ...ix
Remerciements ...xi
Avant-propos ... xiii
Introduction ... 1
Chapitre 1 Matrix metalloproteinases and their inhibitors in Fuchs endothelial corneal dystrophy ... 41
1.1 Résumé ... 42
1.2 Abstract ... 43
1.3 Introduction ... 45
1.4 Methods and materials ... 47
1.5 Results ... 54
1.6 Discussion ... 59
1.7 Conclusion ... 67
1.8 Acknowledgements ... 68
Chapitre 2 Discussion ... 92
2.1 Les résultats originaux de l’étude ... 92
2.2 Forces de l’étude ... 101
2.3 Limites de l’étude ... 102
2.4 Perspectives de recherche ... 104
Conclusion ... 106
Liste des figures
Figure 1 Schéma de l’œil. ... 2
Figure 2 Production et circulation de l’humeur aqueuse ... 5
Figure 3 Les couches formant la cornée. ... 6
Figure 4 Cellules endothéliales cornéennes. ... 9
Figure 5 Guttae ... 11
Figure 6 Vision normale et saine à gauche ... 14
Figure 7 Polymégatisme et pléimorphisme ... 14
Figure 8 Différentes techniques de greffe selon les couches greffées... 28
Figure 9 DMEK vs. Descetmetorhexis seule ... 29
Figure 10 Structure typique d’une MMP. ... 30
Figure 11 Activation d’une MMP. ... 32
Liste des tableaux
Tableau 1 Échelle de classification séparant l’évolution de la maladie en quatre stades. .. 15
Tableau 2 Stades de Krachmer. ... 16
Tableau 3 Traitements actuellement disponibles pour les patients atteints de DECF. ... 26
Tableau 4 Familles de MMPs. ... 33
Liste des abréviations, sigles, acronymes
ADN Acide désoxyribonucléiqueAGBL1 ATP/GTP binding protein Like 1 APMA Acétate amino-phénylmercurique AQP1 Aquaporine 1
ARN/RNA Acide ribonucléique; Ribonucleic acid ATP Adenosine triphosphate
ATP1B1 ATPase Na+/K+ transporting subunit beta 1
CECs Corneal endothelial cells ; Cellules endothéliales cornéennes CI/IC Circularité index ; Indice de circularité
CLU Clustérine
COL8A2 Collagen type VIII alpha 2 chain
DECF/FECD Dystrophie endothéliale cornéenne de Fuchs; Fuchs endothelial corneal dystrophy
DMEK Descemet membrane endothelial keratoplasty ; Kératoplastie endothéliale DMPK Myotonic dystrophy type 1 protein kinase
DSAEK Descemet’s stripping automated endothelial keratoplasty ; Kératoplastie endothéliale avec stripping automatisé de la membrane de Descemet ECM/MEC Extracellular matrix ; Matrice extracellulaire
EDTA Ethylenediaminetetraachetic acid ELISA Enzyme-linked immunosorbent assay GTP Guanosine triphosphate
KANK4 KN motif and ankyrin repeat domains 4 KT Kératoplastie transfixiante
IL-1ß Interleukine 1ß
LAMC1 Laminine subunit gamma 1
LOXHD1 Lipoxygenase homology domains 1
MCT Monocarboxylate transporter ; Transporteur monocarboxylate MD/DM Membrane de Descemet; Descemet’s membrane
MMP Matrix metalloproteinase ; Métalloprotéases matricielles mRNA Messenger ribonucleic acid
MT-MMP Membrane-type matrix metalloproteinase ; Métalloprotéinase matricielle membranaire
OD Optical density
PCR Polymerase chain reaction
RER Réticulum endoplasmique rugueux ROCK Rho-associated protein kinase
ROS Reactive oxygen species ; Espèces réactives de l'oxygène SD Standard deviation
SLC4A11 Solute carrier family 4 member 11 TBS Tris-buffered saline
TCF4/8 Transcription factor 4/8
TEM/EMT Transition endothélio-mésenchymateuse; Endothelial-to-mesenchymal transition
TGFß Transforming growth factor ß; Facteur de croissance transformant ß TGFß1 Transforming growth factor ß1 ; Facteur de croissance transformant ß1 TGFßIp Transforming growth factor ß-Induced protein
TIMP Tissue inhibitor of matrix metalloproteinase ; Inhibiteurs tissulaires de métalloprotéases matricielles
UPR Unfolded protein response UV Ultraviolet
UVA Ultraviolet A
VEGF Vascular endothelial growth factor ; facteur de croissance de l’endothélium vasculaire
Remerciements
J’aimerais commencer par remercier ma directrice de maitrise, Dre Stéphanie Proulx, sans qui rien de tout ça ne se serait réalisé. En commençant par notre première conversation dans ton bureau qui a été l’élément déclencheur de mon cheminement vers la maitrise. Je te remercie de m’avoir donné cette opportunité et de m’avoir donné toutes les connaissances et ressources nécessaires afin de réaliser mon projet ainsi que de m’avoir permis de découvrir la recherche fondamentale en ophtalmologie et le domaine du génie tissulaire. Cette expérience fut extrêmement enrichissante, autant sur le plan personnel que sur le plan académique. Merci d’avoir été un acteur important dans mon parcours.
Par la suite, j’aimerais remercier toute l’équipe Proulx. Un merci particulier à Mathieu qui est l’homme à tout faire du laboratoire : merci d’avoir toujours été disponible pour m’aider à n’importe quel moment et pour n’importe quoi. Merci également à Julie pour la formation exemplaire en culture cellulaire que tu m’as donnée. Je veux également remercier Kim d’avoir toujours été disponible pour répondre à mes panoplies de questions et de m’avoir guidé avec mes cellules. Merci à Julien pour ta bonne humeur et ton rire distinctif qui nous permet de te repérer à n’importe quel endroit. Merci aussi à tous les étudiants que j’ai côtoyés depuis le début qui ont fait en sorte que mon expérience de maitrise en soit une bonne : Sabrina, Louis-Philipe, Antoine, Princia et Ange.
Je veux bien évidemment remercier aussi tous les membres du CUO : tous les étudiants, les professionnels de recherche et les chercheurs. Vous avez tous contribué d’une façon ou d’une autre à la réussite de mon projet. Je vous remercie pour votre aide, vos conseils, vos commentaires et votre support. Vous avez tous fait du CUO un milieu de travail agréable et enrichissant.
Je voudrais également remercier tous les organismes subventionnaires qui m’ont permis de réaliser mes travaux de maitrise : le concours Wilbrod-Bhérer de la Faculté de Médecine de l’Université Laval, le Comité scientifique du Réseau de recherche en santé de la vision, le Centre de recherche en organogénèse
expérimentale de l’Université Laval, la Fondation du CHU de Québec de l’Axe Médecine Régénératrice, l’Institut de recherche en santé du Canada et Thécell. Finalement, je voudrais prendre le temps de remercier ma famille. Merci à mes parents qui ont grandement contribué au développement de mon esprit scientifique et curieux dès mon enfance et qui m’ont toujours soutenu de toutes les façons. Un merci particulier à mon père qui m’a fait découvrir le monde de la recherche et qui m’aide à me dépasser tous les jours. Tu es pour moi un chercheur exemplaire : ta rigueur, ta persévérance et ton ingéniosité font de toi une source d’inspiration. Merci également à mon copain François-Jérôme qui croit toujours en moi et qui m’encourage tous les jours. Merci de toujours supporter mes projets et de t’y investir avec moi. Tu m’inspires et me pousses à être meilleure chaque jour. Bref, merci à vous tous d’être vous; ma vie ne serait pas la même sans vous!
Avant-propos
Les travaux de recherche ont été effectués au Centre de recherche du CHU de Québec-site de l’hôpital Saint-Sacrement dans le cadre d’une maîtrise. Les résultats obtenus sont présentés dans un article, en vue d’être soumis au journal Experimental Eye Research.
L’auteure de ce mémoire est également la première auteure du manuscrit présenté ci-dessous. Sous la supervision de la docteure Proulx, elle a participé à l’élaboration du protocole expérimental, a effectué toutes les expériences et a ainsi recueilli et analysé tous les résultats faisant partie de ce projet. Les résultats de profilage génique ont été récoltés précédemment dans l’équipe de la Dre Proulx par Mathieu Thériault, professionnel de recherche, et Benjamin Goyer, ancien étudiant au doctorat sous la supervision de Stéphanie Proulx également. Ces données sont d’ailleurs accessibles au grand publique sur le répertoire du National Center for Biotechnology Information’s Gene Expression Omnibus repository (https://www.ncbi.nlm.nih.gov/geo; code d’accès : GSE112039). Les analyses ont par contre toutes été faites par l’étudiante. Mathieu Thériault, professionnel de recherche de l’équipe de la docteure Proulx, a assisté l’étudiante dans diverses étapes des expérimentations. L’étudiante a rédigé le manuscrit qui a été révisé et approuvé par tous les coauteurs : Mathieu Thériault, Isabelle Brunette, Patrick Rochette et Stéphanie Proulx. Docteure Isabelle Brunette est ophtalmologiste à l’hôpital Maisonneuve-Rosemont. Docteur Patrick Rochette est professeur au centre de recherche du CHU de Québec. Docteure Stéphanie Proulx a coordonné tout le déroulement du projet.
Introduction
La vue est un sens unique permettant à l’humain la conscience du milieu dans lequel il se retrouve. Provocateur d’émotions, le sens de la vision est probablement aussi l’un des sens les plus objectifs, nous permettant de partager une expérience commune avec les gens qui nous entourent. Il n’est donc pas surprenant que la vue ait été un sujet de curiosité dès l’Antiquité. Des écrits de Platon datant du 4e siècle av. J.-C. décrivent l’œil comme étant un émetteur de rayons de lumière qui seraient captés par les objets sur leur chemin. Cette théorie fut opposée par Aristote qui prôna une théorie de l’intromission [1]. Bien entendu, avec le développement des technologies et l’avancement de la médecine, nous en savons aujourd’hui beaucoup plus sur l’anatomie et le fonctionnement de l’œil. Cependant, certaines pathologies et notions de l’œil restent à être démystifiées. La cornée, le tissu transparent à l’avant de l’œil, est notamment un sujet dont plusieurs interrogations existent encore. Le mémoire suivant porte sur la Dystrophie endothéliale cornéenne de Fuchs, une maladie touchant la cornée, dont la cause exacte n’est pas encore comprise à ce jour. Afin d’assurer une bonne compréhension de ce projet de maitrise, voici un chapitre résumant certaines notions de base ainsi que les connaissances actuelles sur la Dystrophie endothéliale cornéenne de Fuchs.
1.1 Anatomie générale de l’œil
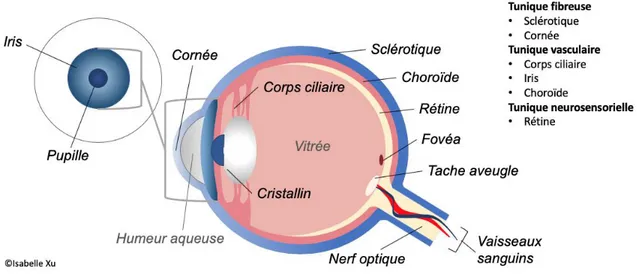
L’œil représente un globe de forme sphérique mesurant en moyenne 2,4 cm de diamètre chez l’adulte. La paroi du globe oculaire peut être séparée en 3 tuniques structurellement et fonctionnellement différentes : la tunique fibreuse, vasculaire et neurosensorielle [2]. Différentes structures composent ces couches et se retrouvent également à l’intérieur du globe. Le globe oculaire est donc composé de plusieurs structures et peut être délimité en différentes zones (Figure 1).
Figure 1 Schéma de l’œil. Les structures formant l’œil sont identifiées sur ce schéma. Ces structures sont également séparées selon les tuniques auxquelles elles appartiennent. L’humeur aqueuse et le vitré, indiqués en gris, sont les deux substances aqueuses se retrouvant au niveau du globe oculaire. (Source : Isabelle Xu)
La tunique fibreuse est la couche supérieure, avasculaire comprenant la cornée en antérieure et la sclérotique en postérieure. La cornée est la couche la plus superficielle de l’œil. Elle est transparente et recouvre l’iris, la partie colorée de l’œil. Sa forme est incurvée, lui permettant ainsi de participer à la focalisation de la lumière sur la rétine. La cornée s’insère dans la sclérotique au niveau du limbe. En effet, la sclérotique est une coque rigide possédant deux ouvertures laissant place à la cornée en antérieure et le nerf optique en postérieur. Elle est composée de tissu conjonctif dense et confère au globe oculaire sa rigidité lui permettant de garder sa forme et d’être le lieu d’insertion des muscles extraoculaires. La sclérotique est ce qui est plus communément appelé le « blanc » de l’œil. Au niveau de la sclérotique se retrouve également la conjonctive. Cette dernière est une mince membrane muqueuse innervée et vascularisée qui recouvre la sclérotique (conjonctive bulbaire) ainsi que la face interne de la paupière (conjonctive palpébrale). La conjonctive joue un rôle de protection contre les corps étrangers, les pathogènes et aide au maintien du film lacrymal [3].
La tunique vasculaire, qui est la couche intermédiaire, aussi appelée uvée, est composée de 3 structures : la choroïde, l’iris et le corps ciliaire. La choroïde se situe entre la sclérotique et la rétine et forme la partie postérieure de la tunique vasculaire. Elle est attachée en antérieur au corps ciliaire et en postérieur au nerf optique. Elle est fortement vascularisée et contribue ainsi à fournir les nutriments nécessaires à la partie externe de la rétine. Comme mentionné plus haut, l’iris est la partie colorée de l’œil au centre duquel se retrouve la pupille, permettant ainsi le passage de la lumière. En effet, cette structure en forme de beigne aplati joue un rôle important dans le contrôle de la quantité de lumière pénétrant la pupille. Le diamètre de cette dernière est modulé par des réflexes autonomes ainsi que la luminosité. L’iris est ainsi composé de myocytes lisses, permettant la modulation du diamètre pupillaire, et de mélanocytes, dont la quantité détermine la couleur de l’œil. En antérieur, se retrouve également le corps ciliaire. Il s’étend de l’extrémité antérieure de la choroïde jusqu’à la racine de l’iris et s’attache au cristallin, présentant ainsi une forme triangulaire. Il possède un rôle dans la sécrétion de l’humeur aqueuse ainsi que la tension appliquée sur le cristallin, contrôlant ainsi sa forme et permettant donc l’accommodation visuelle. En effet, le cristallin représente une lentille élastique, avasculaire, transparente et biconvexe se situant en arrière de l’iris et mesurant 4 mm d’épaisseur et 9 mm de diamètre. Sa forme lui permet de converger la lumière sur la rétine. L’application de différente tension sur le cristallin module son niveau de « bombement » et permet donc l’accommodation [4-6]. Avec l’âge, l’épaisseur du cristallin augmente et sa capacité à se déformer diminue, ce qui peut mener à des problèmes d’accommodation, dont la presbytie [7].
La couche la plus interne formant la paroi du globe oculaire, la tunique neurosensorielle, est la rétine. Celle-ci recouvre le ¾ postérieur du globe. La rétine peut être observée à l’aide d’un ophtalmoscope et permet de visualiser directement les vaisseaux sanguins ainsi que le disque du nerf optique. La rétine est formée d’une partie nerveuse à sa couche interne et d’une partie épithéliale en externe qui est en contact avec la choroïde. La partie nerveuse est composée de trois couches de neurones du plus profond au moins profond : les photorécepteurs, les neurones
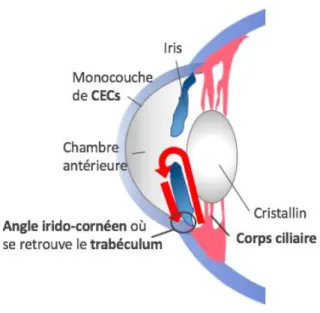
permettent le traitement des données visuelles puis la transmission des influx nerveux aux axones du nerf optique. Il existe deux types de photorécepteurs ayant des rôles différents : les batônnets et les cônes. Les bâtonnets permettent la vision périphérique ainsi que la vision nocturne et se retrouvent principalement en périphérie, tandis que les cônes permettent la vision centrale et la perception des couleurs. Ces derniers se retrouvent à la macula située à la partie centrale de la rétine. Au centre de la macula se retrouve une région nommée la fovéa possédant une concentration maximale de cônes, faisant d’elle la zone d’acuité maximale. Outre les structures solides du globe oculaire, certains liquides s’y retrouvent également, dont le vitré et l’humeur aqueuse. Le vitré est une substance gélatineuse se retrouvant dans l’espace en arrière du cristallin et occupant le 2/3 du volume de l’œil. Il a comme rôle de remplir la cavité oculaire et est composé d’eau à 99% et de 1% de collagène et d’hyaluronane [8]. L’humeur aqueuse lui est un liquide transparent se retrouvant dans la chambre antérieure, espace entre la cornée et l’iris. Elle permet d’acheminer les nutriments nécessaires pour répondre aux besoins métaboliques de la cornée et du cristallin et participe au maintien d’une pression intraoculaire adéquate. L’humeur aqueuse est constamment renouvelée à chaque 100 minutes et représente un volume d’à peu près 300 l. Produite par les cellules épithéliales de l’iris et des corps ciliaires, elle traverse la pupille pour se rendre à la chambre antérieure et est finalement drainée par le trabéculum au niveau de l’angle irido-cornéen et le canal de Schlemm (Figure 2). Ces structures se retrouvent au niveau du limbe, c’est-à-dire la zone transitionnelle entre la cornée et la sclérotique. Une 2e voie d’excrétion existe, appelée la voie uvéosclérale, par laquelle l’humeur aqueuse transverse directement l’iris et la sclérotique. Une fois sortie, l’humeur aqueuse est absorbée par la microcirculation des vaisseaux épiscléraux [9]. Un problème au niveau de ce système de drainage peut mener à une accumulation d’humeur aqueuse et ainsi à une pression intraoculaire élevée pouvant causer des dommages au nerf optique, comme vu dans le glaucome.
Figure 2 Production et circulation de l’humeur aqueuse. L’humeur aqueuse est produite par les cellules épithéliales du corps ciliaire et de l’iris. La flèche en rouge représente le cheminement de l’humeur aqueuse, de son lieu de production
jusqu’à son lieu de drainage, en passant par la chambre antérieure. (Source : Isabelle Xu)
1.2 Cornée
Comme mentionné précédemment, la cornée est la couche transparente en avant de l’œil recouvrant l’iris et ayant une forme convexe asphérique [10, 11]. La cornée est relativement large à la naissance et atteint une taille adulte à l’âge de deux ans. La cornée du bébé est plus profonde et présente une plus grande courbure en périphérie comparée au centre, tandis que le contraire est vrai chez l’adulte. Une cornée adulte mesure en moyenne 11,7mm de diamètre horizontal et 10,6mm de diamètre vertical [8, 12, 13]. Bien qu’il existe des variations raciales, l’épaisseur moyenne d’une cornée est de 550μm à la région centrale et 612μm en périphérie [8, 14]. Cette différence d’épaisseur s’explique par une quantité plus grande de collagène au niveau de la périphérie.
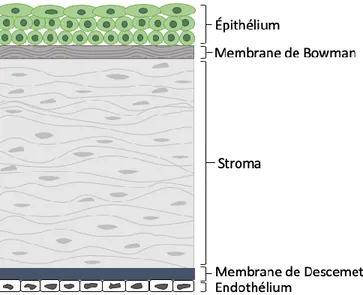
importants : barrière contre les infections, réfraction de la lumière (70% du pouvoir réfractaire de l’œil) [10, 13]. La transparence de la cornée permet la transmission de la lumière jusqu’à la rétine et est donc primordiale pour le maintien d’une vision claire. Ceci est possible par l’organisation spécifique de la cornée. En effet, cette dernière est organisée en différentes couches possédant des caractéristiques et rôles spécifiques : l’épithélium, la membrane de Bowman, le stroma, la membrane de Descemet et l’endothélium cornéen (Figure 3) [15].
Figure 3 Les couches formant la cornée. La cornée est composée de différentes couches, de la plus externe à la plus interne : épithélium, membrane de Bowman, stroma, membrane de Descemet et endothélium. (Source : Isabelle Xu)
1.2.1 Épithélium & Membrane de Bowman
L’épithélium cornéen est composé de 5-6 couches de cellules épithéliales stratifiées pavimenteuses non kératinisées mesurant au total 50μm d’épaisseur [8, 11, 13]. Ces cellules épithéliales se renouvèlent à tous les 7-10 jours. Cette capacité à se renouveler constamment ainsi que la présence de jonctions serrées entre les cellules font de l’épithélium une bonne barrière contre les agents chimiques, les pathogènes et l’eau. Cette couche contient aussi des cellules de Langherhans ayant
des rôles importants dans la défense immunitaire. De plus, sa surface lisse facilite l’adhérence du film lacrymal. En effet, l’épithélium est en étroite relation avec les mucines du film lacrymal ayant un rôle important dans la protection de la cornée. Cette interaction permet un bon étalement du film lacrymal à la surface oculaire à chaque clignement d’œil [10, 11]. La membrane basale de l’épithélium mesure 0,05 μm d’épaisseur et est composée de collagène de type IV et de laminine, sécrétés par les cellules basales de l’épithélium [10, 16].
L’épithélium cornéen repose sur la membrane de Bowman mesurant 12μm d’épaisseur [11]. Cette membrane est transparente, acellulaire et ne possède aucune capacité régénérative. Elle n’est pas considérée comme une vraie membrane, mais plutôt la continuité de la portion antérieure du stroma condensée et sans cellules; elle peut donc être considérée comme une portion modifiée de celle-ci [8, 10, 11]. Cette couche est composée principalement de collagène et joue un rôle dans le maintien de la forme cornéenne [11, 17].
1.2.2 Stroma
Le stroma contribue à 90% de l’épaisseur de la cornée et est composé principalement de kératocytes et de matrice extracellulaire. Les kératocytes, localisées dans la région antérieure principalement, sont impliquées dans le maintien de la matrice extracellulaire en jouant un rôle dans la synthèse de collagène, de glycosaminoglycanes ainsi que de métalloprotéinases matricielles [10, 11]. La transparence du stroma est le résultat d’une organisation spécifique et précise de la matrice extracellulaire qui s’y retrouve. La matrice extracellulaire est principalement composée de glycosaminoglycane et de collagène de type I (forme prédominante), V et VI. Les microfibrilles de collagène sont arrangées en fibrilles parallèles. Ces fibrilles sont à leur tour assemblées en lamelles, mesurant 10-250 μm de largeur et 1-2 μm de hauteur et sont arrangées de façon précise afin d’assurer une transparence totale à la cornée [8, 13, 18, 19]. La densité à laquelle les lamelles sont assemblées varie selon la région : plus dense en antérieure qu’en postérieure. Par conséquent, la partie postérieure du stroma s’œdématie plus facilement que le
la capacité de rester morphologiquement intact même en situation d’extrême œdème [11]. C’est d’ailleurs la rigidité de la portion antérieure du stroma qui permet à la cornée de garder sa courbure [10]. De plus, l’organisation particulière du collagène dans le stroma lui permet également de conduire la lumière sans dispersion [10, 20]. Outre le support et la transparence, le stroma renferme également de nombreux leucocytes, jouant ainsi un rôle clé dans l’immunité cornéenne [2, 21, 22].
1.2.3 Endothélium & Membrane de Descemet
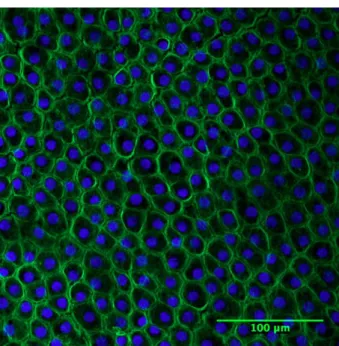
L’endothélium cornéen consiste en une monocouche de cellules mesurant 5μm d’épaisseur et 20μm de diamètre, reposant sur une membrane basale appelée membrane de Descemet [11, 13]. Les cellules endothéliales cornéennes (CECs) sont de forme hexagonale (Figure 4). Elles sont métaboliquement très actives car elles ont un rôle important à jouer dans le maintien de la déturgescence du stroma cornéen [11]. Cependant, ce sont des cellules fragiles, susceptibles aux blessures et pertes cellulaires avec l’âge. En effet, la densité cellulaire de l’endothélium cornéen passe de 3000-4000 cellules/mm2 à la naissance, à 2000 cellules/mm2 à la fin de vie [23]. Les cellules de l’endothélium n’ont pas la capacité de se régénérer puisqu’elles ne peuvent pas proliférer et sont arrêtées en phase G1 du cycle de division cellulaire [13, 24, 25]. Ainsi, en cas de dommage endothélial, la réparation se limite à l’élargissement et à la migration des cellules endothéliales existantes afin de recouvrir la surface dépourvue de cellules. Avec l’âge, la perte de cellules endothéliales cornéennes laisse place au polymégathisme (augmentation de la taille cellulaire) et au pléomorphisme (changement dans la forme cellulaire) [8, 15, 26]. Cependant, certaines études ont montré qu’il existerait des cellules souches endothéliales à la périphérie de la cornée, au niveau du limbe, ayant des capacités de régénération sous certaines conditions [27, 28].
Figure 4 Cellules endothéliales cornéennes. Immunofluorescence de
spécimens natifs sains montrant des cellules endothéliales cornéennes attachées à la membrane de Descemet. Les noyaux sont marqués en bleu et l’actine-F en vert. (Source : Isabelle Xu)
La membrane de Descemet possède une portion antérieure/prénatale et une portion postérieure/postnatale. La portion prénatale mesure 3μm d’épaisseur à la naissance. Cette dernière, composée de collagène lamellaire et de protéoglycane, est détectable chez le fœtus dès la 12e semaine gestationnelle. Au courant de la vie, les cellules endothéliales cornéennes y déposent de la matrice extracellulaire et se forme ainsi la portion postnatale qui atteint 10-12μm avec l’âge [8, 10, 29, 30]. La membrane de Descemet est composée de différents types de collagène (type IV, VI, VIII, XII, XVIII), glycoprotéines (fibronectine, laminine, osteonectine) et protéoglycanes (versican). Cette composition change au courant de la vie et lors de certaines conditions pathologiques [31]. La portion antérieure possède une configuration en treillis tandis que celle en postérieure est plutôt homogène [11, 13]. Cette membrane basale participerait au maintien de la déturgescence cornéenne [13].
1.3 Physiologie de l’endothélium cornéen
Comme mentionné plus haut, l’endothélium cornéen joue un rôle de barrière et de pompe afin d’assurer la transparence cornéenne. En effet, l’endothélium est une barrière imparfaite permettant un passage sélectif entre la chambre antérieure et le reste de la cornée. Cette fonction de barrière dépend de la présence de jonctions serrées et d’ancrage : macula occludens, macular adherens et jonctions lacunaires [32, 33]. Par exemple, l’endothélium cornéen possède des protéines zonula occludens incomplètes qui permettent le passage de molécules de la chambre antérieure vers le stroma cornéen [20]. D’ailleurs, comme mentionné précédemment, l’humeur aqueuse présente dans la chambre antérieure permet de nourrir la cornée. Les solutés et nutriments qui s’y retrouvent passent à travers la barrière imparfaite, ainsi que les canaux et transporteurs spécifiques situés sur l’endothélium cornéen [34]. Les protéoglycanes du stroma cornéen sont chargés négativement et créent une entrée de liquide, propulsée par la pression intraoculaire, qui explique que le stroma cornéen a une tendance à absorber l’eau. Lorsqu’un surplus d’humeur aqueuse se rend au stroma, la distance entre les fibrilles de collagène augmente, perturbant l’architecture stromale spécifique, causant ainsi une perte de la transparence et une opacification. L’endothélium doit contrebalancer cette entrée de liquide afin d’éviter l’œdème cornéen, en maintenant un taux d’hydratation optimal. Pour ce faire, la monocouche de cellules endothéliales doit rediriger l’eau vers la chambre antérieure et ainsi créer un équilibre entre l’eau rentrant et sortant de la cornée [35]. C’est là que le rôle de pompe de l’endothélium cornéen devient important. Ce rôle dépend principalement de la protéine Na+/K+-ATPase et Mg2+-Na+/K+-ATPase bicarbonate-dépendante [13]. Ces derniers permettent le passage des ions du stroma vers l’humeur aqueuse au niveau de la chambre antérieure, permettant ainsi une baisse de l’osmolarité du côté basolatéral de l’endothélium, amenant ainsi le surplus d’humeur aqueuse en dehors du stroma [11, 36, 37]. Ce processus est régulé par la pression stromale ; les pompes s’activent lorsqu’une hausse de la pression stromale est ressentie [35]. L’endothélium cornéen est donc un tissu métaboliquement actif [11]. Une quantité minimale de CECs (>500
cellules/mm2) est requise afin d’assurer une fonction de pompe optimale [10, 13, 20, 38, 39].
1.4 Dystrophie de Fuchs
La Dystrophie endothéliale cornéenne de Fuchs (DECF) est une maladie de l’endothélium cornéen, décrite pour la première fois il y a plus de 100 ans, en 1910, par le professeur Ernst Fuchs lorsqu’il remarqua chez des personnes âgées une cornée présentant de l’œdème progressif impliquant davantage les couches postérieures de la cornée [40]. Initialement nommé « Dystrophia epithelialis » par le Dr Fuchs, ce n’est que six ans plus tard avec le développement de la lampe à fente, qu’on observa au niveau de l’endothélium cornéen, les guttae pathognomiques de la DECF [41]. En effet, la DECF est une maladie bilatérale, plus souvent asymétrique, caractérisée par la dysfonction de l’endothélium cornéen et le développement d’excroissances typiques au niveau de la membrane de Descemet, nommée guttae (Figure 5) [42, 43]. Cette pathologie est d’ailleurs une des causes les plus fréquentes de dysfonction endothéliale cornéenne [38].
Il existe toutefois une forme de DECF sans guttae dans laquelle la dysfonction de l’endothélium cornéen mène également à l’œdème cornéen, mais sans excroissances au niveau de la membrane de Descemet. Cette forme étant très rare et peu rapportée dans la littérature ne fera pas l’objet de ce mémoire [44].
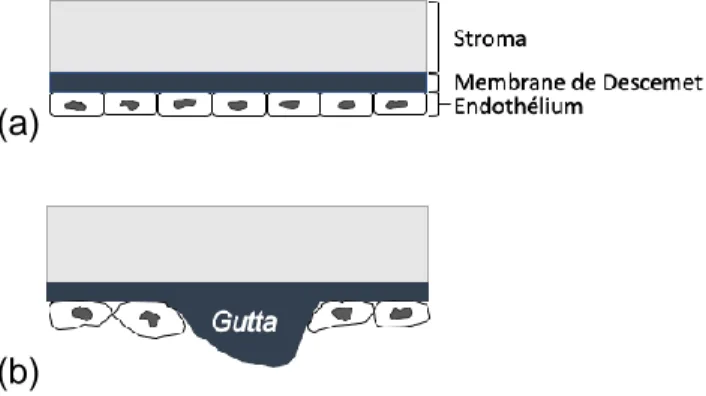
(a)
(b)
Figure 5 Guttae. (a) Endothélium et membrane de Descemet sains. (Source : Isabelle Xu) (b) Endothélium et membrane de Descemet atteints de dystrophie
deviennent dysfonctionnelles et la membrane de Descemet présente des guttae. (Source : Isabelle Xu)
1.4.1 Épidémiologie
La prévalence de la DECF est difficile à déterminer avec précision en raison de l’hétérogénéité présente et l’apparition tardive de la maladie qui rendent difficile le diagnostic précoce de la maladie. Cependant, cette dernière serait plus présente en Europe et moins présente chez les Asiatiques [42, 43]. En effet, la DECF serait une maladie touchant davantage les Caucasiens [38]. La prévalence varie entre 3,8-11% chez les personnes âgées de plus de 40 ans [15, 45, 46]. De plus, en 2016, la DECF représentait 93% des greffes de cornées effectuées pour la correction des dysfonctions endothéliales cornéennes aux États-Unis [47]. En effet, la DECF est la dystrophie la plus fréquente mondialement qui nécessite une kératoplastie dans la prise en charge. Une enquête mondiale effectuée dans 116 pays rapporte la DECF comme étant responsable de 39% des 184 576 greffes cornéennes effectuées en 2012. Parmi les pays ayant réalisé le plus de greffes cornéennes sont les États-Unis, le Canada, le Danemark et le Royaume-Unis [48].
La DECF est une maladie qui touche principalement les personnes âgées. L’apparition des premières guttae se fait dans la quarantaine et la maladie continue à progresser jusqu’à ce qu’une intervention chirurgicale soit nécessaire, normalement vers l’âge de 60-70 ans [39]. Outre l’âge, le sexe est l’autre facteur de risque le plus important lié au développement de la DECF [49]. En effet, les femmes sont plus à risque que les hommes avec un ratio femme à homme de 3 :1 [39]. Cette tendance serait expliquée par une susceptibilité plus grande des femmes, en raison de l’estrogène, envers les rayons UVA qui seraient capables de causer des dommages oxydatifs observés dans la DECF [50]. Cependant, la forme rare d’apparition précoce de la DECF se présente avec un ratio 1 :1 (F :H) [39]. Le tabagisme, l’exposition aux rayons UV et le diabète sont d’autres facteurs de risque qui peuvent affecter la sévérité de la maladie, alors que l’indice de masse corporel serait un facteur protecteur [49]. Par exemple, une étude faite auprès d’Islandais a montré que les gens ayant fumé 20 paquets-année et plus doublent leur risque
d’avoir des guttae à partir de 50 ans [45]. Aux États-Unis, une autre étude a montré que le tabagisme amenait une hausse de 30% de DECF [49].
1.4.2 Clinique
Il existe deux formes de DECF : la forme précoce et la forme tardive. La forme précoce apparaît dès la 1re décennie de vie (3-40 ans) tandis que la forme tardive apparaît plus tard au courant de la vie (>40 ans) [38, 44]. Étant donné que la forme précoce est beaucoup plus rare, ce mémoire adressera davantage la forme tardive. En effet, la forme tardive de DECF est une maladie progressive et dont les premiers symptômes apparaissent la plupart du temps autour de la 6e-7e décennies de vie, une fois que la maladie a déjà évolué [39]. Ainsi, un diagnostic précoce est difficile à faire. Une fois le diagnostic posé, les patients devraient être suivis aux six mois. L’épaisseur cornéenne centrale ainsi que la quantité et la morphologie des cellules endothéliales cornéennes sont des facteurs qui peuvent être utilisés pour suivre la progression de la maladie [38, 39]. La DECF évolue sur 2-3 décennies jusqu’à ce qu’une greffe de cornée soit nécessaire. La kératoplastie permet une amélioration significative de la vision et ainsi un assez bon pronostic pour la DECF [44]. Malheureusement, à ce jour, il n’existe aucun moyen pour prévenir la DECF ou sa progression.
Figure 6 Vision saine à gauche. Vision des personnes ayant la dystrophie endothéliale cornéenne de Fuchs à gauche : vision embrouillée, floue, perte des contrastes et baisse de l’acuité visuelle. Vision normale à droite. (Source : Images originales provenant de Unsplash, plateforme de partage d’images libre de droits. Modifications « vision Fuchs » apportées par Isabelle Xu)
Les principaux symptômes de la DECF sont une vision embrouillée et/ou déformée ainsi que des éblouissements. Ces derniers diminuent l’acuité visuelle dans des situations de luminosité faible ou vive provoquant une difficulté à bien voir le soir et la présence de halos de lumières (Figure 6). Les symptômes sont pires le matin et s’améliorent au courant de la journée en raison de l’augmentation de l’hydratation cornéenne la nuit lorsque les yeux sont fermés. Une sensibilité à la lumière peut également se développer. Avec l’avancement de la maladie, une opacification de la cornée peut être observable et des ulcères cornéens peuvent apparaître, provoquant ainsi de la douleur ou une sensation de grain de sable à la surface de la cornée. Dans les stades ultimes de la maladie, une destruction des nerfs peut survenir et provoquer une baisse de la sensibilité à la surface de la cornée et donc disparition de la douleur [15, 39, 43, 51].
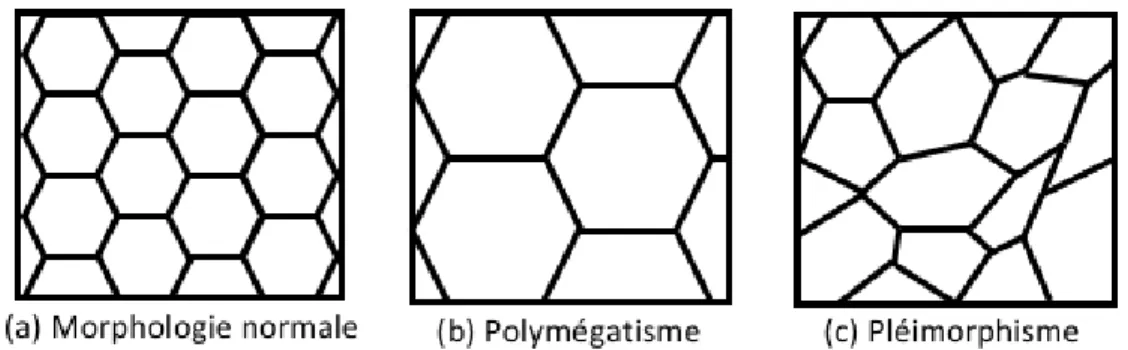
Figure 7 Polymégatisme et pléimorphisme. (a) Morphologie normale. (b)
Polymégatisme : cellules cornéennes endothéliales ayant augmenté de volume. (c) Pléimorphisme : cellules cornéennes endothéliales ayant changé de forme.
(Source : Isabelle Xu)
Deux échelles de classification de la progression de la maladie existent. Cependant, avec les progrès fait dans la prise en charge des patients DECF et les interventions
chirurgicales faites plus tôt dans le développement de la maladie, ces échelles seraient de moins en moins pertinentes cliniquement [44]. La première échelle possède quatre étapes et est davantage clinique (Tableau 1) [42, 43, 52]. La première étape représentant le début de la maladie est asymptomatique, mais présente des guttae isolées, non-confluentes. Un épaississement de la membrane de Descemet commence à être observé ainsi qu’un début de perte de cellules endothéliales cornéennes, laissant place à du polymégatisme (Figure 7). Dans la deuxième étape, les guttae augmentent en taille et en quantité formant ainsi des guttae coalescentes. S’ensuit une perte de cellules endothéliales cornéennes de plus en plus importante entraînant une augmentation de polymégastime et pléomorphisme. L’œdème cornéen commence à être observable aux régions où la perte de cellules n’est pas compensable et la DECF devient symptomatique. À la troisième étape, la fonction endothéliale est compromise et l’œdème cornéen devient évident. Ce dernier peut se rendre jusqu’au niveau de l’épithélium et y causer des ulcères. Finalement, dans la quatrième étape, la cornée devient vascularisée, cicatrisée et opaque. La perte d’acuité visuelle est sévère et les patients peuvent souvent seulement percevoir les mouvements de mains. Ce dernier stade est rare de nos jours en raison de la disponibilité de la greffe de cornée [42, 43, 52].
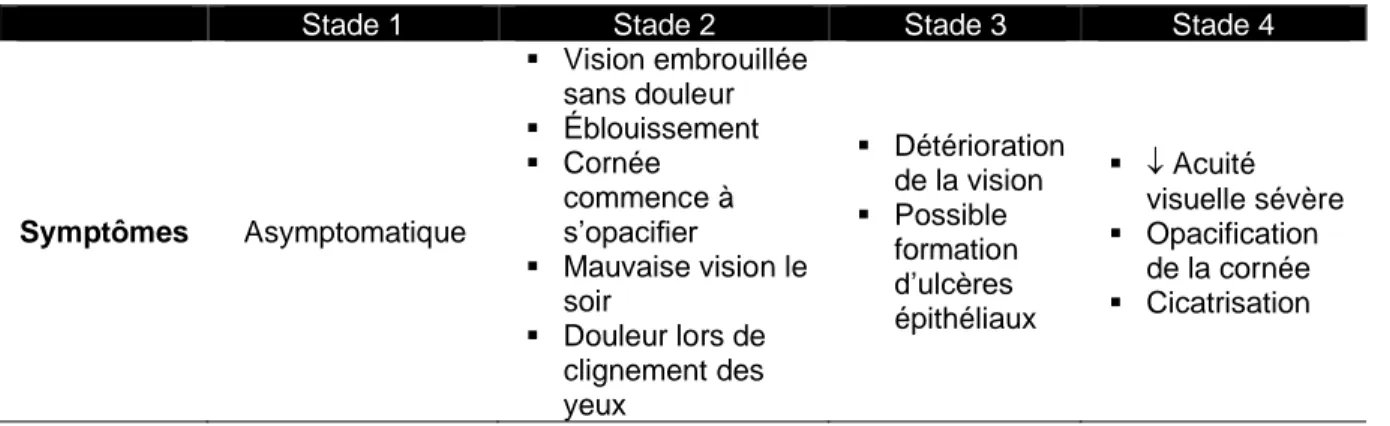
Tableau 1 Échelle de classification séparant l’évolution de la maladie en quatre stades.
Stade 1 Stade 2 Stade 3 Stade 4
Symptômes Asymptomatique ▪ Vision embrouillée sans douleur ▪ Éblouissement ▪ Cornée commence à s’opacifier ▪ Mauvaise vision le soir ▪ Douleur lors de clignement des yeux ▪ Détérioration de la vision ▪ Possible formation d’ulcères épithéliaux ▪ Acuité visuelle sévère ▪ Opacification de la cornée ▪ Cicatrisation
Observation à la lampe à fente ▪ Guttae isolées, non-confluentes ▪ Épaississement de la membrane de Descemet ▪ Polymégatisme ▪ Guttae coalescentes ▪ Polymégatisme et pléomorphisme ▪ Fonction endothéliale compromise ▪ Œdème cornéen évident ▪ Opacification de la cornée ▪ Cicatrisation ▪ Vascularisation cornéenne Références : [42, 43, 52]
La deuxième échelle a été proposée par l’équipe de Krachmer et possède cinq stades d’évolution basés sur la quantité et la distribution des guttae (Tableau 2) [41]. Le « stade 0 » représente l’absence de maladie. Tandis que le « stade 1 » correspond au début de la maladie avant l’apparition des symptômes. Au fur et à mesure que la DECF progresse, la présence de guttae devient de plus en plus importante.
Tableau 2 Stades de Krachmer. Stades proposés par Krachmer classifiant la maladie selon 6 stades basés sur la quantité et la distribution des guttae.
0 1 2 3 4 5 Pas de maladie observée ▪ Asymptomatique ▪ 0-12 guttae ▪ Non-confluentes ▪ Centrales ▪ Au moins un œil affecté ▪ >12 guttae ▪ Non-confluentes ▪ Au moins un œil affecté ▪ Amas de guttae mesurant 1-2mm ▪ Confluentes ▪ Centrales Amas de guttae mesurant 2-5 mm ▪ Amas de guttae mesurant >5mm ▪ +/- Œdème stromale et/ou épithéliale 1.4.3 Physiopathologie
La DECF est caractérisée par une perte progressive de CECs et la formation de guttae. La perte de CECs déclenche l’apparition de polymégatisme et de pléomorphisme. En effet, les CECs restantes changent de forme et de taille comme mécanisme de compensation afin d’essayer de recouvrir les surfaces démunies de cellules. Cependant, avec l’évolution de la maladie, arrive un point où les cellules restantes ne sont plus en mesure de compenser la perte de CECs et s’ensuit la dysfonction endothéliale [53]. Lorsque le compte cellulaire tombe en bas de 400-500
cellules/mm2, la déturgescence cornéenne est compromise et la kératopathie bulleuse ainsi que des troubles de vision se développent [10, 20, 38, 39, 54-56]. Plusieurs changements structuraux apparaissent avec la progression de la maladie en commençant à l’endothélium et évoluant jusqu’à l’épithélium. Effectivement, la DECF commence au niveau de l’endothélium et de la membrane de Descemet. Les CECs montrent des changements morphologiques et structurels : apparition de filaments cytoplasmiques, hausse de réticulum endoplasmique rugueux et des processus cytoplasmiques ressemblant aux fibroblastes [57]. De plus, une baisse de l’expression d’aquaporines a également été observée [58]. Ces dysfonctions au niveau des cellules endothéliales cornéennes participeraient à la sécrétion d’une quantité anormale de matrice extracellulaire. En effet, au niveau de la membrane de Descemet, il y a une hausse dans le dépôt de collagène (IV et VIII), de fibronectine et de laminine [31, 59-63]. D’ailleurs, la fibronectine serait une des premières composantes à montrer un dépôt augmenté, suivi de la laminine et du collagène de type IV dans les stades avancés [62]. Des études ont également rapporté la présence d’une couche anormale de collagène en bande déposée à la face postérieure de la membrane de Descemet appelée « couche collagène postérieure » [31, 54, 57, 64, 65]. De plus, des analyses PCR ont montré une régulation à la hausse de plusieurs gènes codant pour la matrice extracellulaire, dont le collagène (I, III, XVI) et la fibronectine [31, 62]. Une autre étude a également montré une élévation dans les niveaux d’ARN messager et de protéines de collagène (III, XVI), agrine, facteur de croissance transformant bêta (TGFß1) et clusterine [31].
L’épaississement de la membrane de Descemet se traduit également par la présence de guttae. Ces dernières sont des amas de matrices extracellulaires (Figure 5) pathognomiques de la DECF à ne pas confondre à des corps de Hassal-Hense liés au vieillissement et situés en périphérie de la cornée [44]. En effet, les guttae sont typiquement localisées à la région centrale de la cornée en début de maladie et se retrouvent en périphérie seulement dans les stades plus avancés [43,
collagène de type IV et VIII. Avec le temps, les guttae augmentent en quantité et en grosseur pour éventuellement devenir confluentes. À ce stade, il y a une perte de cellules endothéliales au-dessus des guttae. De plus, ces agrégats de matrice extracellulaire sont à leur tour toxiques et exacerbent la perte de cellules endothéliales cornéennes. Ainsi, certaines régions de l’endothélium deviennent incapables de maintenir la déturgescence. Avec la progression de la DECF, la cornée décompense et du liquide s’accumule dans la cornée causant de l’œdème [44]. Par contre, à ce jour, il n’est pas clair à savoir quel est l’élément déclencheur de la DECF : la perte de cellules endothéliales cornéennes ou la formation de guttae. Certaines différences existent, cependant, entre la forme précoce et la forme tardive de la maladie. La forme précoce débutant dès les premières années de vie, présente un épaississement de la membrane de Descemet au niveau de la portion antérieure et peut donc atteindre 35μm d’épaisseur [33, 59]. Elle contient des guttae profondes et discontinuées tandis que la forme tardive de la DECF montre des guttae moins profondes et qui se fusionnent éventuellement. De plus, l’épaississement de la membrane de Descemet est moins important (22μm) dans cette forme et touche seulement la portion postérieure [29, 59, 66]. L’épaisseur de la membrane basale est un facteur indicatif de la sévérité de la maladie [60]. Effectivement, la forme prédominante tardive de la DECF est moins sévère que la forme précoce [38]. Avec la dysfonction endothéliale, la DECF amène éventuellement des changements au niveau du stroma jusqu’à l’épithélium. La perte de la fonction de pompe de l’endothélium provoque une accumulation d’eau au niveau du stroma causant de l’œdème [54]. D’ailleurs, en raison des différences architecturales entre la partie antérieure et postérieure du stroma, l’œdème au niveau du stroma provoque un changement dans la forme de la cornée. La partie antérieure de la cornée devient moins allongée tandis que la partie postérieure devient plus aplatie. Ces changements entraînent un état myopique qui, avec la greffe de cornée, devient davantage hypermétropique [67-69]. Au niveau de la membrane de Bowman, un épaississement irrégulier est observé ainsi qu’une baisse des kératocytes présents [70]. L’épithélium cornéen reste intact en début de DECF. Dans les stades avancés
de la maladie, l’œdème atteint l’épithélium et des ulcères se forment [54]. De plus, les branches du nerf trijumeau présentent une densité réduite et une tortuosité augmentée, expliquant la diminution de sensibilité observée au niveau de la cornée [71]. Cette dysfonction nerveuse peut également nuire à la fonction des cellules épithéliales [72, 73]. La sensibilité peut être rétablie après la greffe de cornée, mais ne sera jamais complète [71]. Tous ces changements au niveau des différentes couches de la cornée expliquent le tableau clinique d’évolution de la DECF, tel que décrit par l’échelle de progression détaillée plus haut.
1.4.4 Étiologies
Actuellement, la cause sous-jacente de la DECF n’est pas encore bien comprise. Néanmoins, plusieurs mécanismes ont été proposés dans la littérature. La DECF serait le résultat d’une combinaison de plusieurs facteurs. Des stress environnementaux et/ou génétiques variés apporteraient différentes mutations qui peuvent avoir diverses conséquences : la toxicité cellulaire et/ou nucléaire et la dérégulation des gènes essentiels pour le bon fonctionnement de l’endothélium cornéenne (ex. taux d’hydratation, besoins énergétiques, réparation ADN, production d’antioxydant, etc.) [38]. Les différents évènements peuvent se produire en même temps ou encore séparément, et mener à la maladie. Les principales hypothèses sont : la génétique, le dysfonctionnement des canaux ioniques, le stress oxydatif et l’apoptose, la dysfonction des mitochondries, et la transition endothélio-mésenchymateuse.
1.4.4.1 Génétique
La DECF est peut-être une maladie génétique à transmission autosomale dominante. Cette forme a été rapportée chez quelques familles à travers le monde. La forme précoce de la maladie est bien définie génétiquement et cliniquement. Cette forme rare est toujours familiale et implique une mutation dans le gène COL8A2 [74, 75]. Par contre, la forme tardive possède une pénétrance incomplète.
Les autres cas de DECF sont sporadiques : seulement la moitié des patients montre une histoire familiale positive. Cette forme est d’ailleurs beaucoup plus hétérogène génétiquement [15, 33, 39, 76-78]. En effet, plusieurs mutations ont été identifiées : TCF4, DMPK, SLC4A11, ZEB1, AGBL1, LOXHD1, KANK4, LAMC1, ATP1B1. 1.4.4.1.1 COL8A2
Le gène COL8A2 code pour le collagène de type VIII qui est la principale composante de la partie antérieure de la membrane de Descemet [33]. Une mutation dans ce gène amène donc un changement au niveau de la structure de cette membrane basale [59, 74, 79, 80]. En effet, une étude ayant induit une mutation homozygote dans un modèle de souris, a observé l’apparition de guttae, le dépôt de collagène abérrante et des réticulums endoplasmiques gonflés [81]. Cette mutation est exclusive à la forme précoce de la maladie [74, 75].
1.4.4.1.2 TCF4
Le TCF4 est un facteur de transcription codant pour la protéine E2-2 ayant des rôles dans la croissance et la différenciation cellulaire. Il est le gène qui a été le plus étudié parmi plusieurs origines ethniques et est davantage associé aux patients caucasiens avec une pénétrance de 80% chez ceux-ci [38, 44]. Les mutations affectant ce gène seraient de type expansion de séquences répétées d’ADN et amènent une toxicité ayant un rôle dans la pathophysiologie de la DECF [33].
1.4.4.1.3 SLC4A11 (Sodium borate transporter)
SLC4A11 code pour la protéine NaBC1, un canal ionique ayant un impact important dans le maintien de la déturgescence de la cornée ainsi qu’un rôle dans la croissance et la prolifération cellulaire [82, 83]. Ce canal a un rôle dans le transport d’un Na+ couplé à un H+ ainsi que le transport de OH- [84]. Ces transports ioniques permettent le passage de l’eau à travers l’endothélium et ainsi, au maintien d’un taux d’hydratation cornéen adéquat [83]. Une mutation dans ce gène amène donc de l’œdème cornéen. D’ailleurs, ce gène a été associé à d’autres dystrophies telles que la dystrophie endothéliale congénitale héréditaire et au Syndrome Harboyan. [38,
54] Plusieurs mutations ont été associées à ce gène : ex, une erreur structurale provoquant une perte de fonction et l’accumulation de protéines mal repliées au niveau du réticulum endoplasmique, production de pompes avec perte partielle de fonction à la membrane, diminution de l’expression des pompes à la membrane, etc [85-87]. Ces mutations mènent ainsi toutes à une dysfonction du transport des ions Na+, OH- et du cotransport NH3 :2H+ [84, 88]. De plus, des études récentes ont rapporté que l’ammonium transporté par cette pompe serait essentiel à la production d’ATP par une voie accessoire, et serait donc une source d’énergie pour l’endothélium cornéen [89]. Ainsi, cette perte de fonction serait également associée à un stress important au niveau de l’endothélium, menant éventuellement à un état apoptotique [90].
1.4.4.1.4 ZEB1
La protéine ZEB1 est un facteur de transcription « Zinc finger E-Box binding homeodomain 1 » codé par TCF8 et régulé positivement par la protéine E2-2 mentionnée ci-haut [44]. TCF8 aurait des fonctions physiologiques similaires à TCF4, mais son rôle précis n’est pas encore connu [33].
1.4.4.1.5 AGBL1
Ce gène code pour l’enzyme « deglutamylase ATP/GTP binding protein-like 1 » et est impliqué dans les modifications post-transcriptionnelles des protéines [38, 44]. 1.4.4.1.6 LOXHD1 (Lipoxygenase homology domains 1)
Cette protéine est impliquée dans l’ouïe. Au niveau cellulaire, elle joue un rôle pour cibler les protéines à la membrane plasmique [38]. En effet, LOXHD1 est retrouvée à la membrane plasmique. L’hypothèse est qu’une mutation dans cette protéine provoquerait sa surexpression et son accumulation sous forme d’agrégats cytotoxiques [91].
KN motif and ankyrin repeat domains 4, Laminin subunit gamma 1 et ATPase Na+/K+ transporting subunit beta
Ces gènes permettent la déturgescence de la cornée en ayant un contrôle sur le transport de fluide, les contacts intercellulaires et l’intégrité tissulaire [38, 92]. L’ATP1B1 code pour une Na+/K+ATPase chez qui une mutation a été associée à des cellules endothéliales cornéennes en état d’épuisement énergétique [38]. 1.4.4.1.8 DMPK (Myotonic dystrophy type 1 protein kinase)
La DMPK est impliquée dans plusieurs maladies neurodégénératives : Dystrophie myotonique 1 et 2, tremblement et ataxie associés au syndrome X fragile, sclérose latérale amyotrophique et démence fronto-temporale [38].
1.4.4.2 Dysfonctionnement des canaux ioniques
Comme mentionné précédemment, les canaux ioniques sont très importants dans le maintien d’un taux d’hydratation cornéen optimal. Ainsi, une dysfonction au niveau de ces protéines mène à de l’œdème cornéen, comme observée dans la DECF. Par exemple, comme expliqué ci-haut, une mutation dans le gène codant SLC4A11, un canal ionique, est reliée à la DECF. En effet, avec la progression de la DECF, il y a une baisse dans la quantité de pompes ioniques retrouvées sur les cellules endothéliales cornéennes qui coïncide avec l’apparition de l’œdème cornéen [52, 93]. Ces pompes peuvent également devenir simplement dysfonctionnelles. L’aquaporine AQP1 et les transporteurs monocarboxylates MCT1 et MCT4 sont des exemples de pompes dont la fonction et la quantité sont en baisses dans la DECF [58, 84, 94]. D’ailleurs, des chercheurs ont montré que la perte progressive de pompes ioniques serait plus importante dans l’évolution de la maladie que la perte de la fonction barrière des CECs [33, 95-98].
1.4.4.3 Stress oxydatif et apoptose
La cornée est régulièrement exposée à des rayons UV. Cette exposition mènerait à la production d’espèces réactives de l’oxygène qui causent à leur tour des
dommages à l’ADN mitochondrial et nucléaire, provoquant la mort de cellules endothéliales cornéennes [38, 39]. La réponse aux protéines mal repliées (UPR) du réticulum endoplasmique serait aussi une source de stress oxydatif dans la DECF. En effet, ce phénomène est mis en évidence par des niveaux dérégulés de marqueur d’UPR et la présence de réticulums endoplasmiques rugueux et élargis [81, 99, 100]. Cette réponse est normalement activée pour réduire la quantité de protéines mal repliées et ainsi diminuer le stress cellulaire. Cependant, dans des situations de stress du réticulum endoplasmique sévère et prolongé, telle la DECF, l’UPR provoque l’apoptose [33]. De plus, la DECF serait également associée à une baisse des niveaux de certains antioxydants importants : superoxide dismutase, catalase, glutathione peroxidase et glutathione réductase [101]. Il y a donc un déséquilibre oxydatif provoqué par une combinaison de facteurs environnementaux et génétiques [102].
L’accumulation de mutations, la dysfonction de canaux ionique, le stress au niveau du réticulum endoplasmique et la toxicité d’ARN sont des conséquences de l’état oxydatif présent dans la DECF. En effet, le stress oxydatif excessif entraîne des dommages irréversibles de l’ADN qui suppriment la capacité proliférative des cellules et mènent à l’apoptose précoce [103]. La DECF serait également associée à une surexpression de la clustérine en lien avec le stress cytotoxique présent [104]. Cette protéine a des effets différents selon sa localisation : la forme sécrétoire favorise la survie tandis que la forme nucléaire induit l’apoptose. Les deux formes sont surexprimées dans la DECF avec prédominance de la forme sécrétoire autour des guttae [33].
1.4.4.4 Dysfonction mitochondriale
Les cellules endothéliales cornéennes sont des cellules très actives métaboliquement de par leurs rôles et requièrent donc beaucoup d’énergie. Elles possèdent d’ailleurs énormément de mitochondries pour répondre à leur besoin. Cependant, les mitochondries présentes dans les CECs DECF seraient surchargées
immortalisées DECF ainsi que des spécimens ex vivo, ont remarqué plusieurs traits caractéristiques de dysfonction mitochondriale : hausse de dommages à l’ADN mitochondrial, baisse du potentiel d’action membranaire mitochondrial et fragmentation mitochondriale par mitophagie [106, 107]. Une étude a aussi observé de la dysfonction mitochondriale à des régions spécifiques par une baisse de l’activité de la cytochrome-oxydase. Ces régions correspondaient aux endroits présentant de l’œdème cornéen, laissant croire qu’une dysfonction des mitochondries occasionne une quantité insuffisante d’ATP nécessaire pour le bon fonctionnement des canaux ioniques [38].
1.4.4.5 Transition endothélio-mésenchymateuse
Certaines analyses histopathologiques révèlent que les cellules endothéliales cornéennes peuvent changer de phénotype pour devenir fibroblastique ou épithéliale, où elles sécrètent davantage de protéines matricielles constituantes entrainant un épaississement de la membrane de Descemet, tel qu’observé dans la DECF [77]. En effet, certains changements retrouvés au niveau des cellules endothéliales cornéennes suggèrent que ces dernières subissent une métaplasie et acquièrent un phénotype davantage fibroblastique ou épithéliales : RER élargi, mitochondries dilatées et certains marqueurs épithéliaux [33, 57, 108]. Aussi, des études faites sur des cellules DECF immortalisées ont montré l’implication de deux protéines favorisant la transition endothélio-mésenchymateuse (TEM) (ZEB1 et Snail1, via la voie TGF-) dans le dépôt excessif de MEC [109].
De plus, la formation de guttae serait associée à la surexpression des protéines TGF1 et CLU. La TGF1 est une cytokine qui, une fois sécrétée, interagit avec des composantes de la MEC telles que le collagène, les intégrines et la fibronectine [38]. 1.4.5 Traitements
Aucun traitement curatif autre que la greffe de cornée n’existe à ce jour. Certains traitements existent néanmoins pour le contrôle des symptômes.
Différentes méthodes non-chirurgicales sont disponibles pour la prise en charge de la DECF. Parmi celles-ci, l’inhibiteur sélectif de ROCK (Rho/Rho-kinase) (Y-27632) semble prometteur. Cet agent diminue l’apoptose induite par dissociation et favorise ainsi l’adhésion et la prolifération des cellules endothéliales cornéennes [110-114]. De plus, ROCK a aussi un effet sur la morphologie cellulaire et la réorganisation de la matrice extracellulaire en jouant sur le cytosquelette des cellules [44]. Des études cliniques sur ces gouttes oculaires ont montré une baisse de l’épaisseur cornéenne centrale qui a été maintenue dans le temps. De plus, l’utilisation de l’inhibiteur ROCK n’a pas induit de toxicité ou d’altérations cellulaires [115]. Une autre étude effectuée chez des singes a montré que cet inhibiteur a permis la régénération complète des cellules endothéliales cornéennes en état apoptotique ou de différenciation terminale [116]. Cet agent pourrait donc être utilisé comme une alternative de transplantation cornéenne chez les patients ayant un début de décompensation cornéenne. Cet inhibiteur a également été étudié lorsque mis en culture avec des cellules endothéliales cornéennes humaines, puis injectées au niveau de la chambre antérieure. Les chercheurs ont remarqué une ré-endothélialisation, permettant à la cornée de redevenir transparente et ainsi une amélioration de l’acuité visuelle [117, 118]. Une étude a aussi testé cet agent chez un homme japonais de 52 ans, chez qui l’application des gouttes oculaires inhibitrices ROCK a mené à une amélioration de la vision, sans effets secondaires, persistant jusqu’à deux ans post-traitement [116]. Néanmoins, certains chercheurs ont montré que l’inhibiteur ROCK engendrait également la régénération de cellules possédant des mutations pouvant ainsi mener à un endothélium cornéen pathologique [38]. Ce point devrait être considéré lors de son utilisation dans la prise en charge de la DECF.
D’autres traitements existent pour soulager les symptômes de vision floue et douleur oculaire. Par exemple, des gouttes oculaires hypertoniques de NaCl sont utilisées lorsque l’endothélium cornéen commence à décompenser afin d’aider à la déshydratation cornéenne et ainsi diminuer son épaisseur [119]. Ces gouttes sont parfois utilisées en combinaison avec des lentilles de type pansement qui aident à diminuer la douleur et l’inconfort [15]. Ce traitement n’est cependant pas efficace
que l’application d’air tiède et sec à l’aide d’un séchoir à cheveux permet d’assécher la cornée et atténuer la vision floue matinale [44]. La ponction stromale antérieure est un traitement efficace chez les patients ayant de l’œdème stromal localisé [120]. Cependant, l’efficacité et l’innocuité de cette technique n’ont pas encore été montrées chez les patients ayant une décompensation cornéenne. De plus, l’impact de cette procédure sur les greffes de cornée ultérieures n’a pas été évalué [15]. D’autres traitements pouvant aider au soulagement des symptômes sont : la kératectomie photothérapeutique, le « Gundersen conjunctival flap », la transplantation de membrane amniotique et la réticulation de collagène cornéen. (Tableau 4) Bref, aucun traitement non-chirurgical n’est curatif à ce jour.
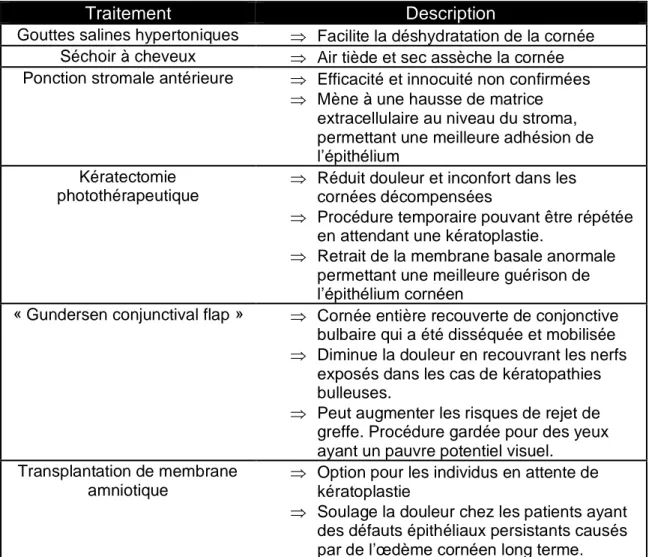
Tableau 3 Traitements actuellement disponibles pour les patients atteints de DECF.
Traitement Description
Gouttes salines hypertoniques Facilite la déshydratation de la cornée Séchoir à cheveux Air tiède et sec assèche la cornée Ponction stromale antérieure Efficacité et innocuité non confirmées
Mène à une hausse de matrice extracellulaire au niveau du stroma, permettant une meilleure adhésion de l’épithélium
Kératectomie photothérapeutique
Réduit douleur et inconfort dans les cornées décompensées
Procédure temporaire pouvant être répétée en attendant une kératoplastie.
Retrait de la membrane basale anormale permettant une meilleure guérison de l’épithélium cornéen
« Gundersen conjunctival flap » Cornée entière recouverte de conjonctive bulbaire qui a été disséquée et mobilisée Diminue la douleur en recouvrant les nerfs
exposés dans les cas de kératopathies bulleuses.
Peut augmenter les risques de rejet de greffe. Procédure gardée pour des yeux ayant un pauvre potentiel visuel. Transplantation de membrane
amniotique
Option pour les individus en attente de kératoplastie
Soulage la douleur chez les patients ayant des défauts épithéliaux persistants causés par de l’œdème cornéen long terme.
Références : [15, 44]
1.4.5.2 Chirurgicales
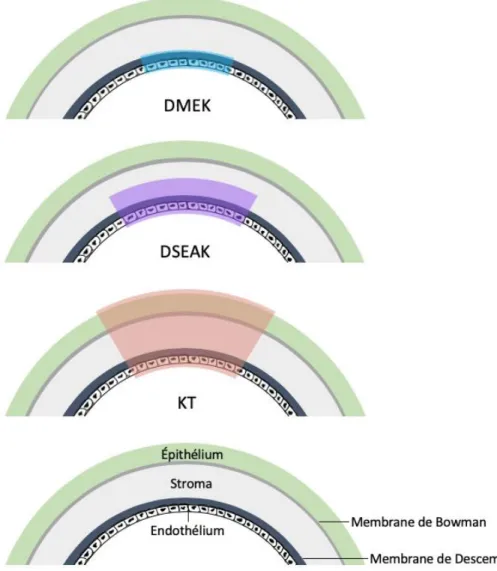
Le seul traitement définitif de la DECF est la greffe de cornée. Cependant, avec l’avancement des techniques chirurgicales, un éventail de techniques existe. En effet, la greffe de cornée peut soit se faire entière ou seulement au niveau de l’endothélium et de la membrane de Descemet. (Figure 8) La kératoplastie transfixiante (KT) consiste à remplacer toutes les couches de la cornée. Cette technique n’est cependant plus favorisée. La kératoplastie endothéliale avec stripping automatisé de la membrane de Descemet (DSAEK) ainsi que la kératoplastie endothéliale (DMEK) sont les deux techniques les plus utilisées à ce jour. La DSAEK implique la greffe de l’endothélium, de la membrane de Descemet avec le stroma, alors que la DMEK constitue une greffe de l’endothélium avec la membrane de Descemet, sans le stroma [15, 38]. Une revue Cochrane comparant la DMEK et la KT n’identifie pas de différence significative dans la vision finale post-chirurgie, mais rapporte une amélioration visuelle plus rapide et répétable avec la DMEK [121]. De plus, cette technique permettrait également une diminution des complications post-opératoires incluant les rejets [38, 44]. Les complications
Permet aux cellules épithéliales de croître Effet sur greffe de cornée ultérieure non
connu. Réticulation de collagène
cornéen
Résultats sont mixtes. Aiderait avec l’œdème cornéen en améliorant l’acuité visuelle et en diminuant l’inconfort.
Permettrait également de retarder le besoin de transplantation.
Mais effet diminue dans les 3-6 mois post-op
Effet diminue avec le temps et dépend de la sévérité de l’œdème
Rends les fibres de collagènes de la portion antérieure du stroma plus compacts et organisées. Effet moindre dans les cas d’œdème cornéen sévère.
Permet de diminuer l’afflux transendothélial et la pression d’imbibition stromale.
greffon, la fuite aqueuse, l’infection, l’hypertension oculaire suivant l’utilisation de stéroïde, la formation de cataracte, la mauvaise cicatrisation des plaies et les complications vitréo-rétiniennes [44]. La greffe de cornée reste donc une méthode invasive pour traiter la DECF.
Figure 8 Différentes techniques de greffe selon les couches greffées.
Kératoplastie transfixiante (KT) consiste à enlever et greffer toutes les couches de la cornée. La kératoplastie endothéliale avec stripping automatisé de la membrane de Descemet (DSAEK) enlève l’endothélium, la membrane de Descemet ainsi qu’une partie du stroma. La Kératoplastie endothéliale (DMEK) est une greffe de l’endothélium et de la membrane de Descemet seulement. (Source : Isabelle Xu)