IW
'T&6*
MEMOIRE PRESENTE
A L'ECOLE DES GRADUES DE L'UNIVERSITE LAVAL
POUR L'OBTENTION
DU GRADE DE MAITRE ES SCIENCE (M.Sc.)
PAR
MARIE-JOSE BLOUIN BACHELIERE ES SCIENCE DE L'UNIVERSITE DE SHERBROOKE
CARACTERISATION D'UN ANTICORPS MONOCLONAL ANTI-CYTOKERATINES POUR LE TYPAGE DE CELLULES EPITHELIALES HUMAINES
J1 aimerais profiter de l'occasion pour remercier mes 2 co-directeurs: le Docteur Jacques Huot qui m'a acceptée dans son équipe et m'a fourni toutes les facilités matérielles et techniques nécessaires à la réussite de mon projet et le Docteur Louis Lafleur qui m'a aidée au cours de ces 2 années par ses nombreux conseils, au niveau expérimentation et rédaction du mémoire et ses encouragements. De plus, par la confiance qu'il a portée en moi, il a su me donner l'assurance qu'il me manquait.
Je remercie aussi le Docteur Normand Marceau, surtout lors de l'absence de mes directeurs, pour son support et ses conseils en ce qui concerne les travaux expérimentaux et lors de la rédaction de mon mémoire.
Je remercie les Docteurs Yves Fradet et Jacques Landry, membres de mon comité de thèse, pour leurs conseils dans l'orientation de mes travaux.
Merci à René Goyette pour son aide au laboratoire et à Colette Dufour pour avoir effectué les fusions permettant l'avancement de mon projet.
Je remercie les gens qui ont bien voulu me fournir les lignées cellulaires, i.e. les Docteurs Yves Fradet du Centre de Recherche et Richard Gagné du CHUL. Aussi, le personnel du département de pathologie de 1'Hôtel-Dieu de Québec qui m'a procuré les échantillons de tissus humains.
Un gros merci à ma famille, ma mère et mes frères. Même loin, ils étaient présents pour me soutenir et m'encourager à aller de l'avant.
Et merci à tous ceux qui, par leur conseil, leur aide technique et surtout pour leur amitié et leur soutien moral ont facilité mes études.
Je remercie enfin le Ministère de la Santé et Bien-Etre Social du Canada (division Programmme National de Recherche et Développement en Matière de Santé) dont l'aide matérielle a permis la réalisation de ce travail.
La fusion entre des cellules de rate de souris immunisées avec des suspensions de tumeurs primaires mammaires humaines et des cellules d'une lignée de myélome de souris a permis d1 obtenir des anticorps monoclonaux reconnaissant les cellules épithéliales. De cette banque d'anticorps, trois réagissent contre des filaments cytoplasmiques.
La caractérisation de ces anticorps monoclonaux a été faite à l'aide de techniques d'immunohistochimie, immunofluorescence et immunoperoxydase, en utilisant différentes lignées cellulaires humaines et différents tissus épithéliaux et non-épithéliaux humains, afin de connaître la spécificité des anticorps. Le poids moléculaire relatif des protéines reconnues par les anticorps a été déterminé par immunodétection de type western après transfert des protéines sur membrane de nitrocellulose .
Les résultats présentés dans ce mémoire concernent uniquement la caractérisation d'un anticorps monoclonal, 1B6, qui reconnaît spécifiquement plusieurs cytokératines.
Par sa spécificité, cet anticorps est un marqueur des cytokératines, donc des cellules d'origine épithéliale normales et tumorales. Il représente ainsi un outil utile et unique à notre connaissance pour le diagnostic, en pathologie, de métastases d'origine épithéliale. Au niveau de la recherche fondamentale, il constitue un outil intéressant pour l'étude, entre autres de la différenciation cellulaire épithéliale et du rôle des cytokératines.
Marie-José Blouin, B.5c.
page
AVANT-PROPOS... i
RESUME... il TABLE DES MATIERES... iii
LISTE DES ABREVIATIONS... vi
LISTE DES TABLEAUX... viii
LISTE DES FIGURES... ix
CHAPITRE 1: INTRODUCTION... 1 1.1 Cytosquelette... 1 1.2 Filaments intermédiaires... 1 1.2.1 Types et distribution... 1 1.2.2 Structure protéique... 2 1.3 Cytokératines... 5 1.3.1 Types d'épithélium... 5
1.3.2 Diversité des cytokératines...5
1.4 Aspect immunologique de l'étude... 7
1.5 Buts du travail... 9
CHAPITRE 2: MATERIEL ET METHODES... 10
2.1 Cultures cellulaires... 10
2.2 Provenance des tissus... 10
2.3 Production d'anticorps monoclonaux...11
2.4 Préparation pour 1 'immunohistologie...11
2.4.1 Lignées cellulaires... 11
2.4.2 Tissus congelés... 12
2.4.3 Tissus paraffinés...12
2.5 Microscopie d ' immunofluorescence indirecte... 12
2.6 Immunoper oxydase...13
2.7 Enrichissement des filaments intermédiaires... 13
2.8 Dosage de protéines par la méthode de Lowry... 14
2.9 Electrophorèse et immunodétection de type western...14
2.10 Technique de marquage à 1 'iode-125... 15
2.11 Technique de précipitation au TCA... 15
2.12 RIA en phase solide... 16
CHAPITRE 3: RESULTATS page .19 A- Immunohistochimie... 19 3.1 Tissus... 19 3.1.1 Epithélium simple... 19 3.1.1.1 Sein... 19 3.1.1.2 Estomac... 19 3.1.1.3 Foie... 22 3.1.1.4 Pancréas... 22 3.1.1.5 Rein... 22 3.1.2 Epithélium transitionnel... 22 3.1.2.1 Vessie... ...22 3.1.2.2 Uretère... 22 3.1.3 Epithélium glandulaire... 24 3.1.3.1 Prostate... 24 3.1.3.2 Poumon... 24 3.1.4 Epithélium kératinisé... 24 3.1.4.1 Peau... 24 3.1.5 Epithélium germinal... 24 3.1.5.1 Testicules... 24 3.1.6 Tissus non-épithéliaux... 24 3.1.6.1 Endothélium... 24 3.1.6.2 Myocarde... 26 3.1.7 Tissus tumoraux... 26 3.1.7.1 Sein... 26
3.1.7.2 Métastases aux ganglions...26
3.1.7.3 Rein... 26
3.1.7.4 Muqueuse pyélique... 26
3.1.7.5 Vessie... 29
3.2 Lignées cellulaires... 29
3.2.1 Origine épithéliale simple... 29
3.2.2 Origine épithéliale transitionnelle... 34
3.2.3 Origine épithéliale glandulaire... 34
3.2.4 Autres origines...34
B- Immunodétection de type western... 40
page 3.4. Lignées épithéliales... 40 CHAPITRE 4: DISCUSSION ET CONCLUSIONS... 47 BIBLIOGRAPHIE... 51
A
:
AmpèreBSA : Albumine de sérum bovin °C : Degré Celcius
cm : Centimètre
cpm : Comptes par minute DAB : Diaminobenzidine fil.
:
Filamentsg
: Unité de gravitéGEAR : Protéine acidique fibrillaire gliale
h : Heure
X • 0 •
: C'est-à-direig
: Immunoglobuline kD : KilodaltonM : Molaire
MEM : Minimal Essential Medium
\m
: Microgrammenx
:
Microlitre mA:
Milliampère mCi:
Millicurie ml:
Millilitre mM:
Millimolaire min:
Minute N:
Normale nm:
Nanomètre-
:
NégatifP BS
:
Tampon phosphate salin PEG:
Polyéthylène glycolpi
:
Point isoélectriquePMSF
:
Fluorure de phénylméthylsulfonyl pts:
Points+
:
PositifRPM
:
Révolutions par minute SDS:
Dodécyl sulfate de sodium TCA:
Acide trichloroacétiqueTNM : Tampon Tris 10 mM, NaCl 140 mM, MgClg'GHgO 5mM, pH 7.6 U.I. : Unité internationale
LISTE DES TABLEAUX
page
TABLEAU I: Immunohistochimie de 1B6 sur des coupes de tissus
humains congelés ou déparaffinés...20
TABLEAU II: Immunofluorescence de 1B6 sur différentes lignées
LISTE DES FIGURES
page
FIGURE 1: Structure protéique des filaments intermédiaires... 4
FIGURE 2: Protocole expérimental général... 18
FIGURE 3: Immunofluorescence de 1B6 sur le sein et 1'estomac normaux..21
FIGURE 4: Immunoperoxydase de 1B6 sur 11 uretère normal... 23
FIGURE 5: Immunofluorescence de 1B6 sur la peau normale...25
FIGURE 6: Immunofluorescence de 1B6 sur une tumeur mammaire.27 FIGURE 7: Immunofluorescence de 1B6 sur des métastases aux ganglions..28
FIGURE 8: Immunofluorescence de 1B6 sur la lignée ME-180...31
FIGURE 9: Immunofluorescence de 1B6 sur la lignée MCF-7... 32
FIGURE 10: Immunofluorescence de 1B6 sur la lignée SW-780...33
FIGURE 11: Immunofluorescence de 1B6 sur la lignée J'O.N... 35
FIGURE 12: Immunofluorescence de 1B6 sur la lignée T-24... 36
FIGURE 13: Immunofluorescence de 1B6 sur la lignée SK-LC-6... 37
FIGURE 14: Immunofluorescence de 1B6 sur les fibroblastes normaux 38 FIGURE 15: Immunofluorescence de 186 sur les lignées EFFRON et U-251... 39
FIGURE 16: Immunodétection (western) de 1B6 sur la lignée EFFRON... 41
FIGURE 17: Immunodétection (western) de 1B6 sur les fibroblastes... 42
FIGURE 18: Immunodétection (western) de 1B6 sur la lignée MCF-7... 43
FIGURE 19: Immunodétection (western) de 1B6 sur la lignée ME-180... 44
1.1 Cytosquelette
Le cytosquelette est formé de réseaux fibrillaires qui sont en majeure partie responsables de 11 organisation structurale de la cellule. Il y a 3 systèmes de filaments qui composent principalement le cytosquelette : les microtubules qui ont le plus grand diamètre (15 nm) et qui comprennent, entre autres, la tubuline (55 kD) ; les microfilaments dont la protéine majeure est l'actine (43 kD) et qui possèdent un diamètre d1 environ 6 nm et les filaments de taille intermédiaire dont le diamètre se situe entre 7 et 11 nm. Il y a aussi les microtrabicules qui ont un diamètre de 2 à 3 nm, mais leur existence est encore très controversée. Chaque classe de filaments est distincte des autres par ses caractéristiques morphologiques, sa composition peptidique et ses propriétés physicochimiques.
1.2 Filaments intermédiaires 1.2.1 Types et distribution
Les présents travaux portent sur les filaments de diamètre intermédiaire. Ceux-ci sont présents dans plusieurs types cellulaires et ils se retrouvent, probablement, dans les cellules de tous les vertébrés. Les filaments intermédiaires sont une structure cytoplasmique très stable mécaniquement et chimiquement (Franke et coll., 1983a). Plusieurs drogues, telle la cytochalasine, sont inefficaces à les déloger ou les modifier. Ils sont aussi très insolubles dans des détergents non-ioniques et de forte ou faible force ionique. La famille des filaments intermédiaires comprend 5 membres, chacun caractérisant spécifiquement un type cellulaire (Gown et Vogel, 1984). Leur distribution est reliée à la voie de différenciation majeure i.e. les cellules épithéliales, les cellules nerveuses, les cellules du tissu conjonctif, etc. (Franke et coll., 1983a).
La vimentine est une protéine de 58 kD, présente dans toutes les cellules et tissus qui proviennent du mésenchyme, entre autres les fibroblastes et les cellules musculaires. Par contre, la desmine qui est une protéine de poids moléculaire de 55 kD, n'est retrouvée que dans certaines cellules mésenchymateuses, telles les cellules des muscles lisses, squelettiques et cardiaques. Les neurofilaments sont composés de 3 peptides de 68, 160 et 200 kD qui sont retrouvés strictement dans les neurones. Dans
le système nerveux central et périphérique, en plus des neurofilaments, il y a aussi les filaments gliaux, qui contiennent la protéine acidique fibrillaire gliale (GFAP) de poids moléculaire de 51 kD. Cette protéine est retrouvée dans les cellules épendymaires et astrogliales. Les cellules épithéliales sont caractérisées par les cytokératines qui sont au nombre de 19 protéines chez l'humain. Les cytokératines se différencient d'après leur hétérogénéité de poids moléculaire (40 kD à 68 kD) et de pi (4.8 à 7.6) (Moll et coll., 1982).
Dans différents types de cellules, la vimentine peut être exprimée avec un autre membre de la classe des filaments intermédiaires. C'est le cas des muscles où il y a coexpression de la desmine avec la vimentine (Steinert et coll., 1981; Berner et coll., 1981; Nelson et Traub, 1983). La vimentine se retrouve fréquemment dans des lignées cellulaires (Traub, 1985). Cela peut être expliqué par la présence de cellules souches qui, elles, ont la possibilité d'exprimer les différents filaments intermédiaires (Traub, 1985). Il peut arriver aussi que dans certaines cellules épithéliales en culture, l'expression des cytokératines soit diminuée. Une des causes possibles peut être la perte de leur état de différenciation normal (Sun et coll., 1984). Cependant, la coexpression de la vimentine et des cytokératines chez les mammifères adultes est très rare (Caselitz et coll., 1984). Récemment, Gould et coll. (1986) ont montré que dans certains types de tumeurs, les filaments intermédiaires sont exprimés dans un tissu où, normalement, ils ne l'étaient pas. Il est donc possible en général, d'après la distribution des filaments intermédiaires, d'identifier l'origine des cellules; ou de suspecter la présence de tumeur, si un des types de filaments est aussi présent dans un tissu autre que celui qu'il caractérise normalement.
1.2.2 Structure protéique
Les protéines de la famille des filaments intermédiaires sont classifiées d'après les groupements protéiques caractérisant leur structure (Steinert et coll., 1985). Les cytokératines sont distribuées dans le Type I ou II selon qu'elles sont acides ou neutres/basiques, respectivement. Le Type III regroupe la vimentine, la desmine et la protéine acidique fibrillaire gliale. Les neurofilaments font probablement partie d'une autre catégorie (non-déterminée).
Des études ont été effectuées pour savoir si les différents types ont une origine commune ou s'ils sont totalement indépendants les uns des autres. Mais, l'étude des gènes montre pour les différents types une similarité dans la position des introns (Krieg et coll., 1985), ce qui renforce 1'hypothèse d'une origine commune. La chaîne peptidique des filaments intermédiaires est divisée en 3 domaines: le domaine central et les domaines terminaux (acidique et aminé). La plus grande ressemblance entre les différents types est retrouvée dans le domaine central. Cette partie est constituée de 4 segments qui forment une hélice alpha superenroulée. Ces segments sont séparés par des ligands qui ne sont pas en hélice alpha (Steinert et coll., 1985; Steinert et Steven, 1985). Des unités heptades répétitives sont responsables de la formation de l'hélice alpha superenroulée. D'ailleurs, c'est cette répétition hydrophobe typiquement retrouvée dans les structures en hélice alpha qui donne les caractéristiques des filaments intermédiaires (Marchuk et coll., 1984) et qui les distingue des autres classes de filaments (Steinert et Steven, 1985). La séquence du domaine central est différente d'un type à l'autre, mais la structure est semblable (Steinert et coll., 1985), figure 1.
La longueur des 2 domaines terminaux varie d'un type à l'autre et d'une protéine à l'autre. Ces 2 parties déterminent le caractère chimique et distinguent les différents types et protéines. La séquence des domaines terminaux est importante pour la fonction des filaments intermédiaires (Krieg et coll., 1985). Ces derniers ont une certaine homologie de structure entre eux qui peut atteindre 60 à 70%. Cependant, les cytokératines ne sont qu'à 30% homologues avec les autres filaments intermédiaires (Marchuk et coll., 1984).
La formation des filaments intermédiaires nécessite 2 sous-unités de protéines par fibre, i.e. 4 chaînes superenroulées (Steinert et coll., 1985). Pour les protéines du type III, les fibres sont homopolymères. Les cytokératines, pour leur part, nécessitent la présence d'une protéine du type I et une autre du type II (Steinert et coll., 1985). Cependant, l'arrangement des cytokératines pour former chaque sous-unité de la fibre n'est pas encore déterminé (Hanukoglu et Fuchs, 1982). Il pourrait être homopolymère ou hétéropolymère.
N-terminal domain —central rod domain
1B
2A
L12 L2
2B
J=
Œ_____ I Type I Acidic keratins
N
V1 j
|
ŒZ_D Type II Neutral-basic keratins
N V1
H1|
I
EZ=ZD Type III Vimentin, Desmin, GFAP
N I Hl{
I cc I NeurofilamentsN?
V1
j C-terminal domaini n
| V2
c
n
|H2 V2 C
U
j H2
ŒZZU
H2? V2 ? C
FIGURE 1: Schéma expliquant les différences structurales des types de protéines composant la classe des filaments intermédiaires: Type I les cytokératines acides ; Type II les cytokératines neutres-basiques; Type III la vimentine, la desmine et la protéine fibrillaire acidique gliale; et les neurofilaments. Le domaine central est la partie où il y a le plus de similarités entre les types. Les domaines terminaux procurent une identité spécifique pour chaque protéine. H, V et N ou C correspondent aux séquences homologues, variables et terminales basiques, respectivement, (d'après Steinert et coll., 1985).
1.3 Cytokératines
1.3.1 Types d1 épithélium
Il existe plusieurs types d'épithélium regroupés selon leur fonction: de recouvrement ou glandulaires (Leeson et Leeson, 1976). Les épithéliums de recouvrement ont comme fonction de protéger les tissus ou d1 absorber différentes substances. Ils sont constitués de feuillets de cellules épithéliales qui sont rangées en couches simples ou multiples, ce qui donne l'appelation d1 épithélium simple et d'épithélium stratifié. Les épithéliums de recouvrement ne sont pas irrigués par des vaisseaux sanguins et lymphatiques. En fait, la quantité de substance intercellulaire est très réduite puisque l'épithélium est déposé sur une lame basale qui le sépare aussi du tissu conjonctif. Les différents épithéliums peuvent être divisés en sous-groupes d'après la forme des cellules, i.e. pavimenteuses, cubiques ou cylindriques. L'origine embryologique de ces cellules ne peut être déterminée puisque 1'ectoblaste, 1'endoblaste et le mésoblaste sont responsables de la naissance des épithéliums. La localisation des différents épithéliums dépend, pour beaucoup, de la fonction de 1'organe qu'ils recouvrent.
En plus des épithéliums simples et stratifiés, d'autres sous-classes existent: 1'épithélium pseudostratifié qui est un épithélium simple, mais dû à 1'emplacement du noyau des cellules, ressemble à un épithélium stratifié. L'épithélium transitionnel qui se situe aux endroits où des variations de pression peuvent se produire. De plus, 1'épithélium stratifié peut être non-kératinisé; ou kératinisé s'il est situé à une interface en contact avec l'air et où les cellules se transforment en couches résistantes et dures formant de la kératine ; c'est le cas de la peau.
Les épithéliums glandulaires sont présents là où la fonction de sécrétion est importante. Ils sont composés de cellules organisées de façon à faciliter le transport des produits de sécrétions des glandes endocrines dont 1'épithélium est sous forme de cordons, de travées ou de follicules, ou des glandes exocrines où l'épithélium peut être simple sous forme tubulaire, alvéolaire ou composée.
1.3.2 Diversité des cytokératines
En réalité, 1'existence des cytokératines dans les cellules épithéliales non-kératinisées n'est connue que depuis une dizaine d'années (Franke et
coll., 1978). Plusieurs études ont été effectuées sur la kératine, protéine des cheveux, entre autres. D'ailleurs, c'est en étudiant la structure de cette protéine que Pauling et Corey (1953) démontrèrent 1'existence de la structure en hélice alpha.
Au cours de 1'évolution des vertébrés, les cytokératines se sont relativement bien conservées (Franks et coll., 1981a; Moll et coll., 1982). En général, la spécificité de 11 expression des cytokératines est en relation avec la différenciation (Franks et coll., 1981a). Il y a des cytokératines propres à chaque type d'épithélium (simple: foie, glandes mammaires; stratifié : oesophage ; kératinisé: peau). Et pour chaque type, 1'expression tient compte du programme de différenciation et de l'état de croissance de la cellule (Cooper et coll., 1985; Sun et coll., 1984). Dans les différents tissus, des combinaisons spécifiques de cytokératines sont établies. Il peut y en avoir jusqu'à 6 dans un même tissu. Là encore, la composition des cytokératines dépend de la localisation anatomique, de l'environnement dans lequel les cellules croissent, du stade de différenciation et de la période du développement embryonnaire (Tseng et coll., 1982). Ce qui laisse croire que la distribution des cytokératines n'est pas laissée au hasard. Il a été remarqué que les cytokératines de plus haut poids moléculaire se retrouvent, généralement, dans les cellules kératinisées tandis que les plus petites sont dans les cellules de type épithélial simple. De plus, certaines cytokératines sont spécifiques à un tissu et ne se retrouvent pas ailleurs.
Tel que mentionné précédemment, les cytokératines se divisent en 2 parties : les types I et II, i.e. les cytokératines acides et neutres/basiques, respectivement. L'identification des types I et II est basée sur la séquence de la région en hélice alpha. Il y a environ 30% d'homologie entre le type I et le type II et pour les membres d'un même type, 1 'homologie peut être de 50 à 99% (Glass et coll., 1985). Les protéines du type II sont en général de plus haut poids moléculaire que les cytokératines acides dû à une segment de plus dans un des domaines terminaux (Steinert et coll., 1985). D'ailleurs, la différence de charge entre les 2 types est due à une différence d'acides aminés basiques dans le segment 2B du domaine central (Steinert et coll., 1985), voir figure 1.
Jusqu'à maintenant, aucun rôle n'a été attribué spécifiquement aux cytokératines. Elles ont été classées comme étant des protéines structurales responsables du maintien de la forme de la cellule en étant un support
intracellulaire. Une autre hypothèse est qu'elles pourraient être nécessaires pour la locomotion de la cellule ou responsables du mouvement des particules cellulaires. Cependant, des études de microinjection d'anticorps semblent démontrer que ces fonctions seraient indépendantes du réseau de filaments intermédiaires (Traub, 1985). Mais, depuis quelques temps, 1'hypothèse qui prévaut est un rôle nucléaire pour ces protéines. En général, les filaments intermédiaires pourraient être vus comme étant une forme de transport et d'entreposage des molécules précurseurs des protéines liant les acides nucléiques et qui transmettraient 1'information de la membrane plasmique au noyau. Il est possible que ce soit les protéines des filaments intermédiaires qui seraient transformées en protéines liant les acides nucléiques (Traub, 1985).
Par la spécificité de la distribution des cytokératines, il est donc possible d'identifier le type d'épithélium. En second lieu, étant des protéines caractérisant les tissus épithéliaux, elles peuvent distinguer des cellules d'origine épithéliale de cellules d'une autre provenance. Ce qui rend plus intéressant l'aspect marqueur des cytokératines, c'est que la distribution de ces dernières demeure constante et stable pour un même tissu dans son état normal ou tumoral (Osborn et Weber, 1983). Dans quelques cas de métastases aux ganglions, il peut arriver que les cytokératines ne représentent pas nécessairement les cytokératines du tissu d'origine (Moll et coll., 1982). Dans les lignées cellulaires, le nombre de cytokératines est en général moindre que dans le tissu iri vivo. D'ailleurs il n'a été retrouvé, en caractérisant plusieurs types de cellules en culture que 11 des 19 cytokératines humaines (Traub, 1985; Franke et coll., 1983b). En résumé, au point de vue bio-histologique, les cytokératines constituent un marqueur très fiable de type et même de sous-type de tissus épithéliaux.
1.4 Aspect immunologique de l'étude
L'apport de 1'immunologie pour l'étude des filaments intermédiaires est assez important. La production d'anticorps polyclonaux contre plusieurs protéines a permis de connaître leur distribution et d'observer 1'interrelation entre elles. Cependant ce type d'outil s'avère avoir plusieurs désavantages. Sur une même protéine, il peut reconnaître plusieurs déterminants antigéniques différents d'où la possibilité qu'un de ces déterminants se retrouve aussi sur une autre protéine et soit aussi reconnu.
Dans ce sens, il s'agit d'une spécificité relative. De plus, il est parfois difficile de reproduire les même résultats à cause du nombre d'anticorps différents et de la variabilité des préparations. La quantité d'antisérum est aussi limitée.
En 1975, Kohler et Milstein ont, pour la première fois, produit des anticorps monoclonaux de spécificité prédéterminée. Cette nouvelle technique allait donner les avantages, en général sans les limitations des anticorps polyclonaux, i.e. augmenter la spécificité et la sélectivité de réactivité par un contenu homogène en anticorps et fournir une très bonne reproductibilité par une possibilité de produire des anticorps monoclonaux d'une façon illimitée. Cependant, il y a parfois arrêt de sécrétion des anticorps par un hybridome dû à une perte de chromosomes ou il peut être perdu à cause d'infections bactériennes (Coding, 1980). De plus, c'est une technique qui demande beaucoup de temps, mais les résultats obtenus, la spécificité et la pureté du produit, valent la peine d'y investir ce temps.
C'est cependant à partir d'anticorps polyclonaux produits contre les prékératines de l'épiderme bovin que Franke et coll. (1978) ont d'abord montré la présence de cytokératines dans les cellules épithéliales non-kératinisées. Les cytokératines étant assez immunogéniques, (Cooper et coll., 1985) plusieurs autres chercheurs, après la découverte de Franke, ont tenté et réussi à produire des anticorps monoclonaux contre différentes cytokératines (van Muijen et coll., 1984; Debus et coll., 1982; et 1984; Franke et coll., 1983a; Knight et coll., 1985; Broers et coll., 1985).
La spécificité de ces anticorps monoclonaux varie, selon l'épitope reconnu et 1'endroit où cet épitope est situé sur la protéine (domaine central ou terminal). Il y a des anticorps monoclonaux qui réagissent contre tous les filaments intermédiaires (épitope commun dans le domaine central) (Pruss et coll., 1981). Il est aussi possible de distinguer s'il s'agit d'une cytokératine acide ou basique (Nelson et Sun, 1983; Cooper et coll., 1985), en ayant un anticorps monoclonal réagissant contre un seul des types. Dans ce cas-ci, 1'anticorps reconnaît un épitope présent dans le domaine central ou terminal (région Hj pour le type II). Parmi les anticorps monoclonaux qui reconnaissent un déterminant antigénique d'un domaine terminal, il y en a qui sont spécifiques à une seule cytokératine (Debus et coll., 1982; et 1984; Broers et coll., 1985). Jusqu'à maintenant, aucun anticorps monoclonal ne réagit contre toutes les cytokératines et seulement
contre les cytokératines. Mais, serait-il possible d'en obtenir un puisque celui qui réagit avec plusieurs cytokératines (Pruss et coll., 1981) reconnaît aussi tous les filaments intermédiaires? Un anticorps monoclonal de cette envergure, qui réagirait avec toutes les cytokératines sans réagir avec les autres filaments intermédiaires, serait très utile pour différentes études biologiques, par exemple de différenciation cellulaire, et en pathologie, pour aider au diagnostic de métastases de tumeurs d'origine épithéliale.
1.5 Buts du travail
En possession de plusieurs anticorps qui réagissent avec les cellules épithéliales, une analyse préliminaire est faite pour déterminer lequel de ces anticorps semble le plus spécifique. Nous présentons ici les résultats de l'étude effectuée pour connaître le patron de réactivité de l'anticorps choisi, i.e. est-il spécifique aux cytokératines ou réagit-il contre d'autres protéines et combien de cytokératines reconnaît-il?
L'approche technique utilisée pour caractériser cet anticorps monoclonal est 1'immunohistochimie par immunofluorescence et immunoperoxydase: 1) sur des coupes de tissus épithéliaux et non-épithéliaux humains afin de déterminer la spécificité tissulaire et 2) sur des cellules en culture fixées et perméabilisées dans le but d ' observer le type et la distribution des filaments. L'immunodétection de type western après transfert des protéines sur membrane de nitrocellulose (Western blot) a aussi été utilisée pour connaître le poids moléculaire relatif des cytokératines que notre anticorps monoclonal, 1B6, reconnaît et pour apporter en même temps une preuve supplémentaire que 1'anticorps reconnaît bien des cytokératines.
La caractérisation de cet anticorps, sur les différentes lignées cellulaires et tissus humains, nous permet de démontrer sa spécificité pour les cytokératines puisqu'aucune réaction significative n'a été observée avec d'autres protéines.
2- MATERIEL ET METHODES
2.1 Cultures cellulaires
Le Dr Yves Eradet du Centre de Recherche de 1'Hôtel-Dieu de Québec nous a gracieusement fourni les lignées cellulaires établies suivantes : SW-1222 (adénocarcinome de côlon), RUPP II (adénocarcinome rénal), ROAC (carcinome ovarien), ME-180 (carcinome épidermoïde du col utérin), SW-780 (carcinome vésical bien différencié), T-24 (carcinome vésical peu différencié), J'O.N. (adénocarcinome vésical), SK-LC-6 (carcinome épidermoïde squameux du poumon), DU-145 (carcinome de la prostate), EPERON (mélanome) et U-251 (astrocytome). Le Dr Richard Gagné du C.H.U.L. de Québec nous a procuré les fibroblastes humains normaux. Les lignées MCF-7 (adénocarcinome mammaire), BT-20 (carcinome mammaire) et HBL-100 (cellules mammaires normales) proviennent de American Type Culture Collection (A.T.C.C.), Maryland. Sauf pour HBL-100, toutes les lignées sont cultivées dans le milieu Minimal Essential Medium de Eagle (MEM) (Gibco) auquel on ajoute 0.22% de NaHCO-j, 10% de sérum bovin foetal (Flow Laboratories), 1% d'une solution d'acides aminés non-essentiels (Flow Laboratories), 1% de pyruvate de sodium (11 mg/ml) (Flow Laboratories) et 1% d'antibiotiques pénicilline-streptomycine (5000 U.I./ml et 5000 g/ml) (Flow Laboratories). La lignée HBL-100 est gardée dans le milieu McCoy's 5A (Gibco) avec 1'addition des mêmes suppléments. Les cellules sont gardées dans une étuve à 5% COg. Les cellules sont décollées à la trypsine (0.75% de trypsine dans un tampon citrate de sodium, pH 7.8), 1 à 2 fois par semaine.
2.2 Provenance des tissus
Les tissus normaux proviennent d'autopsies effectuées à 1'Hôtel-Dieu de Québec, sauf les échantillons de sein normal provenant de réductions mammaires. Les tumeurs mammaires et les métastases aux ganglions sont des surplus d'échantillons utilisés à des fins d'essais clonogéniques. On les congèle immédiatement dans "O.C.T. Compound" (Lab-Tek Miles Scientific) dans l'azote liquide et elles sont rangées à -80°C jusqu'à utilisation. Des coupes de 6
jjp
d'épaisseur sont ensuite effectuées à l'aide d'un cryostat et sont gardées à -20°C 1 à 2 mois. Les coupes de tissus paraffinés ont été préparées au département de pathologie de 1'Hôtel-Dieu de Québec.2.3 Production d'anticorps monoclonaux
Sur une période de 3 mois, 3 immunisations intra-péritonéales ont été faites chez des souris BALB/c avec 1 x 10^ cellules de tumeurs primaires mammaires humaines dans de 11 adjuvant complet (Coding, 1980). Par la suite, 4 jours avant le prélèvement de la rate, une injection intra-péritonéale a été faite, mais cette fois-ci, dans de 11 adjuvant incomplet. Les cellules de la rate ont été fusionnées avec des cellules de myélome de souris SP2/0-AG14 en utilisant comme agent fusionnant du polyéthylène glycol (PEG). Le clonage a été fait dans des plaques de 96 puits et le dépistage des hybridomes positifs a été effectué par immunofluorescence sur des coupes de tumeurs mammaires (voir section 2.5). Les clones positifs furent amplifiés, transférés dans des plaques de 24 puits et par la suite, dans des boîtes de 25 cm^ et 75 cm^ (Falcon). Les plus intéressants furent sous-clonés, une partie a été congelée et l'autre fut gardée pour être injectée à des souris pour produire un ascite. Le liquide d'ascite est conservé à -80°C en aliquots et c'est avec ceux-ci que les différents tests ont été effectués. En plus des anticorps monoclonaux produits au laboratoire, des anticorps monoclonaux commerciaux: un anti-cytokératine #18, un anti-vimentine et un anti-desmine (Boehringer Mannheim) ont aussi été utilisés. Un anticorps monoclonal spécifique aux cellules épithéliales, M-8.4 (Foster et coll., 1982a; 1982b) et 2 anticorps monoclonaux provenant du laboratoire du Dr Normand Marceau, un anti-vimentine et un anti-cytokératine de 55 kD chez le rat ont aussi été utilisés.
2.4 Préparation pour l'immunohistologie 2.4.1 Lignées cellulaires
Différentes techniques ont été testées pour pouvoir utiliser celle qui endommage le moins les cellules et qui donne les meilleurs résultats.
Premièrement, les cellules sont mises en culture sur des lamelles de verre, pour une durée d'environ 48 h. Le type de fixation qui a
été
le plus satisfaisant est le suivant: les cellules sont fixées à l'aide de formaldéhyde 3.7% pour 30 min à la température de la pièce ensuite, perméabilisées à -20°C avec acétone:eau (1:1) pour 2 min, acétone 100% pour 5 min et acétone:eau (1:1) pour 2 min. La perméabilisation à l'acétone uniquement donne aussi de bons résultats. Cependant certaines lignées plus fragiles sont endommagées par cette méthode. Les autres méthodes essayéesavec le formaldéhyde 3.7% ou avec 11 acétone 100% ou combinée à l'eau, de même que la perméabilisation à l'éthanol 100% ou 70% à -20°C n'ont pas donné d'aussi bon rendement. On a aussi analysé des cellules non-fixées, qu'on fixe seulement après la réaction avec l'anticorps fluorescent, au formaldéhyde 3.7%, à la température de la pièce, 15 minutes.
2.4.2 Tissus congelés
La perméabilisation des tissus congelés se limite à 10 minutes à -20°C en présence d'acétone 100%.
2.4.3 Tissus paraffinés
Aucune étape précise de fixation n'est effectuée dû au traitement subi par les tissus pour être paraffinés. Cependant avant de faire réagir l'anticorps sur les tissus, il faut procéder à la déparaffination des coupes. Les lames sont trempées une fois dans un bain de toluène 100%, 2 fois dans l'éthanol 100% et 2 fois dans l'éthanol 95%, chaque incubation durant 5 minutes.
2.5 Microscopie d'immunofluorescence indirecte
Une fois les lames préparées, on utilise la même technique que ce soit avec les cellules en culture ou avec les coupes de tissus. Avant la réaction avec l'anticorps, on doit rincer les lames ou lamelles avec du tampon phosphate salin (PBS: NaCl 140 mM, KC1 3 mM, NagPO^ 7 mM, KHgPO^ ImM, CaClg 9mM, MgClg'éHgO 0.5 mM). L'anticorps (1B6) en ascite est utilisé à une dilution 1/200 dans le PBS et l'incubation est de 45 minutes à la température de la pièce (Naiem et coll., 1982 modifié). Les anticorps commerciaux sont utilisés à une concentration de 4
jjg/
ml. Après un ou deux lavages au PBS, on incube 45 minutes à la température de la pièce avec des anticorps de chèvre anti-immunoglobulines de souris marqués avec la fluorescéine isothiocyanate (20jjg/
ml). Les anticorps sont préalablement absorbés avec des Ig humains et ont un rapport F/P (moles de fluorescéine par mole de Ig) de 2.9 à 3.5. On lave de nouveau au PBS et on monte les lames avec un milieu à base de glycérol et de tampon glycine. Par la suite, on observe les cellules et coupes de tissus au microscope à épifluorescence, (Ortholux, Leitz) pourvu d'une caméra Leitz de type Photo automat Wild #MPS45.2.6 Immunoperoxydase
En plus de faire une coloration par immunofluorescence, on a aussi fait une coloration par immunoperoxydase sur différentes coupes de tissus. On utilise une technique avidine-biotine "ABC kit Vecta Stain" (Vector Laboratories). Après avoir fixé les tissus et avoir rincé au PBS, on bloque la peroxydase endogène avec une solution de peroxyde 0.6%, pendant 30 minutes. Cette étape est suivie d'un bain de PBS de 10 minutes. Une incubation de 20 minutes avec du sérum de cheval non-immun permet de bloquer les molécules fixant les anticorps de façon non-spécifique. L'excès de sérum est enlevé et 1'anticorps monoclonal est appliqué environ 45 minutes à la température de la pièce. Deux autres lavages sont faits: le premier avec du PBS-Tween 20 0.1% et le deuxième, avec du PBS seul. Pour augmenter le signal de détection, on ajoute 1'anti-Ig de souris couplé à la biotine pendant 30 minutes. Les mêmes lavages suivent et on fait une incubation de 30 minutes avec une solution d'avidine-peroxydase. Après les 2 bains au PBS, les coupes sont colorées avec une solution de tétrahydrochlorure de diaminobenzidine (DAB) 1 mg/ml dans du tampon T ris(Hydroxyméthylaminométhane (Tris) et HgOg 0.02% (1:1) pendant 5 à 10 minutes. Une contre-coloration peut être faite avec 1'hématoxyline de Mayer's (Sigma) 1 minute, puis les coupes sont rincées à l'eau et ensuite trempées pendant 30 secondes dans un bain d1 ammoniaque 1%. On monte les lames avec un milieu aqueux pour ensuite observer la coloration au microscope en lumière directe.
2.7 Enrichissement des filaments intermédiaires
Les filaments intermédiaires sont un groupe de protéines hautement insolubles. L'extraction des filaments de 10 millions de cellules fournit suffisamment de matériel pour 3 à 5 gels selon la lignée cellulaire. On rince 2 à 5 fois les cellules avec le tampon TNM (Tris 10 mM, NaCl 140 mM, MgClg'éHgO 5 mM, pH 7.6) (Franks et coll., 1981b). On incube 5 minutes avec du TNM contenant 1% de Triton X-100. On rince de nouveau, 2 fois au TNM et on incube une heure avec du TNM Triton X-100 0.5%, KOI 1.5% M. A chaque boîte, on ajoute 10
fjX
d'une solution de fluorure de phenylméthylsulfonyl (PMSF) (5 mg/ml), un inhibiteur de protéases. On lave au TNM et on gratte les boîtes. Ce qu'on recueille est ensuite centrifugé 20 minutes à 3500 g, 2 à 3 fois. Ce qu'on obtient à ce point est très enrichi en protéines cytoplasmiques insolubles. On ajoute au culot un maximum de 1 ml de tamponde solubilisation (Tris 62 mM, dodécyl sulfate de sodium (SDS)
2.5
%). On garde à -20°C pour une éventuelle utilisation. Pour chaque lignée, on a aussi un échantillon de protéines totales solubilisées dans le tampon de solubilisation. On détermine la quantité de protéines en effectuant un dosage par la méthode de Lowry.2.8 Dosage de protéines par la méthode de Lowry (Lowry et coll., 1951)
Le réactif de la méthode de Lowry se prépare à partir de 3 solutions: CuSO^'HgO 0.5% (0.5 ml), tartrate de sodium 1% (0.5 ml) et une solution de 2% de NagCO^, NaOH 0.1 N (25 ml). On ajoute 2 ml de cette solution à l'échantillon à tester. On doit avoir 200
jX
L d'échantillon qu'on complète avec le tampon de solubilisation, si nécessaire. On attend 10 minutes et on ajoute le réactif de Folin (solution de rouge de phénol (Fisher)), on attend 1 heure et on lit la densité optique à 630 nm. Avec une courbe standard utilisant de la BSA, on peut déterminer la quantité de protéines obtenues pour chaque échantillon. Ce test peut détecter jusqu'à 20jjg/
ml.2.9 Electrophorèse et immunodétection de'type western
On utilise un gel à une concentration de 10% de polyacrylamide (SDS-PAGE). Avant de déposer les échantillons dans les puits, on ajoute 10% de tampon de bromophénol-glycérol 30% et 5% de (î-mercaptoéthanol. Avant l'application sur le gel, les échantillons sont chauffés pendant 2 min. La quantité appliquée est d'environ 2 de protéines/bande de protéine/puits (environ 30
jjg
pour un échantillon de protéines totales). Le tampon d'électrode utilisé pour la migration des protéines est fait de Tris 25 mM, glycine 192 mM, SDS 3.5 mM, (Laemmli, 1970). Le temps de migration est d'environ 2 heures dont 1 heure à 20 mA et 1 heure à 40 mA, pour un gel de 1.5 mm d'épaisseur. Après la migration, on fait transférer les protéines du gel sur une membrane de nitrocellulose dans le tampon de transfert (NaHPO^ 25 mM, pH 6.5) pendant 3 heures à 1 A (Towbin et coll., 1979).Le papier de nitrocellulose est coloré au rouge Ponceau (solution de 0.2% de rouge Ponceau et de 3% de TCA ). On le découpe en bandes verticales et on le décolore à l'eau distillée et au PBS, puis on l'incube une nuit dans une solution de lait en poudre écrémé (5%) dans du PBS contenant aussi de 1'azide de sodium (0.1%). Après cette incubation, on lave les bandes pendant 1 heure avec le tampon PBS en le changeant au 15 min. L'incubation
avec chacun des anticorps se fait à la même dilution que lors de 11 immunohistochimie, mais dans du PBS-lait en poudre 1%. Pour chaque sachet, on met un volume de 2 ml. Ceci est suivi d'un lavage d'une heure (4 fois 15 minutes) au tampon PBS contenant 0.2% de Tween 20. Après ce lavage, les bandes sont incubées dans 2 ml d'une solution d'anticorps de chèvre anti-Ig de souris marqués à l'iode-125 diluée dans du PBS-lait en poudre 1% pour obtenir environ 1 x 10^ cpm/ml. L'incubation dure 3 heures, ensuite on lave 3 fois 15 minutes avec du PBS-Tween 20 0.2% et 15 minutes avec PBS seul. On expose à un film Kodak XAR-5 entre 16 et 40 heures.
2.10 Technique de marquage à l'iode-125 (Bolton, 1977)
Dans un premier temps, on monte une colonne de 1 x 50 cm avec du Séphadex 0-25 Coarse qui a été gonflé dans un tampon phosphate (NagHPO^ 0.05 M, NaHgiPO^ 0.05 M, pH 7.0). Ensuite, on prépare les réactifs qui sont la chloramine-T (5 mg/ml), le métabisulfite de sodium (2.4 mg/ml) et l'iodure de sodium (10 mg/ml). Ces réactifs sont dilués dans le tampon phosphate de façon extemporanée. La protéine pure qu'on utilise consiste en des anti-immunoglobulines de souris préparées chez la chèvre. On doit avoir
15fjig
de protéines dans 5 à 15fiL.
La quantité d'iode-125 utilisée est de 1 mCi dans 10 jj).
. Pour ioder la protéine, on mélange la protéine à environ 1 mg/ml (15 jwl), l'iode-125 (10fjfX)
et la chloramine-T (5^). Une incubation de 45 secondes est faite en agitant et l'arrêt de la réaction se produit lorsque le métabisulfite de sodium (25fiL)
et l'iodure de sodium (50 jj§.)
sont ajoutés.Juste avant de déposer la protéine iodée sur le gel, 3 ml d'albumine de sérum bovin (BSA) 1% sont passés sur le gel pour éviter l'absorption de la protéine sur la paroi. La protéine marquée est déposée sur le gel et l'élution se poursuit avec environ 75 ml de tampon phosphate 0.05 M, pH 7.0. Des fractions de 1 ml sont récoltées et de ces fractions, on prélève 20
jjl
qui sont comptés au compteur gamma. On trace la courbe d'élution et on recueille les fractions maximales du premier pic.2.11 Technique de précipitation au TCA
On prend une aliquote de 50
fi
L de la solution marquée et on ajoute 800fjD-
de BSA 1%. Ensuite, on ajoute 100fjd
d'une solution de TCA 100% (acide trichloroacétique). On laisse précipiter pendant environ 5 minutes et oncentrifuge à 1200 RPM pendant 10 minutes. Le surnageant est décanté et mis dans un autre tube. Une autre aliquote de 50 j^l est mise à compter au compteur gamma. On compte durant 6 secondes la radioactivité totale, la radioactivité spécifique et la radioactivité non-liée. On fait le pourcentage de la radioactivité totale qui se retrouve dans le culot pour connaître la qualité de 11 iodation.
2.12 RIA en phase solide (Tsu et Herzenberg, 1980)
Pour connaître la quantité d1 immunoglobulines présentes dans les ascites et le sérum de souris normale, on a décidé de faire un RIA (essai radioimmunologique) en phase solide. La première étape est de fixer 11 antigène (ici un anti-Ig de souris) dilué dans du PBS pH 7.2 dans des plaques de 96 puits de polyviinyle (100
py
/puits à une concentration de 1jA
g/ml). On incube à 4°C pour la nuit. On lave 3 fois avec une solution de NaCl 0.86% et de Tween 20 0.05%. Les sites sont saturés avec du PBS-BSA 3% pendant 15 à 30 minutes à la température de la pièce. On lave encore 3 fois avec la même solution. Ensuite, à différentes dilutions, les surnageants et ascites sont ajoutés, 50fl
1/puits. L'incubation dure toute la nuit à 4°C ou 3 à 4 heures à la température de la pièce. Avant d1 ajouter l'anticorps marqué à 1'iode-125 dilué dans le PBS (100000 cpm/ml), 3 autres lavages sont faits avec NaCl-Tween 20. On incube 1 heure à la température de la pièce et on lave 8 à 10 fois dans la solution NaCl-Tween 20. Ensuite, on découpe les puits et on compte au compteur gamma.2.13 Purification des immunoglobulines (Pharmacia, 1978)
La purification de l'anticorps en ascite se fait sur une colonne de protéine-A sépharose CL-4B. Le liquide d'ascite est centrifugé à 10000 RPM pendant 20 minutes. On dilue ensuite l'ascite dans du PBS (1:1). On précipite les protéines avec du (NH^^SO^ saturé à 100% pour obtenir une concentration finale de 50%. Il faut ajouter le sulfate d'ammonium goutte à goutte en agitant. Après une incubation d'une heure à 4°C, le mélange est centrifugé à 3000 RPM pendant 15 minutes. On doit, par la suite, resolubiliser le culot dans le plus petit volume de PBS possible. On dialyse, jusqu'au lendemain, contre du PBS. Pour préparer la colonne, on la rince avec le tampon phosphate 10 mM, pH 8.0. On dépose 11 anticorps dilué dans le tampon phosphate et on fait 10 lavages avec le tampon initial. Pour
une élution rapide, une solution d'acide acétique 0.58% (v/v), NaCl 0.15 M est utilisée sans ajustement du pH. On recueille les différentes fractions et on lit la densité optique à l'U.V. à 280 nm. Pour laver la colonne, on utilise l'acide acétique à pH 2.7, une solution de NaCl 0.5 M et NaPO^ 10 mM à bas pH et le tampon NaPO^ 10 mM, pH 8.0. On dialyse les fractions contenant les immunoglobulines contre un tampon phosphate jusqu'au lendemain et ensuite, on passe l'échantillon sur 1'ultrafiltration pour concentrer l'anticorps. Par la suite, la concentration est quantifiée à l'aide d'un Lowry.
FIGURE 2: Protocole expérimental général
Immunisation des souris
Fusion
Sélection des hybridomes par immunofluorescence Sous-clonage. Amplification. Congélation Congélation Caractérisation Immunohistochimie Coupes de tissus Cellules vivantes (lignées) Cellules vivantes Enrichissement des filaments intermédiaires Electrophorèse
Transfert sur nitrocellulose
Immunodétection de type Western
3- RESULTATS
Le protocole expérimental suivi pour cette étude est schématisé à la figure 2. Les anticorps monoclonaux ont été produits chez des souris immunisées avec des cellules extraites de tumeurs mammaires primaires humaines. Deux fusions ont été effectuées et plusieurs clones positifs ont été obtenus et ensuite sous-clonés. Après un dépistage préliminaire, 3 clones sont retenus, car ils semblent réagir avec les filaments intermédiaires. Les 3 anticorps monoclonaux sont caractérisés sur différentes lignées cellulaires humaines et différents tissus humains. Ils réagissent avec tous les tissus épithéliaux testés. Deux de ces anticorps, réagissant aussi contre d1 autres protéines ne seront pas de cette étude. La caractérisation est faite par immunohistochimie et par immunodétection après transfert sur membrane de nitrocellulose (type western). La composition en cytokératines variant selon le type d'épithélium, il s'est avéré nécessaire de vérifier le patron de réactivité de 1'anticorps monoclonal sur plusieurs tissus.
A- Immunohistochimie 3.1- Tissus
Les résultats des réactions immunohistochimiques faites avec 1'anticorps monoclonal, 1B6, sur les différents tissus sont regroupés au tableau 1.
3.1.1 Epithélium simple 3.1.1.1 Sein
Sur le sein normal, 1B6 ne réagit qu'avec les cellules épithéliales mammaires. Les cellules faisant partie des fibres de collagène ou les lipides ne sont pas reconnus par 1B6. Il reconnaît autant les cellules de l'épithélium simple des glandes mammaires que les cellules des grands canaux galactophores constituant l'épithélium cylindrique stratifié, figure 3.
3.1.1.2 Estomac
1B6 reconnaît les cellules épithéliales sécrétant le cellules caliciformes. Il reconnaît aussi les cellules gastriques. C'est le cytoplasme de ces cellules qui est coloré
mucus et les des glanâtes-,..
, figuryiW^--!:
TABLEAU 1: Immunohistochimie de 1B6 sur des ou déparaffinés
coupes de tissus congelés
Tissus Nombre positif
Intensité Commentaires à propos des cellules reconnues NORMAUX
Epithélium simple
Sein 2/2
i
iii
cellules épithélialesEstomac 3/3 ++++ mammaires cellules muqueuses et Foie 3/3 4-++ caliciformes, glandes gastriques hépatocytes
Pancréas 2/2
-H-+
cellules épithélialesRein 3/5 -4-4*+4*
des canaux excréteurs tubules et tubes
Epithélium transitionnel
Vessie 1/1 ++ cellules urothéliales
Uretère 2/3
-H-H-
cellules urothélialesEpithélium glandulaire
Poumon 2/2 +++ peu de cellules
Prostate 1/1 ++ + cellules glandulaires
Epithélium kératinisé
Peau 1/1
•H-H-
couches épidermiquesEpithélium germinal Testicules 1/1 +/-et glandes sudoripares cellules épithéliales Autres Endothélium 0/1 Myocarde 0/2 -TUMORAUX
Sein 13/13
-H-H-
cytoplasme desMétastases 4/4 +++
cellules mammaires cellules métastatiques aux ganglions
Rein 1/1 4+ cellules cancéreuses à
Muqueuse 1/1 +
cytoplasme clair, très périphérique
cellules glandulaires pyélique
Vessie 4/4 +—►+++ cellules urothéliales
FIGURE 3: Réaction d'immunofluorescence sur des coupes de tissus épithéliaux simples: le sein normal a et b et l'estomac c et d. L'anticorps monoclonal, 1B6 ne réagit qu'avec les cellules épithéliales dans les 2 tissus, a et c. b et d: contraste de phase. 312X.
3.1.1.3 Foie
Dans le foie, 1B6 reconnaît les hépatocytes. Il suit la travée d'hépatocytes en colorant leur cytoplasme. Il ne réagit pas avec les cellules sinusoïdales (endothéliales). Les globules rouges pouvant se retrouver dans les sinusoïdes sont aussi négatifs en présence de 1B6.
3.1.1.4 Pancréas
Dans le pancréas, 1B6 réagit contre un épitope présent dans le cytoplasme des cellules épithéliales des canaux excréteurs.
3.1.1.5 Rein
1B6 reconnaît différentes structures cellulaires du rein. Il reconnaît les cellules tapissant les tubules proximaux et distaux et les cellules des tubes collecteurs qui sont toutes de type épithélial. La réaction positive se trouve dans le cytoplasme de ces cellules mais pas dans leur noyau. Les glomérules d'origine non-épithéliale et la graisse présente sur certaines coupes ne sont pas reconnus par 1B6.
3.1.2 Epithélium transitionnel 3.1.2.1 Vessie
L'épithélium transitionnel de la vessie ressemble à celui de 1'uretère, mais il est plus épais et 1 ' étalement des cellules diffère selon que la vessie est vide ou distendue. Ce ne sont que ces couches de cellules que 1B6 reconnaît.
3.1.2.2 Uretère
Les cellules urothéliales bordant la lumière de 1'uretère sont positives avec 1B6. Il est possible de distinguer les cellules des différentes couches épithéliales. La réaction est négative avec le reste du tissu, figure 4. Un des échantillons s'est avéré négatif. Il faut cependant noter qu'au microscope on ne pouvait distinguer la forme de l'uretère (comme la figure 4). L'état du tissu, congelé depuis plusieurs mois, s'est peut-être détérioré masquant ou détruisant le site de liaison reconnu par 1B6.
FIGURE 4: Réaction d1immunoperoxydase sur un tissu d1 épithélium transitionnel : uretère normale a: en présence de 1B6, il y a une réaction positive avec les cellules épithéliales bordant la lumière de 11 uretère, b: avec un témoin négatif. 125X.
3.1.3 Epithélium glandulaire 3.1.3.1 Prostate
Le cytoplasme des cellules glandulaires qui forment la prostate est reconnu par 1B6.
3.1.3.2 Poumon
Dans une coupe de tissu pulmonaire, 186 ne réagit pas avec toutes les cellules. Il colore le cytoplasme des cellules regroupées en colonie.
3.1.4 Epithélium kératinisé 3.1.4.1 Peau
186 réagit avec les cellules épithéliales de la peau (les couches stratifiées) ainsi qu'avec les cellules qui se retrouvent à 1'intérieur du tissu et qui sont regroupées en îlots (glandes sudoripares). Le cytoplasme des cellules épithéliales est coloré, mais pas leur noyau. On peut remarquer que les cellules qui sont à la jonction du derme et de l'épiderme (la couche germinative) ont l'air plus colorées que celles dans la couche cornée. Mais, le derme n'est pas coloré ni les autres cellules n'appartenant pas aux couches épithéliales. En ce qui concerne les cellules des glandes sudoripares, c'est aussi le cytoplasme qui est reconnu, figure 3.
3.1.5 Epithélium germinal 3.1.5.1 Testicules
L'épithélium germinatif est un épithélium cubique stratifié modifié. Les tubes germinaux du testicule sont faits de cellules germinatives qui sont en fait, séparées par une matrice qui elle est faite de tissu conjonctif (fibres, fibroblastes, etc) (Leeson et Leeson, 1976). En présence de 1 ' anticorps monoclonal 186, une faible réaction a lieu et peu de cellules sont reconnues.
3.1.6 Tissus non-épithéliaux 3.1.6.1 Endothélium
186 ne reconnaît aucunement les cellules endothéliales. Même dans les tissus (épithéliaux, musculaires, etc) vascularisés, les vaisseaux sanguins ne sont pas reconnus par 186.
FIGURE 5: Réaction d1 immunofluorescence de 1B6 sur un épithélium kératinisé: la peau. Les différentes couches de 11 épiderme (a et b) autant que les glandes sudoripares (c) sont reconnues par 186. b: contraste de phase. 312X
3.1.6.2 Myocarde
Dans le myocarde, 186 ne reconnaît aucune cellule. On peut remarquer une certaine réactivité, mais elle est aussi observable avec des témoins négatifs (avec l'anticorps monoclonal M 8.4 ou en absence du premier anticorps).
3.1.7 Tissus tumoraux
Chacun des échantillons consiste en tumeurs extraites du tissu. La composition en cellules tumorales est d'au moins 75%. Les cellules normales sont en minorité. Les cellules tumorales sont plus facilement identifiables par leurs nombreux regroupements en colonies que les cellules normales. De plus, l'arrangement tissulaire du tissu normal est rarement retrouvé dans ces échantillons.
3.1.7.1 Sein
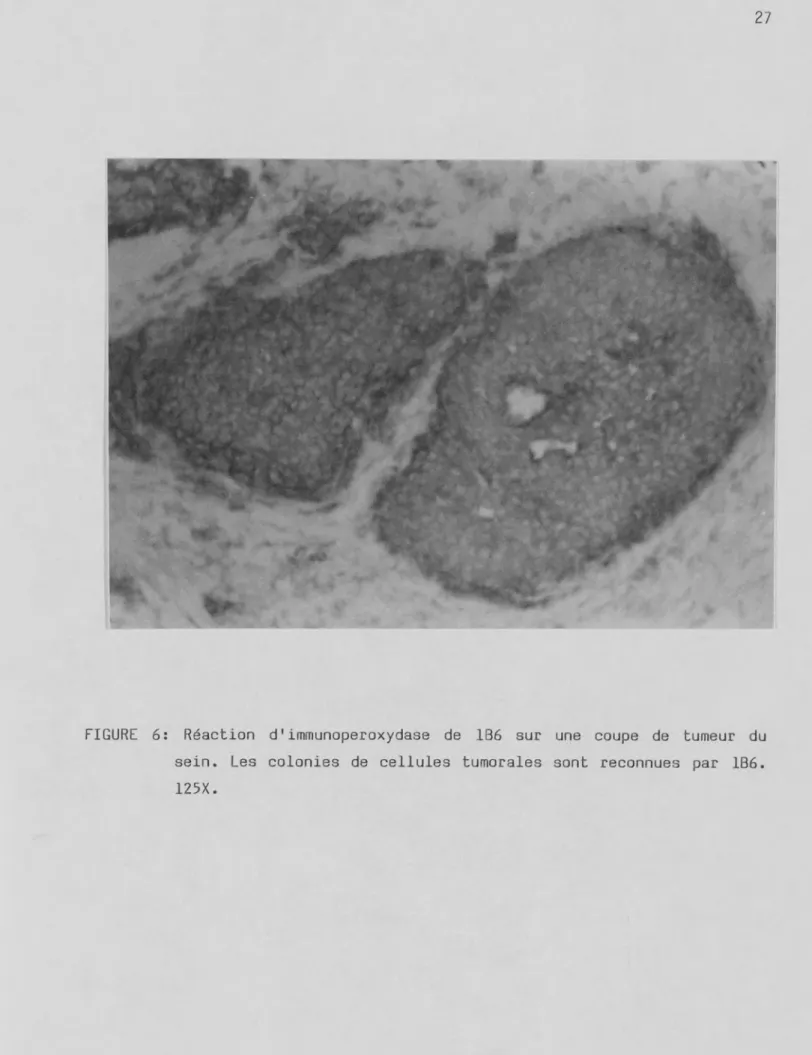
186, testé sur 13 échantillons de tumeurs primaires mammaires, reconnaît les cellules tumorales. Le cytoplasme de ces cellules est coloré, figure 6.
3.1.7.2 Métastases aux ganglions
Le patron de réactivité de 186 observé sur des coupes de métastases aux ganglions (4), montre une réactivité positive avec les cellules métastatiques uniquement. Les cellules lymphatiques sont négatives, figure 7.
3.1.7.3 Rein
186 reconnaît les cellules cancéreuses. Dans ces tumeurs, elles apparaissent avec un cytoplasme clair. La coloration est très périphérique.
3.1.7.4 Muqueuse pyélique
Le tissu étant congelé depuis quelques mois, son état a pu se détériorer abîmant ainsi les cellules. Ceci pourrait expliquer, en partie, la faible réaction de 186. Cette réaction est remarquée chez les cellules glandulaires en périphérie de leur cytoplasme.
FIGURE 6: Réaction d1immunoperoxydase de 1B6 sur une coupe de tumeur du sein. Les colonies de cellules tumorales sont reconnues par 1B6. 125X.
FIGURE 7: Réaction d1 immunofluorescence de 1B6 sur une coupe de métastases aux ganglions, a et b; c: contraste de phase. Il n'y a que les cellules métastatiques qui sont reconnues. 312X.
3.1.7.5 Vessie
Dans ce tissu, les cellules urothéliales tumorales sont reconnues par 1B6. On remarque une différence dans 11 intensité de coloration d'un échantillon à l'autre: de faible à forte. Mais, même dans l'échantillon où l'intensité est faible, elle est quand même plus forte que celles des tissus avoisinants non-épithéliaux.
3.2- Lignées cellulaires
Le patron de coloration est très semblable d'une lignée épithéliale à l'autre, en général. Il peut apparaître un peu différent dû à la morphologie cellulaire de chaque lignée: les cellules étant rondes ou allongées. Le tableau 2 regroupe les réactions de 186 sur les différentes lignées cellulaires.
3.2.1 Origine épithéliale simple
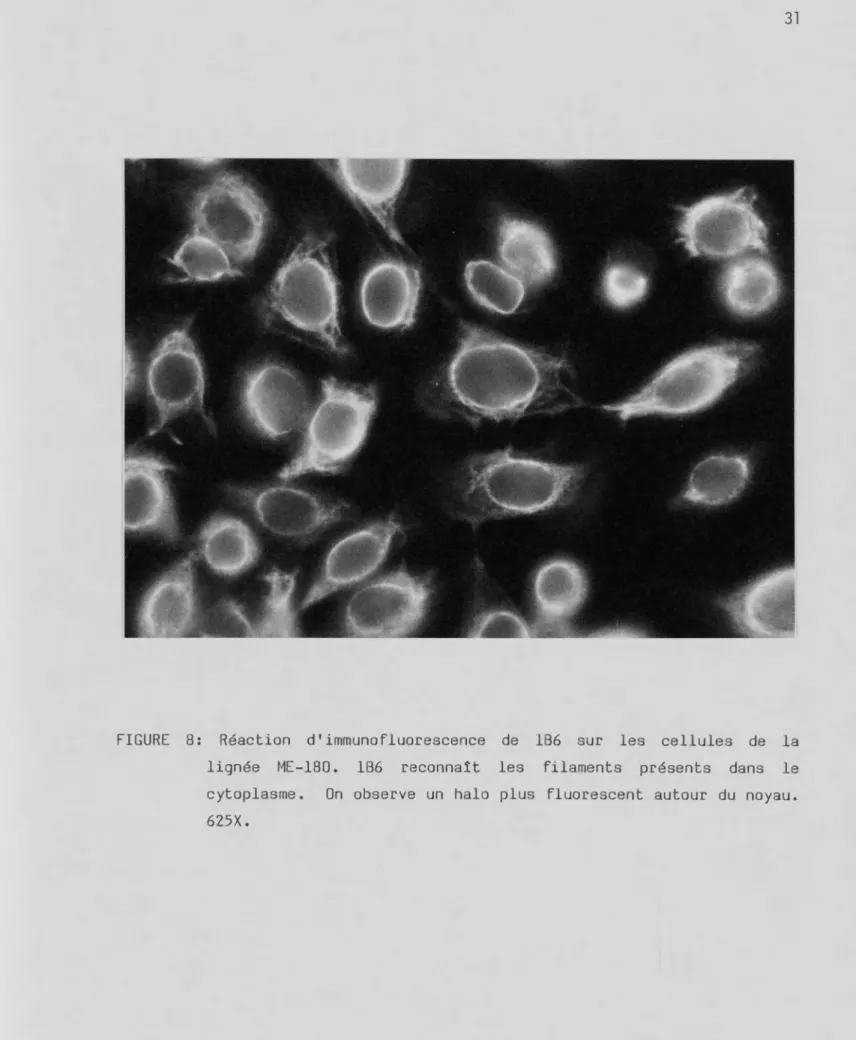
Avec les lignées suivantes, HBL-100, BT-20, SW-1222, et ME-180, 1B6 a un patron de réactivité qui s'équivaut. 1B6, par sa coloration, nous permet d'observer le réseau formé par les cytokératines et toutes les cellules sont positives. Avec toutes les lignées, l'intensité est très forte sauf avec la lignée HBL-100 où le patron de réactivité montre une plus grande concentration près du noyau. De plus, la petitesse des cellules de cette lignée rend difficile la visualisation des filaments. On peut observer aussi, que dans les cellules de la lignée ME-180, figure 8, il y a présence d'un halo plus fluorescent autour du noyau.
Les lignées MCF-7, figure 9, et ROAC ont une particularité par rapport aux autres lignées décrites précédemment ; en plus de voir très bien les réseaux de filaments dans la cellules, on remarque une différence dans 1'intensité de réactivité, d'une cellule à l'autre. Certaines sont presque négatives tandis que d'autres sont fortement colorées.
L'adénocarcinome rénal RUPP II a une patron de réaction différent. Il est possible de voir les réseaux de filaments, mais 1'intensité est faible. C'est surtout le noyau qui est reconnu.
TABLEAU 2: Immunofluorescence de 1B6 sur différentes lignées cellulaires humaines
Origine Nom Description Réactivité
Epithélium simple
Sein HBL-100 cellules normales
H-MCF-7 adénocarcinome +
--
*BT-20 carcinome
H-H-Côlon SW-1222 adénocarcinome
H-H-Rein RUPP II adénocarcinome
+/-Ovaire ROAC carcinome +
--
1Utérus ME-180 carcinome épidermoïde du col utérin
H-H-Epithélium transitionnel Vessie SW-780 T-24 carcinome bien différencié carcinome peu différencié J'O.N. adénocarcinome+ —►++++
exponentiel: +, pts, (- fil) confluent:-
h-
h-
certaines cellules (fil) -H-H-Epithélium glandulaire Poumon SK-LC-6 carcinome Prostate DU 145 carcinome Autres Tissu conjonctif Neuroectoderme EPERON U-251 fibroblastes normaux mélanome astrocytome+
H--- ►H-H
+/- (-fil)FIGURE 8: Réaction d1 immunofluorescence de 186 sur les cellules de la lignée ME-180. 186 reconnaît les filaments présents dans le cytoplasme. On observe un halo plus fluorescent autour du noyau. 625X.
FIGURE 9 : Réaction d1 immunofluorescence de 186 sur la lignée MCF-7. On observe une différence d'intensité, d'une cellule à l'autre. 625X.
FIGURE 10: Réaction d1 immunofluorescence sur la lignée SW-780. a: réaction avec 1B6, toutes les cellules sont positives, mais avec une différence d'intensité, b: coloration avec un anti-cytokératine #18, très peu de cellules sont positives colorés et c: réaction avec 1'anti-vimentine, aucune cellule n'est reconnue. 625X.
3.2.2 Origine épithéliale transitionnelle
Le patron de réactivité produit par 186 sur ces différentes lignées s'apparente beaucoup à celui produite chez les lignées d1 origine épithéliale simple. Chez SW-780, 186 réagit de la même façon qu'avec MCF-7, i.e. qu'une différence d'intensité existe entre les cellules, figure 10a. La réaction a aussi été faite avec les anticorps anti-vimentine et anti-cytokératine £18. Aucune cellule n'est reconnue en présence de 1'anti-vimentine (fig. 10c) et très peu le sont avec 1'anti-cytokératine £18. Mais, il est possible de voir les filaments de cytokératine avec ce dernier (fig. 10b). Quant à J'O.N., son patron de réactivité ressemble à celui des autres lignées où l'on observe les réseaux avec une intensité forte et stable, figure 11. La réaction d'immunofluorescence est effectuée à 2 stades de croissance pour la lignée T-24. Quand les cellules sont en phase exponentionnelle, la réaction n'est pas très intense et aucun filament n'est apparent. On observe plutôt, des points en périphérie des cellules (coloration granuleuse). Lorsque les cellules sont à confluence, une certaine variation d'intensité est apparente. On remarque même, certaines cellules à forte coloration qui ont des filaments dans leur cytoplasme, figure 12.
3.2.3 Origine épithéliale glandulaire
La réaction que produit 186 sur les 2 lignées qui représentent ce type d'épithélium est très différente. Sur la lignée 5K-LC-6, la coloration est faible et elle est par points dans le cytoplasme, près du noyau. Mais, on ne distingue aucunement les filaments, figure 13. Pour la lignée DU 143, de la prostate, le type de réactivité peut être regroupé avec les lignées telles que MCF-7 et SW-780 où il y a une variation dans l'intensité, d'une cellule à l'autre: de moyenne à très forte.
3.2.4 Autres origines
186 ne réagit pas du tout avec les fibroblastes humains normaux, figure 14. On a 2 lignées qui proviennent du neuroectoderme: EFFRON, un mélanome et U-251, un astrocytome. Avec le mélanome, aucun filament n'est observable en présence de 186, mais un certain bruit de fond est présent dans toutes les cellules. Pour la lignée U-251, une faible réaction est présente près du noyau de ces cellules. Dans les 2 cas, 1 'intensité n'est qu'un peu plus forte qu'avec un témoin négatif, figure 15.
FIGURE 11: Réaction d1 immunofluorescence de 186 sur la lignée épithélium transitionnel. Les filaments reconnus par voient très bien. 625X.
J'O.N., 186 se
FIGURE 12: Réaction d'immunofluorescence sur la lignée transitionnelle 1-24 en présence de 186. a: cellules en phase exponentielle, aucun filament n'est apparent. Le patron de réactivité est plutôt par points à la périphérie de la cellule, b: cellules à confluence, il est possible de voir dans plusieurs cellules les filaments de cytokératines avec une forte intensité. 625X.
FIGURE 13: Réaction d1 immunofluorescence sur la lignée SK-LC-6 a: en présence de 186, b: en présence d'un anti-vimentine. On remarque qu'il n'y a pas de filaments dans les cellules en présence de 186. Les résultats sont les mêmes lorsque les cellules sont à confluence. 625X.
FIGURE 14: Réaction d'immunofluorescence de 186 sur des fibroblastes normaux humains. 186 ne réagit pas avec ce type de cellules. 625X.
FIGURE 15: Réaction d1 immunofluorescence sur les lignées en provenance du neuroectoderme: EFFRON, le mélanome (a et b) et U-251, 11 astrocytome (c et d). En a et c la réaction a été faite avec 186 et en b et d avec 11 anti-vimentine . On remarque que les filaments ne sont pas reconnus par 186 chez les cellules de ces 2 lignées. 625X.
B- Immunodétection de type western
Nous avons utilisé des lignées épithéliales pour connaître contre quelles cytokératines notre anticorps réagit et quelques lignées non-épithéliales pour connaître sa spécificité. Pour chacune d'elles, il y avait un échantillon de protéines insolubles au Triton X-100 et un échantillon de protéines totales.
3.3. Lignées non-épithéliales
Avec les lignées non-épithéliales d'un mélanome, EFFRON, (figure 16) et les fibroblastes humains normaux, aucune bande de protéine n'est reconnue par 1'anticorps monoclonal, 1B6, figure 17. Une faible bande sur la lignée U-251 (astrocytome) un peu en-dessous de 66 kd dans l'échantillon de protéines insolubles au Triton X-100 est aussi présente avec un témoin négatif, un autre anticorps monoclonal, de la même classe, mais spécifique à une protéine de 35 kD chez le rat; elle est donc probablement un artéfact.
3.4. Lignées épithéliales
D'après les immunodétections faites sur les lignées épithéliales, 1B6 réagit avec au moins 5 cytokératines. Il n'y a qu'une seule des lignées utilisées dont la composition en cytokératines est décrite (Moll et coll., 1982). Les MCF-7 ont 3 cytokératines: 40, 45 et 52 kD. Par immunodétection, on remarque que 1B6 reconnaît les 3 cytokératines: #8, 18 et 19 selon la nomenclature donnée par Moll et coll. (1982), figure 18.
Dans le cas de la lignée ME-180 (carcinome épidermoïde du col utérin), 1B6 réagit avec des cytokératines dont le poids moléculaire relatif est de 52.5 et 48 kD (# et 16),figure 19.
Dans un échantillon de protéines totales de peau humain, on détecte une bande à 65-67 kD et une à 56 kD. 1B6 ne réagit qu'avec celle de 56 kD, figure 20.
L'immunodétection a été fait sur d'autres lignées épithéliales. Il semble que 186 reconnaisse d'autres cytokératines, car il est possible d'observer des bandes à 50 kD (DU 145) et 54 ou 56 KD (ROAC), entre autres, en sa présence. La composition complète en cytokératines de ces lignées n'est pas connue, mais il est certain qu'il y a au moins 2 cytokératines dans chacune des lignées puisqu'il est nécessaire d'avoir au moins une paire de cytokératines pour former les fibres de filaments intermédiaires. Donc,
FIGURE 16: Immunodetection de type western sur la lignée EFFRON. Les protéines des filaments sont enrichies au Triton X-100. 1B6 ne reconnaît aucune protéine. a: Bleu de Coomassie, b: autoradiographie. (s: protéines standards ; e : échantillon enrichi ; t: protéines totales de l'échantillon.)
FIGURE 17: Immunodétection de type western sur les fibroblastes humains normaux. Aucune bande n'est détectée par 186. a: Bleu de Coomassie, b: autoradiographie, (s: protéines standards; e: échantillon enrichi; t: protéines totales de l'échantillon. )
FIGURE 18: Immunodétection de type western sur les protéines de filaments intermédiaires enrichies par le Triton X-100 et les protéines totales de la lignée MCF-7. a: gel SDS-PAGE, bleu de Coomassie; b: transfert sur nitrocellulose, coloration au rouge Ponceau; c: autoradiographie. 1B6 reconnaît les 3 protéines correspondant aux cytokératines. (s: protéines standards ; e: échantillon enrichi ; t: protéines totales de l'échantillon.)
A B
SET E
FIGURE 19: Immunodétection de type western sur les protéines des filaments intermédiaires enrichies par le Triton X-100 et sur des protéines totales de la lignée ME-180. 186 réagit avec 2 des 4 bandes présentes dans le puits contenant les protéines insolubles au Triton X-100. Ces bandes ont un poids moléculaire de 48 et 52.5 kD. Celles avec lesquelles il ne réagit pas correspondent à la vimentine (58 kD) et à l'actine (43 kD). a: Bleu de coomassie, b: autoradiographie. (s: protéines standards; e: échantillon enrichi ; t: protéines totales de l'échantillon.)
FIGURE 20: Immunodétection de type western avec un échantillon de protéines totales de peau humaine. Deux bandes sont présentes dans cet échantillon (65 et 56.5 kD) et 186 ne réagit qu'avec celle de 56.5 kD. a: Bleu de Coomassie, b: autoradiographie. (s: protéines standards; e: échantillon enrichi ; t: protéines totales de 11 échantillon.)
si dans les cellules DU-145 la cytokératine de 50 kD est présente, il y a probablement celle de 58 kD aussi. Chez la lignée ROAC, en plus de la 54 kD,il y aura la 46 kD. De plus, il peut y avoir les cytokératines susceptibles d'être dans les cellules d'origine épithéliale simple pour la lignée ROAC et celles présentes chez les cellules d'origine épithéliale squameuse pour la lignée DU-145. La réaction n'a pas été faite avec la lignée SW-780, mais en comparant la réaction d'immunofluorescence de 1B6 et de l'anti-cytokératine #18 (fig. 10) sur cette lignée, il est fort probable que 1B6 reconnaisse plus d'une cytokératine (#18). D'ailleurs, la reconnaissance de cette cytokératine a été constatée par immunodétection de type western sur la lignée MCF-7.