Université de Lille
Année Universitaire 2019/2020
Faculté de Pharmacie de Lille
MÉMOIRE
POUR LE DIPLÔME D'ÉTUDES SPÉCIALISÉES
DE BIOLOGIE MÉDICALE
Soutenu publiquement le 04 octobre 2019
Par M
lleLaëtitia ANQUETIL
conformément aux dispositions réglementaires en vigueur
tient lieu de
THÈSE EN
VUE DU DIPLÔME D’ÉTAT DE DOCTEUR EN PHARMACIE
_____________________________
CARACTÉRISATION DE LA PERTE DE L’HAPLOTYPE HLA
SPÉCIFIQUE DU RECEVEUR
EN RECHUTE APRÈS ALLOGREFFE HAPLO-IDENTIQUE
_____________________________
Membres du jury :
Président : Madame le Professeur Annabelle DUPONT (CHU de Lille)
Assesseurs : Madame le Professeur Myriam LABALETTE (CHU de Lille)
Madame le Docteur Dominique BORIES (APHP, Créteil) Madame le Docteur Micha SROUR (CHU de Lille)
1
Université de Lille
Année Universitaire 2019/2020
Faculté de Pharmacie de Lille
MÉMOIRE
POUR LE DIPLÔME D'ÉTUDES SPÉCIALISÉES
DE BIOLOGIE MÉDICALE
Soutenu publiquement le 04 octobre 2019
Par M
lleLaëtitia ANQUETIL
conformément aux dispositions réglementaires en vigueur
tient lieu de
THÈSE EN
VUE DU DIPLÔME D’ÉTAT DE DOCTEUR EN PHARMACIE
_____________________________
CARACTÉRISATION DE LA PERTE DE L’HAPLOTYPE HLA
SPÉCIFIQUE DU RECEVEUR
EN RECHUTE APRÈS ALLOGREFFE HAPLO-IDENTIQUE
_____________________________
Membres du jury :
Président : Madame le Professeur Annabelle DUPONT (CHU de Lille)
Assesseurs : Madame le Professeur Myriam LABALETTE (CHU de Lille)
Madame le Docteur Dominique BORIES (APHP, Créteil) Madame le Docteur Micha SROUR (CHU de Lille)
2
Université de Lille
Président : Jean-Christophe CAMART
Premier Vice-président : Damien CUNY
Vice-présidente Formation : Lynne FRANJIÉ Vice-président Recherche : Lionel MONTAGNE Vice-président Relations Internationales : François-Olivier SEYS
Directeur Général des Services : Pierre-Marie ROBERT Directrice Générale des Services Adjointe : Marie-Dominique SAVINA
Faculté de Pharmacie
Doyen : Bertrand DÉCAUDIN
Vice-Doyen et Assesseur à la Recherche : Patricia MELNYK Assesseur aux Relations Internationales : : Philippe CHAVATTE Assesseur à la Vie de la Faculté et aux
Relations avec le Monde Professionnel : Thomas MORGENROTH Assesseur à la Pédagogie : Benjamin BERTIN
Assesseur à la Scolarité : Christophe BOCHU
Responsable des Services : Cyrille PORTA
Liste des Professeurs des Universités - Praticiens Hospitaliers
Civ. NOM Prénom Laboratoire
Mme ALLORGE Delphine Toxicologie
M. BROUSSEAU Thierry Biochimie
M. DÉCAUDIN Bertrand Pharmacie Galénique
M. DEPREUX Patrick ICPAL
M. DINE Thierry Pharmacie clinique
Mme DUPONT-PRADO Annabelle Hématologie
M. GRESSIER Bernard Pharmacologie
M. LUYCKX Michel Pharmacie clinique
M. ODOU Pascal Pharmacie Galénique
M. STAELS Bart Biologie Cellulaire
Faculté de Pharmacie
de Lille
3, rue du Professeur Laguesse - B.P. 83 - 59006 LILLE CEDEX 03.20.96.40.40 - : 03.20.96.43.64
3
Liste des Professeurs des Universités
Civ. NOM Prénom Laboratoire
M. ALIOUAT El Moukhtar Parasitologie
Mme AZAROUAL Nathalie Physique
M. BERTHELOT Pascal Onco et Neurochimie
M. CAZIN Jean-Louis Pharmacologie – Pharmacie clinique
M. CHAVATTE Philippe ICPAL
M. COURTECUISSE Régis Sciences végétales et fongiques
M. CUNY Damien Sciences végétales et fongiques
Mme DELBAERE Stéphanie Physique
M. DEPREZ Benoît Lab. de Médicaments et Molécules
Mme DEPREZ Rebecca Lab. de Médicaments et Molécules
M. DUPONT Frédéric Sciences végétales et fongiques
M. DURIEZ Patrick Physiologie
M. FOLIGNE Benoît Bactériologie
M. GARÇON Guillaume Toxicologie
Mme GAYOT Anne Pharmacotechnie Industrielle
M. GOOSSENS Jean François Chimie Analytique
M. HENNEBELLE Thierry Pharmacognosie
M. LEMDANI Mohamed Biomathématiques
Mme LESTAVEL Sophie Biologie Cellulaire
M. LUC Gerald Physiologie
Mme MELNYK Patricia Onco et Neurochimie
M. MILLET Régis ICPAL
Mme MUHR – TAILLEUX Anne Biochimie
Mme PAUMELLE-LESTRELIN Réjane Biologie Cellulaire
Mme PERROY Anne Catherine Législation
Mme ROMOND Marie Bénédicte Bactériologie
Mme SAHPAZ Sevser Pharmacognosie
M. SERGHERAERT Eric Législation
Mme SIEPMANN Florence Pharmacotechnie Industrielle
M. SIEPMANN Juergen Pharmacotechnie Industrielle
M. WILLAND Nicolas Lab. de Médicaments et Molécules
Liste des Maîtres de Conférences - Praticiens Hospitaliers
Civ. NOM Prénom Laboratoire
Mme BALDUYCK Malika Biochimie
Mme GARAT Anne Toxicologie
Mme GOFFARD Anne Bactériologie
M. LANNOY Damien Pharmacie Galénique
Mme ODOU Marie Françoise Bactériologie
4
Liste des Maîtres de Conférences
Civ. NOM Prénom Laboratoire
Mme ALIOUAT Cécile Marie Parasitologie
M. ANTHERIEU Sébastien Toxicologie
Mme AUMERCIER Pierrette Biochimie
Mme BANTUBUNGI Kadiombo Biologie cellulaire
Mme BARTHELEMY Christine Pharmacie Galénique
Mme BEHRA Josette Bactériologie
M BELARBI Karim Pharmacologie
M. BERTHET Jérôme Physique
M. BERTIN Benjamin Immunologie
M. BLANCHEMAIN Nicolas Pharmacotechnie industrielle
M. BOCHU Christophe Physique
M. BORDAGE Simon Pharmacognosie
M. BOSC Damien Lab. de Médicaments et Molécules
M. BRIAND Olivier Biochimie
M. CARNOY Christophe Immunologie
Mme CARON Sandrine Biologie cellulaire
Mme CHABÉ Magali Parasitologie
Mme CHARTON Julie Lab. de Médicaments et Molécules
M CHEVALIER Dany Toxicologie
M. COCHELARD Dominique Biomathématiques
Mme DANEL Cécile Chimie Analytique
Mme DEMANCHE Christine Parasitologie
Mme DEMARQUILLY Catherine Biomathématiques
M. DHIFLI Wajdi Biomathématiques
Mme DUMONT Julie Biologie cellulaire
Mme DUTOUT-AGOURIDAS Laurence Onco et Neurochimie
M. EL BAKALI Jamal Onco et Neurochimie
M. FARCE Amaury ICPAL
Mme FLIPO Marion Lab. de Médicaments et Molécules
Mme FOULON Catherine Chimie Analytique
M. FURMAN Christophe ICPAL
Mme GENAY Stéphanie Pharmacie Galénique
M. GERVOIS Philippe Biochimie
Mme GOOSSENS Laurence ICPAL
Mme GRAVE Béatrice Toxicologie
Mme GROSS Barbara Biochimie
M. HAMONIER Julien Biomathématiques
Mme HAMOUDI Chérifa Mounira Pharmacotechnie industrielle Mme HANNOTHIAUX Marie-Hélène Toxicologie
Mme HELLEBOID Audrey Physiologie
M. HERMANN Emmanuel Immunologie
M. KAMBIA Kpakpaga Nicolas Pharmacologie
M. KARROUT Youness Pharmacotechnie Industrielle
Mme LALLOYER Fanny Biochimie
M. LEBEGUE Nicolas Onco et Neurochimie
Mme LECOEUR Marie Chimie Analytique
Mme LEHMANN Hélène Législation
Mme LELEU-CHAVAIN Natascha ICPAL
Mme LIPKA Emmanuelle Chimie Analytique
Mme MARTIN Françoise Physiologie
M. MOREAU Pierre Arthur Sciences végétales et fongiques
M. MORGENROTH Thomas Législation
Mme MUSCHERT Susanne Pharmacotechnie industrielle
5
Mme PINÇON Claire Biomathématiques
M. PIVA Frank Biochimie
Mme PLATEL Anne Toxicologie
M. POURCET Benoît Biochimie
M. RAVAUX Pierre Biomathématiques
Mme RAVEZ Séverine Onco et Neurochimie
Mme RIVIERE Céline Pharmacognosie
Mme ROGER Nadine Immunologie
M. ROUMY Vincent Pharmacognosie
Mme SEBTI Yasmine Biochimie
Mme SINGER Elisabeth Bactériologie
Mme STANDAERT Annie Parasitologie
M. TAGZIRT Madjid Hématologie
M. VILLEMAGNE Baptiste Lab. de Médicaments et Molécules
M. WELTI Stéphane Sciences végétales et fongiques
M. YOUS Saïd Onco et Neurochimie
M. ZITOUNI Djamel Biomathématiques
Professeurs Certifiés
Civ. NOM Prénom Laboratoire
M. HUGES Dominique Anglais
Mlle FAUQUANT Soline Anglais
M. OSTYN Gaël Anglais
Professeur Associé - mi-temps
Civ. NOM Prénom Laboratoire
M. DAO PHAN Hai Pascal Lab. Médicaments et Molécules
M. DHANANI Alban Droit et Economie Pharmaceutique
Maîtres de Conférences ASSOCIES - mi-temps
Civ. NOM Prénom Laboratoire
M. BRICOTEAU Didier Biomathématiques
Mme CUCCHI Malgorzata Biomathématiques
M. FRIMAT Bruno Pharmacie Clinique
M. GILLOT François Droit et Economie pharmaceutique
M. MASCAUT Daniel Pharmacie Clinique
M. ZANETTI Sébastien Biomathématiques
M. BRICOTEAU Didier Biomathématiques
AHU
Civ. NOM Prénom Laboratoire
Mme DEMARET Julie Immunologie
Mme HENRY Héloïse Biopharmacie
REMERCIEMENTS
7
À mon président de thèse,Madame le Professeur Annabelle DUPONT,
Merci d’avoir accepté et de me faire l’honneur de présider ce jury de thèse. Merci pour votre investissement, votre gentillesse et votre disponibilité.
Ce fut un réel plaisir de travailler avec vous.
À mes assesseurs,
Madame le Professeur Myriam LABALETTE,
Je tiens tout d’abord à vous remercier de m’avoir permis de réaliser mon travail de thèse au sein de votre laboratoire. Merci pour votre disponibilité et votre soutien. J’admire votre implication, votre rigueur et votre pédagogie. Je suis honorée de soutenir ce travail de thèse
devant vous.
Madame le Docteur Dominique BORIES,
Je vous remercie d’avoir accepté sans hésitation de faire partie du jury de cette thèse. Merci pour votre intérêt et pour votre expérience qui permettra d’enrichir ce travail.
Madame le Docteur Micha SROUR,
Merci d’avoir accepté avec enthousiasme de venir juger mon travail de thèse. Votre collaboration et votre expérience sont essentielles à ce travail mais aussi à notre métier.
À mon directeur de thèse,
Madame le Docteur Pauline VARLET,
Merci de m’avoir fait confiance et de m’avoir proposée ce sujet de thèse passionnant. Merci de m’avoir aussi bien encadrée, d’avoir été disponible et bienveillante quand il le fallait. J’ai
beaucoup appris de tes connaissances, de ton enthousiasme et de ton dynamisme. Je n’aurai pas pu rêver mieux que toi pour encadrer ma thèse. J’espère avoir l’occasion de
REMERCIEMENTS
8
Tout d’abord je tiens à remercier l’ensemble du laboratoire d’Immunologie, pour votre bonne humeur, votre gentillesse et votre accueil qui ont rendu mes stages encore meilleurs, À l’équipe du cellulaire, Virginie, Véro L., Véro B., Marie-Thérèse, les deux Coralie, Jacques,
vous êtes une équipe géniale,
avec laquelle j’ai toujours grand plaisir de travailler et de discuter.
À l’équipe de l’humorale, Manue, Sandrine, merci encore pour le projet que j’ai réalisé avec toi lors de mon premier semestre, Laure, Justine, Hélène, Isabelle, Elisabeth...
Merci pour votre gentillesse.
À l’équipe du HLA, que j’ai appris à connaitre au cours de ce travail de thèse et ce semestre, Cécile, Céline, Ève-Marie, Juliette, Tiffanie, Dominique, Antoine, Cédric, Vincent, Pascale G, un grand merci aux techniciens du NGS et merci à toi, Pascale C., pour le temps précieux
que tu as pris pour les manips et pour m’encadrer.
À l’ensemble des biologistes d’immunologie, pour leur pédagogie et leur encadrement durant ces deux semestres, Benjamin, Stéphanie, Anne-Sophie, Sylvain, Guillaume.
À Rébecca, merci pour tes précieux conseils, tes encouragements, et ta bienveillance, je suis heureuse d’avoir pu travailler avec toi et même danser !
À Isabelle, qui m’a fait découvrir l’univers du HLA avec beaucoup de gentillesse et de patience, c’est un plaisir de travailler avec toi.
À Vincent, merci pour ta pédagogie, que ce soit en humorale et aujourd’hui au HLA ou durant mon travail de thèse, qui me donne envie de continuer dans ce domaine, je te
remercie pour les premières corrections soignées et attentionnées de cette thèse. Aux secrétaires du laboratoire avec qui j’ai toujours plaisir de discuter.
Merci à mes co-internes actuels, Caroline, Geoffrey et Mathieu, qui m’ont permis de travailler sur ma thèse lorsque j’en avais besoin.
Je tiens à remercier l’ensemble de l’équipe de l’EFS : Christine, Gauthier, Odile, Pascale ainsi que tous les techniciens et cadres, qui m’ont soutenue une partie durant ce travail de thèse. Merci pour votre accueil, votre bonne humeur au quotidien, j’ai passé un super stage
REMERCIEMENTS
9
Merci également à tous les biologistes et techniciens que j’ai eu la chance de rencontrer durant mon internat : Sylvie, Patrice, Catherine, Amel, Jean-Michel, Delphine, Bodalé,
Thomas, Emmanuelle, Christophe, Michel…
À tous les co-internes que j’ai appris à connaitre au cours des semestres et des soirées, Maximilien, Adé, Caroline, Félix, Pauline, Lucie, Belka, Romane, Camille, Sarah, …
À ma scolarité, qui m’a permis de rencontrer mes meilleures amies, À ma Souille, qui est là depuis quasiment le début,
Merci d’être là, d’être toi, de m’écouter sans jugement, et de m’apprendre la géographie, À notre belle amitié, pour notre passé et notre avenir,
Et surtout, un grand merci pour ta belle collaboration sur cette thèse…, À ma Flo, au destin qui fait bien les choses, ou les paillettes,
Merci d’être une amie dévouée et attentionnée sur laquelle je peux compter, pour tout ce qu’on a partagé et qu’on partagera encore, JTMPQMPV,
À ma Élea, qui permet de finir les LEEF,
À tes belles bouclettes, parce que tu me fais toujours rire et que je suis née un 14 juillet, À ma Bichette, à notre rencontre au premier rang de la petite salle,
À notre complicité, à nos fous rires, merci pour ton écoute et ton soutien sans faille, tu es ma petite bulle de bonheur et de réconfort,
et parce que tu me manques dans ma vie de tous les jours, À ma Clémence, à notre première route ensemble,
Une amie unique et exceptionnelle, j’ai beaucoup de chance de t’avoir à mes côtés, merci pour ton grand cœur, tu me complètes et me rends meilleure,
et merci pour avoir relu avec enthousiasme et bienveillance mon travail, À ma Juju, ma co-interne adorée (petite tape sur l’épaule),
Merci pour tous ces semestres partagés avec toi, tu es aussi belle que touchante, merci pour avoir été mon modèle, pour ne pas m’avoir écoutée, à notre complicité qui est née, et qui
REMERCIEMENTS
10
À ma belle Julie, tu es une belle personne, touchante et généreuse,
Un grand MERCI pour ton soutien tout le long de cette thèse, de la rédaction des invitations aux relectures attentionnées, jusqu’à l’impression, tu es mon petit ange,
et je te souhaite tout le bonheur que tu mérites tant ! Aux petits potes et aux Normands à Lille,
À Nicole et Marc,
Merci d’être là aujourd’hui, et pour votre bienveillance,
À ma tante, et Stéphane,
Merci d’être présents et de m’avoir toujours soutenue, je vous en suis reconnaissante,
À mes parents,
Je suis heureuse de vous rendre fiers, parce que vous le méritez et que je vous aime,
À ma sœur, mon bouboune, ma nini,
Je suis tellement fière de toi, à notre belle complicité, à ta future vie de maman, et parce que je t’aime de tout mon cœur,
À Pierre,
Merci de m’apporter tout ce bonheur, merci de m’aimer comme tu le fais, à notre avenir…
À toi mamie,
Les mots ne suffiront pas pour te dire combien je te remercie, merci pour tout l’amour que tu m’as apportée, je te dois tout ce que je suis aujourd’hui, de là où tu es,
SOMMAIRE
11
I.
INTRODUCTION ... 17
A. Allogreffe de cellules souches hématopoïétiques ... 17
1. Généralités et actualités ...17
2. Alloréactivités antigéniques ...19
a. Effets immunologiques de l’allogreffe de CSH ...19
b. Compatibilité HLA ...21
B. Greffe haplo-identique ... 26
C. Rechute post-allogreffe ... 33
1. Facteurs prédictifs de la rechute post-allogreffe ...33
2. Suivi post-allogreffe ...34
3. Mécanisme d’échappement immunitaire ...36
a. Après allogreffe de CSH...36
b. Le cas de la perte HLA après greffe haplo-identique ...37
4. Conséquences dans la prise en charge de la rechute ...40
II.
OBJECTIFS DE L’ÉTUDE ... 43
III. MATÉRIEL ET MÉTHODES ... 45
A. Population étudiée ... 45
1. Critères d’inclusion ...45
2. Critères d'exclusion ...45
3. Échantillons d’intérêt ...45
B. Techniques analytiques de la perte HLA ... 46
1. PCR quantitative en temps réel (qPCR) ...46
a. Choix des marqueurs spécifiques des receveurs ...46
i. Marqueur HLA ...46
ii. Marqueur non-HLA ...47
b. Principe de la technique ...48
c. Protocole analytique ...49
d. Interprétation des résultats ...50
e. Limites ...50
2. Séquençage de nouvelle génération (NGS) ...51
a. Principe de la technique ...51
SOMMAIRE
12
C.
Stratégie globale d’analyse de la perte HLA ... 54
D. Analyse des résultats ... 54
IV. RÉSULTATS ... 55
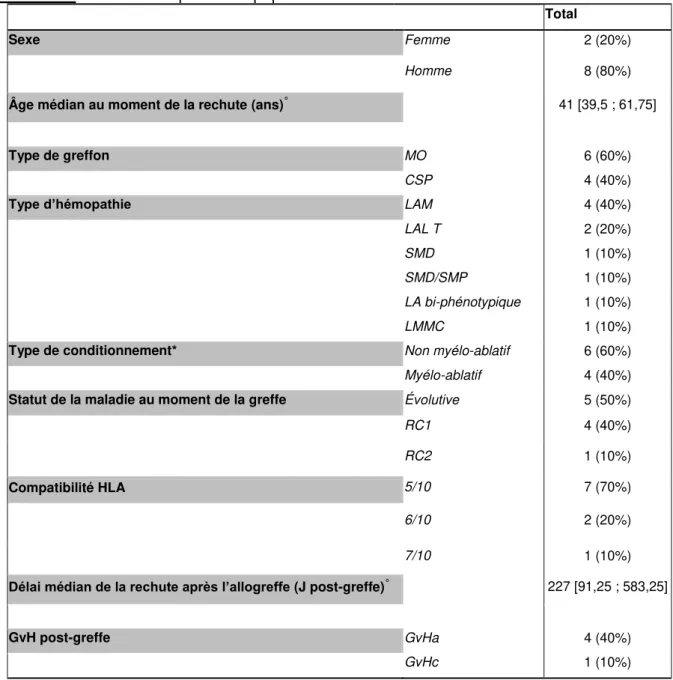
A. Population étudiée ... 55
1. Population incluse dans l’étude ...55
2. Caractéristiques de la population étudiée...55
B. Perte HLA ... 57
1. Sélection de la technique et résultats obtenus ...57
2. Résultats des analyses par qPCR ...58
a. Rechute « classique » ...60
b. Rechute avec perte HLA ...61
c. Cas particulier : rechute « classique » suivie d'une perte HLA après injections de lymphocytes du donneur (DLI) ...62
d. Concordance entre les sondes ...63
3. Résultats des analyses par NGS ...63
a. Rechute « classique » ...63
b. Rechute avec perte HLA ...65
c. Cas particulier : rechute « classique » suivie d'une perte HLA après injections de lymphocytes du donneur (DLI) ...66
d. Concordance entre les allèles ...67
V. DISCUSSION ... 69
VI. CONCLUSION ET PERSPECTIVES ... 75
BIBLIOGRAPHIE ... 77
TABLE DES
ANNEXES
13
Annexe 1 : Spécificités des sondes HLA QTRACE (JETA Molecular). ... 87
Annexe 2 : Spécificités des sondes HLA KMR (GenDx). ... 87
Annexe 3 : Caractéristiques de la population étudiée. ... 88
Annexe 4 : Conditionnements utilisés dans la population étudiée. ... 89
Annexe 5 : Haplotypes HLA des donneurs et des receveurs avec les sondes
choisies et leurs spécificités HLA. ... 90
Annexe 6 : Présentation du NGS. ... 91
TABLE DES ABRÉVIATIONS
15
ABM : Agence de la BiomédecineALDH : Aldéhyde déshydrogénase CAR-T : Chimeric Antigen Receptor T Cellules NK : cellules Natural Killer CMF : Cytométrie en flux
CMH : Complexe Majeur d'Histocompatibilité cnLOH : copy-neutral Loss Of Heterozygotie CPA : Cellules Présentatrices d'Antigènes CSH : Cellules Souches Hématopoïétiques CSP : Cellules Souches Périphériques Ct : Cycle threshold
Cy : Cyclophosphamide
DLI : Donor Lymphocyte Infusion, injection de lymphocytes du donneur
G-CSF : Granulocyte Colony Stimulating Factor, facteur de croissance hématopoïétique spécifique de la lignée granulocytaire
GvI : Graft versus Infection, réaction du greffon contre les infections GvH : Graft versus Host, réaction du greffon contre l’hôte
GvHa : GvH aiguë GvHc : GvH chronique
GvL : Graft versus Leukemia, réaction du greffon contre la leucémie HLA : Human Leukocyte Antigen, CMH humain
HPN : Hémoglobinurie Paroxystique Nocturne ICT : Irradiation Corporelle Totale
KIRs : Killer cell Immunoglobulin-like Receptors LA : Leucémie Aiguë
LAL : Leucémie Aiguë Lymphoblastique LAM : Leucémie Aiguë Myéloblastique LLC : Leucémie Lymphoïde Chronique LMC : Leucémie Myéloïde Chronique
TABLE DES ABRÉVIATIONS
16
LNH : Lymphome Non HodgkinienMH : Maladie de Hodgkin MM : Myélome Multiple MMF : Mycophénolate Mofétil MMUD : Mismatch Unrelated Donor MRD : Match Related Donor MUD : Match Unrelated Donor MO : Moelle Osseuse
NGS : Next Generation Sequencing
NRM : No Relapse Mortality, mortalité non liée à une rechute PCR : Polymerase Chain Reaction
PRS : Post-Relapse Survival, survie après une rechute qPCR : PCR quantitative
RC : Rémission Complète RC1 : Première RC RC2 : Deuxième RC
RIC : Conditionnement d'Intensité Réduite R-IPSS : Revised Index Pronostic System SAL : Sérum Anti-Lymphocytaire
SFGM-TC : Société Francophone de Greffe de Moelle et de Thérapie Cellulaire SMD : Syndrome Myélodysplasique
SMP : Syndrome Myéloprolifératif STR : Short Tandem Repetition UPD : Uniparental disomy UPDa : UPD acquise
I.
Introduction
17
I.
INTRODUCTION
A. Allogreffe de cellules souches hématopoïétiques
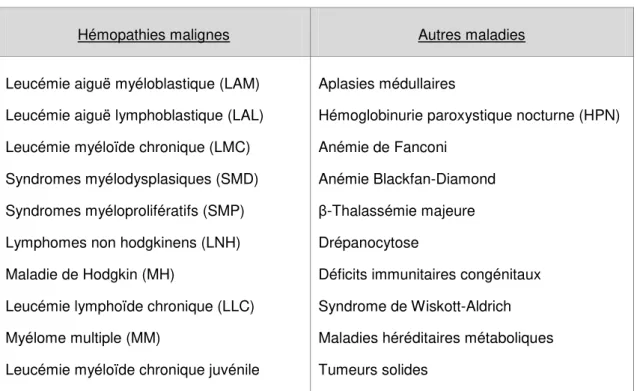
1. Généralités et actualitésDepuis plus de 60 ans, l’allogreffe de cellules souches hématopoïétiques (CSH) représente un traitement curatif potentiel pour de nombreuses hémopathies malignes (1) mais aussi non malignes telles que les aplasies médullaires (1,2), les hémoglobinopathies (2,3) ou encore les déficits immunitaires primitifs sévères (4). L’ensemble des indications de l’allogreffe de CSH est regroupé dans le Tableau 1.
Tableau 1 : Principales indications de l'allogreffe de CSH.
Hémopathies malignes Autres maladies
Leucémie aiguë myéloblastique (LAM) Leucémie aiguë lymphoblastique (LAL) Leucémie myéloïde chronique (LMC) Syndromes myélodysplasiques (SMD) Syndromes myéloprolifératifs (SMP) Lymphomes non hodgkinens (LNH) Maladie de Hodgkin (MH)
Leucémie lymphoïde chronique (LLC) Myélome multiple (MM)
Leucémie myéloïde chronique juvénile
Aplasies médullaires
Hémoglobinurie paroxystique nocturne (HPN) Anémie de Fanconi
Anémie Blackfan-Diamond β-Thalassémie majeure Drépanocytose
Déficits immunitaires congénitaux Syndrome de Wiskott-Aldrich Maladies héréditaires métaboliques Tumeurs solides
L’allogreffe de CSH est principalement indiquée dans le traitement d'hémopathies malignes myéloïdes à haut risque de rechute (5), notamment dans la leucémie aiguë myéloïde (LAM), représentant 40,5% des indications en 2016 d’après l’Agence de la Biomédecine (ABM). En France, 1 902 allogreffes de CSH ont été recensées en 2017 contre 855 en 2001 (base de données de l’EBMT, European Bone Marrow Transplantation et de ProMISe, Projet Manager Internet Server). Cette activité est en constante progression depuis plusieurs années du fait de l’augmentation du nombre de donneurs potentiellement éligibles au don et de la diminution de la toxicité liée à cette procédure, même si on remarque un plateau depuis 2014. Actuellement, en Europe, plus de 15 000 allogreffes de CSH sont réalisées chaque année (6).
I.
Introduction
18
Une allogreffe de CSH est considérée comme une véritable immunothérapie adoptive (7,8). Les cellules souches multipotentes (CD34+) issues d’un donneur sain vont permettre de restaurer une hématopoïèse complète et fonctionnelle chez un malade, le receveur. Le greffon va également apporter des cellules immunocompétentes du donneur permettant d’obtenir un effet anti-tumoral du greffon contre la leucémie (Graft-versus-Leukemia, GvL), correspondant à l’effet positif de la greffe. Cependant, cet effet est souvent associé à une réaction du greffon contre les tissus sains de l’hôte (Graft-versus-Host, GvH) représentant l’une des principales complications de la procédure d’allogreffe. Ces effets peuvent être modulés par certains traitements, en fonction du type de conditionnement, du choix des donneurs ou par l’utilisation de réinjection de lymphocytes du donneur (Donor Lymphocyte Infusion, DLI).
Un conditionnement est utilisé avant l’allogreffe de CSH permettant de détruire les cellules malignes médullaires résiduelles du receveur et de laisser la place pour la reconstitution d’une hématopoïèse complète et normale. Ce conditionnement permet aussi de détruire les cellules immunocompétentes du receveur qui pourraient empêcher la prise de la greffe et entrainer un rejet du greffon. Il existe différents schémas de conditionnement en fonction de leur caractère myélotoxique et immunomodulateur. Ceci permet de différencier un conditionnement :
Myélo-ablatif : le premier à avoir été utilisé et associant le plus souvent une irradiation corporelle totale (ICT) avec du cyclophosphamide (Endoxan), pour les hémopathies myéloïdes ou de la fludarabine, pour les leucémies aiguës lymphoblastiques (LAL).
Non myélo-ablatif ou dit d’intensité réduite (RIC) : qui ne comporte aucune chimiothérapie myélotoxique, permettant d’élargir les indications de l’allogreffe et de rendre éligibles des patients âgés et/ou avec des co-morbidités associées.
Le greffon de CSH peut provenir de différentes sources : la moelle osseuse, le sang périphérique ou le sang placentaire.
Le prélèvement de moelle osseuse correspond à la première source de CSH qui a été utilisée. La ponction est réalisée au niveau des crêtes iliaques postérieures (riches en CSH) voire au niveau sternal, sous anesthésie générale.
Le prélèvement de CSH issues de sang périphérique, appelées CSP, est réalisé après stimulation médullaire du donneur par notamment, un facteur de croissance hématopoïétique spécifique de la lignée granulocytaire, le G-CSF. L’utilisation du
G-I.
Introduction
20
Elles peuvent reconnaitre également des antigènes allogéniques sur les cellules du receveur et provoquer des conflits immunologiques : on parle d’alloréactivité. Ces conflits sont liés à des différences antigéniques entre les cellules du donneur et du receveur. Plus de 90% des antigènes allogéniques sont les molécules du Complexe Majeur d’Histocompatibilité (CMH). Après une allogreffe de CSH, 1 à 10% des lymphocytes T du donneur vont être alloréactifs (10,11) et induire des réactions allogéniques dont :
Une réaction allogénique contre les tissus sains du receveur correspondant à
un effet de greffon contre l’hôte (Graft-versus-Host, GvH). Cet effet est la
principale complication post-allogreffe et peut mettre en jeu le pronostic vital du receveur. Elle survient chez 70% des malades et entraine un décès dans 15 à 40% des cas. Il existe deux formes cliniques : la GvH aiguë survenant en général avant le 100e jour post-greffe et la GvH chronique, plus tardive. L’effet de GvH est lié plus
précisément à une réaction lymphocytaire T du greffon dirigée contre les cellules présentatrices d’antigènes (CPA) du receveur, étrangères à ce dernier et provoquant des lésions notamment au niveau cutané, hépatique, digestif, pulmonaire…(10,12). D’après Glucksberg et al (13), il existe plusieurs stades de gravité, notamment pour la GvH aiguë (grade I à IV), utilisés pour évaluer le pronostic et la survie des patients (14). L’utilisation d’immunosuppresseurs permet de prévenir cet effet.
Une réaction allogénique contre les cellules malignes résiduelles du receveur
responsable de l’effet anti-tumoral recherché (Graft-versus-Leukemia, GvL)
(15,16). Les mécanismes physiologiques permettant d’expliquer l’effet GvL sont liés principalement à l’incompatibilité du CMH entre le donneur et le receveur, aux antigènes mineurs d’histocompatibilité présents sur les cellules malignes du receveur ou encore liés à des antigènes spécifiques de tumeur. Les antigènes mineurs d’histocompatibilité sont des produits de la dégradation de protéines intracellulaires n’appartenant pas au CMH. Les cellules NK jouent également un rôle dans l’effet GvL. En effet, au cours d’une allogreffe de CSH, les cellules NK du donneur présentes dans le greffon ne vont pas reconnaitre les récepteurs inhibiteurs (Killer cell Immunoglobulin-like Receptors
,
KIRs) du receveur et ainsi provoquer une activation de la fonction effectrice de cellules NK alloréactives et une lyse des cellules malignes du receveur (17,18).Les mécanismes immunologiques responsables de l’effet GvL sont étroitement liés à ceux de la GvH. Le modèle des allogreffes syngéniques (absence de différences allogéniques entre le donneur et le receveur) illustre cette perte d’alloréactivité par une augmentation du
I.
Introduction
21
risque de rechute (15). De plus, il existe une diminution du risque de rechute lors d’une GvH chronique (19–21).
Les cellules hématopoïétiques résiduelles du receveur peuvent également reconnaitre des antigènes allogéniques du donneur et provoquer un rejet de la greffe. Cependant, le rejet reste rare car le receveur est souvent très immunodéprimé du fait de son hémopathie, des traitements et du conditionnement reçus avant la greffe.
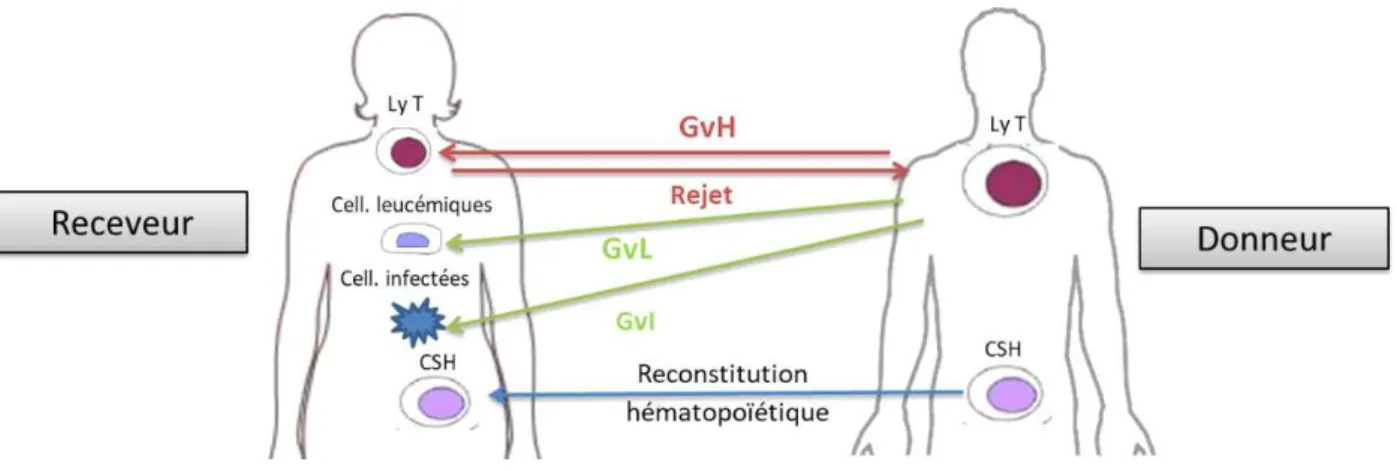
L’ensemble des réactions immunologiques entre un donneur et un receveur après une allogreffe de CSH est représenté dans la Figure 2.
Figure 2 : Effets immunologiques de l’allogreffe de CSH.
GvH : réaction du greffon contre l’hôte ; GvL : réaction du greffon contre la leucémie ; GvI : réaction du greffon contre les infections.
b. Compatibilité HLA
Plus de 90% des antigènes allogéniques responsables de ces conflits immunologiques sont des protéines codées dans le CMH. Ces protéines sont responsables de la présentation des antigènes aux lymphocytes T ainsi que de l’histocompatibilité, c’est-à-dire la compatibilité des tissus d’un donneur et d’un receveur permettant la survie du greffon (22). Chez l’Homme, le CMH humain est constitué par le complexe des antigènes leucocytaires humains (Human Leukocyte Antigen, HLA).
Le système HLA représente un ensemble de plus de 200 gènes, situé sur le bras court du chromosome 6 (6p) (Figure 3). Chaque individu possède à la surface de ces cellules des combinaisons différentes de molécules HLA, extrêmement variables d’un individu à un autre au sein d’une population. Ce polymorphisme génétique multiallélique explique le risque de
I.
Introduction
22
rejet de greffe entre un donneur et un receveur différent, ce qui fut à l’origine de sa découverte par Jean Dausset (23).
Le système HLA est subdivisé en 3 régions (11):
• La région du CMH de classe I avec 3 gènes HLA de classe I dits « classiques
»,
appelés allèles ou locus: HLA-A, HLA-B et HLA-C.• La région du CMH de classe II avec trois paires de gènes HLA de classe II dits « classiques », appelés allèles ou locus: HLA-DP (gènes DPA et DPB), HLA-DQ (DQA et DQB) et HLA-DR (DRA et DRB).
• La région du CMH de classe III correspond à des gènes codant différentes protéines n’intervenant pas dans la présentation antigénique (protéines du complément, cytokines, enzymes,..).
Chaque allèle HLA code pour des protéines avec des séquences en acides aminés spécifiques. Les différences sont surtout concentrées au niveau des régions codant le sillon de liaison aux peptides, correspondant à la zone la plus polymorphe (Figure 3) (11)
.
Les molécules HLA de classe I sont présentes sur presque toutes les cellules nucléées et les plaquettes et présentent des fragments peptidiques cytosoliques endogènes (protéines du soi en fin de vie, défectueuses ou protéines du non soi infectieuses ou cancéreuses) aux lymphocytes T CD8+ cytotoxiques. Les molécules HLA de classe II sont présentes sur les CPA (macrophages, cellules dendritiques, lymphocytes B), les lymphocytes T activés et les cellules endothéliales dans un contexte inflammatoire. Elles présentent des fragments de protéines exogènes surtout mais aussi endogènes aux lymphocytes T CD4+.
I.
Introduction
25
En première intention, un donneur familial HLA identique de compatibilité 10/10, appelé géno-identique issu de la fratrie du receveur, va être recherché, on parle également de MRD (Match Related Donor). La probabilité d’être HLA identique dans la fratrie est d’une chance sur quatre. En cas d’absence d’un donneur familial, un donneur HLA identique non apparenté est recherché, appelé donneur phéno-identique ou MUD (Match Unrelated Donor). Ce sont des donneurs vivants non apparentés issus de fichiers internationaux ou nationaux de donneurs volontaires (26).
Du fait de la difficulté de trouver des donneurs HLA identiques et des progrès constants dans ce domaine, le recours aux greffes avec un ou plusieurs mismatchs est une option envisageable (Figure 5). Il est possible de recourir à une greffe alternative avec un donneur non apparenté avec un mismatch HLA (compatibilité 9/10), appelée MMUD (Mismatch Unrelated Donor), ou de recourir à des greffes de sang placentaire ou des greffes haplo-identiques (semi-compatibles). Ainsi, au sein d’une fratrie, il y a une chance sur deux d’avoir un donneur semi-compatible, c’est à dire partageant un des deux haplotypes HLA hérités du père ou de la mère. Pour les greffes à partir de sang placentaire, on ne s’intéresse qu’aux locus : HLA-A, HLA-B et HLA-DRB1. Il est possible et admis d’avoir plusieurs mismatchs pour ce type de greffe compte tenu de l’immaturité cellulaire du sang placentaire. L'un des principaux inconvénients est la quantité de cellules nécessaires par rapport au poids du patient qui nécessite souvent deux USP pour un adulte. De plus, la sortie en aplasie peut être plus lente et le risque infectieux plus important du fait d'un nombre moins important de cellules souches et de cellules T matures. Le risque de GvH est diminué ainsi que l’effet GvL, pouvant induire un risque de non prise de greffe ou de rechute. L'avantage de ces greffes reste leurs disponibilités puisque les USP sont déjà typées et congelées. Aujourd’hui, ces greffes ne sont quasiment plus pratiquées. Les greffes haplo-identiques sont quant à elles en plein essor (6,27).
I.
Introduction
28
Figure 7: Evolution du nombre d’allogreffes de CSH selon le type de donneur. D’après le rapport annuel de l’ABM de 2017 (9).
La greffe haplo-identique est indiquée dans le traitement curatif d’hémopathies malignes principalement myéloïdes dont les LAM, à stade avancé ou en première réponse complète (RC1) mais aussi les lymphomes (6,30,31). À Lille, les greffes haplo-identiques sont réalisées depuis 2014. Plusieurs études ont montré une supériorité des greffes haplo-identiques par rapport aux greffes HLA haplo-identiques (compatibilité 10/10) dans la maladie de Hodgkin (MH) (32,33). Pour les autres hémopathies malignes, il y a peu ou pas de données dans la littérature à l’exception d’une étude dans le traitement de la myélofibrose (34). Concernant son indication dans les hémopathies non malignes, des études ont été réalisées sur l’aplasie médullaire, la drépanocytose et la thalassémie avec des résultats très encourageants (35,36).
La toxicité principale de ces allogreffes est le risque de GvH du fait d’une ou plusieurs incompatibilités HLA (appelées aussi mismatchs HLA) entre le donneur et le receveur. Les premières tentatives de greffes étaient associées à des taux de rejets et de GvH sévères (37,38). Du fait du rôle des lymphocytes T du greffon dans la GvH, comme vu précédemment, plusieurs approches ont été développées pour réduire cette toxicité.
I.
Introduction
29
Tout d’abord, l’équipe du Pr. Martelli (39), a eu recours à des greffons manipulés in vitro avec injection d’une dose importante de CD34+, ce qui entrainait une déplétion profonde ex vivo des lymphocytes mais aussi un rejet du greffon important. De plus, du fait de l’absence de lymphocytes immunocompétents, des taux élevés de rechute étaient constatés ainsi que de nombreuses infections. Cette stratégie n’est donc plus préconisée aujourd’hui. Ensuite, pour améliorer la reconstitution immune, il a été proposé d’utiliser des greffons déplétés en cellules CD3+ (lymphocytes T) et CD19+ (lymphocytes B). Les cellules NK et les cellules dendritiques étaient préservées car utiles pour la prise de greffe. Le conditionnement utilisé était d’intensité réduite. Ce type de greffe avec déplétion ex vivo n’est actuellement quasiment plus utilisé, à part dans certaines situations pédiatriques exceptionnelles.
Actuellement, il existe deux grandes stratégies qui ont en commun de ne pas utiliser de greffon déplété ex vivo en lymphocytes T. La prise de greffe semble satisfaisante, sans ou avec peu de GvH sévère et la mortalité non liée à rechute (NRM) reste faible.
La première stratégie, étudiée par l’équipe de Pékin (40), utilise comme prophylaxie de GvH une forte dose de sérum anti-lymphocytaire (SAL) associé à de la ciclosporine, du mycophénolate mofétil (MMF) et du méthotrexate. D’après l’équipe de Wang, l’incidence à 3 ans de NRM est de 17% et l’incidence de GvH aiguë et chronique était comprise entre 11 et 23%. Des résultats similaires ont été obtenus en termes d’efficacité sur le contrôle de la maladie par rapport à des allogreffes avec un donneur HLA identique.
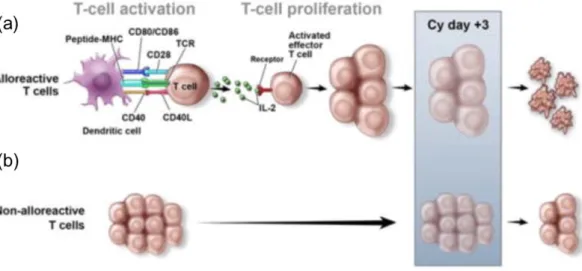
La deuxième stratégie de l’équipe de John Hopkins de Baltimore (41), utilise une injection d’immunosuppresseur à haute dose (50mg/kg) : le cyclophosphamide (Cy), en post-greffe. Ce traitement est donné après l’injection du greffon de CSH à J+3 et J+4 de l’allogreffe, suivie d’un traitement par des immunosuppresseurs : tacrolimus ou ciclosporine et MMF. Le cyclophosphamide est une pro-drogue inactive dont le principe actif est un agent alkylant, la moutarde phosphoramide. La génération de celle-ci est inversement proportionnelle à la présence de l’enzyme aldéhyde déshydrogénase (ALDH) dans les cellules (Figure 8). En effet, le principe actif est produit en plus grande quantité dans les cellules pauvres en ALDH, ce qui est le cas des lymphocytes T activés, responsables de la GvH. Son utilisation induit donc une déplétion en lymphocytes T in vivo. Les cellules présentant un fort taux de ALDH sont quant à elles préservées de l’effet toxique du cyclophosphamide, qui reste inactif, notamment dans les cellules hématopoïétiques, hépatiques et intestinales, permettant de limiter l’effet de GvH. Cette équipe rapporte un taux de survenue de
I.
Introduction
30
GvH aiguë grave inférieur à 5% et un taux de GvH chronique inférieur à 14% (42,43). Cette molécule présente cependant des effets indésirables pouvant limiter son utilisation chez certains patients, notamment une toxicité cardiaque ainsi que l’apparition de cystite hémorragique (32,44).
Figure 8 : Effet du cyclophosphamide à haute dose en post-greffe.
(a) Reconnaissance par les cellules T alloréactives du donneur d’alloantigènes présentés par les CPA du receveur, activation et prolifération de ces cellules T alloréactives puis destruction par le cyclophosphamide (Cy) à haute dose reçue à J+3 post-greffe ; (b) Les cellules T non alloréactives ne sont pas détruites par le cyclophosphamide. D’après Luznik et al (45).
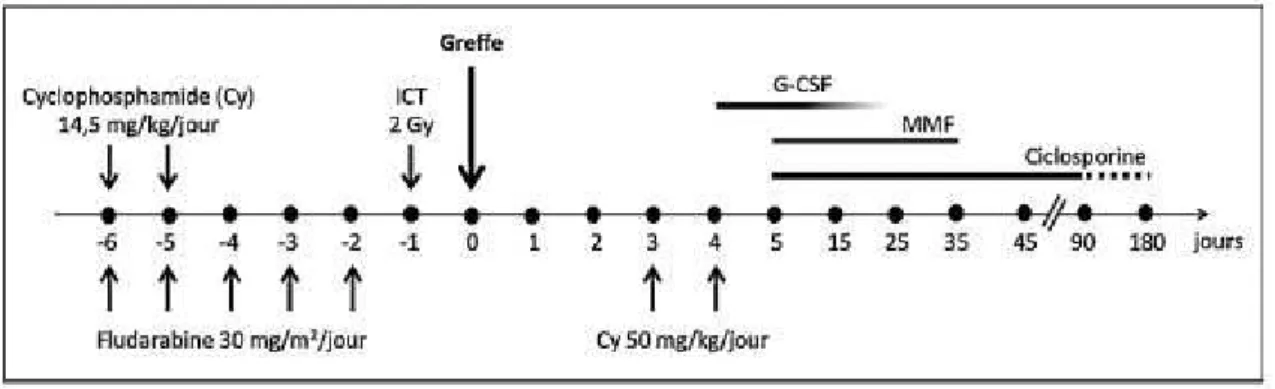
D’après les recommandations de la Société Francophone de Greffe de Moelle et de Thérapie Cellulaire (SFGM-TC) de l’atelier de 2016 (27), la stratégie de l’équipe de Baltimore avec un conditionnement non myélo-ablatif (RIC) est recommandé et est le plus utilisé (Figure 9), associant de la fludarabine, du cyclophosphamide (Cy) et une ICT. Le G-CSF est utilisé pour aider à la reconstitution hématologique. Un conditionnement myélo-ablatif peut être utilisé notamment chez les plus jeunes avec des hémopathies à haut risque ou à stade plus avancé.
I.
Introduction
31
Figure 9 : Conditionnement non myélo-ablatif et prophylaxie de la GvH selon la stratégie de
l’équipe de Baltimore.
ICT : Irradiation Corporelle Totale ; Cy : cyclophosphamide ; G-CSF : facteur de croissance hématopoïétique spécifique de la lignée granulocytaire ; MMF : mycophénolate mofétil. En ce qui concerne le type de greffon, des premières études ont comparé des greffes haplo-identiques de CSP et de MO avec un conditionnement non myélo-ablatif (RIC) et les résultats n’ont pas montré de différence en termes d’incidence de GvH aiguë et chronique, de NRM ou encore en termes de reconstitution hématologique. Une étude plus large a comparé les greffons de MO et de CSP après un conditionnement myélo-ablatif et le taux de GvH aiguë était de l’ordre de 40% avec les CSP et entre 20-25% pour la MO. De plus, il semblerait que le taux de rechute soit plus élevé avec la MO qu’avec des CSP, qui présenteraient un effet GvL plus important (46–49). L’utilisation d’un greffon de CSP ou de MO, dépend surtout des centres greffeurs et notamment de l’accès au bloc opératoire pour le don de MO. Le choix repose également sur le type d’hémopathie, le type de conditionnement mais aussi le poids du patient (50).
Les nombreuses incompatibilités HLA dans les greffes haplo-identiques entrainent un risque de toxicité importante sans traitement associé mais permettent aussi d’obtenir un puissant effet GvL. (Figure 10) (17). Les cellules immunitaires du donneur (lymphocytes T et cellules NK) apportées par le greffon vont reconnaitre via les CPA, les cellules malignes du receveur qui portent les allèles HLA mismatchs de l’haplotype HLA spécifique du receveur. Cette forte alloréactivité entraine une apoptose des cellules malignes résiduelles du receveur après activation et prolifération lymphocytaire et inflammatoire. L’alloréactivité antigénique dans la greffe haplo-identique est due aux mismatchs HLA mais aussi aux antigènes mineurs d’histocompatibilité.
I.
Introduction
32
Figure 10 : Principe de la greffe haplo-identique.
En bleu : haplotype HLA commun au donneur et au receveur ; en rouge : haplotype HLA spécifique du receveur ; en vert : haplotype HLA spécifique du donneur.
Après la greffe, ce sont les infections et la maladie du greffon contre l’hôte (GvH) qui représentent les principales causes de décès. Après les 100 premiers jours post-greffe, le principal risque est la rechute de l’hémopathie initiale. L’équipe de Baltimore et al (51) a montré des résultats équivalents concernant le risque de rechute entre une greffe haplo-identique et une greffe non apparentée HLA compatibles (MUD) avec un conditionnement non myélo-ablatif (RIC). Le risque de rechute dépend principalement du type d’hémopathie et du statut de la maladie avant la greffe.
Aujourd'hui, la place de la greffe haplo-identique dans le choix du donneur est en cours d'étude (50). Les premières conclusions placent le donneur familial HLA identique (MRD) en premier choix lorsqu'il est disponible. En cas d'absence de MRD, un donneur MUD reste une option envisageable en seconde intention, surtout pour les sujets jeunes. En troisième option, la greffe haplo-identique est placée aujourd’hui au même rang que les greffes non apparentées avec une compatibilité HLA de 9/10 (MMUD).
I.
Introduction
33
Des protocoles pour comparer ces greffes sont actuellement en cours : le protocole ALTERGREF : NCT03250546 (9/10 versus haplo-identique), le protocole HAPLOMUDELDERLY-IPC2015-004 : NCT02623309 (10/10 versus haplo-identique), avec un conditionnement RIC et le protocole MACHAPLOMUD : NCT03655145 (10/10 versus haplo-identique), avec un conditionnement myélo-ablatif. Notre centre lillois participe notamment à ces études randomisées permettant de mieux positionner la greffe haplo-identique dans l'avenir.
C. Rechute post-allogreffe
1. Facteurs prédictifs de la rechute post-allogreffe
La rechute de l’hémopathie initiale représente la principale cause de mortalité post-allogreffe de CSH (52). Ce risque peut varier entre 20 et 80% après la greffe (53). Pour prévenir le risque de rechute, plusieurs stratégies sont utilisées : le suivi de la maladie résiduelle (MRD), le suivi du chimérisme mais aussi l’utilisation de thérapeutique prophylactique ou préemptive. Concernant les facteurs prédictifs de rechute, cela dépend de différentes périodes par rapport à la greffe :
Avant la greffe, c’est surtout le statut de la maladie qui est décisif, puisque le risque de rechute est plus élevé si l’hémopathie était réfractaire à la chimiothérapie ou en rechute avant la greffe ou encore si le nombre de rémissions complètes antérieures est élevé (RC2 ou plus). Ce statut est basé notamment sur des anomalies moléculaires ou cytogénétiques notamment pour les LAM (ex : LAM et mutation FLT3 associée à un haut risque de rechute) (54) ou le score R-IPSS (Revised index pronostic system) pour les SMD (55). Ce score prend en compte le pourcentage de blastes dans la MO, le nombre de cytopénies et l’étude cytogénétique. En amont de la transplantation, le type de conditionnement a également un impact sur le risque de rechute. En effet, il existe un risque de rechute plus élevé si le conditionnement est non myélo-ablatif (RIC) par rapport à un conditionnement myélo-ablatif (56).
Après la greffe, le risque de rechute est corrélé à l’alloréactivité générée. Le degré de la GvH aiguë est inversement corrélé au risque de rechute. De plus, une GvH chronique limitée présente des effets bénéfiques pour la rechute, surtout pour les patients atteints de leucémies aiguës ou de lymphomes indolents agressifs (57).
I.
Introduction
34
2. Suivi post-allogreffeL’étude du chimérisme est une analyse importante dans le suivi après une allogreffe. Elle permet de quantifier les cellules du donneur et du receveur dans une population cellulaire à partir d’un prélèvement sanguin ou médullaire. Les objectifs de cette analyse sont de renseigner sur la qualité de la prise de l’allogreffe et de prédire une rechute ou un rejet (58).
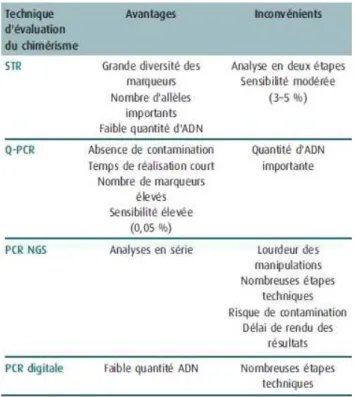
Il existe plusieurs techniques pour étudier le chimérisme (58,59). Certaines techniques de biologie moléculaire utilisent des marqueurs de type microsatellites (régions répétées) dont la technique de STR (short tandem repeats) (60,61). Dans cette technique, les amorces se situent dans des régions constantes, à proximité de régions polymorphes, et se différencient par le nombre de répétitions. Ensuite, une technique de PCR quantitative en temps réel (quantitative Polymerase Chain Reaction, qPCR) (62–64) peut être utilisée, basée sur l’analyse des polymorphismes de type insertions et délétions. L’avantage de cette technique est une excellente sensibilité, de 0,05%, mais qui nécessite des quantités d’ADN importantes. Des approches plus récentes basées sur une réaction de séquençage de nouvelle génération (Next Generation Sequencing, NGS) (65,66) permettent une analyse de plusieurs prélèvements en même temps. La sensibilité de cette méthode est de 1%. Enfin, une technique de PCR digitale (67–69) peut être utilisée, le but étant de réaliser une PCR dans des gouttelettes indépendantes les unes des autres permettant d’avoir une meilleure sensibilité mais à partir d’une faible quantité d’ADN. Les avantages et inconvénients de ces techniques de chimérisme sont résumés dans le Tableau 2.
I.
Introduction
35
Tableau 2 : Différentes techniques utilisées pour l’étude du chimérisme.
À Lille, l’étude du chimérisme est réalisée par qPCR. Avant de réaliser cette étude, il est indispensable de définir des systèmes dits « informatifs », correspondant à des marqueurs spécifiques du receveur ou du donneur et permettant de les différencier. Dans le cas d’allogreffe entre un patient de genre masculin et un donneur de genre féminin, un marqueur situé sur le chromosome Y par exemple sera utilisé. Les résultats sont exprimés en pourcentage de cellules receveurs ou de cellules donneurs, selon les systèmes « informatifs » choisis. Pour détecter une potentielle rechute post-allogreffe, il est pertinent d’utiliser deux systèmes « informatifs » ciblant deux chromosomes différents, dans le cas où les cellules malignes du receveur en rechute auraient muté et perdu un des deux marqueurs ciblés (risque de rendre un chimérisme faussement 100% donneur) (70). Lors de la première année de greffe, le suivi est réalisé classiquement à J30, J60, J90, J180, J360, principalement sur du sang total ou de la MO (58). Après la première année le suivi est effectué au moins une fois par an sauf si suspicion de rechute ou de rejet, le suivi sera plus rapproché. Une intervention thérapeutique ou non va dépendre notamment de la cinétique d’évolution du chimérisme.
Un chimérisme complet est caractérisé par un remplacement total de l’hématopoïèse du patient par celle du donneur alors qu’un chimérisme dit mixte, correspond à une persistance de cellules du receveur avec une quantification de moins de 95% de cellules du donneur
I.
Introduction
36
détectée. Ce seuil de 95% reste débattu car il dépend de la sensibilité de la technique utilisée par les centres (STR vs qPCR). À Lille, compte tenu de la quantification du chimérisme par qPCR, nous considérons un chimérisme comme mixte à partir de 2% de cellules du receveur détectable. Néanmoins, ce pourcentage reste arbitraire et chaque résultat de chimérisme avec un pourcentage receveur entre 1 et 2% et ascendant est à discuter avec le clinicien. D’après une étude réalisée par Jacque et al (64), la technique de qPCR présente une excellente valeur prédictive négative (absence de rechute lorsque le chimérisme est complet). De plus, ils ont montré qu’un chimérisme mixte, avec une ascension d’au moins 0,1% de cellules receveur, sur deux analyses successives était associé à un haut de risque de rechute.
Les résultats obtenus sont complémentaires aux analyses réalisées par le suivi en hématologie : hémogramme, myélogramme, suivi de la maladie résiduelle (MRD)… En effet, le suivi du chimérisme peut être réalisé chez quasiment tous les patients allogreffés (sauf exception, si aucun système « informatif » ne permet de différencier le donneur et le receveur), ce qui contraste avec le manque de marqueurs génétiques pour certains patients ne permettant pas le suivi en MRD (64). Pour prédire une rechute, une évaluation de la MRD reste l’examen de référence lorsqu’il existe des marqueurs hématologiques spécifiques (moléculaires, immunophénotypiques ou cytogénétiques) (56,68). Des seuils sont définis en fonction des anomalies recherchées dans le sang et/ou dans la MO mais c’est surtout la cinétique de ces marqueurs et leur évolution qui est important pour suspecter une rechute. Pour les LAM par exemple, un suivi de la MRD sur l’expression de WT1 est fréquente mais peu spécifique, retrouvée également pour le suivi des LAL B. Des mutations peuvent être suivies comme la mutation NPM1, FLT3 ou la duplication en tandem FLT3-ITD, associée à un risque élevé de rechute. La rechute sera également objectivée par la présence significative de cellules malignes dans le sang et/ou dans la MO (>5% de blastes).
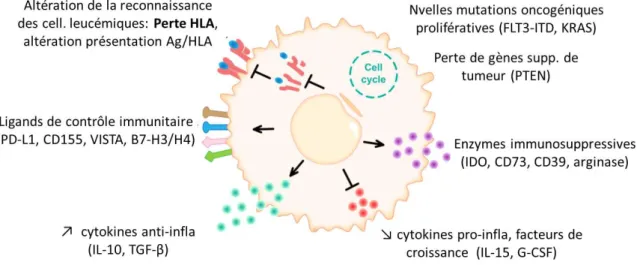
3. Mécanisme d’échappement immunitaire a. Après allogreffe de CSH
Différents mécanismes d’échappement immunitaire des cellules malignes après allogreffe de CSH ont été observés (71,72) dont : l’apparition de nouvelles mutations, une perte des gènes suppresseurs de tumeur, une dérégulation de la sécrétion de cytokines, ou encore une altération de la reconnaissance des cellules malignes et du système immunitaire du donneur par notamment une perte HLA (Figure 11).
I.
Introduction
37
Figure 11 : Mécanismes d’échappement immunitaire post-allogreffe de CSH. D’après Zeiser et Vago (71).
En effet, des altérations des gènes HLA ont souvent été observées dans des tumeurs solides, montrant la capacité d’échappement immunitaire des cellules cancéreuses (73,74). Notamment, une perte ou une diminution de l’expression des molécules HLA de classe I avec plusieurs mécanismes proposés dont une absence de la β2-microglobuline, une délétion ou une recombinaison mitotique du chromosome 6 (75).
b. Le cas de la perte HLA après greffe haplo-identique
Un des mécanismes d’échappement immunitaire le plus représenté après une greffe haplo-identique est une perte du HLA. Les équipes de Crucitti et Vago (76–78) ont mis en évidence chez des patients en rechute, une perte de l’haplotype HLA spécifique du receveur dans le génome des cellules malignes. La principale hypothèse mécanistique repose sur une perte de l’hétérozygotie (copy-neutral loss of heterozygotie, cnLOH), par perte d’une copie d’un des deux parents qui est remplacée par l’autre, appelé aussi disomie uniparentale (Uniparental disomy, UPD). Dans ce contexte, ce phénomène est acquis du fait d’une forte pression immunologique liée à la greffe et d’instabilités génomiques des hémopathies, on parle de UPD acquise (UPDa). Ce mécanisme entraine une perte partielle du bras court du chromosome 6 où sont situés les gènes HLA de classe I et II puis une substitution de la partie perdue par la région correspondante de l’autre chromosome (Figure 12). Dans le cas de la greffe haplo-identique, c’est l’haplotype HLA spécifique du receveur (haplotype HLA mismatch) qui est remplacée par la copie correspondant à l’haplotype HLA commun, conservé. Le typage HLA des cellules malignes du receveur à la rechute paraitra donc homozygote avec le typage de l’haplotype HLA conservé, commun au donneur et au
I.
Introduction
38
receveur. Cela n’entraine pas de perte totale du matériel génétique et l’expression des molécules de CMH de classe I persiste pour la copie non perdue (78,79).
Ainsi, la conséquence est un échappement des cellules tumorales du receveur de l’alloreconnaissance des lymphocytes T du donneur entrainant une perte de l’effet GvL de l’allogreffe lié aux antigènes majeurs d’histocompatibilité (80).
Figure 12: Mécanisme d’échappement immunitaire de cellules malignes du receveur en rechute : perte HLA post-greffe haplo-identique.
En bleu : haplotype HLA commun au donneur et au receveur ; en rouge : haplotype HLA spécifique du receveur ; en vert : haplotype HLA spécifique du donneur.
UPDa = disomie uniparentale acquise ; 6p = bras court du chromosome 6.
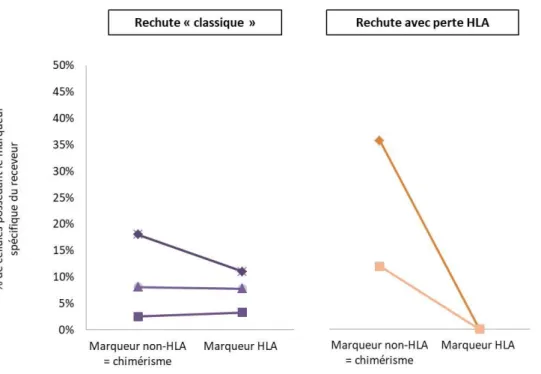
De nombreuses études réalisées pour la plupart sur des patients atteints de LAM, ont mis en évidence qu’une rechute sur trois était concernée. Nous pouvons ainsi distinguer deux types de rechute :
Les rechutes dites « classiques », sans perte HLA ;
Les rechutes avec perte HLA et plus précisément avec perte de l’haplotype HLA spécifique du receveur (haplotype HLA mismatch).
L’équipe de Crucitti et al (76), a montré que les rechutes avec perte HLA apparaissaient plus tardivement par rapport aux rechutes « classiques » (Figure 13). Cependant, en termes de mortalité et de survie, il n’a pas été mis en évidence de différence significative entre une rechute avec perte HLA et une rechute « classique » (le taux de survie à six mois post-rechute était de 28,5% pour les post-rechutes avec perte HLA et 27,4% pour les post-rechute sans perte HLA). De plus, du fait de rechute plus tardive et d’une longue phase d’équilibre
I.
Introduction
41
mais avec des efficacités variables dépendant notamment de l’intensité de la rechute et du type d’hémopathie (16). Les DLI peuvent également être données en préemptif ou en prophylactique, notamment en cas d'hémopathie à haut risque de rechute (85).
Dans le contexte de traitement de rechute après une greffe haplo-identique, les protocoles de DLI sont différents des greffes conventionnelles, notamment en termes de quantité de cellules/kg. En effet, du fait du risque de GvH post-DLI et des nombreuses incompatibilités HLA présentes dans les greffes haplo-identiques, le risque de GvH est d’autant plus important que l’utilisation des DLI sera réalisée avec une grande précaution. De ce fait, les premières réinjections présentent des quantités de cellules/kg plus faibles de l’ordre de 1x103 à 1x104 cellules CD3+ /kg (86).
L’effet des DLI étant de déclencher un effet GvL, il est important que les cellules T du greffon puissent toujours agir contre les cellules malignes en rechute. En cas de rechute avec perte de l’haplotype HLA spécifique du receveur, l’efficacité des DLI est remis en question, puisque l’effet GvL serait fortement amoindri dans ce cas (16,86). Des alternatives thérapeutiques devront être envisagées, notamment l’utilisation d’immunothérapies ou une seconde allogreffe avec un donneur différent (87).
Concernant le pronostic des patients en rechute après une greffe haplo-identique, celui-ci semble plus mauvais par rapport aux greffes MUD et MRD. En effet, une étude a comparé les taux de survie à un an après rechute post-greffe (post-relapse survival, PRS) qui est de 17%, 46% et 40%, pour les greffes haplo-identique, MUD et MRD, respectivement. Ce taux de survie moins bon peut être expliqué notamment par une utilisation plus limitée des DLI chez les patients en rechute après une greffe haplo-identique.
II.
Objectifs de l’étude
43
II.
OBJECTIFS DE L’ÉTUDE
La rechute de la maladie initiale reste une des causes principales de décès post-greffe haplo-identique. Une meilleure compréhension de l’effet GvL et des mécanismes d’échappement de la maladie est nécessaire pour améliorer la prise en charge de ces patients allogreffés.
De récentes études ont mis en évidence comme principal mécanisme d’échappement immunitaire, une perte de l’haplotype HLA spécifique du receveur dans une rechute sur trois. Une nouvelle approche technique, par qPCR en temps réel, permet de détecter rapidement cette perte HLA en utilisant des sondes ciblant des allèles HLA spécifiques de cet haplotype. Le but étant de pouvoir différencier une rechute, avec ou sans perte HLA, et d’obtenir une prise en charge spécifique et rapide du patient en rechute.
Mon travail de thèse était de réaliser une étude rétrospective pour tester cette technique sur une population de patients en rechute après une greffe haplo-identique et de définir le pourcentage de rechutes « classiques », sans perte HLA et de rechutes avec perte HLA. L’objectif est de vérifier si nous obtenons des résultats similaires aux études réalisées sur ce sujet. De plus, cette approche permet d’apporter une nouvelle perspective de suivi post-greffe de ces patients en rechute et d’orienter au mieux leur prise en charge. Nous avons utilisé la même technique que celle utilisée pour l’étude du chimérisme au laboratoire HLA-Transplantation de l’Institut d’Immunologie. À terme, ce test pourra être proposé au moment de la mise en évidence d’une rechute avec des cellules malignes quantifiables dans le sang et/ou dans la moelle osseuse.
Ce projet est mené en collaboration avec le Service des Maladies du Sang du CHU de Lille et le laboratoire HLA-Transplantation de l’Institut d’Immunologie. Cette étude pourra également servir à l’étude rétrospective réalisée par la SFGM-TC sur ce sujet et permettra de participer à l’élaboration de nouvelles recommandations.
III.
Matériel et méthodes
45
III.
MATÉRIEL ET MÉTHODES
A. Population étudiée
1. Critères d’inclusion
Pour réaliser notre étude les patients inclus étaient des patients ayant bénéficié d’une allogreffe haplo-identique au CHU de Lille et étant en situation de rechute après cette allogreffe.
Pour cela, nous avons réalisé une étude rétrospective. Nous avons tout d’abord récupéré les identités des patients ayant subi une allogreffe haplo-identique au CHU de Lille entre janvier 2014 et mars 2019 à partir des données du Service des Maladies du Sang (données de ProMise) et du laboratoire HLA-Transplantation de l’Institut d’Immunologie du CHU de Lille. Pour sélectionner parmi cette population, les patients en situation de rechute après leur greffe haplo-identique, nous avons analysé les comptes rendus de consultation de suivi de ces patients, à l’aide du logiciel de gestion des dossiers médicaux, SILLAGE (SIB), ainsi que les résultats des bilans de suivi réalisés aux laboratoires d’Hématologie et HLA-Transplantation, stockés dans le logiciel du laboratoire, MOLIS (CGM LAB).
Nous avons inclus les patients présentant des cellules malignes circulantes à la rechute. La rechute était définie par les cliniciens sur la base de différents critères selon les hémopathies malignes : présence de cellules malignes ou d’anomalies cytologiques significatives dans le sang et/ou dans la moelle osseuse, maladie résiduelle positive (MRD) en cytogénétique et/ou en biologie moléculaire (surexpression WT1, mutations FLT3, NPM1…), chimérisme mixte avec au moins 2% de cellules du receveur.
2. Critères d'exclusion
Nous avons exclus les patients en rechute ne présentant pas de cellules malignes circulantes du receveur au moment de la rechute.
3. Échantillons d’intérêt
Les échantillons d’intérêt étaient des échantillons d’ADN extraits de sang total et/ou de moelle osseuse prélevés sur un tube avec un anticoagulant EDTA, en pré-greffe et au moment de la rechute (Figure 15). Un consentement éclairé, pour réaliser des analyses à des fins de recherche, a été obtenu au moment de la consultation pour l’allogreffe de CSH. L’extraction des ADN a été réalisée sur un extracteur Quikgene mini80 (AutoGen)